UJI DISOLUSI TABLET GLISERIL GUAIAKOLAT YANG DIPRODUKSI OLEH PT. KIMIA FARMA (PERSERO) TBK.
PLANT MEDAN MENGGUNAKAN METODE SPEKTROFOTOMETRI UV-VIS
TUGAS AKHIR
OLEH:
HUSRINA SURYANI NIM 132410043
PROGRAM STUDI DIPLOMA III ANALIS FARMASI DAN MAKANAN
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2016
LEMBAR PENGESAHAN
UJI DISOLUSI TABLET GLISERIL GUAIAKOLAT YANG DIPRODUKSI OLEH PT. KIMIA FARMA (PERSERO) TBK.
PLANT MEDAN MENGGUNAKAN METODE SPEKTROFOTOMETRI UV-VIS
TUGAS AKHIR
Diajukan Untuk Memenuhi Salah Satu Syarat Untuk Memperoleh GelarAhli Madya Pada Program Studi Diploma III Analis Farmasi dan Makanan
Fakultas FarmasiUniversitas Sumatera Utara
Oleh:
HUSRINA SURYANI NIM 122410043
Medan, April 2016 Disetujui Oleh:
DosenPembimbing,
Drs. Fathur Rahman H., M.Si., Apt.
NIP 195201041980031002
Disahkan Oleh:
Pejabat Dekan,
Dr. Masfria, M.S., Apt.
KATA PENGANTAR Bismillahirrahmanirrahim,
Alhamdulillah puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan karunia-Nya, sehingga penulis dapat menyusun dan menyelesaikan Tugas Akhir ini sebagai mestinya.
Tugas akhir ini berjudul “Uji Disolusi Tablet Gliseril Guaiakolat yang Diproduksi Oleh PT. Kimia Farma (Persero) Tbk. Plant Medan Menggunakan Metode Spektrofotometri UV-Vis”. Tugas akhir ini disusun sebagai salah satu syarat untuk dapat menyelesaikan pendidikan pada program Studi Universitas Sumatera Utara, Medan.
Penulis menyadari sepenuhnya bahwa tanpa bantuan dari berbagai pihak, penulis tidak akan dapat menyelesaikan tugas akhir ini. Untuk penulis mengucapkan terima kasih yang sebesar-besarnya kepada berbagai pihak antara lain:
1. Ibu Dr. Masfria, M.S., Apt., sebagai Dekan Fakultas Farmasi Universitas Sumatera Utara.
2. Ibu Prof. Dr. Julia Reveny, M.Si., Apt., sebagai Wakil Dekan Fakultas Farmasi Sumatera Utara.
3. Bapak Drs. Fathur Rahman Harun, M.Si., Apt., selaku dosen pembimbing yang telah banyak memberikan arahan dan bimbingan dengan penuh perhatian hingga tugas akhir ini selesai.
4. Bapak Prof. Dr. Jansen Silalahi, M.App.Sc., Apt., selaku Ketua Program Studi D3 Analis Farmasi dan Makanan Fakultas Farmasi Universitas Sumatera Utara.
5. Bapak Rahmat Rasyidi, S.Farm., Apt., selaku pembimbing dalam melaksanakan praktek kerja lapangan.
6. Ibu Dra. Fat Aminah, M.Sc., Apt., sebagai Dosen Penasehat Akademis yang telah memberikan nasehat dan pengarahan kepada penulis dalam hal akademis setiap semester.
7. Bapak dan Ibu dosen staf Pengajar Fakultas Farmasi Program D3 Analis Farmasi dan Makanan yang berupaya mendukung kemajuan mahasiswa Analis Farmasi dan makanan.
8. Seluruh staf dan pegawai PT. KIMIA FARMA (PERSERO) TBK.
PLANT MEDAN yang telah meluangkan waktu, tenaga dan pikiran kepada penulis dalam melaksanakan Praktek Kerja Lapangan (PKL).
9. Teman-teman PKL yang saling mendukung hingga Tugas Akhir ini selesai, kepada sepupu sekaligus teman seperjuangan penulis yaitu Sri Mina Yanti dan sahabat penulis Intan Baruna dan Hidayatul Islamiyah dan teman-teman mahasiswa Analis Farmasi dan Makanan stambuk 2013 semuanya, tanpa terkecuali, senior alumni D3 Analis Farmasi dan Makanan stambuk 2013, dan teman-teman stambuk 2013 jurusan Sains dan Klinis Fakultas Farmasi dan Makanan yang tidak disebutkan namanya satu persatu, terima kasih atas kebersamaannya dan semangatnya selama ini, serta masukan dalam penyusunan tugas akhir ini.
10. Serta pihak-pihak yang telah ikut membantu penulis namun tidak tercantum namanya.
Teristimewa kedua orang tua penulis yaitu Alm.Ayahanda Drs. Maskot Siregar dan Ibunda Kholijah Simamora, dan kepada Saudara penulis Mandar Alamsyah Siregar, S.Sos., Mardan Eriansyah Siregar, S.Sos., dan Saudari penulis Nurasyiah Siregar, S.Pd., dan Paman penulis Drs. Marahalim Simamora dan juga seluruh keluarga besar penulis yang selalu memberikan doa serta semangat, perhatian, dorongan dan pengorbanan baik moril maupun materil dalam penyelesaian tugas akhir ini.
Penulis menyadari sepenuhnya bahwa dalam penulisan maupun penyajian tugas akhir ini terdapat kekurangan dan kelemahan serta masih jauh dari kesempurnaan, oleh karena itu dengan kerendahan hati penulis mengharapkan saran dan kritik yang sifatnya membangun demi kesempurnaan tugas akhir ini.
Akhir kata, semoga Allah SWT melimpahkan rahmat dan karunia-Nya kepada kita semua dan harapan penulis semoga tugas akhir ini dapat memberikan manfaat bagi kita semua. Aamiin yaa Rabbal Alamin.
Medan, Agustus 2016 Penulis,
Husrina Suryani NIM 132410043
SURAT PERNYATAAN TIDAK PLAGIAT
Saya yang bertandatangan dibawah ini,
Nama : Husrina Suryani
NIM : 132410043
Program Studi : D III Analis Farmasi dan Makanan
Judul Tugas Akhir : Uji Disolusi Tablet Gliseril Guaiakolat yang Diproduksi Oleh PT. Kimia Farma (Persero) Tbk. Plant Medan Menggunakan Metode Spektrofotometri UV-Vis
Dengan ini menyatakan bahwa tugas akhir ini ditulis berdasarkan data dari hasil pekerjaan yang saya lakukan sendiri, dan belum pernah diajukan oleh orang lain untuk memperoleh gelar Ahli Madya di perguruan tinggi lain, dan bukan plagiat karena kutipan yang ditulis telah disebutkan sumbernya didalam daftar pustaka.
Apabila dikemudian hari ada pengaduan dari pihak lain karena didalam tugas akhir ini ditemukan plagiat karena kesalahan saya sendiri, maka saya bersedia menerima sanksi apapun oleh Program Studi D III Analis Farmasi dan Makanan Fakultas Farmasi Universitas Sumatera Utara, dan bukan menjadi tanggung jawab pembimbing.
Demikian surat pernyataan ini saya perbuat dengan sebenarnya untuk dapat digunakan jika diperlukan sebagaimana mestinya.
Medan, Agustus 2016 Yang Membuat pernyataan
Husrina Suryani
UJI DISOLUSI TABLET GLISERIL GUAIAKOLAT YANG DIPRODUKSI OLEH PT. KIMIA FARMA (PERSERO) TBK.
PLANT MEDAN
ABSTRAK
Tablet gliseril guaiakolat atau disebut juga guaifenesin adalah derivat guaiakol yang banyak digunakan sebagai ekspektoran. Tablet gliseril harus melalui serangkaian pengujian untuk menentukan kualitas tablet tersebut. Salah satunya adalah uji disolusi. Tujuan pengujian ini adalah untuk mengetahui apakah tablet gliseril guaiakolat yang diproduksi oleh PT. Kimia (Persero) Tbk. Plant Medan memenuhi persyaratan uji disolusi sesuai dengan yang ditetapkan oleh Farmakope Indonesia Edisi V.
Sampel terdiri dari 6 tablet yang diambil dari satu bets. Uji disolusi dilakukan dengan menggunakan alat tipe 2 (metode dayung) dan penetapan kadar zat terlarut dilakukan dengan mengggunakan metode spektrofotometri UV-Vis sesuai dengan prosedur dan alat spktrofotometri UV-Vis merk Agilent type 8453 E yang digunakan di laboratorium PT. Kimia Farma (Persero) Tbk. Plant Medan.
Hasil Pengujian menunjukkan bahwa kadar zat terlarut dari ke-6 tablet, yaitu 100,655%, 94,935%, 95,003%, 95,951%, 95,281%, 94,931%, sesuai dengan batas yang ditetapkan dalam Farmakope Indonesia, dimana jumlah ke-6 tablet yang diuji pada tahap 1 (S1) memenuhi kriteria penerimaan hasil uji disolusi yaitu tidak satupun kadar yang diperoleh kurang dari ketentuan (Q+5%) yakni (75% + 5%) = 80%
Kata kunci: tablet gliseril guaiakolat, uji disolusi, penetapan kadar, spektrofotometri UV-Vis.
DAFTAR ISI
Halaman
LEMBAR JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
SURAT PERNYATAAN TIDAK PLAGIAT ... vi
ABSTRAK ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan dan Manfaat ... 2
1.2.1 Tujuan ... 2
1.2.2 Manfaat ... 2
BAB II TINJAUAN PUSTAKA ... 3
2.1 Pengertian Obat ... 3
2.2 Tablet... 3
2.2.1 Tablet Secara Umum ... 3
2.2.2 Persyaratan Tablet ... 4
2.3 Uraian Umum Gliseril Guaiakolat ... 7
2.3.1 Tablet Gliseril Guaiakolat ... 7
2.4 Uji Disolusi ... 9
2.4.1 Metode Uji Disolusi ... 10
2.4.2 Kriteria Sediaan Uji ... 11
2.4.3 Prosedur Ujian ... 12
2.4.4 Kriteria penerimaan ... 12
2.4.5 Faktor yang Mempengaruhi Disolusi Zat Aktif ... 13
2.5 Penetapan Kadar ... 14
2.6 Spektrofotometer ... 15
2.6.1 Defenisi ... 15
2.6.2 Instrumen ... 16
BAB III METODE PENELITIAN... 17
3.1 Tempat ... 17
3.2 Alat-alat ... 17
3.3 Bahan-bahan ... 17
3.4 Prosedur ... 17
3.4.1 Pengambilan Sampel ... 17
3.4.2 Pembuatan Larutan Standar ... 17
3.4.3 Pembuatan Larutan Sampel ... 18
3.4.4 Cara Penetapan Serapan ... 18
3.5 Perhitungan ... 19
BAB IV HASIL DAN PEMBAHASAN ... 20
4.1 Hasil ... 20
4.2 Pembahasan ... 20
BAB V KESIMPULAN DAN SARAN ... 22
5.1 Kesimpulan ... 22
5.2 Saran ... 22
DAFTAR PUSTAKA ... 23
LAMPIRAN ... 25
DAFTAR TABEL
Tabel Halaman
2.1 Penyimpangan Bobot Rata-Rata ... 5
2.2 Penerimaan Hasil Uji Disolusi Berdsarkan FI Edisi V ... 12
4.1 Hasil Perhitungan Disolusi ... 20
4.2 Penerimaan Hasil Uji Disolusi ... 21
DAFTAR GAMBAR
Gambar Halaman
1 Struktur Gliseril Guaiakolat ... 7
DAFTAR LAMPIRAN
Lampiran Halaman
1 Data dan hasil uji disolusi tablet gliseril guaiakolat ... 25
2 Data hasil uji disolusi Oleh PT. Kimia Farma ... 26
3 Hasil absorbansi larutan sampel ... 27
4 Hasil absorbansi larutan standar ... 28
5 Contoh perhitungan ... 29
6 Gambar alat disolusi ... 31
7 Gambar alat spektrofotometer (Agilent 8453) ... 32
8 Gambar alat pH meter ... 33
BAB I PENDAHULUAN 1.1 Latar Belakang
Obat dapat digolongkan dalam beberapa sediaan, seperti tablet, kapsul, suspensi, dan berbagai larutan sediaan farmasi. Tablet adalah sediaan padat yang berbentuk rata atau cembung rangkap, umumnya bulat, dibuat dengan mengempa atau mencetak obat atau campuran obat dengan atau tanpa zat tambahan (Anief, 1986).
Tablet Gliseril Guaikolat termasuk jenis obat batuk basah. Obat batuk ini digunakan untuk batuk yang memiliki ciri berlendir, dahak mudah dikeluarkan dan terasa ringan (Widodo, 2004).
Sediaan tablet mempunyai beberapa persyaratan antara lain uji disolusi yaitu untuk mengetahui seberapa banyak persentase zat aktif dalam obat, yang terlarut kedalam peredaran darah untuk memberikan efek terapi. Sebelum melakukan uji disolusi, metode analisis yang digunakan harus ditetapkan terlebih dahulu dan dikaji dengan seksama, antara lain komposisi media disolusi, jumlah media (dalam mL), waktu (dalam menit) kecepatan pengadukan (dalam rotasi per menit = rpm), prosedur penetapan konsentrasi dan toleransi. Setelah pengambilan sampel uji disolusi, dilanjutkan dengan proses analisis penetapan kadar zat aktif dalam sampel (Siregar, 2010).
Ditinjau dari struktur molekul Gliseril Guaiakolat yang mempunyai gugus kromofor dan ausokrom, maka Gliseril Guaiakolat kadar terlarutnya dapat diuji secara spektrofotometri UV.
Berdasarkan hal diatas penulis tertarik untuk menentukan mutu tablet Gliseril Guaiakolat dengan salah satu parameter yaitu uji disolusi, dengan penetapan kadar terlarut secara spektrofotometri UV. Sehingga penulis tertarik untuk mengambil judul tugas akhir sebagai berikut “Uji Disolusi Tablet Gliseril Guaiakolat Yang diproduksi oleh PT. Kimia Farma (Persero) Tbk. Plant Medan Menggunakan Metode Spektrofotometri UV-Vis”.
1.2 Tujuan dan Manfaat 1.2.1 Tujuan
1. Mengetahui kadar gliseril guaiakolat terlarut dari tablet Gliseril Guaiakolat yang diproduksi oleh PT. Kimia Farma (Persero) Tbk.
Plant Medan.
2. Mengetahui apakah kadar gliseril guaiakolat dalam tablet tersebut memenuhi persyaratan yang ditetapkan pada Farmakope Indonesia Edisi V tahun 2014.
1.2.2 Manfaat
1. Mahasiswa dapat mengaplikasikan kemampuan dalam melakukan uji disolusi dan penetapan kadar gliseril guaiakolat secara spektrofotometri.
2. Untuk mengetahui dan memberikan informasi kepada masyarakat, bahwa sediaan tablet gliseril guaiakolat produksi PT. Kimia Farma (Persero) Tbk. Plant Medan telah memenuhi persyaratan serta terjamin mutu dan khasiatnya, sehingga layak didistribusikan dan aman untuk digunakan.
BAB II
TINJAUAN PUSTAKA 2.1 Pengertian Obat
Obat adalah zat aktif berasal dari nabati, hewani, kimiawi alam maupun sintetis dalam dosis atau kadar tertentu dapat dipergunakan untuk preventif (profilaksis), rehabililtasi, terapi, diagnosa terhadap keadaan penyakit pada manusia maupun hewan. Namun zat aktif tersebut tidak dapat dipergunakan begitu saja sebagai obat, terlebih dahulu harus dibuat dalam bentuk sediaan. Oleh karena itu muncul sediaan pil, tablet, kapsul, sirup, suspensi, suppositoria, salap dan lain-lain (Jas, 2004).
Efek farmakologi atau efek terapi obat harus mencapai tempat aksinya dalam konsentrasi yang cukup untuk menimbulkan respon. Tercapainya konsentrasi obat tergantung pada keadaan dan kecepatan obat diabsorpsi dari tempat pemberian dan distribusinya oleh aliran darah ke bagian yang lain dari badan. Kecepatan absorbsi obat akan dipengaruhi oleh laju disolusi, semakin cepat laju disolusi akan semakin cepat absorbsi obat (Anief, 2007).
2.2 Tablet
2.2.1 Tablet Secara Umum
Tablet merupakan bahan obat dalam bentuk sediaan padat yang biasanya dibuat dengan penambahan bahan tambahan farmasetika yang sesuai. Tablet dapat berbeda-beda dalam ukuran, bentuk, berat, kekerasan, ketebalan, daya hancur, dan aspek lainnya tergantung pada cara pemakaian tablet dan metode pembuatanya.
Umumnya tablet digunakan pada pemberian obat-obat secara oral (Ansel, 1989).
Untuk membuat tablet diperlukan bahan tambahan berupa (Anief, 1986):
a. Bahan pengisi (diluent)
Bahan ini dimaksudkan agar memperbesar volume tablet. Zat-zat yang dipakai ialah : saccharum lactis, amylum, kalsium fosfat, kalsium karbonat.
b. Bahan pengikat (binder)
Agar tablet tidak pecah, dapat merekat digunakan zat seperti : mucilago Gummi Arabici 10-20%, mucilago amyli 10%, larutan gelatin 10-20%
(panas), larutan metilselulosa 5%.
c. Bahan penghancur (disintegrator)
Agar tablet dapat hancur dalam pelarut, digunakan amilum kering, gelatin, agar-agar, natrium alginat.
d. Bahan pelicin (lubricant)
Agar tablet tidak lekat pada cetakan (matrys) digunakan zat seperti : Talcum 5%, magnesium stearat, asam stearat.
Dalam pembuatan tablet, zat berkhasiat dan bahan tambahan, kecuali bahan pelicin dibuat granul (butiran kasar), karena serbuk yang halus tidak mengisi cetakan dengan baik. Dengan dibuat granul, akan terjadi “free flowing”, mengisi cetakan secara tetap dan dapat dihindari tablet menjadi “capping” (retak) pada tablet (Anief, 1986).
2.2.2 Persyaratan Tablet
Tablet harus memenuhi persyaratan sebagai berikut : a. Keseragaman Bobot
Timbang 20 tablet, hitung bobot rata-rata tiap tablet. Jika ditimbang satu persatu, tidak boleh lebih dari 2 tablet yang menyimpang dari bobot rata-rata lebih besar dari harga yang ditetapkan dalam kolom A dan tidak boleh satu
tablet pun yang bobotnya menyimpang dari bobot rata-rata lebih dari harga dalam kolom B. Jika perlu dapat digunakan dalam 10 tablet dan tidak satu tablet yang bobotnya menyimpang lebih besar dari bobot rata-rata yang ditetapkan dalam kolom A maupun kolom B.
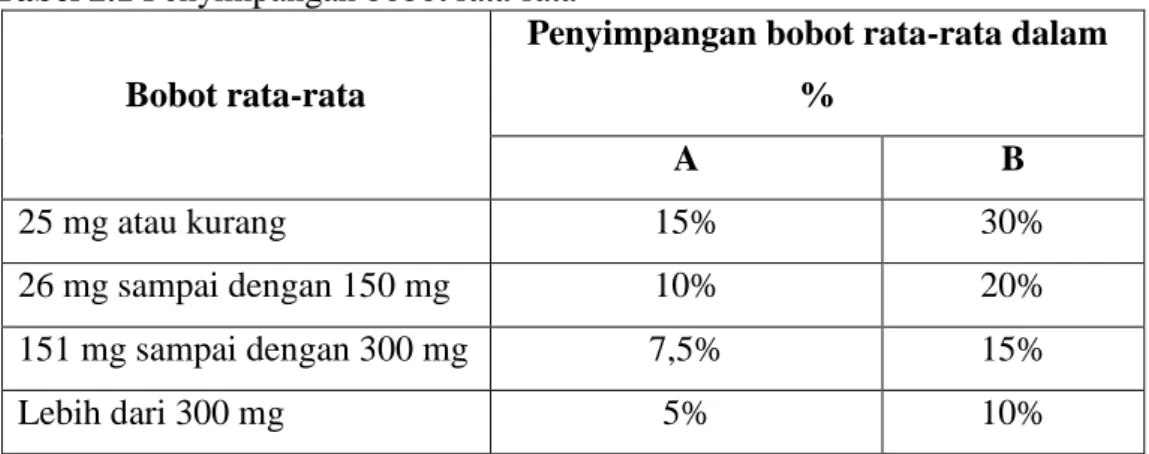
Tabel 2.1 Penyimpangan bobot rata-rata
Bobot rata-rata
Penyimpangan bobot rata-rata dalam
%
A B
25 mg atau kurang 15% 30%
26 mg sampai dengan 150 mg 10% 20%
151 mg sampai dengan 300 mg 7,5% 15%
Lebih dari 300 mg 5% 10%
Sumber: Ditjen POM, 1979 b. Kekerasan
Tablet harus cukup keras untuk tahan pecah waktu dikemas, pengiriman dan waktu ditangani secara normal, tapi juga tablet ini akan cukup lunak untuk melarut akan menghancur dengan sempurna pada saat digunakan orang atau dapat dipatahkan diantara jari-jari bila memang tablet ini perlu dibagi untuk pemakaiannya. Uji ini dilakukan dengan menggunakan alat hardness tester untuk mengukur tingkat kekuatan yang dibutuhkan dalam memecahkan tablet.
Umumnya kekuatan tablet berkisar 4-8 kg (Ansel, 1989).
c. Friabilitas
Uji ini dilakukan untuk mengetahui keregasan (friabilitas) tablet. Tablet yang rapuh akan mengurangi kandungan zat berkhasiatnya sehingga mempengaruhi efek terapi. Uji ini dilakukan dengan menggunakan alat Roche friabilator.
Terlebih dahulu tablet ditimbang sebelum dimasukkan ke friabilator.
Kemudian tablet dimasukkan ke dalam alat, lalu alat dioperasikan selama empat menit atau 100 kali putaran. Tablet ditimbang kembali dan dibandingkan dengan berat mula-mula. Selisih berat dihitung sebagai keregasan tablet. Persyaratan keregasan tablet harus lebih kecil dari 0,8 % (Ansel, 1989).
d. Waktu hancur (Disintegration Test)
Uji waktu hancur tablet dilakukan untuk tablet tidak bersalut, tablet bersalut bukan enterik, tablet salut enterik, tablet bukal, dan tablet sublingual. Uji waktu hancur dilakukan dengan menggunakan alat uji hancur. Masing-masing sediaan tablet tersebut mempunyai prosedur uji waktu hancur dan persyaratan tertentu (Siregar dan Wikarsa, 2010).
e. Disolusi (Dissolution Test)
Disolusi adalah suatu proses perpindahan molekul obat dari bentuk padat kedalam larutan suatu media. Uji ini dimaksudkan untuk mengetahui banyaknya zat aktif yang terlarut yang memberikan efek terapi didalam tubuh.
Kecepatan absorbsi obat tergantung pada pemberian yang dikehendaki dan juga harus dipertimbangkan frekuensi pemberian obat (Syamsuni, 2007).
f. Penetapan kadar zat aktif
Penetapan kadar zat aktif bertujuan untuk mengetahui apakah kadar zat aktif yang terkandung didalam suatu sediaan sesuai dengan yang tertera pada etiket dan memenuhi syarat yang tertera pada masing-masing monografi. Bila zat aktif obat tidak memenuhi syarat maka obat tersebut tidak akan memberikan efek terapi dan juga tidak layak untuk dikonsumsi (Syamsuni, 2007).
2.3 Uraian Umum Gliseril Guaiakolat Rumus Bangun :
Rumus Bangun Gliseril Guaiakolat
Nama Kimia : Guaifenesin Rumus Molekul : C10H14O4
Berat Molekul :198,22
Pemerian : Serbuk Hablur, Putih hingga keabuan, hampir tidak berbau atau berbau lemah, rasa pahit.
Kelarutan : Larut dalam air, dalam etanol , dalam kloroform, daam propilenglikol; agak sukar larut dalam gliserin
Syarat kadar : Mengandung C10H14O4 tidak kurang dari 90,0% dan tidak lebih dari 110,0%, dihitung terhadap zat yang telah
dikeringkan (Ditjen POM, 1995).
2.3.1 Tablet Gliseril Guaiakolat
Tablet Gliseril Guaiakolat atau disebut juga Guaifenesin adalah derivat guaiakolat yang banyak digunakan sebagai ekspektoran dalam berbagai jenis sediaan batuk populer. Pada dosis tinggi bekerja merelaksasi otot (Tjay, 2007).
Ekspektoran adalah obat yang dapat merangsang pengeluaran dahak dari saluran napas (ekspektoransi). Penggunaan obat Gliseril Guaiakolat hanya didasarkan tradisi dan kesan subyektif pasien dan dokter. Belum ada bukti bahwa obat bermanfaat pada dosis yang diberikan (Setiabudy, 2007).
Obat ekspektoran bekerja dengan cara meningkatkan jumlah cairan sehingga lendir menjadi encer, dan juga merangsang pengeluaran lendir dari saluran napas (Sartono, 1996).
Batuk adalah refleks penting yang membersihkan tenggorokan dan saluran bronkhus dari flegma yang sering tertimbun pada saat flu. Batuk yang cukup, penting dilakukan agar mukus dan flegma dapat keluar. Batuk yang kurang mengeluarkan mukus dan flegma akan sangat menyiksa dan selanjutnya dapat mengiritasi saluran udara (Harkness,1989).
Batuk berfungsi sebagai mekanisme pertahanan tubuh dalam mengatasi penyakit atau gangguan pada saluran napas. Batuk dapat disebabkan oleh rangsangan, radang, atau gangguan pada saluran napas yang disebabkan oleh lendir (Sartono, 1996).
Gliseril Guaiakolat termasuk jenis obat batuk basah. Obat batuk ini digunakan untuk batuk yang memiliki ciri berlendir, dahak mudah dikeluarkan dan terasa ringan dan tidak begitu sering intensitas batuknya. Khasiat obat ini mengeluarkan lendir batuk agar jalan napas terbebas dari zat asing (Widodo, 2004). Hal-hal yang perlu diperhatikan pada penggunaan Gliseril Guaiakolat:
- Jangan gunakan lebih dari 7 hari tanpa izin dokter - Minumlah 1 gelas air setiap minum obat ini - Tidak diperbolehkan untuk alergi
Contoh Merk Obat : Guaipim, Pasaba, Pectorin, Phenex, Probat, Triadex, Expektoran (Widodo, 2004).
Golongan/Kelas Terapi : Obat untuk saluran napas.
Indikasi : Penggunaan untuk batuk yang membutuhkan pengeluaran dahak.
Kontraindikasi : Hipersensitivitas terhadap produk Guaifenesin.
Dosis : Oral 4-6 dd 100-200 mg.
Dewasa : Sehari 3 kali 1-2 tablet.
Anak-anak : Sehari 3 kali -1 tablet.
Efek Samping : Berupa iritasi lambung (mual, muntah) yang dapat dikurangi bila diminum dengan segelas air.
Stabilitas Penyimpanan : Serbuk Guaifenesin cendrung menggumpal pada saat penyimpanan, simpan dalam wadah yang tertutup rapat.
Mekanisme Kerja : Merangsang reseptor-reseptor dimukosa lambung yang kemudian meningkatkan kegiatan kelenjar- sekresi dari saluran lambung-usus dan sebagai refleks memperbanyak sekresi dari kelenjar yang berada disaluran napas (Tjay, 2007).
2.4 Uji Disolusi
Disolusi didefinisikan sebagai proses melarutnya suatu zat padat dalam zat cair tertentu. Kecepatan disolusi obat merupakan tahap sebelum obat berada dalam darah. Dalam saluran pencernaan, zat berkhasiat dari sediaan padat akan
terlarut sehingga dapat melewati membran saluran cerna. Obat yang larut baik dalam air akan melarut cepat dan berdifusi secara pasif (Syukri, 2002).
Laju disolusi dapat menjadi tahap pembatasan kecepatan sebelum zat aktif berada dalam darah. Akan tetapi jika bentuk sediaan (tablet) yang diberikan secara per oral masuk dan berada disaluran cerna dalam bentuk solid. Pertama bentuk sediaan solid harus terdisintegrasi dan zat aktif larut dalam media cair dan kemudian harus melewati membran saluran cerna. Zat aktif yang mudah larut akan cenderung cepat melarut, membuat tahap pembetasan kecepatan, yakni difusi pasif dan/atau transpor zat aktif, untuk absorbsi melalui membran saluran cerna.
Sebaliknya, kecepatan absorbsi cepat zat aktif yang sukar larut akan dibatasi oleh laju disolusi zat aktif yang tidak larut, atau juga dapat dibatasi oleh kecepatan disintegrasi bentuk sediaan (Siregar, 2010).
2.4.1 Metode Uji Disolusi
Alat uji disolusi berfungsi melepaskan dan melarutkan zat aktif dari sediaannya. Pada prinsipnya, alat uji disolusi terdiri atas bejana dan tutup, yang berfungsi sebagai wadah yang mendisolusi zat aktif, pengaduk, motor pengaduk, termometer, penangas air yang dilengkapi dengan termostat (Siregar, 2010).
Menurut Farmakope Indonesia Edisi V (2014), terdapat dua tipe metode uji disolusi yaitu :
a. Alat 1 (Tipe Keranjang)
Alat terdiri dari wadah tertutup dari kaca, suatu batang logam yang digerakkan oleh mesin dan wadah disolusi (keranjang). Wadah disolusi berbentuk silinder dengan dasar setengah bola, tinggi 160 – 175 mm, diameter 98 – 106 mm dan berkapasitas 1000 mL. Batang logam berada pada posisi sedemikian rupa
sehingga sumbunya tidak lebih dari 2 mm pada setiap titik dari sumbu pertikal wadah, berputar dengan halus dan tanpa goyangan. Sebuah tablet diletakkan dalam keranjang yang diikatkan pada bagian bawah batang logam yang digerakkan oleh mesin yang kecepatannya dapat diatur. Wadah dicelupkan sebagian di dalam suatu tangas air yang sesuai sehingga dapat mempertahankan suhu dalam wadah pada 37 ºC ± 0,5 ºC. Pada bagian atas wadah ujungnya melebar, untuk mencegah penguapan digunakan suatu penutup yang sesuai.
b. Alat 2 (Tipe Dayung)
Alat ini sama dengan alat 1, bedanya pada alat ini digunakan dayung yang terdiri dari daun dan batang logam sebagai pengaduk. Dayung melewati diameter batang sehingga dasar dayung dan batang rata. Dayung memenuhi spesifikasi dengan jarak 25 ± 2 mm antara dayung dan bagian dasar wadah yang dipertahankan selama pengujian berlangsung. Sediaan obat dibiarkan tenggelam ke bagian dasar wadah sebelum dayung mulai berputar. Gulungan kawat berbentuk spiral dapat digunakan unuk mencegah mengapungnya sediaan.
2.4.2 Kriteria Sediaan Uji
Suatu sediaan tablet diuji disolusinya jika dinyatakan dalam monografinya. Hal ini berarti prosedur dan persyaratan uji disolusi hanya berlaku untuk sediaan tablet yang terera dalam monografi tersebut. Sediaan tablet yang tidak tertera dalam FI. Ed. IV tentu saja dapat diuji disolusinya dengan prosedur dan persyaratan yang ditetapkan sendiri oleh pabriknya atau laboratorium pengendalian mutu (Siregar, 2010).
2.4.3 Prosedur Pengujian
Pada tiap pengujian, dimasukkan sejumlah volume media disolusi (seperti yang tertera dalam masing-masing monografi) kedalam wadah. Alat dirangkai dan suhu media disolusi diatur pada 37 ºC. Satu tablet dicelupkan dalam keranjang atau dibiarkan tenggelam ke bagian dasar wadah, kemudian pengaduk diputar dengan kecepatan seperti yang ditetapkan dalam monografi. Pada interval waktu yang ditetapkan, diambil cuplikan pada daerah pertengahan antara permukaan media disolusi dan bagian atas dari keranjang berputar atau dayung dan tidak kurang dari 1 cm dari dinding wadah untuk analisis kimia. Tablet harus memenuhi syarat seperti yang terdapat dalam monografi (Ditjen POM, 1995).
2.4.4 Kriteria Penerimaan
Persyaratan Dipenuhi bila jumlah zat aktif yang terlarut dari sediaan yang diuji sesuai dengan tabel penerimaan. Pengujian dilakuk an sampai tiga tahap.
Pada tahap 1 (S1) digunakan 6 tablet. Bila pada tahap ini tidak memenuhi syarat, maka akan dilanjutkan ke tahap berikutnya yaitu tahap 2 (S2). Pada tahap ini digunakan 6 tablet tambahan. Bila tetap tidak memnuhi syarat, maka pengujian dilakukan lagi ke tahap 3 (S3). Pada tahap ini digunakan 12 tablet tambahan (Ditjen POM, 2014)
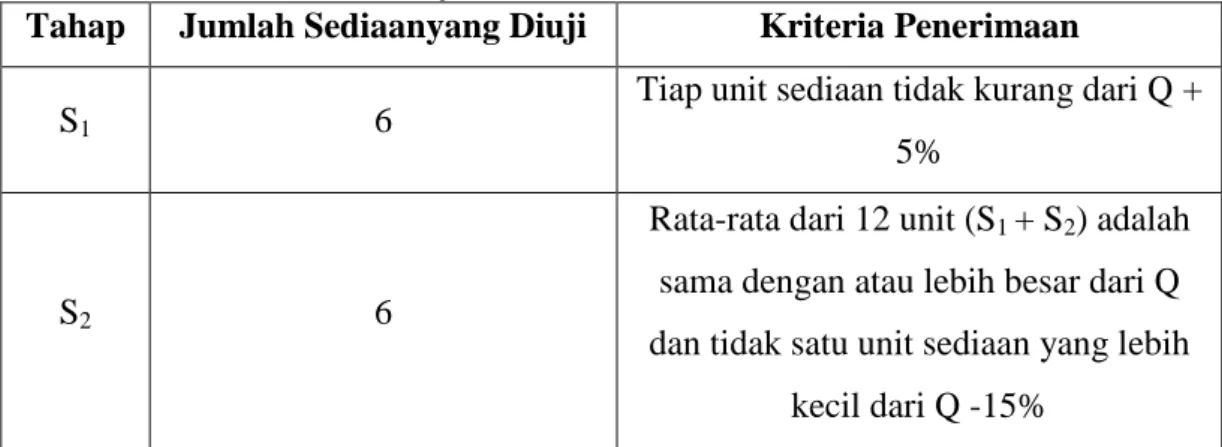
Tabel 2.2 Penerimaan Hasil Uji Disolusi Berdsarkan FI Edisi V
Tahap Jumlah Sediaanyang Diuji Kriteria Penerimaan
S1 6 Tiap unit sediaan tidak kurang dari Q +
5%
S2 6
Rata-rata dari 12 unit (S1 + S2) adalah sama dengan atau lebih besar dari Q dan tidak satu unit sediaan yang lebih
kecil dari Q -15%
S3 12
Rata-rata dari 24 unit (S1 + S2 + S3) adalah sama dengan atau lebih besar d
ari Q, tidak lebih dari 2 unit sediaan yang lebih kecil dari Q – 15% dan tidak 1 unitpun yang lebih kecil dari Q
– 25%.
Keterangan :
S1 : Tahap pertama S2 : Tahap Kedua S3: Tahap Ketiga
Q : Jumlah zat aktif yang terlarut yang tertera dalam masing-masing monografi Harga Q adalah jumlah zat yang terlarut, seperti yang tertera dalam masing-masing monografi, dinyatakan dalam persen dari jumlah yang tertera pada pada etiket. Angka 5% dan 15% adalah persen dari jumlah yang tertera pada etiket sehingga mempunyai arti yang sama dengan Q. Kecuali ditetapkan lain dalam masing-masing monografi, persyaratan umum untuk penetapan satu titik tunggal ialah terdisolusi 75% dalam 45 menit dengan menggunakan Alat 1 pada 100 rpm atau alat 2 pada 50 rpm (Ditjen POM, 2014).
2.4.5 Faktor yang Mempengaruhi Disolusi Zat Aktif
Faktor-faktor yang mempengaruhi laju disolusi dari bentuk sediaan padat, antara lain:
a. Faktor yang berkaitan dengan sifat fisikomia obat
Sifat-sifat fisikokimia obat yang mempengaruhi laju disolusi meliputi kelarutan zat aktif, bentuk kristal, serta ukuran partikel.
b. Faktor yang berkaitan dengan formulasi sediaan
Formulasi sediaan berkaitan dengan bentuk sediaan, bahan tambahan dan cara pengolahan. Pengaruh bentuk sediaan terhadap laju disolusi tergantung kecepatan pelepasan bahan aktif yang terkandung didalamnya. Penggunaan
dalam proses formulasi dapat menghambat atau mempercepat laju disolusi tergantung bahan tambahan yang digunakan. Cara pengolahan bahan baku, bahan tambahan dan prosedur yang dilakukan dalam formulasi sediaan padat peroral juga berpengaruh terhadap laju disolusi. Pengadukan yang terlalu lama pada granulasi basah dapat menghasilkan granul-granul besar, keras dan padat sehingga tablet yang dihasilkan waktu hancur dan disolusi yang lama. Faktor interaksi obat dengan eksipien (bahan tambahan) dan kekerasan.
c. Faktor yang berkaitan dengan alat dan parameter uji
Parameter ini dipengaruhi oleh lingkungan selama percobaan meliputi kecepatan pengadukan, suhu dan pH medium, serta metode uji. Pengadukan mempengaruhi penyebaran parikel-partikel dan tebal lapisan difusi sehingga memperluas permukaan partikel yang kontak dengan pelarut. Suhu medium berpengaruh terhadap kelarutan zat aktif. Zat yang kelarutannya tidak tergantung pH, perubahan pH medium disolusi tidak akan mempengaruhi laju disolusi. Pemilihan kondisi pH pada percobaan in vitro penting karena kondisi pH akan berbeda pada lokasi obat disaluran cerna. Metode penentuan laju disolusi yang berbeda dapat menghasilkan laju disolusi sama atau berbeda, tergantung pada metode uji yang digunakan (Syukri, 2002).
2.5 Penetapan Kadar
Setelah pengambilan sampel uji disolusi, dilanjutkan dengan proses analisis penetapan kadar zat aktif dalam sampel. Penetapan kadar dipilih berdasarkan sifat senyawa dan prosedur penetapan kadar senyawa dalam cairan.
Untuk penetapan kadar dapat dilakukan dengan metode fisikokimia yaitu
spektrofotometri uv-visibel, flourometri dan konduktormetri (Devissaquest, 1993).
Spektrofotometri UV-Vis adalah pengukuran panjang gelombang dan intensitass sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel.
Metode ini biasanya digunakan untuk molekul dan ion anorganik atau kompleks di dalam larutan. Spektrum UV-Vis mempunyai bentuk yang lebar dan hanya sedikit informasi tentang struktur yang didapatkan, tetapi spektrum ini sangat berguna untuk pengukuran secara kuantitatif (Dachriyanus, 2004).
2.6 Spektrofotometer 2.6.1 Defenisi
Spektrofotometri uv-visible adalah pengukuran serapan cahaya didaerah ultraviolet (200-400 nm) dan sinar tampak (400-800 nm) oleh suatu senyawa.
Absorbansi spektrofotometri uv-visible adalah istilah yang digunakan ketika radiasi ultraviolet dan cahaya tampak diabsorbsi oleh molekul yang diukur.
Alatnya disebut uv-visible spektrofotometri. Spektrofotometri uv visible adalah salah satu instrumen yang digunakan dalam menganalisa suatu senyawa kimia.
Spektrofotometri umumnya digunakan karena kemampuannya dalam menganalisa begitu banyak senyawa kimia serta kepraktisannya dalam hal preparasi sampel apabila dibandingkan dengan beberapa metode analisa (Rohman, 2007).
Metode spektrofotometri UV-Vis adalah pengukuran intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel. Sinar ultraviolet dan cahaya tampak memiliki energi yang cukup untuk mempromosikan elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Spektrofotometri UV-Vis biasanya digunakan untuk molekul organik didalam larutan.Spektrumnya
mempunyai daerah yang lebar dan sedikit informasi yang bisa didapatkan dari spektrum ini sangat berguna untuk pengukuran secara kuantitatif (Dachriyanus, 2004).
2.6.2 Instrumen
Komponen-komponen suatu spektrofotometri uv-vis meliputi sebagai berikut :
a. Sumber sinar
Sumber sinar yang digunakan untuk daerah UV digunakan lampu hidrogen atau lampu deuterium pada panjang gelombang dari 190-350 nm, sementara lampu halogen kuarsa atau lampu tungsten digunakan untuk daerah visible pada panjang gelombang antara (350-900 nm).
b. Monokromator
Monokromator merupakan sumber sinar yang umum digunakan menghasilkan radiasi kontinu dalam kisaran panjang gelombang yang lebar.
Monokromator digunakan untuk mendiskripsikan sinar ke dalam komponen- komponen panjang gelombangnya, yang selanjutnya akan dipilih oleh celah (slit).
Monokromator berputar sedemikian rupa sehingga kisaran panjang gelombang dilewatkan pada sampel sebagai scan instrumen melewati spektrum.
c. Optik
Optik memecah sumber sinar sehingga sumber sinar melewati 2 kompartemen. Suatu larutan blanko dapat digunakan dalam suatu kompartemen untuk mengkoreksi pembacaan atau spektrum sampel. Blanko dalam spektrofotometri adalah semua pelarut yang digunakan untuk melarutkan sampel atau pereaksi (Rohman, 2007).
BAB III
METODE PENELITIAN
3.1 Tempat Pelaksanakan
Uji Disolusi tablet gliseril guaiakolat dilakukan di Laboratorium industri PT. Kimia Farma (Persero) Tbk. Plant Medan yang beralamat di jalan Sisimangaraja KM.59 NO. 9 Medan.
3.2 Alat
Alat-alat yang digunakan adalah alat disolusi (type paddle) (Merk Hanson type Vision G2 Elite 8TM), Beaker glass, labu tentukur, volume pipet, dan Perangkat Spektrofotometri UV-Vis merk Agilent Type 8543 E.
3.3 Bahan
Bahan yang digunakan adalah Aquademineralisata dan sampel yang diambil adalah gliseril guaiakolat 100 mg bentuk tablet yang diproduksi oleh PT.
Kimia Farma (Persero) Tbk. Plant Medan.
3.4 Prosedur
3.4.1 Pengambilan Sampel
Sebanyak 10 tablet gliseril guaiakolat diambil secara acak dari satu siklus produksi.
3.4.2 Pembuatan Larutan Standar
a. Ditimbang saksama 44,44 mg baku kerja gliseril guaiakolat, dimasukkan kedalam labu ukur 100 mL.
b. Dilarutkan dengan larutan Aquademineralisata (pelarut), dicukupkan dengan pelarut sampai batas.
c. Dipipet 1 mL larutan, dimasukkan ke dalam labu ukur 10 mL lalu dicukupkan dengan pelarut, kocok.
3.4.3 Pembuatan Larutan Sampel
a. Ditimbang tablet satu persatu sebanyak 6 tablet dari 10 tablet yang dipilih secara acak, dicatat bobotnya.
b. Diisi tabung disolusi dengan media (Aquademineralisata) masing-masing sebanyak 900 mL.
c. Dipanaskan media hingga suhu ± 37ºC, dengan cara menekan “HEATER”
(dikontrol dengan teermometer bila perlu).
d. Setelah suhu sesuai, dimasukkan tablet yang telah ditimbang (setara dengan bobot tablet 300 mg x 100/300 mg gliseril guaiakolat) tadi ke dalam masing-masing tabung (satu tablet per tabung).
e. Ditekan tombol “ON” pada alat, diatur waktu dengan menggunakan timer selama 30 menit.
f. Setelah selesai, diambil sampel dengan menggunakan spuit 30 mL (posisi alat dayung masih berputar), dipindahkan kedalam beaker 50 mL.
g. Dipipet 10 mL larutan dimasukkan kedalam labu ukur 25 mL, lalu dicukupkan dengan aquademineralisata sampai garis tanda.
h. Larutan siap dianalisis.
3.4.4 Cara Penetapan Serapan
- Diukur serapan larutan A dan B pada panjang Gelombang serapan maksimal 274 nm dengan menggunakan larutan aquademineralisata sebagai blanko.
3.5 Perhitungan
Kadar Uji disolusi dapat diukur dengan rumus:
Keterangan:
Asp : Absorbansi sampel Ast : Absorbansi Standarisasi
Bsp : Bobot gliseril guaiakolat yang terkandung dalam sampel yang ditimbang (mg)
Bst : Bobot standar gliseril guaiakolat yang ditimbang (mg) Kst : Kadar standar gliseril guaiakolat (%)
BAB IV
HASIL DAN PEMBAHASAN 4.1 Hasil
Hasil disolusi tablet gliseril guaiakolat dapat dilihat pada tabel dibawah ini:
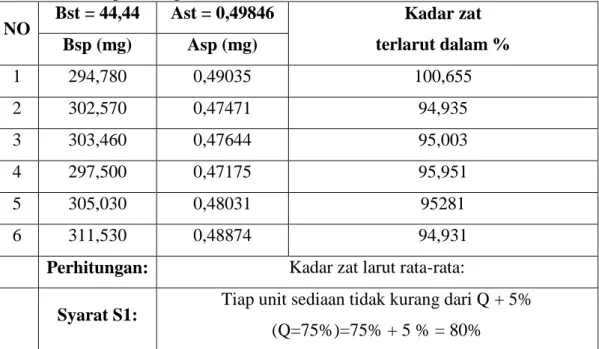
Tabel 4.1 Hasil perhitungan disolusi
NO Bst = 44,44 Ast = 0,49846 Kadar zat terlarut dalam % Bsp (mg) Asp (mg)
1 294,780 0,49035 100,655
2 302,570 0,47471 94,935
3 303,460 0,47644 95,003
4 297,500 0,47175 95,951
5 305,030 0,48031 95281
6 311,530 0,48874 94,931
Perhitungan: Kadar zat larut rata-rata:
Syarat S1: Tiap unit sediaan tidak kurang dari Q + 5%
(Q=75%)=75% + 5 % = 80%
4.2 Pembahasan
Hasil penetapan kadar tablet gliseril guaiakolat 100 mg yang dilakukan pada uji disolusi secara spektrofotometri terhadap 6 (enam) tablet diperoleh kadar yaitu 100,655%, 94,935%, 95,003%, 95,951%, 95,281%, 94,931%.
Persyaratan Dipenuhi bila jumlah zat aktif yang terlarut dari sediaan yang diuji sesuai dengan tabel penerimaan. Pengujian dilakukan sampai tiga tahap.
Pada tahap 1 (S1) digunakan 6 tablet. Bila pada tahap ini tidak memenuhi syarat, maka akan dilanjutkan ke tahap berikutnya yaitu tahap 2 (S2). Pada tahap ini digunakan 6 tablet tambahan. Bila tetap tidak memnuhi syarat, maka pengujian
dilakukan lagi ke tahap 3 (S3). Pada tahap ini digunakan 12 tablet tambahan (Ditjen POM, 2014).
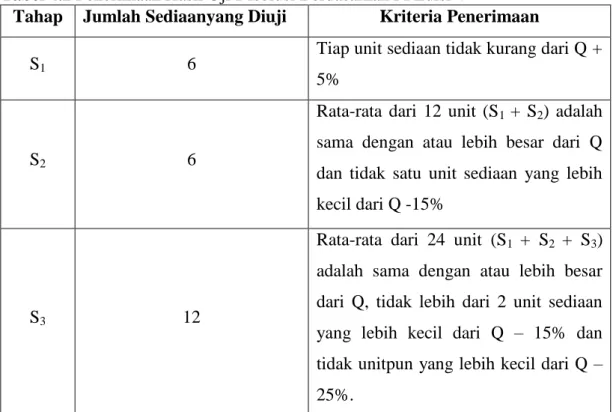
Tabel 4.2 Penerimaan Hasil Uji Disolusi Berdasarkan FI Edisi V
Tahap Jumlah Sediaanyang Diuji Kriteria Penerimaan
S1 6 Tiap unit sediaan tidak kurang dari Q +
5%
S2 6
Rata-rata dari 12 unit (S1 + S2) adalah sama dengan atau lebih besar dari Q dan tidak satu unit sediaan yang lebih kecil dari Q -15%
S3 12
Rata-rata dari 24 unit (S1 + S2 + S3) adalah sama dengan atau lebih besar dari Q, tidak lebih dari 2 unit sediaan yang lebih kecil dari Q – 15% dan tidak unitpun yang lebih kecil dari Q – 25%.
Keterangan :
S1 : Tahap pertama S2 : Tahap Kedua S3: Tahap Ketiga
Q : Jumlah zat aktif yang terlarut yang tertera dalam masing-masing monografi Harga Q adalah jumlah zat yang terlarut, seperti yang tertera dalam masing-masing monografi, dinyatakan dalam persen dari jumlah yang tertera pada pada etiket. Angka 5% dan 15% adalah persen dari jumlah yang tertera pada etiket sehingga mempunyai arti yang sama dengan Q (Ditjen POM, 2014).
Dari hasil pemeriksaan uji disolusi tablet gliseril guaiakolat, kadar zat aktif yang terlarut tersebut sesuai dengan batas yang ditetapkan dimana dari ke-6 tablet pada tahap 1 (S1) dalam farmakope Indonesia edisi V, yaitu tidak satupun kadar yang diperoleh kurang dari 80%. Dari data diatas dinyatakan bahwa tablet gliseril guaiakolat 100 mg yang diproduksi PT. Kimia Farma (Persero) Tbk. Plant Medan
BAB V
KESIMPULAN DAN SARAN 5.1. Kesimpulan
1. Kadar gliseril guaiakolat dalam tablet produksi PT. Kimia Farma (persero) Tbk. Plant Medan adalah 100,655%, 94,935%, 95,003%, 95,951%, 95,281%, 94,931%.
2. Dari hasil penetapan kadar yang telah dilakukan maka dapat ditarik kesimpulan bahwa tablet gliseril guaiakolat 100 mg yang diproduksi oleh PT. Kimia Farma (persero) Tbk. Plant Medan memenuhi persyaratan Farmakope Indonesia Edisi V. Dimana Persyaratan kadar uji disolusi tiap unit sediaan tidak kurang dari Q + 5 (Q = 75%).
5.2 Saran
Diharapkan mutu tablet gliseril guaiakolat yang diproduksi PT. Kimia Farma (Persero) Tbk. Plant Medan tetap dipertahankan terutama pada uji disolusi sesuai dengan monografi Farmakope Indonesia.
DAFTAR PUSTAKA
Anief, M. (1986). Ilmu Farmasi. Jakarta: Ghalia Indonesia. Hal. 39, 61, 62.
Anief, M. (2007). Perjalanan dan Nasib Obat Dalam Badan. Yogyakarta: Gajah Mada University Press. Hal.1.
Ansel, H.C. (1989). Pengantar Bentuk Sediaan Farmasi. Edisi keempat. Jakarta:
Penerbit Universitas Indonesia (UI-Press). Hal. 50, 244, 255.
Dachriyanus. (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi.
Cetakan I. Padang: Andalas University Press. Hal.1.
Devissaquest, J. (1993). Farmasetika 2 Biofarmasi. Surabaya: Airlangga University Press. Hal. 51, 56.
Direktorat Jendral Pengawasan Obat dan Makanan. (1979). Farmakope Indonesia.
Edisi III. Jakarta: Departemen Kesehatan RI. Hal.7, 272.
Direktorat Jenderal Pengawasan Obat dan Makanan. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Hal. 4, 422, 423, 1084,1085.
Direktorat Jendral Pengawasan Obat dan Makanan. (2014). Farmakope Indonesia.
Edisi V. Jakarta: Departemen Kesehatan RI. Hal.1084,1085.
Harkness, R. (1989). Interaksi Obat. Bandung: Penerbit ITB. Hal.77.
Jas, A. (2004). Perihal Obat Dengan Berbagai Bentuk Sediaannya. Medan: USU Press. Hal. 2.
Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta : Pustaka Pelajar.
Hal.58.
Sastrohamidjojo, H. (1991). Spektroskopi. Edisi Kedua. Yogyakarta: Liberty. Hal 11,13.
Sartono. (1996). Apa yang Sebaiknya Anda Ketahui Tentang Obat-Obat Terbatas dan Bebas Terbatas. Jakarta: Penerbit PT Gramedia Pustaka Utama. Hal.
38.
Setiabudy, R. (2007). Farmakologi dan Terapi. Edisi V. Jakarta: Penerbit FKUI.
Hal.772, 773, 774, 779.
Siregar, C.J.P., dan Wikarsa, S. (2010). Teknologi Farmasi Sediaan Tablet.
Dasar-Dasar Praktis. Jakarta: Penerbit Buku Kedokteran EGC. Hal.55, 84, 86, 90, 604.
Syamsuni, A.H. (2007). Ilmu Resep. Jakarta: Penerbit Kedokteran EGC. Hal.61.
Syukri, Y. (2002). Biofarmasetika. Edisi Pertama. Yogyakarta: UI Press. Hal.30, 35.
Tjay, T.H., dan Rahardja, K. (2007). Obat-Obat Penting Khasiat, Penggunaan, dan Efek-Efek Sampingnya. Jakarta : PT. Elex Media Komputindo. Hal.
624.
Widodo, S., dan Ahmadi, A. (2004). Psikologi Belajar. Jakarta: PT. Rineka Cipta.
Hal. 69, 70, 71.
Lampiran 1. Data dan Hasil Uji Disolusi Tablet Gliseril Guaiakolat
Nama sediaan : Tablet Gliseril Guaiakolat 100 mg
Zat aktif : 100 mg Gliseril Guaiakolat tiap
tablet
No. Batch : A60023T
Volume Media : 900 mL
Media Disolusi : Aquademineralisata
Tipe Alat : Dayung (Paddle)
Waktu : 45 Menit
Kecepatan Putaran : 50 rpm
Panjang Gelombang : 274 nm
Persyaratan ( Q ) : Tidak kurang 80 % dari yang
tertera pada etiket Faktor Pengenceran Larutan Baku : 100 mL
Kandungan Gliseril Guaiakolat Pada Etiket : 100 mg Absorbansi Larutan Standar : 0,49846 Absorbansi larutan sampel
Sampel Absorbansi Larutan Sampel
Pertama 0,49035
Kedua 0,47471
Ketiga 0,47644
Keempat 0,47175
Kelima 0,48031
Keenam 0,48874
Lampiran 2. Data Hasil Uji Disolusi Oleh PT. Kimia Farma
Lampiran 3. Hasil Absorbansi Larutan Sampel
Lampiran 4. Hasil Absorbansi Larutan Standar
Lampiran 5. Contoh Perhitungan
Zatterlarut =
Kst Keterangan :
Bs : Bobot standart gliseril guaiakolat yang ditimbang (mg)
Bsp : Bobot gliseril guaiakolat yang terkandung dalam sampel yang ditimbang (mg)
Kst : Kadar standart gliseril guaiakolat (%)
1. Tablet 1
% Kadar =
0%
=
100,550%
= 100,655%
2. Tablet 2
% Kadar =
%
=
100,550%
= 94,935%
3. Tablet 3
% Kadar =
0%
= 0,95582
100,550%
= 95,003%
Lampiran 5. (Lanjutan) 4. Tablet 4
% Kadar =
0%
= 0,94641
100,550%
= 95.951%
5. Tabel 5
% Kadar =
0%
=
100,550%
= 95,281%
6. Tabel 6
% Kadar =
0%
=
100,550%
= 94,931%
Kadar rata-rata
= 96,126%
Lampiran 6. Gambar Alat Disolusi (Merk Hanson Type Vision G2 Elite 8TM)
Lampiran 7. Gambar Alat Spektrofotometer (Agilent 8453)