PRODUKSI BIOMASSA DAN POTENSI NUTRISI MIKROALGA Nannochloropsissp. K4 (Biomass Production and Potential Nutrition of MicroalgaeNannochloropsissp. K4) 1)I Wayan Arnata,1)I B Wayan Gunam, 1)AAM Dewi Anggreni, 1)W Redi Aryanta, 2)PM. Loberto.
1)Teknologi Industri Pertanian Universitas Udayana 2)Alumni Teknologi Industri Pertanian Universitas Udayana
Email: [email protected]
ABSTRAK
Penelitian ini bertujuan untuk menetukan konsentrasi nitrat dan fosfat untuk produksi biomassa dan mengetahui potensi nutrisi dari mikroalga Nannochloropsis sp. K4. Untuk produksi biomassa menggunakan metode respon permukaan dengan memperlakukan konsentrasi nitrat dan fosfat, sedangkan untuk mengetahui potensi nutrisi dilakukan analisa proksimat terhadap biomassa
Nannochloropsis sp. K4 yang meliputi analisis kadar air, abu, lemak, protein, dan kadar karbohidrat.
Hasil penelitian menunjukkan bahwa produksi biomassa Nannochloropsis sp. K4 optimal sebesar 0,33 g/l diperoleh pada konsentrasi nitrat 104,12 g/l dan fosfat 15,72 g/l. Hasil analisa proksimat menunjukkan bahwa Nannochloropsis sp K4 berpotensi sebagai sumber karbohidrat dengan kadar 40,30 %, protein 39,07 % dan lemak 14,44%. Mikroalga Nannochloropsis sp K4 mengadung kadar air 3,41 % dan kadar abu 4,77 %.
Kata kunci : Nannochloropsis sp. K4, Biomassa, Nutrisi
ABSTRACT
The objective of this research was to determine of the optimal concentration of nitrate and phosphorus on biomass production and determine of the nutrition potential of microalgae Nannochloropsis
sp. K4. Response surface methodology (RSM) has been utilized for finding the optimal values of nitrate and phosphorus concentration on biomass production, whereas Nannochloropsis sp. K4 biomass was proximate analyzed to determine the potential nutrients, which includes analysis of moisture, ash, fat, protein, and carbohydrate content.
The results showed that the optimal Nannochloropsis sp. K4 biomass production of 0.33 g/L was obtained at 104.12 g /L nitrate concentrations and 15.72 g/Ll phosphate concentrations. Proximate analysis results showed that Nannochloropsis has potential as a source of carbohydrates (40.30%), protein (39.07%) and fat (14.44%) with moisture and ash contents of 3.41 % and 4.77 %, respectively.
PENDAHULUAN
Wilayah Indonesia sebagian besar merupakan laut dan memiliki kekayaan yang beranekaragam.
Saat ini, penggalian potensi biota laut terutama mikroalga untuk meningkatkan ketahanan pangan masih
sangat minim. Dengan wilayah perairan yang sangat luas ini, maka Indonesia memiliki potensi yang sangat
besar untuk menemukan spesies mikroalga yang cocok untuk dikembangkan sebagai sumber nutrisi.
Berdasarkan hasil penelitian Arnata et al., (2010) diperairan Pantai Pulau Bali telah berhasil diisolasi
beberapa jenis mikroalga seperti mikroalga dari genus Nannochloropsis sp, Nitzschia sp, Botryococcus sp,
Chaetoceros sp, Ceratium sp, Closterium sp, Cyclotella sp, dan Skeletonema. Dari beberapa genus yang
berhasil diisolasi, ternyata Nannochloropsis sp mempunyai kecepatan dan kestabilan pertumbuhan yang
paling tinggi di bandingkan dengan genus-genus lainnya. Berkaitan dengan hal ini, maka diperlukan
adanya penelitian lebih lanjut mengenai potensi mikroalga khususnya Nannochloropsis sp. isolat K4
sebagai sumber pangan.
Mikroalga mengandung berbagai macam komponen yang sangat bermanfaat khususnya untuk
nutrisi dalam bahan pangan, seperti lipid, karbohidrat, protein dan asam-asam nukleat (Brown et al.,1993.,
Sankar dan Ramasubramanian., 2012). Lemak yang terkandung dalam mikroalga umum terdiri atas asam
lemak tidak jenuh, seperti linoleat, eicosapentaenoic acid/EPA (Rebolloso et al., 2001) dan
docosahexaenoic acid/DHA (Hu dan Gao, 2006., Chisti, 2007). Asam-asam lemat tidak jenuh telah banyak
dilaporkan sangat menguntungkan bagi kesehatan terutama sebagai makanan suplemen pencegahan
penyakit kardiovaskuler, arterosklerosis, dan kanker (Colquhoun, et al., 2008). Eicosapentaenoic acid
atau EPA dan DHA memainkan peran penting dalam perkembangan otak dan retinal bayi. Selain lemak,
mikroalga juga mengandung protein dan asam-asam nukelat (Spolaore et al.,2006). Sebagai contohnya
mikroalga Chlorella vulgaris mengandung protein sekitar 51 – 58% dan asam nukleat 4 – 5% (Becker,
1994). Mikroalga juga berpotensi menghasilkan pigmen yang dapat dimanfaatkan sebagai bioaktif, seperti
Dunaliella mengandung karotenoid sekitar 12,6% bk (Fretes et al., 2012) dan Nannochloropsis sp
mengandung klorofil-a sekitar 0,73-2,85 µg/ml (Allsul dan Wan, 2012). Berbagai jenis pigmen yang
dihasilkan dari mikroalga dapat dimanfaatkan sebagai sumber antioksidan dalam bahan pangan.
Dalam memproduksi komponen-komponen nutrisi, maka jenis media dalam kultivasi dan faktor
lingkungan sangat berpengaruh terhadap pertumbuhan dan perkembangan mikroalga (Fariaet al., 2012).
Kondisi media dan lingkungan berhubungan langsung dengan proses fotosintesis, metabolisme, maupun
reproduksi (Graham et al.,2009). Dalam media pertumbuhan unsur nitrat dan posfat merupakan dua unsur
makronutrien yang sangat mempengaruhi pertumbuhan dan produktifitas biomassa alga karena dibutuhkan
untuk pembentuk protein, lemak dan klorofil (Hu dan Gao, 2006). Lebih lanjut Renaud dan Parry (1994)
menyebutkan bahwa modifikasi faktor nutrient pada media seperti konsentrasi nitrat, fosfat dan pengaturan
faktor-faktor lingkungan seperti cahaya, pH, temperatur dan salinitas juga diperlukan dan dapat
berpengaruh terhadap kuantitas biomassa dan komposisi komponen nutrisi yang terkandung dalam
mikroalga.
Melihat banyaknya keanekaragaman dan potensi yang dimiliki oleh mikroalga serta belum
diketahuinya beberapa faktor nutrisi media yang optimal dalam pertumbuhan untuk memproduksi biomassa
dan komponen-komponen nutrisi, maka penelitian ini bertujuan untuk menentukan konsentrasi nitrat dan
fosfat yang optimal untuk produksi biomassa Nannochloropsis sp. K4 yang maksimal dan mengetahui
potensi kandungan nutrisi Nannochloropsis sp. K4 pada produksi biomassa yang maksimal dengan kondisi
medium pertumbuhan yang optimal.
BAHAN DAN METODE
Bahan
Bahan yang digunakan dalam penelitian ini adalah kultur Nannochloropsis sp. diperoleh dari stok
kultur mikroalga Laboratorium Bioindustri TIP-FTP Unud. FeCl3, MnCl2,5H2O, H3BO3, Na-2 EDTA,
NaH2PO4.2H2O, NaNO3, ZnCl2, CoCl2,6H2O, (NH4)6Mo7O24, 4H2O, CuSO4,5H2O, HCl, Vitamin B1 dan
Vitamin B12. Bahan yang digunakan dalam proses analisis nutrisi adalah : tablet kjeldahl, H2SO4, aquades,
indikator PP, antibuih, NaOH, HCl dan heksana. Bahan-bahan yang dipergunakan berstandar p.a yang
diperoleh dari Zigma Aldrich.
Persiapan Media
Media walne (Andersen, 2005) terdiri meliputi 4 jenis solusi nutrisi yaitu (1) solusi E, dibuat dengan
melarutkan Vitamin B12 sebanyak 0,1 g ke dalam 250 ml air laut. (2) solusi C, dibuat dengan
mencampurkan 0,2 gr Vitamin B1 dengan 25,0 ml solution E, kemudian dilarutkan ke dalam 200 ml air laut.
(3) solusi B dibuat dengan 2,1gr ZnCl2; 2,0gr CoCl2,6H2O; 0,9gr (NH4)6Mo7O24. 4H2O; 2,0gr CuSO4,5H2O
dan 10,0 ml HCl dilarutkan dalam 100 ml dengan air laut.(3) solusi A dibuat dengan 0,8 gr FeCl3; 0,4 gr
MnCl2,5H2O; 33,6 gr H3BO3; 45,0 gr Na-2 EDTA; 20,0 gr NaH2PO4,2H2O; 100,0 gr NaNO3, dan solusi B 1,0
ml, kemudian dilarutkan ke dalam 1 l air laut. Untuk proses kultivasi diperlukan solusi A, B dan C
Kultivasi
Kultivasi mikroalga dilakukan dengan mencampurkan 30% kultur mikroalga ke dalam 70% media
tumbuh (Isnanstyo dan Kurniastuti, 1995; Kawaroe et al, 2010). Pada penelitian ini kultivasi
Nannochloropsis sp. dilakukan secara bertingkat, dimulai dari volume 10 ml hingga mencapai volume 12
liter. Proses kultivasi dilakukan dengan pH media 6, suhu 28±2oC, intensitas cahaya sebesar 2,5 klux,
salinitas 30 ppt, dan dilakukan aerasi selama proses kultivasi.
Penentuan Waktu Panen
Waktu panen ditentukan dengan membuat kurva pertumbuhan mikroalga dalam media walne.
Pada tahap ini preparasi inokulum dilakukan dalam keadaan aseptik. Sel mikroalga sebanyak 0,30 %v/v
diinokulasikan pada flask 2 L yang mengandung media walne. Kultivasi dilakukan dalam erlenmeyer 2 L
dengan pH media 6, suhu 28±2 oC, intensitas cahaya 2,5 klux dengan siklus perbandingan terang dengan
gelap 24:0 jam, salinitas 30 ppt, dan dilakukan aerasi dengan mengalirkan udara ke dalam media. Proses
kultivasi dilaksanakan selama 2 minggu atau 14 hari. Perubahan biomasa kultur diamati setiap 24 jam
secara aseptis. Setiap perlakuan dilakukan dua kali ulangan. Data yang diperoleh kemudian dibuatkan
kurva pertumbuhannya. Waktu panen ditentukan berdasarkan waktu awal stasioner yang memberikan
konsentrasi biomassa tertinggi. Biomassa yang diukur berdasarkan jumlah sel yang dihitung dengan
menggunakan haemacytometer(Palet al.,2011) dan bobot kering (Rocha et al., 2003).
Pemanenan
Pemanenan biomassa Nannochloropsis sp. dilakukan dengan menggunakan metode
pengendapan (tanpa aerasi), yaitu biomassa Nannochloropsis sp. yang mengendap dipisahkan dari media
dan biomassa Nannochloropsis sp. selanjutnya dioven selama 24 jam pada suhu 80oC (Sulistyo, 2010;
Gunawan, 2012).
Optimasi Produksi Biomassa Nannochloropsis sp. K4
Pada percobaan ini ditetapkan dua variabel independen yang berpengaruh terhadap produksi
biomassa yaitu konsentrasi NaNO3 dengan kisaran 80, 100, 120 g/l dan Konsentrasi NaH2PO4.2H2O
dengan kisaran 10, 20, 30 gr/l. Penetapan model untuk respon biomassa menggunakan model kuadratik
dari rancangan percobaan Central Composite Design (CCD). Dari rancangan ini diperoleh 12 kombinasi
perlakuan yang mengikuti rancangan percobaan CCD. Data yang dihasilkan dari rancangan percobaan
tersebut dianalisis dengan menggunakan Response Surface Methodology (RSM). Metode respon
biomassa mikroalga. Data yang diperoleh dianalisis dengan menggunakan program Statistica 10. Bentuk
dan kode perlakuan serta rancangan percobaan CCD dengan sistem pengkodean dapat dilihat pada Tabel
1 dan Tabel 2.
Tabel 1. Perlakuan dan kode perlakuan rancangan CCD.
Perlakuan Kode perlakuan
-1,414 -1 0 1 1,414
Konsentrasi NaNO3 (g/l) 71,72 80 100 120 128,28
Konsentrasi NaH2PO4.2H2O (g/l) 5,86 10 20 30 34,14
Tabel 2. Rancangan percobaan CCD
No Kode kons.
NO3
Kode Kons. PO4
Kons. NaNO3(g/l)
Kons. NaH2PO4.2H2O
(g/l)
1 -1 -1 80 10
2 1 -1 120 10
3 -1 1 80 30
4 1 1 120 30
5 -1.414 0 71,72 20
6 1.414 0 128,28 20
7 0 -1.414 100 5,86
8 0 1.414 100 34,14
9 0 0 100 20
10 0 0 100 20
11 0 0 100 20
12 0 0 100 20
Validasi model
Validasi model dilakukan setelah tahap optimasi produksi biomassa diperoleh. Proses ini
dilakukan dengan dua pendekatan, yaitu menggunakan statistik uji t dengan volume produksi 1 liter dan
validasi dengan sistem produksi pada volume yang lebih besar (scale up) yaitu volume 25 liter. Validasi
dilakukan dengan menguji perbedaan bobot biomassa Nannochloropsis sp. K4 yang dihasilkan secara
actual atau riil dengan prediksi bobot biomassa Nannochloropsis sp. yang dihasilkan dari persamaan
model optimum.
Parameter yang diamati
Pengamatan terhadap parameter penelitian dilakukan terhadap konsentrasi biomassa dengan metode
(Rocha et al., 2003), kadar air dengan metode oven (AOAC, 1998), kadar abu dengan cara kering (AOAC,
1998), kadar lemak dengan metode ekstraksi soxhlet (Sudarmadji et al., 1984), kadar protein dengan
metode semi mikro kjeldahl (Sudarmadji et al., 1984), dan kadar karbohidrat secara by difference
(Sudarmadjiet al., 1984).
HASIL DAN PEMBAHASAN
Waktu Panen Nannochloropsis sp. K4
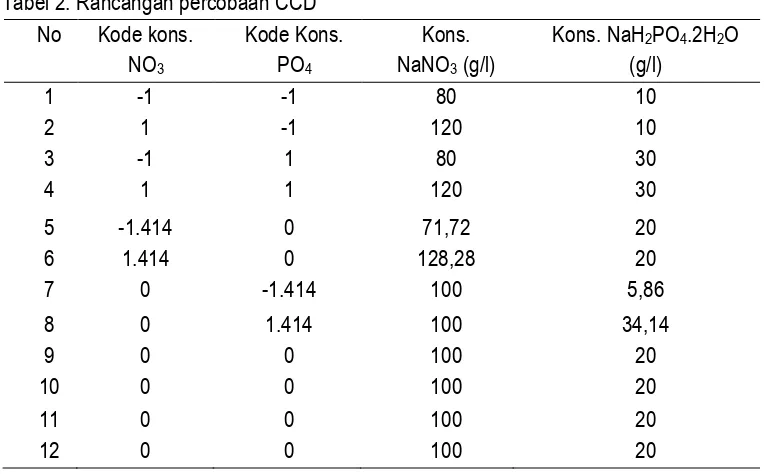
Penentuan waktu panen didasarkan pada kepadatan sel tertinggi yang ditentukan dari kurva
pertumbuhan. Pada awal inokulasi terdapat rata-rata 2,80 x 107±7,78 x 106 sel/ml dan jumlah sel
maksimum dengan rata-rata 2,75 x 108±2.12 x 107 sel/ml terjadi pada hari ke-10. Berdasarkan kurva
pertumbuhan tersebut, maka waktu panen Nannochloropsis sp. ditentukan pada hari ke 10 kultivasi yang
merupakan titik stasioner pertumbuhan dengan konsentrasi sel 0,25±0,07 g/l (bk) dan laju pertumbuhan
spesifik 0,23±0,03/hari. Fase awal stasioner dipilih sebagai waktu panen karena pada fase ini, mikroalga
mengalami pertumbuhan yang seimbang, dimana laju reproduksi mikroalga sama dengan laju
kematiannya, sehingga membuat kandungan nutrisi pada sel mikroalga yang dipanen akan menjadi lebih
baik dari fase-fase sebelumnya (Kawaroe et al., 2010). Kurva pertumbuhan Nannochloropsis sp.K4
disajikan pada Gambar 1.
Gambar 1. Kurva pertumbuhan Nannochloropsissp. K4
Chiu et al., (2009) melaporkan bahwa mikroalga Nannochloropsis oculata mencapai fase
stasioner antara 6 sampai 8 hari dengan bobot biomassa berkisar antara 0,372±0,022 g/L sampai
0,480±0,029 g/L dan laju pertumbuhan spesifik 0,571/hari. Hasil ini lebih tinggi dibandingkan dengan hasil
yang diperoleh pada penelitian ini. Adanya perbedaan waktu untuk mencapai fase stasioner dan kepadatan 0.0E+00
5.0E+07 1.0E+08 1.5E+08 2.0E+08 2.5E+08 3.0E+08 3.5E+08
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
B
io
m
as
sa
(
se
l/m
l)
sel dapat disebabkan oleh perbedaan faktor nutrisi selama kultivasi kultivasi (Sutomo, 2005). Lebih lanjut,
Rocha et al.,(2003) dan Kawaroe et al.,(2009) menyebutkan bahwa perbedaan laju pertumbuhan spesifik
mikroalga dapat disebabkan oleh perbedaan strain atau spesies Nannochloropsisdan umur sel. Selain itu
pertumbuhan mikroalga juga dipengaruhi oleh faktor lingkungan seperti intensitas cahaya (Pal et al.,2011),
media kultur untuk kultivasi (Olofsson et al.,2012)., suplai CO2(Chiu et al.,2009), metode kultivasi (Zittelli et al.,1999).
Optimasi Produksi Biomassa Nannochloropsis sp.
Optimasi produksi biomassa pada penelitian ini bertujuan untuk mencari variabel optimum
pengaruh konsentrasi nitrat dan fosfat terhadap produksi biomassa Nannochloropsis sp. K4 yang
maksimal. Data pengujian produksi biomassa Nannochloropsis sp. dengan kombinasi konsentrasi nitrat
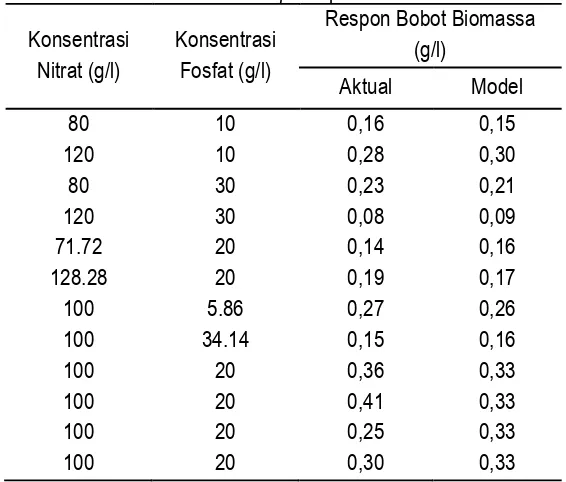
dan fosfat dapat dilihat pada Tabel 3.
Tabel 3. Bobot biomassa Nannochloropsis sp. aktual, dan bobot biomassa Nannochloropsis sp. model
Konsentrasi Nitrat (g/l)
Konsentrasi Fosfat (g/l)
Respon Bobot Biomassa (g/l)
Aktual Model
80 10 0,16 0,15
120 10 0,28 0,30
80 30 0,23 0,21
120 30 0,08 0,09
71.72 20 0,14 0,16
128.28 20 0,19 0,17
100 5.86 0,27 0,26
100 34.14 0,15 0,16
100 20 0,36 0,33
100 20 0,41 0,33
100 20 0,25 0,33
100 20 0,30 0,33
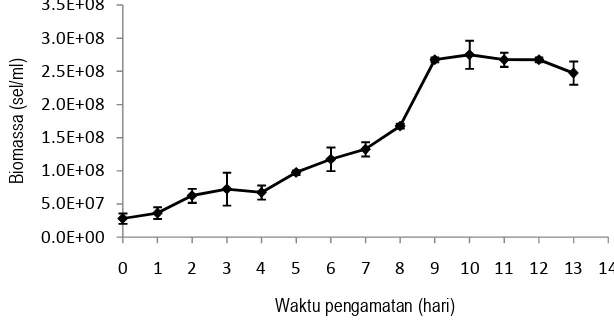
Hasil optimasi produksi biomassa Nannochloropsis sp. dengan menggunakan RSM diperoleh
model persamaan Y= -2,5983 + 0,0483 X1 + 0,5040 X2– 0,0002 X12– 0,0003X1.X2-0,0006 X22, dimana Y
adalah biomassa Nannochloropsis sp. K4, X1 adalah konsentrasi NaNO3 dan X2 adalah konsentrasi
15,77% dipengaruhi oleh variabel
dapat berupa faktor-faktor lingkungan
2012).
Berdasarkan persamaan model
104,12 g/l dan fosfat 15,72 g/l dengan
surfacedan counter plotproduksi biomassa
3. Berdasarkan bentuk kontur yan
[image:8.595.173.426.266.467.2]maksimum
Gambar 2. Grafik respon permukaan produksi biomass
60 0 5 10 15 20 25 30 35 40 F os fa t ( g/ L)
Gambar 3. Grafik
variabel lain yang tidak diperlakukan dalam penelitian ini.
lingkungan seperti salinitas, suhu, pH dan intensitas cahaya
model tersebut, diperoleh kondisi optimum dari variabel
dengan hasil produksi biomassa optimum sebesar
produksi biomassa Nannochloropsis sp. K4 disajikan pada Gambar
kontur yang memusat menunjukkan bahwa titik stasioner merupakan titik
. Grafik respon permukaan produksi biomassa Nannochloropsis
Fitted Surface; Variable: Biomassa (g/L)
0.3 0.2 0.1 0 -0.1 -0.2 -0.3 -0.4 -0.5
60 70 80 90 100 110 120 130 140
Nitrat (g/L)
. Grafik counter plotproduksi biomassa Nannochloropsis
ni. Variabel-variabel lain ini
intensitas cahaya (Olofsson et al.,
dari variabel konsentrasi nitrat
sebesar 0,33 g/l. Grafik respon
pada Gambar 2 dan Gambar
stasioner merupakan titik stasioner
Nannochloropsis sp.
-0.1 -0.2 -0.3 -0.4 -0.5
[image:8.595.187.421.502.694.2]Produksi biomassa optimal Nannochloropsis sp. K4 sebesar 0,33 g/l diperoleh pada kosentrasi
nitrat (104,12 g/l) dan fosfat (15,72 g/l), sedikit berbeda dengan hasil penelitian Bae dan Hur (2011) dan
Widianingsih et al. (2011) yang menyatakan bahwa produksi biomassa optimal Nannochloropsis sp.
dengan konsentrasi nitrat sebesar 100 g/l dan fosfat 20 g/l dapat menghasilkan biomassa Nannochloropsis
sp. sebesar 0,45 - 0,50 g/l. Adanya perbedaan bobot biomassa Nannochloropsissp. yang dihasilkan pada
penelitian ini diduga karena selain faktor nutrisi berupa nitrat dan fosfat, juga terdapat faktor-faktor lain
yang berpengaruh terhadap produksi biomassa Nannochloropsissp. itu sendiri, seperti suhu (Crowe et al.,
2012), salinitas (Hu dan Gao, 2006; Adenan, 2013), pH (Banerjee et al.,2011), cahaya (Fabregas et al.,
2004), dan CO2(Chiu et al.,2009). Validasi model
Berdasarkan hasil proses validasi yang dilakukan dengan uji t diperoleh nilai t-test sebesar 0,004
dengan nilai p>0,05. Hal ini menunjukkan bahwa, tidak ada perbedaan yang nyata antara bobot biomassa
Nannochloropsis sp. secara aktual dengan prediksi bobot biomassa Nannochloropsis sp. yang dhasilkan
dari persamaan model optimum pada kultivasi volume kultivasi 1 liter (Tabel 3). Pada validasi
menggunakan sistem produksi dengan volume kultivasi yang lebih besar yaitu 25 liter, diperoleh bobot
biomassa Nannochloropsis sp. secara aktual sebesar 7,89 ± 0,43 g. dan bobot ini tidak berbeda nyata
dengan respon bobot biomassa Nannochloropsissp. yang dihasilkan dari persamaan model optimum yaitu
sebesar 8,25 g. Dari hasil validasi menunjukkan bahwa model yang dikembangkan dapat mewakili sistem
yang sebenarnya atau kondisi aktual.
Nutrisi Biomassa Nannochloropsis sp. K4
Dari hasil analisis proksimat biomassa diperoleh bahwa mikroalga Nannochloropsis sp. K4
mempunyai kandungan karbohidrat 40,30±0,37 %, protein 39,07±0,08 %, lemak 12,44±0,14 %, abu 4,77±
0,79% dan air 3,41±0,37%. Dari hasil ini menunjukkan bahwa biomassa Nannochloropsis sp. K4
mempunyai kandungan karbohidrat dan protein yang cukup tinggi. Hal ini sejalan dengan pernyataan Hu
dan Gao (2006) dan Widianingsih et al. (2011) yang menyatakan bahwa, adanya penambahan konsentrasi
nitrat dan fosfat pada media tumbuh mikroalga akan dapat meningkatkan kandungan protein dan
karbohidrat yang dihasilkan. Selain itu, jenis media dengan komposisi nutrisi yang berbeda juga akan
berpengaruh terhadap perubahan kandungan nutrisi dari biomassa mikroalga. Torres et al., 2012
melaporkan bahwa Nannochloropsis oculata yang dikutivasi pada media Guillard F/2 dengan konsentrasi
nitrat 20,2%, fosfat 5,0% dan silika 21,9% mengandung karbohidrat 18.85±1.31%, protein 20.89±1.54%,
konsentrasi nitrat 11,0%, fosfat 48,0% dan silika 22,7% menghasilkan karbohidrat 24.51±1.07%, protein
20.61±1.44%, lipid 24.84±1.08% dan abu 26.9±2.21%.
Adanya perbedaan kandungan nutrisi mikroalga Nannochloropsis sp. diduga karena adanya
perbedaan dalam nutrisi jenis dan spesias dari mikroalga (Olofsson et al., 2012). Selain faktor nutrisi,
faktor-faktor lingkungan seperti salinitas, pH, intensitas cahaya dan suhu akan memberikan pengaruh
terhadap karakteristik nutrisi mikroalga (Khatoon et al.,2010; Hemaiswarya et al., 2011).
KESIMPULAN
Produksi biomassa Nannochloropsis sp yang maksimal sebesar 0,33 g/l, dihasilkan pada
konsentrasi nitrat 104,12 g/l dan fosfat sebesar 15,72 g/l. Nannochloropsis sp. K4 memiliki potensi
kandungan karbohidrat (40,30 %), protein (39,07 %), dan lemak (12,44 %) yang cukup tinggi.
UCAPAN TERIMA KASIH
Peneliti berterimakasih atas dana penelitian PNBP Hibah Bersaing universitas Udayana 2012 dan
semua pihak yang telah membantu kelancaran penelitian ini.
DAFTAR PUSTAKA
Adenan NS, Fatimah MD. Yusoff, Mohamed S. 2013. Effect of Salinity and Temperature on the Growth of Diatoms and Green Algae. J. Fisheries and Aquatic Science (8): 397-404. Doi: 10.3923/jfas.2013.397.404
Alsull M, Wan M, Wan O. 2012. Responses of Tetraselmis sp. And Nannochloropsis sp. Isolated from Penang National Park Coastal Waters, Malaysia, to the Combined Influences of Salinity, Light and Nitrogen Limitation. International Conference on Chemical, Ecology and Environmental Sciences (ICEES'2012) march 17-18, 2012 Bangkok pp:142-145
Andersen RA. 2005. Algal Culturing Techniques. Elsevier Academic Press. America.
AOAC. 1998. Official Methods of Analysis. 15th ed. Vol. 2. Virginia.
Arnata I W, Gunam IBW, Anggreni AAMD. 2010. Eksplorasi Potensi Mikroalga di Pantai Pulau Bali Untuk Produksi Biodiesel. Laporan Penelitian Hibah Unggulan Udayana, Universitas Udayana.
Bae JH, Hur SB. 2011. Development of Economical Fertilizer-Based Media for Mass Culturing of
Nannochloropsis oceanica. Department of Marine Biomaterials and Aquaculture Pukyong National University. Busan-Korea.
Banerjee S, Wei WH, Helena K, Mohamed S, Fatimah MY. 2011. Growth and Proximate Composition of Tropical Marine Chaetoceros calcitrans and Nannochloropsis oculata Cultured Outdoors and Under Aboratory Conditions. J. Biotechnology 10 (8): 1375-1383. Doi: 10.5897/AJB10.1748
Braden, Crowe B, Said A, Shweta A, Peter W,Randy R, Jon VW, Aaron C, John K, Murat K, Kim LO, Michael H. 2012. A Comparison of Nannochloropsis salinaGrowth Performance in Two Outdoor Pond Designs: Conventional Raceways versus the ARID Pond with Superior Temperature Management. J. Chemical Engineering (2012): 1-9. Doi:10.1155/2012/920608
Brown MR. Garland CD, Jeffrey SW, Jameson ID, Leroi JM.1993. The Gross and Amino Acid Compositions of Batch and Semi-Continuous Cultures of Isochrysissp. (clone T.ISO), Pavlova lutheri and Nannochloropsis oculata. J. Applied Phycology 5: 285-296.
Chiu SY, Chien YK, Ming TT, Seow CO, Chiun HC, Chih SL. 2009. Lipid Accumulation and CO2
Utilization of Nannochloropsis oculatain Response to CO2Aeration. J. Bioresource Technology (100):
833–838. Doi:10.1016/j.biortech.2008.06.061
Colquhoun D, Antonio FJ, Tuesday U, Barbara E. 2008. Fish, Fish Oils, n-3 Polyunsaturated Fatty Acids and Cardiovascular Health. Nutrition and Metabolism Committee of the Heart Foundation. Australia.
Fabregas J, Maseda A, Dominguez A, Otero A. 2004. The Cell Composition of Nannochloropsis sp. Changes Under Different Irradiances In Semicontinuous Culture. World J. Microbiol. Biotechnol. 20, 31–35.
Faria GR, Caroline RPS, Paes, Dominique JFA, Castro, Natália AB, Tinoco, Elisabete B, Sergio OL. 2012. Effects of The Availability of CO2 on Growth, Nutrient Uptake, and Chemical Composition of The
Marine Microalgae Chlorella sp. and Nannochloropsis oculata, Two Potentially Useful Strains for Biofuel Production. Journal of Biotechnology 3(5) : 65-75.
Fretes HD, Susanto AB, Budhi P, Leenawaty L. 2012. Karotenoid dari Makroalga dan Mikroalga: Potensi Kesehatan Aplikasi dan Bioteknologi. J. Teknol. Dan Industri Pangan 23 (2) :221-228.
Graham LE, Graham JE, Wilcox LW. 2009. Algae. 2nd ed. Benjamin Cummings (Pearson). San Francisco. P. 720.
Gunawan. 2012. Respon Pertumbuhan Mikroalga (Tetraselmis sp.) Pada Berbagai Intensitas Cahaya. FMIPA Universitas Lambung Mangkurat. Kalimantan Selatan.
Hemaiswarya S, Raja R, Kumar RR, Ganesan V, Anbazhagan C, 2011. Microalgae: A Sustainable Feed Source For Aquaculture. World J. Microbiol. Biotechnol., 27: 1737-1746.
Hu H, Gao K. 2006. Optimization of Growth and Fatty Acid Composition of a Unicellular Marine Picoplankton, Nannochloropsis sp. with Enriched Carbon Sources. Biotechnology Letters. 25(5):421-425. Doi:10.1007/s10529-006-9026-6
Isnanstyo A, Kurniastuti. 1995. Teknik Kultiur Phytoplankton dan Zooplankton. Kansius. Jogjakarta.
Khatoon H, Sanjoy B, Fatimah MY, Mohamed S. 2010. Effects of Salinity on the Growth and Proximate Composition of Selected Tropical Marine Periphytic Diatoms and Cyanobacteria. J. Aquaculture Research 41(9): 1348–1355. Doi: 10.1111/j.1365-2109.2009.02423.x
Kawaroe M, Tri P, Adriani S, Dahlia WS, Dina A. 2009. Laju Pertumbuhan Spesifik Chlorella Sp. dan
Kawaroe M, Prartono T, Sunuddin A, Wulan DS, Augustine D. 2010. Mikroalga : Potensi dan Pemanfaatannya Untuk Produksi Bio Bahan Bakar. IPB Press. Bogor.
Olofsson M, Teresa L, Emmelie N, Jean PB, Victória DP, Pauliina U, Catherine L. 2012. Seasonal Variation of Lipids and Fatty Acids of the Microalgae Nannochloropsis oculata Grown in Outdoor Large-Scale Photobioreactors. J. Energies (5): 1577-1592. Doi:10.3390/en5051577
Pal D, Inna KG, Zvi C, Sammy B. 2011. The Effect Of Light, Salinity, And Nitrogen Availability on Lipid Production by Nannochloropsis sp. J. Appl Microbiol Biotechnol 90:1429–1441.DOI: 10.1007/s00253-011-3170-1
Rebolloso F, Navarro PA., García CF, Ramos MJJ, Guil GJL. 2001. Biomass Nutrient Profiles Of The MicroalgaNannochloropsis. J Agric Food Chem. 49(6):2966-2972.
Renaud S, Parry D. 1994. Microalgae for Use In Tropical Aquaculture, Effect Of Salinity on Growth, Gross Chemical-Composition and Fatty-Acid Composition of 3 Species Of Marine Microalgae. J Appl Phycol 6:347–356.
Rocha JMS, Juan EC, Garcia, Marta HF, Henriques. 2003. Growth Aspects Of The Marine Microalga
Nannochloropsis gaditana. J. Biomolecular Engineering 20: 237-242. Doi:10.1016/S1389-0344(03)00061-3
Sankar, M., Ramasubramanian V. 2012. Biomass Production of Commercial Algae Chlorella vulgaris on Different Culture Media. J. Life Science 1 (1): 56-60.
Sutomo. 2005. Kultur Tiga Jenis Mikroalga (Tetraselmis sp., Chlorella sp. dan Dunaliella gracilis) dan Pengaruh Kepadatan Awal Terhadap Pertumbuhan C. gracilis Di Laboratorium. Oseanologi dan Limnologi Indonesia. 37 : 43-58.
Torres AC, Córdova MLR, Porchas MM, Elías JAL, Cornejo MAP. 2012. Productive Response Of
Nannochloropsis oculata, Cultured In Different Media And Their Efficiency As Food For The Rotifer
Brachionus rotundiformis. J. Experimental Botany 81: 45-50.
Spolaore P, Claire JC, Elie D, Arsène I. 2006. Commercial Applications of Microalgae. J. Bioscience and Bioengineering 101(2): 87–96.
Sudarmadji S, Haryono B, Suhardi. 1984. Prosedur Analisa Untuk Bahan Makanan dan Pertanian. Liberty, Yogyakarta.
Sulistyo J. 2010. Eksplorasi Sumberdaya Mikroba Penghasil Lemak Sel Tunggal Untuk Pengembangan Bioenergi Alternatif Berbasis Biodiesel dan Biometan. Lembaga llmu Pengetahuan Indonesia (LIPI) Cibinong. Bogor.
Widianingsih R. Hartati H, Endrawati E, Yudiati, Iriani VR. 2011. Pengaruh Pengurangan Konsentrasi Nutrien Fosfat dan Nitrat Terhadap Kandungan Lipid Total Nannochloropsis oculata. Jurusan Ilmu Kelautan Universitas Diponegoro. Semarang.