PRODUKSI DAN APLIKASI KITINASE DARI B. licheniformis HSA3-1a
DALAM MENGHIDROLISIS KITIN DARI LIMBAH UDANG DAN
DINDING SEL JAMUR Ganoderma sp.
Hasnah Natsir 1), Abd. Rauf Patong1), Maggy T.Suhartono2) and Ahyar Ahmad1)
1)
Department of Chemistry, Faculty of Mathematics and Natural Sciences, Hasanuddin University, Jl. Perintis Kemerdekaan Km 10 Tamalanrea,
Makassar, South Sulawesi, Indonesia 90245 2)
Departement of Food Technology and Human Nutrition Fateta and Research Center for Biotechnology, Bogor Agricultural University,
Jl. Raya Dramaga, Campus IPB. PO.BOX 220, Bogor 16002, West Java, Indonesia
Email: [email protected]
ABSTRAK
Kitinase merupakan enzim golongan hidrolitik yang dapat menghidrolisis kitin dari berbagai
sumber. Kitinase ini mempunyai aplikasi komersial dalam bidang pertanian dan kesehatan
.
Produksi kitinase dari
B. licheniformis
HSA3-1a dilakukan secara ekstraseluler pada kondisi
optimum, kemudian kitinase tersebut diaplikasikan dalam menghidrolisis kitin dari limbah
udang dan kitin pada jamur
Ganoderma
sp. penyebab penyakit busuk batang pada kelapa
sawit. Hasil penelitian menunjukkan bahwa bakteri
B. licheniformis
HSA3-1a potensial
menghasilkan kitinase yang diproduksi maksimum pada kondisi waktu fermentasi 72 jam,
konsentrasi koloidal kitin 0,5%, suhu 55
oC dengan nilai aktivitas 0,225 U/mL. Kemampuan
kitinase dalam menghidrolisis kitin dari limbah udang ditunjukkan dengan hasil pengujian
aktivitas enzim yang menggunakan substrat kitin dari limbah udang dengan aktivitas 0,48
Unit/mL dan pola tekstur kitin sebelum dan sesudah hidrolisis terlihat berbeda yang dianalisis
dengan menggunakan SEM
(Scanning Electron Microscope).
Kitinase juga dapat
menghidrolisis kitin pada dinding sel jamur
Ganoderma
sp., hal ini ditunjukkan dengan
adanya zona inhibisi disekitar koloni setelah diinkubasi 48 jam sebesar 19
,
5 mm.
Kata kunci: B. licheniformis, Kitinase, Kitin, Ganoderma sp.
PENDAHULUAN
Kitinase
adalah
enzim
yang
dapat
mendegradasi kitin, menjadi oligomer sampai
dimernya. Kitinase dan hasil hidrolisisnya
banyak
dimanfaatkan
dalam
bidang
bioteknologi
pertanian,
kesehatan
dan
lingkungan (Muzzarelli and Peter, 1997; Patil
et. al.,
2000). Mekanisme kerja enzim kitinase
dalam menghidrolisis kitin pada limbah udang
dan jamur patogen, terkait dengan adanya
kitin pada limbah udang dan pada dinding sel
jamur yang dapat dimanfaatkan oleh enzim
tersebut sebagai substratnya (Katatny
et. al.,
2000). Kitin merupakan polimer linier yang
tersusun dari 2.000–3.000 monomer
N-asetil-D-glukosamin
yang
dihubungkan
dengan ikatan
-1,4-glikosida. Sumber
utama kitin adalah limbah hasil laut seperti:
kulit udang, lobster, dan cangkang kepiting,
serta dinding sel jamur dan bakteri (Wang
and Chang,1997 dan Natsir
et.al.
2002).
Penggunaan kitinase telah dilaporkan oleh
beberapa peneliti antara lain: Katatny
dkk.
(2000) menggunakan kitinase dan
1,3-glukanase
dari
Trichoderma
harzianum
sebagai agensia fungisida dalam pengendalian
jamur
Sclerotium rolfsii
secara
in vitro
;
sedangkan Harjono dan Widyastuti (2001)
menggunakan
endo-kitinase
murni
dari
Trichoderma reesei
sebagai fungisida dalam
menghambat perkecambahan spora jamur
patogen
Ganoderma philippii
secara
in-vitro
.
Berdasarkan informasi pada latar belakang,
maka dilakukan produksi kitinase dari
B.
licheniformis
HSA3-1a dan diaplikasikan
dalam hidrolisis kitin pada limbah udang dan
kitin pada dinding sel jamur
Ganoderma
sp.
METODE PENELITIAN
Bahan:
Bakteri
B. licheniformis
HSA3-1a
yang diisolasi dari sumber air panas Sulili
Sulawesi Selatan, kitin dari limbah udang,
NaOH, HCl, N-asetil-D-glukosamin, Na
2CO
3,
K
3[Fe(CN)
6], CuSO
4.5H
2O, Sephadeks
G-75
dan bahan untuk medium.
Produksi Enzim Kitinase
Produksi
kitinase
dilakukan
dengan
menggunakan inokulum aktif 10-15% dari
spora biakan
B. licheniformis
HSA3-1a dengan
komposisi medium: (NH
4)
2SO
40,7%, yeast
ekstrak 0.05%, bakto tripton 0,1%, NaCl 0,1%,
K
2HPO
40,1%, MgSO
4.7H
2O 0,01% dan
koloidal kitin 0,5%, dishaker pada 55
oC, 180
rpm selama 72 jam, Selanjutnya kitinase yang
dihasilkan diuji aktivitas enzim dengan metode
schales
(Natsir
et al.
, 2010), dan uji protein.
Pengukuran Aktivitas Kitinase
Prinsip
pengukuran
aktivitas
kitinase
didasarkan pada jumlah gula pereduksi yang
dihasilkan dari hidrolisis koloidal kitin dan
diukur dengan dengan metode S
chales
modifikasi (Toharisman
et al.,
2005; Natsir
et
al.
,2010). Uji aktivitas enzim menggunakan
substrat koloidal kitin 0,3 % yang diinkubasi
pada 55
oC selama 30 menit. Selanjutnya
campuran enzim,
substrat dan bufer
ditambah reagen S
chales.
Hasil reaksi
diukur pada panjang gelombang 420 nm.
Pengukuran ini menggunakan
N-asetil-D-glukosamin sebagai larutan standar.
Satu
unit aktivitas enzim kitinase didefinisikan
sebagai sejumlah enzim yang menghasilkan
1µmol N
-asetil-D-glukosamin per menit.
Aplikasi kitinase dalam menghidrolisis
kitin limbah udang.
Uji hidrolisis kitin menggunakan sampel: 1)
serbuk kitin dari limbah udang windu 2)
glikol kitin, dan 3) koloidal kitin yaitu
serbuk kitin sigma yang dibuat dalam
bentuk koloid. Sebelum menggunakan kitin
dari limbah udang terlebih dahulu dilakukan
isolasi kitin dari limbah udang secara
kimiawi. Isolasi kitin dari limbah udang
mengikuti metode Bastaman
dkk.
(1998) dan
Natsir,
dkk.
(2007) dengan menggunakan
larutan NaOH 0,5M pada tahap deproteinasi,
dan HCl 1,0 N pada tahap demineralisasi.
Hasil isolasi berupa serbuk kitin digunakan
sebagai substrat dalam uji hidrolisis kitinase
kasar dan murni. Analisis struktur kitin hasil
hidrolisis kitinase menggunakan alat SEM
(Scanning Electron Microscope).
Aplikasi kitinase dalam hidrolisis kitin
pada dinding sel jamur secara in vitro
Uji aktivitas kitinase dalam hidrolisis kitin
ini menggunakan jamur uji
Ganoderma
sp.
Pengujian dilakukan dengan metode difusi
agar yang menggunakan
paper disc
. Biakan
jamur
Ganoderma
sp. telah tumbuh dalam
medium potato dekstrose agar (PDA) selama
1x24 jam, dimasukkan
paper disc
yang
telah diberi kitinase ektrak kasar dan
kitinase murni, kemudian diinkubasi 2-3
hari. Pengamatan zona hidrolisis dilakukan
setiap hari dengan mengukur zona inhibisi
pada biakan jamur uji tersebut. Zona
inhibisi memberikan indikasi aktivitas
hidrolisis kitinase pada dinding sel jamur.
HASIL DAN PEMBAHASAN
Produksi Kitinase
Enzim kitinase dari
B. licheniformis
HSA3-1a
diproduksi maksimum selama 72 jam dalam
medium sintetik minimum (MSM) dengan
kondisi suhu 50
oC dan pH 7,0 yang seiring
dengan pertumbuhan sel mencapai akhir fase
stasioner dengan aktivitas kitinase sebesar
0,225 U/mL (Gambar 1). Hasil penelitian ini
menunjukkan
bahwa
bakteri
tersebut
membutuhkan enzim kitinase sebagai strategi
dalam mempertahan-kan hidupnya. Hasil
tersebut sesuai dengan penelitian Toharisman
et al.
(2005) yang memproduksi kitinase dari
B. licheniformis
MB-2 maksimum pada jam
ke-72 pada kondisi suhu 55
oC, pH 7,0. serta
kitinase dari
Bacillus
MH-1 diproduksi
maksimum pada suhu 58
oC dalam kisaran
waktu 72–96 jam (Sakai
et al.,
1998).
Aplikasi kitinase dalam menghidrolisis kitin
pada limbah udang
Kitinase dapat menghidrolisis kitin menjadi
derivatnya yang banyak dimanfaatkan dalam
bidang seperti: industri bahan obat, kosmetik,
kapsul, dan dapat digunakan dalam bidang
biokimia dan bioteknologi.
Berdasarkan hasil peneitian aplikasi kitinase
ekstrak kasar dan kitinase murni dari bakteri
B.
licheniformis
HSA3-1a
dalam
menghidrolisis kitin dari koloidal kitin, dan
kitin golongan
crustaceae
yaitu limbah
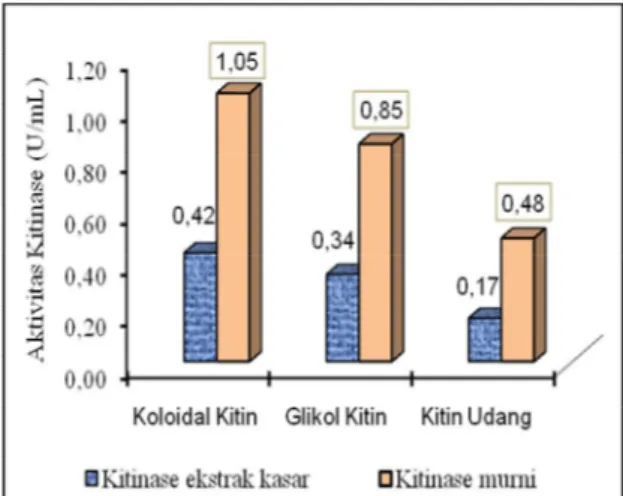
udang windu (Gambar 2). Data hasil
penelitian menunjukkan bahwa kitinase ini
dapat menghidrolisis kitin dari limbah udang
windu dengan aktivitas sebesar 0,48 U/mL.
Hasil analisis SEM menunjukkan bahwa
pola tekstur kitin dari limbah udang sebelum
dan sesudah hidrolisis oleh kitinase terlihat
berbeda. Tekstur kitin sebelum hidrolisis
terlihat utuh dan kompak sedangkan setelah
hidrolisis terlihat mulai terurai dan tidak
kompak (Gambar 3).
Gambar 1. Aktivitas kitinase ekstrak kasar dan kitinase murni dari B. licheniformis HAS3-1a dalam menghidrolisis kitin
Gambar 3. Pola tekstur kitin dari limbah udang: (A) sebelum hidrolisis dan (B) setelah
A
B
Gambar 1. Produksi enzim kitinase dari B. licheniformis HAS3-1a pada kondisi suhu 50oC, pH 7,0 dengan kecepatan aerasi 180 rpm.
Aplikasi kitinase dalam hidrolisis kitin pada
dinding sel jamur secara in vitro
Pengujian
hidrolisis
kitinase
dari
B.
licheniformis
HSA3-1a
terhadap
jamur
patogen tanaman dilakukan secara
in vitro
menggunakan jamur
Ganoderma
sp. yang
diisolasi dari kelapa sawit. Pengujian hidrolisis
ini selanjutnya disebut pengujian bioaktivitas
yang menggunakan kitinase ekstrak kasar dan
kitinase murni sebanyak
40 µL,
kontrol
negatif, dan kontrol positif (fungisida
komersial
yang
bioaktivitasnya
dianggap100%). Hasil pengujian aktivitas
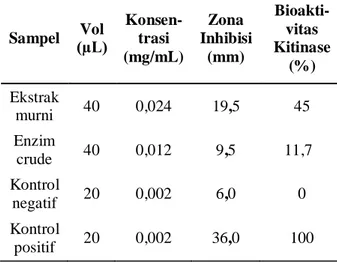
menunjukkan bahwa kitinase murni dengan
konsentrasi enzim 0,024 mg (0,092 unit
aktivitas kitinase) yang memiliki zona inhibisi
19,5 mmbioaktivitasnya
sebesar
45%.
Sedangkan kitinase ekstrak kasar hanya
memiliki zona inhibisi 9,5 mm pada
konsentrasi enzim 0,012 mg bioaktivitasnya
hanya mencapai 11,7%. (Tabel 1). Hal ini
dapat terjadi karena konsentrasi kitinase murni
lebih tinggi yang menyebabkan zona inhibisi
luas daripada enzim ekstrak kasar.
Tabel 1. Bioaktivitas kitinase dari B. licheniformis HSA3-1a terhadap jamur Ganoderma sp. in vitro
Sampel Vol (µL) Konsen-trasi (mg/mL) Zona Inhibisi (mm) Bioakti-vitas Kitinase (%) Ekstrak murni 40 0,024 19,5 45 Enzim crude 40 0,012 9,5 11,7 Kontrol negatif 20 0,002 6,0 0 Kontrol positif 20 0,002 36,0 100
Berdasarkan fenomena bioaktivitas pada
Gambar 4 menunjukkan bahwa kitinase dari
bakteri
termofil
isolat
HSA3-1a
dapat
digunakan sebagai agensia fungisida dalam
penanggulangan jamur patogen kelapa sawit
khususnya
Ganoderma
sp. secara
in vitro.
Secara
teoritis
enzim
kitinase
dapat
digunakan dalam pengendalian hayati jamur
patogen tanaman karena dinding sel jamur
patogen tersebut mengandung kitin yang
merupakan substrat dari enzim kitinase.
Terkait dengan aplikasi kitinase dalam
menghidrolisis kitin pada dinding sel jamur
patogen tanaman yaitu sebagai agensia
fungisida dilaporkan oleh: Katatny
et al
.,
(2000) menggunakan kitinase dari
T.
harzianum
sebagai agen biokontrol dalam
pengendalian hayati jamur patogen tanaman
secara
in vitro,
khususnya pada jamur
Sclerotium rolfsii
, dan Mateos
et al
. (2007)
melakukan
peneliktian
terhadap
T.
harzianum
strain
CECT
2413
dan
menghasilkan kitinase yang menghambat
pertumbuhan jamur
Rhizoctania solani
dan
P. chipthoptora
secara
in vitro.
Kedua
penelitian aplikasi kitinase sebagai agensia
fungisida sebelumnya memperkuat teori
bahwa kitinase dapat digunakan dalam
hidrolisis dinding sel jamur patogen.
Gambar 4.
Uji bioaktivitas kitinase dari
B.
licheniformis
HSA3-1a terhadap
pertum-buhan
Ganoderma
sp. Ket: 1) enzim murni;
2). enzim ekstrak kasar; 3) kontrol negatif
dan 4) kontrol positif.
KESIMPULAN:
Kesimpulan dari penelitian ini adalah kitinase dari B. licheniformis HSA3-1a dapat menghidrolisis kitin dari limbah udang dan kitin pada dinding sel jamur
Ganoderma
sp.
1
4 2 3
UCAPAN TERIMA KASIH
Terima kasih disampaikan kepada Dirjen Dikti atas bantuan Hibah Doktor yang diberikan untuk menyelesaikan penelitian dan penyusunan Disertasi pada Program Studi S3 Ilmu Kimia Universitas Hasanuddin.
REFERENCES
Bastaman, S., Aprianita, N. dan Hendarti. 1998. Penelitian Limbah Udang sebagai Bahan Industri Kitin dan Kitosan. Balai Besar Penelitiaan dan Pengembangan Industri Hasil Pertanian. Jakarta.
Harjono and Widyastuti, S.M. 2001. Antifungal Activity of Purified Endochitinase Produced by Biocontrol Agent Trichoderma reesei Against Ganoderma philippii. Pakistan J. of Biological Sciences. 4 (10): 1232-1234.
Katatny, M.H.EI., W. Somitsch, K.H. Robra, M.S.EI-Katatny and G.M. Gubitz, (2000), Production of Chitinase and 1,3-Glucanase by Trichoderma harzianum for Control of the Phytopathogenic Fungus Sclerotium rolfsii. J. Food Technol. Biotechnol. 38 (3) : 170 – 180.
Mateos, M.M.A., Jarana, J.D., Codon, A.C. and Benitez, T. 2007. pH and Pacl Control Development and Antifungal Activity in Trichoderma harzianum. J. Fungal Genetic and Biology , 44: 1355 – 1367. Muzzarelli, R.A.A. and Peter, M.G. 1997. Chitin
Handbook. European Chitin Society. Atec, Grottamare. Italy. 165–174; 305–311. Natsir, H., Jawahir, B., dan Fitriani. 2007.
Konversi Kitin dari Limbah Udang Apiapi (Metapenaeus monodon) Menjadi Senyawa Kitosan Secara Enzimatis. Jurnal Marina Chemica Acta, Edisi Khusus FK3TI, ISSN: 1411-2132,
Natsir, H., Chandra, D., Rukayadi, Y., Suhartono, M.T., Hwang, J.K. and Pyun, Y.R. 2002. Biochemical Characteristics of Chitinase Enzyme from Bacillus sp. of Kamojang Creater, Indonesian. J. of
Biochem. Molecular Biology and
Biophysics. 6 (4): 279–282.
Natsir, H., Patong, A.R., Suhartono,M.T. and Ahmad, A. 2010. Production and Characterization of Chitinase Enzymes from Hot Spring in South Sulawesi, Bacillus sp. HSA3-1a. Indo. J. of Chem. 10 (2): 256–260.
Rahayu, S., Tanuwijaya, F., Suhartono, M.T., Hwang, J.K. dan Pyun, Y.R. 2004. Study of Thermostable Chitinase Enzymes from Indonesia Bacillus K29-14. J. Microbiol. and Biotech. 4: 647–652.
Sakai, K., Yokota, A., Kurokawa, H., Wakayama, M. and Moriguchi, M. 1998. Purification and Characterization of Three Termostable Endochitinases of a Noble Bacillus sp. Strain, MH-1 Isolated from Chitin-Containing Compost. J. Appl. and Env. Microbiology. 64 (9): 3397–3402. Toharisman, A., Suhartono, M.T., Spindler,
B.M., Hwang, J.K. and Pyun, Y.R. 2005. Purification and Characterization of a Thermostable Chitinase from Bacillus licheniformis MB-2. World J. Microbiol. Biotechnol. 21 (5): 730–738.
Wang, S.L. and Chang, W.T. 1997. Purification and Characterization of Two Bifungsional Chitinases/Lysozymes Extracellularly Produced by Pseudomonas aeruginosa K-187 in a Shrimp and Crab Shell Powder Medium. J. Appl. and Environmental Micro-biology. 63 (2): 380.
Yuli, E.P., Suhartono, M.T., Rukayadi, Y., Hwang, J.K. and Pyun, Y.R. 2004 Characteristic of Thermostable Chitinase Enzymes from the Bacillus sp. J. Enzyme and Microbial Technology.13–26.