KONDISI OPTIMUM UNTUK MEMPRODUKSI N-ASETIL GLUKOSAMIN DARI KITIN JENIS AMORF
DENGAN ENZIM KITINASE DARI Pseudomonas Sp TNH54
Oleh :
NUNIEK HERDYASTUTI, dkk
DISAMPAIKAN PADA :
SEMINAR NASIONAL KIMIA DAN PENDIDIKAN JURUSAN KIMIA – UNIVERSITAS NEGERI SEMARANG
TANGGAL : 10 OKTOBER 2015
KONDISI OPTIMUM UNTUK MEMPRODUKSI N-ASETIL GLUKOSAMIN
DARI KITIN JENIS AMORF DENGAN ENZIM KITINASE DARI Pseudomonas Sp TNH54
Nuniek Herdyastuti, Sari Edi Cahyaningrum dan Pirim Setiarso Jurusan Kimia – FMIPA Universitas Negeri Surabaya
nuniekherdyastuti@unesa.ac.id
Abstrak
Kitin secara kimiawi adalah suatu polimer golongan polisakarida yang tersusun atas 2- asetamido-2-deoksi-D-glukosa membentuk ikatan -1,4. Monomer senyawa tersebut yang dikenal dengan N-asetil glukosamin dapat membentuk disakarida yang dikenal dengan kitobiosa. N-Asetil glukosamin merupakan suatu nutrien, metabolit senyawa antara yang diperlukan pada fungsi sel dan merupakan kandidat food supplement, serta pengobatan pada penderita osteoarthritis. Pembentukan N-asetil glukosamin secara enzimatis dipengaruhi oleh beberapa hal seperti konsentrasi substrat, enzim dan waktu inkubasi. Metode yang dapat digunakan untuk menentukan kandungan N-Asetil glukosamin adalah spektrofotometer UV-Vis dan HPLC. Optimasi terhadap konsentrasi substrat menunjukkan bahwa konsentrasi 1,2 % kitin jenis amorf dapat menghasilkan 54,8% N-Asetil glukosamin, konsentrasi enzim kitinase 0,097 U/mL menghasilkan 1,9 % N-Asetil glukosamin serta waktu inkubasi 8 jam merupakan waktu optimal untuk menghasilkan N-Asetil glukosamin
Kata kunci : kitin, kitinase, kondisi optimum, N-Asetil glukosamin
1. Pendahuluan
Kitin merupakan bentuk linier polisakarida yang dibentuk dari ikatan -1,4 residu N-asetil-glukosamin. Dengan demikian kitin secara kimiawi adalah suatu polimer golongan polisakarida yang tersusun atas 2-asetamido-2-deoksi-D-glukosa membentuk fibra yang linier (Majtán, 2007). Rantainya dapat membentuk kristal karena adanya ikatan hidrogen intramolekul dan membentuk mikrofibril yang panjang menghasilkan struktur yang rigid dan stabil (Gooday, 1990). Kitin mempunyai dua bentuk allomorph, tergantung dari sumbernya, yaitu bentuk α dan β yang dapat dibedakan berdasarkan spektroskopi inframerah dan NMR serta difraksi sinar – X. Struktur kitin – α yang menyebabkan kitin tidak larut dalam pelarut, sedangkan kitin-β dapat membentuk swollen di dalam air sehingga dapat larut seperti dalam asam format (Coutiño et al., 2006).
Setiap tahun, sekitar 100 miliar ton kitin diproduksi di alam sehingga dapat membuat kitin sebagai sumber daya biomassa yang cocok untuk memproduksi GlcNAc melalui proses yang didasarkan pada hidrolisis kitin (Chen et al, 2010). GlcNAc dapat
diperoleh dengan cara hidrolisis secara kimia atau degradasi secara enzimatis dengan menggunakan enzim kitinase. Degradasi kitin secara enzimatis telah banyak dilakukan karena merupakan metode yang sederhana, cepat dan reproducible untuk menghasilkan senyawa turunan kitin atau kitin oligosakarida (Krokeide, 2007).
N-Asetil glukosamin merupakan suatu nutrien, metabolit senyawa antara dan diperlukan pada fungsi sel dan merupakan kandidat food supplement, serta pengobatan pada penderita osteoarthritis (Illankovan et al., 2005). Keberadaan N-asetilglukosamin di kelenjar timus tampaknya juga dapat mencegah pembentukan dan pertumbuhan sel-sel abnormal timus (T-sel), yang berkontribusi terhadap gangguan autoimun (Chang and Fu, 2000). Berdasarkan hal tersebut menunjukkan bahwa GlcNAc sangat potensial untuk digunakan dalam industri karena mempunyai banyak aplikasi yang signifikan dan mempunyai efisiensi tinggi.
2. Bahan dan Metode Bahan
Bahan yang digunakan adalah : kitin dari cangkang udang (Rongsheng) yang diproduksi oleh China. Ekstrak kasar enzim yang diperoleh dari bakteri Pseudomonas sp TNH54 dengan menumbuhkan pada media LB yang mengandung kitin. Beberapa bahan kimia seperti : 3,5-dinitro salisiclyc acid (SIGMA), HCl (Merck), Kalium–Natrium tartrat, Sodium dodecyl sulphate (SDS, Merck), N-Asetil glukosamin (SIGMA).
Meteode Persiapan Kitin
Kitin diperoleh dari cangkang udang windu yang telah dikeringkan dan dihaluskan kemudian dilanjutkan dengan proses isolasi yang terdiri dari dua tahap, yaitu deproteinasi dan demineralisasi dengan menggunakan metode dari Acosta, et al (1993). Kitin yang diperoleh selanjutnya dibuat menjadi jenis amorf dengan cara melarutkan 10 g kitin dalam campuran larutan NaOH 40% dan 0,2% SDS (yang sudah didinginkan pada suhu 4C). Larutan di-swell selama 1 jam pada suhu 4C. Matriks slurry kitin disimpan selama 1 malam pada suhu -20C, kemudian dinetralkan dengan HCl 6 N. Selanjutnya difiltrasi, dan dicuci dengan urutan pelarut etanol, air, etanol, dan aseton.
Produksi Enzim kitinase
Koloni tunggal dari isolat TNH54 ditumbuhkan pada 100 mL media screening cair yang mengandung 0,4% kitin pada suhu kamar dengan pengocokan 120 rpm selama
20 jam. Kultur cair kemudian disentrifugasi pada 8000xg selama 15 menit suhu 4C.
Supernatan yang diperoleh merupakan ekstrak kasar kitinase.
Uji N-Asetil glukosamin
2 mL larutan kitin 1,25 % (b/v) dilarutkan dalam 200 mM buffer kalium fosfat diaduk dengan pengaduk magnet dan ditambahkan 0,5 mL larutan enzim. Inkubasi selama 2 jam pada suhu kamar. Setelah 2 jam tempatkan tabung ke dalam air mendidih selama 5 menit dan didinginkan pada suhu kamar. Suspensi disentrifugasi selama 10 menit pada kecepatan 4000 rpm dan supernatan yang diperoleh ditentukan dengan HPLC (HP 1050) pada kolom Waters; menggunakan detector UV 210 nm ; kecepatan 1 mL/mnt
; injeksi 0,1 mL
3. Hasil dan Pembahasan
Modifikasi kitin dengan menggunakan detergen (Sodium Dodecyl Sulphate) menyebabkan penggembungan pada struktur kitin sehingga menyebabkan perubahan pada sifat fisik kitin serbuk. Pada kitin jenis amorf mempunyai jari-jari yang lebih panjang dibandingkan jenis kitin yang lain dan luas area tiga kali lebih besar dibandingkan dengan kitin serbuk. Data tersebut menunjukkan bahwa kitin jenis amorf lebih terbuka dan kemungkinan lebih memudahkan interaksi dengan kitinase sehingga dapat memberikan aktivitas kitinase yang lebih tinggi dibandingkan dengan substrat yang lain (Herdyastuti, 2015).
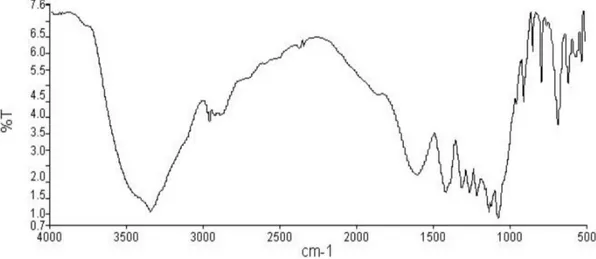
Gambar 1. Hasil FT-IR kitin jenis amorf
Hasil analisis gugus fungsi kitin jenis amorf dengan FT–IR menunjukkan adanya peak yang sangat lebar pada 3348 cm-1 , muncul banyak serapan pada daerah 1072 – 1598 cm-1 dan munculnya puncak yang tajam pada daerah sidik jari yaitu di bawah 700 cm-1 seperti pada Gambar 1.
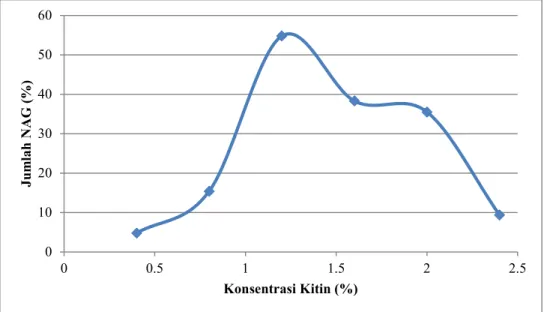
Hasil degradasi kitin jenis amorf secara enzimatis maupun non enzimatis akan menghasilkan senyawa N-Asetil glukosamin. Pembentukan N-asetil glukosamin secara enzimatis dengan menggunakan enzim kitinase dari Pseudomonas sp TNH54 memerlukan optimasi kondisi seperti konsentrasi enzim, konsentrasi substrat dan waktu inkubasi. Hasil optimasi pembentukan N-Asetil glukosamin terhadap konsentrasi substrat menunjukkan bahwa konsentrasi kitin 1,2% dapat menghasilkan N-Asetil glukosamin tertinggi sebesar 55% dan mengalami penurunan dengan konsentrasi kitin (Gambar 2).
Jamialahmadi et al (2011) menyebutkan bahwa substrat kitin koloidal 100 mg/mL dapat menghasilkan N-Asetil glukosamin 21,5 %. Penelitian lain menunjukkan bahwa kitinase dari Trichoderma harzianum dapat mendegradasi kitin dengan konsentrasi 17,5 mg/mL dapat menghasilkan 77% N-Asetil glukosamin (Das et al., 2012). Rameshaiah et al (2014) memperoleh 0,32 g/L N-Asetil glukosamin dengan konsentrasi kitin 15 g/L.
Gambar 2. Pengaruh konsentrasi kitin terhadap jumlah N-asetil glukosamin 0
10 20 30 40 50 60
0 0.5 1 1.5 2 2.5
Jumlah NAG (%)
Konsentrasi Kitin (%)
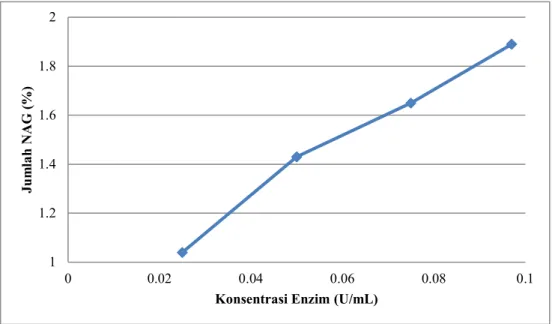
Pembentukan N-Asetil glukosamin juga dipengaruhi oleh konsentrasi enzim kitinase, dimana semakin tinggi konsentrasi enzim kitinase maka N-Asetil glukosamin yang terbentuk juga semakin bertambah (Gambar 3).
Gambar 3. Pengaruh konsentrasi enzim terhadap jumlah N-asetil glukosamin
Das et al (2012) melakukan variasi konsentrasi enzim dari 1 sampai 5 U/mL menunjukkan hasil bahwa konsentrasi enzim 4 – 5 U/mL menghasilkan N-Asetil glukosamin tertinggi sebesar 70%. Jamialahmadi (2011) menyebutkan bahwa variasi konsentrasi enzim antara 4 – 20 U dapat menghasilkan N-Asetil glukosamin hingga 50 % setelah diinkubasi selama 12 jam.
Proses degradasi enzim kitinase terhadap kitin memerlukan waktu yang cukup lama dikarenakan struktur kitin yang rapat dengan ikatan hidrogen yang sangat kuat.
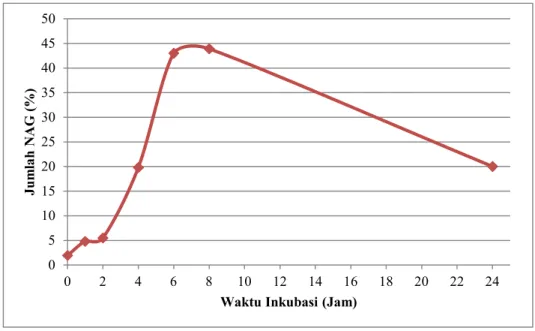
Untuk memperoleh N-Asetil glukosamin yang optimal dilakukan variasi terhadap waktu inkubasi kitin terhadap kitinase selama 1 sampai 24 jam seperti pada Gambar 4. Waktu inkubasi berpengaruh terhadap pembentukan N-Asetil glukosamin dan mengalami peningkatan dari 1 sampai 8 jam, akan tetapi mengalami penurunan setelah melewati waktu inkubasi 8 jam. Pembentukan N-Asetil glukosamin sebanyak 1,3 g/L diperoleh dari substrat kitin setelah diinkubasi dengan kitinase dari Trichoderma harzianum selama 113,17 jam (Rameshaiah et al., 2014). Penelitian lain menyebutkan bahwa produksi N-
1 1.2 1.4 1.6 1.8 2
0 0.02 0.04 0.06 0.08 0.1
Jumlah NAG (%)
Konsentrasi Enzim (U/mL)
Asetil glukosamin dari kitin koloidal dengan enzim kitinase dari Aeromonas sp PTCC 1691 menghasilkan sekitar 40% setelah diinkubasi selama 24 jam (Jamialahmadi, 2011).
Gambar 4. Pengaruh waktu inkubasi terhadap jumlah N-asetil glukosamin
4. Kesimpulan
Berdasarkan hasil yang diperoleh menunjukkan bahwa kondisi optimum dari konsentrasi enzim, substrat dan waktu inkubasi sangat berperan pada pembentukan N- Asetil glukosamin. Akan tetapi kondisi tersebut dipengaruhi oleh aktivitas enzim serta jenis kitin yang digunakan.
Ucapan Terima Kasih
Ucapan terima kasih ditujukan pada DirJen Dikti Kemendikbud yang telah memberikan dana melalui Penelitian Fundamental tahun anggaran 2015.
Daftar Pustaka
Acosta N., Jimenez C, Borau V, and Heras A., 1993. Extraction and characterization of chitin from crustaceans, Biomass. Bioenerg., 5 (2) : 53
Chang K.L.B and FU, W.R., 2000, HPLC analysis of n-acetyl-chito-oligosaccharides during the acid hydrolysis of chitin, Journal of Food and Drug Analysis, 2000.
8(2) : 75-83 0 5 10 15 20 25 30 35 40 45 50
0 2 4 6 8 10 12 14 16 18 20 22 24
Jumlah NAG (%)
Waktu Inkubasi (Jam)
Chen, J.K, Shen,C.R.,Liu, C.L., 2010. N-Acetylglucosamine: Production and applications, Mar. Drugs, 8 : 2493-2516
Coutin˜o, L.R., Marı´a del Carmen, M.C., Huerta, S., Revah, S., Shirai, K., 2006.
Enzymatic hydrolysis of chitin in the production of oligosaccharides using Lecanicillium fungicola chitinases, Process Biochemistry, Vol. 41 : 1106–1110.
Das S., Sen R., and Roy D. 2012. Enzymatic processing of chitinaceous wastes for N- Acetyl-D-glucosamine production : an example of green and efficient environmental management. Eniromental Engineering and management journal Vol. 11(10) : 1848-1855
Gooday, G.W., 1990. Physiology of Microbial Degradation of Chitin and Chitosan, Biodegradation, 1 : 177-190
Herdaystuti, N. Cahyaningrum, S.E., Tamimi M. and Wirawan A., 2015. Modification of chitin as substrates for chitinase, African Journal of Biotechnology, Vol. 14 (18) : 1590-1595
Ilankovan P., Hein S., Chuen-How Ng, Trung T.S., Stevens W.F., 2005. Production of N- acetyl chitobiose from various chitin substrates using commercial enzymes, J.Carb.Poly. available online at www.sciencedirect.com
Jamialahmadi,K., J.Behravan, MF.Najafi, MT.Yazdi, AR. Shahverdi, and MA.Faramarzi, Enzymatic production of N-Acetyl-D-glucosamine from chitin using crude enzyme preparation of Aeromonas sp PTCC1691, 2011. Biotechnology, 10 (3) : 292-297
Krokeide, I.M., Eijsink, V.G.H., and Sørlie, M., 2007. Enzyme assay for chitinase catalyzed hydrolysis of tetra-N-acetylchitotetraose by isothermal titration calorimetry, Thermochimica Acta, Vol. 454 : 144–146
Majt´an J., B´ılikov´a, K., Markoviˇc O., J´an Gr´of, Kogan G., and Sim´uth J., 2007.
Isolation and characterization of chitin from bumblebee (Bombus terrestris), Intern. J. Biol. Macromol., 40 : 237–241
Monreal J. and Reese, E.T., 1969. The Chitinase of Serratia marcescens, Canadian Journal of Microbiology, 15 : 689-696.
Rameshaiah, G. N. and Suneetha Y. K. 2014. Enzymatic Depolymerization of Nano chitin Particles into N-Acetylglucosamine. International Journal of Advanced Engineering and Nano Technology (IJAENT), Volume-2 Issue-1 : 22-28