ELEKTROLIT SENG SULFAT (ZnSO4) 15% DENGAN ELEKTRODA TEMBAGA (Cu) DAN ALUMUNIUM (Al)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Sains ( S.Si. )
Program Studi Fisika
Oleh :
Karolina Neni Widarningsih NIM : 013214001
JURUSAN FISIKA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS SANATA DHARMA
SULFAT (ZnSO4) ELECTROLYTE WITH COPPER (Cu) AND ALUMUNIUM (Al) ELECTRODE
SKRIPSI
Precented as Partial Fulfillment of the Requirements to Obtain the Sarjana Sains Degree
In Physics
By
Karolina Neni Widarningsih NIM : 013214001
PHYSICS STUDY PROGRAM PHYSICS DEPARTMENT
SCIENCE AND TECHNOLOGY FACULTY SANATA DHARMA UNIVERSITY
Aku dibuat lemah, supaya aku dengan rendah hati belajar untuk taat.
Aku meminta kesehatan, supaya aku berbuat perkara-perkara yang besar,
Aku diberi kerentanan, supaya aku berbuat perkara-perkara yang lebih baik.
Aku meminta kekayaan, supaya aku bahagia,
Aku diberi kemiskinan, supaya aku menjadi bijaksana.
Aku meminta kekuasaan, supaya aku dipuji-puji manusia,
Aku diberi kelemahan, supaya aku merasakan kebutuhan akan Tuhan.
Aku meminta segala sesuatu, supaya aku menikmati hidup,
Aku diberi hidup, supaya aku menikmati segala sesuatu.
Aku tidak pernah mendapatkan yang aku minta… Tetapi segala yang kuharapkan, hampir di
samping diriku sendiri, semua doaku yang tak terucap dijawab.
AKU ADALAH, DIANTARA SEMUA MANUSIA YANG DIBERKATI SECARA
MELIMPAH.
ª
Ayahanda Petrus Wigarna & Ibunda Katarina Suarni,
the Greatest
Supporter and a lifetime Motivator
ª
Adikku Yohannes Dadang S.
ª
Keluarga besar Abah Pangger dan Keluarga Besar Robertus roheman
sederhana yang tersusun atas elektrolit seng sulfat (ZnSO4) 15% dengan elektroda
tembaga (Cu) dan Alumunium (Al) dengan menggunakan metode Kohlrausch. Penelitian ini dimaksudkan untuk memperbaiki metode pengukuran tahanan elektrolit secara konvensional, untuk itu diawali dengan penelitian pendahuluan untuk mengetahui watak akumulator, dengan menggunakan dua akumulator sederhana. Akumulator sederhana yang pertama tersusun atas elektrolit seng sulfat (ZnSO4) 15% dengan elektroda tembaga
(Cu) dan alumunium (Al). Akumulator sederhana yang lainnya tersusun atas elektrolit seng sulfat (ZnSO4) 15% dengan elektroda seng (Zn) dan tembaga (Cu). Dari penelitian
pendahuluan diketahui bahwa efek polarisasi menyebabkan naiknya nilai tahanan terhadap waktu.
Dari penelitian pengukuran tahanan dengan menggunakan metode Kohlrausch didapatkan nilai tahanan dalam akumulator sederhana sebesar (3.40±0.40)ohm.
Kata kunci : akumulator sederhana, elektrolit seng sulfat (ZnSO4), elektroda tembaga
accumulator which consist of 15% zink sulfat (ZnSO4) electrolyte with copper (Cu) and
alumunium electrode (Al) using Kohlrausch method. The purpose of this research is to fix conventional measure method of electrolyte’s resistance which started with a pre-experiment to determine accumulator’s characteristic, by using two simple accumulators. One of the simple accumulator consist of 15% zink sulfat (ZnSO4) electrolyte with
copper (Cu) and alumunium (Al) electrode. The other simple accumulator consist of 15% zink sulfat (ZnSO4) electrolyte with zink (Zn) and copper (Cu) electrode. The
pre-experiment indicates that polaritation effect caused the increasing of resistance toward time.
From the research of measuring internal resistance with Kohlrausch method obtains an internal resistance of (3.40±0.40) ohm.
Key words : simple accumulator, zink sulfat (ZnSO4) electrolyte, copper (Cu) electrode,
Segala hormat dan pujian terlantun ke hadirat Tuhan Yang Maha Esa, Pencipta penulis yang senantiasa mencintai dan melindungi penulis, atas berkat dan karunia yang dilimpahkan-Nya sehingga penulis bisa menyelesaikan skripsi ini.
Skripsi dengan judul “Pemanfaatan Metode Kohlrausch Untuk Pengukuran Tahanan Dalam Akumulator Sederhana Yang Tersusun Atas Elektrolit Seng Sulfat
(ZnSO4) 15% Dengan Elektroda Tembaga (Cu) Dan Alumunium (Al)” ditujukan untuk memenuhi salah satu syarat mendapatkan gelar Sarjana Sains (S.Si) pada Fakultas Sains dan Teknologi di Universitas Sanata Dharma Jogjakarta.
Tak ada gading yang tak retak, penulis menyadari skripsi ini jauh dari sempurna, oleh karena itu penulis sangat mengharapkan kritik dan saran yang membangun untuk perbaikan karya penulis selanjutnya.
Tanpa kerja keras, kerja sama, dukungan dan semangat dari berbagai pihak, mustahil skripsi ini bisa selesai. Inilah saat hati membungkuk, mengucapkan terima kasih yang tak terhingga, kepada :
1. Ibu Ir. Sri Agustini Sulandari, M.Si. selaku Dosen Pembimbing yang telah banyak membantu dan membimbing selama mengerjakan tugas akhir ini.
2. Romo Ir. Gregorius Heliarko S.J. S.S., BST., M.Sc., M.A. selaku Dekan Fakultas Sains dan Teknologi Universitas Sanata Dharma yang telah meluangkan waktu dan memberikan saran.
3. Bapak Drs. Domi Severinus, M.Si. selaku dosen penguji.
6. Segenap dosen dan selurus staf Jurusan Fisika Fakultas Sains dan Teknologi USD.
7. Donny Kurniawan, S.Farm., Apt., “editor handal”, for all the days when you have been there loving, caring, helping, giving and for all the days that have been
brighter, happier and richer.
8. My Best Friends; Putri “Sholehah”, Melati “Melo”, Dianing “Mardian” . You’re coming as a light, yours truly exist as a hope and you’re here as a miracle.
9. Korea 2001 (Ismeth, Yoan, Hero, Enzo, Minto, Aris, Patrik, Dwi, Mela, Nita, Nopex, Ayu) atas kebersamaannya selama ini.
10.Mintin’s Family; Ellen, Mega, Merry, Yoc, Angel, dan para bintang tamu. 11.Semua pihak yang telah banyak membantu yang tidak dapat disebutkan
satu-persatu.
Akhir kata semoga skripsi ini dapat memberikan manfaat bagi yang memerlukannya dan dapat memberikan khasanah ilmu pengatahuan, khususnya di bidang Fisika. Terima kasih.
Yogyakarta, 11 Oktober 2007
HALAMAN JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PERNYATAAN KEASLIAN KARYA ... vi
INTISARI ... vii
ABSTRACT... viii
KATA PENGANTAR ... ix
DAFTAR ISI... xi
DAFTAR GAMBAR ... xiv
DAFTAR TABEL... xv
BAB I PENDAHULUAN 1.1. Latar Belakang Masalah... 1
1.2. Perumusan Masalah... 3
1.3. Batasan Masalah... 3
1.4. Tujuan Penelitian ... 3
1.5. Manfaat Penelitian... 3
BAB II DASAR TEORI 2.1. Dipol Listrik ... 5
2.2. Dielektrik... 7
2.2.1. Polarisasi ... 7
2.2.2. Bahan Dielektrik ... 8
2.3. Sel Elektrokimia ... 10
2.3.1. Sel Elektrolisis ... 11
2.3.2. Elektrolisis Larutan Elektrolit... 11
2.3.3. Stoikiometri Reaksi Elektrolisis ... 13
2.4.1. Prinsip Jembatan Wheatsone ... 18
2.4.2. Kesalahan Pengukuran... 20
2.5. Metode Kohlrausch ... 20
BAB III METODOLOGI PENELITIAN 3.1. Tempat dan Waktu Penelitian ... 23
3.2. Bahan Penelitian... 23
3.3. Alat Penelitian ... 23
3.4. Langkah-Langkah Penelitian………. ... 24
3.4.1. Perlakuan Bahan... 24
3.4.2. Pengambilan Data Untuk Eksperimen Pendahuluan Penentuan Watak Akumulator ... 25
3.4.3. Mengukur Besarnya Nilai Tahanan Akumulator Sederhana Dengan Elektrolit Seng Sulfat (ZnSO4) 15 % Dengan Elektroda Tembaga (Cu) dan Alumunium (Al) Dengan Menggunakan Metode Kohlrausch ... 26
3.5. Metode Analisis Data ... 28
3.5.1. Mencari Watak Akumulator ... 28
3.5.2. Mengukur Besarnya Nilai Tahanan Akumulator Sederhana Dengan Elektrolit Seng Sulfat (ZnSO4) 15 % Dengan Elektroda Tembaga (Cu) dan Alumunium (Al) Dengan Menggunakan Metode Kohlrausch ... 28
BAB IV HASIL DAN PEMBAHASAN 4.1. Data Hasil Penelitian ... 30
4.1.1. Eksperimen Pendahuluan... 30
1. Penentuan Watak Akumulator Dengan Elektroda Yang Tidak Sejenis Dengan Elektrolitnya ... 30
2. Penentuan Watak Akumulator Dengan Elektroda Yang Sejenis Dengan Elektrolitnya ... 31
4.1.2. Eksperimen Pengukuran Tahanan Dalam Akumulator Dengan Metode Kohlrausch ... 33
4.2. Analisis Data ... 34
BAB V KESIMPULAN DAN SARAN
5.1. Kesimpulan... 44
5.2. Saran... 45
DAFTAR PUSTAKA... 46
Gambar 2.1 Dipol listrik ... 5
Gambar 2.2 Kuat medan untuk dipol listrik... 6
Gambar 2.3 Dipol-dipol listriktersebar secara acak dari suatu dielektrik polar tanpa kehadiran medan listrik dari luar... 9
Gambar 2.4 Dalam pengaruh medan listrik luar, dipol-dipol menyearahkan dirinya dengan arah medan listrik ... 10
Gambar 2.5 Ketika suatu dielektrik diletakkan antara keping-keping kapasitor, medan listrik dari kapasitor mempolarisasikan molekul-molekul dielektrik... 10
Gambar 2.6 Rangkaian sederhana yang berisi baterai ideal dengan ggl ξ, resistansi R dan kawat-kawat penghubung yang diasumsikan tidak memiliki resistansi ... 15
Gambar 2.7 Diagram rangkaian untuk Gambar 2.5 ... 16
Gambar 2.8 Jembatan Wheatstone... 18
Gambar 2.9 Jembatan Kohlrausch ... 21
Gambar 3.1 Rangkaian alat untuk penelitian menentukan watak akumulator ... 25
Gambar 4.1 Grafik hubungan Rs (Tahanan standar) dengan AC/CB larutan ZnSO4 pada F=700 Hz... 38
Gambar 4.2 Grafik hubungan Rs (Tahanan standar) dengan AC/CB larutan ZnSO4 pada F=800 Hz... 39
Tabel 4.1 Data hasil penelitian menentukan watak akumulator dengan
elektroda yang tidak sejenis dengan elektrolitnya ... 30 Tabel 4.2 Data hasil penelitian menentukan watak akumulator dengan
elektroda yang sejenis dengan elektrolitnya ... 32 Tabel 4.3 Hubungan antara nilai Rs dengan Nilai AC dan CB pada
frekuensi 700 Hz ... 33 Tabel 4.4 Hubungan antara nilai Rs dengan Nilai AC dan CB pada
frekuensi 800 Hz ... 33 Tabel 4.5 Hubungan antara nilai Rs dengan Nilai AC dan CB pada
frekuensi 900 Hz ... 34 Tabel 4.6 Hasil perhitungan eksperimen penentuan watak akumulator
dengan elektroda yang tidak sejenis dengan elektrolitnya... 35 Tabel 4.7 Hasil perhitungan eksperimen pendahuluan menentukan
watak akumulator dengan elektroda yang sejenis dengan
elektrolitnya ... 36 Tabel 4.8 Hubungan antara nilai Rs dengan nilai AC/CB pada frekuensi
700 Hz ... 38 Tabel 4.9 Hubungan antara nilai Rs dengan nilai AC/CB pada frekuensi
800 Hz ... 39 Tabel 4.10 Hubungan antara nilai Rs dengan nilai AC/CB pada frekuensi
900 Hz ... 40 Tabel 4.11 Nilai tahanan akumulator (Rx) yang diperoleh untuk tiga
BAB I PENDAHULUAN
1.1 Latar Belakang Masalah
Pengukuran adalah suatu kegiatan membandingkan sesuatu dengan suatu besaran yang telah ditentukan. Pengukuran resistansi pada umumnya dapat menggunakan ohmmeter atau dengan menggunakan jembatan Wheatstone. Pengukuran tahanan dalam suatu larutan elektrolit dengan menggunakan ohmmeter nilainya tidak stabil, karena pada saat elektrolit dialiri arus, terjadi elektrolisis dan polarisasi yang mengakibatkan resistansi pada permukaan elektrolit terus meningkat. Kemungkinan pengaruh polarisasi bisa dihilangkan dengan menggunakan elektroda yang berasal dari logam yang sama sebagai ion positif elektrolit. Sebatang logam yang tercelup dalam larutan garamnya akan berhasrat melarutkan ionnya ke dalam larutan garamnya dan sebaliknya larutan garamnya akan berhasrat mengendapkan ion logamnya ke batang logam. Pada keadaan keseimbangan dinamik, maka jumlah ion yang melarut dan jumlah ion yang mengendap per sekon adalah sama (Johannes, 1978). Ketika terjadi elektrolisis dan polarisasi dalam larutan elektrolit dengan elektroda yang sejenis dengan elektrolitnya, maka resistansi elektrolit dapat diketahui dengan menggunakan jembatan Wheatstone (Armitage, 1982), karena resistansinya relatif stabil.
pada saat elektrolit dialiri arus tidak akan terjadi polarisasi. Karena tidak terjadi polarisasi maka, nilaia tahanan dalam larutan elektrolit relatif stabil. Pada dasarnya prinsip metode Kohlrausch sama dengan prinsip metode jembatan Wheatstone. Perbedaannya terletak pada sumber tegangan yang digunakan dan detektor keseimbangan. Pada metode Kohlrausch menggunakan sumber tegangan bolak-balik yang berasal dari AFG dan menggunakan osiloskop atau headphone sebagai detektor keseimbangan, sedangkan pada metode jembatan Wheatstone, menggunakan sumber tegangan searah yang berasal dari catu daya dan menggunakan galvanometer sebagai detektor keseimbangan.
Salah satu komponen listrik yang mengandung larutan elektrolit adalah akumulator. Akumulator adalah alat yang dapat menghasilkan energi listrik dari proses kimia (Anonim, 2006 akumulator). Dalam sebuah akumulator berlangsung proses elektrokimia yang reversible (bolak – balik) dengan efisiensi yang tinggi. Yang dimaksud dengan proses elektrokimia reversible, yaitu di dalam aki saat dipakai berlangsung proses pengubahan energi kimia menjadi energi listrik, sedangkan saat diisi atau dimuati, terjadi proses perubahan energi listrik menjadi energi kimia (Anonim, 2006 elektrokimia).
1.2 Perumusan Masalah
Dalam penelitian ini perumusan masalah ditekankan pada :
1. Bagaimana mengukur tahanan dalam suatu elektrolit pada akumulator dengan menggunakan metode Kohlrausch?
2. Berapakah nilai tahanan dalam dari sebuah akumulator sederhana yang tersusun atas elektrolit seng sulfat (ZnSO4) 15% dengan elektroda tembaga
(Cu) dan alumunium (Al)?
1.3 Pembatasan Masalah
Pengukuran tahanan dalam akumulator sederhana yang tersusun atas elektrolit seng sulfat (ZnSO4) 15% dengan elektroda tembaga (Cu) dan
alumunium (Al) dilakukan dengan menggunakan metode Kohlrausch.
1.4 Tujuan Penelitian
1. Mengetahui cara pengukuran nilai tahanan dalam akumulator sederhana dengan menggunakan metode Kohlrausch.
2. Mendapatkan nilai tahanan dalam akumulator sederhana yang tersusun atas elektrolit seng sulfat (ZnSO4) 15% dengan elektroda tembaga (Cu) dan
alumunium (Al).
1.5 Manfaat Penelitian
2. Memperoleh pengetahuan cara mengetahui nilai tahanan dalam elektrolit dengan menggunakan metode Kohlrausch.
BAB II DASAR TEORI
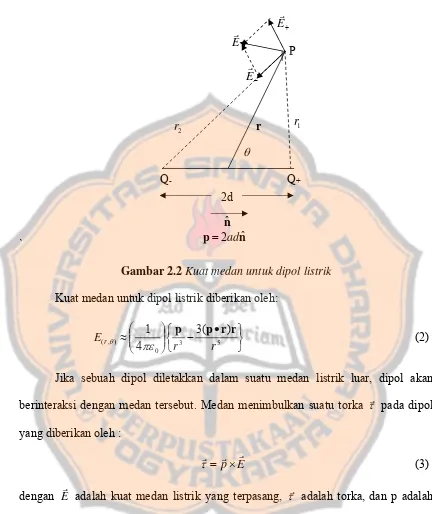
2.1 Dipol Listrik
Sebuah dipol listrik dipikirkan sebagai suatu kesatuan yang tersusun dari dua
muatan yang berlawanan tanda tapi besarnya sama, Q dan –Q.
-Q +Q
d
+
Gambar 2.1 Dipol listrik
Momen dipol listrik didefinisikan sebagai perkalian salah satu muatan dengan
jarak antar kedua muatan tersebut.
p r
(1)
d Q
p r
r =
dengan dradalah vektor jarak dari muatan negatif ( - ) ke muatan positif ( + ).
Sebuah dipol listrik dapat membangkitkan medan listrik, yang dapat dihitung dengan
menerapkan hukum coulomb dalam menentukan kuat medan dua muatan terpisah
`
Gambar 2.2Kuat medan untuk dipol listrik
Kuat medan untuk dipol listrik diberikan oleh:
⎭
Jika sebuah dipol diletakkan dalam suatu medan listrik luar, dipol akan
berinteraksi dengan medan tersebut. Medan menimbulkan suatu torka τr pada dipol
yang diberikan oleh :
E
dengan Er adalah kuat medan listrik yang terpasang, τr adalah torka, dan p adalah
momen dipol (Omar, 1975).
2.2 Dielektrik 2.2.1 Polarisasi
Polarisasi Pr dari bahan didefinisikan sebagai momen dipol per-satuan
volume. Jika jumlah molekul persatuan volume adalah N, dan masing-masing
mempunyai momen pr, maka polarisasi dinyatakan dalam:
p N
Pr = r (4)
dengan anggapan bahwa semua momen molekular mempunyai arah yang sama.
Jika suatu medium terpolarisasi, maka sifat-sifat elektromagnetnya berubah,
yang dinyatakan dalam persamaan :
P E
Dr =εr r+ r (5)
dengan Dr = vektor pergeseran listrik, Er = vektor kuat medan listrik dari luar,
danεr =permitivitas bahan.
Jika diketahui bahwa pergeseran Dr hanya gayut pada sumber luar yang
menghasilkan medan luar dan betul-betul tidak dipengaruhi polarisasi bahan, maka
antara Dr dan Ero berlaku hubungan :
Persamaan (6) disubstitusikan dengan persamaan (5) maka diperoleh:
r
Persamaan (7) menunjukan bahwa efek polarisasi adalah mengurangi kuat medan di
2.2.2 Bahan Dielektrik
Dielektrik adalah bahan-bahan yang molekul-molekulnya mudah terpolarisasi
menjadi dipol-dipol listrik (Soedojo, 1999).
Watak utama bahan dielektrik adalah sifat nonkonduktifnya. Selain itu, sifat
bahan dielektrik yang paling penting dan bermanfaat adalah kemampuannya untuk
menaikkan nilai kapasitansi suatu kapasitor, bila bahan itu ditempatkan di antara
kedua lempeng kapasitor pada suatu beda potensial tertentu. Bahan dielektrik terbagi
menjadi dua, yaitu polar dan non polar. Molekul polar adalah dipol listrik tetap. Oleh
pengaruh medan listrik luar, maka momen dipolnya dapat diarahkan oleh pergeseran
muatan positif dan negatif di dalamnya. Molekul non polar bukan dipol, karena titik
berat muatan - muatan positif yaitu inti - intinya dan titik berat muatan -muatan
negatif, yaitu elektron - elektronnya berimpit, namun oleh medan listrik luar akan
menjadi dipol sementara oleh bergesernya muatan - muatan itu. Jika suatu bahan
dikenakan medan listrik luar akan timbul polarisasi, yaitu pergeseran ion - ion atau
atom - atom pada arah yang berlawanan (Omar, 1975).
Kapasitansi kapasitor semula C0 diberikan oleh C0 =Q V0dan kapasitansi C
dengan kehadiran dielektrik adalah C =Q V , dimana C adalah kapasitansi dalam
farad, Q adalah kuantitas muatan listrik dengan satuan coulomb, dan V adalah
perbedaan potensial dalam volt. Muatan Q adalah sama dalam kedua kasus, dan V
lebih kecil daripada V0, sehingga dapat disimpulkan bahwa kapasitansi C dengan
kehadiran dielektrik adalah lebih besar daripada C0. Bila ruang hampa di antara
pelat-pelat diisi sepenuhnya oleh dielektrik, maka rasio C terhadap C0 (yang sama
0 C
C
K = (8)
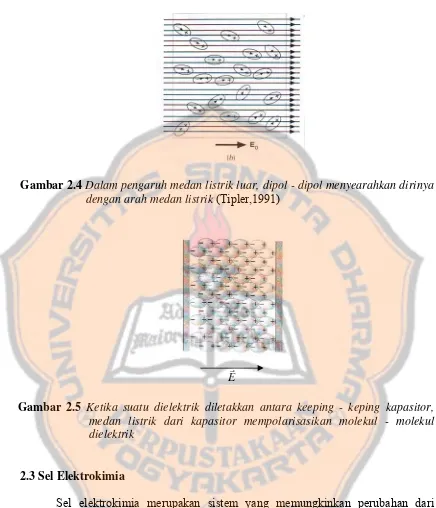
Bila sebuah material dielektrik, misalnya larutan elektrolit disisipkan diantara
elektroda – elektroda sementara muatan dipertahankan konstan, selisih potensial
diantara elektroda – elektroda itu berkurang oleh sebuah faktor K. Maka medan listrik
di antara konduktor – konduktor itu harus berkurang oleh faktor yang sama. Jika Er0
adalah nilai medan listrik di ruang hampa dan Er adalah nilai medan listrik dengan
adanya dielektrik, maka
K E
E 0
r r
= (9)
Karena besarnya medan listrik adalah lebih kecil bila dielektrik itu ada, maka
kerapatan muatan permukaan (yang menyebabkan medan itu) juga akan lebih kecil.
Muatan permukaan pada konduktor tidak berubah, tetapi sebuah induksi yang
tandannya berlawanan muncul pada setiap permukaan larutan elektrolit tersebut.
Momen dipol pada larutan elektrolit pada mulanya netral secara listrik, dan tetap
netral; muatan permukaan timbul sebagai akibat dari pendistribusian kembali muatan
positif dan muatan negatif di dalam material larutan elektrolit tersebut, yakni sebuah
fenomena yang dinamakan polarisasi (Sears & Zemansky, 2001).
Gambar 2.4 Dalam pengaruh medan listrik luar, dipol - dipol menyearahkan dirinya dengan arah medan listrik (Tipler,1991)
Er
Gambar 2.5 Ketika suatu dielektrik diletakkan antara keeping - keping kapasitor, medan listrik dari kapasitor mempolarisasikan molekul - molekul dielektrik
2.3 Sel Elektrokimia
Sel elektrokimia merupakan sistem yang memungkinkan perubahan dari
energi kimia menjadi energi listrik atau dari energi listrik menjadi energi kimia.
Secara umum sel elektrokimia terbagi menjadi sel listrik dan sel elektrolisis
(Johannes, 1978). Sel listrik adalah sel yang dapat menghasilkan arus listrik akibat
reaksi kimia di dalamnya. Sel elektrolisis adalah sel yang bila dialiri arus dapat
2.3.1. Sel Elektrolisis
Bahan atau zat yang larutannya dapat menghantarkan arus listrik disebut
sebagai zat elektrolit. Proses penguraian atau penumpukkan yang terjadi pada
elektroda melalui arus listrik disebut sebagai peristiwa elektrolisis (Musbach, 1996).
Pada elektrolisis, elektroda tempat berlangsungnya reaksi reduksi bertindak
sebagai katoda dan elektroda tempat berlangsungnya reaksi oksidasi bertindak
sebagai anoda. Sumber arus listrik akan mengalirkan elektron ke katoda, selanjutnya
elektron akan ditangkap oleh ion positif (kation) sehingga pada permukaan katoda
terjadi reduksi. Pada saat yang sama, ion negatif (anion) melepaskan elektron,
elektron ini dikembalikan ke sumber arus melalui anoda, akibatnya pada permukaan
anoda terjadi oksidasi (Petruci, 1987).
2.3.2. Elektrolisis Larutan Elektrolit
Larutan elektrolit adalah senyawa heteropolar, yang dibentuk oleh atom –
atom bermuatan atau radikal yang disebut ion – ion. Ion – ion itu di dalam larutan
bebas bergerak hingga terjadi kesetimbangan dengan gaya elektrostatik karena
adanya gaya gesek. Medan listrik menggiring ion – ion positif ke katoda, sedangkan
ion – ion negatif ke anoda. Elektroda dapat menetralisasi ion – ion. Kation
mengambil elektron, sedangkan anion memberikan elektron (Tippler, 1991).
Hantaran listrik melalui larutan elektrolit terjadi sebagai berikut. Sumber arus
searah memberi muatan yang berbeda pada kedua elektroda. Spesi (ion, molekul atau
lainnya melepas elektron ke anoda. Selanjutnya elektron akan dialirkan ke katoda
melalui sumber arus (Denbigh, 1993).
Dalam larutan, molekul ZnSO4 terurai menjadi ion Zn2+ dan ion SO42−
menurut reaksi ionisasi berikut ini :
ZnSO4(aq)→ Zn2+(aq) + SO42−(aq)
Ion-ion Zn2+ akan bergerak menuju katoda, sementara itu ion - ion SO42- bergerak
menuju anoda.
a. Reaksi - reaksi di katoda
Reaksi di katoda tergantung pada jenis kation dalam larutan. Jika kation
berasal dari logam - logam aktif (logam golongan IA, IIA, Al atau Mn), yaitu logam -
logam yang potensial elektrodanya lebih kecil ( lebih negatif daripada air), maka air
yang tereduksi.
b. Reaksi – reaksi di anoda
Elektroda negatif tidak mungkin ikut bereaksi selama elektrolisis karena
logam tidak ada kecenderungan menyerap elektron membentuk ion negatif. Akan
tetapi elektroda positif (anoda) mungkin saja ikut bereaksi, melapas elektron dan
mengalami oksidasi. Elektroda Pt, Au, dan grafit (C) digolongkan sebgai elektroda
inert (sukar bereaksi). Jika anoda terbuat dari elektroda inert, maka reaksi anoda
bergantung pada jenis anion dalam larutan. Anion sisa asam oksidasi seperti SO4
2-mempunyai potensial oksodasi lebih negatif daripada air. Anion - anion seperti itu
sukar dioksidasi sehingga air yang akan teroksidasi.
Jika anion lebih mudah dioksidasi daripada air, maka anion itu akan teroksidasi
(Chang, 2004).
c. Reaksi elektrolisis larutan seng sulfat (ZnSO4) dengan katoda alumunium (Al) dan
anoda tembaga (Cu)
ZnSO4(aq)→ Zn2+(aq) + SO42-(aq)
Zn bukan logam aktif, jadi kation itu akan direduksi. Anion (SO42-) berasal
dari sisa asam oksidasi, maka air akan teroksidasi di anoda, reaksinya :
Pada katoda : Zn2+(aq) + 2e → Zn(s)
Pada anoda : 2H2O(l) → 4H+(aq) + O2(g) + 4e
Reaksi keseluruhan:
2Zn2+(aq) + 2H2O(l)→ 2Zn(s) + 4H+(aq) + O2(g)
2.3.3. Stoikiometri Reaksi Elektrolisis
Michael Faraday menyatakan bahwa ada hubungan kuantitatif antara jumlah
arus listrik yang dialirkan pada sel elektrolisis dengan jumlah zat yang dihasilkan
pada elektroda. Setelah melakukan eksperimen, Faraday merumuskan beberapa
prinsip perhitungan elektrolisis, yang kini dikenal sebagai hukum Faraday.
Hukum Faraday I : Jumlah zat yang dihasilkan pada suatu elektroda berbading lurus
dengan jumlah arus listrik yang melalui sel elektrolisis
Hukum Faraday II : Jika arus listrik yang besarnya sama dialirkan pada beberapa sel
elektrosis, maka massa zat yang dihasilkan pada elektroda tiap - tiap sel berbanding
Secara kuantitatif kedua hukum Faraday tersebut di atas dapat dirumuskan sebagai
berikut :
1. jumlah zat yang terbentuk pada katoda dan anoda dinyatakan dalam
persamaan berikut :
F
dengan, m adalah massa hasil elektrolisis (gram), e adalah berat ekuivalen, F adalah jumlah listrik (Faraday), i adalah kuat arus (ampere), dan t adalah waktu elektrolisis
(s).
2. Dengan arus listrik yang sama, diperoleh dua zat hasil elektrolisis, dapat
dirumuskan sebagai berikut:
m1 : m2 = e1 : e2
2.3.4. GGL Akumulator
Gaya gerak listrik atau disingkat ggl, mengubah energi kimia, mekanik dan
bentuk energi lainnya menjadi energi listrik. Sumber ggl melakukan kerja pada
muatan yang melewatinya dengan meningkatkan energi potensial muatan. Ketika
muatan ∆Qmengalir melalui sumber ggl ξ, energi potensial dinaikkan sejumlah
ξ
Q
ξ
I
Gambar 2.6 Rangkaian sederhana yang berisi baterai ideal dengan ggl ξ, resistansi R dan kawat - kawat penghubung yang diasumsikan tidak memiliki resistansi (Tippler,1991).
Gambar 2.6 menunjukkan rangkaian sederhana berisi resistansi R yang dihubungkan
dengan sebuah akumulator sederhana. Sumber ggl menjaga potensial konstan yang
sama dengan ξ antara titik a dan b, dengan titik a pada potensial yang cukup tinggi.
Beda potensial antara titik a dan c dan antara titik b dan d diabaikan, karena kawat
penghubung diasumsikan tidak memiliki resistansi, sehingga beda potensial antara
titik c dan d sama dengan nilai ggl ξ dan arusnya adalah I =ξ R. Arah arus dalam
rangkaian ini searah jarum jam, seperti dalam gambar. Ketika muatan mengalir
melalui sumber ggl
Q ∆
ξ, energi potensialnya meningkat sejumlah ∆Qξ, dan akan turun
kembali saat muatan mengalir melalui resistor, karena disini energi potensial diubah
menjadi energi termal. Laju di mana energi disalurkan oleh sumber ggl ξ adalah
daya keluaran :
I t Qξ ξ
= ∆ ∆ =
a
Gambar 2.7 diagram rangkaian untuk Gambar 2.6 (Tippler, 1991).
Pada gambar 2.7, jika arus dalam rangkaian adalah I dengan satuan ampere,
dan radalah tahanan dalam dengan satuan ohm, maka beda potensial antara titik a
dan titik b adalah :
Ir V
Va − b =ξ− (11)
Tegangan jatuh pada resistor R adalah IR dan sama dengan tegangan terminal :
Ir V
V
IR= a− b =ξ− (12)
Pemecahan persamaan untuk arus I, kita peroleh :
ξ
= +Ir
IR (13)
atau
r R I
+
= ξ (14)
Tegangan terminal yang diberikan oleh persamaan (11) lebih kecil daripada
tegangan jepit baterai akibat tegangan jatuh pada resistansi internal baterai (Tippler,
1991).
2.3.5. Energi dan Daya Pada Akumulator
Sewaktu muatan lewat melalui rangkaian akumulator, gaya listrik melakukan
kerja pada muatan tersebut. Kerja total yang dilakukan pada sebuah muatan Qsama
r I R
ξ
dengan hasil kali Qdan selisih beda potensial Vab. Bila Vab adalah positif, gaya listrik
melakukan sebuah kerja positif pada muatan itu sewaktu muatan itu berpindah
dari tempat yang beda potensialnya tinggi ke tempat yang beda potensialnya lebih
rendah. Jika arus itu adalah
ab
QV
I dengan satuan ampere, maka dalam selang waktu
sejumlah muatan lewat. Kerja yang dilakukan pada muatan ini
adalah :
dt dQ=Idt dW
Idt V dQ V
dW = ab = ab (15)
Laju perpindahan energi terhadap waktu adalah daya, yang dinyatakan dengan P.
Dengan membagi persamaan diatas dengan , maka akan didapatkan laju pada
rangkaian itu menghantar energi listrik ke elemen akumulator :
dt
I V dt
dW
ab =
=P (16)
Dalam akumulator akan terjadi potensial di titik b lebih tinggi daripada potensial di
titik a; maka Vab adalah negatif. Pada kondisi ini terjadi perpindahan energi dari
elemen akumulator ke rangkaian luar. Elemen ini kemudian bertindak sebagai
sumber, yang menghantarkan energi listrik ke dalam rangkaian tempat sumber itu
disambungkan. Situasi ini untuk mengkonversi energi kimia menjadi energi listrik
dan menghantarkannya ke rangkaian luar (Sears dan Zemansky, 2001).
2.4 Jembatan Wheatstone
Jembatan Wheatstone merupakan alat atau rangkaian yang dapat digunakan
Kegunaan jembatan Wheatstone dalam aplikasi pengukuran dan alat ukur
diantaranya adalah (Wahyunggoro, 1998):
1. Pengukuran resistansi medium (besarnya antara 1 Ω dan 100 k Ω)
2. Pengukuran resistansi tinggi (besarnya 100 k Ω atau lebih)
3. Pengukuran resistansi dinamis
4. Pengukuran induktansi
5. Pengukuran kapasitansi
2.4.1. Prinsip Jembatan Wheatstone
Rangkaian listrik yang terdiri dari empat tahanan, sumber tegangan, yang
dihubungkan melalui dua titik diagonal, dan pada kedua titik diagonal yang lain
ditempatkan galvanometer, seperti yang diperlihatkan pada gambar 2.8 disebut
jembatan Wheatstone (Sapiie dan Nishino, 1994).
Vab
Gambar 2.8 Jembatan Wheatstone (Sapiie dan Nishino, 1994)
R3 G
c
R1 R2
a b
Rx K2
d
Rh
Misalkan bahwa K1 tetap tertutup dan K2 terbuka. Tegangan - tegangan
melalui terminal a-b pada saat ini disebut Vab, maka tegangan melalui c-b dan
tegangan melalui d-b masing-masing, dapat dinyatakan sebagai berikut :
ab
Dengan mengatur R2, dapat diperoleh Vcb = Vdb. Bila hal ini terpenuhi, maka tidak ada
arus yang mengalir melalui galvanometer, meskipun K2 ditutup. Bila G tidak
memperlihatkan pergeseran meskipun K2 ditutup, maka dikatakan bahwa jembatan
dikatakan seimbang. Bila Vcb =Vdb maka, persamaan (17) dan persamaan (18)
menjadi :
Jadi dalam keadaan seimbang didapatkan persamaan:
2
Pada umumnya cara-cara untuk menyeimbangkan jembatan adalah:
Pertama - tama sirkuit dari sumber energi ditutup. Kemudian sirkuit dari
galvanometer ditutup sesaat, untuk melihat arah ketidakseimbangan dan Q diatur
untuk mengkompensasikannya. Setelah itu, K2 ditutup untuk sesaat. Dengan cara itu
Jadi harga dari tahanan yang tidak diketahui bisa didapatkan dengan
menyeimbangkan jembatan bila rasio dari tahanan R3 R1dan harga dari R1 diketahui.
Cabang R1 dan R3 disebut cabang - cabang rasio dan cabang R2 disebut cabang
pengatur. Harga rasio dari cabang - cabang rasio harus didapatkan seteliti mungkin.
Disamping itu harga tahanan dari cabang pengatur harus diketahui seteliti mungkin.
Rasio-rasio tahanan pada cabang rasio biasanya diambil sebagai pangkat dari
sepuluh, sehingga harga Rx yang akan diukur akan mudah didapatkan dengan
mengukur harga dari R2 dan hasil ukurnya didapatkan hanya dengan mengalikan
dengan rasio kepangkatan dari sepuluh.
2.4.2 Kesalahan Pengukuran
Kesalahan - kesalahan pengukuran dengan menggunakan jembatan Wheatstone
disebabkan oleh (Harini, 2001) :
1. Kesalahan batas dari ketiga tahanan yang diketahui
2. Sensitivitas detektor nol yang tidak cukup
3. Perubahan tahanan lengan - lengan jembatan karena efek pemanasan arus
melalui tahanan - tahanan tersebut.
2.5 Metode Kohlrausch
Metode Kohlrausch merupakan salah satu metode yang digunakan untuk
mengukur resistansi dari sebuah larutan elektrolit. Prinsip dari metode Kohlrausch
sama dengan metode jembatan Wheatstone, perbedaannya hanya pada sumber
menggunakan sumber tegangan searah sedangkan pada metode Kohlrausch
menggunakan sumber tegangan bolak - balik. Metode jembatan Wheatstone
menggunakan galvanometer sebagai indikator nol, sedangkan pada metode
Kohlrausch menggunakan osiloskop sebagai indikator nol (Armitage, 1972).
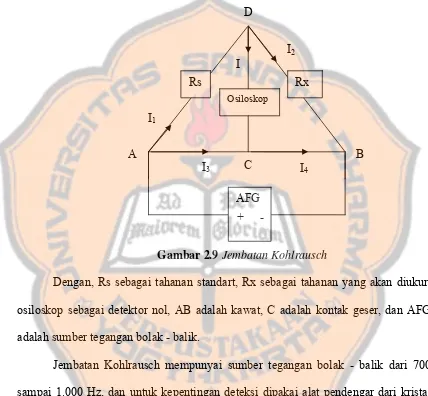
Gambar 2.9 Jembatan Kohlrausch
Dengan, Rs sebagai tahanan standart, Rx sebagai tahanan yang akan diukur,
osiloskop sebagai detektor nol, AB adalah kawat, C adalah kontak geser, dan AFG
adalah sumber tegangan bolak - balik.
Jembatan Kohlrausch mempunyai sumber tegangan bolak - balik dari 700
sampai 1.000 Hz, dan untuk kepentingan deteksi dipakai alat pendengar dari kristal
atau dengan penyambungan ke osiloskop, seperti diperlihatkan dalam gambar 2.8.
Cabang - cabang rasio dari jembatan tersebut dibentuk dengan tahanan geser, dan
diberi skala sedemikian rupa sehingga rasio tahanan dari cabang - cabang tersebut
Osiloskop
Rx Rs
D
AFG
B C
A
+
-I4
I2
I1
I
bisa didapat sebagai
CB
AC dari posisi sikat. Jadi tahanan dari elekrolit didapat
sebagai :
s
x R
CB AC
R = (21)
Rx dapat diubah untuk merubah batas pengukuran. Batas pengukuran berkisar antara
0,05 ohm sampai dengan 10 ohm (Sapiie dan Nishino, 1994) .
Jika sumber GGL berupa sumber tegangan bolak - balik, perbedaan
potensial berubah tanda setiap setengah periode. Jika mempertahankan GGL
pembangkitnya konstan sambil meningkatkan frekuensi, untuk setiap setengah siklus
sejumlah muatan yang sama berpindah ke atau dari kapasitor, tetapi jumlah siklusnya
tiap detik bertambah, sehingga arus melalui kapasitor meningkat sebanding frekuensi.
Jadi, semakin tinggi frekuensi, kapasitor semakin kurang menghambat aliran muatan
(Tippler, 1991).
Bila pengukuran dibuat dengan arus bolak - balik, jumlah muatan yang
mengalir melalui elektroda - elektroda adalah hampir nol, meskipun arus yang
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Fisika Universitas Sanata Dharma Yogyakarta. Penelitian ini dilaksanakan antara bulan Februari - Mei 2007.
3.2Bahan Penelitian
Bahan-bahan yang digunakan adalah larutan : 1. Larutan elektrolit seng sulfat (ZnSO4) 15% .
2. Elektroda tembaga (Cu). 3. Elektroda alumunium (Al). 4. Elektroda seng (Zn).
Ketiga elektroda mempunyai luas yang sama.
3.3 Alat Penelitian
Alat/instrumen yang diunakan dalam penelitian adalah: 1. Satu buah gelas ukur untuk mengukur volume larutan. 2. Satu buah tabung kaca untuk tempat menyimpan larutan. 3. Satu buah AFG sebagai sumber tegangan bolak-balik. 4. Satu set alat ukur jembatan Wheatstone.
6. Resistor dengan nilai 4,7 ohm sebagai tahanan bebas digunakan untuk menentukan nilai tahanan dalam akumulator sederhana dengan elektrolit sengsulfat (ZnSO4) 15% elektroda tembaga (Cu) dan
Alumunium (Al) dengan dialiri arus DC.
7. Power supply sebagai sumber tegangan searah (DC).
8. Papan yang digunakan sebagai alas alat - alat yang telah diset.
9. Ohmmeter digital yang digunakan untuk mengukur nilai tahanan dalam akumulator sederhana dengan elektrolit seng sulfat (ZnSO4)
15% elektroda tembaga (Cu) dan seng (Zn) yang dialiri arus DC. 10.Kabel penghubung yang digunakan sebagai penghubung piranti yang
satu ke yang lain.
3.4Langkah-Langkah Penelitian 3.4.1 Perlakuan Bahan
Langkah - langkah yang dilakukan untuk membuat akumulator sederhana: 1. Mempersiapkan larutan seng sulfat (ZnSO4) 15% sebanyak 40 ml.
2. Memasukan larutan tersebut ke dalam tabung kaca
3.4.2 Pengambilan Data Untuk Eksperimen Pendahuluan Penentuan Watak Akumulator
1. Eksperimen I : Mengukur besarnya nilai tahanan akumulator sederhana dengan elektrolit seng sulfat (ZnSO4) 15% dengan elektroda
tembaga (Cu) dan alumunium (Al) yang dialiri arus DC dengan menggunakan metode ohmmeter.
2. Eksperimen II : Mengukur besarnya nilai tahanan akumulator sederhana dengan elektrolit seng sulfat (ZnSO4) 15% dengan elektroda
tembaga (Cu) dan seng (Zn) yang dialiri arus DC dengan menggunakan metode ohmmeter.
Langkah-langkah untuk pengambilan data: 1. Menyusun alat seperti pada gambar 3.1
A
Gambar 3.1 Rangkaian alat untuk penelitian menentukan watak akumulator
2. Memasang power supply pada tegangan 12 volt.
3. Arus dari catu daya mengalir ke akumulator sederhana melalui anoda, dari katoda di akumulator sederhana arus dialirkan
Catu Daya Amperemeter digital
_ +
Tahanan beban
ZnSO4
-+
(Zn) (Cu) (Cu) (Al)
melalui kawat, sehingga pada amperemeter dapat dilihat nilai arus dari akumulator sederhana. Dari amperemeter arus dialirkan ke tahanan beban kemudian dikembalikan ke catu daya. Tegangan antara katoda dan anoda diukur secara langsung dengan voltmeter digital.
4. Mengukur arus tiap 30 detik dengan menggunakan amperemeter digital
5. Memasukan data yang diperoleh ke dalam tabel :
T(s) I(Hz)
3.4.3 Mengukur Besarnya Nilai Tahanan Dalam Akumulator Sederhana Dengan Elektrolit Seng Sulfat (ZnSO4) 15 % Dengan Elektroda Tembaga (Cu) dan Alumunium (Al) Dengan Metode Kohlrausch.
Susunan peralatan ditunjukkan seperti pada gambar 2.8
B A
AFG
Osiloskop
Rx Rs
C
+
-I4
I2
I1
D
I
Dengan, Rs sebagai tahanan standart, Rx sebagai tahanan yang akan diukur (tahanan dalam akumulator), osiloskop sebagai detektor nol, AB adalah kawat, C adalah kontak geser, dan AFG adalah sumber tegangan bolak - balik.
Pengambilan data dilakukan dengan memvariasikan nilai Rs (tahanan standar) pada tiga nilai frekuensi yang berbeda. Adapun prosedur pengambilan data adalah sebagai berikut:
1. Memasang AFG pada frekuensi 700 Hz.
2. Memvariasikan harga Rs (tahanan standar) secara berturut - turut dari 1 ohm sampai 10 ohm.
3. Menggeser kedudukan C untuk masing - masing nilai Rs sampai mendapatkan keadaan yang seimbang (tegangan pada osiloskop sama dengan nol (0)).
4. Mengukur jarak dari titik A ke titik C (jarak AC) dan jarak dari titik C ke titik B (jarak CB), jika sudah mendapatkan keadaan yang seimbang.
5. Memasukan data yang diperoleh ke dalam tabel.
Rs(ohm) AC(cm) CB(cm)
3.5Metode Analisis Data
3.5.1 Mencari Watak Akumulator
Setelah memperoleh data yang diperlukan, langkah yang harus dilakukan adalah:
a. Menghitung tahanan dalam dari akumulator sederhana tersebut dengan menggunakan persamaan (13):
• Tegangan terminal = IR=ξ−Ir
• Tahanan dalam = R
I
r ⎟−
⎠ ⎞ ⎜ ⎝ ⎛ = ξ
b. Menganalisis hasil perhitungan agar dapat diketahui pengaruh pemakaian elektroda yang tidak sejenis dengan elektrolitnya dan elektroda yang sejenis dengan elektrolitnya.
3.5.2 Mengukur Besarnya Nilai Tahanan Dalam Akumulator Sederhana Dengan Elektrolit Seng Sulfat (ZnSO4) 15% Dengan Elektroda Tembaga (Cu) dan Alumunium (Al) Dengan Metode Kohlrausch
Setelah memperoleh data yang diperlukan, langkah yang harus dilakukan adalah:
a. Mencari rasio antara AC dengan BC
Dari grafik hubungan Rs dengan AC/CB didapatkan
adalah gradien.
Dari nilai gradien bisa dicari nilai Rx.
Langkah selanjutnya adalah mencari ralat untuk nilai Rx
1
dari seluruh data yang diperoleh untuk masing – masing frekuensi, melalui persamaan :
( )
Dalam bentuk persentase :
100%
Dengan x adalah hasil ukur, σm adalah simpangan baku
BAB IV
HASIL DAN PEMBAHASAN
4.1 Data Hasil Eksperimen 4.1.1 Eksperimen Pendahuluan
1. Penentuan watak akumulator dengan elektroda yang tidak sejenis dengan elektrolitnya dengan metode ohmmeter
Elektrolit : 40 ml seng sulfat (ZnSO4) 15%
Elektroda : Tembaga (Cu) dan Alumunium (Al) R = 4,7 Ohm.
V = 12 volt
Dari penelitian ini diperoleh data yang ditampilkan dalam Tabel 4.1.
Tabel 4.1 Data hasil penelitian menentukan watak akumulator dengan elektroda yang tidak sejenis dengan elektrolitnya
T (s) I (Hz) 0.5 3.05
1 3.02 1.5 3
2 2.97 2.5 2.95
3 2.93 3.5 2.91
4 2.89 4.5 2.87
5 2.86 5.5 2.83
6 2.82 6.5 2.8
7 2.79 7.5 2.78
8 2.77 8.5 2.76
9 2.75 9.5 2.74
10.5 2.72 11 2.71 11.5 2.7
12 2.69 12.5 2.68
13 2.68 13.5 2.67
14 2.67 14.5 2.66
2. Penentuan watak akumulator dengan elektroda yang sejenis dengan elektrolitnya dengan metode ohmmeter
Hasil pengukuran dengan menggunakan elektroda yang tidak sejenis dengan elektrolitnya memberikan data penurunan nilai arus, maka dilakukan eksperimen dengan mengganti elektroda menjadi sejenis dengan elektrolitnya agar mendapat nilai arus yang konstan.
Elektrolit : 40 ml seng sulfat (ZnSO4) 15%
Elektroda : Tembaga (Cu) dan seng (Zn) R = 4,7 Ohm.
V = 12 volt
Tabel 4.2 Data hasil penelitian menentukan watak akumulator dengan elektroda yang sejenis dengan elektrolitnya
T (s) I (Hz) 0.5 1.24
1 1.25 1.5 1.25
2 1.26 2.5 1.26
3 1.26 3.5 1.26
4 1.26 4.5 1.26
5 1.26 5.5 1.26
6 1.26 6.5 1.27
7 1.27 7.5 1.27
8 1.28 8.5 1.28
9 1.28 9.5 1.28
10 1.28 10.5 1.29
11 1.29 11.5 1.3
4.1.2 Eksperimen Pengukuran Tahanan Dalam Akumulator Sederhana Dengan Metode Kohlrausch
Elektrolit : 40 ml larutan seng sulfat (ZnSO4) 15%
Elektroda : Tembaga (Cu) dan Alumunium (Al).
Data hasil eksperimen ditampilkan dalam tabel 4.3, 4.4, dan 4.5.
Tabel 4.3Hubungan antara nilai Rs dengan nilai AC dan CB pada frekuensi 700 Hz No Rs(ohm) AC(cm) CB(cm)
1 1 35.3 14.7 2 2 36.3 13.7 3 3 36.7 13.3 4 4 37.5 12.5 5 5 37.8 12.2 6 6 38.2 11.8 7 7 38.9 11.1 8 8 39.5 10.5 9 9 40.1 9.9 10 10 40.5 9.5
Tabel 4.4 Hubungan antara nilai Rs dengan nilai AC dan CB pada frekuensi 800 Hz No Rs(ohm) AC(cm) CB(cm)
Tabel 4.5 Hubungan antara nilai Rs dengan nilai AC dan CB pada frekuensi 900 Hz No Rs(ohm) AC(cm) CB(cm)
1 1 35.6 14.4
4.2 Analisis Data
4.2.1 Menganalisis Watak Akumulator
Menghitung tahanan dalam dari akumulator tersebut dengan menggunakan persamaan (13) :
Contoh perhitungan :
Dengan menggunakan metode perhitungan seperti pada contoh, maka didapatkan nilai keseluruhan yang ditampilkan pada tabel 4.6 dan 4.7.
Tabel 4.6 Hasil perhitungan eksperimen penentuan watak akumulator dengan elektroda yang tidak sejenis dengan elektrolitnya.
T (s) I (A) r (ohm)
Tabel 4.7 Hasil perhitungan eksperimen pendahuluan menentukan watak akumulator dengan elektroda yang sejenis dengan elektrolitnya
T (s) I (A) r(ohm) 0.5 1.24 4.98
1 1.25 4.90 1.5 1.25 4.90
2 1.26 4.82 2.5 1.26 4.82
3 1.26 4.82 3.5 1.26 4.82
4 1.26 4.82 4.5 1.26 4.82
5 1.26 4.82 5.5 1.26 4.82
6 1.26 4.82 6.5 1.27 4.75
7 1.27 4.75 7.5 1.27 4.75
8 1.28 4.68 8.5 1.28 4.68
9 1.28 4.68 9.5 1.28 4.68
10 1.28 4.68 10.5 1.29 4.60
11 1.29 4.60 11.5 1.3 4.53 12 1.3 4.53
4.2.2 Eksperimen Pengukuran Tahanan Dalam Akumulator Sederhana Dengan Menggunakan Metode Kohlrausch
Dari Tabel 4.3, 4.4, dan 4.5 yang telah diperoleh, selanjutnya dicari nilai AC/CB, untuk mencari hubungan antara nilai Rs dengan AC/CB. Dari hubungan antara nilai Rs dengan AC/CB, dengan menggunakan persamaan (21) akan didapatkan gradien yang besarnya sebanding dengan 1/Rx (Rx adalah nilai tahanan dalam akumulator sederhana dengan elektrolit ZnSO4 dan elektroda alumunium (Al)
dan tembaga (Cu)). Ralat untuk
Rx 1
dicari dengan menggunakan persamaan (22).
Setelah mendapatkan ralat untuk nilai
Rx 1
maka dicari ralat untuk nilai Rx dengan
menggunakan persamaan (24). Persentase kesalahan dicari dengan menggunakan persamaan (23).
Tabel 4.8 Hubungan antara nilai Rs dengan nilai AC/CB pada pada larutan elektrolit ZnSO4 15% dengan elektroda tembaga (Cu) dan Alumunium (Al) pada frekuensi 700 Hz
Rs(ohm) AC/CB
Dari persamaan (21), (22), (23), dan (24) maka diperoleh gradien sebesar: ohm dan nilai Rx yang dihasilkan dengan ralatnya adalah
sebesar ( )ohm dengan persentase kesalahan sebesar 1.82%. )
Gambar 4.1. Grafik Hubungan Rs (Tahanan standar) Dengan AC/CB pada larutan
elektrolit ZnSO4 15% dengan elektroda tembaga (Cu) dan Alumunium
(Al) pada frekuensi 700 Hz
0 1 2 3 4 5 6 7 8 9 10 11 12 13
Tabel 4.9 Hubungan antara nilai Rs dengan nilai AC/CB padalarutan elektrolit ZnSO4 15% dengan elektroda tembaga (Cu) dan Alumunium (Al) pada frekuensi 800 Hz
persamaan (21), (22), (23), dan (24) maka diperoleh gradien sebesar ohm dan nilai Rx yang dihasilkan dengan ralatnya adalah sebesar
(4 )ohm dengan persentase kesalahan sebesar 0.3 %. )
Gambar 4.2. Grafik Hubungan Rs (Tahanan standar) Dengan AC/CB pada larutan
elektrolit ZnSO4 15% dengan elektroda tembaga (Cu) dan
Alumunium (Al) pada frekuensi 800 Hz
1 2 3 4 5 6 7 8 9 10 11 12 13
Tabel 4.10 Hubungan antara nilai Rs dengannilai AC/CB pada larutan elektrolit ZnSO4 15% dengan elektroda tembaga (Cu) dan Alumunium (Al) pada frekuensi 900 Hz
Rs(ohm) AC/CB
persamaan (21), (22), (23), dan (24) maka diperoleh gradien sebesar (0 )ohm dan nilai Rx yang dihasilkan dengan ralatnya adalah sebesar (4 )ohm dengan persentase kesalahan sebesar 0.3 %.
04
Gambar 4.3. Grafik Hubungan Rs (Tahanan standar) Dengan AC/CB pada
larutan elektrolit ZnSO4 15% dengan elektroda tembaga (Cu) dan
Alumunium (Al) pada frekuensi 900 Hz
0 1 2 3 4 5 6 7 8 9 10 11 12 13
Secara ringkas nilai Rx untuk tiga frekuensi yang berbeda dapat dilihat pada Tabel 4.11.
Tabel 4.11 Nilai tahanan akumulator (Rx) yang diperoleh untuk tiga frekuensi yang berbeda pada larutan elektrolit ZnSO4 15% dengan elektroda tembaga (Cu) dan Alumunium (Al) pada
Frekuensi (Hz) Rx (ohm) 700 Hz 4.90±0.40 800 Hz 4.80±0.10 900 Hz 4.70±0.20
4.3Pembahasan
Dari hasil perhitungan untuk menentukan watak akumulator, didapat hasil yang menunjukan bahwa untuk akumulator yang elektrodanya tidak sejenis dengan elektrolitnya, dalam penelitian ini dipakai elektrolit seng sulfat (ZnSO4)
Diharapkan dengan mengganti elektroda menjadi sejenis dengan elektrolitnya dapat mengurangi efek polarisasi. Dalam akumulator, ketika larutan dialiri arus larutan tersebut akan terurai menjadi Zn++ dan SO4-. Sumber arus akan
mengalirkan elektron ke katoda, selanjutnya elektron ini ditangkap oleh ion positif (kation) sehingga pada permukaan katoda terjadi reduksi. Pada saat yang sama, ion negatif (anion) melepaskan elektron, elektron ini dikembalikan ke sumber arus melalui anoda, akibatnya pada permukaan anoda terjadi oksidasi. Pada sel ini, ion Zn++ tidak bisa bersatu dengan logam seng (Zn) sehingga polarisasi tidak terjadi. Dari hasil perhitungan menunjukan bahwa nilai tahanan menurun dengan berlalunya waktu, karena adanya kanaikan arus. Kenaikkan arus diduga karena ada salah satu dari logam tersebut melarut. Karena ion dari logamnya melarut, maka konsentrasi larutan akan bertambah, penambahan konsentrasi akan menyebabkan kenaikan arus. Logam yang larut adalah logam lain, ini menunjukkan bahwa seng yang dipakai sebagai elektroda adalah seng yang tidak murni.
Karena efek polarisasi menyebabkan tahanan dalam akumulator meningkat, maka penulis mempertimbangkan metode Kohlrausch dengan harapan bisa mendapatkan nilai tahanan dalam dari akumulator sederhana dengan elektrolit seng sulfat (ZnSO4) 15% dengan elektroda tembaga (Cu) dan
(ZnSO4) 15% dengan elektroda tembaga (Cu) dan alumunium (Al). Larutan
elektrolit dan elektroda diperlakukan sebagai akumulator sederhana, dengan banyaknya larutan 40 ml tiap pengambilan data. Frekuensi yang digunakan adalah 700 Hz, 800 Hz, dan 900 Hz.
Dari gambar 4.8, 4.9, dan 4.10 dapat dilihat bahwa perubahan tahanan standar (Rs) terhadap AC/CB hampir mendekati fungsi linear.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Metode Kohlrausch merupakan metode jembatan menggunakan sumber tegangan bolak – balik dan titik keseimbangan ditentukan dengan alat headphone atau dengan penyambungan ke piring Y osiloskop. Jembatan yang digunakan adalah jembatan Wheatstone. Berdasarkan hasil pengukuran tahanan dengan menggunakan metode Kohlrausch dengan tiga frekuensi yang berbeda maka dapat disimpulkan bahwa:
1. Pada saat akumulator dialiri arus akan terjadi polarisasi yang mengkibatkan meningkatnya tahanan dalam.
2. Ohmmeter tidak efektif digunakan dalam pengukuran tahanan dalam akumulator pada saat akumulator dialiri arus, karena nilai tahanan tidak konstan.
3. Metode Kohlrausch dimaksudkan untuk memperbaiki pengukuran tahanan dalam secara konvensional, karena pengukuran dengan menggunakan metode ini tidak akan terjadi polarisasi.
4. Perubahan frekuensi tidak memberikan pengaruh yang besar terhadap perubahan nilai tahanan elektrolit.
5. Besarnya tahanan larutan elektrolit seng sulfat (ZnSO4) dengan elektroda
5.2 Saran
Saran - saran yang dapat penulis berikan untuk penelitian lebih lanjut yaitu: 1. Untuk larutan elektrolit dapat digunakan larutan yang lain dengan
konsentrasi yang berbeda.
2. Elektroda yang digunakan dapat menggunakan elektroda yang lain.
DAFTAR PUSTAKA
Anonim, 2006, akumulator,
www.polinpdg.ac.id/duelike/faisal_m.pdf+pengertian+akumulator, diakses pada tanggal 19/09/2006.
Anonim, 2006, elektrokimia, http/kimia.st.infoax.com/id/elektrokimia, diakses pada tanggal 19/09/2006.
Armitage, E., 1972, Practical Physics in S1, Wing King Tong Co Ltd, Hongkong. Chang, R., 2004, Kimia Dasar, Edisi Ketiga, Jilid 2, Penerbit Erlangga, Jakarta.
Denbigh, K., 1993, Prinsip-Prinsip Keseimbangan Kimia, Edisi Keempat, Diterjemahkan oleh Siti Soedarini, UI Press, Jakarta.
Giancoli, D.C., 2001, Fisika Jilid 2, Edisi Kelima , Penerbit Erlangga, Jakarta.
Harini, B.W., 2001, Pengukuran Besaran Listrik, Diktat Kuliah, Jurusan Teknik Elektro Fakultas Teknik Universitas Sanata Dharma, Jogjakarta.
Johannes, H., 1978, Listrik dan Magnet, Penerbit Balai Pustaka, Jakarta.
Musbach, M., 1996, Fisika Listrik Magnet dan Optik, Pusat Pembinaan dan Pengembangan Bahasa, Departemen Pendidikan dan Kebudayaan RI, Jakarta.
Omar, M.A., 1975, Elementary Solid State Physics, Addison-Wesley Publishing Company, Reading, Massachusetts, USA.
Petruci, R. H., 1987, Kimia Dasar Prinsip dan Terapan Modern, Edisi Keempat, Jilid 2, Diterjemahkan oleh Suminar Achmadi, Penerbit Erlangga, Jakarta.
Sapiie, S. dan Nishino, O., 1994, Pengukuran dan Alat-Alat Ukur Listrik, Cetakan Kelima, PT. Pradnya Paramita, Jakarta.
Sears dan Zemansky., 2001, Fisika untuk Universitas Jilid II, Penerbit Binacipta, Bandung.
Soedojo, P., 1999, Fisika Dasar, Penerbit Andi, Jogjakarta.
Tippler, P. A.,1991, Fisika Untuk Sains dan Teknik, Edisi 3, Jilid 2, Alih Bahasa Bambang Soegiyono, Penerbit Erlangga, Jakarta.
Elektrolit : 40 ml seng sulfat (ZnSO4) 15%
Elektrolit : 40 ml seng sulfat (ZnSO4) 15%
Elektrolit : 40 ml larutan seng sulfat (ZnSO4) 15%
Elektroda : Tembaga (Cu) dan Alumunium (Al).
Data 1:
R(ohm) AC(cm) CB(cm) AC/CB 1 37.4 12.6 2.968254
R(ohm) AC(cm) CB(cm) AC/CB 1 37.3 12.7 2.937008
R(ohm) AC(cm) CB(cm) AC/CB 1 35.4 14.6 2.424658
R(ohm) AC(cm) CB(cm) AC/CB 1 36 14 2.571429
R(ohm) AC(cm) CB(cm) AC/CB 1 35 15 2.333333
2 33.9 16.1 2.10559
R(ohm) AC(cm) CB(cm) AC/CB 1 32.2 17.8 1.808989
R(ohm) AC(cm) CB(cm) AC/CB 1 34.6 15.4 2.246753 10 38.6 11.4 3.385965
2 36.3 13.7 2.649635
Elektrolit : 40 ml larutan seng sulfat (ZnSO4) 15%
Elektroda : Tembaga (Cu) dan Alumunium (Al).
Data 1:
R(ohm) AC(cm) CB(cm) AC/CB 1 44.8 5.2 8.615385
R(ohm) AC(cm) CB(cm) AC/CB 1 43.5 6.5 6.692308
R(ohm) AC(cm) CB(cm) AC/CB 1 36.1 13.9 2.597122
R(ohm) AC(cm) CB(cm) AC/CB 1 36.1 13.9 2.597122
R(ohm) AC(cm) CB(cm) AC/CB 1 40.3 9.7 4.154639
2 35.2 14.8 2.378378
R(ohm) AC(cm) CB(cm) AC/CB 1 35.2 14.8 2.378378
Elektrolit : 40 ml larutan seng sulfat (ZnSO4) 15%
Elektroda : Tembaga (Cu) dan Alumunium (Al).
Data 1:
R(ohm) AC(cm) CB(cm) AC/CB 1 29 21 1.380952
R(ohm) AC(cm) CB(cm) AC/CB 1 34.7 15.3 2.267974
R(ohm) AC(cm) CB(cm) AC/CB 1 35.9 14.1 2.546099
R(ohm) AC(cm) CB(cm) AC/CB 1 40.5 9.5 4.263158
R(ohm) AC(cm) CB(cm) AC/CB 1 40.6 9.4 4.319149
2 35.1 14.9 2.355705
R(ohm) AC(cm) CB(cm) AC/CB 1 34.9 15.1 2.311258
R(ohm) AC(cm) CB(cm) AC/CB 1 33.6 16.4 2.04878