KIMIA TANAH PERTANIAN
Clay
+
++H2O
Na+ Ca
2+
Dr. Ir. NUNUNG SONDARI, MP Ir. SUPARMAN, MP
ii
Katalog Nasional Dalam Terbitan (KDT)
Nunung MP, Sondari Dr, Ir. Suparman MP, Ir.
KIMIA TANAH PERTANIAN
LPPM UNIVERSITAS WINAYA MUKTI, 2015
I.1. Ilmu Pertanian II. Judul
152 halaman, 48 gambar, 31 tabel, daftar isi
ISBN : 978-602-8160-05-6
Tata letak : Suhendar
Cetakan Pertama
Diterbitkan oleh :
LPPM UNIVERSITAS WINAYA MUKTI
Kampus UNWIM Tanjungsari Kabupaten Sumedang
i
KATA PENGANTAR
Tuntutan untuk membuat buku bagi tenaga pengajar (Dosen) di perguruan tinggi merupakan suatu keharusan untuk mendukung proses pembelajaran realisasi dari Tridharma Perguruan Tinggi. Buku yang dibuat
dengan judul “Kimia Tanah Pertanian “ sebagai hasil terjemahan, kajian
pustaka , kreasi dan pengalaman sendiri yang dituangkan dalam tulisan ini merupakan bagian yang tidak terpisahkan dari keinginan penulis untuk berbagi pengalaman dan kemampuan serta pengetahuan mengenai Ilmu Kimia Tanah.
Semoga karya tulis ini dapat bermanfaat bagi Civitas akademika khususnya mahasiswa jenjang Sarjana dan Pascasarjana di lingkungan UNWIM, umumnya yang memerlukannya dan semoga buku ini menjadi acuan awal bagi berbagai pihak yang memiliki kepentingan di dalamnya untuk lebih mendalami tentang Kimia tanah di bidang Pertanian.
Ucapan terimakasih kepada Tim LPPM Unwim yang telah membantu terwujudnya ISBN melalui Unwim Press. Demikian pula penghargaan tertinggi pada Ir. Suhendar yang telah banyak membantu untuk terwujudnya karya tulis ini, juga anak-anakku tercinta Sinta Gea, Candra dan Sidik terimakasih atas doanya yang selalu memberikan dorongan kuat untuk tercapainya pembuatan buku ini, kepada rekan-rekan dosen di lingkungan Fakultas Pertanian UNWIM yang berkenan untuk mendukung tercapainya karya tulis ini. Semoga Allah SWT melalui buku ini memberikan manfaat ilmu bagi kita semua. Amin.
Bandung, September 2015
ii
3.3.2. Efisiensi pertukaran kation-kation dalam tanah ... 62
3.3.3. Daya Pertukaran Kation... .. 69
3.3.4. Penyebaran Kation ... 70
3.3.5. Komposisi Ion pada Kompleks Pertukaran ... 70
3.3.6. Kation Dapat Dipertukarkan dan Exchange Acidity 73
3.3.7. Contoh Jerapan (Tingkat Adsorpsi) dalam Tanah .... 78
3.3.8. Hubungan Kation Terjerap (Teradsorpsi), Kation Dapat Ditukar, Valensi dan Radius Hidrasi ... 79
3.3.9. Analisis mineral liat dengan difraktometer sinar-X.. 83
3.3.10. Retensi dan Fiksasi Fosfat ... 86
IV. DINAMIKA KESEIMBANGAN KIMIA DI DALAM TANAH ... ... 89
4.1. Karakteristik Sistem Tanah dan Tanaman (Sebagai Fase Padat dalam Tanah) ... 91
4.2. Adsorpsi (Adsorbsi) ... 92
V. PELAPUKAN GEOKIMIA DARI MINERAL DI DALAM TANAH ... 96
5.1. Reaksi Oksidasi... 96
5.2. Reaksi Reduksi ... 96
iii
5.4. Reaksi Hidrasi ... 99
5.5. Reaksi Hidrolisis ... 99
5.6. Pelarutan (Solution) ... 100
VI. REAKSI-REAKSI KIMIA YANG TERJADI DALAM TANAH ... ... 104
6.1. Reaksi Kimia di Dalam Tanah ... 104
6.2. Reaksi-reaksi dari Kelarutan Mineral-mineral Alumina Silikat Hubungannya dengan Keterse- Diaan Hara bagi Tanaman ... 107
6.3. Karakteristik Kimia Tanah yang Dipergunakan Dalam Penentu Kerusakan Tanah/Lahan ... 111
6.3.1. Daya Hantar Listrik (DHL) ... 112
6.3.2. Nilai Redoks (Eh) ... 113
6.3.3. Kedalaman Lapisan Berpirit... 114
6.3.4. Indikator Lain ... 115
VII. BENTUK ION LOGAM TRANSISI DALAM FRAKSI NASIONASI TANAH ... 116
VIII. DISKUSI PENULIS DENGAN Prof.Dr.Ir.H. Sulya Djaka Sutami Dan Prof. Dr. Ir. Hj. Aisyah D. Suyono ... ... 130
iv
DAFTAR TABEL Tabel 1.1 Efisiensi Pupuk pada Tanah Masam sampai
Netral ... ... 8
Tabel 1.2 Sifat Kimia Tanah yang dicampurkan dengan
Fly Ash ... 11
Tabel 1.3 Beberapa Contoh Tanaman yang Toleran terhadap Tingkat Kemasaman Tinggi (pH Rendah).. ... 11
Tabel 1.4 .Kisaran pH yang Sesuai dari Tanaman Pilihan ... 12
Tabel 1.5 Prosentase Kejenuhan Alumunium (Al) dan pH dalam Hubungannya dengan pertumbuhan
Tanaman ... ... 16
Tabel 2.1. Mineral Primer Sebagai Cadangan Unsur
Hara Bagi Tanaman Dalam Tanah ... 24
Tabel 2.2 Proporsi Senyawa Kimiawi (%) Beberapa Mineral
Primer Utama Tanah ... 25
Tabel 2.3 Besarnya KTK dari Berbagai Jenis Mineral Liat ... 28
Tabel 2.4 Mineral-mineral Sekunder (Mineral Liat Silikat
Utama) dalam Tanah ... 29
Tabel 2.5 Mineral Sekunder Utama : Mineral Liat ... 33
Tabel 2.6 Karakteristik Muatan Permukaan Tanah-tanah di Wilayah Tropik ... 34
Tabel 2.7 Definisi kelas mineralogi jenis mineral liat pada
Berbagai Ordo Tanah ... 35
Tabel 2.8 Fraksi Mineral Liat dengan Karakteristiknya ... 36
Tabel 2.9 Beberapa Sifat Podsolik Merah Kuning (Hardjowi- Geno, 1992) ... 38
Tabel 2.10 Reaksi Kesetimbangan Kimia yang Membangun
Stabilitas dengan Alumina Silikat ... 39
v
Tabel 3.2 Kandungan Unsur-unsur pada Asam Humat dan
Fulvat ... 58
Tabel 3.3 Beberapa Gugus Fungsional dari Bahan Organik (BO) 59 Tabel 3.4 Kapasitas Tukar Kation dan pH Beberapa Macam Tanah di North Carolina (Colleman dan Thomas, 1967) ... 67
Tabel 3.5 Kapasitas Tukar Kation Beberapa Tanah Indonesia dengan Tekstur yang Berbeda (Soepardi, 1979) .... 67
Tabel 3.6 KTK Berbagai Jenis Mineral Liat ... 67
Tabel 3.7 Karakteristik Muatan Beberapa Mineral Liat dari Beberapa Tanah di Kenya (Satuan me/100 g liat) . 76 Tabel 3.8 Radius Ion Hidrasi dan Efisiensi Pertukaran Beberapa Ion ... 80
Tabel 3.9 Contoh Nilai peak pada perlakuan yang berbeda ... 84
Tabel 5.1. Sekuen Terminal Akseptor Elektron yang Digunakan Di Lingkungan Tanah Dihubungkan dengan Skala Potensi Redoks pada pH 7 ... 101
Tabel 6.1. Reaksi Kimia dari Hallosit, Analcime, Vermikulit 107
Tabel 6.2. Zeolit-Zeogen ... 108
Tabel 6.3. Evaluasi kerusakan tanah di lahan kering ... 111
Tabel 6.4. Evaluasi kerusakan tanah di lahan basah ... 112
Tabel 7.1. Lima bentuk Cu (tembaga) di dalam Tanah ... 117
vi
DAFTAR GAMBAR
Gambar 1.1. Pengaruh pH tanah terhadap ketersediaan hara
bagi tanaman ... 3
Gambar 1.2. Sumber informasi mineral pembaik tanah. ... 4
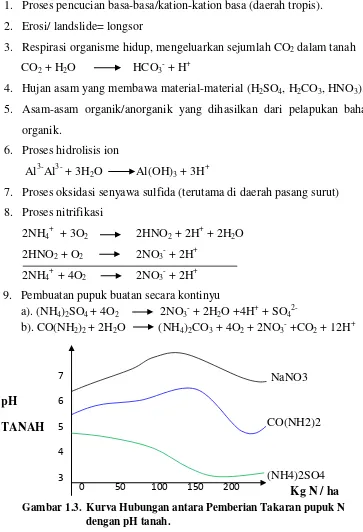
Gambar 1.3. Kurva hubungan antara pemberian takaran pupuk N dengan tanah ... 5
Gambar 1.4. Bahan penyangga dalam tanah dan perubahan pH tanah ... 7
Gambar 1.5 Pengaruh Kapur Pertanian dan Fly Ash ... ... 10
Gambar 2.1. Skema Komponen Penyusun Tanah ... 20
Gambar 2.2. Pembentukan Mineral Sekunder ... 21
Gambar 2.3. Skema Mineral Liat dalam Tanah ... 23
Gambar 2.4. Struktur Kaolinit ... 29
Gambar 2.5. Dinamika Kesetimbangan Kation Teradsorpsi Liat (clay) dan Dalam Larutan Tanah ... 31
Gambar 2.6. Tipe Mineral Liat 1:1 ... 31
Gambar 2.7. Tipe Mineral Liat 2:1 (Montmorilonit) ... 31
Gambar 2.8. Kelarutan macam-macam aluminasilikat yang Tidak tersubtitusi dibandingkan dengan Gibbsite (Al(OH)3 amorf ... 41
Gambar 2.9. Kestabilan dari beberapa Na-Aluminosilikat Dibanding dengan gibbsite, merupakan pengaruh pH dan aktivitas Na ... 43
Gambar 2.10. Kestabilan dari beberapa K-Aluminosilikat Dibanding dengan gibbsite menunjukkan penga- Ruh pH dan aktivitas Na+ ... 44
vii
Gambar 2.12 . Kestabilan beberapa Magnesium Aluminosilikat Dalam kesetimbangan dengan 10-3 M K 10-4
M F dan Fe- tanah pada pe+ pH = 17,0 dengan Pertukaran untuk pH dan Mg2+ sebagai
indikator ... 47
Gambar 2.13. Ringkasan diagram beberapa campuran alumino- Silikat dalam kesetimbangan dengan 10-3 M K+
10-3 M Mg2+ dan Fe tanah dengan pH dan K+
sebagai indikator ... 36
Gambar 2.14. Penyanggaan aktivitas Al3+ oleh Mg-montmori-
lonit, kaolinit dan gibsit sebagai pengaruh pH, Silika, oksida besi dan Mg2+ (Lindsay, 1979) ... 51
Gambar 2.15. Hubungan antara Log (K+)/(H+) dengan Log
(H4SiO4) ... 52
Gambar 3.1. Hubungan Aktivitas Ion dengan Kecepatan
Penjerapan ... 62
Gambar 3.2. Penyebaran muatan dalam keadaan (A) kering Dan (B) lembab (Supartini, 1978) ... 71
Gambar 3.3. Kurva Muatan Bergantung pH ... 75
Gambar 3.4. Adsorpsi ion Na dan Ca oleh mineral Liat ... 80
Gambar 3.5. Model pengaruh dari interlayer Al hidroksi ter- Hadap tukar kation K+ (Huang, 1985) ... 81
Gambar 3.6. Lapisan mengkriting (curling) oleh pertukaran ion Na+ terhidrasi untuk ion K+ dalam
belahan permukaan mineral mika (tipe 2:1) yang terlihat oleh mikroskop elektron (Raman dan Jackson, 1964) ... 82
Gambar 3.7. Komplek lapisan liat silikat yang representatif Dominan Monmorilonit yang Dibentuk oleh
hasil pelapukan Mika ... 83
Gambar 3.8. Pola Difraksi X-ray Magnesium Jenuh, Contoh Liat Terlarut dalam Gliserol dari Tiga Jenis
Tanah ... 84
viii
(Stevenson dan Ardakani, 1982) ... 85
Gambar 3.10. Kurva Jerapan P (Adsorpsi P) ... 87
Gambar 4.1. Dinamika Kesetimbangan Kimia Fase Cair Dalam Tanah (Lindsay, 1979) ... 89
Gambar 4.2. Dinamika Kesetimbangan Fase Padat dalam
Tanah ... 91
Gambar 4.3. Intensitas, Kuantitas dan Sumber-sumber Unsur Hara ... 93
Gambar 4.4. Hubungan antara Intensitas, Kuantitas, dan
Kapasitas Buffer ... 94
Gambar 4.5. Dinamika Kesetimbangan Fosfat dalam Tanah 95
Gambar 5.1. Stabilitas Fe dan Mn dalam Hubungan dengan Eh dan pH (Collins dan Buol, 1970.,Hardjowigeno ,1993) ... 98
Gambar 6.1. Kedudukan Kaolinit, hallosit, gibbsite ... 106
Gambar 6.2. Reaksi Pupuk Fosfat dalam Tanah ... 110
Gambar 7.1. Hubungan antara tiga bentuk keterikatan Cu di dalam tanah ... 116
Gambar 7.2. Skema Keberadaan Cu di Dalam Tanah ... 117
Gambar 7.3. Skema analisis spesifikasi bahan kimia untuk ion Logam unsur mikro didalam aquades ... 119
Gambar 7.4. Faktor-faktor yang mempengaruhi mekanisme Pengambilan logam berat oleh tanaman ... 121
Gambar 7.5. Strategi dalam fitoremediasi ... 122
Gambar 7.6. Mekanisme Uptake Logam Berat pada tekno-
logi Fitoremediasi ... 123
Gambar 7.7. Mekanisme ion logam (M) diserap oleh Tana-
man .. ... 126
ix
Gambar 7.9. Kemungkinan yang terjadi terhadap polutan selama proses fitoremediasi dapat distabilkan, didegradasi pada lingkungan perakaran, teraku- mulasi atau terdegradasi pada jaringan tanaman 127
Gambar 7.10. Peningkatan serapan Pb mempergunakan kelat Sintetik... 127
1
BAB. I
KEMASAMAN DAN KEBASAAN TANAH (pH TANAH)
Mempelajari pH tanah sangat penting dalam bidang pertanian khususnya dan umumnya dalam bidang ilmu-ilmu alam lainnya. Secara umum kemasaman dan kebasaan (pH) tanah dapat menggambarkan beberapa hal penting di bidang pertanian diantaranya dapat menggambarkan ketersediaan unsur-unsur hara (nutrisi) di dalam tanah bagi tanaman, kecocokan untuk hidup mikroorganisme tanah baik yang menguntungkan maupun yang merugikan , kecocokan pertumbuhan tanaman (tanaman pangan, tanaman hias, dan tanaman tahunan), sifat kimia pupuk (pupuk an-organik maupun pupuk an-organik), serta dapat menggambarkan pula keberadaan logam-logam berat di dalam tanah.
pH tanah merupakan singkatan dari Potensial of Hydrogen, pH tanah
disebut pula “reaksi tanah”. Nilai pH menunjukkan banyaknya konsentrasi
ion hidrogen (H+) di dalam tanah. Makin tinggi kadar ion H+ di dalam tanah, semakin masam tanah tersebut. Di dalam tanah selain H+ dan ion-ion lain ditemukan pula ion OH-, yang jumlahnya berbanding terbalik dengan banyaknya H+. Pada tanah-tanah yang masam jumlah ion H+ lebih tinggi dari pada OH-, sedang pada tanah alkalis kandungan OH- lebih banyak daripada H+. Bila kandungan H+ sama dengan OH- maka tanah bereaksi netral (Hardjowigeno, 2003).
Konsentrasi H+ atau OH- di dalam tanah sebenarnya sangat kecil. Sebagai contoh tanah yang bereaksi netral kandungan ion H+ adalah
sebanyak mol per liter atau 10-7 mole per liter. Oleh karena itu,
2
untuk tanah yang bereaksi netral maka :
Nilai pH berkisar antara 0 sampai 14 dengan nilai pH 7 disebut netral sedang pH kurang dari 7 disebut masam dan pH lebih dari 7 disebut alkalis. Besarnya kisaran nilai pH tersebut didasarkan atas besarnya konstanta disosiasi air murni yaitu :
HOH H+ + OH
= 10-14 = K (konstanta)
Walaupun demikian kisaran pH tanah di Indonesia mulai dari pH 3,0 sampai pH 9,0. Di Indonesia tanah-tanah yang ada umumnya bereaksi masam dengan pH 4,0 – 5,5 sehingga tanah dengan pH 6,0 - 6,5 sering dikatakan cukup netral meskipun sebenarnya masih agak masam. Dominannya tanah-tanah bersifat masam di Indonesia seperti ultisol dan oksisol karena sering intensifnya mengalami pencucian unsur-unsur hara dalam profil tanah dengan adanya rata-rata curah hujan yang tinggi.
pH tanah berpengaruh terhadap tingkat ketersediaan unsur-unsur hara di dalam tanah sebagaimana dijelaskan pada Gambar 1.1 di bawah ini. Pada Gambar 1.1 tampak bahwa pada tanah dengan pH netral (6,5 - 7,0) ketersediaan unsur hara makro seperti N, P, K, S, Ca, Mg dan unsur hara mikro seperti Mo (Molibdenum) cukup tersedia (available) bagi tanaman. Sedangkan unsur-unsur hara mikro seperti Fe, Mn, B, Cu dan Zn berlimpah pada kondisi pH tanah masam.
3
4 Carey, Ohio * (419) 396-3501
ASC Mineral Proccesing
Sumber; Kemasaman di Dalam Tanah (Sources of Soil Acidity)
Gambar 1.2. Sumber Informasi Mineral pembaik tanah Berdasarkan sumber dari (http://bioag.byu.edu/aghort/282pres/Acidsoil/s
Id002.htm ) Sumber-sumber kemasaman di dalam tanah berasal dari
beberapa faktor :
1. Adanya pertukaran ion H+ dari akar dengan kation lain (Kapasitas Tukar Kation Akar).
2. Hujan asam yang memberikan kontribusi berlimpah di alam seperti H2SO4, HNO3 dan H2CO3
3. Leaching (Pencucian) unsur-unsur hara seperti terjadi pencucian basa-basa (Ca2+, Mg2 dan K+) yang intensif.
7. Terjadinya oksidasi sulfur (belerang) di alam dengan reaksi : 2SO + 3O2 + 2H2O 2SO42- + 4H+
5
sumber-sumber kemasaman tanah dapat terjadi karena adanya beberapa hal yaitu :
1. Proses pencucian basa-basa/kation-kation basa (daerah tropis). 2. Erosi/ landslide= longsor
3. Respirasi organisme hidup, mengeluarkan sejumlah CO2 dalam tanah CO2 + H2O HCO3- + H+
4. Hujan asam yang membawa material-material (H2SO4, H2CO3, HNO3). 5. Asam-asam organik/anorganik yang dihasilkan dari pelapukan bahan
organik.
6. Proses hidrolisis ion
Al3-Al3- + 3H2O Al(OH)3 + 3H+
7. Proses oksidasi senyawa sulfida (terutama di daerah pasang surut) 8. Proses nitrifikasi
2NH4+ + 3O2 2HNO2 + 2H+ + 2H2O 2HNO2 + O2 2NO3- + 2H+
2NH4+ + 4O2 2NO3- + 2H+ 9. Pembuatan pupuk buatan secara kontinyu
a). (NH4)2SO4 + 4O2 2NO3- + 2H2O +4H+ + SO42-
b). CO(NH2)2 + 2H2O (NH4)2CO3 + 4O2 + 2NO3- +CO2 + 12H+
6
ZA menghasilkan 2 mol H+ per mol NH4+, urea menghasilkan 1 mol H+ per mol NH4+.
10. KTK akar (plant root often exchange H+ for nutrient cation). Bila akar tanaman menyerap unsur hara dalam bentuk kation maka dari akar akan dikeluarkan H+ dalam jumlah setara, bila bentuk anion yang diserap oleh akar, maka akar akan mengeluarkan HCO3- dengan jumlah yang setara pula.
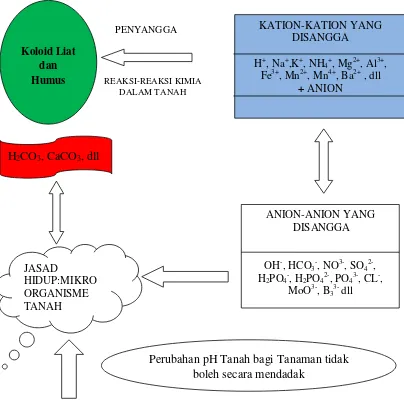
pH di dalam tanah mempengaruhi pertumbuhan tanaman, akan tetapi perubahan pH tanah tidak boleh mengalami perubahan secara mendadak dalam mempengaruhi pertumbuhan tanaman (Gambar 1.4). Akan tetapi pada tanah-tanah yang kaya akan kompleks jerapan seperti humus dan liat serta mikroorganisme maka material itu befungsi sebagai penyangga perubahan pH tanah seperti yang diilustrasikan sebagai berikut :
Penyanga, tidak saja berperan untuk menahan perubahan reaksi tanah, tetapi juga berfungsi menyimpan unsur hara yang dibebaskan dari mineral primer agar tidak mudah hilang (menguap atau tercuci atau presipitasi/pengendapan).
7
Gambar 1.4. Bahan Penyangga dalam Tanah dan Perubahan pH tanah. Koloid Liat
dan Humus
KATION-KATION YANG DISANGGA
H+, Na+,K+, NH
4+, Mg2+, Al3+,
Fe3+, Mn2+, Mn4+, Ba2+ , dll
+ ANION
H2CO3, CaCO3, dll
JASAD
HIDUP:MIKRO ORGANISME TANAH
ANION-ANION YANG DISANGGA
OH-, HCO
3-, NO3-, SO42-,
H2PO4-, H2PO42-, PO43-, CL-,
MoO3-, B
33- dll
Perubahan pH Tanah bagi Tanaman tidak boleh secara mendadak
PENYANGGA
8
Tabel 1.1 Efisiensi Pupuk pada Tanah Masam Sampai Netral
Soil Acidity N P K
Sumber : University of Minnesota – 1985.
Demikian pula budidaya tanaman pangan pada tanah-tanah dengan pH ≤ 5,0 efisiensi pemupukan N, P dan K masih < 55%. Akan tetapi manakala pH meningkat akibat adanya input perbaikan pH tanah sampai batas yang diinginkan sampai netral maka efisiensi pemupukan akan lebih maksimal, karena terjadi pemberian pupuk yang optimum dengan pH tanah yang sesuai. Tanah-tanah potensial masam yang diperuntukan bagi tanaman-tanaman yang toleran tidak dipermasalahkan, akan tetapi pada tanah-tanah kering ber-pH masam dapat dikembangkan tanaman pangan melalui perbaikan dengan input pengapuran.
Kapur pertanian jenis kalsit (CaCO3) dan dolomit (CaMg(CO3)2) dengan takaran yang tepat dari hasil beberapa kajian dapat membuktikan perannya yang menguntungkan bagi tanaman karena kapur pertanian yang dimaksud, selain dapat menetralisir pH masam juga adanya penambahan Ca2+ dan Mg2+ bagi tanaman.
9
A. Penetralan Dengan Kalsit (CaCO3)
1. CaCO3 + H2O +CO2 Ca(HCO3)2
Ca(HCO3)2 Ca2+ + 2HCO
3-2. CaCO3 Ca2+ + CO3
2-CO32- +2HX 2X- + H2CO3-
2X- + Ca2+ CaX2
3. RCOOH RCOO- + H+
RCOO- + H+ + CaO RCOOCa2+ + OH
-4. RCOH RCO- + H+
RCO- + H+ + CaO RCOCa2+ + OH-
B. Penetralan dengan kapur pertanian dolomite (CaMg(CO3)2)
CaMg(CO3)2 Ca2+ + Mg2+ + 2CO32-
CO32- + H2O HCO3- + OH
-HCO- + H+ H2CO3 H2O +CO2
Al3+ +OH- Al(OH)3
C. Pertukara kation
Clay surface - Al3+ + 3Ca2+ - + 2Al3+
D. Reaksi hidrolisis
Al3+ + H
2O Al(OH)2+ + 2H+
E. Presipitasi
Al(OH)2+ + H2PO4- Al(OH)2H2PO4 atau AlPO4.2H2O
Depperindag mengklasifikasikan kapur pertanian/kaptan dikenal sebagai bahan amelioran (pembenah tanah). Saat ini untuk memperbaiki
Ca2+
10
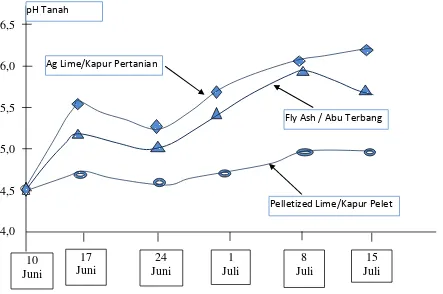
tanah-tanah masam selain kapur pertanian baik yang bersifat tepung maupun pelet, ada suatu bahan yang disebut dengan Fly Ash (abu terbang) yang merupakan limbah dari hasil pembakaran batubara sebagai sumber energi listrik dari PLTU. Pada Gambar 1.2 tampak bahwa Ag Lime (kapur pertanian) dan fly ash sama-sama dapat meningkatkan tanah masam.
Menurut Kumar (2004) dalam Nunung Sondari (2005) pemberian fly
ash (abu sisa bakaran batubara) 10 t ha-1 sampai 20 t ha-1+ pada tanah laterit dapat meningkatkan pH tanah dari pH 4,5 menjadi 5,8 sehingga dapat meningkatkan pertumbuhan dan hasil padi, kapas millet dan gandum.
11
Tabel 1.2. Sifat Kimia Tanah yang dicampurkan dengan Fly Ash
Kriteria
P (ppm) Sangat rendah medium
K (mg/100g) Sangat rendah medium
KTK (me/100g) 12 me/100g 19 me/100g
Sumber : Capp and Eagle, 1987; Kumar, 2004; Nunung Sondari, 2005.
Tabel 1.3. Beberapa Contoh Tanaman yang Toleran terhadap Tingkat Kemasaman Tinggi (pH Rendah).
Kelompok Nama Lokal Nama Ilmiah
Tanaman Pangan Padi Oryza sativa
Palawija Kacang Tanah
Kacang Tunggak Pohon buah-buahan Rambutan
12
Tanaman pagar Petaian
13
Rumput biru Kentucky 5,5-7,5
Klover merah 6,0-7,5
Klover manis 6,5-7,5
Klover putih 5,6-7,0
Jagung 5,5-7,5
Jali 5,0-7,0
Oat (serealia berbiji kecil) 5,0-7,5
14
Bunga mulut singa 6,0-7,5
Bola salju 6,5-7,5
Sweet william 6,0-7,5
Zinnia 5,5-7,5
Tanaman Hutan
Tumbuhan ash putih 6,0-7,5
Aspen 3,8-5,5
Beech 5,0-6,7
Birch eropa (putih) 4,5-6,0
15
16
tanaman pangan seperti kedelai atau legum (kacang-kacangan akan mengalami pertumbuhan yang kerdil dan merana). Akan tetapi pada tingkat kejenuhan tersebut untuk komoditas karet, duren, kopi, manggis, jeruk, rambutan dapat hidup karena toleran pada tanah masam.
Tabel 1.5. Prosentase Kejenuhan Alumunium (Al) dan pH dalam Hubungannya dengan pertumbuhan Tanaman.
No. Tanaman % Kej. Al pH Tanah
1 Karet 60-80 4,5-5,5
2 Kopi, Jeruk, Rambutan 40-60 4,5-5,5
3 Jagung 40 4,5-6,0
4 Pologan 20 5,5
5 Sayuran 20-40 5,0-5,5
6 Hermada
Rumus kejenuhan Al adalah :
KTK efektif = Aldd (ekstrak 1 N KCl) + jumlah basa dapat ditukar (dd) (NH4OAc pH 7,0)
Akan tetapi dari beberapa pendapat menyatakan bahwa pengapuran tanah di daerah tropik sampai mendekati pH netral tidaklah perlu, bahkan dapat meninimbulkan gangguan pada tingkat produksi.
Penghambat tumbuh di tanah masam : a. pH tanah rendah
b. keracunan Al, Mn, Fe c. kekurangan Ca dan Mg
Dengan keracunan Al perkembangan akar tanaman terhambat. Akar dalam menyerap air dan hara menurun dan tanaman lebih peka terhadap kekeringan.
17
Fungsi Zn : Metabolism auksin Sistesis nuleotida Dehidrogenase
Kekurangan Mn : khlorosis, daun mengeras, bercak nekrotik pada daun di bagian tengah.
Kekurangan Zn : Rosset, klorotik
Kelebihan Mn : daun menjadi berwarna coklat, bercak-bercak hitam pada gandum pada daun tua
Hubungan pH dengan titik Muatan nol (TMN)
Titik muatan nol (TMN) atau point of zero charge (pzc) (Parfitt, 1980; Bowden et al;., 1980) adalah pH tanah pada kondisi muatan neto permukaan sama dengan nol atau total muatan positif sama dengan total muatan negatif. Beberapa ahli tanah menyebut titik ini sebagai point of zero
charge (pzc) atau titik nol muatan (diantaranya Uehara dan Gilman1981, dan Sakurai 1989). Istilah yang dikemukakan Parfitt (1980) lebih tepat untuk mengungkapkan sifat tanah ini karena salah satu metoda penetapan TMN adalah menetapkan suatu titik yang menunjukan pH pada kondisi total jerapan H+ = OH-. Ahli-ahli tanah sepakat pula bahwa pH pada kondisi ini disebut juga pH0.
18
(Bohn et al., 1979). Untuk mendapatkan TMN, dapat digunakan metode titrasi garam (Salt Titration) yang telah dikembangkan oleh Uehara dan Gilman (1981). Penetapan TMN dengan titrasi garam didasarkan pada teori Gouy-Chapman dan Nerst. Dalam hal permukaan liat telah bermuatan neto negatif, muatan akan lebih negatif dengan penambahan garam akibat hidrogen ke dalam larutan tanah yang mengakibatkan turunnya pH dan sebaliknya, pH suspense akan meningkat dengan penambahan garam jika muatan permukaan positif. Jika muatan neto permukaan liat nol, pH larutan tidak akan dipengaruhi oleh penambahan elektrolit.
Semua hasil percobaan menunjukan bahwa semua nilai hasil pengamatan berhubungan satu sama lain sebagai refleksi karakteristika komponen bermuatan variabel. Nilai TMN, koef. Absorpsi Fosfat (KAF), dan permukaan jenis diduga merupakan komponen yang penting untuk analisis parameter oksida atau hidroksida amorf secara kualitatif. Kandungan oksida dan hidroksida yang tinggi telah diketahui meningkatkan TMN, terutama Al oksida amorf memberikan kontribusi yang besar terhadap tingginya nilai TMN sebagai karakterika tanah abu vulkan.
TMN pada Andisol di perkebunan teh Ciater, Sedep, dan Sinumbra berkisar 3,45 sampai 4,98 dan berkolerasi positif dengan kandungan alofan (Mahfud Arifin, 1994). Dengan demikian perbedaan TMN tersebut berkaitan dengan kandungan bahan amorf yang merupakan fraksi-fraksi dapat larut dalam oksalat, yaitu alofan dan bahan-bahan yang menyerupai alofan (Allophane like materials). Parks (1965) mengemukakan bahwa oksida-oksida yang larut dalam oksalat atau dikenal juga sebagai liat amorf mempunyai nilai TMN yang lebih tinggi bila dibandingkan dengan liat kristalin.
19
hal ini terjadi karena kandungan bahan organik lapisan atas lebih tinggi dan tanah memperoleh kesempatan retensi kation jika diperlukan. Dengan demikian, penambahan bahan organik pada sistem ini akan menurunkan TMN. Akan tetapi hasil beberapa penelitian mengenai pengaruh bahan organik tersebut berbeda-beda, tergantung pada neto permukaan lainnya. Hasil penelitian Mahfud Arifin (1994) menunjukan bahwa liat dengan
permukaan neto positif (∆ pH < 0), dan muatan neto negatif (0 < ∆ pH ≤
0,5), bahan organik menurunkan TMN, tetapi pada muatan neto negatif dan
∆ pH > 0,5, ternyata bahan organik meningkatkan TMN, karena bahan
20
BAB II. MINERAL DALAM TANAH
2.1 Mineral Tanah dan Manfaatnya bagi Tanaman
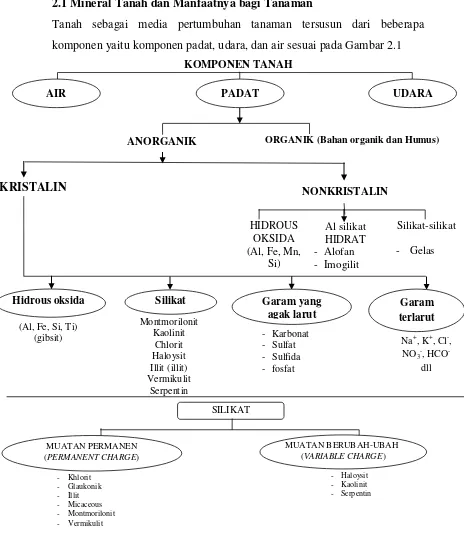
Tanah sebagai media pertumbuhan tanaman tersusun dari beberapa komponen yaitu komponen padat, udara, dan air sesuai pada Gambar 2.1
KOMPONEN TANAH
AIR PADAT UDARA
ANORGANIK ORGANIK (Bahan organik dan Humus)
KRISTALIN NONKRISTALIN
Hidrous oksida Silikat Garam yang
agak larut
21
Mineral dalam tanah terbagi atas mineral primer dan mineral sekunder. Mineral primer adalah mineral kompleks bersusunan kimiawi asli yang keluar dari perut bumi melalui mekanisme aliran atau semburan cairan magma dari erupsi G. api lalu membeku membentuk bebatuan dan susunan kimia tersebut tidak berubah, umumnya merupakan fraksi kasar berukuran > 2 µm (kerikil, pasir dan debu). Contoh mineral primer terdapat pada Tabel 2.1.
Mineral sekunder merupakan hasil proses pelapukan mineral primer dan mengalami perubahan susunan kimiawi. Mineral sekunder lebih banyak ditemukan dalam fraksi mineral liat (clay). Mineral liat adalah mineral yang berukuran < 2u, dalam tanah terbentuk karena :
(1). Rekristalisasi (sintesis) dari senyawa-senyawa hasil pelapukan mineral primer, atau
(2). Alterasi (perubahan) langsung dari mineral primer yang telah ada, contoh perubahan atau pelapukan mika menjadi illit.
Illit Montmorilonit Kaolinit oksida-oksida Al dan Fe
Sumber : Hardjowigeno (2003)
Gambar 2.2. Pembentukan Mineral Sekunder. Mineral Primer
Feldsfar Mika Mineral Feromagnesium
Mineral Sekunder (Liat) Alterasi
22
Mineral liat dalam tanah dibedakan menjadi : (1). Mineral liat Al-silikat :
(a). Memiliki bentuk Kristal (tipe 1 : 1, Kaolinit, haloysit, tipe 2 : 1, smektit: montmorilonit, illit, vermikulit, tipe 2 : 2 contoh klorit).
(b). Mineral liat Al-silikat A-morf
(nonkristalin), contoh mineral alofan, imogolit banyak ditemukan pada tanah Andisol.
(2). Oksida-oksida Fe dan Al serta hidrousoksida Fe dan Al merupakan penyumbangterbesar suatu sifat fisik warna tanah, sehingga warna tanah dapat berbeda. Contoh dari mineral oksida Fe dan Al adalah Geotit (FeOOH), memberikan warna coklat-kemerahan; Hematit (Fe2O3) memberikan warna merah pada tanah; hidrousoksida limonit Fe2O3 . 3H2O memberikan warna kuning-coklat pada tanah. Gibsit (hidragilit) Al(OH)3
(3). Sebagian golongan mineral primer.
Montmorilonit muatan negatifnya secara umum berasal dari substitusi isomorfik, yaitu penggantian kation valensi tinggi oleh kation valensi rendah dengan syarat jari-jari atom relatif sama. Mineral ini banyak ditemukan pada tanah Vertisol (grumosol), penyebab retak-retak (rekahan) pada musim kemarau. Skema mineral tanah dapat terlihat pada diagram di bawah ini.
23
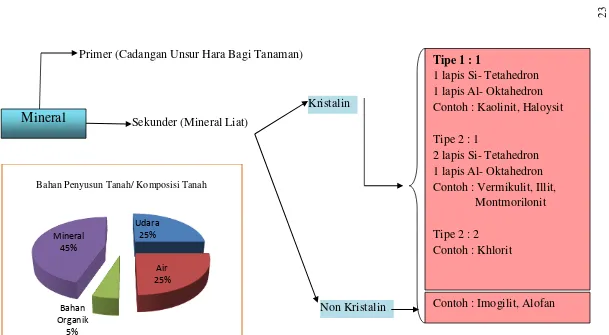
Gambar 2.3 Skema Mineral Liat dalam Tanah
Udara 25%
Air 25%
Bahan Organik
5% Mineral
45%
Kristalin
Non Kristalin
Mineral
Primer (Cadangan Unsur Hara Bagi Tanaman)
Sekunder (Mineral Liat)
Tipe 1 : 1
1 lapis Si- Tetahedron 1 lapis Al- Oktahedron Contoh : Kaolinit, Haloysit
Tipe 2 : 1
2 lapis Si- Tetahedron 1 lapis Al- Oktahedron Contoh : Vermikulit, Illit,
Montmorilonit
Tipe 2 : 2 Contoh : Khlorit
Contoh : Imogilit, Alofan Bahan Penyusun Tanah/ Komposisi Tanah
2
24
ketersediaan unsur-unsur hara yang berasal dari pelapukan batuan dan mineral tidak begitu besar dalam jangka waktu pendek.
Tabel 2.1. Mineral Primer Sebagai Cadangan Unsur Hara Bagi Tanaman Dalam Tanah
GOLONGAN NAMA MINERAL RUMUS KIMIA CADANGAN
UNSUR HARA
25 Bebatuam effuse asam (liparit) dan abu volkan gunung Krakatau (van Mohrcit,
Darmawijaya, 1990):
Liparit 73,99 15,22 0,56 0,18 0,15 0,49 0,09 3,49 3,48 0,01 Abu
26
Tampak pada Tabel 2.2 bahwa sumbangan dari mineral primer tanah sejumlah unsur hara seperti Ca adalah dari mineral Apatit Ca3 (PO4)2 dan Epidot serta Augit dansejumlah mineral yang tertera pada Tabel 2.1 adalah golongan kapur pertanian seperti Kalsit dan Dolomit. Demikian pula sumbangan terbesar unsur hara K (Kalium/pottasium) dapat dari mineral tanah yatu berasal dari mineral Muskovit, Ortoklas dan Biotit. Sedangkan sumbangan terbesar fosfat atau unsur hara P berasal dari mineral Apatit.
Batuan dan atau mineral sebelum dapat menyumbangkan sejumlah unsur hara ke dalam tanah bagi tanaman dan tumbuhan akan mengalami pelapukan/perombakan dengan reaksi-reaksi yang terjadi di bawah ini.
3KAlSi3O8 + 2H+ + 12H2O KAl3Si3O10(OH)2 + 6H4SiO4 + 2K+
K-Feldsfar K-Mica
2KAl3Si3O10(OH)2 + 2H+ + 3H2O 3H4Al2Si2O9 + 2K+
K-Mica K-Kaolinit
H4Al2Si2O9 + 5H2O Al2O3 . 3H2O + 2H4SiO4
K-Kaolinit Gibsit Dissolved Silica
Montmorilonit Haloisit Metalo haolisit Kaolinit
H2KAl3Si3O12 SERI ILLIT Al2O3 . 4SiO2 . H2O + x H2O
27
1. Mineral liat Al-Silikat (Kristalin) : Kaolinit, Haloisit, Illit, Montmorilonit, Vermikulit, Chlorit, dll
2. Mineral liat Al-Silikat Amorf (Amorfous) (Non kristalin) : Alofan , Imogilit
Alofan (Al2O3 . 2SiO2 . H2O atau SiO2 . Al2O3 . 2H2O) Imogilit (SiO2 . Al2O3 . 2,5H2O
KTK (Kapasitas Tukat Kation) = 8-50 me/100g
8-50 Cmol (+)/kg
KTA (Kapasitas Tukar Anion) = 5-30 me/100g
5-30 Cmol (+)/kg
3. Oksida-oksida Fe dan Al pada tanah-tanah tua
(Oxisol, Ultisol Gibsit (Al2O3 . 3H2O), Hematit (Fe2O3), Geotit (Fe2O3, H2O), Limonit (Fe2O3, 3H2O)
Sering bermuatan + dapat memfiksasi P melalui KTA Mineral Primer
KAlSi3O8 (Feldsfar)
H2kaL3Si3O12 (Muskovit/mika)
28
2.2 Permukaan Jenis Mineral (Specific Surface)
Permukaan jenis mineral dapat menentukan besarnya nilai tukar kation atau menentukan banyaknya unsur-unsur hara (ion-ion) yang dapat di Jerap.
Adsorpsi (Jerapan) : terikatnya ion dan molekul air pada koloidal, terikatnya ion tersebut tidak terlalu kuat dapat diganti/ditukar oleh ion lain.
Permukaan jenis (s) : Luas Permukaan Butir m2/g = cm2/g Berat Butir
Luas permukaan suatu jenis mineral dapat dilihat pada Tabel 2.3
Tabel .2.3. Besarnya KTK dari Berbagai Jenis Mineral Liat
JENIS MINERAL LIAT PERMUKAAN LUAS (cm2/g)
M2/g (me/100g) KTK
1. KAOLINIT 10-50 x 104 7-30 3-15
2. HALLOYSIT
3. ILLIT (MIKA) 60-200 x 104 65-120 10-40
4. MONTMORILONIT 60-800 x 104 600-800 80-150
5. VERMIKULIT 400-800 x 104 50-800 100-150
6. PASIR 0,0001
7. DEBU 0,05
8. HUMUS >200
KTK ZEAGRO : > 100 Me/100g= mili ekuivalen
PERMUKAAN JENIS
Menentukan banyaknya unsur hara yang dapat (diadsorpsi) oleh liat humus, liat amorf, dll.
29
2.3. Golongan Mineral Sekunder
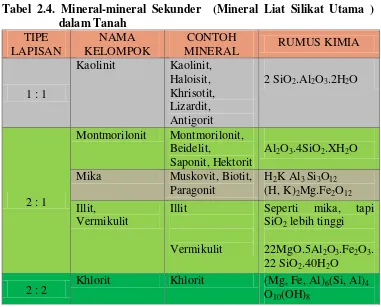
Mineral-mineral sekunder utama yang mendominasi pada tanah-tanah mineral dapat dilihat pada Tabel 2.4 di bawah ini.
Tabel 2.4. Mineral-mineral Sekunder (Mineral Liat Silikat Utama )
Mineral liat memiliki sruktur berlapis-lapis
30
2.4. Muatan Negatif dan Positif pada Mineral Liat
Menurut Brady (1974), muatan negatif pada mineral liat silikat dapat disebabkan oleh beberapa hal, yaitu :
1. Substitusi isomorfik
Adalah penggantian kation dalam struktur Kristal mineral liat oleh kation lain yang mempunyai ukuran sama tetapi muatan (valensi) berbeda. Umumnya kation yang menggantikan mempunyai muatan yang lebih rendah dari pada yang digantikan, misalnya Mg2+ atau Fe2+ menggantikan Al3+ dalam Al-oktahedron, atau Al3+ menggantikan Si4+ dalam Si-tetrahedron, sehingga terjadi kelebihan muatan negatif pada mineral liat.
Substitusi isomorfik terjadi waktu proses pembentukan liat berlangsung dan menghasilkan muatan tetap pada mineral tersebut. Proses substitusi isimorfik dapat dijelaskan pada berbagai tipe mineral liat pada Gambar 2.5 dan Gambar 2.6 di bawah ini.
2. Kelebihan muatan negatif pada ujung-ujung patahan Kristal mineral liat, baik pada Si-tetrahedron maupun Al-oktahedron.
3. Disosiasi H+ dari gugus OH yang terdapat pada tepi atau ujung Kristal.
OH O- + H+
31
Gambar 2.5. Dinamika Kesetimbangan Kation Teradsorpsi Liat (clay) dan Dalam Larutan Tanah
Gambar 2.6. Tipe Mineral Liat 1 : 1
32
Dalam tanah selain ditemukan proses pertukaran kation, sering ditemukan pula proses pertukaran anion, walaupun dalam jumlah yang jauh lebih sedikit. Kapasitas Tukar Anion (KTA) banyak dijumpai pada mineral liat amorf dan liat Al dan Fe-oksida. KTA ditemukan pula pada kaolinit dalam jumlah sedikit. Adanya muatan positif pada mineral liat silikat disebabkan oleh adanya patahan-patahan Kristal atau akibat penggantian gugus OH oleh anion-anion lain (Sanchez, 1976). Karena koloid-koloid ini bermuatan positif, maka terjadi pertukaran anion.
Oksida-oksida Fe dan Al seperti gibsit (Al2O3.3H2O), Hematit (Fe3O2), goetit (Fe3O2.H2O) dan limonit (Fe3O2.3H2O), mineral-mineral ini bersifat amorf memiliki KTK rendah, sering bermuatan positif dan dapat melakukan fiksasi P dengan kuat melalui pertukaran Anion, yang digambarkan pada reaksi kimia sebagai berikut :
Al(OH)3 Al(OH)2+ + OH
-Al(OH)2+ + H2PO4- Al(OH)2 H2PO4
Sebaran mineral liat tidak selalu tertumpu pada satu jenis tanah, akan tetapi sejumlah mineral liat dapat mendominasi pada satu atau lebih jenis tanah. Mineral liat utama dengan sifat dan tipe lapisan liat dapat dijumpai pada berbagai tanah yang dapat terlihat pada Tabel 2.5, Tabel 2.6 dan Tabel 2.7.
Haloisit dianggap sebagai pengaktif (precursor) dari kaolinit karena pembentukan mineral ini mengikuti tahapan sbb :
33
Tabel 2.5 Mineral Sekunder Utama : Mineral Liat
Mineral Utama Tipe
Lapisan
KTK
(cmol(+)/kg) Dijumpai Pada Tanah
Lempung amorf/parakristalin
Kristobalit, n(SiO2) - Mineral tambahan pada tanah
abu vulkan
Fe2O3.3H2O = Limonit, penyebab warna kuning coklat pada tanah.
Liat montmorilonit banyak dijumpai pada tanah Vertisol, Mollisol dan Alfisol dan juga ditemukan pada beberapa Entisol.
H2KAl3O12 Al2O34SiO2H2O + xH2O
34 Liat kaolinit banyak ditemui pada tanah : Ultisol dan Oxisol dan juga
terdeteksi sebagai mineral pelengkap pada tanah Alfisol dan Vertisol.
Muatan tetap/permanen terdapat pada mineral liat tipe 2 : 1 (smektit)/monmorilonit, mika/illit. Pada tanah grumosol (vertisol), rendzina (mollisol), sedikit pada tanah aluvila (entisol).
Tabel 2.6. Karakteristik Muatan Permukaan Tanah-tanah di Wilayah Tropik
Mineral Tanah %Liat KTK
TETAP
KTK Variabel
Total KTA KTK Liat
Montmorilonit 60 44 3 47 3 75
Kaolinit/Haloysit 64 7 10 17 4 26
Campuran Kristalin /Amorf
56 4 17 21 11 39
Dominan Amorf 62 6 32 38 20 61
Bahan Organik 12 8 30 38 7 100
KTK Variabel : KTK bergantung pH (pH Dependent Charge Variable) SERI KEKUATAN PENGIKATAN KATION-KATION KAOLINIT : Ba2+ > Ca2+ > Mg2+ > K+ > H > NH4+ > Na+ MONTMORILONIT : Ba2+ > Ca2+ > Mg2+ > H+ > K+ > NH4+ > Na+ MIKA : Ba2+ > H+ > K+ > Ca2+ > Mg2 K +> NH
4+ > Na+
KEKUATAN MEKANISME JERAPAN ION PO43- > SO42- > F- > NO3- > Cl- > Br- > I
35 KTK TOTAL diekstrak dengan BaCl2- TEA (TetraetanolAmina) pada pH 8,2
KTK Variabel = KTK TOTAL + KTK PERMANEN
Tabel 2.7.Definisi kelas mineralogi jenis mineral liat pada Berbagai Ordo Tanah
Class Simplified Definitions Commonly Found Orders Most Halioysitic (1:1) >50% nontabular halloysitic
in clay fraction by weight Oxisol, Inceptisol Ultisol, Montmorillonitic
(2:1)
>50% montmorilonite or nontronite in clay fraction by weight, or a mixture with more montmorillonite than any other single clay mineral
Vertisol, Mollisol, Alfisol, Aridisol, Inceptisol, Entisol
Illitic (2:1) >50% illite (hydrous mica) in clay by weight or > 4% K2O
Mollisol, Alfisol, Aridisol, Inceptisol, Entisol
Vermiculitic (2:1) >50% vermiculite in clay by weight, or more vermiculite thanj any other single clay mineral
Mollisol, Ultisol, Alfisol, Aridisol, Inceptisol, Entisol
Chloritic (2:2) >50% chlorite in clay by weight or more chlorite than any other mineral
Mollisol, Alfisol, Aridisol, Inceptisol, Entisol
Kaolinitic (1:1) >50% clay fraction kaolinite or tabular halloysite by
Gibbsitic >40% gibbsite and boehmite
of soil by weight Oxisol, Ultisol Ferritic >40% free Fe2O3 of soil by
weight
Oxisol, Ultisol
Ashy >60% volcanic ash, cinders,
and pumice in soil Andept
Cindery >35% cinders larger than 2 mm by volume
Andept
Siliceous >90% by weight of quartz
36
2 mm fraction by weight Inceptisol, Entisol Carbonatic Mixed >40% CaCO3 by weight soil
with less than 40% of any mineral in the 0,02-2 mm fraction and less than 50% single layer silicate mineral
Sumber: Soil Survey Staff (1970)
Fraksi Mineral Liat dengan Berbagai Karakteristiknya: Karakteristik fraksi liat (clay) di dalam tanah :
1. Mineral liat Al-silikat kristalin
2. Mineral liat Al-silikat nonkristalin (amorf) 3. Oksida dan hidrousoksida Fe dan Al 4. Mineral-mineral primer
Tabel 2.8. Fraksi Mineral Liat dengan Karakteristiknya KAOLINIT (mineral liat
Al-silikat tipe 1 : 1)
Tiap unit terdiri dari satu gugus Si-Tetrahedron + satu
gugus Al-Oktahedron
MONTMORILONIT (Mineral liat Al-silikat tipe 2 : 1)
Masing-masing unit terdiri dari 2 gugus Si-Tetrahedron + 1 gugus
Al-Oktahedron
1. Ditemukan pada tanah dengan pelapukan lanjut
Masing-masing unit dihubungkan dengan unit lain oleh ikatan yang lemah dari oksigen ke oksigen sehingga mudah mengembang dan mengkerut.
3. Masing-masing unit melekat dengan unit lain dengan kuat oleh ikatan H, sehingga tidak dapat mengembang dan mengkerut.
37
4. Sedikit atau tidak ada substitusi isomorfik, sehingga kapasitas tukar kation rendah. naiknya pH akibat meningkatnya ionisasi H+ dari gugus OH, karena
4 Rekristalisasi dari hasil pelapukan mineral silikat dalam lingkungan agak masam atau masam akibat basa-basa yang tercuci (drainase tanah baik, curah hujan tinggi)
Konsentrasi ion Si dan Mg tinggi.
5 Dekomposisi kaolinit dapat menghasilkan oksida-oksida
38
Fe dan Al (dan oksida silika
yang mudah larut) banyak mengandung Mg (dan Fe). Air dalam tanah tidak atau lambat bergerak (drainase jelek). Pencucian lambat
Dapat terbentuk pula karena alterasi dari khlorit, illit atau vermikulit.
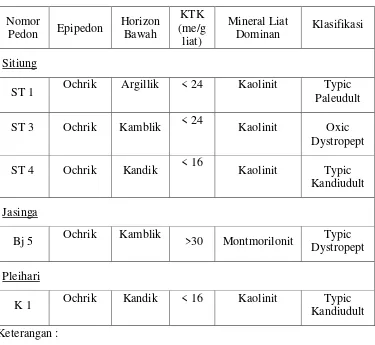
Tabel 2.9. Beberapa Sifat Podsolik Merah Kuning (Hardjowigeno, 1992).
Nomor
Pedon Epipedon Horizon Bawah
KTK (me/g liat)
Mineral Liat
Dominan Klasifikasi
Sitiung
ST 1 Ochrik Argillik < 24 Kaolinit Paleudult Typic
ST 3 Ochrik Kamblik < 24 Kaolinit Oxic
Dystropept
ST 4 Ochrik Kandik < 16 Kaolinit Typic
Kandiudult
Jasinga
Bj 5 Ochrik Kamblik >30 Montmorilonit Dystropept Typic
Pleihari
K 1 Ochrik Kandik < 16 Kaolinit Kandiudult Typic
Keterangan :
39
Value : gelap terangnya warna tanah, sesuai dengan banyaknya sinar yang dipantulkan.
Horison Argillik : horison penimbunan liat, horison B tanah paling sedikit mengandung 1,2 x liat (clay) lebih banyak dari pada liat di atasnya. terdapat selaput liat.
Horison Kandik : seperti horison agrillit tetapi KTK tanah (NH4OAC) <16 Cmol (+)/kg liat dan KTK efektif < 12 Cmol (+)/kg liat. Horison Kambik : horison bawah yang telah terbentuk struktur tanah atau
warna sudah lebih merah dari bahan induk atau ada indikasi lemah adanya agrillik atau spodik, tetapi tidak memenuhi syarat untuk kedua horison tersebut.
41
Gambar 2.8. Kelarutan macam-macam aluminasilikat yang tidak tersubstitusi dibandingkan dengan gibbsite (Al(OH)3 amorf.
Mineral yang paling stabil kelarutan Al2Si2O5 menurun dalam urutan silimaite > kyanite > dicktit > andalusit. Kelarutan Al2Si2O5 (OH) menurun menurut haloysit > dicktit > kaolinit. Pada kondisi H4SiO4 aktif > 10-3,7 M.
42
Pyropilit lebih stabil dari kaolinit yang berada di bawah tingkat H4SiO4, kaolinit lebih stabil.
Kelarutan Al(OH)3 amorf terletak pada 9.66. pada H4SiO4 aktif dibawah 10-5,31 M gibbsite merupakan mineral paling stabil, dalam tanah yang mengalami pelapukan dibawah pengaruh iklim yang hebat, silika dicuci dari tanah sebagai kaolinit dengan semua oksida alumina dan hidroksi mineral adalah tidak stabil dalam tanah yang H4SiO4 melampaui 10-5,31 M (Lendsay, 1979). Keaktifan Al3+ dalam kesetimbangan dengan bermacam aluminosilikat. Kesetimbangan dengan gibbsite (Al(OH)3) :
Gambar 2.8 menunjukan kestabilan relatif dari mineral Na-aluminosilikat. Mineral yang dapat larut kebanyakan Na-glass, dari ketiga NaAlSi3O8 kelarutannya menurun sesuai dengan Na-glass > High albite >
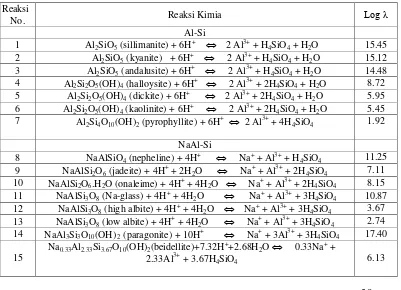
low albite. Kelarutan beberapa Na-aluminosilikat ditunjukan dengan reaksi no. 8 sampai dengan no. 15 tabel 2.9.
Mineral NaAlSiO4 (nepheline), NaAlSi2O6 (jadeite) dan NaAlSi2O6 (analcime) berada dalam kelarutan sementara dan diharapkan terjadi lebih cepat lagi. Mineral NaAl3Si3O10 yang paling stabil adalah NaAl3Si3O10(OH)2 dan Na0.33Al2.33Si3.67O10(OH)2. Kaolinit dan pyropillit lebih stabil dibanding dengan sodium aluminosilikat.
Log Al3+ + 3 pH = 8,04 Dan untuk pH 5
log Al3+ + 3 (5) = 8,04 atau
43
SODIUM ALUMINOSILICATES (Na Aluminosilicates)
Gambar 2.9. Kestabilan dari beberapa Na-Aluminosilikat dibanding dengan gibbsite, merupakan pengaruh pH dan aktivitas Na.
Kelarutan beberapa K-Aluminosilikat ditunjukan dengan reaksi no. 16 sampai dengan no. 21 pada tabel 2.9. kelarutan K-Aluminosilikatmenurun sesuai KAlSi3O8 > KAlSi3O4 (kaliophilite) > KAlSi3O6 (leucite) > KAlSi3O8 (high sanidine) > KAlSi3O8 (nictocline) > KAl2AlSi3O8 (muskovite). Garis kelarutan mineral muskovite ditunjukan oleh reaksi :
44
45
Persamaan (2) bila K+ = 10-3 M, maka
Persamaan (2) menjadi
log Al3+ + 3 pH = 5,48 – 0,33 log K+ - 0,33 pH – log H4SiO4
muskovit lebih stabil dari gibbsite (Al(OH)3) pada semua kisaran H4SiO4 yang terjadi dalam tanah, hanya pada keadaan selanjutnya dari tanah pelapukan lanjut jika silika telah hilang, gibbsite menjadi lebih stabil.
CALCIUM ALUMINOSILICATES
Gambar 2.11. Kestabilan dari beberapa Kalsium Alumina-silikat dibandingkan dengan gibbsite dengan indikator perubahan pH dan Ca2+
Hexagonal anorthite (24)
46
Kelarutan beberapa kalsium alumino silikat diberikan dengan reaksi-reaksi 22 sampai 28 pada tabel 2.9 dan dipetakan pada gambar 2.10 diatas. Suatu contoh dari bagaimana deret kstabilan terjagi ditunjukan untuk pyroxine dimulai dengan reaksi 22 dari tabel 2.9
CaAlSiO6 (pyroxine) + 8H+
Ca2+ + 2Al3+ + H4SiO4 + 2H2O...(10)Log Ko = 35,25
2 log Al3+ + 6 pH = 35.25 – 2pH – log Ca2+ - log H4SiO4
log Al3+ + 3pH = 17,63 – ½ log Ca2+ - pH - ½ log H4SiO4 ...(11) jika diberikan 10-2.5 M, persamaan (11) menjadi
log Al3+ + 3pH = 18,88 – pH - ½ log H4SiO4 ...(12)
Gambar dari persamaan 12 untuk pH 7 ditunjukan dalam gambar 2.10 dan dinamakan garis pyroxine. Garis kestabilan lainnya dalam gambar ini didapatkan secara persis. Pergeseran dalam garis ini dengan pertukaran dalam pH dan log Ca2+ ditunjukan oleh garis pendek dan panah.
Kalsium Aluminosilikat dalam gambar 2.10 menurun dalam kelarutan sesuai CaAl2SiO8 (k-glass) > CaAl2SiO6(pyroxine) > CaAl2Si2O8 (heksagonal anorthit) > CaAl2Si4O12 . 2H2O(wairajit) > Ca2Al4Si8O24.7H2O (leonhardit)
Kelarutan dari beberapa magnesium aluminosilikat dan substitusi aluminosilikat ditunjukan oleh reaksi 29 sampai 34 pada tabel 2.9. reaksi kestimbangan dari chlorite :
Log Al3+ + 3pH = 30,15 – 2,5 log Mg2+ - 5pH – 1,5 log H4SiO4 ...(13) Bilamana Mg2+ adalah 10-3 M, persamaan reduksi menjadi
47
MAGNESIUM ALUMINOSILICATES
Gambar 2.12. Kestabilan beberapa Magnesium Aluminosilikat dalam kestimbangan dengan 10-3 M K 10-4 M F dan Fe-tanah pada pe + pH = 17,0 dengan pertukaran untuk pH dan Mg2+ sebagai indikator.
48
Persamaan (14) dipetakan dalam gambar 2.11 dan diberinama garis chlorit. Kestabilannya dipengaruhi pH, perubahan 5 log unit untuk suatu pertukaran dalam pH. Chlorit kebanyakan lebih stabil dalam suasana alkalin dan mungkin diharapkan sebagai suatu mineral yang stabil pada pH 7,5.
Substitusi isomorfikdari berbagai kation menjadi kisi-kisi chlorit memungkinkan sedikit perubahan dalam hubungan kestabilan. Semua ini cukup membantu dalam ketidakpastian mengenai nilai kelarutan chlorit.
Gambaran kestimbangan untuk vermikulit ditunjukan dari reaksi 32 pada tabel 2.9 adalah :
Log Al3+ + 3pH = 33,46 – 6,09pH - 2,38 log Mg2+– 0,2 log Fe2+ – 0,40 log Fe3+ – 0,5 log Ca2+ – 0,9 log K+ – 2,55 log H4SiO4 ...(15)
Bila Mg2+ = K+ = 10-3 M, Ca2+ = 10-2,5 M, log Fe3+ = 2,70 – 3 pH dan log Fe2+ = 15,74 – 2 pH – (pe + pH), persamaan (15) menjadi :
Log Al3+ + 3pH = 39,60 – 4,85pH + 0,02 (pe + PH) – 2,55LOG H4SiO4 ...(16)
Gambaran dari persamaan (16) ditunjukan sebagai deret vermikulit dalam gambar 2.11 pada pe + pH = 17,0. Mineral ini tidak stabil dalam tanah. Pergantian dalam redoks (pe + pH) hanya sedikit berpengaruh terhadap stabilitas vermikulit apabila kandungan reduksi Fe2+ hanya sedikit. Misalnya, suatu perpindahan dalam pe + pH dari 17 ke 10 hanya menurunkan garis vermikulit oleh 0,14 log unit (persamaan 16).
49
MAGNESIUM ALUMINOSILICATES
Gambar 2.13. Ringkasan diagram beberapa campuran aluminosilikat dalam kestimbangan dengan 10-3 M K+ 10-3 M Mg2+ dan Fe tanah dengan pH dan K+ swbagai indikator.
Garis kestabilan dalam mineral illit dalam gambar ini akan dikembangkan dari reaksi 33 pada tabel 2.9 dan diberikan persamaan :
50
persamaan (18) ditunjukan pada gambar 2.12 sebagai garis illit. Deret ini diambil untuk pH 7 dan yang menunjukan pergeseran ke atas atau ke bawah oleh 0.48 unit untuk suatu perpindahan unit dalam pH.
Garis kaolinit dlam gambar 2.12 diperoleh dari reaksi 7 pada tabel 2.9 yang diberikan
Log Al3+ + 3pH = 2.73 – log H4SiO4 ...(19)
Garis muskovit diperoleh dari reaksi 21 pada tabel 2.9 yang diberikan log Al3+ + 3pH = 4,48 –⅓ log K+–⅓pH – log H4SiO4 ...(20) Bilamana K+ = 10-3 M, persamaan reduksi ini menjadi
log Al3+ + 3pH = 5,48 –⅓pH – log H
4SiO4 ...(21)
Garis Mg-montmorilonit diperoleh dari reaksi 34 pada tabel 2.9 yang diberikan
log Al3+ + 3pH = 1,56 – 0.29 log Mg2+– 0.13 log Fe3+ – 0.95pH – 2,23 log H4SiO4 ...(22)
Bila Mg2+ = 10-3 M dan Fe3+ ditentukan oleh Fe(OH)3 (Fe-tanah), log Fe3+ = 2.70 - 3pH dari reaksi 35 pada tabel 2.9 persamaan (22) menjadi
Log Al3+ + 3pH = 2.08 – 0.56 pH – 2.23 log H4SiO4 ...(23) Beberapa hubungan kestabilan yang penting dari mineral-mineral liat sekunder dalam tanah diwakili dalam gambar 2.12. dari gambaran-gambaran mineral-mineral ini Mg-montmorilonit adalah lebih stabil pada kondisi H4SiO4 yang tinggi yang akan terjadi selama pelapukan mineral. mineral Al2Si4O10(OH)2 (pyropilit) hanya sedikit mengalami perubahan. Pada pH 7,0 jika H4SiO4 menurun mendekati 10-3.7 M, Al2Si2O5(OH)4 (kaolinit menjadi lebih stabilpada tanah dengan larutan silika lebih besar. Pada kondisi demikian aluminosilikat sebagian besar menghilang sebagai gibbsite dan oksida besi.
51
Mg-montmorilonit lebih stabildibanding kaolinit, sedangkan penurunan pH menurunkan pula kestabilan relatif kaolinit.
Gambar 2.14. Penyanggaan aktivitas Al3+ oleh Mg-montmorilonit, kaolinit dan gibsit sebagai pengaruh pH, silika, oksida besi dan Mg2+ (Lindsay,1979).
52
Dalam tanah-tanah dengan pH 8,2, KAl2(AlSi3O10)(OH)2 (muskovit) adalah sangat stabil dengan keadaan kaolinit bilamana K+ adalah 10-3 M. Akibat tanah-tanah menjadi asam dan K+ mengalami pencucian, muskovit juga menghilang dari tanah.
Pada tanah-tanah dengan pengaruh suhu tinggi H4SiO4 menurun di bawah SiO2 (kuarsa) dan mengakibatkan aktivitas Al3+ meningkat sampai akhirnya dibatasi oleh Gibsit (Lindsay, 1979). Faktor-faktor yang mempengaruhi terhadap aktivitas Al3+ secara tidak langsung mempengaruhi kelarutan P (fosfor) dan juga alumunium Fosfat.
53
2.5. Diskusi
Kandungan mineral alumino silikat tanah tidak sama (Dixon dan Weed,1977). Substitusi isomorfik ion-ion kedalam kisi kristal pada beberapa mineral diharapkan akan menhubah hubungan energi bebas pada mineral-mineral ini.
Beberapa metoda mengusulkan, energi bebas pada mineral liat didasarkan pada komposisi stoichiometrik (Slaughtor, 1966; Taddy dan Carrels, 1974; Nriagu, 1975, Mattigod dan Sposito, 1978 cit. Lindsay, 1979). Kemampuan mineral-mineral dalam menerima Fe2+ dan Mn2+ kedalam kisi-kisi mineral itu dipengaruhi oleh hubungan redoks. Dalam kondisi yang lebih hebat lagi, reduksi yang kuat akan terjadi penggabungan pada ion-ion ini ke dalam kisi-kisi mineral. Sebagai hasil kondisi reduksi, aktivitas Al3+ dipertahankan oleh substitusi mineral yang akan meningkat lagi. Jadi hubungan redoks menjadi suatu hal yang sangat penting dalam pembentukan dan penguraian besi-mangan dan substitusi aluminasilikat. Efek redoks terhadap kelarutan dari beberapa besi dan mineral mangan merupakan hal yang harus diperhatikan.
Perkembangan diagram kestabilan yang memasukan dasar kelarutan mineral aluminasilikat merupakan kenyataan yang tidak dapat diragukan lagi. Banyak laporan tentang kelarutan aluminasilikat, tetapi bukan merupakan hasil suatu penelitian akhir, melainkan hasil mempelajari secara teliti dari beberapa literatur. Informasi lebih lanjut tentang macam substitusi isomorfik akan merupakan perbandingan pada bagaimana faktor-faktor tanahakan mempengaruhi kelarutan dan kestabilan dalam hubungannya dengan yang termasuk pada mineral-mineral ini (Lindsay, 1979).
54
Pendugaan ini perlu untuk diuji oleh penelitian tanah dalam lingkungan alami untuk mengetahui mineral-mineral yang mana yang akan dilarutkan atau diendapkan. Banyak harapan ahli-ahli ilmu tanah akan mendorong untuk menggunakan prinsip-prinsip kesetimbangan kimia dalam mempelajari proses pelapukan mineraldan pembentukan tanah. Proses kesetimbangan merupakan hal yang penting sebab merupakan hal yang menentukan hubungan kelarutan pada semua elemen-elemen dalam tanah.
Sehubungan dengan hal-hal tersebut maka penelitian mengenai kesetimbangan kimia dalam tanah perlu dikembangkan karena akan memberikan pengaruh yang nyata baik pada perkembangan ilmu pengetahuan dan khususnya kemajuan teknlogi pertanian.
1. Dari berbagai mineral silikat tanah, kuarsa merupakan mineral paling stabil dalam tekanan dan temperatur normal.
2. Daya serap permukaan asam silikat dapat mencegah terjadinya hubungan kesetimbangan .
3. Dalam deret pH yang normal, H4SiO4 mengandung jenis yang besar dalam larutan.
55
BAB III
KOLOID TANAH DAN PERTUKARAN ION
3.1 Koloid Tanah
Sebelum mempelajari reaksi pertukaran ion dalam tanah, kita mengenal koloid dalam tanah. Koloid dalam tanah terbagi menjadi dua golongan penting, yakni koloid anorganik dan koloid anorganik. Koloid anorganik lebih dikenal dengan mineral liat yang berukuran < 1 mikron, koloid ini sangat penting dalam hubungan fungsi dan keguanaan di dalam tanah bagi tanaman, bagaimana unsur-unsur hara dipertahankan agar tidak hilang di dalam tanah dan termanfaatkan oleh tanaman.
Demikian pula salah satu bahan organik tanah yang begitu besar manfaatnya bagi manusia di alam (di dalam tanah) yaitu yang kita kenal Humus. Humus sebagai bunga tanah, sangat bermanfaat dan begitu sangat penting. Unsur hara dan air tidak pernah akan hilang selama humus berlimpah di dalam tanah. Dengan demikian, koloid anorganik dan koloid organik tanah harus dipertahankan keberadaannya dalam tanah pertanian.
Mengenal ion di dalam tanah, berarti mengenal adanya pertukaran kation dan anion atau lebih dikenal dengan istilah kapasitas tukar kation (KTK) dan kapasitas tukar anion (KTA) dalam tanah. Mempelajari kedua hal itu, sangatlah penting. Karena KTK dan KTA merupakan bagian penciri penting petunjuk tingkat produktivitas tanah sebagai penciri kesuburan kimia tanah pertanian.
Beberapa hal yang harus dijelaskan pentingnya peranan KTK atau pertukaran kation, mulai dari jerapan kation (adsorpsi) kation, pelepasan kation (desorpsi) dari komplek jerapan (komplek adsorpsi).
56
Liat (< 2µ) termasuk koloid, tetapi tidak semua fraksi liat termasuk koloid. Koloid ( Yunani) seperti lem (glue like).
Koloid Tanah
Bagian tanah yang sngat aktif dalam reaksi-reaksi fsikokimia dalam tanah.
Butir koloid yang sangat halus dan diseluputi kulit hidrasi disebut (micelle) atau mikosel yang umumnya bermuatan negatif atau disebut kompleks jerapan. Karena itu ion-ion yang bermuatan positif (kation) tertarik pada koloid tersebut, sehingga terbentuk lapisan ganda ion (Conic Double Layer) atau lapisan ganda listrik.
Teori lapisan ganda listrik : 1. Helmholtz
2. Govy Chapman 3. Lapisan Ganda Stern
Ukuran koloid dalam tanah seperti koloid an-organik (mineral liat) memiliki ukuran yang berbeda dengan partikel-partikel lain sesuai yang terlihat pada Tabel 3.1 di bawah ini.
Tabel 3.1. Ukuran relatif dari berbagai partikel di alam.
Particle Approximate Diameter
Atoms (atom) 0.1 – 0.6 mµ
Molecules (molekul) 0.2 – 5.0 mµ
Molecilar groups (grup molesilar) 0.5 – 10 mµ Colloidal particles (partikel koloid) 0.001 – 10 mµ
Microscopically visible particles > 250 µ
Colloidal clay (koloid liat) < 0.2 µ
Clay (liat) < 2 µ
Silt (debu) 0.05 – 0.002 mm
Very fine sand (pasir sangat halus) 0.10 – 0.005 mm Koloid Organik (Humus)
57
Fine sand (pasir halus) 0.25 – 0,10 mm
ɑ 1 Å (Ångstrom) = 10-7 mm = 10-8 cm; 1 mµ (milimicron) = 10-6 mm = 10-7 cm; 1 µ (micron) = 10-3 mm = 10-4 cm.
3.2. Koloid Organik
Humus (koloid organik) tersusun oleh C, H dan O. humus bersifat amorf, memiliki kapasitas tukar kation (KTK) yang lebih tinggi disbanding mineral liat.
Sumber muatan negatif (-) dari humus karena adanya gugus karboksil
(-C dan gugus phenol (OH)
Muatan dalam humus muatan bergantung pH. Dalam keadaan masam H+ dipegang kuat dalam gugus karboksil/fenol, ikatan tersebut menurun bila pH meningkat . Humus berperan dalam reaksi fisik, kimia dan fisikokimia dalam tanah.
Humus disusun oleh :
1. asam fulvik : BM (berat molekul) kecil, warna terang, larut (dalam asam atau basa), aktif dalam reaksi-reaksi kimia (dulu : asam krenik). Asam fulvat mengandung O2 (44-54%) lebih tinggi, H dan N lebih sedikit (0,7-2,6%).
2. Asam Humik : BM (berat molekul) sedang, warna tidak terlalu terng dan tidak terlalu gelap, larut dalam basa tetapi tidak larut dalam asam, aktif dalam reaksi kimia, mengandung 33-46% O2; 2,5% N. 3. Asam Humin : BM (berat molekul) paling besar, warna paling gelap,
tidak larut dalam asam atau basa, tidak aktif dalam reaksi kimia. Gugusan hidroksil asam humat lebih sedikit dibandingkan dengan asam
fulvat.
O
58
Untuk mengetahui gugusan karboksil/hidroksil dalam asam humat/fulvat yaitu dengan metode-metode (iodometri, dekarboksilasi, pertukaran ion, esterifikasi, dll).
kurang lebih 54% pertukaran asam humat dipengaruhi oleh karboksil. Contoh reaksi antara asam humat gugus karboksil dengan Ca2+ yaitu : R-COOH + Ca (CH2COO)2 (RCOO)2 + 2CH3COOH
Humus bersifat amfoter
Unsur yang membangun asam humat dan fulvat adalah C dan O. Kandungan C (karbon) dari asam humat antara 50 sampai 60 %; oksigen (O) antara 30 sampai 35%. Asam fulvat lebih rendah, dengan kandungan C antara 40 sampai 50%, akan tetapi kandungan oksigen lebih tinggi yakni 44 sampai 50%. Persentase dari H, S bervariasi mulai dari 4 sampai 6, 2 sampai 6, dan 0 sampai 2%.
Tabel 3.2 Kandungan Unsur-Unsur pada Asam Humat dan Fulvat.
Element Asam Fulvik Dry and Ash-Free Basis (%) Asam Humic
C 40-50 50-60
O 44-50 30-35
H 4-6 4-6
N < 1-3 2-6
S 0-2 0-2
59
Tabel 3.3 Beberapa Gugus Fungsional dari Bahan Organik (BO)
60
3.3. Larutan Tanah (Soil Solution)
61
Larutan Tanah (Soil Solution) atau medium reaksi kimia tanah yang merupakan campuran antara air dan bahan terlarut terdiri dari garam-garam bebas, ion-ion terjerap pada komplek koloid dan atau larutan organik. Fungsi dari larutan tanah sebagai medium hara bagi tanaman.
3.3.1. Jerapan Kaion oleh Koloid Tanah
Telah disebutkan bahwa secara umum koloid liat bermuatan negatif. Muatan negatif tersebut dinetralkan dengan menarik kation-kation misalnya K+, Na+, Mg2+, Ca2+, dll kepermukaannya. Hal ini disebabkan adanya gaya elektrostatis pada permukaan liat (clay). Pengikatan kation secara demikian disebut jerapan (adsorpsi).
Mudah tidaknya kation-kation dapat dijerap oleh koloid liat atau liat tidak sama, sangat bergantung dari ion atau kation terhidrasi dan berukuran kecil lebih mudah dijerap.
Seri kekuatan pengikatan kation-kation bergantung pada tipe mineral-mineral liat, yang lebih dikenal dengan seri liotrofik (Tan, 1982).
Seri kation monovalen yang semakin berkurang dijerap liat : Cs > Rb > K > Na > Li
Untuk kation yang bervalensi dua ukuran kekuatan jerapan liat adalah : Ba2+ > Sr2+ > Ca2+ > Mg2+
Pada daerah basah (humid) ion yang banyak dijerap tanah adalah H+ dan Ca2+ diikuti oleh Mg2+, sedangkan Na+ paling sedikit. Akan tetapi di daerah humid misel atau mikrosel (komplek jerapan) dijenuhi dengan ion H+ sehingga sering terbentuk liat masam. Pada tanah sangat masam bentuk ion monomerik dari Al(OH)2+ dapat menempati sebagian besar dari misel dan jumlah tersebut akan meningkat dengan semakin menurunnya pH tanah. Pertukaran kation dapat terjadi antara :
62
2. Kation pada satu misel dengan kation pada misel lainnya.
3. Kation-kation dari tempat yang berbeda pada satu misel yang sama.
3.3.2. Efisiensi pertukaran kation-kation dalam tanah
Efisiensi pertukaran kation-kation dalam tanah sangat ditentukan oleh beberapa faktor :
1. Kepekatan ion atau hukum aksi massa. Semakin tinggi kepekatan suatu kation dalam tanah maka pertukaran semakin cepat.
2. Aktivitas ion yang ditentukan oleh hidrasi ionnya, semakin besar ukuran ion terhidrasi semakin rendah aktivitas dari pergerakannya. Ukuran aktivitas ion yang berhidrasi menurut seri Ostwald yakni :
Sr2+ > Ba2+ > Ca2+ > Mg2+ > Rb+ > H+ > K+ > NH4+ > Na+ > Li+
Aktivitas ion merupakan pernyataan kekuatan ion dalam larutan tanah (Khasawneh, 1971). Aktivitas ion ada hubunganya dengan kecepatan penyerapan ion. Aktivitas ion akan berbanding lurus dengan koefisien aktivitas dan konsentrasi ion.
∂I = fi x Ci, fi (koef. Aktivitas), CI (konsentrasi ion)
Gambar 3.1. Hubungan Aktifitas Ion dengan Kecepatan Penjerapan A dan B konstanta temperatur
63
3. Jenis dari mineral liat. Urutan kemudahan tukar pada mineral liat sbb : a. Montmorilonit : Ca2+ > Mg2+ > H+ > K+ > Na+
b. Kaolinit : Ca2+ > Mg2+ > K+ > H+> Na+ c. Mika : H+ > K+ > Ca2+ > Mg2+ > Na+
Pertukaran kation adalah reaksi yang paling penting dan selalu terjadi dalam tanah terutama dalam penyediaan dan kehilangan hara tanaman. Contoh bentuk paling sederhana pertukaran kation :
Ca + 2NH4+ (NH4)2 + Ca2+
Contoh diatas menggambarkan reaksi kesetimbangan pada pertukaran kation Ca2+ yang dijerap dengan NH4+ dari larutan tanah atau dari kelarutan pupuk. Bila karena sesuatu sebab, jumlah ion NH4+ dari dalam larutan berkurang atau Ca2+ dalam larutan bertambah maka kesetimbangan beralih ke kiri.
64
terlindih, sedangkan ion Mg2+ , K+ , Na2+ terlindih juga, tetapi dengan kecepatan lebih lambat. Dengan demikian terjadi pelepasan atau perlindihan kation dari misel di daerah basah (humida) atau pemiskinan kation-kation yang menjurus kepada pembentukan liat jenuh ion H+ atau liat masam.
Hx Caz
+ Z Ca2+ Hx + 2 z H+
My My
Tanah yang diberi kapur umumnya adalah tanah yang banyak menjerap ion H+ selain kation-kation lain. Bila di kapur maka ion H+ akan ditukar dengan ion Ca2+. Sebelum tercapai kesetimbangan maka reaksi ke kanan terjadi. Pada contoh tersebut ion H+ dijerap masih bersisa setelah kesetimbangan tercapai.
Pada pemberian pupuk KCl akan terjadi reaksi :
Pada reaksi itu ion K+ akan menggantikan kation-kation pada misel dan kation tersebut dengan Cl- membentuk garam-garam larut yang mungkin dapat diserap tanaman atau hilang terlindih. Ion-ion K+ akan dijerap, untuk sementara akan terhindar dari pelindihan sampai akhirnya ditukarkan lagi dengan kation lain dan langsung atau setelah menjadi ion-ion dalam larutan tanah diserap tanaman. Dengan demikian maka pemupukan akan lebih mangkus bila tidak terjadi reaksi pertukaran.
1. Kapasitas Tukar Kation (KTK = Cation Exchange Capacity) Misel
Misel
65
Kapasitas tukar kation (KTK) suatu tanah dapat didefinisikan sebagai suatu kemampuan koloid tanah menjerap dan mempertukarkan kation. Kemampuan ini dapat dinyatakan dalam miliekuivalen per 100 gram tanah. Suatu miliekuivalen atau satu mili setara adalah asa dengan satu miligram hidrogen atau sejumlah ion lain yang dapat bereaksi atau menggantikan ion hidrogen tersebut pada misel. Walaupun demikian kadang-kadang USDA bagian survei tanah menggunakan sebagai me/100 g liat. Akan tetapi pada umumnya penentuan KTK adalah untuk semua kation yang dapat dipertukarkan, sehingga KTK = jumlah atau total mili ekuivalen kation yang dapat dipertukarkan per 100 gram tanah (Tan, 1982). Menurut Bolt et al., (1976) dalam Tan (1982) bahwa batasan tersebut masih memerlukan sedikit pembetulan, karena jerapan kation yang sebenarnya tidak boleh diikuti oleh anion. Akan tetapi kadang-kadang ion bebas dapat mengikutsertakan anion dalam proses tersebut. Oleh karena itu untuk mendapatkan KTK yang tepat, maka ion-ion yang ikut serta harus dikurangi. Misalnya dalam penentuan kation dan anion yang dapat dipertukarkan didapat hasil sebagai berikut :
Kation, me/100g Anion,
me/100g
Na+ = 5,0 Cl- = 0,8
K+ = 5,0 HCO3- = 0,2
Ca2+ = 10,0
Mg2+ = 10,0 Jumlah = 1,0
H+ = 5,0
Jumlah = 35,0
Kapasitas tukar kation menurut Bolt et al., (1976) adalah :
KTK = jumlah kation dapat dipertukarkan – jumlah anion dapat dipertukarkan.