SKRIPSI
GAMBARAN HISTOPATOLOGI VAGINA MENCIT
(Mus
musculus)
YANG DI INFEKSI
Toxoplasma gondii
SECARA
INTRAVAGINA
i
Oleh :
ADITYA BAYU SURYANTO
NIM 061111189
FAKULTAS KEDOKTERAN HEWAN
UNIVERSITAS AIRLANGGA
ii
iv
Telah dinilai pada Seminar Hasil Penelitian Tanggal : 14 Juli 2015
KOMISI PENILAI SEMINAR HASIL PENELITIAN
Ketua : Dr. Mufasirin, drh., M. Si. Sekretaris : Arimbi, drh., M.Kes.
Anggota : Prof. Dr. Lucia Tri Suwanti, drh., M.P. Pembimbing I : Prof. Dr. Imam Mustofa, drh., M.Kes. Pembimbing II : Julien Soepraptini, drh., SU.
vi
HISTOPATHOLOGY DESCRIPTION OF VAGINA MICE (Mus musculus) IN THE INFECTION by Toxoplasma gondii INTRAVAGINAL
Aditya Bayu Suryanto
ABSTRACT
The aim of this research is to determine T. gondii infection intravaginal in mice (Mus musculus). Experimental animals used in study were eighteen mice age 2-3 mounth
with body weight 20-25 grams. Experimental animals were divided into two groups: mice in first group is given NaCl for control group, and second group was infected by tachyzoites of T. gondii 1x103 by intravagina. Eight days after experiment, mice
sacrificed and vagina of all mice were taken for vagina histopathology preparations, were made for further observation. Each of the vagina of mice processed by Hematoxylin Eosin staining method. The data’s of observation were used descriptivy. This research showed that vagina mice infected by tachyzoites of T. gondii
intravagina could be find erotion of the stratum corneum vagina, inflamatory cell, and hiperplation vagina mucosa. Base on the result showed that the infection of T. gondii
tachyzoites cause pathological changes such as erosion , infiltration of inflamatory cells , and hiperplation.
Keywords: Toxoplasma gondii, vagina histology, erotion epitel, inflamatory cell,
hiperplation.
Puji syukur Alhamdulilah penulis panjatkan kehadirat Allah SWT, atas segala limpahan rahmat taufiq dan hidayah-Nya sehingga penulis dapat menyusun proposal penelitian sebagai salah satu syarat untuk mengajukan penelitian. Sholawat serta salam semoga tercurahkan kepada junjungan kita yakni Nabi Muhammad SAW beserta keluarga dan sahabatnya yang telah mengawali upaya menegakkan cita-cita Islam di muka bumi ini.
Penulis menyadari banyak pihak yang telah berpatisipasi dan membantu dalam menyusun skripsi dengan judul “GAMBARAN HISTOPATOLOGI VAGINA MENCIT (Mus musculus) YANG DI INFEKSI Toxoplasma gondii SECARA INTRAVAGINA”. Untuk itu, iringan doa dan ucapan terima kasih yang sebesar-besarnya penulis sampaikan, utama kepada :
Prof. Hj. Romziah Sidik, Ph.D., Drh., selaku Dekan Fakultas Kedokteran Hewan Universitas Airlangga Surabaya atas kesempatan untuk mengikuti pendidikan di Fakultas Kedokteran Hewan.
Prof. Dr. Imam Mustofa, drh., M.Kes selaku dosen pembimbing pertama dan Julien Soepraptini,drh.,SU selaku dosen pembimbing kedua atas semua arahan, bimbingan, bantuan, dorongan serta kesabarannya yang telah diberikan kepada penulis selama penulisan skripsi.
Ibu Sri Mumpuni, drh., M. Kes selaku dosen wali dan seluruh bapak dan ibu dosen Fakultas Kedokteran Hewan Universitas Airlangga Surabaya penulis yang telah membantu dan memberikan ilmu pengetahuan yang sangat bermanfaat pada penulis.
viii
Fakultas Kedokteran Hewan beserta seluruh stafnya atas segala fasilitas yang diberikan kepada penulis.
Terimakasih juga buat teman-teman kelompok penelitian Toxoplasma, Vonny Prasetya
Irgantara, Tutuk Wahyuningtyas, Dimas Fajar Subhan, Febri Putra Aditya, Frisca Trisna Rosandy, Desty Renata, Murtiningsih,Rossianawati,Maharani Yuliastina Chandra Puspita.
Seluruh keluarga besar saya, Papa, Mama dan Kakakku yang tercinta darinya kuperoleh sebuah perjuangan ketulusan dan keteguhan hati. Terimakasih banyak atas bantuan do’a yang menemaniku sepanjang waktu.
Kepada Roselia Yuliani Permatasari terimakasih banyak sudah menemani, membantu dan memotivasi saya dalam penyusunan skripsi ini. Juga sahabat-sahabat tercinta saya Karinadintha Marsya Ramadhani, Faiq Mudaffar, Achmad Firdaus Firmansyah dan teman-teman kelas B 2011 tercinta terimakasih sudah memberi masukan dan semangat untuk penyusunan skripsi ini. Semua teman-teman angkatan 2011 dan teman–teman kuliah di Fakultas Kedokteran Hewan Universitas Airlangga terima kasih atas dukungan serta persahabatan yang terjalin dan semua pihak yang tidak disebutkan tetapi sangat membantu dalam proses penyusunan skripsi.
Penulis juga menyadari bahwa mungkin saja terdapat kesalahan dan kekurangan pada skripsi ini, untuk itu mohon kritik dan saran yang konstruktif demi perbaikan di masa mendatang. Semoga karya ilmiah ini dapat bermanfaat bagi penulis khususnya dan semua pihak yang membutuhkan.
Surabaya, 2015
Penulis
x
3.3.4 Pengambilan organ untuk pembuatan preparat histopatologi………. 24
4.1 Infeksi Toxoplasma gondii pada vagina mencit intravagina (Mus musculus) secaraintravagina……….. 26
4.2 Gambaran Histopatologi Vagina Mencit (Mus musculus) Setelah Diinfeksi Toxoplasma gondii Secara Intravagina….. 28
BAB 5 PEMBAHASAN ……….. 30
RINGKASAN ……… 37
DAFTAR PUSTAKA ……….... 39
xii
DAFTAR SINGKATAN DAN ARTI LAMBANG
T. gondii : Toxoplasma gondii
µm : Mikrometer
PCR : Polymerase Chain Reaction ad libitum : Secukupnya
DNA : Deoxyribose-Nucleic Acid
DAFTAR GAMBAR
Halaman
Gambar
2.1 Takizoit T. gondii stadium takizoit (kiri) dan bradizoit (kanan).
dengan mikroskop electron ……… 8
2.2 Kista T. gondii pada jaringan otak mencit……….. 9
2.3 Ookista T.gondii……… 10
2.4 Siklus Hidup T. gondii ……….. 12
2.5 Perubahan epitel vagina mencit selama siklus estrus ……… 17
2.6 Histologi vagina……….……… 19
2.7 Gambaran histologi normal vagina……… 20
3.1 Skema kerangka operasional penelitian……….. 25
4.1 Lamina propria vagina mencit…….……….. 27
xiv
DAFTAR LAMPIRAN
Lampiran Hal
1. Prosedur Pembuatan Preparat Histopatologi ……… 43
2. Skema Pembuatan Preparat Histopatologi ……… 47
3. Skema Pewarnaan Haematoxylin Eosin ……….... 48
4. Menghitung dosis 1x 103………. 49
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Toksoplasmosis adalah suatu penyakit yang disebabkan protozoa Toxoplasma
gondii. Toksoplasmosis adalah salah satu penyakit zoonosis yang mendapat banyak
perhatian dunia kesehatan saat ini, mengingat dampak yang ditimbulkan terutama pada manusia. Infeksi T. gondii pada wanita hamil atau ternak bunting dapat
mengakibatkan reasorbsi fetus, abortus, lahir mati, kematian bayi dan kelainan kongenital berupa retadarsi mental, kelainan mata ringan sampai buta mata dan hidrosefalus (Suwanti, 2005).
Dalam Suwanti (2005), kerugian ekonomis akibat toksoplasmosis meliputi kehilangan janin, biaya perawatan, biaya pendidikan penderita dan biaya pengobatan kelainan mata, sedangkan pada hewan kerugian dapat berupa penurunan produktivitas akibat gangguan sistem reproduksi.
Toxoplasma gondii dapat menyerang semua organ dan jaringan induk semang
seperti pada jaringan hati, limpa, sumsum tulang, paru-paru, otak, ginjal, otot, kelenjar limfe, mata dan jantung . Kejadian dan dampak infeksi T. gondii pada hewan
Toksoplasmosis mulai diteliti oleh Durfee di Indonesia sejak tahun 1971 sampai 1972 yang dilaporkan pada tahun 1976 (Sasmita, 2006). Diperkirakan 30-60% penduduk dunia terinfeksi oleh T. gondii (Hendri, 2008). Menurut Rasmaliah (2003),
infeksi ini tersebar di seluruh dunia, dimana manusia berperan sebagai induk semang antara, kucing dan famili Felidae lainnya merupakan induk semang definitif. Angka kejadian toksoplasmosis di Indonesia berdasarkan uji serologis, pada manusia adalah 2-63%, pada kucing 35-73%, babi 11-36%, kambing 11-61%, anjing 75% dan pada ternak lain kurang dari 10% (Gandahusada dkk, 2003).
Predileksi T. gondii ada di semua tipe sel dan setelah empat hari infeksi T.
gondii telah menyebar di semua jaringan tubuh (Dubey, 2002). Bentuk lesi jaringan
akibat T. gondii dapat berbeda berdasarkan perbedaan organ. Bentuk lesi tersebut
berupa gambaran peradangan granulomatosa, pembentukan kista, nekrosis difusa dan
non suppuratif pada otak, nekrosis koagulatif dan hipertrofi limfonodul pada organ
limfatik, serta nekrosis koagulatif dan hipertrofi limfonodul pada organ limfatik, serta nekrosis fokalis pada myocardium dan myometrium (Sasmita, 2006).
Jalur penularan toksoplasmosis akibat T. gondii bisa terjadi saat proses
inseminasi buatan pada kambing dengan menggunakan semen yang mengandung stadium takizoit T. gondii (Diogo et al., 2013). Penelitian lain meyebutkan bahwa infeksi T. gondii juga terjadi pada semen mencit, kemudian mencit jantan yang
terinfeksi T. gondii tersebut dikawinkan dengan mencit betina dan didapatkan bahwa
mencit betina tersebut juga terinfeksi T. gondii (Dalimi et al., 2013), dari penelitian
tersebut dapat diasumsikan bahwa jalur penularan toksoplasmosis tidak hanya
melalui inang perantara, tetapi juga bisa melalui perkawinan alam atau sejenisnya.
Kerusakan jaringan akibat infeksi takizoit Toxoplasma gondii semakin lama semakin meluas, hal ini dikarenakan kecepatan replikasi takizoit yang sangat cepat
dibandingkan kemampuan sel untuk bermitosis. Takizoit dapat berkembang menjadi
64-128 takizoit baru per vakuola dalam sel 24 sampai dengan 48 jam pasca infeksi,
terjadinya disintegrasi struktur dan hancurnya sel yg berakibat pada kematian sel
diikuti dengan keluarnya seluruh komponen seluler (Subekti dkk, 2006).
Berdasarkan latar belakang diatas, penelitian ini dilakukan untuk mengetahui
perubahan histopatologi vagina pada mencit yang diinfeksi Toxoplasma gondii
stadium takizoit secara intravagina. Dampak infeksi T. gondii stadium takizoit secara
intravagina terhadap vagina mencit (Mus musculus) belum banyak dilaporkan. Dan sejauh ini penelitian tentang gambaran histopatologi belum pernah dilakukan dan
kepentingan penularan intravagina.
1.2 Rumusan Masalah
1). Apakah vagina mencit dapat terinfeksi takizoit T. gondii secara
intravagina ?
2). Bagaimana gambaran histopatologi vagina mencit yang sudah diinfeksi T.
1.3 Landasan Teori
Toxoplasma gondii mempunyai tiga bentuk stadium antara lain takizoit, kista
jaringan dan ookista. Stadium takizoit merupakan salah satu stadium infektif yang ditemukan selama infeksi akut (Soedarto, 2008). Stadium takizoit merupakan stadium multiplikasi, perkembangannya sangat cepat dan dapat ditemukan pada stadium akut (Suwanti dkk, 1999).
Toxoplasma gondii bersifat intraseluler obligat sehingga memerlukan habitat
intraseluler untuk hidup dan berkembang biak. Predileksi ada di semua tipe sel dan empat hari pasca diinfeksi parasit telah menyebar di semua jaringan tubuh (Dubey, 2002). T. gondii dapat menginfeksi segala macam tipe sel organ dan jaringan hospes.
Nekrosis sel yang ditimbulkan oleh T. gondii dapat ditemukan di dalam paru, hati,
limpa, dan ginjal. Pada organ hati dan limpa dapat dijumpai dalam sel makrofag, kadang-kadang dalam organ limpa T. gondii ditemukan dalam sel reticulum (Subekti
dkk, 2006).
Penyebaran takizoit sampai pada organ yang lain disebabkan oleh dua faktor, pertama gerakan aktif dari takizoit dan kedua gerakan pasif dengan memanfaatkan leukosit yang menyebar ke berbagai jaringan melalui darah (Subekti dkk, 2006).
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui gambaran histopatologi vagina
mencit yang diinfeksi T. gondii stadium takizoit secara intravagina dan sebagai
informasi mengenai jalur penularan toksoplasmosis.
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat mengetahui perubahan histopatologi
yang terjadi pada vagina mencit akibat infeksi T. gondii stadium takizoit secara
intravagina sehingga dapat memberikan informasi ilmiah mengenai jalur penularan
dan kerusakan vagina akibat infeksi takizoit T. gondii secara histopatologi.
1.6 Hipotesis
Infeksi T. gondii secara intravagina pada mencit dapat menyebabkan
6 BAB 2
TINJAUAN PUSTAKA
2.1 Toxoplasma gondii
Toxoplasma berasal dari bahasa Yunani yaitu kata toxon yang artinya busur
(bow) yang mengacu pada bentuk sabit (crescent shape) dari takizoit. Hal ini menjadi
dasar dari bahasa latin yaitu toxicum yang berarti racun. Adapun nama gondii berasal
dari kata Ctenodactylus gondii, seekor rodensia dari Afrika Utara dimana parasit
tersebut untuk pertama kali diisolasi (Black and Boothroyd, 2000).
Toxoplasma gondii adalah parasit bersel tunggal, berbentuk seperti bulan
sabit, dengan salah satu ujung runcing dan ujung lain bulat yang hidup dan berkembang biak di dalam host (Yowani dkk, 2007). Parasit ini mempunyai tiga bentuk infektif yaitu, takizoit yang terdapat dalam cairan tubuh, bentuk bradizoit (kista) yang terdapat di dalam jaringan tubuh seperti paru, jantung, otot bergaris, otak dan bentuk ookista yang akan bersporulasi dan terdapat di dalam tinja kucing (Iskandar, 2006).
Host parasit ini adalah kucing dan hewan sejenisnya (Felidae). Secara alami
invasi parasit umumnya terjadi di usus, dan kemudian akan memasuki sel. Parasit berkembang biak di dalam sel host, sehingga menyebabkan sel inang pecah dan parasit yang baru keluar dari sel dan masuk ke dalam sel yang lain di sekitar yang menyebabkan kerusakan jaringan yang lebih luas (Zhao et al., 2009).
Toxoplasma gondii adalah hewan bersel satu yang disebut protozoa. Protozoa
ini merupakan parasit yang menyerang sel berinti, manusia dan mamalia lain dapat menjadi inang perantara. Manusia terinfeksi T. gondii dengan cara memakan
makanan yang terkontaminasi oleh kista di dalam daging yang kurang matang, makanan sayuran atau dari minum susu. Manusia dapat terinfeksi dengan ookista T.
gondii ketika membersihkan kandang kucing. Ibu hamil dan janin beresiko besar
terinfeksi T. gondii. Parasit ini dapat hidup pada mamalia dan burung, tetapi
perkembangbiakan secara seksual hanya terjadi di dalam tubuh kucing yang merupakan host definitif(Zhao et al., 2009).
2.1.1 Klasifikasi Toxoplasma gondi
Toxoplasma gondii dalam klasifikasinya termasuk kelas sprozoa, karena
berkembang biak secara seksual dan aseksual yang terjadi secara bergantian. Menurut Levine (1990) klasifikasi parasit sebagai berikut :
2.1.2 Morfologi T. gondii
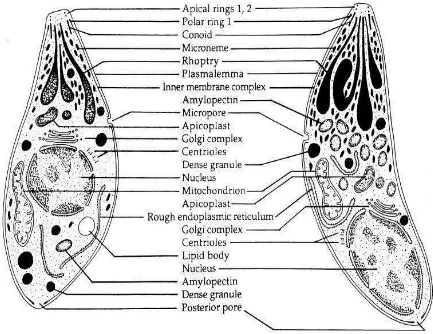
Toxoplasma gondii merupakan protozoa intraseluler obligat, terdapat dalam
tiga bentuk perkembangan yaitu takizoit, kista dan ookista. Bentuk takizoit menyerupai bulan sabit dengan ujung yang runcing dan ujung yang lain tumpul. Ukuran panjang 4-8 mikron, lebar 2-4 mikron dan mempunyai selaput sel, satu inti terletak di tengah bulan sabit dan beberapa organel lain seperti mitokondria, ribosom,
reticulum endoplasmic dan badan golgi (Sasmita, 2006).
Gambar 2.1 T. gondii stadium takizoit (kiri) dan stadium bradizoit (kanan).
Dengan mikroskop elektron (Dubey et al., 1998).
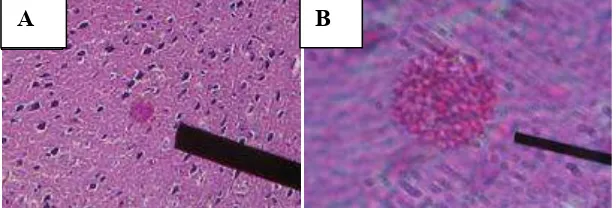
Kista jaringan dibentuk di dalam sel host bila takizoit yang membelah telah membentuk dinding. Ukuran kista bervariasi, ada yang berukuran kecil hanya berisi beberapa bradizoit dan ada yang berukuran 200 mikron berisi kira-kira 3000 bradizoit. Kista dalam tubuh host dapat ditemukan seumur hidup terutama di otak, otot jantung, dan otot bergaris. Di otak bentuk kista lonjong atau bulat, tetapi di dalam otot bentuk kista mengikuti bentuk sel otot (Sutanto dkk, 2008).
Gambar 2.2. Kista T. gondii pada jaringan otak mencit
A = Perbesaran 100X, B = perbesaran 1000X (Mufasirin dan Suwanti., 2008)
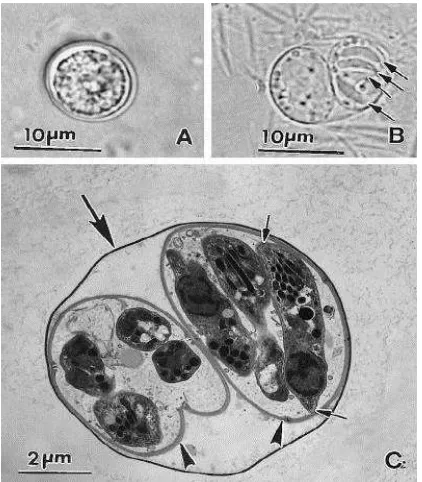
Dalam epitel usus halus kucing berlangsung daur aseksual dan daur seksual yang menghasilkan ookista yang dikeluarkan bersama feses. Ookista yang bentuknya bundar dengan ukuran 12,5 mikron menghasilkan 2 sporokista yang masing-masing mengandung 4 sporozoit (Sutanto dkk, 2008).
Gambar 2.3. Ookista T.gondii (Dubey et al., 1998)
A = Ookista yang belum bersporulasi
B = Ookista yang bersporulasi dengan 4 sporozoit C = Ookista bersporulasi dilihat dengan electron
micrograph
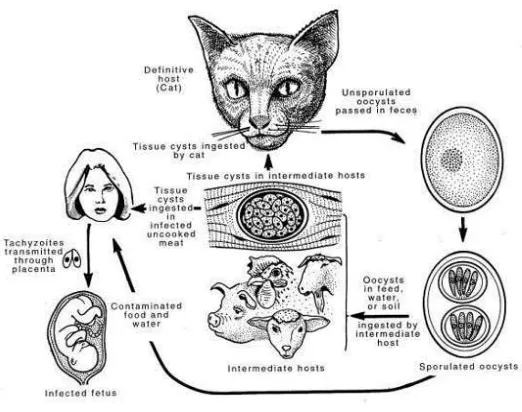
2.1.3 Siklus hidup T. gondii
Infeksi dimulai dengan tertelannya ookista dari feses kucing atau kista jaringan yang tertelan bersama makanan. Ookista yang masuk ke dalam usus, akibat enzim tripsin dan HCl serta gerakan peristaltik usus maka ookista pecah mengeluarkan sporozoit, sedangkan jika kista jaringan akan mengeluarkan bradizoit. Sporozoit ataupun bradizoit akan menembus sel epitel usus dan berproliferasi secara aseksual (skizogoni) menjadi skizon yang berisi banyak merozoit. Hasil fertilisasi makrogamet dan mikrogamet berupa zigot disebut ookista. Selanjutnya ookista akan dilepas bersamaan dengan feses kucing dan ookista akan menjadi infektif bila telah
mengalami sporulasi di luar tubuh host. Waktu yang diperlukan mulai dari parasit masuk ke tubuh host sampai keluar berupa ookista tergantung pada bentuk parasit yang tertelan, jika yang tertelan ookista atau takizoit maka waktu infeksi selama kurang lebih 21-40 hari, sedangkan jika yang tertelan kista jaringan maka waktu yang dibutuhkan sekitar 3-6 hari (Hiswani, 2003).
Pada stadium takizoit terjadi perkembangan endodiogeni dimana sel induk membelah menjadi dua yang hasil pembelahannya itu memiliki bentuk yang sama dengan sel induk. Predileksi parasit pada stadium ini di semua tipe sel jaringan dan dapat bertahan hidup membentuk dalam vakuola parasitiforosa serta mengakibatkan sel host pecah lalu takizoit akan menginfeksi sel yang baru. Takizoit menginfeksi semua organ melalui peredaran darah dan cairan limfe. Organ yang pertama kali terserang yaitu limfonodus mesenterika, hati, paru-paru, lien, otak dan jaringan lain. Bentuk takizoit akan berubah menjadi bradizoit apabila sistem kekebalan tubuh telah menghambat perkembangan takizoit tersebut. Secara perlahan bradizoit menjadi bentuk kista dan menyebabkan infeksi kronik pada hospes (Dubey et al., 1998).
Kucing yang terinfeksi T. gondii dalam sekali eksresi akan mengeluarkan
jutaan ookista. Bila ookista ini tertelan oleh host perantara seperti manusia, sapi, kambing atau kucing maka pada berbagai jaringan host perantara akan dibentuk kelompok trofozoit yang membelah secara aktif. Pada host perantara tidak dibentuk stadium seksual tetapi dibentuk stadium istirahat yaitu kista jaringan. Bila kucing sebagai hospes definitif makan host perantara yang terinfeksi maka berbagai stadium seksual di dalam epitel usus muda akan terbentuk lagi. Jika hospes perantara yang dimakan kucing mengandung kista T. gondii, maka masa prepaten 2-3 hari. Bila
ookista tertelan langsung oleh kucing, maka masa prepatennya 20-24 hari sehingga kucing lebih mudah terinfeksi oleh kista dari pada oleh ookista (Cox, 1982 ; Levine, 1990).
Gambar 2.4. Siklus Hidup T. gondii (Dubey et al., 1998)
2.1.4 Penularan T. gondii
Toxoplasma gondii ditularkan dengan melalui makanan atau air minum yang
tercampur stadium infektif yaitu takizoit, kista dan ookista. Infeksi pada manusia, hewan dan unggas disebabkan oleh mengkonsumsi daging kurang masak yang terinfeksi takizoit atau menelan bentuk bradizoit, mengkonsumsi sayur, buah serta tercemar ookista yang berasal dari feses kucing yang terinfeksi dan secara transplasental dari ibu yang terinfeksi selama masa kehamilan. Tikus dan burung sebagai host perantara yang merupakan binatang buruan kucing serta jumlah vektor seperti kecoa dan lalat yang dapat memindahkan ookista dari feses kucing ke makanan. Ternak domba, kambing, sapi, babi, ayam dan kuda terinfeksi T. gondii
karena pakan dan air minum tercemar ookista dari feses kucing (Nelson dan Couto, 2003; Hanafiah dkk, 2009; Seitz, 2009).
Kucing adalah host definitif T. gondii karena dapat berkembang biak secara
seksual maupun aseksual di dalam tubuh manusia, unggas atau hewan ternak lain sebagai host perantara, parasit ini berkembang biak secara aseksual (Kasper, 2001). Infeksi juga dapat terjadi di laboratorium, yaitu peneliti yang bekerja dengan hewan percobaan yang terinfeksi T. gondii atau melalui jarum suntik dan alat laboratorium
lain yang terkontaminasi T. gondii (Hiswani, 2003).
Penularan Toksoplasmosis pada kucing terjadi karena memangsa tikus atau daging mentah dari unggas maupun mamalia yang terinfeksi T. gondii. Ookista dalam
terjadi secara vertical melewati plasenta dari induk ke janin sewaktu dalam kandungan atau diperoleh setelah lahir (Robert dan Janovy, 2000).
2.1.5 Diagnosis infeksi T. gondi
Diagnosis memiliki arti penting dalam hal penatalaksaan pasien karena pengobatan memerlukan waktu lama, biaya dan kemungkinan efek toksik pada inang. Pengobatan toksoplasmosis sering tidak memuaskan, karena infeksi terdeteksi pada stadium yang sudah melanjut, padahal salah satu unsur keberhasilan pengobatan toksoplasmosis terletak pada seberapa dini infeksi terdeteksi (Robert dan Janovy, 2000 ; Montoya dan Liesenfeld, 2004).
Diagnosis molekuler dengan teknik Polymerase Chain Reaction (PCR) untuk
deteksi asam nukleat Deoxyribose-Nucleic Acid (DNA), banyak digunakan pada
toksoplasmosis konginetal dan individu immunocompromised karena cukup sensitif
dan spesifik . Selain menggunakan PCR untuk deteksi asam nukleat Toksoplasmosis, hibridasi dot blot dengan probe yang spesifik juga dapat digunakan, karena teknik ini
sederhana dan bisa diterapkan pada sejumlah besar sampel (Robert dan Janovy, 2000 ; Montoya dan Liesenfeld, 2004).
2.1.6 Pencegahan dan pengobatan T. gondii
Pada manusia terapi untuk penyakit ini membutuhkan biaya sangat mahal. Pada ternak berdampak pada kerugian ekonomi karena penurunan produksi. Pemberian obat seperti sulfonamide dan pyrimethamine dapat membunuh T. gondii
pada stadium takizoit, tetapi pengobatan tersebut tidak efektif pada stadium bradizoit. Selain itu, obat tersebut bersifat toksik sehingga tidak disarankan untuk digunakan
dalam jangka waktu lama. Pencegahan dengan program vaksinasi belum sepenuhnya memberikan perlindungan (Radke, 2007).
Dampak akibat Toksoplasmosis baik pada hewan maupun manusia sangat merugikan, sehingga diperlukan berbagai upaya pencegahan yaitu tidak mengkonsumsi daging mentah atau kurang matang dan menghindari agen pembawa
T. gondii yang terkontaminasi ookista. Daging dimasak dengan suhu 65 ºC selama 20
menit atau dibekukan pada suhu -12 ºC selama 3 hari, dan mencuci tangan dengan sabun setelah berkebun atau kontak dengan tanah. Sayur dan buah dikupas dan dicuci bersih sebelum dikonsumsi. Peralatan yang kontak langsung dengan daging mentah, harus dicuci dengan air panas atau air sabun. Darah yang digunakan untuk transfusi harus diskrining terhadap T. gondii (Gandahusada dkk, 2000).
Agen penyebab infeksi (ookista), hanya terbentuk pada inang defintif (kucing), oleh sebab itu kucing piara sebaiknya hanya diberi makanan komersial (makanan matang). Kucing piara jangan dibiarkan memangsa hewan buruan, karena walaupun hanya satu kista termakan, kucing dapat melepaskan berjuta-juta ookista bersama feses untuk mencemari lingkungan. Kotoran kucing sebaiknya dibersihkan setiap hari agar ookista tidak sempat mengalami sporulasi (Robert dan Janovy, 2000 ; Nelson dan Couto, 2003).
mematikan kista T. gondii pada mencit. Obat Toksoplasmosis untuk manusia pada
umumnya dapat digunakan juga pada hewan (Gandahusada dkk, 2000).
2.2 Mencit
2.2.1 Klasifikasi mencit
Mencit termasuk famili Muridae dari kelompok mamalia (hewan menyusui).
Para ahli zoologi (ilmu hewan) menggolongkannya ke dalam ordo Rodensia (hewan yang mengerat), subordo Myomorpha, family Muridae, dan sub family Murinae. Menurut Jordan dan Verna (1980) klasifikasi mencit adalah sebagai berikut :
Kingdom : Animalia Phylum : Chordata Subphylum : Vertebrata Classic : Mammalia Subclassic : Theria Ordo : Rodentia Sub ordo : Myomorpha Famili : Muridae Sub family : Murinae Genus : Mus
Spesies : Mus musculus
Mencit atau Mus musculus bisa digunakan pada penelitian seperti ini karena
mencit memiliki fisiologis yang mirip dengan manusia serta mencit relatif tahan
terhadap suhu atau cuaca yang bervariasi sehingga lebih mudah dan tepat apabila digunakan sebagai hewan percobaan (Jordan dan Verna, 1980).
2.2.2 Vagina
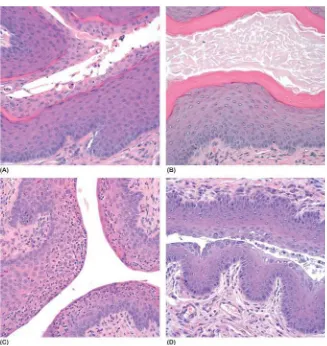
Gambar 2.5. Perubahan epitel vagina mencit selama siklus estrus. (A) proestrus, (B) Estrus, (C) Metestrus, (D) Diestrus. (Pewarnaan H.E; perbesaran 400x) (Treuting et al., 2012).
terdapat mukosa sekitar 10-13 sel tebal dan lapisan luar noda ringan dengan eosin, sedangkan lapisan granulosa menunjukkan peningkatan kornifikasi. Mitosis sering ditemukan, tetapi hanya sedikit leukosit yang tampak. (B) Dalam siklus estrus, terdapat mukosa 12 sel tebal. Lapisan berinti dangkal hilang, dan lapisan cornified dangkal. Mitosis menurun, dan leukosit tidak ada. (C) Dalam metestrus, lapisan cornified adalah delaminated, dan leukosit mulai muncul di bawah epitel. (D) Selama diestrus, terdapat mukosa 4-7 sel tebal. Epitel permukaan yang mucified, dan lendir, leukosit, dan desquamated sel yang ada(Treuting et al., 2012).
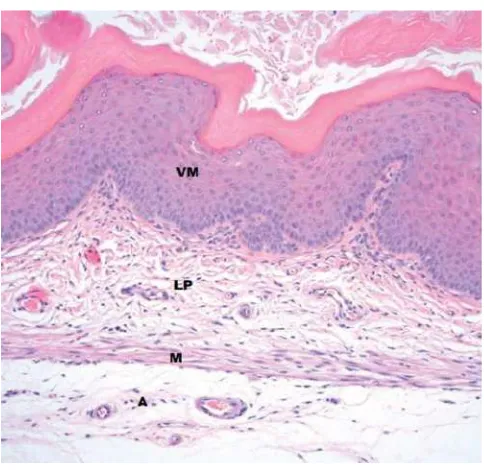
Gambar 2.6 Histologi vagina mencit, VM = Mukosa Vagina, LP = Lamina Propria, M = Muskularis, A= Adventitia. Mukosa Vagina (VM) mencit terdiri dari epitel skuamosa bertingkat dan dilipat ke ketinggian memanjang tanpa kelenjar. Itu morfologi perubahan epitel vagina selama tahapan yang berbeda dari siklus estrus. Lamina propria (LP) adalah berserat, dan Lapisan Muskularis (M) adalah dicampur tipis dengan jaringan ikat fibrosa yang signifikan. Adventitia (A) membentuk lapisan terluar. (Pewarnaan H.E; perbesaran 400x) (Treuting et al., 2012).
A B
C D
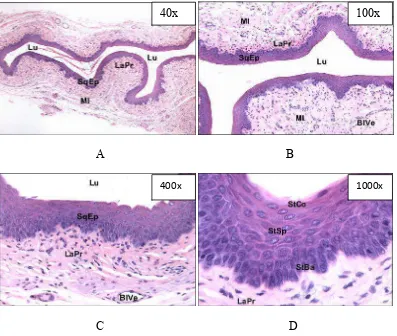
Gambar 2.7 Gambaran histologi normal vagina, Lu = Lumen, SqEp = Stratified squamous epithelium, LaPr = Lamina propria, Ml = Muscularis, BlVe = Blood Vessel, StCo = Stratum Corneum, StSp = Stratum Spinosum, StBa = Stratum Basale (Conti et al., 2004).
Perubahan epitel vagina diilustrasikan pada (Gambar 2.7). Vagina menghubungkan leher rahim ke luar. Epitel vagina dan serviks menyambung kecuali pada dinding lateral, dimana forniks vagina bentuknya lebih dalam (forniks vagina digambarkan dalam Serviks, gambar 2.7A dengan perbesaran 40X). Dinding vagina terdiri dari dalam ke luar, stratified epitel squamousa, mukosa dilipat tanpa kelenjar,
100x 40x
berserat lamina propria, sebuah lapisan muskularis tipis terdiri dari lingkaran dalam dan memanjang pada lapisan otot polos luar, dan adventitia. Perubahan morfologi epitel vagina hewan pengerat dalam menanggapi kadar hormon, yang bervariasi dalam tahap siklus estrus (Conti et al., 2004).
Semua mikrograf menggambarkan vagina di proestrus. Pada (gambar 2.7A) perbesaran 40x mikrograf menunjukkan berbagai lapisan vagina. Gambar perbesaran 100x, 400x, 1000x dan mikrograf menyajikan epitel skuamosa berlapis dan lamina propria dalam meningkatkan rinci. Gambar perbesaran 400X mikrograf menunjukkan pembuluh darah di lamina propria. Gambar perbesaran 1000X menampilkan berbagai lapisan epitel squamousa berlapis (Conti et al., 2004).
BAB 3
MATERI DAN METODE
3.1 Tempat dan Waktu Penelitian
Penelitian dilakukan di Departemen Parasitologi Veteriner Laboratorium Protozoologi Fakultas Kedokteran Hewan Universitas Airlangga Surabaya dan dilakukan pada bulan Desember 2014. Pembuataan sediaan histopatologi vagina dilakukan di Laboratorium Patologi Veteriner Fakultas Kedokteran Hewan Universitas Airlangga Surabaya pada bulan Desember 2014 sampai Januari 2015.
3.2 Bahan dan Materi Penelitian
3.2.1. Bahan penelitian
Bahan histopatologi yang diperlukan dalam penelitian ini adalah vagina mencit, NaCl fisiologis, formalin 10%, Alkahol 70%, Alkohol 80%, Alkohol 96%, Alkohol asam, Aquades, Hematoxylin Eosin dan Xylol.
3.2.2 Alat penelitian
Alat yang di gunakan dalam penelitian ini terdiri dari kandang hewan coba untuk tempat pemeliharaan dari bak yang terbuat dari bahan plastik (40 cm x 30 cm) , kawat jala (40 cm x 30 cm) sebagai penutup, tempat pakan, tempat minum, spuit 1
ml, spuit 3 ml, mikropipet, sonde, microtube, Counting chamber
object glass, cover glass, masker, glove, papan seksi dari gabus, nampan sebagai
wadah, kertas label, pot saleb dan tutup sebagai tempat penyimpanan organ, kamera digital dan mikroskop cahaya.
3.2.3. Hewan coba
Hewan percobaan yang digunakan adalah mencit betina galur Balb-C dari PUSVETMA (Pusat Veteriner Farma) umur 2-3 bulan dengan berat badan rata-rata 20-25 gram sebanyak 18 ekor. Mencit dibagi menjadi dua kelompok perlakuan, masing-masing perlakuan terdapat sembilan ulangan ekor mencit. Besar sampel yang di gunakan ditentukan dengan rumus Federer dalam Kusriningrum (2008) :
Keterangan :
t : Jumlah perlakuan n : Jumlah ulangan
Dengan pertimbangan besar sampel berikut : t (n-1) ≥ 15
2 (n-1) ≥ 15 2n - 2 ≥ 15 2n ≥ 15 + 2
n = 17/2 n = 8,5 ~ 9
t (n-1) ≥ 15
3.3. Metode Penelitian
3.3.1. Persiapan hewan coba
Mencit betina yang berjumlah 18 ekor ini dibagi menjadi dua kelompok perlakuan, masing-masing perlakuan terdapat sembilan ulangan ekor mencit. Mencit diadaptasikan selama satu minggu, kandang diusahakan dalam keadaan bersih, diberi pakan pelet ayam dan minum secara ad libitum.
3.3.2. Tahap perbanyakan in vivo takizoit T. gondii
Isolat diperbanyak dengan cara dipasasekan ke mencit sehat. Mencit di injeksi secara intraperitoneal dosis injeksi 1x106 takizoit tiap mencit, sebanyak 0,3 ml takizoit dalam NaCl fisiologis ke tubuh mencit. Takizoit dipanen setelah mencit menunjukkan gejala : lemah, bulu berdiri dan nafas tersengal-sengal. Mencit dikorbankan dengan cara dislokasi cervicalis kulit di bagian abdomen dibuka, ke dalam cavum peritoneum mencit ditambahkan sebanyak 5 ml larutan NaCl fisiologis dan cairan diambil kembali. Takizoit hasil panen digunakan untuk perlakuan (Suwanti, 2009).
3.3.3. Perlakuan hewan coba
Hewan coba dibagi dua kelompok perlakuan :
Kelompok P0: Mencit diberi NaCl fisiologis secara intravagina sebagai media kontrol.
Kelompok P1: Mencit diinfeksi 20 µl secara intravagina yang mengandung 1x103
3.3.4. Pengambilan organ untuk pembuatan preparat histopatologi
Untuk mengetahui infeksi yang terjadi maka delapan hari setelah infeksi, mencit langsung dikorbankan dan dibedah kemudian diseksi untuk memisahkan organ vagina dan dimasukkan ke dalam pot plastik tertutup yang berisi formalin 10%. Selanjutnya dilakukan pembuatan sediaan histopatologi. Cara pembuatan histopatologis dapat dilihat pada Lampiran 1.
3.3.5 Perubahan yang diamati
Pengamatan preparat vagina mencit menggunakan mikroskop cahaya dengan pembesaran 100x dan 1000x. Perbesaran 100x untuk melihat perubahan histopatologi pada vagina, sedangkan perbesaran 1000x untuk melihat bentukan takizoit T. gondii.
Perubahan histopatologi yang diamati meliputi Infiltrasi sel radang, Hiperplasia dan Erosi pada preparat vagina mencit.
3.4 Variabel Penelitian
3.4.1. Variabel bebas
Takizoit T. gondii yang diinfeksi secara intravagina. 3.4.2. Variabel tergantung
Perubahan gambaran histopatologi pada vagina mencit.
3.4.3 Variabel kendali
Jenis kelamin, umur, pakan, air minum, berat badan dan kandang mencit.
3.5 Analisis data
Perubahan histopatologi pada vagina disajikan secara deskriptif.
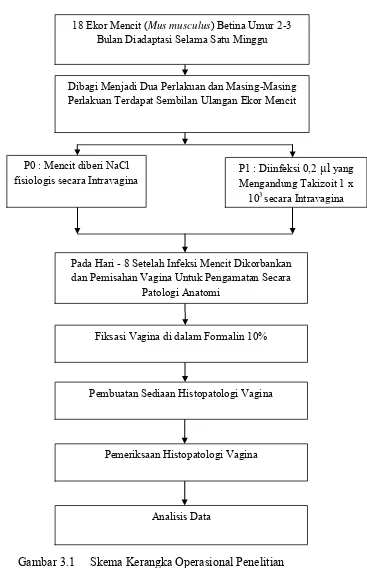
3.6 Kerangka Operasional Penelitian
18 Ekor Mencit (Mus musculus) Betina Umur 2-3 Bulan Diadaptasi Selama Satu Minggu
Dibagi Menjadi Dua Perlakuan dan Masing-Masing Perlakuan Terdapat Sembilan Ulangan Ekor Mencit
P0 : Mencit diberi NaCl
fisiologis secara Intravagina P1 : Diinfeksi 0,2Mengandung Takizoit 1 x µl yang 103 secara Intravagina
Pada Hari - 8 Setelah Infeksi Mencit Dikorbankan dan Pemisahan Vagina Untuk Pengamatan Secara
Patologi Anatomi
Pembuatan Sediaan Histopatologi Vagina
Pemeriksaan Histopatologi Vagina
Analisis Data
26 BAB 4
HASIL PENELITIAN
Data hasil pengamatan terhadap perubahan histopatologi vagina mencit setelah diinfeksi dengan T. gondii disajikan secara diskriptif. Pengamatan dilakukan
dengan mikroskop cahaya dengan dua skala pembesaran yang berbeda yaitu 100x dan 1000x. Berdasarkan hasil pengamatan, bentuk lesi histopatologi vagina mencit yang diinfeksi dengan takizoit T. gondii terdapat perubahan lesi histopatologi berupa
adanya erosi, infiltrasi sel radang dan hiperplasia.
4.1 Infeksi T. gondii pada vagina mencit secara intravagina
Toxoplasma gondii dapat menginfeksi melalui vagina. Pemeriksaan
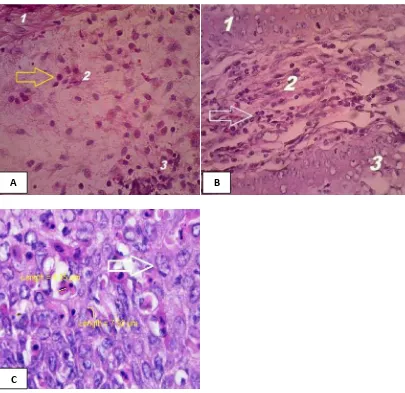
histopatologis seluruh lapangan pandang kelompok perlakuan banyak sekali didapatkan adanya sel radang pada lamina propria vagina dan bentukan takizoit T.
gondii. Gambar (4.1A dan 4.1B) lamina propria vagina mencit di bawah
menunjukkan bahwa perubahan antara kontrol dengan perlakuan yang diinfeksi takizoit T. gondii sangat berbeda, hal ini terlihat jelas pada perubahan infiltrasi sel
radang pada bagian lamina propria vagina mencit. Infiltrasi sel radang merupakan salah satu dari bentuk lesi paling sering ditemukan dengan presentase 88,88% (8-9 sampel).
Hasil pengamatan mikroskopis pada kelompok perlakuan juga ditemukan adanya beberapa bentukan takizoit T. gondii pada lamina propria vagina dengan besar
presentase 55,55% (5-9 sampel). Gambar (4.1C) dibawah menunjukkan lamina
propria vagina mencit bahwa ada perubahan antara kontrol dengan perlakuan yang diinfeksi takizoit T. gondii, hal ini terlihat jelas dengan ditemukan adanya bentukan
takizoit T. gondii pada perlakuan sedangkan pada kontrol tidak ada.
Gambar 4.1. Lamina propria vagina mencit kontrol (A) tampak normal (tanda panah kuning), perlakuan (B) ada infiltrasi sel radang (tanda panah putih) dan perlakuan (C) ada bentukan takizoit T. gondii (tanda panah
putih).(1) Epitel squamousa (2) Lamina propria (3) Lapisan muskularis. (Pewarnaan H.E; perbesaran 100x [A &B] dan perbesaran 1000x [C] ).
A B
4.2 Gambaran Histopatologi Vagina Mencit (Mus musculus) Setelah Diinfeksi Toxoplasma gondii Secara Intravagina
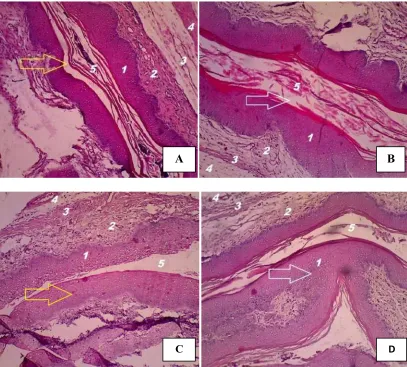
Perubahan histopatologi yang juga ditemukan pada kelompok perlakuan adalah erosi pada stratum corneum vagina. Erosi pada organ vagina mirip dengan erosi pada organ serviks karena kedua organ tersebut berdekatan tempatnya. Erosi merupakan bentuk lesi paling banyak ditemukan kedua setelah infiltrasi sel radang dengan frekuensi kejadian dengan presentase 88,75% (8-9 sampel) seperti gambar (4.2B).
Gambaran histopatologis lain yang ditemukan pada kelompok perlakuan adalah hiperplasia pada mukosa vagina. Gambaran hiperplasia ini pada kelompok perlakuan tidak banyak terjadi seperti gambaran sel radang dan erosi pada stratum corneum vagina. Gambar (4.2C dan 4.2D) dinding mukosa vagina mencit diatas menunjukkan bahwa perubahan antara kontrol dengan perlakuan yang diinfeksi takizoit T. gondii sangat berbeda hal ini terlihat jelas pada pembesaran mukosa vagina
yang terkena hiperplasia yaitu presentasenya sebesar 55,55% (5 dari 9 sampel).
Gambar 4.2. Mukosa vagina mencit setelah diinfeksi dengan Toxoplasma gondii
intravagina kontrol (A) tampak normal (tanda panah kuning) dan perlakuan (B) mengalami erosi pada stratum corneum vagina (tanda panah putih), kontrol (C) tampak normal (tanda panah kuning) dan perlakuan (D) mengalami hiperplasia pada mukosa vagina (tanda panah putih). (1) Mukosa vagina (2) Lamina propria (3) Muskularis (4) Adventitia (5) Lumen (Pewarnaan H.E; perbesaran 100x).
A B
30 BAB 5
PEMBAHASAN
Berdasarkan hasil pemeriksaan dan pengamatan mikroskopis yang telah dilakukan pada dua kelompok perlakuan yaitu kelompok kontrol disonde melalui intravagina dengan NaCl fisiologis, kelompok perlakuan disonde melalui intravagina dengan takizoit T. gondii dosis 1x103 didapatkan adanya perubahan lesi histopatologi
berupa infiltrasi sel radang pada lamina propria, hiperplasia pada mukosa vagina dan erosi pada startum corneum vagina.
5.1 Infeksi Toxoplasma gondii pada vagina mencit (Mus musculus) secara intravagina
Pemeriksaan histopatologis seluruh lapangan pandang kelompok perlakuan banyak didapatkan adanya sel radang pada lamina propria vagina. Pada penelitian ini gambaran infiltrasi sel radang tersebut nampak jelas teramati pada hampir semua vagina mencit yang diinfeksi yaitu dengan besar presentase 88,88% atau (8 dari 9 (Dorland, 2002). Rubor atau kemerahan pada organ yang mengalami infeksi secara
mikroskopis adalah suatu keadaan patologi yang diakibatkan oleh meningkatnya aliran dan retensi darah pada organ yang terinfeksi. Hampir keseluruhan dari preparat mengalami infiltrasi sel radang di setiap lapangan pandang. Pada vagina mencit perlakuan bagian lamina propria mengalami infiltrasi sel radang setelah di infeksi dengan T. gondii.
Penyebab terjadinya peradangan sangat banyak dan bervariasi, namun pada umumnya radang merupakan proses respon imun terhadap mikroorganisme yang menyebabkan infeksi (Romo, 2001). Tujuan dari adanya keradangan secara umum adalah untuk mengeluarkan, membuang dan menetralkan agen iritan. Komponen reaksi keradangan berupa plasma, sel darah dalam sirkulasi antara lain neutrofil, monosit, eosinofil, limfosit, basofil, platelet, komponen jaringan konektivus, fibroblas dan makrofag (Celloti dan Laufer, 2001). Hasil reaksi peradangan adalah netralisasi dan pembuangan agen penyerang, penghancuran jaringan nekrosis dan pembentukan perbaikan dan pemulihan pada jaringan tersebut (Arimbi dkk, 2013). Pada penelitian ini hampir seluruhnya pada kelompok perlakuan yang diinfeksi dengan takizoit T.gondii 1x103 terdapat adanya infiltrasi sel radang.
Hasil pengamatan mikroskopis pada kelompok perlakuan juga ditemukan adanya beberapa bentukan takizoit T. gondii pada lamina propria vagina dengan besar
presentase 55,55% (5-9 sampel). Dan 4 sampel yang tidak ditemukan takizoit T.
agak membulat dengan ukuran sekitar 4 sampai 8 mikron. Takizoit ini bersifat obligat intraseluler yang berkembang biak dalam sel secara endodiogeni. Percobaan secara in
vitro memperlihatkan bahwa satu takizoit akan memperbanyak diri berlipat ganda
melebihi pertumbuhan eksponensial setiap 6 sampai 8 jam. Takizoit akan menghancurkan sel untuk keluar setelah berkembang menjadi 64 sampai 128 takizoit baru pervakuola pada 24 sampai 48 jam pascainfeksi (Jerome et al., 1998 ; Black and
Boothroyd, 2000). Kecepatan replikasi takizoit yang demikian cepat dibanding kemampuan sel untuk bermitosis maka kerusakan yang terjadi semakin lama semakin berat dan meluas. Bila sel menjadi penuh dengan takizoit maka sel tersebut akan pecah dan takizoit akan keluar kemudian memasuki sel di sekitar atau terjadi fagositosis terhadap takizoit tersebut oleh makrofag (Gandahusada dkk, 2004).
5.2 Erosi dan Hiperplasia
Pengetahuan patogenesis yang ada dewasa ini menunjukkan bahwa pada dasarnya takizoit dapat menginfeksi hampir semua jenis sel berinti berbagai jenis hewan dan manusia bahkan juga insekta (Black and Boothroyd, 2000; Hakanson et
al., 2001). Walaupun demikian, terdapat beberapa jenis sel dan organ yang dominan
diinfeksi oleh takizoit. Dominasi sel dan jaringan yang diinfeksi dan jenis host. Bukti dominasi takizoit pada sel tertentu berasal dari penelitian in vivo (dalam tubuh
organisme) maupun in vitro (di luar tubuh organisme, misalnya pada kultur sel). Pada
sistem sirkulasi misalnya, di antara sel darah putih (leukosit) meskipun semua jenis sel dapat diinfeksi tetapi hanya beberapa yang paling dominan diinfeksi. Belum diketahui secara tepat alasan mengapa fenomena tersebut dapat terjadi. Komponen sel
darah putih adalah neutrofil, eosinofil, basofil, monosit dan limfosit. Monosit dalam darah akan berdiferensiasi menjadi makrofag dalam jaringan. Di antara sel tersebut, yang dominan diinfeksi secara berurutan sesuai dominansi adalah monosit (dan juga makrofag), neutrofil dan limfosit (Channon et al., 2000).
Apabila takizoit menginfeksi neutrofil maka kecepatan perkembangbiakannya menjadi menurun, tetapi setelah keluar dari neutrofil dan menginfeksi sel dan jaringan lain kecepatannya kembali seperti sediakala (Channon et al., 2000). Adapun
jaringan atau organ yang umumnya diinvasi pada ternak di antaranya adalah hati, ginjal, otak, otot skeletal, diafragma dan jantung (Dubey et al., 1998). Proporsi
masing-masing jaringan berbeda di antara beberapa jenis ternak. Pada infeksi intraperitoneal menggunakan mencit diketahui bahwa takizoit akan segera ditemukan dalam peredaran darah paling lama dua hari sejak infeksi (Mordue et al., 2001; Sibley
et al., 2002).
Percobaan lain menggunakan kelinci juga menunjukkan pola serupa. Pada infeksi intraperitoneal, intravena dan oral masing-masing menunjukkan kesamaan organ yang diinfeksi namun berbeda dalam hal tingkat kerusakannya (Haziroglu et
al., 2003) . Penyebaran takizoit sampai pada organ yang jauh disebabkan oleh dua
faktor, pertama gerakan aktif dari takizoit maupun gerakan pasif dengan memanfaatkan leukosit yang menyebar ke berbagai jaringan melalui aliran darah.
patogenik. Kejadian patologis ini terjadi pada hampir semua kelompok perlakuan dengan besar presentase 88,75% (8 dari 9 sampel). Erosi pada organ vagina mirip dengan erosi pada organ serviks karena kedua organ tersebut berdekatan tempat. Erosi ini bisa disebabkan adanya infeksi takizoit Toxoplasma gondii.
Gambaran histopatologi lain yang ditemukan pada kelompok perlakuan adalah hiperplasia pada mukosa vagina. Pada mencit kontrol tidak ditemukan hiperplasia, sedangkan pada vagina mencit perlakuan bagian mukosa vagina mengalami hiperplasia, yaitu dengan besar presentase 55,55% (5 dari 9 sampel). Dan 4 sampel yang tidak ditemukan hiperplasia karena pengaruh sistem imun tubuh mencit yang kuat sehingga takizoit tidak bisa menembus sel untuk berkembang biak dalam sel secara endodiogeni. Gambaran hiperplasia pada kelompok perlakuan tidak banyak terjadi seperti gambaran sel radang dan erosi epitel. Takizoit T. gondii dapat
menyebabkan hiperplasia, penyebaran ke berbagai organ dapat dideteksi paling lambat empat hari pasca infeksi (Sibley et al., 2002). Secara umum, organ yang
diinfeksi di antaranya adalah limpa, vagina, serviks, uterus, paru-paru, hati, otak dan kelenjar limfe mesenterik maupun perifer (Meyer et al., 2000; Mordue et al., 2001).
Hiperplasia ini terjadi karena adanya peningkatan jumlah sel dalam organ atau jaringan. Secara mikroskopis, ukuran sel masih normal, tetapi jumlahnya meningkat. Hiperplasia secara umum bersifat patologis, yang dapat berkembang menjadi kanker, dengan timbulnya proliferasi yang tidak terkendali. Proses hiperplasia biasanya terjadi secara reversibel, namun dalam beberapa kasus proses ini tetap terjadi setelah penghentian rangsangan, kondisi ini dapat memicu adanya perubahan yang mengarah
pada neoplasia. Peningkatan jumlah sel dalam organ ini menyebabkan adanya penebalan atau hiperplasia pada area epitel vagina (Arimbi dkk, 2013).
Perubahan histopatologi pada organ vagina mencit (Mus musculus) dikaitkan
dengan siklus estrus. Estrus berasal dari bahasa latin “oestrus” yang berarti “kegilaan” atau “gairah” dimana pada fase ini merupakan satu-satunya waktu dimana terjadi perubahan pada vagina yang memungkinkan terjadi perkawinan. Pengaruh musim dan iklim juga lebih kuat terhadap siklus estrus. Estrus kadang-kadang disebut “heat” (panas) karena pada saat tersebut, suhu tubuh betina meningkat. Panjang dan frekuensi siklus reproduksi pada masing-masing organisme berbeda. Pada tikus, siklus estrus berlangsung selama 5 hari. Tipe siklus birahi pada mencit (Mus
musculus) adalah poliestrus, dimana dalam setahun terjadi lebih dari dua kali masa
birahi. Siklus hewan ini berulang secara periodik dengan selang waktu 4 – 5 hari. Siklus estrus terjadi dalam empat fase, yaitu fase proestrus, estrus, metestrus dan diestrus (Zulfiati, 2003).
36 BAB 6
KESIMPULAN DAN SARAN
6.1 Kesimpulan
1). Vagina mencit dapat terinfeksi T. gondii ditandai dengan adanya sel
radang pada lamina propria dan keberadaan takizoit T. gondii.
2). Infeksi T. gondii melalui vagina ditandai adanya erosi pada stratum
corneum vagina dan hiperplasia pada mukosa vagina.
6.2 Saran
1). Perlu dilakukan penelitian lebih lanjut infeksi T. gondii menggunakan
sinkronisasi birahi dengan metode intravagina
2). Perlu dilakukan penelitian pada organ genital betina hewan lain.
RINGKASAN
ADITYA BAYU SURYANTO. Toxoplasma gondii merupakan parasit
protozoa intraseluler obligat yang dapat menginfeksi semua bangsa burung. Penyakit akibat infeksi Toxplasma gondii disebut toksoplasmosis. Secara umum, infeksi
Toxoplasma gondii bersifat asimtomatis, tetapi apabila menginfeksi wanita hamil atau
ternak bunting, akan mengakibatkan resorpsi fetus, abortus, lahir mati, kematian bayi, dan kelainan kongenital berupa retardasi mental, kelainan mata ringan sampai buta dan hydrocephalus.
Sampai saat ini, dampak Toxoplasma gondii organ sistem genitalia wanita
atau hewan betina dalam hal ini vagina belum banyak dilaporkan. Penelitian ini bertujuan untuk mengetahui pengaruh infeksi takizoit Toxoplasma gondii terhadap
organ genital betina pada mencit (Mus musculus).
Isolat diperbanyak dengan cara dipasasekan ke mencit sehat. Mencit di injeksi secara intraperitoneal dosis injeksi 1x106 takizoit tiap mencit, sebanyak 0,3 ml
takizoit dalam NaCl fisiologis ke tubuh mencit. Takizoit dipanen setelah mencit menunjukkan gejala : lemah, bulu berdiri dan nafas tersengal-sengal. Mencit dikorbankan dengan cara dibuka kulit di bagian abdomen. Ke dalam cavum peritoneum mencit ditambahkan sebanyak 5 ml larutan NaCl fisiologis dan cairan diambil kembali. Takizoit hasil panen digunakan untuk perlakuan.
ini. Delapan hari setelah infeksi, mencit dikorbankan dan dibedah kemudian diambil organ vagina. Vagina difiksasi dalam formalin 10% dan dibuat sediaan preparat histopatologi.
Hasil penelitian ini menunjukkan bahwa infeksi takizoit Toxoplasma gondii
menyebabkan perubahan patologi seperti erosi, infiltrasi sel radang, hiperplasi, organ terinfeksi (ditemukan takizoit pada organ).
DAFTAR PUSTAKA
Arimbi, A. Ajik, D. Roesno, P. Hani,V. Thomas, L. Djoko .2013. Buku Ajar Patologi Umum Veteriner. Airlangga University Press. Surabaya.
Black,M.W. and Boothroyd J.C.2000. Lytic cycle T. gondii. Micobiol. Rev. 64 :
607-623.
Celloti, F and Laufer, S., 2001, Inflammation, Healing and Repair Synopsis, J. Phar. Res., Vol. 43, No. 5, 2001.
Channon, J.Y., R.M. Seguin and L.H. Kasper. 2000. Differential infectivity and division of Toxoplasma gondii in human peripheral blood leukocytes.
Infect. Immun. 68: 4822 – 4826.
Cox, F.E.G., 1982. : Immunology. In: Modern Parasitology. A Text Book of Parasitology.Blackwell Scientifitic, Publications, London. (p.173).
Dalimi, A. and Abdoli, A. 2013. Toxoplasma gondii and Male Reproduction
Impairment: A new Aspect of Toxoplasmosis Research. Department of Parasitology, Faculty of Medical Sciences, Tarbiat Modares University. Diogo R. C. Wanderley F. S. Roberta L. F. Rinaldo A. M. 2013. Experimental
vaginal infection of goats with semen contaminated with the "CPG" strain of Toxoplasma gondii.Journal of Parasitology 99(4):610
Dorland, W. A. N. 2002. Kamus Kedokteran Dorland (Setiawan, A., Banni, A. P., Widjaja, A. C., Adji, A. S., Soegiarto, B., Kurniawan, D., dkk,
penerjemah). Jakarta: EGC.
Dubey, J. P, Lindsay and Speer, C. A. 1998. Structures of Toxoplasma gondii
Tachyzoites, Bradyzoites and Sporozoites and Biology and Development of Tissue Cysts. Clin Microbiol Rev. 11: 269-299
Dubey, J. P. 1999 . Toxoplasma gondii. http://www. Medmicrochapter84.htm
[08-11-2014].
Dubey, J. P. 2002. Review of Toxoplasmosis in Wild Birds Vet. Parasitol. 106: 121-153.
Gandahusada, S. dkk, 2000. Parasitologi Kedokteran. Edisi II. FKUI. Jakarta. Gandahusada, S., Ilahude, H.H., dan Pribadi, W., 2003. Parasitologi Kedokteran.
Gandahusada S dkk. 2004. Parasitologi Kedokteran. Ed 3. hal 153-161.
Hakansson, S., A.J. Charron and L.D. Sibley. 2001. Toxoplasma evacuoles: A two
step procces of secretion and fusion forms the parasitophorous vacuole. J. EMBO. 20: 3132 – 3144.
Haziroglu, R., K . Altintas, A . Atasever, M .Y. Gulbahar and O.K.R. Tunca. 2003 . Pathological and immunohistochemical studies in rabbits experimentally infected with Toxoplasma gondii . Turk . J. Vet. Anim . Sci . 27 : 285 – 293.
Hendri, 2008. Parasit Toksoplasma Menyerang 30-60% Penduduk Dunia. The Future of Nutrition Today. Diambil dari: http://www.ghtasia.com [26 juli 2015]
Hirmawan, Dkk. 1973. Patologi Umum (Dasar-Dasar Patologi). UI Press: Jakarta Hiswani. 2003. Toxoplasmosis Penyakit Zoonosis yang perlu diwaspada Oleh Ibu
Hamil. Fakultas Kedokteran Universitas Sumatera Utara.
Iskandar, T. 1999. Tinjauan Tentang Toksoplasmosis Pada Hewan dan Manusia.Wartazoa. 8 (2): 58 – 63.
Iskandar, 2006. Gambaran Splenosit, Limpa dan Kekebalan Pada Mencit Galur Balb/C Yang Diberi Alantoin Dan diinfeksi ToxoplasmaGondii. Fakultas
Farmasi Universitas Pancasila Jakarta.
J.C. Claudio, B.G. Conti, I. Benavides, Fernando, F.W. Frijhoff, A.A. Conti and Mariano. 2004. Atlas of laboratory Mouse Histology.
http://ctrgenpath.net/static/atlas/mousehistology/Windows/introduction.ht ml. [26juli 2015]
Jordan, E. L. Verma, P. S. 1980. Chordate Zoology. S. Chand Company Ltd, Rm Nagar. New Delhi.
Kusriningrum, R. S. 2008. Perencanaan Percobaan. Airrlangga University Press. Legowo, D. Sujarwo, S.A. dan Hamid, L.S. 2008. Dampak Penggunaan Estrogen
Jangka Lama pada Gambaran Histopatologi Sel Hati dan Ganjil Serta Berat Badan Mencit Betina. Lembaga Penelitian Universitas Airlangga. Surabaya.
Levine. N. D. 1990. Buku Pelajaran Parasitologi Veteriner. Universitas Gajah Mada Press. Yogyakarta.
Meyer, D.J ., J .E. Allan and M.H . Beaman. 2000. Distribution of parasite stages in tissues of Toxoplasma gondii infected SCID mice and human peripheral blood lymphocyte-transplanted SCID mice . Parasite Immunol . 22 : 567 - 579.
Mordue, D. G., F. Monroy, M.L. Regina, C.A. Dinarello and L.D. Sibley. 2001. Acute toxoplasmosis leads to lethal overproduction of Th1 cytokines . J
Immunol.167: 4574- 4584.
Montoya, J.G., K.E. Lowe, C. Clayberger D. Moody, D.Do., J .S. Remington, S. Talib and C .S. Subauste. 1996. Human CD4+ and CD8 T lymphocytes are bothcytotoxic to Toxoplasma gondii-infected cells. Infect. Immun. 64 : 176 – 181.
Mufasirin dan Suwanti, L. T. 2008. Deteksi Toxoplasma gondii pada Telur Ayam
Buras yang Dijual sebagai Campuran Jamu di Kota Surabaya dengan Uji Biologis. Media Kedokteran Hewan. 24 (1) : 9 - 14
Nelson, R.W. and C.G. Couto. 2003. Small Animal Internal Medicine. Mosby Co. Philadelphia.
Radke, J. 2007. Forward genetic analysis of apicomplexan cell division cycle T. gondii. USA.
Rasmaliah. 2003. Toksplasmosis dan Upaya Pence gahannya. Fakultas Kesehatan Masyarakat, Universitas Sumatera Utara. 1 -6.
Robert ,L.S and Janovy.J. 2000. Foundation of Parasitology. McGraw Hill.Boston.pp.127-132.
Romo III, T.,2001, Skin Wound Healing, JMS., september 10, 2001, Department of Otolaryngology, Division of Plastic Surgery and reconstructive Surgery, New York Eye and ear Infirmy.
Sasmita, R. 2006. Toxoplasmosis Penyebab Keguguran dan Kelainan Bayi. [Pengenalan, Pemahaman, Pencegahan dan Pengobatan]. Airlangga University Press. Surabaya.
Satriyo, U. 2001. Tak Perlu Cemaskan Toxoplasmosis. Infovet. Edisi 084. Hal.26. Sibley, L.D ., D.G . Mordue, C. Su, P.M . Robben and D .K . Howe. 2002 . Genetic
Singh S. 2003. mother to child Transmision and diagnosis of toxoplasma gondii infection during pregnancy . Indian Journal of Medical Microbology. 21 (2) : 69-76.
Soedarto. 2008. Parasitologi Klinik. Airlangga University Press. Surabaya.
Sukbeti, D. dan Nurfida K. A. 2006. Immunopatogenesis Toxoplasma gondii
Berdasarkan Perbedaan galur. Balai Penelitan Veteriner. Bogor. 128-145. Sutanto, I. Ismid I. S. Sjarifuddin . P. K dan Sungkar, S. 2008. Parasitologi
Kedokteran. Edisi ke-4 Balai Penerbit Fakultas Kedokteran Universitas Indonesia. Jakarta. 162-171.
Suwanti, L. T. , Nunuk, D.R dan E. Suprihatin. 1999. Diklat Protozologi Veteriner. Laboratorium Entomologi dan Protozoologi. Fakultas Kedokteran Hewan Universitas Airlangga. Surabaya.
Suwanti, L. T. 2005. Mekanisme Peningkatan Apoptosis Trofoblas Mencit Bunting Terinfeksi Toxoplasma gondii Melalui Peningkatan Sel Desidua Penghasil
IFN-γ dan TNF-α serta Trofoblas Penghasil Fas dan TNFR-1, [Disertasi]. Program Pasca Sarjana Universitas Airlangga Surabaya.
Treuting, M. P ; Dintzis M. , Suzanne and Montine S., Kathleen. 2012. Comparative Anatomy and Histology: A Mouse and Human Atlas. United states of
America : Academic Press Publications
Varney, H. 2004. Varney’s Midwifery Jones Anda Bartlett Publisher. Biston London Singapore.
Yowani,S.C., Kumolosasin,E.,Wibowo S.M., 2007. Karakterisasi Toxoplasma gondii Isolat Indonesia. Jurusan Kimia FMIPA Universitas Udayana, Bukit
Jimbaran.
Zhao,Y.O., Aliaksander Khaminets, Julia P. Hunn, Jonathan C. Howard .2009. Journal of Disruption of the T. gondii Parasitophorus Vacuoleby IFNγ – Inducible Immunity – Related GTPases (IRG Proteins) Triggers Necrotic Cell Death. Institute for Genetics, University of Cologne, Cologne,Germany.
Zulfiati, Eva. 2003. Gambaran Sitologi Ulas Vagina Mencit (Mus musculus albinus) selama Siklus Estrus dengan Tinjauan Khusus Pada Distribusi
Leukosit. [Skripsi]. Bogor:Institut Pertanian Bogor Fakultas Kedokteran
Hewan.
Lampiran
Lampiran1. Prosedur Pembuatan Preparat Histopatologi
Proses pembuatan preparat histopatologi vagina dilalukan di Laboratorium Patologi Veteriner Fakultas Kedokteran Hewan Universitas Airlangga Surabaya, melalui tahapan-tahapan sebagai berikut :
1. Fiksasi dan pencucian 2. Dehidrasi dan clearing 3. Infiltrasi
4. Pembuatan blok paraffin 5. Pengirisan dan mikrotom 6. Pewarnaan
7. Penutupan dengan cover glass
1. Fiksasi dan pencucian
Tujuan :
Mencegah terjadinya degenerasi post mortem.
Mematikan bakteri.
Meningkatkan afinitas jaringan terhadap berbagai zat warna.
Reagen : formalin 10% Cara kerja :
Setelah hewan percobaan mati maka, segera dilakukan otopsi, lalu organ vagina diambil dan dimasukkan dalam formalin 10% selama 24 jam. Selanjutnya dilakukan pencucian dengan air kran.
2. Dehidrasi dan clearing
Tujuan :
Untuk menarik air dari dalam jaringan.
Membersihkan dan menjernihkan jaringan.
Reagen : Alkohol 70%,80%,96%, alkohol absolute I, II, III, xylol I dan II. Cara kerja :
Organ vagina yang telah dicuci dengan air kran selama 30 menit, kemudian dimasukkan ke reagen dengan urutan alkohol 70%, 80%, 96%, alkohol absolute I, II, III, xylol I dan II, masing-masing selama 30 menit.
3. Infiltrasi
Tujuan : Untuk menginfiltrasi paraffin. Paraffin akan menembus ruang antar sel dan dalam sel sehingga, jaringan lebih tahan terhadap pemotongan.
Reagen : paraffin I dan II Cara kerja :
Jaringan dimasukkkan ke dalam paraffin I dan II yang mencair kemudian, dimasukan ke dalam oven selama 30 menit, setelah itu dimasukkan ke dalam paraffin I dan II dan dimasukkan ke dalam oven selama 30 menit pada suhu 80ºC.
4. Pembuatan blok paraffin
Tujuan : Untuk memudahkan pemotongan jaringan. Reagen : paraffin cair.
Cara kerja :
Beberapa cetakan besi yang telah diolesi gliserin dengan tujuan untuk mencegah lengketnya paraffin dan cetakan, kemudian vagina yang telah dipotong dimasukkan dengan pinset dan ditunggu hingga paraffin membeku.
5. Pengirisan dan mikrotom
Tujuan : Untuk memotong jaringan setipis mungkin sehingga mudah dilihat dibawah mikroskop.
Cara kerja :
Tujuan : Untuk memudahkan melihat perubahan pada jaringan/ Pada tahap ini digunakan pewarnaan Hematoxylin Eosin (HE). Cara kerja :
Pewarnaan HE dilakukan dengan menggunakan metode Harris yaitu jaringan yang telah dikeringkan dimasukkan ke dalam :
1. Xylol I : 3 menit dalam tempat khusus
2. Xylol II : 1 menit 3. Alkohol absolute I dan II : 1 menit 4. Alkohol 96%, 80% dan 70% : 1 menit 5. Air kran : 1 menit 6. Zat warna : 5 – 10 menit 7. Air kran : 2 – 5 menit 8. Acid alkohol : 3 – 10 celupan 9. Air kran : 4 – 7 celupan 10. Amoniak : 6 celupan 11. Aquades secukupnya
12. Zat warna eosin : 15 menit 13. Aquadest : 1 – 2 menit 14. Alkohol 70% dan 80% : 1 – 2 menit
15. Dan selanjutnya dibersihkan dari sisa – sisa pewarnaan.
7. Mounting
Tujuan : Penutupan obyek glass dengan cover glass yang telah ditetesi dengan Canada balsem.
Lampiran 2. Skema Pembuatan Preparat Histopatologi
Alkohol 96% Alkohol 80% Alkohol 70% Dehidrasi
Alkohol 96% Alkohol absolute I
100 % Alkohol absolute II 100%
Paraffin II Paraffin I Xylol II Xylol I
Blocking Mikrotom Pewarnaan Mounting Clearin
Lampiran 3. Skema Pewarnaan Hematoxylin Eosin
Lampiran 4. Menghitung Dosis 1x 103
66 x 104 takizoit /ml
= 660 takizoit/µl 20.000 x 1 µl = 30 µl 660
30,3 µl 400 µl NaCl