UJI DAYA ANTIOKSIDAN FRAKSI AIR, KLOROFORM, DAN ETIL ASETAT SARI BUAH KERSEN (Muntingia calabura L.)
MENGGUNAKAN METODE DPPH
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Augustiyani Novie Imoliana
NIM : 088114179
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI DAYA ANTIOKSIDAN FRAKSI AIR, KLOROFORM, DAN ETIL ASETAT SARI BUAH KERSEN (Muntingia calabura L.)
MENGGUNAKAN METODE DPPH
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Augustiyani Novie Imoliana
NIM : 088114179
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
“Kasih itu menutupi segala sesuatu, percaya segala sesuatu, mengharapkan segala sesuatu, sabar menanggung segala sesuatu” (I Kor. 13 : 7)
“LOVE IS A POWER”
Skripsi ini aku persembahkan kepada :
Papa dan Mama serta Adik-adikku tersayang,
Sahabat dan teman-temanku terkasih,
serta Almamaterku yang ku banggakan.
“Segala perkara dapat ku tanggung di dalam Dia yang memberi kekuatan kepadaku.”
v PRAKATA
Puji syukur kepada Tuhan atas kasih dan karunia-Nya penulis dapat
menyelesaikan skripsi yang berjudul “Uji Daya Antioksidan Fraksi Air, Kloroform, dan Etil Asetat Sari buah Kersen (Muntingia calabura L.) Menggunakan Metode DPPH (1,1-Difenil-2-Pikrilhidrazil)” sebagai salah satu syarat guna memperoleh gelar Sarjana Farnasi Universitas Sanata Dharma
Yogyakarta.
Keseluruhan dari proses penelitian dan penyusunan skripsi ini tidak lepas
dari bantuan dan dukungan dari semua pihak sehingga skripsi ini dapat
terselesaikan dengan baik. Oleh karena itu, penulis ingin mengucapkan
terimakasih yang sebesar-besarnya kepada :
1. Yohanes Dwiatmaka, M.Si. sebagai Dosen Pembimbing yang telah memberikan bimbingan, pengarahan serta ilmu selama penelitian dan
penyusunan skripsi ini.
2. Prof. Dr. CJ. Soegihardjo, Apt. atas kesempatan yang telah diberikan untuk berdiskusi bersama dan sebagai Dosen Penguji atas pengarahan dan
kesediaannya menguji skripsi ini.
3. Lucia Wiwid Wijayanti, M.Si. sebagai Dosen Penguji atas pengarahan dan kesediaannya menguji skripsi ini.
4. Ipang Djunarko, M.Sc., Apt. sebagai Dekan Fakultas Farmasi Universitas Sanata Dharma.
vi
6. Papa, Mama, Joice, dan Samuel atas kasih sayang, doa, serta dukungan baik moril maupun materiil sehingga skripsi ini dapat diselesaikan.
7. Saudari-saudariku di “Depends on God” Cell Group (Cik Elizabeth C. Parsono, Claudia T. Parsono, Feliciany Eva Natalia, Laurina Silvianty Dewi, Matrianofa
Gadau, Jenny Siagian, Natalia Wulandari, dll) atas dukungan doa dan semangat
dari kalian yang sangat luar biasa.
8. Saudari-saudariku di “Ester” Cell group (Novia Sarwoningtyas, Bertha Trifina Mardani, Juliana Gona, Johana Gunawan, Mayke Prasastia, dan Elsa Rosdiana)
atas dukungan doa dan semangat yang selalu menguatkanku.
9. Sahabat-sahabatku Mauryn, Cece, Sasa, Inang, Opung, Anna, Ike, dan Budhe karena telah memberikan motivasi dan menjadi inspirasi bagiku.
10.“Gadis-gadis yang selalu bahagia di kala susah selalu bersama” (Keluargaku di kos) Ade Mauryn Marpaung, Devi Y. Sinaga, E.L.Sari Tambunan, Mariana,
Melissa Darmawan, Rotua W.Silitonga, dan Yoestenia atas kebersamaan,
kekeluargaan, dan keceriaan selama ini.
11. Meiske Munda sebagai partner skripsi saya atas kerjasama yang telah dilewati bersama dalam penelitian ini.
12. Cicik2 dan Koko dosen : L.E.Sari Tambunan, Melissa Darmawan, Rolando, Aldo Sahala, Angela N.M.Karvitasari, L.C. Yuni Rogan, dan Octo R. Pius atas
informasi, saran, serta kritik yang membangun selama proses penelitian dan
penyusunan skripsi ini.
vii
Setya Dharma, Anastasia Filipa, Alfonsus Heppy, dan Adi Wirasaputra atas
kerja sama, kebersamaan dan keceriaan di lab selama proses penelitian ini.
14. Mas Bimo, Mas Kunto, Pak Ketul, Pak Parlan, dan Pak Wagiran atas bantuannya di lab selama ini.
15. Bu Jum dan Seorang bapak yang luar biasa baik di daerah Klitren Lor atas bantuannya selama ini.
16. Cik Widya, Cik Fenny, Siana, Fella, Yovinda, dan segenap keluarga besar Creative Ministry GKA Yogyakarta atas pengertian dan perhatiannya sehingga
penelitian ini dapat berjalan lancar.
17.Teman-teman Farmasi kelas C angkatan 2008 dan FST 2008.
18.Indonesian ICEE Team khususnya Miss Karina McDonald dan Miss Melisa Entienza karena telah membuat bahasa inggris menjadi semakin
menyenangkan untukku.
19.Semua pihak yang telah memberi dukungan dan bantuan yang tidak dapat desebutkan satu persatu.
Penulis menyadari bahwa penyusunan skripsi ini banyak kekurangan dan
jauh dari sempurna. Oleh karena itu, dengan segala kerendahan hati penulis
mengharapkan saran dan kritik guna perbaikan dan penyempurnaan skripsi ini.
Harapan penulis semoga penelitian dan penyusunan skripsi ini dapat bermanfaat
bagi perkembangan ilmu pengetahuan khususnya di bidang Farmasi.
Yogyakarta, Juni 2012
ix DAFTAR ISI
HALAMAN JUDUL...i
HALAMAN PERSETUJUAN PEMBIMBING...ii
HALAMAN PENGESAHAN...iii
HALAMAN PERSEMBAHAN...iv
PRAKATA...v
PERNYATAAN KEASLIAN KARYA...viii
DAFTAR ISI...ix
DAFTAR TABEL... xii
DAFTAR GAMBAR... xiii
DAFTAR LAMPIRAN... xiv
INTISARI... xv
ABSTRACT... xvi
BAB I PENGANTAR... 1
A. Latar Belakang...1
1. Permasalahan... 4
2. Manfaat yang diharapkan... 4
3. Keaslian penelitian... 5
B. Tujuan... 6
BAB II PENELAAHAN PUSTAKA... 7
A. TanamanKersen... 7
x
2. Kandungan kimia... 8
3. Kegunaan dan khasiat... 9
4. Penelitian antioksidan...9
B. Radikal dan Antioksidan...10
C. 2,2-Diphenyl-1-picrylhydrazyl (DPPH)...…...……… 14
D. Spektrofotometri UV-Vis……… 16
E. Validasi Metode Analisis... 18
F. Landasan Teori... 21
G. Hipotesis... 23
BAB III METODE PENELITIAN...24
A. Jenis dan Rancangan Penelitian...24
B. Variabel dan Definisi Operasional... 24
C. Bahan Penelitian... 25
D. Alat Penelitian... 25
E. Tata Cara Penelitian... 26
1. Determinasi tanaman... 26
2. Pengumpulan bahan………... 26
3. Penyiapan bahan uji... 26
4. Pengujian dengan metode DPPH... 29
5. Validasi metode uji aktivitas antioksidan…... 30
6. Analisis data………... 30
BAB IV HASIL DAN PEMBAHASAN... 32
xi
B. Hasil Pengumpulan Bahan... 32
C. Hasil Preparasi Sampel... 33
D. Hasil Optimasi Metode Uji Aktivitas Antioksidan... 38
1. Penentuan operating time (OT)...40
2. Penentuan panjang gelombang maksimum... 43
E. Hasil Validasi Metode Uji Aktivitas Antioksidan... 45
1. Akurasi... 47
2. Presisi... 50
3. Linearitas... 51
4. Spesifitas... 52
F. Hasil Uji Daya Antioksidan dengan Radikal DPPH…………... 53
BAB V KESIMPULAN DAN SARAN... 63
A. Kesimpulan... 63
B. Saran... 63
DAFTAR PUSTAKA... 64
LAMPIRAN... 67
xii
DAFTAR TABEL
Tabel I. Rentang akurasi yang dapat diterima (Harmita, 2004)…………...20
Tabel.II. Rentang CV yang masih dapat diterima (Harmita, 2004)………20
Tabel III. Hasil % recovery dan %CV uji aktivitas antioksidan vitamin C……..48
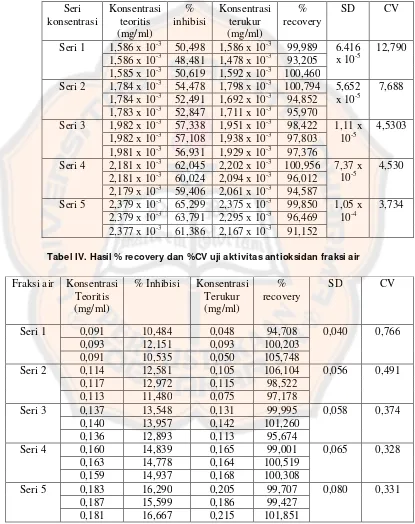
Tabel IV. Hasil % recovery dan %CV uji aktivitas antioksidan fraksi air...48
Tabel V. Hasil % recovery dan %CV uji aktivitas antioksidan f.etil asetat…...49
Tabel. VI. Hasil % recovery dan %CV uji aktivitas antioksidan f.kloroform...49
Tabel VII. Hasil %IC vitamin C menggunakan radikal DPPH………....56
Tabel VIII. Hasil %IC fraksi air menggunakan radikal DPPH...57
Tabel IX. Hasil %IC f.etil asetat menggunakan radikal DPPH………..58
Tabel X. Hasil %IC f.kloroform menggunakan radikal DPPH………...…..59
Tabel XI. Hasil IC50 vitamin C dan f.air,kloroform, dan etil asetat………60
xiii
DAFTAR GAMBAR
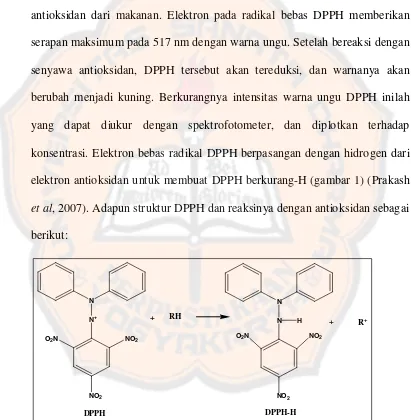
Gambar 1. Struktur DPPH dan reaksinya dengan antioksidan
(Prakash et al, 2007)………...15
Gambar 2. Hasil grafik penentuan OT Vitamin C……….40
Gambar 3. Hasil grafik penentuan OT fraksi air………41
Gambar 4. Hasil grafik penentuan OT fraksi etil asetat…….………41
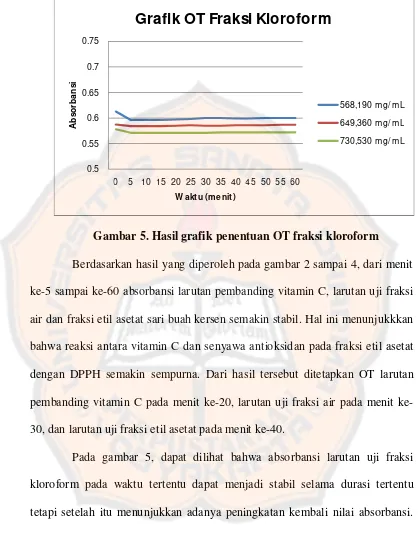
Gambar 5. Hasil grafik penentuan OT fraksi kloroform………...……..42
Gambar 6. Spektra λ maksimum DPPH pada konsentrasi 0,022 mg/mL……..44
Gambar 7. Spektra λ maksimum DPPH pada konsentrasi 0,043 mg/mL……...44
Gambar 8. Spektra λ maksimum DPPH pada konsentrasi 0,085 mg/mL…...44
Gambar 9. Kurva persamaan regresi linier aktivitas antioksidan vitamin C...45
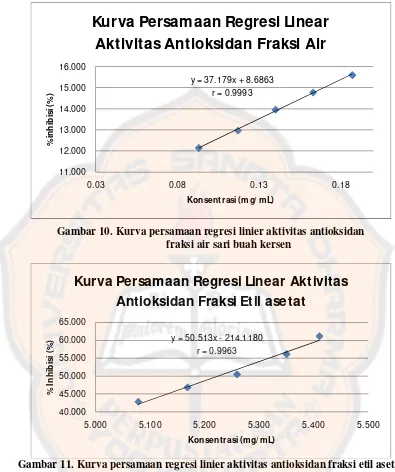
Gambar 10. Kurva persamaan regresi linier aktivitas antioksidan fraksi air...46
Gambar 11. Kurva persamaan regresi linier aktivitas antioksidan fraksi etil asetat………....46
Gambar 12. Kurva persamaan regresi linier aktivitas antioksidan fraksi kloroform………... 47
Gambar 13. Spektra vitamin C pada λ maksimum DPPH... 52
Gambar 14. Perubahan warna DPPH disertai dengan penurunan absorbansi (Molyneux, 2004)... 54
Gambar 15. Gugus kromofor dan auksokrom DPPH (Prakash et al., 2001).. 54
Gambar 16. Reaksi reduksi dan oksidasi asam askorbat (Szent-Györgyi, 1937)………..……….……55
xiv
DAFTAR LAMPIRAN
Lampiran 1. Surat pengesahan determinasi tanaman kersen…...67
Lampiran 2. Gambar tanaman kersen, bunga, dan buah dari daerah Klitren (Yogyakarta)………...68
Lampiran 3. Data penimbangan bahan...69
Lampiran 4. Data perhitungan konsentrasi DPPH, larutan pembanding dan larutan uji... 70
Lampiran 5. Scanning pengkoreksi... 73
Lampiran 6. Optimasi metode uji aktivitas antioksidan... 77
Lampiran 7. Uji aktivitas antioksidan menggunakan radikal DPPH... ..81
Lampiran 8. Hasil nilai IC50 vitamin C, fraksi air, kloroform, dan etil asetat sari buah kersen...85
xv INTISARI
Antioksidan adalah senyawa yang dapat menghambat reaksi radikal bebas dalam tubuh sehingga kerusakkan sel dapat dicegah. Buah kersen (Muntingia calabura L.) adalah salah satu buah dengan kandungan berbagai senyawa antioksidan seperti vitamin C, flavonoid, dan senyawa fenolik lainnya.
Penelitian ini bertujuan untuk mengetahui daya antioksidan fraksi air, kloroform, dan etil asetat sari buah kersen menggunakan metode (DPPH). Daya antioksidan ketiga fraksi sari buah Kersen dinyatakan dalam nilai IC50 yang
merupakan konsentrasi yang menyebabkan penurunan 50% dari konsentrasi DPPH awal. Ketiga fraksi tersebut diperoleh melalui proses partisi dalam corong pisah dengan perbandingan masing-masing pelarut 1 : 1.
Setelah bereaksi dengan senyawa antioksidan, DPPH akan tereduksi, dan warnanya akan berubah menjadi kuning dan disertai penurunan absorbansi. Absorbansi DPPH dibaca dengan menggunakan spektrofotometer pada λ maksimum 515 nm. Daya antioksidan ketiga fraksi ini kemudian dibandingkan dengan daya antioksidan dari larutan pembanding vitamin C.
Hasil uji daya antioksidan fraksi air, etil asetat dan kloroform sari buah kersen menunjukkan bahwa masing-masing fraksi tersebut memiliki nilai IC50
berturut-turut sebesar 0,363 (mg/mL); 2,664 (mg/mL); dan 159,397 (mg/mL). Daya antioksidan ketiga fraksi ini lebih lemah dari vitamin C.
xvi
ABSTRACT
Antioxidants are compounds that obstruct many free radical reactions in our body so that the cell damages can be inhibited. Jamaican cherry (Muntingia calabura L.) is a fruit contains many compounds that potential to be used as antioxidants like ascorbic acid, flavonoid, and other phenolic compounds.
This research was conducted to determine the antioxidant activity in the fractions of Muntingia calabura L. fruits by DPPH method. The fractions are gotten by a partition with the solvent comparison 1 : 1.
After reacting to the antioxidant compounds, DPPH will be reducted, and the colour will change to yellow as the absorbance lowering. Absorbance was read with spectrophotometry at the maximum wavelength 515 nm. The antioxidant activity of the fractions is expressed as IC50 value, the concentration
that causes a decrease of 50% of early DPPH concentration. The IC50 value of the
fractions then compared with the IC50 value of ascorbic acid.
The result shows that IC50 of the aqueous, chloroform, and ethyl acetate
fractions respectively are 0,363 (mg/mL); 2,664 (mg/mL); and 159,397 (mg/mL). The antioxidant activity of the fractions are weaker than the antioxidant activity of ascorbic acid.
1 BAB I PENGANTAR
A. Latar Belakang
Pada saat ini semakin banyak ditemukan penyakit-penyakit yang
diakibatkan karena adanya kerusakan sel oleh reaksi radikal bebas seperti kanker,
penyakit kardiovaskular, katarak, penurunan sistem imun dan kerusakkan otak
(Pervical, 1998). Radikal bebas adalah molekul oksigen yang dalam interaksinya
dengan molekul lain kehilangan sebuah elektron di lingkaran terluar orbitnya
sehingga jumlah eletronnya ganjil. Jumlah elektronnya yang ganjil menyebabkan
molekul ini menjadi tidak stabil dan selalu berusaha mencari pasangan elektron
baru dengan cara mengambil elektron molekul lain yang berdekatan
(Kusumadewi, 2002). Reaksi radikal ini berlangsung secara berantai sehingga
akan menghasilkan radikal bebas baru yang jumlahnya terus bertambah. Radikal
bebas yang berlebihan akan menyerang bagian tubuh yang sehat maupun yang
sakit sehingga dalam jangka waktu yang lama akan menyebabkan timbulnya
berbagai macam penyakit (Saurisari, 2006).
Untuk mencegah efek negatif radikal bebas terhadap tubuh diperlukan
senyawa yang disebut antioksidan. Antioksidan merupakan senyawa yang mampu
menghambat reaksi berantai radikal bebas dalam tubuh manusia (Kumalaningsih,
2007). Secara alami, tubuh mampu menghasilkan antioksidan namun ada batasan
tertentu, tidak semua radikal bebas mampu dinetralisasi. Oleh karena itu,
dihasilkan dalam tubuh. Berbagai antioksidan eksternal alami dapat ditemukan
dalam sayur-sayuran dan buah-buahan (Ismail dkk, 2007). Adanya kekhawatiran
akan kemungkinan efek samping yang belum diketahui dari antioksidan sintetik
menyebabkan antioksidan alami menjadi alternatif yang sangat dibutuhkan
(Sunarni, 2005).
Kersen (Muntingia calabura L.) adalah sejenis tanaman pohon yang
berbuah bulat kecil, jika masak buah berwarna merah dan jika masih muda
berwarna hijau. Tanaman kersen banyak ditemui di daerah tropis seperti di
Indonesia. Akan tetapi selama ini tanaman kersen belum banyak diolah atau
dimanfaatkan di Indonesia (Ekasari, 2009).
Buah kersen memiliki efek antibakteri terhadap sejumlah bakteri gram
negatif seperti Salmonella enteriditis, Citrobacter fruendii, Enterobacter
aerogenes, Klebsiella pneumoniae, Vibrio cholerae, Vibrio parahemolyticus,
Pseudomonas aeruginosa and Salmonella typhi (Zakharia, 2007). Selain itu, buah
kersen juga memiliki efek menurunkan kadar gula dalam darah sehingga
berpotensi juga untuk dimanfaatkan sebagai antidiabetes (Verdayanti, 2009).
Buah kersen (Muntingia calabura L.) yang telah masak dapat digunakan
sebagai obat sakit kuning. Buah kersen (Muntingia calabura L.) juga berkhasiat
sebagai penyembuh asam urat.(Istikhomah, 2010).
Menurut penelitian Balikrishnan (2007) ditemukan bahwa ekstrak
aquadest dan etanol buah kersen memiliki aktivitas antioksidan.
Senyawa-senyawa yang bersifat sebagai antioksidan alami, yaitu Senyawa-senyawa-Senyawa-senyawa fenolik
buah kersen per 100 g, yaitu air, protein, lemak, serat, kalsium, fosfor, besi,
karoten, tianin, riboflavin, niacin, dan vitamin C (Morton, 1987). Pada penelitian
Kolar et al. (2010), diketahui bahwa buah kersen mengandung flavonoid dan
senyawa-senyawa fenolik lainnya. Adanya berbagai senyawa antioksidan alami
dalam buah kersen ini memungkinkan pemanfaatan buah kersen sebagai bahan
baku pembuatan antioksidan alami. Oleh karena itu, peneliti melakukan uji daya
antioksidan sari buah kersen untuk mengetahui seberapa besar potensi daya
antioksidan yang dimiliki oleh sari buah kersen.
Glikosida flavonoid merupakan senyawa polar sehingga dapat larut
dalam pelarut polar seperti air. Akan tetapi, senyawa flavonoid aglikon (flavonoid
tanpa gula terikat) umumnya lebih mudah larut dalam pelarut seperti eter dan
kloroform (Markham, 1998). Beberapa sumber juga menyebutkan bahwa
sejumlah flavonoid juga dapat terlarut dalam pelarut semi polar seperti etil asetat.
Oleh karena itu, untuk mengetahui potensi antioksidan dari sari buah kersen ini,
peneliti melakukan uji daya antioksidan pada fraksi air, kloroform, dan etil asetat
sari buah kersen. Diharapkan dengan diketahuinya potensi buah kersen sebagai
antioksidan, dapat meningkatkan kegunaan buah kersen sebagai bahan pangan
fungsional.
Salah satu uji untuk menentukan aktivitas antioksidan adalah metode
DPPH (1,1Diphenyl-2-picrylhidrazyl). Pada metode ini senyawa antioksidan akan
bereaksi dengan radikal DPPH sehingga DPPH akan tereduksi dan warnanya
berubah dari ungu menjadi kuning. Berkurangnya intensitas warna ungu DPPH
konsentrasi. Nilai aktivitas antioksidan diketahui melalui nilai IC50 yang
merupakan konsentrasi yang menyebabkan penurunan 50% dari konsentrasi
DPPH awal (Sunarni, 2005). Salah satu keuntungan uji aktivitas antioksidan
dengan metode DPPH adalah dapat dikerjakan dengan cepat dan sederhana
dibanding metode lain. Karena itu, penelitian ini bertujuan untuk mengetahui
aktivitas antioksidan buah kersen dengan metode DPPH.
Vitamin C merupakan antioksidan yang larut dalam air (aqueous
antioxidant). Senyawa ini adalah salah satu anti oksidan kuat yang memiliki efek
biologis untuk menghambat kerusakan oksidatif oleh radikal bebas. Peranan
vitamin C sebagai antioksidan sudah dikenal oleh masyarakat luas. Karena inilah
maka vitamin C digunakan sebagai pembanding dalam penelitian ini.
B. Permasalahan
1. Berapa nilai IC50 fraksi air, kloroform, dan etil asetat sari buah kersen?
2. Bagaimana nilai IC50 fraksi air, kloroform, dan etil asetat sari buah kersen
dibanding nilai IC50 vitamin C?
C. Manfaat Penelitian
1. Manfaat praktis
Penelitian ini diharapkan dapat memberi informasi bagi penelitian lebih
lanjut maupun masyarakat mengenai potensi buah kersen sebagai antioksidan
2. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan sumbangan pada
perkembangan ilmu pengetahuan dalam bidang farmasi, khususnya penggunaan
metode DPPH dalam pengujian daya antioksidan.
D. Keaslian Penelitian
Adapun sejumlah penelitian yang telah dilakukan terkait dengan tanaman
Kersen adalah sebagai berikut :
1. “Anthocyanin antioxidant from edible fruits” (Einbond et al, 2002)
Pada penelitian ini, diperoleh hasil bahwa fraksi air sari buah kersen tanpa
kandungan gula dan vitamin C memiliki aktivitas antioksidan dengan nilai
IC50sebesar 6,5 µg/ml.
2. “Free Radical Scavenging Activity of Some Plants Available in Malaysia”
(Zakharia, 2006)
Pada penelitian ini, diperoleh hasil bahwa ekstrak air daun kersen memiliki
aktivitas antioksidan dengan % scavenging sebesar 94.80 ± 1.14. Hasil
penelitian ini juga menunjukkan bahwa ekstrak air daun kersen mengandung
flavonoids, triterpenes, saponins, tannin, dan steroid.
3. “Antioxidant activity and estimation Of Total Phenolic Content Of Muntingia
calabura by Colorimetry”. (Siddiqua, 2010)
Pada penelitian ini, diperoleh hasil bahwa bahwa ekstrak metanol daun kersen
memiliki aktivitas antioksidan dengan nilai IC 50 sebesar 22 µg/mL dan total
E. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui besarnya nilai IC50 fraksi air,
kloroform, dan etil asetat sari buah kersen (Muntingia calabura L.) dan
bagaimana nilai IC50 fraksi air, kloroform, dan etil asetat sari buah kersen
7 BAB II
PENELAAHAN PUSTAKA
A. Tanaman Kersen 1. Keterangan Botani
Kersen (Muntingia calabura L.) termasuk dalam familia Tiliaceae.
Tanaman ini dikenal dengan beberapa nama yaitu : talok (Jawa), kerukup siam
(Malaysia), takhop farang (Thailand), mât sâm (Vietnam); datiles, aratiles,
manzanitas (Filipina); khoom sômz, takhôb (Laos); krâkhôb barang (Kamboja).
Buah kersen juga dikenal sebagai sebagai capulin blanco, cacaniqua, nigua,
niguito (bahasa Spanyol) dan jamaican cherry, panama berry, singapore
cherry (Inggris). Dalam bahasa belanda, buah kersen dikenal dengan nama
japanse kers (Belanda), yang lalu dari nama itu diambil menjadi kersen dalam
bahasa Indonesia. (Iskak, 2010).
Tanaman kersen merupakan tanaman perdu yang tingginya sampai 12
m, meski umumnya hanya sekitar 3-6 m saja. Selalu hijau dan terus menerus
berbunga dan berbuah sepanjang tahun. Cabang-cabang mendatar,
menggantung di ujungnya membentuk naungan yang rindang. Ranting-ranting
berambut halus bercampur dengan rambut kelenjar, demikian pula daunnya.
Daun-daun terletak mendatar , berseling ,helaian daun tidak simetris , bundar
telur lanset , tepinya bergerigi dan berujung runcing, 1-4 x 4-14 cm sisi bawah
kuntum, terletak di ketiak agak di sebelah atas tumbuhnya daun , bertangkai
panjang, berkelamin dua dan berbilangan lima, kelopak berbagi dalam , taju
meruncing bentuk benang, berambut halus, mahkota bertepi rata, bundar telur
terbalik, putih tipis gundul lk 1 cm. Benang sari berjumlah banyak, 10 sampai
lebih dari 100 helai. Bunga yang mekar menonjol keluar, ke atas helai-helai
daun, namun setelah menjadi buah menggantung ke bawah, tersembunyi di
bawah helai daun. Umumnya hanya satu-dua bunga yang menjadi buah dalam
tiap berkasnya. Bertangkai panjang, bulat hampir sempurna, diameter 1-1,5
cm, hijau kuning dan akhirnya merah apabila masak, bermahkota sisa tangkai
putik yang tidak rontok serupa bintang hitam bersudut lima. Berisi beberapa
ribu biji yang kecil-kecil, halus,putih dan kekuningan, terbenam dalam daging
dan sari buah yang manis sekali ( Purwonegoro, 1997).
2. Kandungan Kimia
Daun kersen mengandung flavonoids, triterpenes, saponins, tannin,
dan steroid. (Zakharia, 2007). Buah kersen mengandung air, protein, lemak,
serat, kalsium, fosfor, besi, karoten, tianin, riboflavin, niacin, dan vitamin C.
(Morton, 1987).
Kandungan setiap 100 g bagian buah kersen yang dapat dimakan yaitu
: air (76,3 g), protein (2,1 g), lemak (2,3 g), karbohidrat (17,9 g), abu (1,4 g),
3. Kegunaan dan khasiat
Buah kersen memiliki efek antibakteri terhadap beberapa bakteri gram
negatif seperti Corneybacterium diphtheria, Staphylococcus aureus (ATCC
25923), Bacillus cereus, Proteus vulgaris, Staphylococcus epidermidis,
Kosuria rhizophila, Shigella flexneri, Escherichia coli (O 157), Aeromonas
hydrophila dan Salmonella typhi (Zakharia et all, 2006). Selain itu, buah kersen
juga dapat digunakan untuk mengobati asam urat denga cara mengkonsumsi
bauh kersen sebanyak 9 butir 3 kali sehari. Hal ini terbukti dapat mengurangi
rasa nyeri yang ditimbulkan dari penyakit asam urat (Ekasari, 2010).
Buah kersen yang telah masak dapat digunakan sebagai obat sakit
kuning. (Istikhomah, 2010). Selain itu, buah kersen tanpa kandungan gula dan
vitamin C juga diketahui memiliki efek antioksidan (Einbond et al, 2004)).
4. Penelitian antioksidan
Balikrishnan (2007) telah melakukan penelitian uji aktivitas
antioksidan ekstrak aquadest dan etanol buah kersen dengan metode DPPH,
Lipid peroxidation by Ferric thiocyanate dan Skin whitening assay
Antityrosinase assay. Berdasarkan hasil penelitian tersebut diketahui bahwa
ekstrak aquadest dan etanol buah kersen memiliki aktivitas antioksidan dan
ekstrak aquadest memiliki daya antioksidan yang lebih besar dari daya
antioksidan ekstrak etanol.
Kolar et al (2006) telah melakukan penelitian terhadap ekstrak
reducing antioxidant power (FRAP) assay dan ferrous ion chelating activity
assay. Pada penelitian tersebut diketahui bahwa mengandung ekstrak metanol,
aquadest, dan aseton buah Kersen memiliki aktivitas antioksidan dan memiliki
kandungan senyawa-senyawa fenolik serta flavonoid.
B. Radikal bebas dan Antioksidan
Radikal bebas merupakan atom atau molekul yang mempunyai satu
elektron atau lebih yang tak berpasangan, bersifat sangat labil, sehingga
senyawa ini sangat reaktif untuk memperoleh pasangan elektron dan merusak
jaringan (Karyadi, 2004 cit Da’i et al, 2005).
Elektron yang tidak berpasangan cenderung untuk membentuk
pasangan dengan menarik elektron dari senyawa lain sehingga terbentuk
radikal baru. Radikal bebas memiliki dua sifat sebagai berikut.
1) Reaktivitas tinggi karena cenderung menarik elektron
2) Dapat mengubah suatu molekul menjadi suatu radikal lain (Sjabana
dan Bahalwan, 2002).
Reaksi pembentukan radikal bebas merupakan mekanisme biokimia
tubuh normal yang terjadi melalui reaksi yang langsung memutuskan ikatan
atau melalui transfer elektron (Halliwel and Gutridge, 2000). Radikal bebas
lazimnya hanya bersifat perantara yang bisa dengan cepat diubah menjadi
substansi yang tidak lagi membahayakan bagi tubuh. Namun, apabila radikal
bebas bertemu dengan enzim atau asam lemak tak jenuh ganda, maka
dari suatu molekul disekitarnya. Pengaruh radiasi ionisasi terhadap materi
biologi akan menghasilkan radikal bebas hidroksil dan radikal bebas lainnya,
seperti radikal hidrogen yang siap berinteraksi dengan biomolekul-biomolekul
lain yang saling berdekatan (Middleton et al., 2000).
Reaksi oksidasi lipid berlangsung dalam tiga tahap, yang pertama
adalah inisiasi yang mana suatu radikal lipid terbentuk dari molekul lipid
menurut reaksi RH→R
•
+H•
. Pengurangan atom hidrogen oleh spesies reaktifseperti radikal hidroksil berperan dalam inisiasi oksidasi lipid.
Setelah inisiasi, reaksi propagasi (perambatan) terjadi yang mana
dalam reaksi propagasi ini radikal lipid diubah menjadi radikal lipid yang
berbeda. Reaksi ini umumnya melibatkan pengurangan atom hidrogen dari
molekul lipid atau penambahan atom oksigen pada radikal alkil.
R
•
+ O₂→ ROO•
ROO
•
+ RH → ROOH + R•
Tahap terakhir adalah reaksi terminasi. Dalam reaksi ini radikal bebas
bergabung untuk membentuk molekul dengan elektron berpasangan.
ROO
•
+ ROO•
→ ROOR + O2ROO
•
+ R•
→ ROORR
•
+ R•
→ RRPrekusor molekular untuk memulai proses tersebut umumnya
reaksi rantai dengan berbagai efek yang potensial merusak sel-sel tubuh
(Pokorni et al., 2001).
ROS (Reactive Oxygen Species) adalah senyawa pengoksidasi
turunan oksigen yang bersifat sangat reaktif yang terdiri atas kelompok radikal
bebas dan kelompok nonradikal. Kelompok radikal bebas antara lain
superoxide anion (O2
•
-), hydroxyl radicals (OH•
), dan peroxyl radicals(RO2
•
). Yang nonradikal misalnya hydrogen peroxide (H2O2), dan organicperoxides (ROOH) (Halliwell and Whiteman, 2004). Bentuk radikal bebas
yang lain adalah hydroperoxyl (HO2
•
), alkoxyl (RO•
), carbonate (CO3•
),carbon dioxide (CO2
•
), atomic chlorine (Cl•
), dan nitrogen dioxide (NO2•
)Senyawa oksigen reaktif ini dihasilkan dalam proses metabolisme oksidatif
dalam tubuh misalnya pada proses oksidasi makanan menjadi energi
(Halliwell and Whiteman, 2004).
Antioksidan adalah substansi yang diperlukan tubuh untuk
menetralisir radikal bebas dan mencegah kerusakan yang ditimbulkan oleh
radikal bebas terhadap sel normal, protein, dan lemak. Antioksidan
menghambat oksidasi dengan cara bereaksi dengan radikal bebas reaktif
membentuk radikal bebas yang relatif lebih stabil (Kumalaningsih, 2008).
Tubuh manusia sebenarnya memiliki sistem pertahanan endogen
normal dan peradangan. Sistem pertahanan tersebut dapat dikelompokkan
menjadi tiga golongan sebagai berikut (Niki et al, 1995 cit Hertianti 2000):
a. Antioksidan primer yaitu antioksidan yang dapat menghalangi
pembentukkan radikal bebas baru. Termasuk golongan ini adalah
superoksida dismutase (SOD) dan katalase. SOD akan mengkatalisis
dismutase radikal anion superoksida (O2·) menjadi (O2) dan hydrogen
peroksida (H2O2), sedangkan katalase akan mengubah hydrogen
peroksida menjadi oksigen dan air (Wilmsen Iet al, 2005).
b. Antioksidan sekunder atau penangkap radikal (radical scavenger)
yaitu antioksidan yang dapat menekan terjadinya reaksi berantai baik
pada awal pembentukkan rantai maupun pada fase elongasi. Termasuk
golongan ini adalah vitamin E, ß-karoten, dan kurkuminoid.
c. Antioksidan tersier adalah antioksidan yang emmperbaiki
kerusakan-kerusakan yang terjadi. Termasuk golongan ini adalah enzim yang
memperbaiki DNA dan metionin sulfoksida reduktase.
Sumber antioksidan dalam sistem biologi, yaitu :
a) Enzim (superoksid dismutase, glutation peroksidase dan katalase),
b) molekul besar (albumin, seruloplasmin, ferritrin dan protein lain),
c) molekul kecil (asam askorbat, glutation, asam urat, tokoferol,
karetenoid, dan polifenol), dan
d) hormon (estrogen, angiotensin, melatonin) (Prior et al., 2005).
Berdasarkan tipenya antioksidan dibagi menjadi 2 yaitu Antioksidan
dan Antioksidan alami (Vitamin C, karnosin, flavonoid, polifenol, dan
lain-lain) (Owusu, 2004).
Senyawa-senyawa yang mempunyai potensi sebagai antioksidan
umumnya merupakan senyawa flavonoid, fenolat dan alkaloid. Antioksidan
polifenol seperti flavonoid, vanilin, eugenol,dan antioksidan rosemary
memiliki aktivitas antioksidan yang lebih baik daripada antioksidan golongan
vitamin (Reynertson, et al. 2007).
Kebanyakan senyawa antioksidan yang diisolasi dari sumber alami
adalah berasal dari tumbuhan. Kingdom tumbuhan, Angiosperm memiliki
kira-kira 200.000 sampai 300.000 spesies dan dari jumlah ini kurang lebih 400
spesies yang telah dikenal dapat menjadi bahan pangan manusia. Isolasi
antioksidan alami telah dilakukan dari tumbuhan yang dapat dimakan, tetapi
tidak selalu dari bagian yang dapat dimakan. Antioksidan alami terbesar di
beberapa bagian tanaman, seperti pada kayu, kulit kayu, akar, daun, buah, biji,
dan serbuk sari (Pokorni et al., 2001).
C. (DPPH) 2,2-Diphenyl-1-picrylhydrazyl
DPPH adalah radikal bebas yang stabil dalam larutan berair atau
larutan metanol serta memiliki serapan yang kuat pada panjang gelombang
515 nm dalam bentuk teroksidasi. DPPH mampu menerima elektron atau
radikal hidrogen dari senyawa lain sehingga membentuk molekul diamagnetik
yang stabil (Hatano et al 1998). Uji aktifitas antioksidan dilakukan pada
beberapa metode untuk menentukan aktifitas antioksidan, diantaranya DPPH
(2,2-difenil-1-pikrilhidrazil), Cupric Ion Reducing Antioxidant (CUPRAC)
dan Ferric Reducing Ability of Plasma (FRAP).
Metode 2,2-Diphenyl-1-picrylhydrazyl (DPPH) adalah sebuah
metode sederhana yang telah dikembangkan untuk menentukan aktivitas
antioksidan dari makanan. Elektron pada radikal bebas DPPH memberikan
serapan maksimum pada 517 nm dengan warna ungu. Setelah bereaksi dengan
senyawa antioksidan, DPPH tersebut akan tereduksi, dan warnanya akan
berubah menjadi kuning. Berkurangnya intensitas warna ungu DPPH inilah
yang dapat diukur dengan spektrofotometer, dan diplotkan terhadap
konsentrasi. Elektron bebas radikal DPPH berpasangan dengan hidrogen dari
elektron antioksidan untuk membuat DPPH berkurang-H (gambar 1) (Prakash
et al, 2007). Adapun struktur DPPH dan reaksinya dengan antioksidan sebagai
berikut:
Parameter yang dipakai untuk menunjukan aktivitas antioksidan
adalah harga konsentrasi efisien atau efficient concentration (EC50) atau
inhibitory concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang
dapat menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi
suatu zat antioksidan yang memberikan persen peredaman sebesar 50%. Zat
yang mempunyai aktivitas antioksidan tinggi, akan mempunyai harga EC50
atau IC50 yang rendah (Molyneux, 2004).
D. Spektrofotometri UV-Vis
Teknik spektroskopi adalah salah satu teknik analisis fisika-kimia
yang mengamati tentang interaksi antara atom atau molekul dengan radiasi
elektromagnetik (REM). Spektrofotometer UV-Vis adalah spektrofotometer
yang sesuai untuk pengukuran di daerah spektrum ultraviolet dan sinar
tampak. Spektrofotometer UV-Vis terdiri dari suatu sistem optik dengan
kemampuan menghasilkan sinar monokromatis dalam jangkauan panjang
gelombang 200-800 nm.
Tahapan-tahapan dalam analisis spektrofotometri secara garis besar
adalah :
a. Pembentukan molekul yang dapat menyerap sinar UV-VIS
b. Waktu operasional (operating time)
c. Pemilihan panjang gelombang
d. Pembuatan kurva baku
(Gandjar dan Rohman, 2007).
Prinsip kerja spektrofotometer UV-Vis adalah dimana sinar/cahaya
dilewatkan melewati sebuah wadah (kuvet) yang berisi larutan, dimana akan
menghasilkan spektrum. Alat ini menggunakan hukum Lambert Beer sebagai
acuan (Ewing, 1975). Panjang gelombang untuk sinar ultraviolet antara
200-400 nm sedangkan panjang gelombang untuk sinar tampak/visible antara 200-
400-750 nm (Rohman, 2007).
Apabila cahaya mengenai suatu senyawa, maka sebagian dari cahaya
tersebut akan diserap oleh molekul-molekul sesuai dengan struktur molekul.
Apabila besarnya perbedaan energi antara keadaan tingkat dasar dengan
keadaan tereksitasi suatu senyawa dengan besarnya energi cahaya yang
mengenainya sama, maka elektron-elektron pada keadaan dasar akan
tereksitasi ke tingkat energi eksitasi dan sebagian energi cahaya yang sesuai
dengan panjang gelombang ini diserap. Perbedaan energi antara tingkat dasar
dan tingkat tereksitasi untuk setiap senyawa besarnya berbeda-beda sehingga
frekuensi yang diserap juga akan spesifik untuk tiap-tiap senyawa
(Sastrohamidjodjo, 1991).
Senyawa yang mempunyai gugus kromofor apabila mengalami
interaksi dengan radiasi elektromagnetik pada daerah UV-Vis (200-800 nm)
maka akan menghasilkan transisi elektromagnetik dan spektra absorbansi
elektromagnetik. Spektra absorbansi tersebut dapat digunakan untuk analisis
sebanding dengan jumlah molekul penyerapnya. (Fessenden dan Fesenden,
1995).
Cara kerja spektrofotometer UV-Vis sebagai berikut.
a. Sinar dari sumber radiasi diteruskan menuju monokromator,
b. Monokromator sebagai penyeleksi panjang gelombang yaitu mengubah
cahaya yang berasal dari sumber sinar polikromatis menjadi cahaya
monokromatis,
c. cahaya monokromatis kemudian dilewatkan pada sampel. Digunakan
kuvet untuk meletakkan sampel, kuvet biasa terbuat dari gelas atau
kuarsa transparan,
d. detektor berfungsi menangkap cahaya yang diteruskan dari sampel dan
mengubahnya menjadi arus listrik, dan
e. meter/pencatat akan menangkap besarnya isyarat listrik yang berasal dari
detektor (Sastrohamidjodjo, 2001).
E. Validasi Metode Analisis
Validasi metode analisis merupakan ukuran untuk membuktikan
bahwa metode yang digunakan memberikan hasil seperti yang diharapkan
dengan kecermatan dan ketelitian yang memadai (Mulja dan Hanwar,
2003).
Parameter validasi metode meliputi 10 parameter, yaitu :
selektivitas, atau spesifisitas, sensitivitas, uji ketangguhan (ruggednes), uji
ketegaran (robustness) dan ketidakpastian (uncertainty) (Sumardi, 2002).
Beberapa parameter analisis yang harus dipertimbangkan dalam
validasi metode analisis diuraikan dan didefinisikan sebagaimana cara
penentuannya.
1. Kecermatan (accuracy)
Kecermatan adalah ukuran yang menunjukkan derajat
kedekatan hasil analisis dengan kadar analit yang sebenarnya.
Kecermatan dinyatakan sebagaipersen perolehan kembali (recovery)
analit yang ditambahkan. Kecermatan hasil analisis sangat bergantung
kepada sebaran galat sistematik di dalam keseluruhan tahapan analisis.
Oleh karena itu untuk mencapai kecermatan yang tinggi hanya dapat
dilakukan dengan cara mengurangi galat sistematik tersebut seperti
menggunakan peralatan yang telah dikalibrasi, menggunakan pereaksi
dan pelarut yang baik, pengontrolan suhu, dan pelaksanaannya yang
Tabel I. Rentang akurasi yang dapat diterima (Harmita, 2004)
2. Keseksamaan (precision)
Keseksamaan adalah ukuran yang menunjukkan derajat
kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil
individual dari rata-rata jika prosedur diterapkan secara berulang pada
sampel-sampel yang diambil dari campuran yang homogen (Harmita,
2004).Presisi dinyatakan dalam standar deviasi atau koefisien variasi
(Mulja dan Hanwar, 2003).
Tabel II. Rentang CV yang masih dapat diterima (Harmita, 2004)
Analit pada matrik sampel (%) CV (%)
Selektivitas atau spesifisitas suatu metode adalah
dan seksama dengan adanya komponen lain yang mungkin ada dalam
matriks sampel (Harmita, 2004)
4. Linearitas
Linearitas adalah kemampuan metode analisis yang
memberikan respon yang secara langsung atau dengan bantuan
transformasi matematik yang baik, proporsional terhadap konsentrasi
analit dalam sampel. Rentang metode adalah batas terendah dan
tertinggi analit yang sudah ditunjukkan dapat ditetapkan dengan
kecermatan, keseksamaan, dan linearitas yang dapat diterima (Harmita,
2004).
Linieritas pada suatu metode analisis dari suatu prosedur
analisis merupakan kemampuannya untuk mendapatkan hasil uji yang
secara langsung proporsional dengan konsentrasi (jumlah) analit di
dalam sampel. Persyaratan data linieritas yang bisa diterima jika
memenuhi nilai koefisien korelasi ( r ) > 0,999 (Mulja dan Hanwar,
2003).
F. .Landasan Teori
Penggunaan senyawa antioksidan saat ini semakin meluas
seiring dengan semakin besarnya pemahaman masyarakat tentang
peranannya dalam menghambat penyakit degeneratif seperti penyakit
jantung, arteriosklerosis, kanker, serta gejala penuaan. Kekhawatiran
alami menjadi alternatif yang terpilih. Senyawa-senyawa antioksidan
umumnya merupakan senyawa-senyawa seperti vitamin C, flavonoid,
fenolat dan alkaloid dan dapat ditemukan pada batang, daun, bunga dan
buah dari tanaman.
Buah kersen memiliki kandungan berbagai senyawa
antioksidan alami seperti flavonoid, senyawa fenolik, karotenoid, dan
vitamin C sehingga memungkinkan bagi buah kersen untuk dapat
dimanfaatkan sebagai bahan baku pembuatan antioksidan alami. Oleh
karena itu, peneliti melakukan uji daya antioksidan sari buah kersen
untuk mengetahui seberapa besar potensi daya antioksidan yang
dimiliki oleh sari buah kersen.
Senyawa-senyawa yang bersifat antioksidan pada buah kersen
memiliki kelarutan yang berbeda dalam pelarut organik. Oleh sebab itu,
perlu dilakukan penelitian untuk mengetahui daya antioksidan dari
fraksi air, kloroform, dan etil asetat sari buah kersen.
Pengujian aktivitas antioksidan dapat dilakukan dengan
metode DPPH. DPPH merupakan suatu radikal bebas ketika
elektronnya menjadi berpasangan oleh karena adanya senyawa
antioksidan maka akan terjadi peluruhan warna larutan DPPH dari ungu
menjadi kuning dan menyebabkan penurunan absorbansi secara
G. Hipotesis
Berdasarkan landasan teori di atas dapat dihipotesiskan bahwa nilai IC50
fraksi air, kloroform, dan etil asetat sari buah kersen (Muntingia calabura L.)
24 BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental.
B. Variabel
1. Variabel bebas berupa konsentrasi fraksi air, kloroform, dan etil asetat
sari buah kersen.
2. Variabel tergantung berupa % inhibisi fraksi air, kloroform, dan etil
asetat sari buah kersen (Muntingia calabura L.).
3. Variabel pengacau terkendali berupa tempat tumbuh tanaman, waktu
panen, bahan kimia dan alat yang digunakan.
4. Variabel pengacau tidak terkendali berupa cahaya matahari dan cuaca.
C. Definisi Operasional
1. Sari buah kersen adalah larutan yang diperoleh dari penghancuran buah
kersen menggunakan blender yang telah disaring menggunakan kain
tetron.
2. Fraksi air,kloroform, dan etil asetat sari buah kersen adalah hasil
fraksinasi sari buah kersen menggunakan pelarut aquadest, kloroform,
3. Persen inhibisi adalah persen yang menyatakan kemampuan fraksi air,
kloroform, dan etil asetat sari buah kersen untuk menangkap radikal
DPPH.
4. Inhibition concentration 50 adalah nilai konsentrasi fraksi air, kloroform,
dan etil asetat sari buah kersen yang yang menghasilkan penangkapan
50% radikal DPPH, dinyatakan dalam satuan µg/ml.
D. Bahan dan Alat Penelitian 1. Bahan
Buah kersen; 2,2-diphenyl-1-picrylhydrazyl (DPPH) (Sigma),
metanol p.a (Merck), kloroform p.a. (Merck), dan etil asetat p.a (Merck)
dan aquadest.
2. Alat
Spektrofotometer UV-Vis OPTIMA SP-3000 plus; timbangan
SBC 22 (Scaltec) dan precision balance model GB-3002 (Mettler
Toledo); mikropipet 50 µl-200 µl, 200-1000 µl (Socorex), makropipet
1-10 ml; tabung reaksi (Pyrex-Germany); flakon bertutup, blender; statif,
klem, corong pisah, corong Buchner, penyaring vakum, hot plate, hair
dryer, kertas aluminium foil, kain tetron, termometer dan alat-alat gelas
E Tatacara Penelitian 1. Determinasi tumbuhan
Determinasi tanaman kersen yang digunakan dilakukan
berdasarkan pemngamatan ciri morfologinya di Laboratorium
Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta
2. Pengumpulan bahan
Tanaman Kersen diperoleh dari daerah Klitren Lor, GK III,
Yogyakarta. Buah yang diambil adalah buah matang berwarna merah dan
segar dengan diameter sekitar 1,5 cm. Pemanenan tanaman dilakukan
pada waktu dan hari yang sama.
3. Penyiapan bahan uji
a. Pembersihan dan sortasi
b. Persiapan uji penangkapan radikal bebas DPPH
1) Pembuatan sari buah kersen
Sebanyak 50 gram buah kersen dan aquadest dengan volume
tertentu (1:1) dihancurkan dengan blender lalu sari disaring
menggunakan penyaring teh. Setelah itu, sari disaring lagi
menggunakan pompa vakum dengan melalui kain tetron.
2) Pembuatan fraksi air, kloroform, dan etil asetat sari buah kersen
Sari yang telah diperoleh kemudian dipartisi dengan kloroform
dalam corong pisah dengan perbandingan (1 : 1). Partisi dengan
sebanyak 30 kali. Selanjutnya fraksi air dipartisi lagi dengan etil
asetat 4x dengan penggojogan lemah sebanyak 30 kali. Maka
diperoleh fraksi air, kloroform, dan etil asetat sari buah kersen.
3) Pembuatan larutan induk fraksi air dan etil asetat sari buah kersen
Pada fraksi kloroform tidak dilakukan pengenceran sari
sedangkan pada fraksi air dan etil asetat dilakukan pengenceran.
Pengenceran fraksi air dan etil asetat dilakukan dengan
mengambil sebanyak 1,25 ml sari dan dimasukkan ke dalam labu
ukur 25,0 ml, lalu ditambahkan pelarut masing-masing (air atau
etil asetat) hingga tanda. Maka diperoleh larutan induk fraksi air
dan etil asetat sari buah kersen. Dilakukan replikasi sebanyak 5x
untuk masing-masing sampel yang dimulai dari tahap
penimbangan.
4) Pembuatan larutan seri konsentrasi fraksi air, kloroform, dan etil
asetat sari buah kersen
a) Fraksi Air
Pembuatan seri konsentrasi fraksi air buah kersen
dilakukan dengan memipet cairan sebanyak 50 µl; 62,5 µl; 75
µl; 87,5 µl; 1000 µ dari larutan induk fraksi air sari buah
kersen dan ditambahkan dengan aquadest hingga volume 5,0
ml. Diperoleh konsentrasi akhir 0,203 mg/mL; 0,254 mg/mL;
replikasi sebanyak 5x untuk masing-masing sampel yang
dimulai dari tahap penimbangan.
b) Fraksi Kloroform
Fraksi sari hasil partisi tadi digojog selama 1 menit
kemudian didiamkan selama 15 menit hingga terbentuk
endapan. Pembuatan larutan seri konsentrasi dilakukan dengan
mengambil cairan (bagian atas) dari fraksi kloroform sari buah
kersen sebanyak 7,0 ml; 7,5 ml; 8,0 ml; 8,5 ml; 9,0 ml dan
ditambahkan kloroform hingga volume 10,0 ml. Diperoleh
konsentrasi akhir 284,060 mg/mL; 304,350 mg/mL; 324,640
mg/mL, 344,930 mg/mL, dan 365,220 mg/mL. Dilakukan
replikasi sebanyak 5x untuk masing-masing sampel yang
dimulai dari tahap penimbangan.
c) Fraksi etil asetat
Pembuatan seri konsentrasi fraksi air buah kersen
dilakukan dengan mengambil cairan sebanyak 50 µl; 62,5 µl;
75 µl; 87,5 µl; 1000 µ dari larutan induk fraksi air sari buah
kersen dan ditambahkan dengan aquadest hingga volume 5,0
ml. Diperoleh konsentrasi akhir 11,368 mg/mL; 11,571 mg/mL; 11,774 mg/mL; 11,977 mg/mL; dan 12,180 mg/mL.
Dilakukan replikasi sebanyak 5x untuk masing-masing sampel
5)Pembuatan larutan kontrol
Dipipet sebanyak 0,2 ml metanol dan dimasukan ke dalam vial.
Ditambahkan 3,8 ml larutan DPPH 57,62 µM dan digojog selama 1
menit lalu dibiarkan selama 30 menit di tempat gelap. Serapan diukur
dengan spektrofotometer UV-Vis pada panjang gelombang 515 nm.
6)Pembuatan larutan DPPH 0,227 mM
Larutan DPPH (2,2-diphenyl-1-picrylhydrazyl) ditimbang sebanyak
22,4 mg DPPH dan dilarutkan dengan metanol di dalam labu ukur
sampai 250,0 ml.
7)Pembuatan larutan vitamin C 1 mM
Sebanyak lebih kurang 17,61 mg vitamin C ditimbang seksama dan
dilarutkan dengan aquadest dalam labu ukur 10,0 mL lalu diencerkan
dengan aquadest hingga tanda. Larutan harus selalu dibuat baru.
(Arini, 2007)
4. Pengujian dengan metode DPPH
a. Penentuan panjang gelombang serapan maksimum dan operating
time. Sebanyak 0,95 ; 1,9 ; 3,8 ml larutan DPPH ditambahkan
metanol hingga volume akhir 4,0 ml. Larutan dikocok 30 detik lalu
dibiarkan 30 menit di tempat gelap. Serapan larutan diukur dengan
spektrofotomer UV-Vis pada panjang gelombang 400-600 nm.
Penentuan operating time sampel sari buah kersen dengan memipet
sebanyak 0,95 ml larutan DPPH dan 900 µl sari uji buah kersen lalu
dan Risnawati, 2007). Serapan diukur pada panjang gelombang 515
nm selama 1 jam dengan interval waktu tiap 2 menit.
b. Uji penangkapan radikal bebas dari fraksi air, kloroform, dan etil
asetat sari buah Kersen. Masing-masing seri konsentrasi fraksi sari uji
buah Kersen diambil sebanyak 900 µl dan ditambah dengan 0,95 ml
larutan DPPH 0,227 mM, lalu ditambah metanol hingga volume akhir
4 ml.Serapan diukur menggunakan spektrofotometer UV-Vis pada
panjang gelombang 515 nm selama operating time untuk
masing-masing fraksi sari buah kersen.
5. Validasi Metode Uji Aktivitas Antioksidan
Hasil dari proedur 4a dan 4b divalidasi akurasi (%
recovery), presisi (%CV) spesifisitas (spektra kontrol), dan linearitas
(nilai r).
% Recovery = 100% (1)
% CV = ( ) x 100% (2)
6. Analisis Data
Besarnya aktivitas antioksidan dihitung dengan
menggunakan rumus :
% ℎ = (3)
Data absorbansi senyawa uji dan senyawa kontrol digunakan
untuk menghitung IC50 yaitu konsentrasi larutan sampel yang
dibutuhkan untuk menghambat 50% radikal bebas DPPH dengan
konsentrasi sari buah kersen (sumbu x) dengan % inhibisi (sumbu y).
Persamaan regresi linier : y = bx + a. Selanjutnya, data diuji
secara statistik untuk menentukan ada atau tidak adanya perbedaan
32 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Determinasi tanaman kersen dilakukan di Laboratorium
Farmakognosi-Fitokimia Fakultas Farmasi Universitas Sanata Dharma Yogyakarta menurut buku
acuan Flora Untuk Sekolah di Indonesia (van Steenis,1992). Determinasi ini
dilakukan untuk mengetahui kebenaran identitas tanaman yang akan diuji
sehingga kesalahan pengambilan sampel dalam suatu analisis fitokimia dapat
dihindari.
Dari hasil determinasi (Lampiran 1) dapat dinyatakan bahwa sampel
buah kersen yang digunakan dalam penelitian ini memang benar-benar diambil
dari tanaman Muntingia calabura L. (kersen).
B. Hasil Pengumpulan Bahan
Buah kersen diperoleh dari daerah Klitren Lor, Kecamatan
Gondokusuman III, Kota Yogyakarta. Pemanenan buah dilakukan pada waktu,
hari, dan tempat yang sama. Hal ini untuk menghindari variasi kandungan
senyawa aktif tanaman terkait kondisi lingkungan, waktu, dan umur panen yang
dapat mempengaruhi kandungan senyawa aktif tanaman Umur panen adalah
kondisi dimana tanaman sudah mencapai masak optimum dan siap untuk diambil
hasilnya. Pemanenan dapat dilakukan setiap musim. Pengambilan (pemanenan)
adalah buah yang secara visual menunjukkan ciri-ciri buah masak optimum. Buah
yang diambil adalah buah matang, segar, berwarna merah dan memiliki diameter
sekitar 1,5 cm. Buah yang diperoleh adalah sebanyak 50 g dan masing-masing
memiliki ukuran diameter sekitar 1,5 cm. Tanaman, buah, dan bunga kersen dapat
dilihat pada lampiran 2.
C. Hasil Preparasi Sampel
Preparasi sampel ini dilakukan untuk mendapatkan fraksi air, kloroform,
dan etil asetat sari buah kersen yang diduga dalam ketiga fraksi tersebut terdapat
senyawa antioksidan. Sampel yang digunakan merupakan buah kersen segar.
Digunakan sampel segar karena bertujuan untuk menjaga kestabilan senyawa
fenolik di dalam tanaman karena senyawa fenolik cenderung mengalami
perubahan susunan dengan adanya pengeringan atau pemanasan. Perubahan suhu
yang terjadi dapat menurunkan aktivitas antioksidan dari senyawa fenolik
(Markam, 1988). Adanya pemanasan yang dikatalisis oleh enzim fenol oksidase
atau polifenol oksidase dapat menyebabkan senyawa fenolik berubah menjadi
quinon dan kemudian dipolimerasi menjadi pigmen melaniadin. Senyawa fenolik
dalam bentuk polimer inilah yang tidak memiliki aktivitas antioksidan
(Handayani, 2011).
Buah kersen segar dicuci untuk menghilangkan pengotor-pengotor yang
terdapat pada permukaan buah. Buah kersen dipisahkan dari bagiannya yang tidak
dapat dimakan seperti Buah kersen dipisahkan dari bagiannya yang tidak dapat
digunakan agar kondisi sampel dapat disesuaikan dengan aplikasi penggunaannya
dimana hanya bagian buah yang dimakan yang digunakan sebagai sampel untuk
uji daya antioksidan sari buah kersen.
Buah kersen yang telah bersih diitambah aquadest dengan jumlah yang
sesuai dengan jumlah buah (1 : 1). Penambahan aquadest ini bertujuan untuk
mempermudah proses penghancuran buah menggunakan blender. Hasil
penghancuran buah kersen yang diperoleh dari proses menggunakan blender ini
masih sangat keruh dan cukup kental sehingga dilakukan penyaringan
menggunakan penyaring biasa dengan ukuran pori yang lebih besar dari pori-pori
kain tetron. Tujuan penyaringan ini adalah untuk mengurangi keberadaan
partikel-partikel besar dari larutan sari buah kersen agar diperoleh sari yang lebih jernih.
Setelah penyaringan tersebut, dilakukan penyaring lagi menggunakan penyaring
vakum evaporator dengan melalui kain tetron. Prinsip kerja yang digunakan
dalam penyaringan ini yaitu dengan meminimalisir suatu tekanan didalam sistem,
sehingga tekanan diluar sistem (lingkungan) menjadi lebih besar. Dan hal ini
kemudian akan mempercepat proses penyaringan ketika digunakan untuk
menyaring larutan pada suatu senyawa tertentu. Hasil dari penyaringan
menggunakan penyaring vakum evaporator dengan kain tetron ini masih keruh
akan tetapi sudah lebih jernih dari penampakkan visual sari sebelumnya.
Pada penelitian Kolar et al (2010), diketahui bahwa buah kersen
mengandung senyawa-senyawa fenolik dan flavonoid. Adapun kandungan kimia
buah kersen per 100 g, yaitu 77,8 g air; 0,384 g protein; 1,56 g lemak; 124,6 mg
riboflavin; 0,554 g niacin; dan 80,5 mg vitamin C (Morton, 1987). Terdapat
berbagai macam kandungan senyawa antioksidan dalam buah Kersen.
Masing-masing senyawa antioksidan tersebut tentu memiliki kelarutan yang berbeda-beda
pula, misalnya flavonoid. Senyawa-senyawa flavonoid adalah senyawa-senyawa
polifenol yang mempunyai 15 rantai linier yang terdiri dari tiga atom karbon.
Penyarian flavonoid dari dalam simplisia tumbuhan dapat dilakukan dengan
menggunakan pelarut polar, semi polar, maupun non polar sesuai dengan
kelarutan flavonoid yang diekstraksi. Kelarutan flavonoid berbeda-beda sesuai
golongan dan substitusinya (Robinson, 1995). Glikosida flavonoid merupakan
senyawa polar sehingga dapat larut dalam pelarut polar seperti air. Tetapi senyawa
flavonoid aglikon (flavonoid tanpa gula terikat) umumnya lebih mudah larut
dalam pelarut seperti eter dan kloroform (Markham, 1998). Karena itu, tidak
menutup kemungkinan adanya senyawa fenolik yang terlarut dalam air maupun
etil asetat yang bersifat semi polar. Berdasarkan hal tersebut, maka untuk
mengetahui potensi antioksidan dari sari buah kersen ini, peneliti melakukan uji
daya antioksidan pada fraksi air,kloroform,dan etil asetat sari buah kersen.
Digunakan 3 jenis pelarut dengan kepolaran yang berbeda dimaksudkan agar
dapat diketahui aktivitas dan daya antioksidan dari keseluruhan senyawa-senyawa
antioksidan yang terkandung dalam buah kersen. Dari ketiga fraksi sari tersebut, diharapkan pada fraksi air sari buah kersen dapat diuji daya antioksidan dari
kandungan sari buah kersen seperti vitamin C, glikosida flavonoid, dan
kandungan senyawa antioksidan lainnya yang terlarut di dalam pelarut polar
diuji daya antioksidan dari kandungan senyawa antioksidan dalam buah kersen
yang lebih larut dalam pelarut non polar (kloroform) seperti flavonoid aglikosida
atau pelarut semi polar (etil asetat) seperti senyawa-senyawa karotenoid.
Setelah penyaringan sebanyak 2 kali tersebut, didapatkan sari buah
kersen berwarna coklat muda. Sari buah kersen hasil penyaringan kemudian
dipartisi menggunakan kloroform dan dilanjutkan dengan partisi menggunakan
etil asetat. Partisi dilakukan dengan perbandingan volume larutan 1 : 1. Partisi sari
dengan pelarut aquadest menggunakan kloroform dan etil asetat ini merupakan
ekstraksi cair-cair. Ekstraksi cair-cair adalah proses untuk memisahkan analit
yang dituju dari pengganggu dengan cara melakukan partisi sampel antar 2 pelarut
tidak saling campur. Partisi sari dilakukan menggunakan corong pisah dengan
penggojogan lemah sebanyak 30kali. Penggojogan lemah pada proses ekstraksi
dimaksudkan agar tidak terbentuk emulsi yang dapat menyebabkan proses
pemisahan menjadi lebih lama (Matsuda, 2001).
Partisi sari (pelarut aquadest) dengan kloroform dilakukan
sebanyak 2x. Setelah digojog akan terjadi dua fase, yaitu fase atas adalah fase air
dan fase bawah adalah fase klorofom. Ini dikarenakanberat jenis kloroform lebih
besar (1,49 g/cm3) dari berat jenis air (1 g/cm3). Selanjutnya, fase kloroform ini dipisahkan dan fraksi air kembali disari dengan campuran yang sama sampai 3
kali. Pemilihan pelarut kloroform ini dikarenakan kloroform merupakan pelarut
organik bersifat non polar sehingga dengan partisi menggunakan kloroform ini
maka senyawa-senyawa antioksidan seperti flavonoid aglikon dan lainnya dapat
mengukur daya antioksidan fraksi kloroform sari buah kersen dapat diuji daya
antioksidan dari senyawa-senyawa antioksidan yang larut dalam kloroform
(misalnya : flavonoid aglikosida). Adapun perhitungan konsentrasi fraksi dan
perhitungan lainnya dapat dilihat pada lampiran 4.
Partisi sari (pelarut aquadest) dengan etil asetat dilakukan sebanyak 4x.
Setelah digojog akan terjadi dua fase yaitu fase atas adalah fase etil asetat dan fase
bawah adalah fase air. Ini dikarenakan berat jenis air (1 g/cm3) lebih besar dari
berat jenis etil asetat (0,8945 g/cm3). Selanjutnya, fase etil asetat ini dipisahkan dan fraksi air kembali disari dengan etil aetat sampai 3 kali. Pemilihan pelarut etil
asetat ini dikarenakan etil asetat merupakan pelarut organik bersifat semi polar
sehingga dengan partisi menggunakan etil asetat ini maka senyawa-senyawa
antioksidan seperti karotenoid dapat masuk dalam fraksi etil asetat tersebut.
Berdasarkan hal tersebut maka dapat diuji daya antioksidan dari senyawa-senyawa
antioksidan yang larut dalam fraksi etil asetat sari buah kersen (misalnya :
senyawa-senyawa karotenoid). Proses partisi dilakukan berulang sebanyak lebih
dari sekali (2x pada partisi air-kloroform dan 3x pada partisi air-etil asetat) agar
ekstraksi lebih efektif dan senyawa-senyawa antioksidan terlarut seluruhnya
dalam fraksi air, kloroform, atau pun etil asetat (sesuai kelarutan atau kepolaran
masing-masing senyawa antioksidan tersebut).
Selanjutnya dibuat larutan induk dari fraksi air dan etil asetat. Pada fraksi
kloroform tidak dilakukan pembuatan larutan induk karena berdasarkan hasil
orientasi konsentrasi, ternyata dibutuhkan konsentrasi yang cukup besar untuk
pengukuran serapan menggunakan spekrofotometer UV-Vis. Untuk fraksi
kloroform, dari larutan stok sari hasil partisi langsung dibuat larutan seri
konsentrasi. Pembuatan larutan induk fraksi air dan etil asetat dilakukan dengan
memipet sebanyak 1,25 ml fraksi air atau etil asetat sari buah kersen hasil partisi
kemudian ditambahkan pelarut masing-masing hingga volume akhir 25 ml. Dari
larutan induk ini kemudian dibuat larutan seri konsentrasi fraksi air dan etil asetat
sari buah kersen. Masing-masing dibuat dalam 5 seri konsentrasi.
Selama proses preparasi sampel, alat-alat gelas yang digunakan sebagai
tempat atau wadah bahan sampel dibungkus dengan alumunium foil agar tidak
terkena cahaya matahari atau sinar matahari langsung. Hal ini dikarenakan ada
beberapa senyawa pada sampel seperti vitamin C, flavonoid, dan
senyawa-senyawa fenolik yang dapat bereaksi oleh adanya cahaya dan juga dapat
mengalami kerusakan oleh sinar ultraviolet matahari.
D. Hasil Optimasi Metode Uji Aktivitas Antioksidan
Pengujian daya antioksidan fraksi air, kloroform, dan etil asetat sari buah
kersen menggunakan metode DPPH karena diperkirakan pada ketiga fraksi
tersebut terdapat senyawa-senyawa antioksidan yang dapat menangkap radikal
bebas DPPH. Selain itu, pemilihan metode DPPH ini juga dikarenakan metode ini
mudah digunakan, mempunyai tingkat sensitifitas yang tinggi, dan dapat
menganalisis sejumlah besar sampel dalam jangka waktu yang singkat (Kim et al,
Mekanisme reaksi antara senyawa uji dan DPPH yaitu molekul radikal
bebas DPPH akan bereaksi dengan atom hidrogen yang dilepaskan oleh senyawa
uji sehingga senyawa 1,1-difenil-2-pikrilhidrazil mengalami pengurangan
intensitas warna ungu atau menjadi warna kuning sampai jernih (Gulcin et al.,
2004). Berkurangnya intensitas warna ungu dari larutan DPPH menunjukkan
potensi aktivitas antioksidan dari senyawa uji. Secara kuantitatif dapat dihitung
dengan berkurangnya absorbansi larutan tersebut.
Pengukuran aktivitas penangkapan radikal bebas DPPH menggunakan
spektrofotometri. Radikal DPPH yang memiliki elektron bebas memberikan
serapan yang kuat pada panjang gelombang serapan maksimum pada 517 nm.
(Prakash, 2001). Oleh karena itu, dilakukan scanning panjang gelombang serapan
maksimum pada pelarut, sari buah kersen dan vitamin C pada daerah 400-600 nm
untuk memastikan bahwa tidak ada gangguan pengukuran pada daerah λmaks
DPPH tersebut. Adanya gangguan pengukuran pada daerah λmaks DPPH dapat
menyebabkan pengukuran absorbansi DPPH menjadi tidak akurat. Dari hasil
scanningλ maksimum terhadap pelarut (aquadest, kloroform, dan etil asetat), sari
buah kersen, dan vitamin C tidak menunjukkan adanya gangguan pada daerah
λmaks DPPH. Hasil scanning λmaks pada daerah 400-600 nm dapat dilihat pada
lampiran 5.
Sebelum melakukan pengujian aktivitas antioksidan senyawa uji perlu
dilakukan proses optimasi metode DPPH terlebih dahulu. Proses optimasi
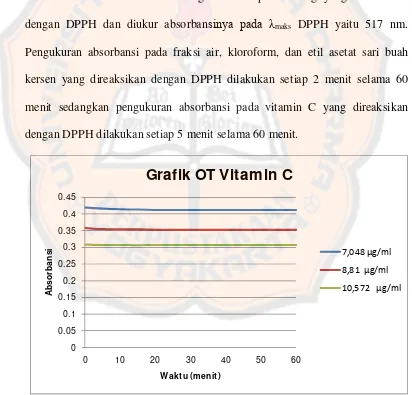
1. Penentuan operating time (OT)
Penentuan OT ini perlu dilakukan untuk memperoleh rentang waktu
dimana sari uji dan vitamin C sudah mereduksi radikal DPPH dengan
sempurna sehingga diperoleh nilai absorbansi yang stabil dengan demikian
kesalahan analisis dapat diminimalkan. Operating time dihitung mulai dari
larutan sampel maupun vitamin C direaksikan dengan DPPH. Penentuan OT
dilakukan terhadap tiga konsentrasi fraksi air, kloroform, dan etil asetat sari
buah kersen serta vitamin C sebagai larutan pembanding yang direaksikan
dengan DPPH dan diukur absorbansinya pada λmaks DPPH yaitu 517 nm.
Pengukuran absorbansi pada fraksi air, kloroform, dan etil asetat sari buah
kersen yang direaksikan dengan DPPH dilakukan setiap 2 menit selama 60
menit sedangkan pengukuran absorbansi pada vitamin C yang direaksikan
dengan DPPH dilakukan setiap 5 menit selama 60 menit.
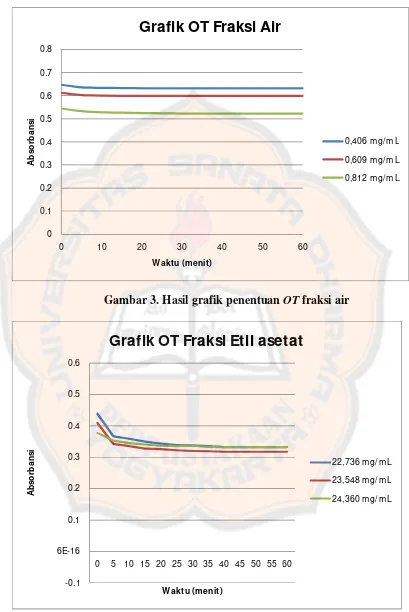
Gambar 3. Hasil grafik penentuan OT fraksi air
Gambar 5. Hasil grafik penentuan OT fraksi kloroform
Berdasarkan hasil yang diperoleh pada gambar 2 sampai 4, dari menit
ke-5 sampai ke-60 absorbansi larutan pembanding vitamin C, larutan uji fraksi
air dan fraksi etil asetat sari buah kersen semakin stabil. Hal ini menunjukkkan
bahwa reaksi antara vitamin C dan senyawa antioksidan pada fraksi etil asetat
dengan DPPH semakin sempurna. Dari hasil tersebut ditetapkan OT larutan
pembanding vitamin C pada menit 20, larutan uji fraksi air pada menit
ke-30, dan larutan uji fraksi etil asetat pada menit ke-40.
Pada gambar 5, dapat dilihat bahwa absorbansi larutan uji fraksi
kloroform pada waktu tertentu dapat menjadi stabil selama durasi tertentu
tetapi setelah itu menunjukkan adanya peningkatan kembali nilai absorbansi.
Hasil ini dimungkinkan karena lemahnya kemampuan senyawa antioksidan
pada fraksi kloroform untuk berinteraksi dengan DPPH. Berdasarkan hasil