PENETAPAN KADAR HIDROKUINON DALAM LARUTAN PENCERAH MEREK “A” YANG BEREDAR DI PASARAN DENGAN METODE
SPEKTROFOTOMETRI VISIBEL
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Shinta Lia Dewi Handoyo NIM : 048114096
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
ii
PENETAPAN KADAR HIDROKUINON DALAM LARUTAN PENCERAH MEREK “A” YANG BEREDAR DI PASARAN DENGAN METODE
SPEKTROFOTOMETRI VISIBEL
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Shinta Lia Dewi Handoyo NIM : 048114096
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
v
HALAMAN PERSEMBAHAN
Papa dan mama yang mengubah kisah hidupku
dengan berbagai cara mereka mengubah kekuranganku
menjadi kelebihan yang mengagumkan
dan membuatku mampu berjalan dengan tenang,
dan bahagia atas bayang-bayang kepedihanku
dan penderitaan yang kujalani.
Karya ini yang kupersembahkan untuk:
Papa dan mama yang selalu sabar dan membimbing saya
Kakak dan adikku yang selalu mendukung saya
vi
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa yang telah melimpahkan segala berkat, kasih, dan karunia-Nya untuk menyelesaikan penelitian dan penulisan skripsi yang berjudul “Penetapan Kadar Hidrokuinon dalam Larutan Pencerah
Merek”A” yang Beredar di Pasaran dengan Metode Spektrofotometri Visibel.” Skripsi ini disusun untuk memenuhi salah satu syarat tugas akhir untuk memperolehi gelar Sarjana Farmasi (S.Farm.) Program studi Ilmu Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam menyelesaikan penelitian dan penyusunan skripsi ini, penulis telah banyak mendapat bantuan baik moral maupun spiritual dan dukungan yang berupa bimbingan, dorongan, sarana, maupun fasilitas dari berbagai pihak dalam penulisan skripsi ini. Oleh karena itu penulis ingin mengucapkan terima kasih sebesar-besarnya kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Christine Patramurti, S.Si, M.Si., Apt. selaku dosen pembimbing atas kesabarannya membimbing, memberi saran dan kritik, dan pengarahan selama penyusunan proposal hingga selesainya skripsi ini.
3. Lucia Wiwid Wijayanti, M. Si., selaku dosen penguji yang telah meluangkan waktu untuk masukan, saran, dan kritik yang membangun selama penelitian.
vii
5. Rekan tim penelitian hidrokuinon (Leo dan Lian) yang selama ini telah membantu, menemani, mendukung dan menyemangati penulis selama penelitian dan penyusunan skripsi ini.
6. Segenap staf laboran terutama laboran lantai IV atas masukan, bantuan, kebersamaan dan kerjasamanya selama penelitian.
7. Acay telah membantu mencari teman yang dapat membuat gambar dan tata tulis. 8. Tris dan Putut telah membantu membuat gambar dan mengatur tata tulis selama ini. 9. Teman-teman FST 2004 atas persahabatan dan kekompakan selama kuliah.
10. Semua pihak lain yang tidak dapat penulis sebutkan satu persatu yang telah membantu penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa penelitian dan penyusunan skripsi ini masih memiliki kekurangan mengingat keterbatasan kemampuan dan pengetahuan penulis, maka penulis sangat mengharapkan saran dan kritik yang membangun dari semua pihak demi kemajuan dan kesempurnaan penelitian yang telah dilakukan. Semoga skripsi ini memberikan manfaat bagi orang lain yang membutuhkan.
viii
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak
memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan
dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 10 April 2010
Penulis
Shinta Lia Dewi Handoyo
x
INTISARI
Hidrokuinon merupakan salah satu zat aktif yang digunakan secara luas pada produk pencerah kulit. Penggunaan hidrokuinon harus dibatasi kadarnya karena penggunaannya dalam jumlah yang berlebihan akan menimbulkan efek samping yang berbahaya. Untuk melindungi kenyamanan dan keamanan bagi konsumen, hal itu sangat diperlukan kontrol kualitas produk larutan pencerah untuk mengetahui mutu produk yang dihasilkan sehingga kandungan hidrokuinonnya dapat diketahui dan hasilnya dapat dipertanggungjawabkan. Tujuan penelitian ini adalah untuk mengetahui kadar hidrokuinon dalam larutan pencerah merek “A” yang beredar di pasaran dengan metode spektrofotometri visibel.
Penelitian ini merupakan penelitian non eksperimental deskriptif menggunakan metode spektrofotometri visibel dengan pereaksi o-fenantrolina. Pemilihan metode ini didasarkan atas pembentukan komplek warna antara Fe2+ dan o-fenantrolina dengan adanya hidrokuinon sebagai agen pereduksi yang baik.
Berdasarkan analisis hasil, diperoleh kadar rata-rata hidrokuinon yang terkandung dalam sampel adalah 3,583 ± 0,085 % b/v. Dari data ini dapat disimpulkan bahwa sampel lebih besar dari persyaratan yang telah ditentukan oleh BPOM.
xi
ABSTRACT
Hydroquinone is one of active agent that can be used widely at product of bleaching skin. The uses of hydroquinone must be limited because abundant usage in a big concentractions can cause dangerous adverse effect. For protect consument confortabel and safety, so that quality control product is very needed to know quality of product is producted so that the hydroquinone content is knowable and the result can be guaranteed. Purpose of this research was know hydroquionone concentraction of bleaching solution merek”A” was revolved in market with visible spectophotometry method.
This study was a non experimental descriptive which was using visible spectrophotometry method with o-phenanthroline reagent. The choice the methods based on form a coloured complex ion from that amount of Fe2+ and o-phenanthroline with hydroquinone as a good reducing agent.
Based on the result analysis, it was found that the average concentraction of hydroquinone in the sample with the trade mark was 3,583 ± 0,085 % b/v. Based on the data, it can be concluded that sample was not conditional fulfilled in BPOM.
xii
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PRAKATA ... vi
PERNYATAAN KEASLIAN KARYA ... viii
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI ... ix
INTISARI ... x
ABSTRACT ... xi
DAFTAR ISI ... xii
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvii
BAB 1. PENDAHULUAN ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian Penelitian ... 3
3. Manfaat Penelitian ... 4
xiii
BAB II. PENELAAHAN PUSTAKA ... 6
A. Larutan ... 6
1. Pengertian larutan ... 6
2. Penggolongan tipe larutan ... 7
3. Faktor yang mempengaruhi kelarutan... 9
4. Kelebihan dan kekurangan sediaan larutan ... 11
B. Larutan Pencerah... 13
C. Hidrokuinon ... 14
1. Struktur dan sifat hidrokuinon ... 14
2. Penggunaan dan mekanisme kerja hidrokuinon ... 15
3. Efek samping hidrokuinon ... 16
D. Spektrofotometri Visibel ... 17
1. Deskripsi umum ... 17
2. Interaksi elektron dengan radiasi elektromagnetik (REM) ... 18
3. Analisis kuantitatif dengan spektrofotometri visible ... 25
4. Instrumentasi spektrofotometri visibel... 29
E. Senyawa kompleks...30
F. Hipotesis ... 37
BAB III. METODOLOGI PENELITIAN ... 38
A. Jenis dan Rancangan Penelitian ... 38
xiv
C. Bahan Penelitian ... 38
D. Alat Penelitian ... 39
E. Tata Cara Penelitian ... 39
1. Pembuatan larutan baku hidrokuinon ... 39
2. Pembuatan larutan besi (III) ... 39
3. Pembuatan larutan o-fenantrolina ... 40
4. Pembuatan larutan natrium asetat ... 40
5. Penetapan kadar hidrokuinon dalam sampel larutan pencerah ... 41
F. Analisis Hasil ... 42
BAB IV. HASIL DAN PEMBAHASAN ... 43
A. Optimasi Metode ... 43
1. Penentuan Operating Time (OT) ... 46
2. Penentuan panjang gelombang serapan maksimum... 48
3. Pembuatan kurva baku ... 52
B. Penetapan Kadar Hidrokuinon dalam Sampel Larutan Pencerah ... 55
1. Pemilihan sampel ... 55
2. Preparasi sampel ... 56
3. Penetapan kadar hidrokuinon ... 56
BAB V. KESIMPULAN ... 59
DAFTAR PUSTAKA ... 60
LAMPIRAN ... 64
xv
DAFTAR TABEL
Tabel I. Kategori kelarutan ... 7
Tabel II. Data replikasi seri baku hidrokuinon ... 3
xvi
DAFTAR GAMBAR
Gambar 1. Struktur hidrokuinon ... 14
Gambar 2. Reaksi oksidasi hidrokuinon menjadi kuinon ... 15
Gambar 3. Tingkat energi elektronik molekul ... 19
Gambar 4. Pengaruh pelarut polar pada transisi n → π* ... 21
Gambar 5. Pengaruh pelarut-pelarut pada transisi π → π* ... 22
Gambar 6. Instrumentasi spektrofotometer visibel ... 29
Gambar 7. Reaksi pembentukan senyawa kompleks [(C12H8N2)3Fe]2+ ... 32
Gambar 8. Spliting orbital d pada senyawa kompleks oktahedral ... 34
Gambar 9. Spliting orbital d pada Fe2+ dengan adanya ligan o-fenantrolina ... 35
Gambar 10. Transisi elektron dari orbital d ke π* ... 36
Gambar 11. Pembentukan ikatan koordinasi pada senyawa kompleks ... 36
Gambar 12. Reaksi Redoks antara besi (III) dan hidrokuinon ... 44
Gambar 13. Reaksi pembentukan senyawa kompleks berwarna ... 46
Gambar 14. Hasil penetapan operating time pada panjang gelombang 510,0 nm... 48
Gambar 15. Hasil pembacaan panjang gelombang serapan maksimum ... 51
xvii
DAFTAR LAMPIRAN
Lampiran 1. Data penimbangan hidrokuinon baku untuk kurva baku ... 64
Lampiran 2. Perhitungan seri kadar baku hidrokuinon ... 64
Lampiran 3. Hasil scanning Operating Time (OT) ... 65
Lampiran 4. Data Operating Time (OT) ... 66
Lampiran 5. Hasil scanning λ max kadar hidrokuinon ... 66
Lampiran 6. Data scanning λ max kadar hidrokuinon ... 67
Lampiran 7. Hasil scanning kurva baku hidrokuinon ... 67
Lampiran 8. Data kurva baku hidrokuinon ... 68
Lampiran 9. Kurva baku dari 3 replikasi ... 68
Lampiran 10. Komposisi sampel larutan pencerah hidrokuinon ... 69
Lampiran 11. Gambar kemasan larutan pencerah merek”A” telah beredar di pasaran .... 70
Lampiran 12. Hasil pembacaan serapan sampel ... 71
Lampiran 13. Data serapan sampel ... 73
Lampiran 14. Contoh perhitungan kadar hidrokuinon dalam sampel larutan pencerah ... 74
Lampiran 15. Data perhitungan KV (%) ... 74
BAB I PENDAHULUAN
A. Latar Belakang
Penggunaan produk kosmetik semakin berkembang di masyarakat terutama
produk pencerah yang biasa digunakan untuk menjaga penampilan dan mempercantik
penampilan tubuh seseorang. Produk pencerah ini dipercaya konsumen dapat
membuat penampilan tubuh seseorang tampak putih dan bersih seri sehingga lebih
percaya diri.
Sediaan pencerah kulit yang beredar di pasaran dalam bentuk larutan paling
disukai oleh konsumen karena mudah menyebar rata di permukaan kulit, tidak
lengket, tidak meninggalkan bekas, dan lebih mudah dibersihkan. Salah satu zat aktif
yang banyak terkandung dalam larutan pencerah kulit adalah hidrokuinon yang
berfungsi untuk menyerap UV dan mengurangi produksi melanin atau
menghilangkan bercak-bercak hitam pada kulit sehingga membuat kulit tampak lebih
putih (Anonim, 2005 b).
Penggunaan hidrokuinon sebagai agen pencerah kulit dapat dikategorikan
menjadi dua yaitu dua yaitu sebagai produk kosmetik dan sebagai obat. Dalam
produk kosmetika, kadar hidrokuinon ≤ 2% biasanya dijual secara bebas di pasaran.
Sedangkan dalam produk obat, hidrokuinon dijual berdasarkan resep dan pengawasan
dari dokter karena kadar yang digunakan umumnya lebih besar dibandingkan pada
tinggi tetapi dapat menimbulkan efek samping yang tidak diinginkan, misalnya:
kemerahan, rasa terbakar (panas), gatal, dan iritasi kulit ringan pada wajah. Oleh
karena itu penggunaan hidrokuinon harus dibatasi kadarnya.
Ada produk larutan pencerah yang mengandung hidrokuinon yang telah
beredar di pasaran namun tidak mencantumkan kadarnya. Dengan demikian, tidak
diketahui apakah kadar hidrokuinon dalam berbagai merek memenuhi persyaratan
BPOM atau tidak. Untuk melindungi kenyamanan dan keamanan bagi konsumen, hal
itu sangat diperlukan kontrol kualitas produk larutan pencerah untuk mengetahui
mutu produk yang dihasilkan sehingga kandungan hidrokuinonnya dapat diketahui
dan hasilnya dapat dipertanggungjawabkan. Pemilihan metode penetapan kadar
sangat penting karena dapat memberikan pengaruh hasil yang diperoleh. Metode
pilihan untuk menetapkan kadar harus merupakan metode yang sensitif, selektif, dan
praktis bagi senyawa tertentu. Metode-metode tersebut harus memenuhi kriteria
validitas metode uji di antaranya adalah akurasi dan presisi, sehingga hasil yang
diperoleh dapat dipertanggungjawabkan.
Pada penelitian ini digunakan metode spektrofotometri visibel menggunakan
pereaksi o-fenantrolina yang digunakan untuk analisis kuantitatif hidrokuinon.
Teknik spektrofotometri visibel mempunyai keunggulan karena senyawa yang
bersama-sama dengan hidrokuinon yang mengabsorpsi radiasi di daerah ultraviolet,
tidak akan mengganggu pengukuran serapan radiasi pada daerah sinar tampak. Selain
itu, pemilihan metode ini didasarkan atas pembentukan senyawa kompleks berwarna
agen pereduksi yang baik. Senyawa kompleks ini dapat diukur serapannya pada
panjang gelombang daerah visibel (Haris, 1999).
1. Permasalahan
Dari latar belakang tersebut di atas, permasalahan yang akan diteliti adalah:
a) Berapa kadar hidrokuinon dalam larutan pencerah merek “A” yang telah
beredar di pasaran dengan metode spektrofotometri visibel?
b) Apakah kadar hidrokuinon dalam sediaan kosmetik yang berbentuk larutan
memenuhi persyaratan yang ditentukan oleh BPOM?
2. Keaslian Penelitian
Sejauh penelusuran pustaka yang dilakukan penulis, penelitian yang telah
dilakukan berjudul ”Penetapan Kecermatan dan Keseksamaan Metode Kolorimetri
Menggunakan Pereaksi Floroglusin untuk Penetapan Kadar Hidrokuinon dalam Krim
Pemutih” (Ibrahim, dkk., 2004), “Validasi Metode Spektrofotometri Visibel
Menggunakan Pereaksi O-fenantrolina Pada Penetapan Kadar Hidrokuinon dalam
Krim Simulasi” (Leo, 2008), dan “Penetapan Kadar Hidrokuinon dalam Krim
Pemutih Berbagai Merk yang Beredar di Yogyakarta” (Liancy, 2008). Sedangkan
sepengetahuan penulis, penelitian tentang “Penetapan Kadar Hidrokuinon dalam
Larutan Pencerah Merek ”A” yang Telah Beredar di Pasaran dengan Metode
3. Manfaat Penelitian
a. Manfaat teoritis
Penelitian ini diharapkan dapat digunakan untuk memberi dan menambah
informasi bagi ilmu pengetahuan, khususnya dalam dunia kefarmasian
mengenai penetapan kadar hidrokuinon dalam larutan pencerah merek”A”
yang telah beredar di pasaran dengan menggunakan metode spektrofotometri
visibel”.
b. Manfaat metodologis
Penelitian ini dapat menjadi acuan tentang penggunaan metode
spektrofotometri visibel dengan pereaksi o-fenantrolina dalam penetapan
kadar hidrokuinon dan dapat digunakan untuk memberikan informasi bagi
konsumen mengenai mutu, keamanan, dan kemanfaatan hidrokuinon dalam
larutan pencerah merek “A” yang telah beredar di pasaran.
c. Manfaat praktis
Penelitian ini diharapkan dapat digunakan untuk memberi informasi kepada
masyarakat mengenai kadar hidrokuinon dalam larutan pencerah yang
bermanfaat bagi kecantikan dan kesesuaiannya dengan nilai yang tercantum
B. Tujuan Penelitian
1. Untuk mengetahui informasi besarnya kadar hidrokuinon yang terkandung di
dalam larutan pencerah merek”A” yang telah beredar di pasaran dengan metode
spektrofotometri visibel.
2. Untuk mengetahui apakah kadar tersebut memenuhi persyaratan yang ditentukan
BAB II
PENELAAHAN PUSTAKA
A. Larutan 1. Pengertian larutan
Larutan adalah sediaan cair yang mengandung satu atau lebih zat kimia yang
terlarut, misalnya: terdispersi merata secara molekuler dalam pelarut yang sesuai atau
campuran pelarut yang saling bercampur. Karena molekul-molekul dalam larutan
terdispersi secara merata, maka penggunaan larutan sebagai bentuk sediaan,
umumnya memberikan jaminan keseragaman dosis dan mempunyai ketelitian yang
baik jika larutan yang diencerkan atau dicampurkan (Anonim, 1995).
Larutan adalah campuran yang bersifat homogen antara molekul, atom
ataupun ion dari dua zat atau lebih. Disebut campuran karena susunannya atau
komposisinya dapat berubah. Disebut homogen karena susunannnya begitu seragam
sehingga tidak dapat diamati adanya bagian-bagian yang berlainan, bahkan dengan
mikroskop optis sekalipun (Anonim, 2010 b). Suatu larutan mengandung satu zat
terlarut atau lebih dari satu pelarut. Zat terlarut merupakan komponen yang
jumlahnya sedikit, sedangkan pelarut adalah komponen yang terdapat dalam jumlah
yang banyak. Komponen dari larutan ialah solute (solvendum) bersinggungan dengan
cairan (solvens), maka solute terbagi homogen atau terdispersi secara molekuler
Larutan topikal adalah larutan yang biasanya mengandung air tetapi seringkali
mengandung pelarut lain, seperti etanol dan poliol, untuk penggunaan topikal pada
kulit. Larutan pencerah ini tergolong dalam larutan topikal karena larutan ini
mengandung pelarut air (Anief, 2000).
Pernyataan kelarutan zat dalam bagian tertentu pelarut adalah kelarutan pada
suhu 200C, kecuali dinyatakan lain menunjukkan 1 bagian bobot zat padat atau bagian
zat cair larut dalam bagian volume tertentu pelarut. Pernyataan bagian dalam
kelarutan berarti 1 g zat padat atau 1 ml zat cair dalam sejumlah ml pelarut (Anief,
2000).
Tabel I. Kategori kelarutan (Anief, 2000)
Istilah kelarutan Jumlah bagian pelarut yang diperlukan untuk melarutkan
Sangat mudah larut Kurang dari 1
Mudah larut 1 – 10
Larut 10 – 30
Agak sukar larut 30 – 100
Sukar larut 100 – 1.000
Sangat sukar larut 1.000 – 10.000
Praktis tidak larut Lebih dari 10.000
2. Penggolongan tipe larutan
Berdasarkan pengenceran, macam-macam tipe larutan dapat dibagi menjadi 2 yaitu:
a. Larutan encer yaitu jumlah zat A yang terlarut kecil.
b. Larutan pekat yaitu larutan yang mengandung fraksi zat A yang besar (Anonim,
Berdasarkan kejenuhan, macam-macam tipe larutan dapat dibagi menjadi 3 yaitu:
a) Larutan tak jenuh (unsaturated)
Adalah jika jumlah solute yang terlarut kurang dari kelarutannya. Larutan tak jenuh lebih encer (kurang pekat) dibandingkan dengan larutan jenuh (Anonim, 2010 b).
b) Larutan jenuh (saturated)
Adalah larutan yang mengandung zat terlarut dalam jumlah yang diperlukan
untuk adanya kesetimbangan antara solute yang terlarut dan yang tak terlarut.
Banyaknya solute yang melarut dalam pelarut yang banyaknya tertentu untuk
menghasilkan suatu larutan jenuh disebut kelarutan zat itu (Anonim, 2010 b).
Larutan yang telah mengandung zat terlarut dalam jumlah maksimal, sehingga
tidak dapat ditambahkan lagi zat terlarut. Pada keadaan jenuh telah terjadi
kesetimbangan antara solut yang larut dan tak larut atau kecepatan pelarutan sama
dengan kecepatan pengendapan. Kelarutan NaCl adalah 36 gram/100 gram air
(pada suhu 20oC). Apabila kita letakkan 40 gram NaCl dalam 100 gram air (pada
suhu pada 20oC), 36 gram akan larut dalam air tersebut.Yang selebihnya (4 gram)
masih dalam keadaan yang tidak larut sehingga terjadi larutan jenuh (Anonim,
2010 b).
c) Larutan lewat jenuh (supersaturated)
dalam pelarut dingin. Jika dalam larutan yang panas itu masih tersisa zat terlarut yang sudah tak dapat melarut lagi, maka sisa itu harus disingkirkan dan tidak boleh ada zat lain yang masuk. Kemudian larutan itu didinginkan hati-hati dengan cara didiamkan untuk menghindari pengkristalan. Jika tidak ada solute yang memisahkan diri (mengkristal kembali) selama pendinginan, maka larutan dingin yang diperoleh bersifat lewat jenuh. Larutan lewat jenuh yang dapat dibuat dengan cara ini misalnya larutan dari sukrosa, natrium asetat dan natrium tiosulfat (hipo). Larutan lewat jenuh merupakan suatu sistem metastabil. Larutan ini dapat diubah menjadi larutan jenuh dengan menambahkan kristal yang kecil (kristal inti/bibit) umumnya kristal dari
solute. Kelebihan molekul solute akan terikat pada kristal inti dan akan mengkristal kembali (Anonim, 2010 b).
3. Faktor yang mempengaruhi kelarutan
Faktor-faktor yang mempengaruhi kelarutan yaitu:
a. Bahan zat yang dilarutkan (solute) dan bahan pelarut (solven) yang digunakan.
Bahan solut dan solven dapat dipengaruhi oleh beberapa faktor yaitu:
1) Perbandingan antara solute dan solven.
Daya larut maksimal dari suatu zat padat dalam suatu cair dinyatakan di
dalam buku resmi (Farmakope). Contohnya: daya larut zat X dalam air = 1 :
10 berarti 1 gram zat X dengan 10 ml air sudah merupakan larutan yang jenuh
2) Pengaruh Jenis Zat pada Kelarutan
Prinsipnya adalah like dissolves like. Zat-zat dengan struktur kimia yang mirip
umumnya dapat saling bercampur dengan baik, sedangkan zat-zat yang
struktur kimianya berbeda umumnya kurang dapat saling bercampur
(Anonim, 2010 b).
3) Sifat polaritas zat terlarut dan pelarut
Prinsipnya adalah like dissolves like. Senyawa yang bersifat polar akan mudah
larut dalam pelarut polar, sedangkan senyawa nonpolar akan mudah larut
dalam pelarut nonpolar. Contohnya alkohol dan air bercampur sempurna
(completely miscible), air dan eter bercampur sebagian (partially miscible),
sedangkan minyak dan air tidak bercampur (completely immiscible) (Anonim,
2010 b).
b. Suhu
Umumnya meningkatkan suhu sehingga meningkatkan kecepatan daya larut.
Kelarutan gas umumnya berkurang pada temperatur yang lebih tinggi. Misalnya
jika air dipanaskan, maka timbul gelembung-gelembung gas yang keluar dari
dalam air, sehingga gas yang terlarut dalam air tersebut menjadi berkurang.
Kebanyakan zat padat yang kelarutannya lebih besar pada temperatur yang lebih
tinggi. Ada beberapa zat padat yang kelarutannya berkurang pada temperatur
yang lebih tinggi, misalnya natrium sulfat dan serium sulfat. Pada larutan jenuh
terdapat kesetimbangan antara proses pelarutan dan proses pengkristalan
bersifat eksoterm. Jika temperatur dinaikkan, maka sesuai dengan azas Le
Chatelier kesetimbangan itu bergeser ke arah proses endoterm. Jadi jika proses
pelarutan bersifat endoterm, maka kelarutannya bertambah pada temperatur yang
lebih tinggi. Sebaliknya jika proses pelarutan bersifat eksoterm, maka
kelarutannya berkurang pada suhu yang lebih tinggi (Anonim, 2010 b).
c. Ukuran partikel dan kecepatan difusi
Ukuran partikel besar yang mengakibatkan kecepatan larutan kecil sehingga
menurunkan kecepatan difusi, sedangkan ukuran partikel kecil yang dapat
mengakibatkan kecepatan kelarutan besar sehingga menaikkan kecepatan difusi
karena adanya luas permukaannya besar (Anief, 2000).
d. Sifat-sifat fisika dan kimia
Faktor yang mempengaruhi sifat-sifat fisika dalam kelarutan yaitu penggojokan
selama proses pelarutan. Sedangkan faktor yang mempengaruhi sifat-sifat kimia
dalam kelarutan yaitu keasaman dan kebasaan (Anief, 2000).
4. Kelebihan dan kekurangan sediaan larutan
Kelebihan sediaan larutan yaitu:
a. Murah dalam biaya produksi dan biaya produk
b. Mudah diaplikasikan pada kulit dan mudah didistribusikan pada kulit secara
merata dan cepat pada permukaan kulit yang luas karena tidak lengket
c. Segera kering pada kulit setelah pemakaian dan meninggalkan lapisan tipis dari
d. Mudah mengalami modifikasi dosis apabila diperlukan atau dosis dapat
diubah-ubah dalam pembuatan.
e. Konsentrasi zat atau obat dalam takaran tertentu dapat tepat karena larutan
homogen.
f. Kejernihan larutan dapat memberikan kesan yang menyenangkan.
g. Dapat diberikan dalam larutan encer.
h. Kerja awal obat lebih cepat karena obat cepat diabsorpsi.
i. Mudah diberi pewangi, pewarna, dan lain-lain (Ansel, 1989; Sri et al., 2001).
Kelemahan sediaan larutan yaitu:
a. Tidak cocok untuk obat-obat yang tidak stabil dalam cairan.
b. Sukar menutupi bau dan rasa yang tidak enak.
c. Tidak cocok untuk obat-obat yang tidak larut dalam cairan.
d. Larutan bersifat voluminous dan tidak praktis, sehingga kurang menyenangkan
untuk diangkut dan disimpan. Apabila kemasan rusak, keseluruhan sediaan tidak
dapat dipergunakan.
e. Stabilitas dalam bentuk sediaan larutan biasanya kurang baik jika dibandingkan
dengan bentuk sediaan lain, terutama jika bahan mudah terhidrolisis.
f. Kemungkinan terjadinya reaksi kimia dalam bentuk larutan di mana air sebagai
katalisator.
g. Larutan merupakan media ideal untuk pertumbuhan mikroorganisme, oleh karena
B. Larutan Pencerah
Larutan pencerah merupakan campuran bahan kimia dan atau
bahan lainnya dalam sediaan larutan yang berkhasiat mampu memucatkan noda hitam
(cokelat) pada kulit. Dalam jangka waktu lama, larutan tersebut dapat menghilangkan
atau mengurangi hiperpigmentasi pada kulit. Namun, penggunaan yang
terus-menerus justru akan menimbulkan pigmentasi dengan efek permanen (Anonim, 2006
a).
Larutan pencerah yang mengandung zat aktif hidrokuinon dapat berubah
warna dari putih menjadi warna coklat selama 3 – 4 bulan (Maibach, 2000). Larutan
pencerah dapat disimpan dalam botol berwarna coklat dan putih. Larutan pencerah
yang disimpan botol berwarna coklat, karena hal ini digunakan untuk menghindari
kerusakan obat karena cahaya sehingga tidak dapat terjadi degradasi obat oleh
cahaya. Sedangkan larutan yang disimpan dalam botol putih untuk menghambat
oksidasi.
Larutan hidrokuinon merupakan produk yang baik dalam mengatasi melasma
dengan atau tanpa bahan kimia untuk pengelupasan kulit (Maibach, 2000). Menurut
Keputusan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia nomor
HK.00.05.4.1745 Bab II Pasal 3, Larutan pencerah dengan kandungan hidrokuinon
termasuk kosmetika golongan Ic yaitu kosmetika yang mengandung bahan dengan
persyaratan kadar dan penandaan seperti termuat pada lampiran I no 47 (Anonim,
C. Hidrokuinon 1. Struktur dan sifat hidrokuinon
Hidrokuinon atau 1,4 benzendiol adalah senyawa organik aromatik dengan
tipe fenol yang mempunyai rumus kimia C6H6O2, dan memiliki dua gugus hidroksil
(-OH) yang berikatan dengan cincin aromatik/benzene pada posisi para (Wenninger
et al., 2000). Rumus bangun hidrokuinon adalah
HO OH
hidrokuinon
Gambar 1. Struktur hidrokuinon
Hidrokuinon mengandung tidak kurang dari 99,0% dan tidak lebih dari
100,5% C6H6O2 dihitung terhadap zat anhidrat. Hidrokuinon merupakan substansi/zat
kristal berbentuk jarum halus, putih, mudah menjadi gelap jika terpapar cahaya dan
udara (Anonim, 1995). Hidrokuinon mudah larut dalam air (1 dalam 17 bagian air),
dalam etanol (1 dalam 4 bagian etanol), dalam kloroform (1 dalam 51 bagian
kloroform), dan dalam eter (1 dalam 16,5 bagian eter) (Anonim, 1995).
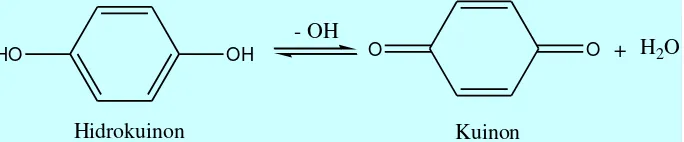
Larutan hidrokuinon akan berwarna coklat dikarenakan proses oksidasi
dengan adanya udara. Dalam suasana basa, hidrokuinon akan mengalami oksidasi
dengan cepat, oksidasi ini bersifat reversibel yaitu senyawa dikarbonil (kuinon)
mudah direduksi kembali menjadi senyawa dihidroksi (hidrokuinon), karena
OH
Gambar 2. Reaksi oksidasi hidrokuinon menjadi kuinon (Anonim, 1996)
2. Penggunaan dan mekanisme kerja hidrokuinon
Hidrokuinon yang digunakan sebagai agen pencerah atau depigmentasi untuk
memutihkan kulit dan menghilangkan kulit yang dalam kondisi hiperpigmentasi
seperti melasma, bercak-bercak atau bintik–bintik hitam, dan lentigines. Karena
mampu mengelupas kulit bagian luar dan menghambat pembentukan melanin pada
kulit (Anonim, 2006a). Melanin adalah pigmen pada kulit yang memberikan warna
gelap atau coklat (Anonim, 2010b). Penggunaannya membutuhkan waktu beberapa
minggu sebelum muncul suatu efek, tapi depigmentasi terjadi setelah 2-6 bulan.
Aplikasi hidrokuinon harus dihentikan jika tidak ada peningkatan setelah melindungi
2 bulan perawatan. Hidrokuinon harus digunakan dua hari sekali hanya untuk kulit
dari sinar matahari dan mengurangi depigmentasi (Anonim, 1999). Selain itu,
kegunaan hidrokuinon adalah sebagai antioksidan dalam fotografi (pencucian film)
untuk mereduksi ion perak menjadi logam perak halida, sebagai penghambat
polimerisasi, sebagai bahan dasar herbisida, karet antioksidan, dan bahan pewarna
rambut (Wenningner et al., 2000).
Hidrokuinon sendiri merupakan zat aktif yang paling banyak digunakan dalam
dapat menginaktivasi enzim tirosinase melalui penghambatan reaksi oksidasi
enzimatik dari tirosin ke 3,4-dihidroksifenilalanin (Wilkinson et al., 1982). Enzim
tirosinase ini merupakan enzim utama dalam pembentukan melanin, sehingga jika
kerjanya dihambat maka jumlah pigmen melanin pemberi warna gelap atau cokelat
kulitpun menjadi berkurang sehingga menjadi kulit lebih putih (Anonim, 2006 a).
Hidrokuinon bekerja menghalangi pengeluaran melanin oleh enzim tirosinase pada
melanosit yang terletak di lapisan epidermis kulit, mendegradasi melonosom pada
kulit, menembus lapisan kulit, dan menyebabkan penebalan pada lapisan kolagen.
Produksi melanin oleh enzim tirosinase pada melanosit ini biasanya diaktifasi oleh
sinar matahari, hormonal, penyakit, obat, alergi dan iritasi yang akhirnya membuat
kulit menjadi berflek, berwarna tak merata dan lebih gelap dari sebelumnya (Daniel,
2010).
3. Efek samping hidrokuinon
Kosmetik hidrokuinon boleh dipasarkan tetapi harus berdasarkan resep dari dokter.
Penggunaan dalam kosmetika bebas tidak boleh lebih dari 2% dan penggunaan
hidrokuinon lebih dari 2% b/b termasuk golongan obat keras yang hanya dapat
digunakan berdasarkan resep dokter sebab dapat mengakibatkan iritasi kulit, kulit
menjadi merah dan terbakar, kelainan pada ginjal (nephropathy), kanker darah
(leukemia) dan kanker sel hati (hepatocelluler adenoma) (Anonim, 2007). Selain itu,
penggunaan hidrokuinon yang berlebihan juga dapat menyebabkan oochronosis (kulit
berbintil seperti pasir dan berwarna coklat kebiruan, serta terasa gatal dan seperti
D. Spektrofotometri Visibel 1. Deskripsi Umum
Spektrofotometer visibel adalah anggota teknik analisis spektroskopik yang
memiliki sumber radiasi elektromagnetik sinar tampak (380-780 nm) dengan
memakai instrumen spektrofotometer. Radiasi elektromagenetik dalam rentang
panjang gelombang 380 – 780 nm merupakan radiasi yang dapat dilihat indera
penglihatan manusia sehingga disebut cahaya tampak (visible) (Suharman, 1995).
Spektrofotometer visibel termasuk dalam spektrofotometri serapan yang
melakukan pengukuran suatu interaksi antara radiasi elektromagnetik (REM) dan
materi (atom zat kimia, ion, atau molekul) sehingga mengalami peningkatan energi
elektronik dari tingkat dasar (ground state) ke tingkat energi yang lebih tinggi
(excited state) saat peralihan atau transisi elektronik. Transisi ini terjadi bila energi
yang dihasilkan oleh radiasi sama dengan energi yang diperlukan untuk melakukan
transisi. Transisi elektronik ditentukan oleh konfigurasi elektron pada molekul
senyawa tersebut, maka transisi ditentukan struktur molekul. Oleh karena itu molekul
yang berbeda strukturnya mempunyai tingkat energi yang berbeda dan setiap jenis
molekul menyerap radiasi pada daerah spektrum tertentu karena hal ini yang menjadi
dasar analisis kualitatif dengan metode ini. Sedangkan banyaknya cahaya yang
diserap di frekuensi atau panjang gelombang tertentu sesuai transisi elektron yang
terjadi karena hal ini menentukan intensitas serapan yang menjadi dasar analisis
Pada kenyataannya, spektrum visibel yang merupakan korelasi antara serapan
(sebagai ordinat) dan panjang gelombang (sebagai absis) tidak merupakan garis
spektrum, tetapi sebagai pita spektrum. Terbentuknya pita spektrum visibel tersebut
disebabkan transisi energi yang tidak sejenis dan terjadinya eksitasi elektronik lebih
dari satu macam pada gugus molekul yang kompleks (Rohman, 2007).
2. Interaksi elektron dengan radiasi elektromagnetik (REM)
Dalam spektrofotometri, larutan sampel akan mengabsorpsi REM dengan
energi yang sesuai dan jumlah yang diserap tersebut berhubungan dengan konsentrasi
dari analit dalam larutan. Suatu molekul mengabsorpsi foton dengan energi yang
sesuai untuk menjalani suatu transisi (Christian, 2004). Jenis-jenis absorpsi yang
dapat terjadi antara lain:
a. Absorpsi yang melibatkan transisi elektron ikatan dan elektron anti ikatan.
Semua molekul organik mampu menyerap REM karena semua molekul organik
mempunyai elektron valensi yang dapat dieksitasikan ke tingkat energi yang lebih
tinggi yang dikenal sebagai elektron anti bonding. Transisi-transisi elektronik yang
terjadi di antara tingkat-tingkat energi di dalam suatu molekul ada 4 yaitu: transisi
sigma-sigma star (ϭ→ ϭ*), transisi n – sigma star (n → ϭ*), transisi n – phi star (n
Gambar 3. Tingkat energi elektronik molekul
1) Transisi atau eksitasi elektron ϭ→ ϭ*
Dibutuhkan energi paling besar untuk menginduksi terjadinya transisi ϭ → ϭ*
dan terjadi pada daerah ultraviolet jauh (λ <180 nm) yang dihasilkan oleh ikatan
tunggal kovalen dan menduduki orbital ϭ, sebagai contoh pada alkana yang
memiliki ikatan karbon-karbon dan karbon-hidrogen (Skoog et al., 1994).
2) Transisi n → ϭ*
Senyawa-senyawa organik jenuh yang mengandung atom dengan pasangan
elektron bebas, seperti oksigen, nitrogen, belerang atau halogen dan struktur
molekul kimia yang mengandung senyawa kromofor organik berupa gugus
karbonil-karbonil mampu melakukan transisi n → ϭ*. Secara umum, energi
transisi yang dibutuhkan lebih kecil daripada transisi ϭ → ϭ* dan memiliki
panjang gelombang antara 150 – 250 nm (Skoog et al., 1998).
Akibatnya adalah nilai absorbsitivitas molar (€) antara 100-3000 liter.cm-1.mol-1
dan pergeseran biru (hipsokromik) dari pelarut yang lebih polar (pergeseran
3) Transisi n → π*
Transisi dari jenis ini meliputi transisi elektron-elektron heteroatom tak berikatan
ke orbital anti ikatan π*. Serapan ini terjadi pada panjang gelombang yang
panjang dan intensitas rendah (Skoog et al., 1998). Struktur molekul kimia yang
mengandung senyawa kromofor organik berupa gugus karbonil-karbonil,
karboksil, amida, azo, nitro, nitroso, dan nitrat; dan gugus auksokrom organik
merupakan gugus fungsional yang mempunyai elektron bebas, seperti –OH, O,
-NH2, dan –OCH3yang mampu melakukan transisi n → π* (Rohman, 2007).
Dalam kebanyakan molekul-molekul yang menunjukkan transisi n → π* dari
keadaan dasar lebih polar dibandingkan dengan keadaan tereksitasi. Secara
khusus, pelarut-pelarut yang berikatan hidrogen akan berinteraksi secara lebih
kuat dengan pasangan elektron yang tidak berpasangan pada molekul dalam
keadaan dasar dibanding pada molekul dalam keadaan tereksitasi. Akibatnya
adalah transisi n → π* mempunyai energi yang lebih besar sehingga
menimbulkan pergeseran hipsokromik (pergeseran biru) dari pelarut yang polar
dan nilai absorbsitivitas molar (€) antara 10-100 liter.cm-1.mol-1. Karena adanya
kemampuan untuk membentuk ikatan hidrogen (polaritas) pelarut yang
Pelarut non polar
Pelarut polar Energi
Gambar 4. Pengaruh pelarut polar pada transisi n → π*
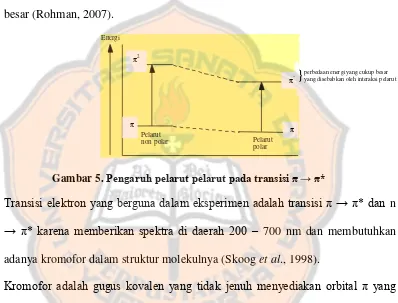
4) Transisi π → π*
Transisi ini dihasilkan oleh ikatan rangkap dua dan tiga dari senyawa organik
apabila molekul menyerap energi di daerah ultraviolet jauh yaitu dapat berupa
alkena dan alkuna yang lebih mudah untuk tereksitasi dengan adanya radiasi
elektromagnetik. Transisi ini juga paling mudah terbaca dan bertanggung jawab
terhadap spektra elektronik pada panjang gelombang antara 200 – 700 nm
(Skoog et al., 1998).
Dalam kebanyakan transisi π → π*, molekul dalam keadaan dasar relatif non
polar, dan keadaan tereksitasinya lebih polar dibanding keadaan dasar. Jika
pelarut polar digunakan pada molekul yang mengalami transisi ini, maka akan
menyebabkan pelarut polar berinteraksi (stabilisasi) lebih kuat dengan keadaan
tereksitasi dibandingkan dengan keadaan dasar, sehingga perbedaan energi
transisi π → π* pada pelarut yang polar ini lebih kecil. Akibatnya adalah
menimbulkan pergeseran batokromik (pergeseran merah) dari pelarut yang polar
(pergeseran pita absorpsi panjang gelombang serapan maksimum ke arah panjang
gelombang yang lebih panjang) dan nilai absorbtivitas molar (€) antara 1.000
-10.000 liter.cm-1.mol-1. Karena adanya terikatnya gugus auksokrom pada gugus
kromofor atau adanya konjugasi antara dua atau lebih kromofor. Semakin
panjang ikatan terkonjugasinya, maka panjang gelombang maksimalnya makin
besar (Rohman, 2007).
Pelarut
non polar Pelarut
polar Energi
Gambar 5. Pengaruh pelarut pelarut pada transisi π → π*
Transisi elektron yang berguna dalam eksperimen adalah transisi π → π* dan n
→ π* karena memberikan spektra di daerah 200 – 700 nm dan membutuhkan
adanya kromofor dalam struktur molekulnya (Skoog et al., 1998).
Kromofor adalah gugus kovalen yang tidak jenuh menyediakan orbital π yang
dapat menyerap radiasi elektromagnetik di daerah ultraviolet dan sinar tampak.
Molekul yang mengandung kromofor disebut kromogen. Auksokrom merupakan
gugus fungsional yang tidak menyerap radiasi elektromagnetik di daerah
ultraviolet dan sinar tampak bila berdiri sendiri, tetapi kehadirannya dalam
molekul dapat menyebabkan perubahan puncak kromofor ke panjang gelombang
yang lebih panjang (pergeseran merah = batokromik) dan meningkatkan
intensitasnya (efek hiperkromik) ketika terikat langsung pada kromofor
(Christian, 2004; dan Sastrohamidjojo, 1991).
b. Absorpsi yang melibatkan transisi elektron d dan f dari molekul kompleks.
Transisi ini kebanyakan terjadi pada logam transisi. Untuk golongan lantanida dan
aktanida, proses absorbsi dihasilkan oleh transisi elektronik dari elektroni 4f dan 5f.
Untuk logam transisi seri pertama dan kedua, transisi elektronik dari elektron 3d dan
4d yang bertanggung jawab terhadap proses absorpsinya. Logam transisi memiliki
orbital d yang masih kosong sebagian (3d dan 4d) yang masing-masing dapat
mengakomodasi sepasang elektron dan berikatan dengan suatu ligan membentuk
kompleks serta menghasilkan spektra tertentu. Berikut ini merupakan urutan ligan
berdasarkan kekuatan medan yang ditimbulkannya I- < Br- < Cl- < F- < OH- < C2O4
2-< H2O 2-< SCN- < NH3 < etilendiamina < o-fenantrolina < NO2- < CN-. Semakin besar
kekuatan medannya maka panjang gelombang serapan maksimumnya menurun sebab
energinya meningkat (Skoog et al., 1998).
c. Absorpsi yang melibatkan charge transfer (perpindahan muatan).
Penyerapan radiasi oleh senyawa kompleks logam berbeda dengan senyawa organik
karena melibatkan perpindahan muatan dari donor elektron ke akseptor elektron yaitu
pergerakan elektron dari ion logam ke ligan atau sebaliknya. Absorpsi tipe ini sangat
penting dalam suatu analisis, karena perpindahan muatan dari spesies-spesies
mempunyai daya serap molar yang sangat besar (Ɛmax >10.000). Oleh karena itu,
yang melakukan absorpsi dengan charge transfer biasanya disebut kompleks
perpindahan muatan. Contoh dari kompleks ini yaitu kompleks tiosianat dan fenol
dengan besi (III), kompleks o-fenantrolina dengan besi (II), kompleks heksasianoferat
(II)/heksasianoferat (III) yang bertanggung jawab atas warna Prussian blue (Skoog et
al., 1998).
Pada umumnya kompleks charge transfer yang melibatkan suatu ion logam,
logam bertindak sebagai penerima elektron (acceptor) dan ligan sebagai donor
elektron terkecuali untuk kompleks besi (II) dengan o-fenantrolina dimana ligannya
merupakan penerima elektron sedangkan ion logam berperan sebagai donor elektron
(Skoog et al., 1998).
Saat transisi, terjadi reduksi-oksidasi antara ion logam dan ligan. Biasanya,
ion logam tereduksi dan ligan teroksidasi. Ion logam berada pada status oksidasi
terendah, dikompleks oleh ligan dengan afinitas elektron tinggi yang dapat
teroksidasi tanpa merusak kompleks (Christian, 2004). Kecenderungan perpindahan
elektron akan meningkat jika energi radiasi yang dibutuhkan untuk terjadinya proses
perpindahan muatan kecil. Kompleks yang dihasilkan akan menyerap pada panjang
gelombang yang besar (Rohman, 2007).
Secara eksperimental sangat mudah untuk mengukur banyaknya radiasi yang
diserap oleh suatu molekul sebagai fungsi frekuensi radiasi. Suatu grafik yang
menghubungkan antara banyaknya sinar yang diserap dengan frekuensi (atau panjang
gelombang) sinar merupakan spektrum absorpsi. Transisi yang dibolehkan untuk
spektra absorpsinya berbeda. Dengan demikian spektra dapat digunakan sebagai
bahan informasi yang bermanfaat untuk analisis kualitatif. Banyaknya sinar yang
diabsorbsi pada panjang gelombang tertentu sebanding dengan banyaknya molekul
yang menyerap radiasi, sehingga spektra absorpsi juga dapat digunakan untuk analisis
kuantitatif (Rohman, 2007).
3. Analisis kuantitatif dengan spektrofotmetri visibel
Dalam aspek kuantitatif, suatu berkas radiasi dikenakan pada cuplikan
(larutan sampel) dan intensitas sinar radiasi yang diteruskan diukur besarnya. Radiasi
yang diserap oleh cuplikan ditentukan dengan membandingkan intensitas sinar yang
diteruskan bila spesies penyerap yang tidak ada dengan intensitas sinar radiasi yang
diteruskan bila penyerap ada. Intensitas sinar yang diteruskan bila tidak ada spesies
penyerap merupakan intensitas sinar yang masuk dikurangi dengan yang hilang oleh
penghamburan, pemantulan, dan serapan oleh konsituen lain (Sastrohamidjojo, 1991).
Besarnya radiasi elektromagnetik (monokromatik) yang dapat diserap oleh
kromofor dapat digambarkan dengan dua hukum klasik, yaitu hukum Lambert dan
Beer. Hukum Lambert menyatakan bahwa bila cahaya monokromik melewati
medium tembus cahaya, laju berkurangnya intensitas oleh bertambahnya ketebalan,
berbanding lurus dengan intensitas cahaya. Hukum Beer menyatakan bahwa
intensitas berkas cahaya monokromatik berkurang secara eksponensial dengan
bertambahnya konsentrasi zat penyerap secara linier (Basset et al., 1994).
Syarat-syarat penggunaan Hukum Beer yaitu:
Pada konsentrasi tinggi, jarak rata-rata di antara zat pengabsorbsi kecil,
sehingga masing-msing zat mempengaruhi distribusi muatan tetangganya.
b. Syarat kimia
Zat pengabsorbsi tidak boleh berdisosiasi, berasosiasi, atau bereaksi
dengan pelarut menghasilkan suatu produk pengabsorpsispektrum yang berbeda
dari zat yang dianalisis.
c. Syarat cahaya
Hukum Beer hanya berlaku untuk cahaya yang betul-betul monokromatik.
d. Syarat kejernihan
Kekeruhan larutan akan menyebabkan penyimpangan Hukum beer.
Sebagian cahaya akan dihamburkan oleh partikel. Akibatnya, kekuatan cahaya
yang diabsorbsi akan berkurang (Skoog, 1998).
Bouger, Lambert dan Beer membuat formula secara matematik hubungan
antara transmitan atau serapan terhadap intensitas radiasi atau konsentrasi zat yang
dianalisis dan tebal kuvet yang mengabsorpsi. Hukum Lambert-Beer menyatakan
bahwa intensitas yang diteruskan oleh larutan zat penyerap berbanding lurus dengan
konsentrasi larutan. Rumus ini yang dapat dinyatakan sebagai:
Dimana: T = persen transmitan; Io = intensitas radiasi yang datang; It =
intensitas radiasi yang diteruskan; a = daya serap molar (Lt.mol-1cm-1); c =
konsentrasi (mol Lt-1); b = tebal kuvet (cm); dan A= serapan (Suharman, 1995).
Daya serap (a) merupakan suatu konstanta yang tidak bergantung pada
konsentrasi, tebal larutan dan intesitas radiasi yang mengenai sampel. Daya serap
tergantung pada suhu, pelarut, struktur molekul, dan panjang gelombang radiasi.
Satuan a ditentukan oleh satuan-satuan b dan c. Jika satuan c dalam molar (M) maka
daya serap disebut dengan daya serap molar dan disimbolkan Ɛ dengan satuan M-1cm
-1
atau L.mol-1cm-1 (Rohman, 2007).
Menurut Farmakope Indonesia edisi ke-IV tahun 1995, hubungan antara
transmitan atau serapan terhadap intensitas radiasi atau konsentrasi zat yang dianalisis
dan tebal kuvet dinyatakan sebagai berikut:
Log (1/T) = A= a b c atau A= Ɛ b c
Dimana: A = serapan (logaritma dasar 10 dari kebalikan transmitan (T), a =
daya serap (hasil bagi serapan (A) dibagi dengan hasil perkalian kadar yang
dinyatakan dalam g per liter zat (c) dan panjang sel dalam cm (b)), Ɛ = daya serap
molar (hasil bagi serapan (A) dengan perkalian kadar zat, dinyatakan dalam mol per
liter, dan panjang serapan dalam cm).
Serapan jenis didefinisikan sebagai serapan dari larutan 1% zat terlarut dalam
pada panjang gelombang tertentu dalam suatu pelarut merupakan sifat dari zat
terlarut. Hubungan antara nilai A (1%, 1 cm) dengan daya serap molar (Ɛ) yaitu:
Ɛ = A (1%, 1cm) x (Anonim, 2005 a)
Dalam hukum Lambert-Beer tersebut ada beberapa pembatasan yaitu:
1. Sinar yang digunakan harus monokromatis
2. Penyerapan terjadi dalam suatu volume yang mempunyai penampang luas yang
sama
3. Senyawa yang menyerap dalam larutan tidak tergantung terhadap senyawa lain
dalam larutan tersebut
4. Tidak terjadi peristiwa fluoresensi atau fosforesensi
5. Indeks bias tidak tergantung pada konsentrasi larutan (Rohman, 2007).
6. Tidak diikuti oleh larutan yang pekat dan terlalu encer. Pada larutan yang pekat
dan terlalu encer terjadi kesalahan fotometrik. Pada larutan yang encer, cahaya
yang diteruskan hampir sama dengan sumber cahayanya. Pada larutan yang pekat
(>0,01M), terjadi penyimpangan antara serapan dan konsentrasi, hal ini dapat
terjadi karena pada larutan pekat, yang diteruskan sedikit sehingga sedikit cahaya
4. Instrumentasi spektrofotometri visibel
Instrumen yang digunakan untuk mempelajari serapan atau emisi radiasi
elektromagnetik sebagai fungsi dari panjang gelombang disebut spektrofotometer.
Diagram sederhana dari spektrofotometer adalah sebagai berikut:
Gambar 6. Instrumentasi spektrofotometer visisbel (Christian,2004)
Sumber cahaya terdiri dari benda yang tereksitasi hingga ke tingkat tenaga
yang tinggi oleh sumber listrik bertegangan tinggi atau oleh pemanasan listrik. Benda
atau materi yang kembali ke tingkat dasarnya, melepaskan foton dengan
tenaga-tenaga yang karakteristik yang sesuai dengan ΔΕ yaitu perbedaan tenaga antara
tingkat tereksitasi dan tingkat dasar rendah. Sumber radiasi yang ideal untuk
pengukuran serapan harus menghasilkan spektrum kontinu dengan intensitas yang
seragam pada keseluruhan kisaran panjang gelombang yang sedang dipelajari
(Sastrohadmidjojo, 1991). Sumber cahaya untuk daerah tampak ialah tungsten
filament incandescent lamp (Christian, 2004). Monokromator berfungsi untuk
mengubah atau mengurai sinar polikromatis menjadi monokromatis (panjang
gelombang tunggal) sesuai yang diinginkkan (Sastrohadmidjojo, 1991). Sel sampel
untuk visibel dari gelas atau kuarsa. Senyawa yang dapat menyerap radiasi cahaya Sumber cahaya monokromator sel sampel
detektor pembaca respon detector
tampak ialah senyawa yang berwarna dimana elektronnya lebih mudah dipromosikan
(Christian, 2004). Detektor berfungsi untuk mengubah tenaga radiasi menjadi arus
listrik atau pengubah panas lainnya (sinyal elektronik) dan biasanya terintegrasi
dengan pencatat (printer). Syarat detektor yang baik yaitu sensitivitas tinggi hingga
dapat mendeteksi tenaga cahaya yang mempunyai tingkatan-tingkatan sekalipun,
respon pendek, stabilitas lama atau panjang untuk menjamin respon secara kuantitatif,
dan sinyal elektronik mudah diperjelas. Agar dapat diukur, sinyal detektor diperbesar
dengan recorder (Sastrohadmidjojo, 1991).
D. Senyawa Kompleks
Senyawa kompleks adalah senyawa yang dibentuk oleh reaksi antara suatu ion
logam (kation) dengan ligan (suatu anion atau molekul netral). Ion kompleks
merupakan senyawa koordinasi bermuatan yang terbentuk antara ion logam dan ligan
(Day and Underwood, 1996). Dalam zat-zat ini, ion logam berperilaku sebagai asam
lewis dan terikat secara kovalen koordinasi kepada ligan yang berperan sebagai basa
lewis (Brady, 1994).
Valensi koordinasi itu sebagai tingkat kecenderungan ion-ion logam mencapai
susunan elektron gas mulia berikutnya. Akibatnya, ion-ion logam itu cenderung
menerima elektron (pasangan elektron) sehingga disebut akseptor. Pemberi pasangan
elektron kepada ion logam itu adalah ligan sehingga disebut donor. Karena ligan
adalah zat yang memiliki satu atau lebih pasangan elektron bebas. Dengan demikian
ikatan kovalen koordinasi dari ligan ke ion logam dengan perpindahan satu atau lebih
pasangan elektron (Rivai, 1995).
Salah satu contoh senyawa kompleks adalah senyawa kompleks besi (II)
dengan o-fenantrolina. Menurut Basset et al., besi (II) dapat ditetapkan kadarnya
menggunakan o-fenantrolina. Besi (II) bereaksi dengan o-fenantrolina membentuk
kompleks merah-jingga [(C12H8N2)3Fe]2+ dalam larutan sedikit asam. Besi (III) tidak
bereaksi membentuk kompleks dengan o-fenantrolina (Anonim, 2001). Dalam
analisis ini, perlu ditambahkan suatu agen preduksi seperti hidrokuinon sebab besi
(II) dapat mudah tereduksi menjadi besi (III) dengan adanya suatu asam dan air
(Anonim, 2001). Menurut Daniel, pH dijaga agar mendekati nilai 3,5 agar kompleks
yang dihasilkan dapat optimal dan stabil. Namun demikian intensitas dari larutan
senyawa kompleks tersebut tidak bergantung pada pH 2-9. Untuk mengontrol tingkat
keasaman dari larutan dan menjaga pH dapat ditambahkan larutan natrium asetat
(Anonim, 2008).
Reaksi pembentukan senyawa kompleks [(C12H8N2)3Fe]2+ adalah sebagai
2Fe3+ +HO OH 2Fe2+ + O O + 2H+
Gambar 7. Reaksi pembentukan senyawa kompleks [(C12H8N2)3Fe] 2+
Daya serap molar dari kompleks [(C12H8N2)3Fe]2+ adalah 11.100 L/mol-cm
pada panjang gelombang serapan maksimum λmax = 508 nm (Harris dan Atkins, 1975;
dan Skoog et al., 1994) atau 510 nm (Harris, 1999; Dean, 1995; Singh et al., 2004;
dan Ibrahim 2004). Nilai yang sangat besar ini menandakan bahwa kompleks
menyerap sangat kuat. Kompleks ini sangat stabil dan intensitas warnanya tidak
berubah dalam waktu yang lama (Anonim, 2005a).
Penyerapan radiasi elektromagnetik oleh senyawa kompleks
[Fe(o-fenantrolina)32+ atau [(C12H8N2)3Fe]2+ yang disebabkan satu atau lebih transisi
elektron pada panjang gelombang daerah visibel yaitu:
1. Eksitasi elektron suatu ion logam
Eksitasi elektron suatu ion logam memiliki daya serap molar (Ɛ) rendah 1-100
(L.mol-1.cm-1). Oleh karena itu, tidak dapat digunakan untuk analisis kuantitatif
2. Eksitasi elektron di dalam ligan
Ada dua transisi elektron yang dapat terjadi di dalam ligan, yakni transisi
elektron dari π → π* dan n → π* (Christian, 2004). Dengan adanya eksitasi n →
π* yang membutuhkan energi yang kecil, maka dapat menggeser panjang
gelombang yang lebih panjang dari senyawa kompleks tersebut menuju ke
panjang gelombang yang lebih panjang sehingga senyawa kompleks tersebut
dapat menjadi berwarna.
3. Transisi transfer muatan
Warna suatu senyawa kompleks terbentuk karena adanya transisi transfer
muatan. Hal ini terjadi karena perpindahan elektron dari ion logam (atau atom
pusat) ke ion ligan dan sebaliknya dari ligan ke ion logamnya. Daya serap molar
(Ɛ) transfer muatan berkisar antara 10.000-100.000 (L.mol-1.cm-1) (Christian,
2004). Donor elektron dalam pembentukan senyawa kompleks [Fe(o
-fenantrolina)32+] atau [Fe(C12H8N2)3]2+ ini adalah ligan yang berupa o
-fenantrolina karena kaya akan elektron yaitu memiliki atom dengan pasangan
elektron bebas, dan akseptor elektron adalah ion logam yang berupa ion Fe2+
karena miskin akan elektron. Ligan dapat mendonorkan elektronnya kepada ion
logam untuk membentuk ikatan kovalen koordinasi dengan ion logam sehingga
mengakibatkan adanya perpindahan muatan dan perubahan energi pada orbital d
yang dimiliki ion logam. Pasangan elektron bebas yang didonorkan dapat
logam menjadi berpasangan. Orbital d yang dimiliki ion logam mengalami
splitting dan perubahan energi yang mengakibatkan elektron pada orbital d
tersebut mengalami eksitasi dari n menuju π*.
Senyawa kompleks [Fe(o-fenantrolina)32+]yang berbentuk oktahedral dimana
orbital d akan terspliting menjadi 2 tingkat energi yang berbeda. Orbital t2g untuk
tingkat yang lebih rendah dan eg untuk orbital yang mempunyai energi yang lebih
tinggi. Perbedaan energi ini (hv) tergantung oleh kekuatan medan ligan.
dxy dxz dyz dz2 dx2_y2
dz2 dx2_y2
dxy dxz dyz hv
Gambar 8. Spliting orbital d pada senyawa kompleks oktahedral
O-fenantrolina merupakan ligan kuat maka perbedaan energinya (hv) menjadi
besar, sehingga gaya tolak elektron tidak mampu mendorong elektron menempati
Gambar 9. Spliting orbital d pada Fe2+ dengan adanya ligan o-fenantrolina
Warna intens yang terbentuk pada senyawa kompleks [Fe(o-fenantrolina)3]2+
pada saat transisi d → π*. Pada transisi ini terjadi transisi elektron dari orbital
elektron d yang dimiliki ion logam ke orbital π* yang dimiliki ligannya, sehingga
intensitas warnanya meningkat. Elektron dari t2g pada orbital d yang memiliki energi
yang lebih rendah akan bertransisi ke orbital π* dari ligan. Dengan adanya transisi d
→ π* yang membutuhkan energi kecil sehingga akan menggeser senyawa kompleks
ke panjang gelombang yang lebih panjang sehingga akan menimbulkan warna
d
eg
t2g
L M
L M
L M
Gambar 10. Transisi elektron dari orbital d ke π*
Pembentukan ikatan koordiansi dari Fe2+ dengan o-fenantrolina dapat
dijelaskan sebagai berikut:
Gambar 11. Pembentukan ikatan koordinasi pada senyawa kompleks [Fe(C12H8N2)3] 2+
Setelah terjadi spliting akibat adanya ligan kuat seperti gambar 11, maka orbital 3 d
dari Fe2+ hanya terisi 3 ruangan saja sedangkan 2 ruangan lainnya kosong. Kemudian
terbentuk orbital d2sp3 dari hibridisasi 2 orbital 3d dengan 1 orbital 4s dan 3 orbital
4p, sehingga 6 pasang PEB (pasangan elektron bebas) dari o-fenantrolina akan masuk
dalam orbital d2sp3 sehingga dapat terbentuk ikatan koordinasi dengan Fe2+.
σ
ππ*
π
F. Hipotesis
Hidrokuinon merupakan salah satu agen pencerah yang bersifat sebagai
reduktor baik yang dapat mereduksi besi (III) menjadi besi (II). Jumlah hidrokuinon
yang ditambahkan sebanding dengan jumlah besi (II) yang dihasilkan, kemudian besi
(II) dapat direaksikan dengan o-fenantrolina membentuk senyawa berwarna
merah-jingga yang dapat dianalisis secara spektrofotometri visibel. Oleh karena itu,
penelitian ini untuk mengetahui metode penetapan kadar hidrokuinon dengan
pereaksi o-fenantrolina menggunakan spektrofotometri visibel dapat digunakan untuk
menetapkan kadar hidrokuinon dalam larutan pencerah merek ”A” yang beredar di
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian non eksperimental deskriptif karena
pada penelitian ini tidak terdapat manipulasi dan perlakuan terhadap subyek
penelitian yang digunakan.
B. Definisi Operasional
1. Kadar hidrokuinon adalah besarnya hidrokuinon (% b/v) yang terdapat dalam
sediaan kosmetik yang berbentuk larutan merek “A”.
2. Sediaan kosmetik pencerah yang berbentuk larutan yang dianalisis adalah produk
sediaan kosmetik berbentuk larutan yang mengandung hidrokuinon dalam label
kemasan yang beredar di Yogyakarta.
3. Spektrofotometri visibel adalah analisis spektroskopik yang menggunakan
sumber radiasi elektromagnetik sinar tampak (380-780nm) dengan menggunakan
instrumen spektrofotometer.
C. Bahan Penelitian
Bahan – bahan yang digunakan dalam penelitian ini adalah hidrokuinon
(p.a., E.Merck), o-phenanthroline (p.a., E.Merck), besi (III) klorida heksahidrat (p.a.,
E.Merck), asam klorida (p.a., E.Merck), aquadest (Fakultas Farmasi Universitas
Sanata Dharma).
D. Alat Penelitian
Alat-alat yang digunakan dalam penelitian adalah sebagai berikut:
seperangkat spektrofotometer UV-VIS Optima, neraca analitik BP 160 dan scaltec
SBC 22 readability 0,01 mg, mikropipet 10-100 μl dan 100-1000 μl (BioHit), pH
indikator universal, labu ukur, dan alat-alat gelas yang lazim digunakan untuk
penelitian di laboratorium analisis (Pyrex, Germany).
E. Tata Cara Penelitian 1. Pembuatan larutan baku hidrokuinon
a. Larutan stok. Sepuluh miligram hidrokuinon p.a ditimbang lebih kurang
seksama, dimasukkan ke dalam labu ukur 10,0 ml dan diencerkan dengan aquadest
hingga tanda. Larutan ini harus selalu dibuat baru.
b. Larutan intermediet. Sebanyak 0,05 ml larutan stok diambil, dimasukkan
ke dalam labu ukur 10,0 ml dan diencerkan dengan aquadest hingga tanda. Larutan
ini harus selalu dibuat baru.
2. Pembuatan larutan Fe3+
Sebanyak 0,019 g FeCl3.6H2O ditimbang, dimasukkan ke dalam labu ukur
10,0 ml dan diencerkan dengan aquadest hingga tanda. Ke dalam larutan ditambahkan
3. Pembuatan larutan o-phenanthroline
Sebanyak 0,025 g o-phenanthroline ditimbang, dan dimasukkan ke dalam
labu ukur 10,0 ml dan diencerkan dengan 1 ml etanol p.a dan 9 ml aquadest hingga
tanda. Larutan ini disimpan dalam wadah yang terlindung dari cahaya.
4. Pembuatan larutan natrium asetat
Sebanyak 0,025 g natrium asetat ditimbang, dan dimasukkan ke dalam labu
ukur 10,0 ml dan diencerkan dengan aquadest hingga tanda. Larutan ini dapat
disimpan di lemari pendingin.
5. Optimasi metode
a. Penentuan operating time (OT). Sebanyak 0,2 ml larutan intermediat
hidrokuinon diambil, dan dimasukkan ke dalam labu ukur 10,0 ml yang mengandung
0,15 ml larutan Fe3+ standar. Beberapa tetes larutan natrium asetat (1-2 tetes)
ditambahkan hingga pH mencapai 3-4, digojog. Larutan o-phenanthroline sebanyak
0,5 ml ditambahkan dan diencerkan dengan aquadest hingga tanda, lalu dicampur
hingga homogen. Serapan diukur pada panjang gelombang maksimum 510,0 nm.
Grafik dibuat antara serapan dan waktu. Operating time dicari yang memberikan
serapan yang stabil.
b. Penetapan panjang gelombang maksimum ( λmaks ). Sebanyak 0,1 ml; 0,2
ml; 0,3 ml larutan intermediat hidrokuinon diambil, dan dimasukkan ke dalam labu
ukur 10,0 ml yang mengandung 0,15 ml larutan Fe3+ standar. Beberapa tetes larutan
natrium asetat (1-2tetes) ditambahkan hingga pH mencapai 3-4, digojog. Larutan
hingga tanda, lalu dicampur hingga homogen dan didiamkan selama OT. Serapan
diukur pada panjang gelombang antara 450-550 nm. Panjang gelombang maksimum
ditentukan pada panjang gelombang yang memberikan serapan maksimum.
c. Pembuatan kurva baku. Sebanyak 0,1 ml; 0,15 ml; 0,20 ml; 0,25 ml;
0,30 ml larutan intermediat hidrokuinon diambil dan dimasukkan ke dalam labu ukur
10,0 ml yang mengandung 0,15 ml larutan Fe3+ standar. Beberapa tetes larutan
natrium asetat (1-2 tetes) ditambahkan hingga pH mencapai 3-4, digojog. Larutan
o-phenanthroline sebanyak 0,5 ml ditambahkan dan diencerkan dengan aquadest
hingga tanda, lalu dicampur hingga homogen dan didiamkan selama OT. Serapan
diukur pada panjang gelombang maksimum. Kurva baku dibuat antara serapan dan
konsentrasi kemudian dicari persamaannya.
6. Penetapan kadar hidrokuinon dalam sampel sediaan kosmetik yang berbentuk larutan
a. Pemilihan sampel. Sampel yang dipilih adalah sediaan kosmetik yang
berbentuk larutan yang beredar di Yogyakarta dan mencantumkan hidrokuinon pada
kemasannya. Larutan pencerah yang diambil sebagai sampel terdiri dari 1 merk dari
golongan kosmetik. Jumlah sampel yang memiliki nomor kode produksi yang sama
adalah enam.
C. Preparasi sampel larutan. Sediaan kosmetik merek “A” yang berbentuk
larutan diambil 6 kemasan dan masing-masing kemasan direplikasi sebanyak dua
dalam labu ukur 10,0 ml dan diencerkan dengan aquadest hingga tanda untuk
pembuatan larutan intermediet.
D. Penetapan kadar hidrokuinon. Sebanyak 0,05 ml sampel dimasukkan ke
dalam labu ukur 10,0 ml yang mengandung 0,15 ml larutan Fe3+ standar. Beberapa
tetes larutan natrium asetat (1-2 tetes) ditambahkan hingga pH mencapai 3-4, digojog.
Larutan o-phenanthroline sebanyak 0,5 ml ditambahkan dan diencerkan dengan
aquadest hingga tanda, lalu dicampur hingga homogen dan didiamkan selama OT.
Serapan diukur pada panjang gelombang yang memberikan serapan maksimum.
Replikasi dilakukan sebanyak 6 kali.
F. Analisis Hasil
Analisis hasil yang dilakukan yaitu dengan menghitung kadar hidrokuinon
yang terdapat dalam sediaan kosmetik yang berbentuk larutan yang beredar di
pasaran yang dimasukkan dalam persamaan kurva baku hidrokuinon y = bx + a.
Kadar yang diperoleh kemudian dicermati secara deskriptif dengan kadar yang tertera
BAB IV
HASIL DAN PEMBAHASAN
A. Optimasi Metode
Penetapan kadar hidrokuinon pada penelitian ini dilakukan dengan
mengetahui penetapan kadar hidrokuinon dalam larutan pencerah merek “A” yang
telah beredar di pasaran dengan menggunakan pereaksi o-fenantrolina secara
spektrofotometri visibel.
Pada penelitian ini, hidrokuinon selalu dibuat baru dan dilindungi dari cahaya
karena hidrokuinon mudah teroksidasi dari warna putih menjadi warnanya kecoklatan
sehingga tidak bisa dipakai karena hal ini dapat mengganggu pembentukan senyawa
kompleks dan pengukuran serapan maka harus diminimalkan (Svehla, 1979).
Jika membuat larutan Fe(III) (kation) dengan menambah air dan 1tetes asam
klorida encer ke dalam larutan FeCl3.6H2O, warna larutan ini menjadi semakin kuat
(Svehla, 1979).
Berdasarkan metode ini, hidrokuinon yang terkandung di dalam larutan
pencerah akan diukur dengan cara mereduksi larutan Fe3+ menjadi Fe2+ lebih dulu
dengan bantuan hidrokuinon sebagai agen pereduksi (reduktor) sehingga menjaga
kestabilan pada keberadaan Fe2+. Karena Fe3+ tidak bisa memberikan warna yang
intens bila bereaksi dengan o-fenantrolina, sehingga menyulitkan penetapan kadar






![Gambar 7. Reaksi pembentukan senyawa kompleks [(C12H8N2)3Fe]2+](https://thumb-ap.123doks.com/thumbv2/123dok/1686388.2077399/49.612.112.522.110.548/gambar-reaksi-pembentukan-senyawa-kompleks-c-h-fe.webp)
