AKTIVITAS ANTIOKSIDAN HASIL FRAKSINASI
EKSTRAK ETANOL ANGKAK DAN BEKATUL
DENGAN METODE REDUKSI FERRI (FRAP)
ANNISA FARHIAH WAHDAH HAMID
DEPARTMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas Antioksidan Hasil Fraksinasi Ekstrak Etanol Angkak dan Bekatul dengan Metode Reduksi Ferri (FRAP) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ANNISA FARHIAH WAHDAH HAMID. Aktivitas Antioksidan Hasil Fraksinasi Ekstrak Etanol Angkak dan Bekatul dengan Metode Reduksi Ferri (FRAP). Dibimbing oleh HASIM dan DIMAS ANDRIANTO.
Penyakit degeneratif merupakan penyebab kematian tertinggi di Indonesia. Salah satu cara pencegahannya adalah dengan konsumsi antioksidan. Angkak dan bekatul merupakan sumber antioksidan yang telah banyak diketahui. Tujuan penelitian ini adalah memperoleh fraksi yang memiliki aktivitas antioksidan tertinggi. Ekstrak etanol difraksinasi dengan partisi cair-cair sehingga diperoleh empat fraksi, yaitu fraksi n-heksana, fraksi diklorometana, fraksi etil asetat, dan fraksi air. Uji aktivitas antioksidan dilakukan dengan metode ferric reducing antioxidant power (FRAP). Hasil uji menunjukkan bahwa semua fraksi pada angkak dan bekatul memiliki potensi sebagai antioksidan. Aktivitas antioksidan tertinggi angkak dan bekatul sama-sama terdapat pada fraksi etil asetat, yaitu sebesar 190.84 mg TE/g fraksi pada angkak dan 163.74 mg TE/g fraksi pada bekatul. Hasil uji korelasi menunjukkan bahwa aktivitas antioksidan angkak berkorelasi dengan total fenolik dan total flavonoidnya, sedangkan aktivitas antioksidan bekatul hanya berkorelasi terhadap total flavonoidnya.
Kata kunci: angkak, bekatul, fenolik, flavonoid, FRAP
ABSTRACT
ANNISA FARHIAH WAHDAH HAMID. Antioxidant Activity of Ethanol Extract Fractions of Red Yeast Rice and Rice Bran with Ferric Reducing Method (FRAP). Supervised by HASIM and DIMAS ANDRIANTO.
The degenerative diseases are the main causes of death in Indonesia.One way to prevent those are by the consumption of antioxidants. Red yeast rice and rice bran are sources of antioxidants which have been widely known. The purpose of this study was to obtain fraction with the highest antioxidant activity. Ethanol extract was fractionated subsequently by liquid-liquid partition to obtain four fractions, namely n-hexane, dichloromethane, ethyl acetate, and water fractions. Antioxidant activity test was carried out using ferric reducing antioxidant power (FRAP) method. The test results showed that all of the fractions of red yeast rice and rice bran have potential as antioxidants. The highest antioxidant activity of red yeast rice and rice bran were both present in ethyl acetate fractions, respectively 190.84 mg TE/g fraction in the red yeast rice and 163.74 mg TE/g fraction in the rice bran. The correlation test results showed that the antioxidant activity of red yeast rice was correlated to its total phenolic and total flavonoid, whereas antioxidant activity of rice bran was correlated only to its total flavonoid.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
AKTIVITAS ANTIOKSIDAN HASIL FRAKSINASI
EKSTRAK ETANOL ANGKAK DAN BEKATUL
DENGAN METODE REDUKSI FERRI (FRAP)
ANNISA FARHIAH WAHDAH HAMID
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji serta syukur penulis haturkan kepada Allah SWT, Tuhan semesta alam yang telah mencurahkan nikmat dan kasih sayangNya dalam hidup, hingga penulis mampu menyelesaikan penelitian serta karya ilmiah yang berjudul Aktivitas Antioksidan Hasil Fraksinasi Ekstrak Etanol Angkak dan Bekatul dengan Metode Reduksi Ferri (FRAP) ini dengan lancar. Tak lupa pula shalawat serta salam kepada nabi besar Muhammad SAW, berkat jasa beliau manusia bisa mengenal Allah SWT lewat hidayah Islam.
Penulis menyampaikan terima kasih kepada Dr drh Hasim, DEA dan Dr Dimas Andrianto, SSi MSi selaku pembimbing, serta Dr Didah Nur Faridah, STP, MSi yang telah memberikan bimbingan, arahan, kritik dan sarannya dalam penelitian serta penulisan dan penyusunan karya ilmiah ini. Selain itu, penghargaan penulis sampaikan kepada Ella, Syuaida, Wira, Riah, dan Ayu sebagai tim riset angkak dan bekatul yang telah membantu selama penelitian. Ungkapan terima kasih juga penulis sampaikan kepada kedua orang tua, yaitu Bapak Abdul Hamid dan Ibu Hibatullah, serta kedua adik, yaitu Syifa dan Addin yang telah memberi dukungan sehingga karya ilmiah ini dapat terselesaikan. Tak lupa juga penulis sampaikan terimakasih kepada Pemda Kabupaten Sumbawa Barat yang telah memberikan beasiswa utasan daerah (BUD) sehingga penulis dapat menyelesaikan studi dengan lancar.
Semoga karya ilmiah ini berguna dalam menambah khasanah pengetahuan penulis dan bermanfaat pula bagi perkembangan ilmu pengetahuan dan teknologi di masa yang akan datang.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Tempat dan Waktu 2
Bahan dan Alat 2
Prosedur Penelitian 3
Rancangan Percobaan dan Analisis Statistik 6
HASIL 7
Kadar Air 7
Rendemen Ekstraksi dan Fraksinasi 7
Fitokimia 8
Total Fenolik 8
Total Flavonoid 9
Aktivitas Antioksidan 9
Korelasi 10
PEMBAHASAN 11
Kadar Air 11
Rendemen Ekstraksi dan Fraksinasi 11
Fitokimia 12
Total Fenolik 13
Total Flavonoid 14
Aktivitas Antioksidan 15
Korelasi 16
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 18
LAMPIRAN 23
DAFTAR TABEL
1 Hasil pengujian fitokimia 8
2 Hasil analisis korelasi antara aktivitas antioksidan, total fenolik, total flavonoid,
dan rendemen pada angkak dan bekatul 10
DAFTAR GAMBAR
1 Kadar air simplisia angkak dan bekatul 7
2 Rendemen setiap fraksi angkak dan bekatul 7
3 Total fenolik setiap fraksi angkak dan bekatul 8
4 Total flavonoid setiap fraksi angkak dan bekatul 9 5 Aktivitas antioksidan setiap fraksi angkak dan bekatul 10
DAFTAR LAMPIRAN
1 Diagram alir penelitian 24
2 Kadar air simplisia 25
3 Rendemen hasil ekstraksi dan fraksinasi 26
4 Hasil uji fitokimia 28
5 Kurva standar asam galat 30
6 Hasil pengukuran total fenolik pada sampel 31
7 Kurva standar kuersetin 33
8 Hasil pengukuran total flavonoid pada sampel 34
9 Kurva standar trolox 36
10 Hasil pengukuran aktivitas antioksidan pada sampel 37 11 Hasil analisis statistik aktivitas antioksidan angkak dengan ANOVA 39
12 Hasil uji LSD aktivitas antioksidan angkak 39
13 Hasil analisis statistik aktivitas antioksidan bekatul dengan ANOVA 40
PENDAHULUAN
Masalah kesehatan yang menjadi penyebab kematian tertinggi di Indonesia ialah penyakit degeneratif (Balitbangkes 2008). Secara umum, penyakit degeneratif ditandai dengan proses kemunduran fungsi atau kerusakan sel yang dapat terakumulasi sehingga menjadi kerusakan jaringan bahkan kerusakan organ (Miller 2009). Salah satu penyebab utama penyakit tersebut adalah aktivitas radikal bebas di dalam tubuh. Radikal bebas adalah suatu molekul, atom, atau beberapa kelompok atom yang memiliki satu atau lebih elektron tak berpasangan pada orbital luarnya sehingga menjadikannya tidak stabil, bebas, dan sangat reaktif. Radikal bebas mampu bereaksi dengan makromolekul seperti protein, lipid, karbohidrat, bahkan asam nukleat sehingga memicu timbulnya kerusakan pada berbagai makromolekul tersebut (Winarno et al. 2015). Apabila sel tidak mampu menghancurkan radikal bebas yang terbentuk dalam jumlah berlebihan, maka akan mengakibatkan kondisi stres oksidatif. Kondisi tersebut dapat menginisiasi munculnya berbagai penyakit degeneratif (Shinde et al. 2012).
Radikal bebas umumnya terlibat dalam reaksi berantai, yaitu reaksi yang menyebabkan regenerasi radikal sehingga senyawa radikal akan terus terbentuk (Sen et al. 2010). Tubuh memiliki mekanisme pertahanan terhadap oksidasi radikal bebas sehingga dapat menghentikan reaksi berantai. Pertahanan tersebut meliputi penghilangan katalis radikal bebas, pengikatan protein pada ion logam pemicu oksidasi, perlindungan terhadap kerusakan makromolekul, serta reduksi radikal bebas (Krishnamurthy dan Wadhwani 2012). Mekanisme pertahanan tersebut dapat terjadi karena adanya senyawa antioksidan, yaitu senyawa yang struktur dan fungsi molekulnya tetap stabil walaupun telah teroksidasi oleh radikal bebas (Kumalaningsih 2006).
Tubuh manusia dilengkapi antioksidan endogen, yaitu antioksidan yang berasal dari metabolisme tubuh. Apabila jumlah radikal bebas di dalam tubuh terlalu besar akan menyebabkan berkurangnya kemampuan tubuh dalam meredam radikal bebas sehingga tubuh menjadi sakit (Winarno et al. 2015). Produksi antioksidan endogen pun akan menurun seiring dengan bertambahnya usia (Hernani dan Raharjo 2005). Sementara itu, perilaku hidup masyarakat modern saat ini sering mencerminkan gaya hidup tidak sehat yang dapat memicu terbentuknya radikal bebas dalam tubuh. Oleh sebab itu, untuk memenuhi kebutuhan antioksidan dalam tubuh diperlukan senyawa antioksidan eksogen yang berasal dari luar tubuh.
Dua contoh sumber antioksidan eksogen adalah angkak dan bekatul. Angkak adalah produk fermentasi beras menggunakan kapang Monascus sp. (Tisnadjaja 2006). Bekatul adalah lapisan kulit ari dari butir padi dan merupakan produk samping yang berlimpah dari proses penggilingan beras untuk memperoleh beras putih (Watson et al. 2014). Park dan Kim (2011) menyatakan bahwa angkak berpotensi sebagai antioksidan, dengan aktivitas sebesar 78.2%. Sama seperti angkak, bekatul pun berpotensi sebagai antioksidan. Widarta et al. (2013) menyatakan bahwa aktivitas antioksidan ekstrak metanol bekatul sebesar 88.84%.
2
fraksinasi digunakan untuk memisahkan senyawa bioaktif yang terdapat pada suatu ekstrak sehingga dapat diperoleh senyawa yang lebih murni (Santos dan Duarte 2014).
Selain itu, kemampuan senyawa antioksidan yang terkandung dalam hasil fraksinasi kedua ekstrak sampel tersebut untuk mereduksi ion Fe3+ belum banyak diketahui. Kemampuan reduksi ion Fe3+ suatu sampel dapat dianalisis dengan metode ferric reducing antioxidant power (FRAP). Prinsip metode FRAP adalah menganalisis kemampuan antioksidan dalam mereduksi ion Fe(TPTZ)23+ yang berwarna kuning menjadi Fe(TPTZ)22+ yang berwarna biru yang dapat diukur pada panjang gelombang 593 nm (Halliwell dan Gutteridge 2015). Ferri merupakan salah satu zat pro-oksidan di dalam tubuh karena dapat mengoksidasi senyawa lain serta berpotensi memunculkan radikal bebas baru (Udipi et al. 2012). FRAP merupakan kondisi in vitro yang dirancang untuk menganalisis kemampuan antioksidan dalam mereduksi ferri dan radikal bebas lainnya dalam tubuh. Keunggulan FRAP dibandingkan metode lainnya adalah harga terjangkau, proses preparasi reagen sederhana, hasilnya konsisten, prosedurnya mudah, cepat, serta tidak memerlukan peralatan khusus (Benzie dan Strain 1996).
Penelitian ini bertujuan memperoleh fraksi ekstrak etanol angkak dan fraksi ekstrak etanol bekatul yang memiliki aktivitas antioksidan tertinggi. Oleh sebab itu, diharapkan dapat memberikan informasi mengenai polaritas dan karakteristik senyawa yang berperan sebagai antioksidan tertinggi pada angkak dan bekatul. Selain itu, penelitian ini juga bertujuan mengidentifikasi senyawa fitokimia pada angkak dan bekatul serta korelasi antara kadar fitokimia dengan aktivitas antioksidannya.
METODE
Tempat dan Waktu
Penelitian ini dilakukan di dua laboratorium, yaitu Laboratorium Pusat Studi Biofarmaka dan Laboratorium Penelitian Departemen Biokimia. Penelitian ini dilaksanakan secara bertahap selama tujuh bulan, yaitu dari Januari hingga Agustus 2016.
Bahan dan Alat
3 Alat-alat yang digunakan dalam penelitian ini ialah oven EYELA type NDO-700, ayakan 40 mesh, desikator, neraca analitik OHAUS GA200, shaker Zhengji HY-4A, kertas saring, rotary evaporator, alumunium foil, spektrofotometer thermo electron corporation model Genesys 10 UV, dan berbagai alat gelas. Alat gelas tersebut meliputi tabung reaksi, Erlenmeyer, plat tetes, cawan porselen, batang pengaduk, corong, corong pisah, labu takar, gelas piala, gelas ukur, pipet Mohr, dan pipet tetes.
Prosedur Penelitian
Penelitian yang dilakukan meliputi proses preparasi dan pengujian (Lampiran 1). Preparasi yang dilakukan ialah pembuatan simplisia, ekstraksi, dan fraksinasi. Pengujian yang dilakukan ialah fitokimia, pengukuran total fenolik, total flavonoid, dan aktivitas antioksidan.
Preparasi Sampel Angkak dan Bekatul (Zubaidah dan Sari 2015; Thanonkaew et al. 2012)
Preparasi angkak dilakukan dengan memasukkan angkak ke dalam oven pada suhu 50o C selama 6 jam. Pemanasan ini dilakukan untuk mengurangi kadar air dalam simplisia. Setelah dipanaskan, angkak dihaluskan menggunakan blender dan diayak dengan ayakan 40 mesh. Setelah itu, simplisia angkak dapat disimpan pada tempat kering sampai saat akan digunakan.
Preparasi bekatul dilakukan dengan memasukkan bekatul ke dalam oven pada suhu 150o C selama 10 menit. Pemanasan ini dilakukan untuk mengurangi kadar air dalam simplisia serta menginaktivasi enzim lipase sehingga simplisia tidak mudah rusak dan tengik. Setelah pemanasan, bekatul didinginkan pada suhu ruang selama 30 menit kemudian disimpan pada lemari pendingin dengan suhu 4°C sampai saat akan digunakan.
Penentuan Kadar Air Angkak dan Bekatul (AOAC 2006)
Kadar air angkak dan bekatul ditentukan dengan metode gravimetri atau pengeringan di dalam oven. Cawan porselin dikeringkan pada suhu 105oC selama 30 menit lalu didinginkan dalam desikator dan ditimbang dengan menggunakan neraca analitik. Sebanyak 3 g sampel dimasukkan dalam cawan tersebut lalu dipanaskan pada suhu 105oC selama 3 jam. Setelah itu, sampel didinginkan dalam desikator kemudian ditimbang. Pemanasan diulang sampai diperoleh bobot konstan. Pengukuran kadar air dilakukan sebanyak tiga kali ulangan setiap sampel. Kadar air dihitung dengan persamaan:
Kadar air (%) = A - BA × 100% dengan: A = bobot sampel sebelum pemanasan (g)
B = bobot sampel setelah pemanasan (g)
Ekstraksi Angkak (Singgih et al.2014)
4
Campuran tersebut kemudian digoyangkan di atas shaker selama 2 jam pada suhu ruang dengan kecepatan 110 rpm. Campuran difiltrasi menggunakan kertas saring. Filtrat yang diperoleh disimpan pada lemari berpendingin sedangkan residu yang tersisa diremaserasi sekali lagi dengan jumlah pelarut dan perlakuan yang sama. Filtrat yang diperoleh dikumpulkan dan diuapkan menggunakan rotary evaporator pada suhu 45°C dengan kecepatan 75 rpm sehingga diperoleh esktrak etanol angkak.
Rendemen ekstrak etanol angkak dinyatakan dalam persen dan dihitung dengan menggunakan persamaan sebagai berikut :
Rendemen ekstrak (%) = Bobot ekstrak yang diperoleh
Bobot simplisia - (kadar air × bobot simplisia) ×100%
Ekstraksi Bekatul (Arab et al. 2011)
Ekstraksi dilakukan secara maserasi dengan perbandingan 1:4 (b/v). Pertama-tama, sebanyak 50 g simplisia bekatul dimasukkan ke dalam Erlenmeyer. Setelah itu, sebanyak 200 mL etanol 95% ditambahkan juga ke dalam Erlenmeyer tersebut. campuran tersebut kemudian digoyangkan di atas shaker dengan kecepatan 130 rpm selama 3 jam pada suhu ruang. Campuran difiltrasi menggunakan kertas saring. Fitrat yang diperoleh disimpan pada lemari berpendingin sedangkan residu yang tersisa diremaserasi sekali lagi dengan jumlah pelarut dan perlakuan yang sama. Filtrat yang diperoleh dikumpulkan dan diuapkan menggunakan rotary evaporator pada suhu 45°C dengan kecepatan 75 rpm (±45 menit) sehingga diperoleh ekstrak etanol bekatul.
Rendemen ekstrak etanol bekatul dinyatakan dalam persen dihitung dengan menggunakan persamaan sebagai berikut :
Rendemen ekstrak (%) = Bobot ekstrak yang diperoleh
Bobot simplisia - (kadar air × bobot simplisia) ×100%
Fraksinasi Ekstrak secara Partisi Cair-Cair (modifikasi Hikmah 2012)
Fraksinasi dilakukan secara bertingkat menggunakan pelarut n-heksana, diklorometana, etil asetat, dan akuades (air) dengan perbandingan volume setiap larutan yang digunakan 1:1. Fraksinasi pertama dilakukan menggunakan pelarut n-heksana dan air. Sebanyak 0.5 g ekstrak etanol dilarutkan dalam 75 mL n-n-heksana lalu dimasukkan ke dalam corong pisah 250 mL. Sebanyak 75 mL air ditambahkan ke dalam corong pisah yang sama kemudian dihomogenkan. Keran corong pisah dibuka hingga udara keluar dan tekanan udara menurun. Lapisan n-heksana dipisahkan dan lapisan air direfraksinasi hingga 3 kali dengan jumlah pelarut yang sama yaitu75 mLn-heksana. Setelah dilakukan 3 kali refraksinasi, lapisan air yang tersisa difraksinasi dengan pelarut diklorometana sebanyak 75 mL. Lapisan diklorometana dipisahkan dan lapisan air direfraksinasi hingga 3 kali dengan jumlah pelarut yang sama yaitu 75 mL diklorometana. Fraksinasi dilakukan kembali dengan langkah yang sama pada pelarut etil asetat. Proses fraksinasi ini akan memisahkan campuran senyawa dalam ekstrak etanol sampel berdasarkan tingkat kepolarannya. Setiap pelarut akan cenderung menarik senyawa yang memiliki tingkat kepolaran yang sama.
5 dibersihkan dengan larutan NaCl jenuh sebanyak setengah volume masing-masing menggunakan corong pisah. Lapisan air dibersihkan dengan disaring menggunakan kertas saring. Selain fraksi air, lapisan lainnya dibersihkan dengan Na2SO4 sesaat sebelum dipekatkan. Setelah itu, lapisan-lapisan tersebut dipekatkan dengan rotary evaporator pada suhu 45°C sehingga diperoleh empat fraksi, yaitu fraksi n-heksana, diklorometana, etil asetat, dan fraksi air.
Rendemen setiap fraksi angkak maupun bekatul dinyatakan dalam persen dan dihitung menggunakan persamaan berikut :
Rendemen fraksi (%) = Bobot fraksi yang diperoleh
Bobot ekstrak yang difraksinasi ×rendemen ekstrak%
Uji Fitokimia (Harborne 1987)
Identifikasi Tanin. Sebanyak 1 g sampel ditambahkan 10 mL akuades kemudian didihkan selama 5 menit. Setelah itu, larutan disaring. Sebanyak tiga tetes filtrat dipindahkan ke plat tetes dan ditambahkan tiga tetes FeCl3 1%. Adanya tanin ditandai dengan terbentuknya warna biru tua atau hijau kehitaman.
Identifikasi Alkaloid. Sebanyak 100 mg sampel ditambahkan 1.5 mL kloroform dan beberapa tetes amonia. Fraksi kloroform dipisahkan dan diasamkan dengan 2 tetes H2SO4 2 M. Fraksi asam diambil dan dibagi menjadi 3 bagian. Setelah itu, masing-masing ditambahkan pereaksi Dragendorf, Meyer dan Wagner. Adanya alkaloid ditandai dengan terbentuknya endapan merah pada penambahan pereaksi Dragendorf, endapan putih pada pereaksi Meyer, dan endapan coklat pada pereaksi Wagner.
Identifikasi Flavonoid. Sebanyak 50 mg sampel ditambahkan 10 mL akuades. Setelah itu, campuran dipanaskan selama 5 menit, disaring lalu diambil filtratnya. Filtrat ditambahkan dengan 0.05 g serbuk Mg dan 0.2 mL asam alkohol (campuran HCl pekat dan etanol 95% dengan volume yang sama). Setelah itu, ditambahkan kembali dengan 2 mL pentanol. Campuran dikocok. Adanya flavonoid ditandai dengan terbentuknya warna merah, kuning, atau jingga pada lapisan pentanol.
Identifikasi Saponin. Sebanyak 50 mg sampel ditambahkan dengan 10 mL akuades dalam tabung reaksi. Setelah itu dikocok dengan kuat selama 10 menit. Adanya saponin ditandai dengan terbentuknya buih yang stabil dengan tinggi lebih dari 1 cm setelah didiamkan selama 10 menit setelah pengocokan.
Identifikasi Triterpenoid dan Steroid. Sebanyak 50 mg sampel ditambah dengan 2 mL etanol 30% kemudian dipanaskan selama 5 menit. Setelah itu, cairan disaring dan filtratnya diuapkan lalu ditambahkan 1 mL eter. Sebanyak lima tetes fraksi eter dipindahkan ke plat tetes dan ditambahkan dengan tiga tetes asetat anhidrida dan satu tetes asam sulfat pekat. Adanya triterpenoid ditandai dengan terbentuknya warna merah atau ungu sedangkan adanya steroid ditandai dengan terbentuknya warna hijau.
Uji Total Fenolik (Vongsak et al. 2013)
6
menit pada suhu ruang. Absorbansi diukur pada panjang gelombang 765 nm menggunakan spektrofotometer UV-Vis. Standar yang digunakan adalah asam galat. Nilai konsentrasi sampel diperoleh dari perhitungan dengan cara memasukkan nilai absorbansi ke dalam persamaan garis pada kurva standar.
Uji Total Flavonoid (Vongsak et al. 2013)
Analisis total flavonoid dilakukan menggunakan reagen alumunium klorida (AlCl3). Pengujian dilakukan dengan cara mencampurkan sampel sebanyak 500 µL dengan larutan AlCl3 2% sebanyak 500 µL. Setelah itu, campuran tersebut dihomogenkan dan diinkubasi selama 10 menit pada suhu ruang. Absorbansi diukur pada panjang gelombang 415 nm. Blanko yang digunakan ialah campuran sampel sebanyak 500 µL dengan akuades tanpa AlCl3 2% sebanyak 500 µL. Standar yang digunakan adalah kuersetin. Nilai konsentrasi sampel diperoleh dari perhitungan dengan cara memasukkan nilai absorbansi ke dalam persamaan garis pada kurva standar.
Uji Aktivitas Antioksidan dengan Metode Ferric Reducing Antioxidant Power (Benzie dan Strain 1996; Tananuwong dan Tewaruth 2010)
Reagen ferric reducing antioxidant power (FRAP), terdiri atas larutan bufer asetat 300 mM (pH 3.6), larutan 2,4,6-tripydyl-s-triazine (TPTZ) 10 mM dalam HCl 40 mM, dan larutan FeCl3.6H2O 20 mM. Reagen FRAP disiapkan dengan cara mencampurkan 25 mL bufer asetat, 2.5 mL larutan TPTZ, dan 2.5 mL larutan FeCl3.6H2O. Pencampuran dilakukan sesaat sebelum analisis dan diinkubasi pada suhu 37°C selama 30 menit kemudian siap untuk digunakan.
Analisis dilakukan dengan cara mencampurkan 10 µL sampel dengan 990 µL reagen FRAP. Setelah itu, campuran tersebut dihomogenkan dan diinkubasi selama 4 menit pada suhu ruang kemudian absorbansinya diukur pada panjang gelombang 593 nm menggunakan spektrofotometer UV-Vis. Larutan standar yang digunakan adalah trolox. Nilai konsentrasi sampel diperoleh dari perhitungan dengan cara memasukkan nilai absorbansi ke dalam persamaan garis pada kurva standar.
Rancangan Percobaan dan Analisis Statistik
Rancangan percobaan dalam penelitian ini adalah rancangan acak lengkap (RAL) pola searah. Variabel tetap berupa jenis pelarut ekstraksi atau fraksinasi (pelarut etanol, n-heksana, diklorometana, etil asetat, dan air) dan variabel bebasnya adalah aktivitas antioksidan. Masing-masing perlakuan dilakukan sebanyak 3 kali ulangan. Data yang diperoleh dianalisis dengan One Way ANOVA dengan bantuan program SPSS versi 21, jika terdapat perbedaan antar perlakuan dilanjutkan dengan Uji least significant difference (LSD) pada tingkat kepercayaan 95%.
7
HASIL
Kadar Air
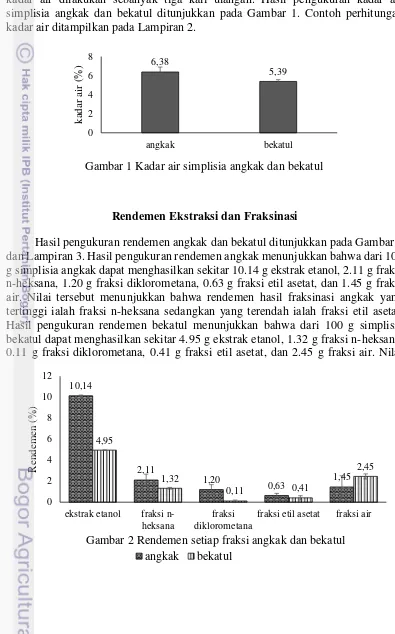
Pengukuran kadar air pada simplisia angkak dan bekatul dilakukan untuk mengetahui besarnya kandungan air dalam simplisia serta kualitasnya. Pengukuran kadar air dilakukan sebanyak tiga kali ulangan. Hasil pengukuran kadar air simplisia angkak dan bekatul ditunjukkan pada Gambar 1. Contoh perhitungan kadar air ditampilkan pada Lampiran 2.
Rendemen Ekstraksi dan Fraksinasi
Hasil pengukuran rendemen angkak dan bekatul ditunjukkan pada Gambar 2 dan Lampiran 3. Hasil pengukuran rendemen angkak menunjukkan bahwa dari 100 g simplisia angkak dapat menghasilkan sekitar 10.14 g ekstrak etanol, 2.11 g fraksi n-heksana, 1.20 g fraksi diklorometana, 0.63 g fraksi etil asetat, dan 1.45 g fraksi air. Nilai tersebut menunjukkan bahwa rendemen hasil fraksinasi angkak yang tertinggi ialah fraksi n-heksana sedangkan yang terendah ialah fraksi etil asetat. Hasil pengukuran rendemen bekatul menunjukkan bahwa dari 100 g simplisia bekatul dapat menghasilkan sekitar 4.95 g ekstrak etanol, 1.32 g fraksi n-heksana, 0.11 g fraksi diklorometana, 0.41 g fraksi etil asetat, dan 2.45 g fraksi air. Nilai
Gambar 1 Kadar air simplisia angkak dan bekatul
6,38
fraksi etil asetat fraksi air
R
8
tersebut menunjukkan bahwa rendemen hasil fraksinasi bekatul yang tertinggi ialah fraksi air sedangkan yang terendah ialah fraksi diklorometana.
Fitokimia
Uji fitokimia merupakan uji pendahuluan secara kualitatif untuk mendeteksi ada atau tidaknya senyawa metabolit sekunder pada ekstrak etanol angkak dan bekatul yang kemungkinan berperan sebagai senyawa antioksidan. Hasil uji fitokimia disajikan pada Tabel 1 dan Lampiran 4. Ekstrak etanol angkak mengandung senyawa saponin, flavonoid, dan alkaloid. Ekstrak etanol bekatul mengandung senyawa tanin, saponin, flavonoid, alkaloid, dan steroid.
Total Fenolik
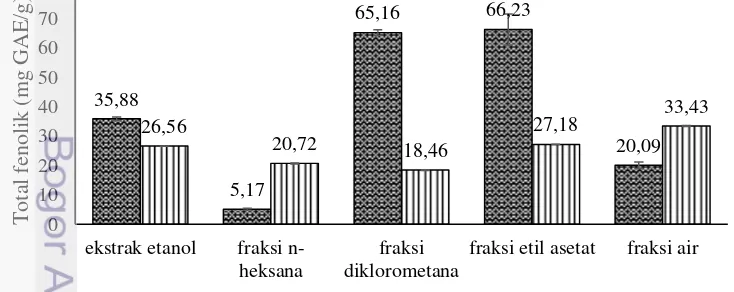
Pengukuran total fenolik pada sampel dilakukan dengan cara membandingkan absorbansi sampel yang diperoleh dengan absorbansi standar menggunakan kurva standar. Kurva standar disajikan pada Lampiran 5. Total fenolik setiap ekstrak dan fraksi angkak serta bekatul ditunjukkan pada Gambar 3. Contoh perhitungannya ditunjukkan pada Lampiran 6. Nilai total fenolik tersebut
Tabel 1 Hasil pengujian fitokimia
Senyawa fitokimia Ekstrak etanol angkak Ekstrak etanol bekatul
Tanin - +++
- : tidak mengandung senyawa fitokimia + : mengandung sedikit senyawa fitokimia ++ : mengandung banyak senyawa fitokimia +++ : mengandung banyak sekali senyawa fitokimia
35,88
fraksi etil asetat fraksi air
T
9 dinyatakan dalam bentuk galic acid equivalent (GAE) dengan satuan mg GAE/g ekstrak atau fraksi, yang artinya dalam 1 g eksrak atau fraksi uji mengandung sekitar 1 mg senyawa setara asam galat. Angkak mengandung total fenolik tertinggi pada fraksi etil asetat dan diklorometana, sedangkan yang terendah pada fraksi n- heksana. Bekatul mengandung total fenolik tertinggi pada fraksi air dan terendah pada fraksi diklorometana.
Total Flavonoid
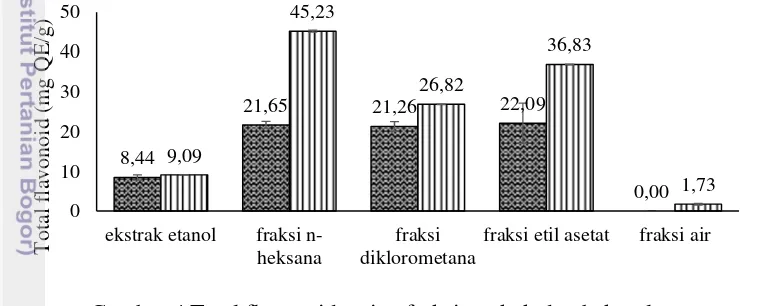
Kurva standar kuersetin disajikan pada Lampiran 7. Nilai total flavonoid yang diperoleh dinyatakan dalam bentuk quercetin equivalent (QE) dengan satuan mg QE/g ekstrak atau fraksi, yang artinya dalam 1 g eksrak atau fraksi uji mengandung sekitar 1 mg senyawa setara kuersetin. Total flavonoid setiap ekstrak dan fraksi angkak serta bekatul disajikan pada Gambar 4. Contoh perhitungannya ditunjukkan pada Lampiran 8. Angkak mengandung total flavonoid tertinggi pada fraksi diklorometana dan terendah pada fraksi air. Fraksi air angkak bahkan tidak terdeteksi mengandung flavonoid sehingga pada hasil pengukurannya memberikan nilai nol. Bekatul mengandung total flavonoid tertinggi pada fraksi n-heksana dan terendah pada fraksi air.
Aktivitas Antioksidan
Kurva standar trolox disajikan pada Lampiran 9. Aktivitas antioksidan tersebut dinyatakan dalam bentuk trolox equivalent (TE) dengan satuan mg TE/g ekstrak atau fraksi, yang artinya dalam 1 g eksrak atau fraksi uji mengandung sekitar 1 mg senyawa setara trolox. Aktivitas antioksidan setiap ekstrak dan fraksi angkak serta bekatul ditunjukkan pada Gambar 5. Contoh perhitungannya ditunjukkan pada Lampiran 10. Fraksi yang memiliki aktivitas antioksidan tertinggi pada angkak maupun bekatul adalah fraksi etil asetat sedangkan yang memiliki aktivitas antioksidan terendah pada angkak adalah fraksi air dan pada bekatul adalah ekstrak etanol.
fraksi etil asetat fraksi air
T
10
Korelasi
Hasil analisis korelasi pada angkak dan bekatul ditunjukkan pada Tabel 2. Hasil tersebut menunjukkan bahwa aktivitas antioksidan angkak berkorelasi positif dengan total fenolik dan total flavonoidnya. Sementara itu, aktivitas antioksidan bekatul hanya berkorelasi positif terhadap total flavonoidnya.
57,79
Gambar 5 Aktivitas antioksidan setiap fraksi angkak dan bekatul angkak bekatul
Tabel 2 Hasil analisis korelasi antara aktivitas antioksidan, total fenolik, total flavonoid, dan rendemen pada angkak dan bekatul
Aktivitas
Total fenolik angkak 0.857**
(sig 0.000) 1
Total flavonoid angkak 0.615* (sig 0.015)
0.392
(sig 0.148) 1
Rendemen angkak -0.346
(sig 0.225)
Total fenolik bekatul -0.256
(sig 0.358) 1
Total flavonoid bekatul 0.700** (sig 0.004)
-0.677**
(sig 0.006) 1
Rendemen bekatul -0.698** (sig 0.005)
0.464 (sig 0.095)
-0.632*
(sig 0.015) 1 Katerangan : ** : korelasi signifikan pada nilai 0.01
11
PEMBAHASAN
Kadar Air
Simplisia merupakan bahan alami yang dimanfaatkan sebagai obat atau bahan baku obat yang belum mengalami proses pengolahan apapun kecuali pengeringan. Salah satu syarat simplisia agar dikatakan baik ialah memiliki kadar air di bawah 10% (BPOM 2014). Alasan nilai kadar air dijadikan parameter utama dalam penentuan kualitas simplisia karena berkaitan dengan masa simpan simplisia. Semakin tinggi nilai kadar air suatu simplisia akan memungkinkan masa simpannya semakin pendek. Hal tersebut karena air dapat menjadi media bagi berbagai mikroorganisme sehingga menyebabkan simplisia mudah rusak.
Simpilisia angkak dan bekatul yang digunakan dalam penelitian ini mengandung kadar air dengan nilai di bawah 10%. Hal ini menunjukkan bahwa simplisia angkak dan bekatul tersebut memenuhi syarat dan dapat dikategorikan baik dan bertahan lama. Rata-rata nilai kadar air simplisia angkak ialah sebesar 6.38% (Gambar 1). Apabila dibandingkan dengan hasil penelitian sebelumnya, kadar air angkak mencapai 5.3770% (Zubaidah dan Sari 2015). Perbedaan tersebut disebabkan oleh besarnya suhu serta lamanya waktu pemanasan pada proses pembuatan simplisia. Selain proses pemanasan, jenis beras yang digunakan, proses pembuatan, serta tempat penyimpanannya pun turut memengaruhi kadar air (Harjadi 1994).
Berbeda dengan simplisia angkak, simplisia bekatul memiliki rata-rata kadar air yang lebih rendah yaitu 5.39% (Gambar 1). Hartati et al. (2015) menyatakan bahwa kadar air bekatul mencapai 9.7%. Perbedaan yang cukup jauh tersebut disebabkan penelitian Hartati et al. (2015) tidak dilakukan pemanasan pada bekatul sehingga kadar airnya masih sangat tinggi. Hal ini menunjukkan bahwa proses pemanasan pada pembuatan simplisia bekatul sangat memengaruhi nilai kadar air. Selain itu, varietas padi yang berbeda pun akan memiliki kadar air yang berbeda (Hartati et al. 2015).
Rendemen Ekstraksi dan Fraksinasi
Hasil pengukuran rendemen angkak dan bekatul ditunjukkan pada Gambar 2. Hasil tersebut menunjukkan bahwa rendemen ekstrak etanol angkak sebesar 10.14% serta rendemen ekstrak etanol bekatul sebesar 4.95%. Rendemen ekstrak etanol angkak yang diperoleh tersebut hampir sama dengan rendemen angkak dari penelitian Handayani (2013), yaitu sekitar 9.6%. Rendemen ekstrak etanol bekatul yang diperoleh pun hampir sama dengan penelitian sebelumnya, yaitu 4.61% (Widarta et al. 2013).
12
pelarut dengan polaritas yang sama dibandingkan dalam pelarut dengan polaritas yang berbeda (Stoker 2016).
Ekstrak etanol difraksinasi bertingkat menjadi empat fraksi. Oleh sebab itu, nilai rendemen ekstrak etanol seharusnya lebih besar atau sama dengan jumlah total rendemen semua fraksi. Hasil penelitian menunjukkan bahwa rendemen ekstrak etanol lebih besar dibandingkan dengan jumlah total rendemen semua fraksi, namun selisih antara rendemen ekstrak etanol dengan jumlah total rendemen semua fraksi pada angkak cukup besar, yaitu sekitar setengah dari rendemen ekstrak etanol angkak. Selisih yang cukup besar tersebut disebabkan oleh adanya fraksi yang tertinggal pada alat saat proses fraksinasi maupun evaporasi. Selain itu, dapat juga disebabkan oleh adanya senyawa yang turut menguap pada proses evaporasi. Berbeda dengan sampel angkak, selisih antara rendemen ekstrak etanol dengan jumlah total rendemen semua fraksi bekatul adalah 0.67%. Hal tersebut menunjukkan bahwa proses ekstraksi dan fraksinasi bekatul berlangsung dengan cukup baik.
Hasil penelitian menunjukkan bahwa nilai rata-rata rendemen hasil fraksinasi ekstrak etanol angkak dari yang tertinggi hingga terendah secara berturut-turut adalah fraksi n-heksana, air, diklorometana, dan fraksi etil asetat. Hal ini menunjukkan bahwa metabolit sekunder pada ekstrak etanol angkak lebih banyak tertarik dan larut pada pelarut n-heksana yang bersifat nonpolar. Markham (1998) menyatakan bahwa metabolit sekunder yang dapat terekstrak menggunakan pelarut n-heksana adalah yang bersifat nonpolar pula, seperti sterol, kumarin, dan beberapa terpenoid. Bamforth dan Ward (2014) juga menyatakan bahwa angkak mengandung berbagai macam asam lemak tak jenuh serta ergosterol yang dapat larut dalam pelarut nonpolar.
Berbeda dengan angkak, nilai rata-rata rendemen hasil fraksinasi ekstrak etanol bekatul dari yang tertinggi hingga terendah secara berturut-turut adalah fraksi air, n-heksana, etil asetat, dan fraksi diklorometana. Hal ini menunjukkan bahwa metabolit sekunder pada ekstrak etanol bekatul lebih banyak tertarik dan larut pada pelarut air yang bersifat polar. Banyak senyawa polar dalam bekatul yang diduga dapat terekstrak etanol, seperti tiamin, riboflavin, niasin, dan berbagai mineral larut air (Widarta et al. 2013). Selain itu, komponen utama pada bekatul adalah karbohidrat yang meliputi pati, gula pereduksi, dan pentosan (Haryadi 2008). Makromolekul tersebut diduga terlarut saat proses ekstraksi dan akan lebih mudah tertarik oleh pelarut polar dibandingkan pelarut nonpolar (Nur 2011). Rendemen fraksi n-heksana memiliki nilai tertinggi kedua. Hal ini disebabkan bekatul juga
banyak mengandung senyawa non polar seperti -orizanol dan vitamin E (Garcia et al. 2007).
Fitokimia
13 Feng et al. (2012) dalam Braun dan Cohen (2015) menyatakan bahwa angkak mengandung fitokimia berupa steroid, flavonoid, tanin, dan alkaloid. Adanya kandungan steroid dan tanin dalam angkak pada laporan tersebut berbeda dengan hasil yang diperoleh dalam penelitian. Perbedaan tersebut disebabkan oleh perbedaan genetik atau varietas pada beras yang digunakan, kondisi lingkungan, serta penggunaan insektisida (Hu 2012). Selain itu, perlakuan pascapanen seperti pengeringan dan proses fermentasi juga dapat memengaruhi kandungan fitokimia (Tiwari 2013).
Hasil analisis fitokimia pada bekatul menunjukkan bahwa ekstrak etanol bekatul mengandung hampir semua fitokimia yang diuji. Hal tersebut hampir sama dengan hasil penelitian Moko et al. (2014), yang menyatakan bahwa bekatul mengandung hampir semua metabolit sekunder seperti fenolik, flavonoid, triterpenoid, alkaloid, dan saponin. Namun, pada laporan Moko et al. (2014) tersebut tidak menunjukkan adanya tanin seperti pada hasil penelitian. Perbedaan tersebut pun disebabkan oleh adanya beberapa faktor yang dapat memengaruhi kandungan fitokimia, seperti varietas tanaman padi, kondisi lingkungan, serta perlakuan pascapanen yang diberikan.
Total Fenolik
Hasil pengukuran total fenolik pada angkak menunjukkan bahwa fraksi dengan total fenolik tertinggi adalah fraksi etil asetat, dilanjutkan dengan fraksi diklorometana, ekstrak etanol, fraksi air, dan terendah fraksi n-heksana. Hal tersebut menunjukkan bahwa senyawa fenolik pada angkak lebih banyak terlarut dalam pelarut semi polar seperti etil asetat dan diklorometana. Aniya et al. (2000) dalam Chairote et al. (2009) menyatakan bahwa senyawa fenolik yang terdapat dalam angkak adalah asam dimerumat yang bersifat polar sehingga mudah larut pelarut polar dan semi polar namun sukar larut dalam pelarut non polar. Hal tersebutlah yang juga menyebabkan fraksi n-heksana memiliki nilai total fenolik terendah.
Total fenolik angkak dari setiap fraksi berada pada rentang 5.17-66.23 mg GAE/g ekstrak atau fraksi. Nilai tersebut merupakan total fenolik angkak per gram ekstrak atau fraksi ujinya. Apabila ditinjau berdasarkan per gram simplisianya, rentang total fenolik angkak berkisar antara 0.11-3.64 mg GAE/g simplisia, dengan kadar paling tinggi pada ekstrak etanol (Lampiran 6). Hal tersebut karena ekstrak etanol memiliki rendemen yang jauh lebih besar dibandingkan fraksi lainnya. Hasil penelitian Park dan Kim (2011) menunjukkan bahwa total fenolik angkak sebesar 1.64 mg GAE/g simplisia. Hal tersebut menunjukkan bahwa kandungan fenolik angkak dalam penelitian ini lebih tinggi dibandingkan penelitian sebelumnya tersebut.
14
Senyawa tersebut bersifat polar sehingga cenderung lebih mudah larut pada pelarut polar dan semi polar. Fraksi n-heksana sebagai fraksi nonpolar memiliki nilai total fenolik yang lebih tinggi dibandingkan fraksi diklorometana sebagai fraksi semi polar. Hal tersebut karena pada fraksi n-heksana terdapat senyawa nonpolar seperti -oryzanol dan vitamin E yang diduga memiliki aktivitas reaksi terhadap reagen yang mirip seperti aktivitas senyawa fenolik (Mumpuni 2013).
Total fenolik bekatul dari setiap fraksi berada pada rentang 18.47-33.43 mg GAE/g ekstrak atau fraksi. Berdasarkan konversi terhadap rendemen, total fenolik bekatul sekitar 0.02-1.31 mg GAE/g simplisia, dengan kadar paling tinggi pada ekstrak etanol (Lampiran 6). Rentang nilai tersebut jauh lebih rendah dibandingkan dengan total fenolik bekatul pada penelitian Rao et al. (2010), yaitu sekitar 3.27-12.4 mg GAE/g simplisia. Perbedaan tersebut dapat disebabkan oleh pelarut ekstraksi dan verietas padi yang digunakan.
Total Flavonoid
Hasil pengukuran total flavonoid ditunjukkan pada Gambar 4. Hasil tersebut menunjukkan bahwa angkak maupun bekatul memiliki nilai total flavonoid fraksi non polar dan semi polar (n-heksana, diklorometana, dan etil asetat) yang jauh lebih tinggi dibandingkan dengan fraksi polar (air dan etanol). Hal tersebut karena metode alumunium klorida yang digunakan lebih spesifik untuk menganalisis flavonoid kelompok flavon dan flavonol (Chang et al. 2002). Kelompok flavon dan flavonol memiliki tingkat kepolaran yang rendah (Andersen dan Markham 2006). Oleh sebab itu, flavon dan flavonol lebih mudah larut dalam etil asetat, diklorometan, dan n-heksana. Khanum et al. (2015) juga menyatakan bahwa berdasarkan analisis AlCl3, fraksi kloroform, etil asetat, dan n-heksana menunjukkan total flavonoid yang lebih tinggi dibandingkan dengan fraksi air dan metanol.
Fraksi angkak dengan total flavonoid tertinggi hingga terendah berturut-turut adalah fraksi etil asetat, diklorometana, n-heksana, ekstrak etanol, dan fraksi air. Wanti (2008) menyatakan bahwa angkak mengandung flavonoid kelompok antosianin. Walaupun antosianin memiliki struktur yang berbeda dengan flavon dan flavonol, namun antosianin memiliki kemungkinan terdeteksi dalam analisis. Antosianin memiliki struktur yang polar sehingga mudah larut dalam pelarut yang polar dan semi polar (Wallace dan Gisuti 2014). Fraksi air angkak tidak terdeteksi mengandung senyawa flavonoid. Hal tersebut dapat disebabkan senyawa flavonoid yang terkandung di dalamnya sangat rendah karena diduga telah terdistribusi pada fraksi lain saat proses fraksinasi.
15 mg QE/g ekstrak dan fermentasi kedelai sekitar 1.9 mg QE/g ekstrak (Katawal et al. 2016; Yang et al. 2012).
Fraksi bekatul dengan total flavonoid tertinggi hingga terendah berturut-turut adalah fraksi n-heksana, etil asetat, diklorometana, ekstrak etanol, dan fraksi air. Ghasemzadeh et al. (2015) mengungkapkan bahwa ekstrak bekatul mengandung senyawa flavonoid berupa apigenin dari kelompok flavon, rutin dan kuersetin dari kelompok flavonol, serta katekin. Tingginya nilai total flavonoid pada fraksi n-heksana, etil asetat, dan diklrometana dapat disebabkan oleh aktivitas flavon dan flavonol. Sementara itu, senyawa flavonoid yang diduga berperan pada ekstrak etanol dan fraksi air adalah katekin.
Total flavonoid bekatul dari setiap fraksi berada pada rentang 1.73-45.23 mg QE/g ekstrak atau fraksi. Sementara itu, total flavonoid setiap fraksi bekatul per simplisianya berada pada rentang 0.02-0.59 mg QE/g simplisia dengan kadar flavonoid tertinggi pada fraksi n-heksana (Lampiran 7). Rentang nilai tersebut lebih rendah dibandingkan dengan total flavonoid bekatul pada penelitian Rao et al. (2010), yaitu sekitar 1.68-8.51 mg QE/g simplisia. Perbedaan total fenolik antara hasil penelitian yang dilakukan dengan penelitian sebelumnya dapat disebabkan oleh pelarut ekstraksi dan verietas padi yang digunakan.
Aktivitas Antioksidan
Fe(TPTZ)23+ dalam analisis FRAP diibaratkan sebagai zat radikal bebas dalam tubuh yang akan direduksi oleh senyawa antioksidan dalam angkak dan bekatul. Fe atau dikenal dengan zat besi merupakan salah satu mineral yang dibutuhkan tubuh. Zat besi dalam tubuh dapat berada dalam tiga bentuk utama, yaitu ion Fe2+ (ferro), ion Fe3+ (ferri), dan besi heme. Ion besi merupakan salah satu zat pro-oksidan di dalam tubuh karena ferri dapat mengoksidasi senyawa lain serta berpotensi memunculkan radikal bebas baru (Udipi et al. 2012). Selain itu, Wang dan Pantopoulos (2011) menyatakan bahwa ferri memiliki bioavailabilitas yang kurang baik karena kelarutannya terbatas sehingga ferri perlu direduksi menjadi ferro terlebih dahulu. Analisis FRAP merupakan kondisi in vitro yang dirancang untuk mendeteksi kemampuan antioksidan dalam mereduksi ferri serta radikal bebas lainnya dalam tubuh.
Hasil analisis aktivitas antioksidan angkak menunjukkan bahwa fraksi yang memiliki aktivitas antioksidan tertinggi ialah fraksi etil asetat, dilanjutkan dengan fraksi diklorometana, ekstrak etanol, fraksi n-heksana, dan yang paling rendah adalah fraksi air (Gambar 5). Hasil uji ANOVA pada selang kepercayaan 95% menunjukkan bahwa dari kelima fraksi angkak terdapat minimal satu fraksi yang memiliki aktivitas antioksidan yang berbeda nyata dengan fraksi lainnya (Lampiran 11). Uji LSD menunjukkan bahwa kelima fraksi yang diuji dapat dikelompokkan menjadi tiga kelompok berdasarkan aktivitas antioksidannya (Lampiran 12). Satu kelompok memiliki aktivitas antioksidan yang sama sedangkan antar kelompok memiliki aktivitas antioksidan yang berbeda. Kelompok pertama adalah fraksi n-heksana, fraksi air, dan ekstrak etanol, kelompok kedua adalah fraksi diklrometana, dan yang ketiga adalah fraksi etil asetat.
16
terakhir ekstrak etanol. Hasil uji ANOVA pada selang kepercayaan 95% menunjukkan bahwa dari kelima fraksi angkak terdapat minimal satu fraksi yang memiliki aktivitas antioksidan yang berbeda nyata dengan fraksi lainnya (Lampiran 13). Uji LSD menunjukkan bahwa kelima fraksi yang diuji dapat dikelompokkan menjadi tiga kelompok berdasarkan aktivitas antioksidannya (Lampiran 14). Kelompok pertama adalah fraksi n-heksana dan fraksi diklorometana, kelompok kedua adalah fraksi etil asetat, dan yang ketiga adalah fraksi air dan ekstrak etanol.
Hasil analisis menunjukkan bahwa aktivitas antioksidan angkak dan bekatul yang paling tinggi terdapat pada fraksi etil asetat dan urutan kedua pada fraksi diklorometana. Hal tersebut disebabkan mayoritas metabolit sekunder termasuk antioksidan bersifat semi polar sehingga lebih mudah larut dalam pelarut yang bersifat semi polar juga, seperti etil asetat dan diklorometana (Saifudin 2014). Tanaya et al. (2015) menyatakan bahwa pelarut etil asetat dapat menarik senyawa golongan flavonoid, triterpenoid, dan tanin. Sementara itu, senyawa yang biasanya terdapat dalam fraksi diklorometana adalah steroid, kuinon, dan terpenoid (Widiyantoro 2014).
Ekstrak etanol merupakan sumber dari senyawa yang berada dalam fraksi sehingga dapat dinyatakan bahwa ekstrak etanol mengandung semua senyawa tersebut. Sementara itu, aktivitas antioksidan ekstrak etanol lebih rendah dibandingkan fraksi etil asetat dan diklorometana pada angkak, bahkan memiliki aktivitas yang paling rendah pada bekatul. Hal tersebut karena aktivitas campuran senyawa dalam ekstrak etanol diduga memiliki hubungan yang antagonis, yaitu saling meniadakan apabila bergabung (Saifudin 2014). Oleh sebab itu, aktivitas antioksidan ekstrak etanol lebih rendah dibandingkan fraksinya. Selain itu, proses pemurnian melalui fraksinasi pun menjadikan konsentrasi senyawa antioksidan dalam fraksi lebih tinggi dibandingkan ekstrak etanol.
Setiap fraksi angkak memiliki aktivitas antioksidan berkisar antara 31.63-190.84 mg TE/g ekstrak atau fraksi. Setiap fraksi bekatul memiliki aktivitas antioksidan berkisar antara 61.02-163.74 mg TE/g ekstrak atau fraksi. Kedua rentang nilai tersebut lebih tinggi dibandingkan dengan aktivitas antioksidan dari sepuluh spesies tanaman obat yang umum digunakan, yaitu hanya berkisar antara 2-22 mg TE/g ekstrak (Panyaphu et al. 2012). Hal ini menunjukkan bahwa angkak dan bekatul memiliki khasiat antioksidan yang lebih tinggi dibandingkan dengan sepuluh spesies tanaman tersebut dalam hal reduksi. Kemampuan reduksi tersebut dapat dimanfaatkan tubuh untuk mereduksi ferri menjadi ferro sehingga dapat diserap dan meningkatkan bioavailabilitasnya.
Korelasi
17 Aktivitas antioksidan dengan total fenolik angkak memiliki korelasi yang sangat kuat pada selang kepercayaan 99%. Aktivitas antioksidan dengan total flavonoid angkak juga memiliki korelasi yang kuat pada selang kepercayaan 95%. Berbeda dengan dua korelasi sebelumnya, total fenolik dengan total flavonoid angkak memiliki koefisien korelasi sebesar 0.487 (p-value>0.05) yang artinya dua variabel tersebut tidak memiliki korelasi yang bermakna.
Hubungan antara aktivitas antioksidan dengan total fenolik, serta aktivitas antioksidan dengan total flavonoid pada angkak memiliki nilai korelasi yang positif. Hal tersebut menunjukkan bahwa fraksi yang memiliki aktivitas antioksidan tinggi, memiliki total fenolik serta total flavonoid yang tinggi pula. Aktivitas antioksidan pada angkak dapat dipengaruhi oleh senyawa fenolik dan flavonoid yang dikandungnya karena senyawa tersebut berpotensi sebagai antioksidan (Chaireto et al. 2009). Senyawa fenolik dan flavonoid dapat bereaksi sebagai pereduksi, penangkap radikal bebas, pengkelat logam, serta peredam terbentuknya singlet oksigen (Kumalaningsih 2006). Sementara itu, Dempsey dan Dempsey (2002) menyatakan bahwa korelasi tidak mewakili hubungan sebab akibat sehingga tidak dapat disimpulkan bahwa aktivitas antioksidan angkak disebabkan oleh senyawa fenolik dan flavonoidnya. Hal tersebut karena ada faktor dan senyawa lain yang dapat memengaruhi aktivitas antioksidan.
Aktivitas antioksidan dengan total fenolik bekatul adalah -0.270 ( p-value>0.05), yang artinya korelasi tersebut lemah serta tidak signifikan. Sementara itu, aktivitas antioksidan dengan total flavonoid bekatul memiliki korelasi yang kuat pada selang kepercayaan 99%. Total fenolik dengan total flavonoid bekatul memiliki koefisien korelasi sebesar -0,645 (p-value<0.01), yang artinya dua variabel tersebut berkorelasi kuat pada selang kepercayaan 99%.
Aktivitas antioksidan dengan total fenolik bekatul memiliki korelasi negatif dan tidak signifikan. Hal tersebut menunjukkan adanya kemungkinan bahwa aktivitas antioksidan bekatul tidak banyak dipengaruhi oleh senyawa fenolik. Terdapat senyawa selain fenolik yang berpotensi sebagai antioksidan pada bekatul, yaitu -oryzanol, α-tocopherol, -tocopherol, α-tocotrienol, - tocotrienol, dan - tocotrienol, -karoten, phytosterol, dan squalene (Garcia et al. 2007; Mumpuni 2013; Suryadinata 2015).
Flavonoid merupakan salah satu bagian dari senyawa fenolik (Vattem dan Maitin 2016). Oleh sebab itu, total fenolik dengan total flavonoid seharusnya berbanding lurus. Sementara itu, hasil penelitian yang diperoleh menunjukkan bahwa total fenolik dengan total flavonoid bekatul berbanding terbalik. Fraksi air bekatul memiliki nilai total fenolik tertinggi namun total flavonoidnya terendah. Hal tersebut menunjukkan bahwa aktivitas total fenolik yang terdeteksi dipengaruhi lebih banyak oleh senyawa asam fenolat atau golongan lain selain flavonoid. Ghasemzadeh et al. (2015) mengungkapkan bahwa senyawa fenolik bekatul yang terdeteksi terdiri dari tujuh asam fenolat dan tiga flavonoid.
18
rendemen hanya menggambarkan jumlah senyawa yang terdapat dalam fraksi, bukan jenis dan kemampuan senyawa tersebut.
Hasil analisis pada bekatul menunjukkan bahwa rendemen memiliki korelasi yang kuat dengan aktivitas antioksidan (p-value<0.01) dan total flavonoidnya ( p-value<0.05). Kedua korelasi tersebut bernilai negatif yang artinya saling berbanding terbalik. Hal ini menunjukkan bahwa semakin rendah nilai rendemen maka semakin tinggi aktivitas antioksidan dan total flavonoidnya, begitu juga sebaliknya. Walaupun demikian, tetap tidak bisa disimpulkan bahwa nilai rendemen memengaruhi aktivitas antioksidan dan total flavonoid karena korelasi tidak mewakili hubungan sebab akibat (Dempsey dan Dempsey 2002).
SIMPULAN DAN SARAN
Simpulan
Fraksi n-heksana, fraksi diklorometana, fraksi etil asetat, fraksi air, serta ekstrak etanol pada angkak dan bekatul berpotensi sebagai antioksidan. Angkak memiliki aktivitas antioksidan tertinggi pada fraksi etil asetat sebesar 190.84 mg TE/ g fraksi. Bekatul pun demikian, fraksi dengan aktivitas antioksidan tertingginya adalah fraksi etil asetat sebesar 163.74 mg TE/ g fraksi. Aktivitas antioksidan pada angkak berkorelasi positif dengan total fenolik dan total flavonoidnya, sedangkan aktivitas antioksidan pada bekatul hanya berkorelasi terhadap total flavonoidnya.
Saran
Perlu dilakukan identifikasi dan pemurnian senyawa antioksidan pada setiap fraksi angkak dan bekatul khususnya fraksi etil asetat untuk mengetahui senyawa aktif yang berperan sebagai antioksidan. Selain itu, perlu dilakukan uji in vivo untuk mengetahui toksisitas dan menentukan Lethal Dose 50 (LD50).
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2006. Official Methods of Analysis Ed.18. Washington (GB): Association of Official Analytical Chemist.
Andersen OM, Markham KR. 2006. Flavonoids : Chemistry, Biochemistry and Applications. Boca Raton (US): CRC Press.
19 [Balitbangkes] Badan Penelitian dan Pengembangan Kesehatan Departemen Kesehatan Republik Indonesia. 2008. Riset Kesehatan Dasar 2007. Jakarta (ID): Balitbangkes.
Bamforth CW, Ward RE. 2014. The Oxford Handbook of Food Fermentations. Oxford (GB): Oxford University Press.
Braun L, Cohen M. 2015. Herbs and Natural Supplements : An Evidence-Based Guide 4th Edition. Chatswood (AT): Elsevier.
Benzie IFF, Strain JJ. 1996. The ferric reducing ability of plasma as a measure of antioxidant power: the FRAP assay. Anal Biochem. 239: 70-76.
[BPOM] Badan Pengawas Obat dan Makanan Republik Indonesia. 2014. Peraturan kepala badan pengawas obat dan makanan Republik Indonesia nomor 12 tahun 2014 tentang persyaratan mutu obat tradisional. Jakarta (ID): BPOM. Chairote E, Chairote G, Lumyong S. 2009. Red yeast rice prepared from thai
glutinous and the antioxidant activities. Chiang Mai J Sci. 36(1): 42-49. Chang C, Yang M, Wen H, Chern J. 2002. Estimation of total flavonoid content in
propolis by two complementary colorimetric methods. JFDA. 10(3): 178-182. Dempsey PA, Dempsey AD. 2002. Riset Kepewatan : Buku Ajar dan Latihan.
Widyastuti P, penerjemah; Adiningsih D, editor. Jakarta (ID): EGC. Terjemahan dari: Nursing Research : Text and Workbook.
Garcia CA, Gavino G, Mosqueda MB, Hevia P, Gavino VC. 2007. Correlation of
tocopherol, tocotrienol, -oryzanol and total polyphenol content in rice bran with different antioxidant capacity assays. Food Chem. 102: 1228-1232. Ghasemzadeh A, Jaafar HZE, Juraimi AS, Tayebi-Meigooni A. 2015. Comparative
evaluation of different extraction techniques and solvent for the assay of phytochemicals and antioxidant activity of hashemi rice bran. Molecules. 20: 10822-10838.
Halliwell B, Gutteridge JMC. 2015. Free Radicals in Biology and Medice 5th
Edition. Oxford (GB): Oxford University Press.
Handayani R. 2013. Formulasi sediaan bubuk kompak menggunakan ekstrak angkak sebagai pewarna [skripsi]. Medan (ID): Universitas Sumatera Utara. Harborne, JB. 1987. Metode Fitokimia : Penuntun Cara Modern Menganalisis
Tumbuhan. Padmawinata K dan Soediro L, penerjemah; Mansoor S, editor. Bandung (ID): ITB Press. Terjemahan dari: J.B. Harborne : Phytochemical Methods.
Harjadi W. 1994. Ilmu Kimia Analitik Dasar. Jakarta (ID): Penerbit Erlangga. Hartati S, Marsono Y, Suparmo, Santoso U. 2015. Komposisi kimia serta aktivitas
antioksidan ekstrak hidrofilik bekatul beberapa varietas padi. AGRITECH. 35(1): 35-42.
20
Hernani, Raharjo M. 2005. Tanaman Berkhasiat Antioksidan. Jakarta (ID): Penebar Swadaya.
Hikmah FD. 2012. Pengaruh partisi bertingkat cair-cair etanol rimpang jahe (Zingiber officinale Rosc.) terhadap profil kandungan senyawa kimia dan aktivitas antiradikalnya [skripsi]. Surakarta (ID): Universitas Muhammadiyah Surakarta.
Hu C. 2012. Factors affecting phytochemical composition and antioxidant activity of ontario vegetable crops [tesis]. Guelph (CA): The University of Guelph. Katawal I, Kharel GP, Poudel BH. 2016. Antioxidant activity and cytotoxicity of
nepalase nak cheese. Bio Chem Res. 3: 234-245.
Khanum R, Mazhar F, Jahangir M. 2015. Antioxidant evaluations of polar and non-polar fractions of Cajanus cajan seeds. J Med Plants Res. 9(6): 193-198. Krishnamurthy P, Wadhwani A. 2012. Antioxidant Enzymes and Human Health.
Di dalam: El-Missiry, editor. Antioxidant Enzyme. Rijeka (CU): InTech. 3-15.
Kumalaningsih S. 2006. Antioksidan Alami. Surabaya (ID): Trubus Agrisarana. Markham KR. 1998. Cara Mengidentifikasi Flavonoid. Padmawinata K,
penerjemah. Bandung (ID): ITB Press. Terjemahan dari: Techniques of Flavonoid Identification.
Miller B. 2009. Antioxidants : Your Answer to Over 60 Degenerative Diseases Involving Free Radical Activity. Petaling Jaya (MY): Oak Publication Sdn Bhd.
Moko EM, Purnomo HKJ, Ijong FG. 2014. Phytochemical content and antioxidant properties of colored and non colored varieties of rice bran from minahasa, north sulawesi, Indonesia. IFRJ. 21(3): 1053-1059.
Mumpuni PD. β01γ. Analisis kadar tokoferol, -oryzanol dan -karoten serta aktivitas antioksidan minyak bekatul kasar [skripsi]. Semarang (ID): Universitas Diponegoro.
Nur AM. 2011. Kapasitas antioksidan bawang dayak (Eleutherine palmifolia) dalam bentuk segar, simplisia dan keripik, pada pelarut nonpolar, semipolar dan polar [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Oktavia N. 2015. Sistematika Karya Ilmiah. Yogyakarta (ID): Deepublish.
Park HJ, Kim IS. 2011. Antioxidant activities and anticancer effect of red yeast rice grown in the medium containing garlic. Food Sci Biotechnol. 20(2): 297-302. Panyaphu K, Sirisa-ard P, Ubol PN, Nathakarnkitkul S, Chansakaow S, On TV. 2012. Phytochemical, antioxidant and antibacterial activities of medical plants used in northern Thailand as postpartum herbal bath recipes by the Mien (Yao) community. Phytopharmacology. 2(1). 92-105.
21 Saifudin A. 2014. Senyawa Alam Metabolit Sekunder : Teori, Konsep, dan Teknik
Pemurnian. Yogyakarta (ID): Deepublish.
Santos TR, Duarte AC. 2014. Analysis of Marine Samples in Search of Bioctive Compounds. Oxford (GB): Elsevier.
Sen S, Chakraborty R, Sridhar C, Reddy YSR, De B. 2010. Free radicals, antioxidants, disease and phytomedicines: current status and future prospect. Int J Phar Sci Rev Res. 3(1): 91-100.
Shinde A, Ganu J, Naik P. 2012. Effect of free radicals and antioxidants on oxidative stress: a review [ulasan]. J Dent Alli Sci. 1(2): 63-66.
Singgih M, Saraswaty V, Ratnaningrum D, Priatni S dan Damayanti S. 2014. The influence of temperature and ethanol concentration in monacolin K extraction from monascus fermented rice. Pro Chem. 9:242–247. DOI: 10.1016/j.porche.2014.05.029.
Stoker HS. 2016. General, Organic, and Biological Chemistry 7th Edition. Boston (US): Cangage Learning.
Suryadinata A. 2015. Oil extraction from rice bran with various solvent and concentration of crude extract to antioxidant activity. ALCHEMY. 4(1): 25-31.
Tananuwong K, Tewaruth W. 2010. Extraction and application of antioxidant from black glutinous rice. Food Sci Technol. 43. 476-481.
Tanaya V Retnowati R, Suratmo. 2015. Fraksi semi polar dari daun mangga kasturi (Mangifera casturi Kosterm). Kim Stud J. 1(1): 778-784.
Thanonkaew A, Wongyai S, McClements DJ, Decker EA. 2012. Effect of stabilization of rice bran by domestic heating on mechanical extraction yield, quality, and antioxidant properties of cold-pressed rice bran oil (Oryza saltiva L.). Food Sci Tech. 48. 231-236.
Tisnadjaja D. 2006. Bebas Kolesterol dan Demam Berdarah dengan Angkak. Jakarta (ID): Penebar Swadaya.
Tiwari BK, Brunton NP, Brennan C. 2013. Handbook of Plant Food Phytochemicals: Sources, Stability and Extraction. New Jersey (US): John Wiley & Sons.
Udipi S, Ghugre P, Gokhale C. 2012. Iron, Oxidative Stress and Health. Di dalam: Lushchak V, editor. Oxidative Stress : Molecular Mechanisms and Biological Effects. Rijeka (CU): InTech. 73-108.
Vattem DA, Maitin V. 2016. Functional Food, Nutraceuticals and Natural Product: Concepts and Applications. Pennsylvania (US): DEStech Publications, Inc.
22
Wallace TC, Giusti MM. 2014. Anthocyanins in Health and Disease. Boca Raton (GB): CRC Press.
Wang J, Pantopoulos K. 2011. Regulation of cellular iron metabolism. Bicohem J. 434: 365-381.
Wanti S. 2008. Pengaruh berbagai jenis beras terhadap aktivitas antioksidan pada angkak oleh Monascus purpureous [skripsi]. Surakarta (ID): Universitas Sebelas Maret.
Watson RR, Preedy VR, Zibadi S. 2014. Wheat and Rice in Desease Prevention and Health: Benefits, Risk and Mechanism of Whole Grains in Health Promotion. London (GB): Elsevier Inc.
Widarta IWR, Nocianitri KA, Sari LPIP. 2013. Ekstraksi komponen bioaktif bekatul beras lokal dengan beberapa jenis pelarut. J Apl Tek Pang. 2(2): 75-79.
Widiyantoro A. 2011. Metabolit sekunder prospektif dari famili simaroubaceae. J Penel Saintek. 19(2): 14-22.
Winarno FG, Winarno W, Ahnan ADW. 2015. Telomer: Membalik Proses Penuaan. Jakarta (ID): PT Gramedia Pustaka Utama.
Yang X, Chen J, Zhang C, Chen H, Liu Y. 2012. Evaluation of antioxidant activity of fermented soybean meal extract. AJPP. 6(24): 1774-1781.
23
24
Lampiran 1 Diagram alir penelitian
Preparasi sampel
Simplisia
Ekstraksi simplisia dengan etanol
Ekstrak etanol
Fraksinasi bertingkat ekstrak etanol dengan pelarut n-heksana diklorometana etil asetat
Fraksi n-heksana, diklorometana, etil
asetat, dan air
Uji total fenolik Uji total flavonoid Uji aktivitas antioksidan
Uji fitokimia kualitatif Pengukuran
25 Lampiran 2 Kadar air simplisia
Sampel A (g) C (g) C+B (g) B (g) Kadar air (%)
Rata-rata kadar air
(%) Angkak 3.0116 40.7053 43.5071 2.8018 6.9664 6.3824 ±
0.5072 3.0271 36.6643 39.5082 2.8439 6.0520
3.0005 39.4842 42.3008 2.8166 6.1289
Bekatul 3.0072 4.7267 7.5676 2.8409 5.4981 5.3886 ± 0.1829 3.0308 5.2175 8.0819 2.8644 5.4903
3.0247 4.4954 7.3635 2.8681 5.1774 Keterangan :
A : bobot sampel sebelum pemanasan B : bobot sampel setelah pemanasan C : bobot cawan kosong
Contoh perhitungan : Angkak ulangan 1 Kadar air = A-B
A × 100% = γ.0116 -β.8018
γ.0116
× 100%
=
0.β09826
Lampiran 3 Rendemen hasil ekstraksi dan fraksinasi
Sampel Fraksi A (g) B (g) Rendemen
(%)
Rata-rata rendemen (%) Angkak Ekstrak etanol 400 37.7700 10.086 10.1355±0.07
400 38.1407 10.185
n-heksana 3.4969 0.8874 2.5721 2.1140±0.5531 1.8081 0.2675 1.4995
1.5356 0.3440 2.2705
Diklorometana 3.4969 0.4774 1.3837 1.1995±0.4676 1.8081 0.2760 1.5471
1.5356 0.1012 0.6679
Etil asetat 3.4969 0.2279 0.6605 0.6302±0.1950 1.8081 0.1442 0.8083
1.5356 0.0639 0.4218
Air 3.4969 0.3645 1.0565 1.4463±1.0683
1.8081 0.4736 2.6548 1.5356 0.0951 0.6277
Bekatul Ekstrak etanol 300 14.0796 4.9606 4.9532±0.0104 300 14.0381 4.9459
n-heksana 7.4430 1.8672 1.2426 1.3190±0.0832 8.4034 2.2169 1.3067
8.8394 2.5122 1.4077
Diklorometana 7.4430 0.0131 0.0087 0.1085±0.0881 8.4034 0.2983 0.1758
8.8394 0.2514 0.1409
Etil asetat 7.4430 0.9427 0.6273 0.4062±0.2031 8.4034 0.6169 0.3635
A : Bobot simplisia yang diekstraksi atau bobot ekstrak yang difraksinasi B : Bobot ekstrak atau fraksi yang diperoleh
Contoh perhitungan :
Rendemen hasil ekstraksi (ekstrak angkak ulangan 1)
27 Lampiran 3 (lanjutan...)
Rendemen hasil fraksinasi (fraksi n-heksana angkak ulangan 1)
fraksi (%) = Bobot fraksi yang diperoleh
Bobot ekstrak yang difraksinasi ×rendemen ekstrak%
= 0.8874
28
Lampiran 4 Hasil uji fitokimia
Fitokimia Hasil uji pada ekstrak etanol angkak
Kontrol + Kontrol - Ulangan 1 Ulangan 2
Tannin
Hasil : + Hasil: - Hasil : - Hasil: -
Saponin
Hasil : +
Hasil : - Hasil : + Hasil : +
Flavonoid
Hasil: + Hasil : - Hasil : + Hasil: + Alkaloid
Dragendorf
Hasil: + Hasil: - Hasil: + Hasil: +
Wagner
Hasil: - Hasil: - Hasil: - Hasil: -
Meyer
Hasil: - Hasil: - Hasil: - Hasil: -
Steroid dan Triterpenoid
Hasil : +
29 Lampiran 4 (lanjutan...)
Kontrol positif :
Tanin : daun teh hijau
Saponin : biji lerak
Flavonoid : daun sirih merah
Alkaloid : daun tapak dara
Steroid dan triterpenoid : som jawa
Fitokimia Hasil uji pada ekstrak etanol bekatul
Kontrol + Kontrol - Ulangan 1 Ulangan 2
Tannin
Hasil : + Hasil: - Hasil : - Hasil: -
Saponin
Hasil : + Hasil : - Hasil : + Hasil : +
Flavonoid
Hasil: + Hasil : - Hasil : + Hasil: + Alkaloid
Dragendorf
Hasil: + Hasil: - Hasil: + Hasil: +
Wagner
Hasil: + Hasil: - Hasil: + Hasil: +
Meyer
Hasil: - Hasil: - Hasil: - Hasil: -
Steroid dan Triterpenoid
Hasil : + triterpenoid
Hasil : - Hasil : + steroid
30
Lampiran 5 Kurva standar asam galat
Konsentrasi (mg/L) Absorbansi (λ 765 nm)
0 0
2 0.174
4 0.318
6 0.450
8 0.579
10 0.667
12 0.760
y = 0,063x + 0,0432 R² = 0,987
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
0 2 4 6 8 10 12 14
A
bsor
bans
i
pada
λ
765
nm
31 Lampiran 6 Hasil pengukuran total fenolik pada sampel
32
Lampiran 6 (Lanjutan...)
Contoh perhitungan (ekstrak etanol angkak ulangan 1):
Perhitungan total fenolik dengan kalibrasi pada persamaan garis kurva standar (y = 0.063x + 0.0432)
mg GAE/ L = Absorbansi-0.04γβ 0.06γ
= 0.γ64-0.04γβ 0.06γ
= 5.0921 mg GAE/ L
Perhitungan total fenolik per bobot ekstrak atau fraksi (mg GAE/ g ekstrak atau fraksi)
mg GAE/ g ekstrak atau fraksi = mg GAE/L sampel g/L × FP = 5.09β1 mg GAE/L
1.06 g/L × 7.5
= 36.0287 mg GAE/ g ekstrak atau fraksi Perhitungan total fenolik per bobot simplisia
mg GAE/ g simplisia = (rata-rata mg GAE/ g ekstrak atau fraksi) × rendemen = 35.88 mg GAE/ g ekstrak × 0.101355 g ekstrak/g simplisia
33 Lampiran 7 Kurva standar kuersetin
Konsentrasi (mg/L) Absorbansi (λ 415 nm)
0 0.002
2 0.121
4 0.244
6 0.356
8 0.516
10 0.658
12 0.775
y = 0,0654x - 0,0107 R² = 0,9978
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
0 2 4 6 8 10 12 14
A
bsor
bans
i
pada
λ
415
nm
34
Lampiran 8 Hasil pengukuran total flavonoid pada sampel
Sampel Fraksi A mg QE
35 Lampiran 8 (Lanjutan...)
Contoh perhitungan (ekstrak etanol angkak ulangan 1):
Perhitungan total flavonoid dengan kalibrasi pada persamaan garis kurva standar (y = 0.0654x - 0.0107)
mg QE/ L = Absorbansi+0.0107 0.0654
= 0.107+0.0107 0.0654
= 1.7997 mg QE/ L
Perhitungan total flavonoid per bobot ekstrak atau fraksi (mg QE/ g ekstrak atau fraksi)
mg QE/ g ekstrak atau fraksi = mg QE/L sampel g/L × FP = 1.7997 mg QE/L
1.0γ g/L × 5 = 8.7364 mg QE/ g ekstrak Perhitungan total flavonoid per bobot simplisia
mg QE/ g simplisia = (rata-rata mg QE/ g ekstrak atau fraksi) × rendemen = 8.44 mg QE/ g ekstrak × 0.101355 g ekstrak/g simplisia
36
Lampiran 9 Kurva standar trolox
Konsentrasi (mg/L) Absorbansi (λ 59γ nm)
0 0
1 0,112
1.5 0,168
2 0,231
2.5 0,297
3 0,422
3.5 0,442
4 0,493
y = 0,1297x - 0,0132 R² = 0,9855
0 0,1 0,2 0,3 0,4 0,5 0,6
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5
abs
robans
i
pada
λ
593
nm
37 Lampiran 10 Hasil pengukuran aktivitas antioksidan pada sampel
38
Lampiran 10 (Lanjutan...)
Contoh perhitungan (ekstrak etanol angkak ulangan 1):
Perhitungan aktivitas antioksidan dengan kalibrasi pada persamaan garis kurva standar (y = 0.1297x - 0.0132)
mg TE/ L = Absorbansi+0.01γβ 0.1β97
= 0.β0β+0.01γβ 0.1β97
= 1.6592 mg TE/ L
Perhitungan aktivitas antioksidan per bobot ekstrak atau fraksi (mg TE/ g ekstrak atau fraksi)
mg TE/ g ekstrak atau fraksi = mg TE/L
sampel g/L × FP = 1.659β mg TE/L
γ.16 g/L × 100
= 52.5068 mg TE/ g ekstrak atau fraksi Perhitungan aktivitas antioksidan per bobot simplisia
mg TE/ g simplisia = (rata-rata mg TE/ g ekstrak atau fraksi) × rendemen = 57.79 mg TE/ g ekstrak × 0.101355 g ekstrak/g simplisia
39 Lampiran 11 Hasil analisis statistik aktivitas antioksidan angkak dengan ANOVA
Lampiran 12 Hasil uji LSD aktivitas antioksidan angkak Tests of Between-Subjects Effects Dependent Variable: aktivitas antioksidan angkak
Source Type III Sum of
Squares
df Mean Square F Sig.
PerlakuanPelarut 54770,860 4 13692,715 62,440 ,000
Error 2192,942 10 219,294
Total 178316,246 15
Corrected Total 56963,802 14
a. R Squared = ,962 (Adjusted R Squared = ,946)
H0: perlakuan tidak berpengaruh terhadap aktivitas antioksidan H1: perlakuan berpengaruh terhadap aktivitas antioksidan
Karena sig kurang dari α 5% maka tolak H0 artinya perlakuan berpengaruh terhadap
aktovitas antioksidan pada selang kepercayaan 95%
Perlakuan
*perbedaan signifikan pada nilai 0.05 Keterangan perlakuan pelarut: