i
PROSIDING
SEMINAR NASIONAL AVoER 7 2015
Fakultas Teknik
Universitas Sriwijaya
Hak Cipta 2015
PROSIDING
SEMINAR
NASIONAL
AVoER
VII
2015
Fakultas Teknik
Universitas Sriwijaya
Hak Terbit Pada Unsri Press
Jalan Srijaya Negara Bukit Besar Palembang 30139
Telpon 0711- 360969 Fax. 0711- 360969
Email :
unsri.press@yahoo.com
Palembang : Unsri Press 2015
Setting & Lay Out Isi : A. Febri Eka Putra, A.Md
Cetakan Pertama, Oktober 2015
xv +35 halaman :21 x 16 cm
Hak cipta dilindungi undang-undang
. Dilarang memperbanyak sebagian
atau seluruh isi buku ini dalam bentuk apapun, baik secara elektronik
maupun mekanik, termasuk memfotokopi, merekam, atau dengan
menggunakan sistem penyimpanan lainnya, tanpa izin tertulis dari Penerbit
Hak Terbit Pada Unsri Press
iii
Seminar Nasional Added Value Of Energy Resources
(AVOER) VII
Gedung Magister Manajemen Universitas Sriwijaya
Jln. Srijaya Negara Bukit Besar Palembang
Untuk pertanyaan berkaitan AvoER VII 2015
Silahkan menghubungi
Telp. 0711 370178
Fax. 0711 352870
Sekretariat :
Grha PTBA Fakultas Teknik Unsri Kampus Palembang
Contact Person :
Restu Juniah
0821-7955-5571
Harry Waristian
0821-8396-8393
Email :
avoer2015@unsri.ac.id
REVIEWER
1.
Prof. Dr. Ir. Subriyer Nasir, M.S. (Ketua)
2.
Prof. Dr. Ir. Eddy Ibrahim, M.S (Waka)
3.
Dr. Ir. Dinar Putranto
4.
Prof. Dr. Ir. Edy Sutriyono, M.Sc.
5.
Prof. Dr. Ir. Hj. Erika Bochori, M.S.
6.
Prof. Dr. Ir. Riman Sipahutar, M.Sc.
7.
Dr. Ir. Hj.Susila Arita
8.
Dr. Ir. Nukman, M.T.
9.
Dr. Hj. Tuti Emilia, M.T.
10. Dr. Ir. Endang Wiwik DH. M.Sc.
11. Dr. Yohannes Adiyanto, M.S.
12. Dr. Faisal, DEA
13. Dr. Ir. H. Marwan Asof, DEA.
14. Dr .Ir. Ari Siswanto
v
Published by :
Faculty of Engineering, University of Sriwijaya
Jl. Srijaya Negara Kampus Unsri Bukit Besar Palembang
Sumatera Selatan
Indonesia
Copyright reserved
PRAKATA
Puji dan syukur dipanjatkan kepada Tuhan Yang Maha Esa atas rahmat-Nya
sehingga Seminar Nasional AVOER VII 2015 ini dapat diselenggarakan sesuai jadwal.
Fakultas teknik Universitas Sriwijaya memiliki perhatian khusus berkaitan dengan
permasalahan energi. Sebagai bentuk implementasi atas kepedulian tersebut maka
dilaksanakan Seminar Nasional Added Value of Energy Resources. Dengan pelaksanaan
seminar ini diharapkan dapat menjadi wadah komunikasi dari berbagai segmen yang
memiliki sudut pandang serta kepentingan yang berbeda terhadap masalah energi.
Inovasi teknologi energi dalam rangka meningkatkan ketahanan energi nasional
dan lingkungan berkelanjutan dipilih menjadi tema AvoER kali ini karena relevan dengan
berbagai permasalahan energi saat ini dan yang mungkin muncul dimasa depan
memerlukan solusi yang tepat dengan pendekatan yang komprehensif.
Pada kesempatan ini kami menyampaikan ucapan terima kasih kepada narasumber :
1.
Prof. Dr. Ir. San Afri Awang, M.Sc
2.Ir. Maritje Hutapea
3.
Ir. Bambang Gatot A, MM
4.Ir. Muhammad Rudy
5.Ir. Iskandar Surya Alam
6.Ir. Edwin A. Mba dan MM
yang telah berkenan hadir meluangkan waktu menjadi narasumber pada acara seminar
yang dilaksanakan pada 20-21 Oktober 2015. Selanjutnya kami mengucapkan terima kasih
kepada para sponsor dan fakultas teknik UNSRI.
vii
PANITIA PELAKSANA
SEMINAR NASIONAL AVOER VII 2015
Pengarah
:
Prof. Dr. Ir. H.M. Taufik Toha, DEA (Dekan Fakultas Teknik)
Dr. Ir. Hj. Sri Haryati, DEA
(Pembantu Dekan I Fakultas Teknik)
Dr. Ir. Amrifan S. Mohruni, Dipl.-Ing.
(Pembantu Dekan II Fakultas Teknik)
Ir. Hairul Alwani, M.T.
(Pembantu Dekan III Fakultas Teknik)
Penanggung Jawab : Prof.Dr.Ir.Riman Sipahutar, M.Sc., PhD (Ketua UPPM FT.Unsri)
Ketua
: Dr.Ir.Restu Juniah, MT.
Sekretaris I
: Bochori, ST ,MT.
Sekretaris II
: Harry Waristian, ST, MT.
Bendahara
: Ir.Hj.Marwani, MT
Wk Bendahara : Umiyati
I. Seksi Makalah/Publikasi :
Prof. Dr. Ir. Subriyer Nasir, M.S.
Prof. Dr. Ir. Eddy Ibrahim, M.S
Prof. Dr. Ir. Edy Sutriyono, M.Sc.
Prof. Dr. Ir. Hj. Erika Bochori, M.S.
Prof. Dr. Ir. Riman Sipahutar, M.Sc.
Dr. Ir. Dinar Putranto, MSCE
Ir. Hj.Susila Arita, DEA, PhD.
Dr. Ir. Nukman, M.T.
Hj. Tuti Emilia, ST, MT, PhD.
Dr. Ir. Endang Wiwik DH. M.Sc.
Dr. Johannes Adiyanto, ST, MT.
Dr. Ir. M.Faisal, DEA
Dr. Ir. H. Marwan Asof, DEA.
Dr .Ir. Arie Siswanto, MSCE
Heni Fitriani, ST, MT, PhD.
II. Seksi Web
:
Irsyadi Yani S.T., M.Eng., Ph.D (Ketua)
Ayatullah Khomeini, S.T. (Waka)
Hj. Rr. Harminuke EH, S.T., M.T
M. Yanis, S.T., M.T.
III. Seksi Acara dan Dokumentasi
: Prof. Dr. Ir. Kaprawi, DEA (Ketua)
Dr. Leli Komariah (Waka)
Ir. Farida Ali, DEA
Dr. Budhi Kuswan Susilo, S.T., M.T
Ir. Hj. Tri Kurnia Dewi, M.Sc, PhD.
Ir. Irwin Bizzy, M.T.
Ir. Fusito HY, M.T.
Dr. Novia, M.T.
Dr. Dewi Puspita Sari, S.T., MT.
Qomarul Hadi, S.T, M.T.
Dr. Ir. Hj. Reini Silvia I, MT
Ir. Sariman, M.S
Ir. Dyos Santoso, M.T
Ir. Sri Agustina, MT.
Budi Santoso, S.T.,M.T
Ratna Dewi, S.T., M.T
Iwan Muwarman,ST, MT
Wenny Herlina, S.T., M.T.
M. Baitullah Al-Amin, S.T., M.Eng.
Bimo Brata Adhitya S.T.,M.T.
Alek Alhadi, S.T.
IV.
Seksi Dana
:
Prof. Ir. H. Zainuddin Nawawi, Ph.D (Ketua)
Dr. Ir. Diah Kusuma Pratiwi,M.T. (Waka)
Dr. Ir. H. Syamsul Komar.
Ir. Hj. Ika Juliantina, M.S.
Ir. Rudiyanto Thayib, M.Sc.
Dr. Ir. H. Joni Arliansyah, M.Eng
Dr. Agung Mataram, S.T., M.T.
Ir. Mukiat, M.S
Ir. Joni Yanto, M.T
Ellyani, S.T., M.T.
Waluyo, S.T.
Heriyanto, S.E.
V. Seksi Sekretariat
:
Ir. Maulana Yusuf, MS, MT.
Ir. Taufik Arief, M.T.
Caroline, S.T.,M.T.
Barlin, S.T. M.T
Marzuki, S.E.
Maidawati, SE, M.Si
Irhas Bambang
Ibrahim
Parnoto
ix
Danar Hadi
Ahmad Husni
Eva Oktarina Sari, S.T.
Sepriadi, S.T.
Ridwan
VI. Seksi Pameran
: Wenty Truly, S.T., M.T
Adam Fitria Wijaya, S.T., M.T.
Rr. Yunita Bayuningsih, S.T.,M.T.
Puji Astuti, SE, M.Si
Dessa Andriyali, S.T.,M.T.
Hendi Warlika, S.T.,M.T
Ganis Mahesa
Muhammad Ichsan
VII. Seksi Transportasi, Publikasi
: Ir. A. Rahman (Ketua)
dan Dokumentasi
Rosihan Pebrianto, S.T., M.T. (Waka)
Aneka Firdaus, S.T., M.T.
Hasan Basri, SE
M. Jamil
Maryono
David Tahharry
Syahrial Indrajaya
Bastari Subroto
Muhiban
Budiono
Sutrisno
M. Hanafi, ST
Agus Gatot H
A. Rivai
Vety, S.T
Erik Wijaya, S.T.
VIII.
Seksi Perlengkapan dan Tata Tempat
: Ir. Firmansyah Burlian, M.T.
Ir. Sarino, M.T.
Ir. Helmy Alian, M.T.
Subiyanto, SE, M.Si
Trimono
IX.
Seksi Pembantu Umum
: Ir. Ubaidillah Anwar, M.S. (Ketua)
Ir. Muhammad Amin, M.S. (Waka)
Hj. Ike Bayusari, S.T., M.T.
Rahmatullah, S.T., M.T.
Gustini, S.T.,M.T.
Muhammad Nafiz
BEM FT UNSRI
PERMATA Unsri
X.
Seksi Konsumsi
: Ir. Hj. Hartini Iskandar, M.Si. (Ketua)
Ir. Siti Miskah, ST, MT (Waka)
Ir. Familia Coniwati, MT
Ir. Hj. Rosdiana Moeksin, MT
Diana Purbasari, S.T., M.T.
Osni Susanti, S.T.
Astuti, ST, MT.
Yunisa Risma, A.Md
Hamidah
xi
UCAPAN TERIMA KASIH
Panitia AvoER VII 2015 menyampaikan terima kasih dan penghargaan sebesar-besarnya
kepada sponsor, keynote speaker dan semua pihak yang membantu terselenggaranya
kegiatan ini
SPONSOR
PT. Pertamina Geothermal Energy
PT. Kaltim Prima Coal
PT. Adaro Energy, Tbk
PT. Adaro Envirocoal
PTBA Unit Tarahan
PT. Pertamina EP Aset 2
PT. Baturona Adimulya
PT. Timah, Tbk
SKK Migas
PT. Semen Baturaja, Tbk
Narasumber
Prof. Dr. Ir. San Afri Awang, M.Sc
Ir. Maritje Hutapea
216
PENGOLAHAN AIR ASAM TAMBANG
DENGAN MENGGUNAKAN REAGEN FENTON DAN ADSORPSI KARBON AKTIF
T. E. Agustina1*, M. F. Hendrawan, dan A. Ambari 1
Teknik Kimia, Universitas Sriwijaya, Palembang
Jl. Raya Palembang-Prabumulih Km 32 Indralaya, Ogan Ilir, 30662 Corresponding author: tutycurtin@yahoo.com
ABSTRAK : Air asam tambang adalah air yang didapatkan dari proses penambangan. Air asam tambang dapat terbentuk pada saat mineral sulphida yang terdapat pada batuan terpapar dengan kondisi adanya air dan oksigen yang akan menyebabkan terjadinya proses oksidasi dan dapat menghasilkan air dengan kondisi asam. Air asam tambang ini menimbulkan masalah karena adanya kandungan logam berat dan pH-nya yang rendah. Umumnya air asam tambang diatasi dengan menggunakan kapur tohor untuk menaikkan pH, akan tetapi jumlah kapur yang diperlukan sangat banyak sehingga tidak ekonomis. Tujuan penelitian ini untuk mengolah air asam tambang dengan menggunakan kombinasi reagen Fenton dan adsorpsi karbon aktif. Pada penelitian ini dipelajari pengaruh perbandingan konsentrasi molar reagen Fenton dan waktu adsorpsi terhadap pH, kadar logam besi (Fe), dan kadar logam mangan (Mn). Dari hasil penelitian ini didapatkan bahwa penggunaan reagen Fenton dan adsorpsi karbon aktif dapat menurunkan kadar logam besi, kadar logam mangan, dan menaikkan nilai pH. Dengan menggunakan rasio molar Reagen Fenton sebesar 1:60 dan adsorpsi karbon aktif selama 2 jam diperoleh kandungan logam besi sebesar 0,49 mg/l, kandungan logam mangan sebesar 0,42 mg/l, dan nilai pH 6,8 yang telah memenuhi baku mutu lingkungan.
Kata kunci : air asam tambang, reagen Fenton, adsorpsi, karbon aktif
ACID MINE DRAINAGE TREATMENT
BY USING FENTON REAGENT AND ACTIVATED CARBON ADSORPTION
ABSTRACT :Acid mine drainage is the water that obtained from mining process. The acid mine drainage can be formed when sulphides mineral contained in rock exposed to the condition in the presence of water and oxygen that would cause the oxidation process and can produce acidic water. The acid mine drainage is problematic because the heavy metals content and its low pH. Generally, acid mine drainage overcome by using quicklime to raise the pH, but the amount of lime required were so much so that it is not economical. The research objective is to treat the acid mine drainage by using a combination of Fenton reagent and activated carbon adsorption. In this research, the effect of molar ratio of Fenton reagent and adsorption time on pH, concentration of iron (Fe), and concentration of manganese (Mn) were studied. From the results of this study, it was found that the use of reagents Fenton and activated carbon adsorption can reduce the concentration of iron and manganese metal, and increase the pH value. By using Fenton reagent molar ratio of 1:60 and activated carbon adsorption for 2 hours, the ferrous metal concentration of 0.49 mg/l, manganese metal concentration of 0.42 mg/l, and the pH value of 6.8 were obtained which has met the environmental quality standard
Keywords:acid main drainage, fenton Reagent, adsorption, activated carbon
PENDAHULUAN
Air asam tambang, meskipun secara alami terjadi sebagai bagian dari proses pelapukan batuan, hal ini juga diperburuk oleh gangguan besar dari operasi penambangan logam dan batubara (Johnson & Hallberg, 2005). Air asam tambang dapat terbentuk pada saat mineral sulphida yang terdapat pada batuan terpapar dengan kondisi adanya air dan oksigen yang akan menyebabkan terjadinya proses oksidasi dan dapat menghasilkan air dengan kondisi asam (Nugraha, 2010). Air asam tambang merupakan air tambang yang banyak
2 4
dan tambang dalam, tetapi kebanyakan keadaan ini terjadi disebabkan unsur sulfur yang terdapat di dalam batuan teroksidasi secara alami selain itu didukung juga oleh curah hujan yang sangat tinggi yang dapat mempercepat perubahan oksida sulfur menjadi asam. Sumber-sumber air asam tambang banyak berasal dari kegiatan tambang terbuka, pengolahan batuan buangan, lokasi penimbunan batuan, dan unit pengolahan limbah tauling.
Bahan yang menjadi sumber potensial terbentuknya air asam tambang adalah mineral-mineral yang mengandung sulfida, terutama pirit (FeS2). Air asam tambang terbentuk karena teroksidasinya pirit dengan melibatkan oksigen dan air. Terbentuknya air asam tambang selalu ditandai dengan adanya karakteristik kualitas air sebagai berikut:
1. pH yang terlalu rendah yaitu 1-5,4.
2. Konsentrasi logam terlarut yang sangat tinggi seperti adanya logam besi, alumunium, mangan, cadmium, tembaga, timbal, seng, arsenik, dan merkuri.
3. Nilai sulfat yang sangat tinggi yaitu 500-10.000 mg/L.
Air asam tambang terbentuk karena memiliki suatu reaksi pembentukan ion H+ yang merupakan ion pembentuk oksidasi mineral sulfide dan dapat berekasi dengan air. Oksidasi mineral sulfida dapat dideskripsikan dengan persamaan (Perkins et al. 1995;
adanya baku mutu air sungai dan baku mutu air laut. 2. Dampak negatif untuk biota perairan
Akan terjadi perubahan keanekaragaman biota perairan seperti plankton dan benthos. Dengan adanya benthos di dalam suatu perairan bisa digunakan sebagai indikator kualitas perairan. Pada suatu perairan yang baik, benthos akan mengalami perkembangbiakan yang baik, namun sebaliknya pada perairan yang kurang subur benthos tidak dapat bertahan hidup sehingga akan cepat mati.
3. Kualitas air di permukaan
Terbentuknya air asam tambang hasil dari oksidasi pirit akan menyebabkan menurunnya kualitas air permukaan. Parameter yang biasa digunakan dalam menentukan kualitas air yang mengalami perubahan diantaranya adalah pH, padatan terlarut, padatan tersuspensi, nilai COD, logam besi, dan logam mangan. Pada tanaman unsur hara merupakan salah satu faktor yang menentukan pertumbuhan suatu tanaman. Namun jika unsur hara yang terdapat di dalam tanah dan air maka akan menyebabkan penghambatan pertumbuhan atau bahkan dapat menyebabkan kematian pada tumbuhan tersebut.
Tabel 1. Hasil AnalisaSampel Air Asam Tambang
Parameter Unit Hasil Analisa
pH 3,50
Morin and Hutt, 1997; Eng & Bussi, 2009) dengan Zat Padat Tersuspensi mg/liter 8,00 langkah pertama terjadinya oksidasi langsung dari pirit
(FeS2) oleh oksigen yang menghasilkan sulfat (SO 2-), 4 ferrous iron (Fe2+) dan keasaman (H+) :
Besi Total mg/liter 28,00 Mangan Total mg/liter 28,47
1. FeS2 + 7/2 O2 + H2O → Fe + + 4SO 2-+ 2 H+ Tabel 2. Baku Mutu Air Limbah KegiatanPenambangan 2. Fe2+ + ¼ O2 + H+→ Fe3+ + ½ H2O
3. Fe3+ + 3 H2O → Fe(OH)3 +3 H+ 2- Parameter Satuan Kadar Maksimum 4. FeS2+ 14 Fe3+ + 8 H2O→ 15 Fe2+ + 2 SO4 +
16 H+ pH 6-9
Dari persamaan diatas dapat terlihat bahwa ion-ion Zat Padat Tersuspensi mg/liter 400 H+ bisa dibebaskan dari oksidasi pirit (persamaan 1),
hidrolisis Fe3+ (persamaan 3) atau melalui reaksi Fe3+ dengan pirit (persamaan 4).
Terbentuknya air asam tambang dilokasi penambangan akan menimbulkan dampak negatif terhadap lingkungan. Adapun dampak negatif yaitu,
1. Masyarakat yang berada pada sekitar wilayah tambang
Dampak yang aka terjadi pada masyarakat disekitar wilayah tambang tidak dirasakan secara langsung dikarenakan air yang dipompakan ke sungai atau ke laut telah dinetralkan terlebih dahulu dan akan selalu dilakukan pemantauan dengan menggunakan peralatan
Besi Total mg/liter 7 Mangan Total mg/liter 4
Sumber: Keputusan Menteri Negara Lingkungan Hidup No 113 Tahun 2003
21
8
2 2 2 2 2Hidrogen peroksida merupakan oksidator kuat akan tetapi pada konsentrasi yang rendah, 0.1 % kinetika reaksinya akan berjalan sangat lambat untuk mendegradasi kontaminan sehingga perlu adanya penambahan Fe (II) untuk meningkatkan kekuatan oksidasi peroksida sehingga dihasilkan radikal baru. Reaksi oksidasi peroksida terkatalisis besi ini biasanya dijalankan pada pH 3-5, dan kombinasi reagen besi/peroksida disebut sebagai Fenton Reagent”. Reagen fenton adalah campuran antara hidrogen peroksida dan ion besi. Campuran diantara keduanya menghasilkan gugus radikal hidroksil mengikuti laju dari reaksi diantara keduanya (Ruppert, et.al, 1993).
Pereaksi Fenton ini terdiri dari oksidator hidrogen peroksida (H2O2) dan katalis ion Fe2+. Reaksi Fenton akan menghasilkan spesi radikal hidroksil (•OH) dan hidroperoksil (•OOH) yang akan memecah struktur dari senyawa fenolik menjadi asam-asam alifatik yang lebih ramah lingkungan dan mampu mendegradasi total senyawa fenolik menjadi CO2 dan H2O. Reaksi fenton banyak digunakan dalam kegiatan penanganan air limbah, tanah dan lumpur terkontaminasi dengan beberapa aplikasi seperti peningkatan biodegradasi, destruksi polutan organik, penghilangan warna dan bau, destruksi resin pada lumpur terkontaminasi radioaktif, penurunan sifat racun, dan penghilangan BOD/COD.Berikut ini adalah mekanisme reaksi reagen fenton yang di katalis oleh Fe2+ (Neyens and Baeyens, 2003) :
1. H2O2 + Fe2+ → •OH + OH - + Fe3+
Jika bereaksi dengan ion ferri maka akan menghasilkan persamaan berikut:
peroksida untuk memproduksi sejumlah senyawa radikal hidroksil yang nantinya akan dapat bereaksi sangat cepat dengan zat organik, karena kecepatan reaksi ion ferri dengan hidrogen peroksida lebih lambat dibandingkan dengan ion ferro, maka oksidasi zat organik merupakan tahapan yang kedua.
2. Tahap Fe3+ / H2O2
Tahap kedua ini lebih lambat dari pada tahap pertama, dalam literatur disebutkan bahwa ion ferri merupakan katalis dengan aktifitas yang lebih rendah daripada ferro. Secara umum, pengaruh dari kemampuan oksidasi reagen fenton dapat diklasifikasikan dalam beberapa parameter sebagai berikut :
a) Nilai pH
b) Konsentrasi zat organik c) Konsentrasi ferro
d) Konsentrasi hidrogen peroksida
Kondisi optimum reagen fenton yang telah diamati pada pH 3 sampai dengan pH 5. Pada pH yang lebih rendah, efektifitas untuk penghilangan kontaminan akan semakin menurun karena dekomposisi H2O2. Pada pH<3 konsentrasi ion H+ terlalu tinggi yang akan menyebabkan ion hidrogen sebagai aseptor utama radikal •OH (Barbusinki, 1999).
Nilai pH secara langsung dapat mempengaruhi reaksi dari ion ferro dan kecepatan reaksi dari ion ferro tersebut dengan hidrogen peroksida dalam membuat radikal hidroksil secara efektif. Ion ferro berperan penting dalam katalis hidrogen peroksida untuk memproduksi radikal hidroksil, jadi apabila kita menambahkan ion ferro maka secara langsung akan mempengaruhi kecepatan dekomposisi senyawa organik. Laju dekomposisi akan meningkat dengan meningkatnya 2. H2O2 + Fe3+ → Fe2+ + HO • + H+ jumlah ion ferro dan akan mencapai titik maksimum 3. H2O2 + Fe3+ → H+ + FeOOH2+
4. FeOOH2+ → HO2• + Fe2+
dimana dengan penambahan secara terus menerus tidak akan membuatnya effisien lagi. Terdapat tiga faktor yang 5. HO • + Fe2++ H+ → H2O2 + Fe3+ mempengruhi penambahan jumlah ferro (Walling, 1975) 6. HO • + Fe3+ → H++Fe2++O2 yaitu:
7. Fe2+ + O -•— Fe2++ O2 1. Jumlah konsentrasi minimal ferro yang di 8. Fe3+ + O - → Fe2+ +O2 perbolehkan sekitar 3-25 mg/L.
9. Fe3+ + HO2• → Fe3+ + HO2
-Konsumsi ion fero lebih cepat dibandingkan dengan produksinya, sehingga kecepatan reaksi persamaan 1 lebih lambat dari pada kecepatan reaksi pada persamaan 2. Radikal hidroksil yang bereaksi dengan ion fero akan menghasilkan ion ferri.
10. •OH + Fe2+ → OH- + Fe3+ 11. •OH + organik → produk
Proses fenton terbagi dalam dua tahap :
2. Perbandingan ferro dan substrat apabila diatas ambang minimal adalah 1 bagian ferro berbanding 10–50 bagian untuk substrat dalam memproduksi produk akhir.
3. Tambahan aliquot dari besi yang jenuh ke dalam air limbah, sehingga memungkinkan besi untuk mengkatalisis pembentukan radikal hidroksil.
Tabel 3.Pengaruh nilai pH terhadap reaksi fenton
<2,5
pH > 4 Pembentukan HO• berjalan lambat pH > 4,6 Reaksi Fe2+ → Fe3+ berlangsung cepat
tapi tidak mengoksidasi sasaran yang ditentukan
3 < pH <5 Laju dekomposisi yang lambat untuk H2O2
PH > 10 Dekomposisi diri sendiri dari hidrogen peroksida :
2H2O2 → 2H2O2 + O2 Sumber:Walling, C. 1975.
Dari hasil analisa air asam tambang pada Tabel 1, dapat dilihat bahwa nilai pH, kadar besi dan mangan total yang tidak memenuhi baku mutu air limbah kegiatan penambangan. Oleh sebab itu air asam tambang harus diolah dengan baik untuk meminimalkan dampak negatifnya terhadap lingkungan. Penelitian ini bertujuan untuk mengolah air asam tambang dengan menggunakan reagen Fenton yang dikombinasikan dengan adsorpsi menggunakan karbon aktif.
METODE PENELITIAN
Sampel air asam tambang diambil dari usaha penambangan yang berlokasi di Air Laya, Kabupaten Tanjung Enim.
Prosedur penelitian dimulai dengan memasukkan air asam tambang sebanyak 500 ml kedalam reaktor. Setelah itu tambahkan FeSO4.7H2O sebanyak 10 ml dengan konsentrasi 4 mM dan aduk menggunakan pengaduk mekanik dengan kecepatan 200 rpm pada suhu kamar. Selanjutnya tambahkan H2O2 sebanyak dengan konsentrasi 160 mM (rasio molar 1:40), kemudian sampel diaduk menggunakan pengaduk mekanik dengan pengambilan sampel pada 20, 40, 60, dan 80 menit. Selanjutnya pada proses adsorpsi, karbon aktif ditambahkan sebanyak 15 gram kedalam reaktor dan sampel diambil pada waktu 2, 3, 4, dan 5 jam. Setelah itu pisahkan sampel dari karbon aktif dan dianalisa. Ulangi untuk FeSO4.7H2O : H2O2 dengan rasio molar 1:60. Sampel awal air asam tambang (Tabel 1) dan sampel setelah pengolahan dengan reagen Fenton dan adsorpsi dianalisa pH, kandungan logam besi (Fe), dan kandungan logam mangan (Mn) di Laboratorium Dinas Pertambangan dan Energi Provinsi Sumatera Selatan.
HASIL DAN PEMBAHASAN
Gambar 1 dengan rasio molar 1:40 menunjukkan terjadi penurunan nilai kandungan logam besi (Fe) dari air asam tambang, setelah dilakukan pengolahan dengan reaksi reagen fenton. Namun nilai kandungan logam besi ini masih belum memenuhi nilai baku mutu lingkungan untuk limbah buangan air asam tambang merujuk pada Keputusan Menteri No. 113, yakni maksimal 7 mg/l.
Gambar 1. Pengaruh waktu terhadap kadar logam besi (Fe) denganmenggunakan reagen fenton padarasio molar 1:40
Gambar 2. Pengaruh waktu terhadap kadar logam besi (Fe) denganmenggunakan reagen fenton pada rasio molar 1:60
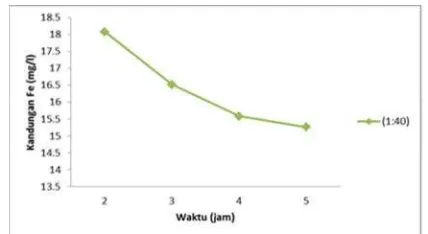
Gambar 3. Pengaruh waktu terhadap kadar logam besi (Fe) dengan menggunakan reagen fenton dan adsorpsi karbon aktif pada rasio molar 1:40
2
20
Gambar 4. Pengaruh waktu terhadap kadar logam besi (Fe) dengan menggunakan reagen fenton dan adsorpsi karbon aktif pada rasio molar 1:60Dari gambar 3 dan 4 pada rasio molar 1:40 dan 1:60 terlihat bahwa nilai kandungan logam besi (Fe) mengalami penurunan setelah dilakukan pengolahan menggunakan adsorpsi karbon aktif. Terlihat bahwa pada rasio molar 1:40 nilai kandungan logam besi belum memenuhi standar baku mutu Pengolahan dengan menggunakan adsorpsi pada perbandingan molar 1:40 menurunkan nilai kandungan logam besi (Fe) sampai dengan 15.26 mg/l. Sedangkan untuk rasio molar 1:60, kandungan besi sudah memenuhi nilai baku mutu. Adapun nilai yang didapatkan pada perbandingan molar ini menurunkan nilai kandungan logamnya sampai dengan 0.14 mg/l. Pada proses adsorpsi dengan karbon aktif sudah memenuhi nilai standar mutu untuk kandungan logam besi (Fe) yang terkandung dalam air hasil pengolahan kegiatan tambang. Hasil ini dicapai karena adanya penyerapan karbon aktif terhadap senyawa-senyawa yang berikatan dengan logam Fe yang terkandung didalam air asam tambang.
Gambar 5. Pengaruh waktu terhadap kadar logam mangan (Mn) dengan menggunakan reagen fenton pada rasio molar 1:40 dan 1:60
Dari Gambar 5 pada pengolahan dengan reagen Fenton dengan rasio molar 1:40 dan 1:60, dapat dilihat bahwa terjadi penurunan angka kandungan logam mangan (Mn) pada air asam tambang. Nilai dari kandungan logam mangan (Mn) ini masih belum memenuhi standar mutu yang ditetapkan oleh pemerintah untuk dibuang ke lingkungan adapun nilai maksimal standar mutu kandungan logam mangan (Mn) yaitu sebesar 4 mg/l.
Gambar 6.Pengaruh waktu terhadap kadar logam mangan (Mn) dengan menggunakan reagen fenton dan adsorpsi karbon aktif pada rasio molar 1:40
Dari gambar 6 terlihat bahwa nilai kandungan logam mangan (Mn) mengalami penurunan setelah dilakukan pengolahan dengan menggunakan adsorpsi karbon aktif. Terlihat bahwa nilai kandungan logam mangan (Mn) pada perbandingan molar 1:40 mengalami penurunan hingga 17.16 mg/l. Namun hasil yang didapatkan ini masih belum memenuhi baku mutu lingkungan.
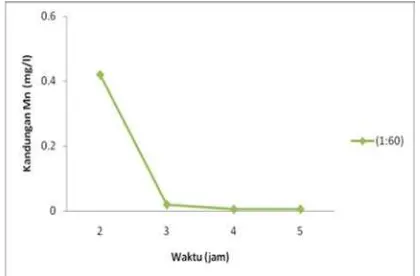
Gambar 7. Pengaruh waktu terhadap kadar logam mangan (Mn) dengan menggunakan reagen fenton dan adsorpsi karbon aktif pada rasio molar 1:60
Gambar 8. Pengaruh waktu terhadap nilai pH dengan menggunakan reagen fenton pada rasio molar 1:40 dan 1:60
Dari Gambar 8 terlihat pengolahan air asam tambang menggunakan reagen fenton pada perbandingan rasio molar 1:40 maupun 1:60 terjadi penurunan nilai pH. Penurunan nilai pH ini disebabkan karena adanya penambahan larutan H2O2 sebagai reaktan utama pada proses yang menyebabkan adanya penambahan ion H+ sehingga air asam tambang mengalami penurunan dari kondisi awal.
Gambar 9. Pengaruh waktu terhadap nilai pH dengan menggunakan reagen fenton dan adsorpsi karbon aktif pada rasio molar 1:40
Gambar 10. Pengaruh waktu proses terhadap nilai pH dengan menggunakan reagen fenton dan adsorpsi karbon aktif pada rasio molar 1:60
Dari gambar 9 dan 10 dapat dilihat derajat keasaman pada air asam tambang dengan pengolahan menggunakan adsorpsi karbon aktif terjadi perubahan.
1:60. Terlihat bahwa nilai pH menggunakan adsorpsi karbon aktif ini sudah memenuhi standar mutu untuk nilai pH, yaitu 6-9.
KESIMPULAN
Pengolahan air asam tambang dengan menggunakan reagen fenton dan adsorpsi karbon aktif telah mampu menurunkan nilai kandungan logam besi (Fe) dan mangan (Mn) sebesar 98% dengan perbandingan rasio reagen fenton 1:60. Dicapai kandungan logam besi 0,49 mg/l sedangkan kandungan logam mangan 0,42 mg/l yang sudah memenuhi standar baku mutu lingkungan. Pengolahan dengan metode ini mampu menaikan nilai pH sampai dengan 6.8 dalam waktu 2 jam.
DAFTAR PUSTAKA
Barbusinki, K., Koscielniak. 1999. Aerobic Sludge Digestion In the Presence of Chemical Oxidation Agents. Part I: Hidrogen Peroxide, Institute a Water and Waste Water Engineering, Silesion Technical University: Poland
Direktorat Jenderal Mineral dan Batubara. 2013. Kumpulan Pedoman Teknis Lingkungan Pertambangan. Kementerian Energi dan Sumberdaya Mineral.
Eng, G., & Bussi, B. (2009). Acid Mine Drainage From Abandoned Mine Sites : Problematic and reclamation approaches, Proceeding of International Symposium on Geoenvironmental Engineering, Hangzhou. China Johnson, D. B., & Hallberg, K. B. (2005). Acid mine
drainage remediation options: A review. Science of the Total Environment, 338(1-2 SPEC. ISS.), 3–14. http://doi.org/10.1016/j.scitotenv.2004.09.002 Nugraha, C. (2010). Air Asam Tambang. Retrieved from
http://airasamtambang.info/apaituaat/
Keputusan Menteri Negara Lingkungan Hidup No 113 Tahun 2003 tentang Baku Mutu Air Limbah Bagi Usaha Dan/Atau Kegiatan Pertambangan Batu Bara. Jakarta: kepmenlh
Morin, K. A. and Hutt, N.M. 1997. Environmental Geochemistry of Minesite Drainage. Practical Theory and Case Studies. MDAG Publishing.
Neyens, E.E., Baeyens, J.J., 2003. A review of classic Fenton’s peroxidation as an advanced oxidation technique. Journal of Hazardous Materials, 98 (1-3): 33.
2
22
Ottawa, Ont.Ruppert, G., Bauer, R., Venkatdri, and Peters. 1993. Mineralization of cyclic organic water contaminants by the photo-fenton reaction: Influence of structure and substituents. Chemosphere, 27, 1339-1347. Walling, C. 1975. Fenton reagent: V. Hydroxylation and