UIN SYARIF HIDAYATULLAH JAKARTA
SKRINING, ISOLASI, DAN UJI AKTIVITAS
ANTIBAKTERI METABOLIT BIOAKTIF JAMUR
ENDOFIT DARI TUMBUHAN GINSENG KUNING
(Rennellia elliptica Korth.)
SKRIPSI
AINUL MARDIAH
NIM. 109102000046
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
SKRINING, ISOLASI, DAN UJI AKTIVITAS
ANTIBAKTERI METABOLIT BIOAKTIF JAMUR
ENDOFIT DARI TUMBUHAN GINSENG KUNING
(Rennellia elliptica Korth.)
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
AINUL MARDIAH
NIM. 109102000046
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
Skripsi ini adalah hasil karya sendiri,
dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar.
Nama : Ainul Mardiah
NIM : 109102000046
Tanda Tangan :
Skrining, Isolasi dan Uji Aktivitas Antibakteri Metabolit Bioaktif Jamur Endofit dari Tumbuhan Ginseng Kuning (Rennellia elliptica Korth.)
Nama : Ainul Mardiah NIM : 109102000046 Program Studi : Farmasi Judul Skripsi :
Menyetujui,
Pembimbing I
Dr. Andria Agusta NIP. 1969081661994031003
Pembimbing II
Prof. Dr. Atiek Soemiati, M.Si., Apt.
Mengetahui,
Kepala Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
UIN Syarif Hidayatullah Jakarta
Skrining, Isolasi, dan Uji Aktivitas Antibakteri Metabolit Bioaktif Jamur Endofit dari Tumbuhan Ginseng Kuning (Rennellia elliptica Korth.)
Nama : Ainul Mardiah
NIM : 109102000046
Program Studi : Farmasi Judul Skripsi :
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
DEWAN PENGUJI
Pembimbing 1 : Dr. Andria Agusta ( )
Pembimbing 2 : Prof. Dr. Atiek Soemiati, M.Si., Apt. ( )
Penguji 1 : Lina Elfita, M.Si., Apt ( )
Penguji 2 : Eka Putri, M.Si., Apt. ( )
Ditetapkan di : Jakarta
Skrining, Isolasi, dan Uji Aktivitas Antibakteri Metabolit Bioaktif Jamur Endofit dari Tumbuhan Ginseng Kuning (Rennellia elliptica Korth.)
Nama : Ainul Mardiah Jurusan : Farmasi Judul :
Sebanyak dua puluh tiga isolat jamur endofit dari tumbuhan bagian akar, biji, daun dan batang tumbuhan Ginseng Kuning (Rennellia elliptica Korth) telah dikultivasi pada medium Potato Dextrose Broth/ PDB selama tiga minggu pada suhu ruang dan kondisi statis. Jamur endofit GKBt 2 yang diisolasi dari bagian batang menunjukkan aktivitas antibakteri paling besar terhadap bakteri uji Staphylococcus aureus dan Escherichia coli pada uji menggunakan metode bioautografi. Scaling Up kultivasi jamur GKBt 2 selama 3 minggu menghasilkan sebanyak 830 mg ekstrak etil asetat media PDB. Fraksinasi dan pemurnian fraksi aktif yang dilakukan dengan menggunakan kromatografi kolom dan Kromatografi Lapis Tipis Preparatif menghasilkan fraksi F.5.8a dan F.5.8b masing- masing memiliki bobot 4,5 mg dan 5 mg. Hasil uji Konsentrasi Hambat Minimum (KHM) menunjukkan bahwa F.5.8a dan F.5.8b aktif melawan bakteri S. aureus masing sebesar 256 µg/mL sedangkan nilai KHM terhadap bakteri E. coli masing-masing sebesar 128 µg/mL.
Screening, Isolation, and Antibacterial Activity of Bioactive Metabolite From Endophytic Fungi Associated with Ginseng Kuning (Rennellia elliptica Korth.)
Name : Ainul Mardiah Program study : Pharmacy Title :
Twenty-three isolates of endophytic fungi from root, seed, leaf and stem of Ginseng Kuning (Rennellia elliptica Korth) was cultivated in Potato Dextrose Broth for three weeks in room temperatur and static condition. GKBt 2, the endophytic fungus was isolated from the stem showed the most active of antibacterial activity against Staphylococcus aureus and Escherichia coli by using bioautography method. Scaling up cultivation of GKBt 2 in 5 L PDB yielded 830 mg ethyl acetat exctract of media. Fractionation and purification of bioactive compound which was performed by using column chromatography and preparative thin layer chromatography produced two fractions, they are F.58a (4,5 mg) and F.58b (5 mg). Fractions F.5.8.a and F.5.8b showed antibacterial activities against S. aureus with Minimum Inhibitory Concentration (MIC) value is 256 µg/ml respectively whereas the MIC value of the fractions against E. coli is 128 µg/ml.
Bismillahirrahmanirrahiim.
Alhamdulillah, puji syukur kehadirat Allah SWT atas segala rahmat dan anugerah-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi ini. Shalawat beriring salam atas junjungan besar Nabi Muhammad SAW yang telah memberikan petunjuk kebenaran sebagai rahmat sekalian alam
Skripsi dengan judul “Skrining, Isolasi, dan Uji Aktivitas
Antibakteri Metabolit Bioaktif Jamur Endofit dari Tumbuhan Ginseng Kuning (Rennellia elliptica Korth)” ini disusun untuk memenuhi salah satu syarat memperoleh gelar sarjana farmasi di Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Penulis menyadari bahwa tanpa adanya bantuan dan bimbingan dari banyak pihak, penelitian dan penyelesaian skripsi ini akan dirasakan sulit. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Bapak Dr. Andria Agusta selaku pembimbing pertama dan Ibu Prof. Dr. Atiek Soemiati, M.Si, Apt selaku pembimbing kedua yang senantiasa memberikan arahan, dukungan, semangat, saran dan solusi selama melaksanakan penelitian dan penyelesaian skripsi ini. Semoga Allah membalas jasa Bapak dan Ibu dengan sebaik-baiknya balasan.
2. Kementrian Agama RI selaku pemberi beasiswa, sehingga penulis dapat menempuh pendidikan di Program Studi Farmasi Fakultas kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Prof. Dr. (hc) dr. M.K. Tadjudin, Sp. And. selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
6. Ibu Dr. Praptiwi, Ibu Yuliasri Jamal, M.Sc., Mas Toni, Teh Dewi, Pak Asep, Pak Lukman beserta staf lain dari Lab Biosains Bidang Botani Puslit LIPI Cibinong yang telah banyak membantu selama penelitian 7. Ayahanda Abdul Jalil AR dan Ibunda Rohani, yang tiada jemu
memberikan doa, dukungan, dan nasihat. Keluarga besar Kak Nia, Kak Eli, Kak Indah, Bang Di, Bang Wan, Bang Rus dan Bang Yon yang selalu memberikan motivasi dan kebahagiaan dalam kehidupan ini. 8. Nurul Robiatul Adawiyah, sahabat, kakak, dan teman berbagi duka dan
suka yang selalu memberikan keceriaan.
9. Rekan-rekan CSS MoRA 2009 (Community Santri Scholar of Ministry of Religious Affair), teman-teman Farmasi 2009, teman-teman IMAPA, terkhusus untuk sahabat-sahabat terbaik Dian, Mayra, Tika, Rya, Kak ya, Kak Ki, Amah, Elia, Susi, Fina, Leli, Nuyung, Feri, Zaki, Ema, Neneng, Yunita, Dyah, Cucut yang selalu menyemangatiku ketika lelah dan menjadi motivator bagiku.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan skripsi ini. Oleh karena itu, penulis sangat berterimakasih terhadap adanya kritik dan saran yang membangun sehingga skripsi ini bisa menjadi lebih baik lagi.
Saya berharap semoga skripsi ini bermanfaat dan dapat menjadi sumbangan pengetahuan di Program Studi Farmasi Fakultas Kedokteran dan Ilmu kesehatan khususnya, Universitas Islam Negeri Syarif Hidayatullah Jakarta dan pembaca pada umumnya.
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Ainul Mardiah
NIM : 109102000046
Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan Jenis Karya : Skripsi
demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul :
SKRINING, ISOLASI, DAN UJI AKTIVITAS ANTIBAKTERI METABOLIT BIOAKTIF JAMUR ENDOFIT DARI TUMBUHAN
GINSENG KUNING (Rennellia elliptica Korth.)
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta. Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Jakarta
Pada tanggal : 2 Oktober 2013
Yang menyatakan,
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI ... x
DAFTAR ISI ... xi
2.2Tumbuhan Ginseng Kuning (Rennellia elliptica Korth.) ... 7
2.3Antimikroba ... 9
2.4Uji Aktivitas Antimikroba ... 10
3.3Tahapan Penelitian ... 26
3.4Prosedur Kerja 3.4.1 Skrining Produksi Metabolit Sekunder ... 26
3.4.2 Uji Aktivitas Antibakteri ... 27
3.4.3 Scaling Up Kultivasi Jamur GKBt 2 ... 29
3.4.4 Ekstraksi Kultur Jamur hasil Scaling Up ... 30
3.4.5 Fraksinasi Metabolit Ekstrak Etil Asetat GKBt 2 ... 31
3.4.6 Uji Aktivitas Antibakteri Hasil Purifikasi ... 32
3.4.7 Pengamatan Morfologi Jamur Endofit GKBt 2 ... 35
BAB 4 HASIL DAN PEMBAHASAN ... 36
4.1Skrining Bioproduksi Metabolit Sekunder ... 36
4.2Uji Aktivitas Antibakteri ... 38
4.3Scaling Up Kultivasi Jamur Endofit GKBt 2 ... 42
4.4Ekstraksi Kultur Jamur Endofit Hasil Scalling Up ... 43
4.5Fraksinasi Metabolit Ekstrak Etil Asetat GKBt 2 ... 45
4.6Uji Aktivitas Antibakteri Hasil Purifikasi ... 48
4.7Pengamatan Morfologi Jamur Endofit GKBt 2... 50
BAB 5 KESIMPULAN DAN SARAN ... 53
5.1Kesimpulan ... 53
5.2Saran ... 53
DAFTAR GAMBAR
Gambar 2.1. Tumbuhan Ginseng Kuning (Rennellia elliptica Korth) ... 7
Gambar 2.2. Klasifikasi metode uji antimikroba ... 12
Gambar 4.1. Hasil skrining bioproduksi metabolit sekunder ekstrak ... 37
Gambar 4.2. Hasil skrining antibakteri ekstrak etil asetat ... 39
Gambar 4.3. Hasil bioautografi antibakteri elusi ekstrak etil asetat GKBt 2 ... 42
Gambar 4.4. Hasil KLT ektstrak GKBt 2 hasil Scaling Up ... 44
Gambar 4.5. Hasil fraksinasi fraksi F.5... 46
Gambar 4.6. Noda bercak pada preparatif setelah dielusi ... 46
Gambar 4.7. Hasil KLT preparatif fraksi murni ... 47
Gambar 4.8. Hasil KLT 2 dimensi fraksi murni ... 48
DAFTAR TABEL
Tabel 2.1. Rangkuman jenis kromatografi ... 16
Tabel 2.2. Ciri bakteri gram positif dan gram negatif ... 21
Tabel 3.1. Data 23 isolat jamur endofit tumbuhan Ginseng Kuning ... 25
Tabel 4.1. Bobot 23 ekstrak etil asetat isolat jamur endofit ...36
Tabel 4.2. Diameter zona hambat hasil uji aktivitas antibakteri ...40
DAFTAR LAMPIRAN
Lampiran 1. Alur Penelitian ... 58
Lampiran 2. Bagan Kerja Uji Aktivitas Antibakteri ... 59
Lampiran 3. Bagan kerja Scaling up dan ektraksi hasil scalling up ... 60
Lampiran 4. Bagan kerja fraksinasi ...61
Lampiran 5. Perhitungan koloni bakteri uji ... 62
Lampiran 6. Skema pengenceran larutan uji ...63
Lampiran 7. Hasil Uji MIC ...64
Lampiran 8. Hasil pewarnaan gram bakteri uji ...65
Lampiran 9. Komposisi Media ...66
1.1 Latar Belakang
Semakin meningkatnya laju pertumbuhan masyarakat, kebutuhan akan senyawa baru yang berguna untuk memperbaiki dan mengobati kondisi masyarakat dalam aspek kesehatan semakin meningkat (Strobel & Daisy, 2003). Kondisi masyarakat yang dimaksud adalah semakin meningkatnya kasus infeksi terhadap penyakit yang disebabkan oleh virus, jamur, dan juga bakteri.
Kasus infeksi merupakan salah satu masalah kesehatan terbesar yang tidak saja terjadi di Indonesia, tapi juga di seluruh dunia (Mardiastuti, et al., 2007). Untuk itu, salah satu penatalaksanaan bagi penderita penyakit infeksi adalah melalui pengobatan menggunakan antibiotik. Namun seiring dengan meluasnya penggunaan antibiotik, timbul masalah baru yaitu meningkatnya resistensi bakteri terhadap obat antibakteri (Mardiastuti, et al., 2007).
Resistensi bakteri terhadap obat antibakteri merupakan masalah yang serius di bidang kesehatan dan telah menjadi perhatian masyarakat global. Sehingga pencarian obat antibakteri baru, menjadi penting dan semakin berkelanjutan (Liang, et al., 2012). Berbagai penelitian telah dilakukan untuk mengisolasi metabolit yang aktif sebagai antibakteri, termasuk yang bersumber dari mikroba endofit.
Mikroba endofit merupakan mikroorganisme yang berada dalam jaringan tanaman hidup dan merupakan produk alam baru yang potensial untuk dieksploitasi di bidang kedokteran, pertanian, dan industri (Strobel & Daisy, 2003). Mikroba endofit menyediakan cadangan yang
melimpah terhadap metabolit bioaktif untuk eksploitasi obat (Liang, et al., 2012).
terbatas pada fitopatogen, tetapi juga terhadap bakteri, fungi, virus, dan protozoa yang menyerang hewan atau tumbuhan (Strobel & Daisy, 2003). Pada kebanyakan kasus, hubungan endofit dengan tanaman inang adalah simbiosis dan mungkin mutualistik. Banyak yang mampu mensintesis senyawa bioaktif yang dapat digunakan oleh tanaman untuk pertahanan terhadap jamur dan bakteri (Nithya & Muthumary, 2011).
Sejak berhasil ditemukannya senyawa "emas" paclitaxel dari jamur endofit Taxomyces andreanae pada tahun 1993, banyak ilmuwan yang semakin berminat untuk mempelajari jamur endofit sebagai produsen yang potensial untuk menghasilkan senyawa bioaktif baru. Selama dua dekade terakhir, banyak senyawa bioaktif yang bernilai dengan berbagai aktivitas ditemukan, seperti sebagai antimikroba, insektisida, sitotoksik, dan anti
kanker yang telah berhasil ditemukan pada jamur endofit (Zhang, et al., 2006 dalam Zhao, et al., 2010).
Salah satu kekayaan alam di Indonesia adalah Ginseng Kuning atau Rennellia elliptica. Rennellia merupakan genus asli Asia Tenggara yang pertama kali ditemukan oleh Korthals pada tahun 1851. Tercatat ada dua spesies Rennellia dari Sumatra, yaitu R. elliptica Korth. dan R. ovalis Korth. Hingga sekarang, variasi dan distribusi dari spesies Rennellia di Indonesia belum lengkap diketahui (Suratman, 2008).
Hasil dekok dari akar R.elliptica digunakan oleh masyarakat lokal untuk bermacam kegunaan, termasuk sebagai aprodisiak, nyeri badan dan kejang setelah melahirkan. Sebuah studi awal oleh Yusoff, et al., (2010) melaporkan bahwa terdapatnya antrakuinon pada akar tumbuhan R.elliptica (Osman, et al., 2010). Pada tahun 2010, Osman melaporkan bahwa adanya aktivitas antiplasmodik pada ekstrak diklorometan dari akar R.elliptica yang ditunjukkan dengan kemampuannya menghambat Plasmodium falciparum (Osman, et al., 2010) serta telah diketahui adanya aktivitas antioksidan dari ekstrak metanol tanaman R.elliptica (Ahmad, et al., 2010).
tumbuhan Ginseng Kuning (Rennellia elliptica Korth.). Oleh karena itu, penelitian ini bertujuan untuk melakukan skrining dan isolasi metabolit bioaktif jamur endofit yang terdapat pada tumbuhan Ginseng Kuning (Rennellia elliptica Korth.) sebagai antibakteri.
1.2. Rumusan Masalah
1. Adakah diantara 23 ekstrak jamur endofit yang diisolasi dari tumbuhan Ginseng Kuning (Rennellia elliptica Korth.) yang menunjukkan aktivitas antibakteri terhadap bakteri Staphylococcus aureus dan Escherichia coli?
2. Berapakah nilai Konsentrasi Hambat Minimum (KHM) dari metabolit bioaktif yang diisolasi dari jamur terpilih ?
1.3. Hipotesis
Metabolit bioaktif jamur endofit yang diisolasi dari jamur endofit yang diisolasi dari tumbuhan Ginseng Kuning (Rennellia elliptica Korth.) mempunyai aktivitas antibakteri terhadap bakteri uji Staphylococcus aureus dan Escherichia coli.
1.4. Tujuan Penelitian
1. Untuk melakukan skrining aktivitas antibakteri metabolit bioaktif jamur endofit yang diisolasi dari tumbuhan Ginseng Kuning (Rennellia elliptica Korth.) terhadap bakteri Staphylococcus aureus dan Escherichia coli.
2. Untuk melakukan isolasi metabolit dari jamur terpilih yang memiliki aktivitas antibakteri terhadap bakteri uji Staphylococcus aureus dan Escherichia coli.
1.5. Manfaat Penelitian
2.1 Jamur Endofit
Endofit adalah mikroba yang mendiami biotop yaitu tumbuhan tingkat tinggi, yang baru-baru ini dianggap sebagai sumber metabolit sekunder yang menawarkan potensi di bidang kesehatan, agrikultural dan industri. Endofit mampu hidup pada variasi suhu yang luas, dengan suhu
optimum yang biasanya tampak pada suhu 20 0C dan 26 0C (Labeda, 1990).
Baru-baru ini endofit dianggap dapat menjadi sumber utama dalam produk bioaktif alami karena banyak endofit yang menduduki jutaan tumbuhan tingkat tinggi (Strobel & Daisy, 2003). Bukti adanya kaitan tanaman dengan mikroba yang ditemukan dalam jaringan fosil batang dan daun menunjukkan bahwa asosiasi endofit mungkin telah berevolusi dari waktu dimana tumbuhan tingkat tinggi pertama kali muncul di bumi, ratusan juta tahun yang lalu (Bacon & White, 2000 dalam Zhao, et al., 2010).
Jamur endofit merupakan kombinasi antara jamur dan tumbuhan dimana jamur hidup secara sistematik dan umumnya berada di dalam tumbuhan (Labeda, 1990). Sebagai sumber daya yang baru dan melimpah, jamur endofit memiliki kemampuan khusus untuk menghasilkan senyawa yang serupa dengan senyawa yang berasal dari tanaman inangnya, serta senyawa bioaktif lainnya (Zhao, et al., 2010).
Karena jumlah spesies tumbuhan di dunia begitu besar, perlu diketahui strategi tertentu untuk mempermudah pencarian endofit yang memiliki bioaktivitas (Strobel & Daisy, 2003). Beberapa hipotesis yang masuk akal sebagai strategi pemilihan tanaman yang dapat dipertimbangkan untuk mendapatkan jamur endofit yang memiliki bioaktivitas adalah sebagai berikut (Strobel & Daisy, 2003) :
b. Tanaman yang memiliki sejarah ethnobotanical (digunakan oleh masyarakat) yang berhubungan dengan penggunaan atau aplikasi tertentu merupakan hal menarik untuk diteliti. Tanaman ini dipilih baik secara kontak langsung dengan masyarakat lokal atau melalui literatur. c. Tanaman yang endemik, yang memiliki umur tanaman yang tidak biasa. d. Tanaman yang tumbuh di daerah keanekaragaman hayati yang besar.
Selama periode panjang ko-evolusi, jamur endofit telah beradaptasi dalam micro environments khusus secara bertahap dengan berbagai variasi genetik, termasuk penyerapan dari beberapa segmen DNA tanaman ke dalam genom jamur, serta penyisipan segmen DNA jamur ke dalam genom inang. Hal ini bisa menyebabkan endofit tertentu memiliki kemampuan untuk mensintesis beberapa "phytochemical" yang berasal dari tumbuhan inangnya (Zhang, et al., 2006 dalam Zhao, et al., 2010).
2.1.1 Kultivasi Endofit
Dalam dua dekade terakhir, para ilmuwan fokus melakukan penyelidikan terutama tentang keanekaragaman jamur endofit, hubungan antara jamur endofit dan tanaman inangnya, pencarian senyawa bioaktif alami yang berasal dari jamur endofit, dan peningkatan produktivitas dari beberapa kandidat yang potensial dengan pemanfaatan rekayasa genetika, proyek fermentasi mikroba dan langkah-langkah lainnya (Strobel & Daisy, 2004 dalam Zhao, et al., 2010).
2.2 Tumbuhan Ginseng Kuning / Rennellia ellipticaKorth 2.2.1 Klasifikasi Tumbuhan Ginseng Kuning (Rennellia elliptica
Korth)
Kingdom : Plantae
Filum : Magnoliophyta Class : Magnoliopsida Ordo : Rubiales Family : Rubiaceae Genus : Rennellia
Spesies : Rennellia elliptica
(Species 2000 & ITIS Catalogue of Life, 2012).
2.2.2 Morfologi
Kayu kecil atau belukar, tinggi 1,5-2 m; batang lignosus; daun ellips, panjang 8-23 cm, warna hijau pucat–hijau gelap, halus; petiolus panjang; infloresens terminal; bunga berwarna putih atau ungu tua, sangat wangi, pembuluh korola berwarna ungu; infructescence terminal; buah bundar, berwarna hijau (Suratman, 2008).
Gambar 2.1. Tumbuhan Ginseng Kuning / Rennellia elliptica Korth. (Ismail, et al., 2012)
2.2.3 Distribusi
Di Indonesia, spesies ini berasal dari Borneo, Sumatra Utara, Sumatra Barat dan Sumatra Selatan (Suratman, 2008).
2.2.4 Habitat dan Ekologi
Ditemukan di sepanjang tepian sungai atau hutan dataran rendah, pada ketinggian 40-650 m diatas permukaan laut (Suratman, 2008).
2.2.5 Nama Daerah
Ginseng Kuning, Jarum-Jarum Betina, Kayu Kuni, Kayu Kemik (Minangkabau) (Suratman, 2008).
2.2.6 Kegunaan
Hasil dekok dari akar R.elliptica digunakan oleh masyarakat lokal untuk bermacam kegunaan, termasuk sebagai aprodisiak, nyeri badan, post tonik natal. Dalam penelitian ilmiah diketahui bahwa adanya aktivitas antiplasmodik pada ekstrak diklorometan dari akar R. elliptica yang ditunjukkan dengan kemampuannya menghambat Plasmodium falciparum (Osman, et al., 2010) dan adanya aktivitas antioksidan dari ekstrak metanol tanaman R. elliptica (Ahmad, et al., 2010).
2.2.7 Kandungan Senyawa
2.3 Antimikroba
Antimikroba ialah obat pembasmi mikroba khususnya mikroba yang merugikan manusia. Obat yang digunakan untuk membasmi mikroba penyebab infeksi pada manusia ditentukan harus memiliki toksisitas selektif setinggi mungkin. Artinya, obat itu haruslah bersifat sangat toksik untuk mikroba tetapi relatif tidak toksik pada hospes (Setiabudy, 2007).
Obat-obat antimikroba efektif dalam pengobatan infeksi karena toksisitas selektifnya, kemampuan obat tersebut membunuh mikroorganisme yang menginvasi penjamu tanpa merusak sel. Pada kebanyakan kasus, toksisitas lebih relatif daripada absolut, yang memerlukan kontrol konsentrasi obat secara hati-hati untuk menyerang mikroorganisme sehingga dapat ditolerir oleh tubuh. Terapi antimikroba mempunyai keuntungan dengan adanya perbedaan biokimia yang timbul antara mikroorganisme dan manusia (Mycek, et al., 2001).
Antibiotik ialah zat yang dihasilkan oleh suatu mikroba, terutama fungi, yang dapat menghambat atau membasmi mikroba jenis lain. Banyak antibiotik dewasa ini dibuat secara semi sintetik atau sintetik penuh. Berdasarkan sifat toksisitas selektif, ada antimikroba yang bersifat menghambat pertumbuhan mikroba, dikenal sebagai aktivitas bakteriostatik; dan ada yang bersifat membunuh antimikroba, dikenal sebagai aktivitas bakterisid. Kadar minimal yang diperlukan untuk menghambat pertumbuhan mikroba atau membunuhnya, masing-masing dikenal dengan kadar hambat minimal (KHM) dan kadar bunuh minimal (KBM). Antimikroba tertentu aktivitasnya dapat meningkat dari bakteriostatik menjadi bakterisid bila kadar antimikrobanya ditingkatkan melebihi KHM (Setiabudy R, 2007).
Berdasarkan mekanisme kerjanya, antimikroba dibagi dalam 5 kelompok (Setiabudy R, 2007), yaitu :
a. Antimikroba yang mengganggu metabolisme sel mikroba.
mensintesis sendiri asam folat dari asam amino benzoat (PABA) untuk kebutuhan hidupnya. Bila antimikroba menang bersaing dalam pembentukan asam folat, maka terbentuk analog asam folat yang nonfungsional. Akibatnya, kehidupan mikroba akan terganggu.
b. Antimikroba yang menghambat sintesis dinding sel mikroba.
Obat yang termasuk kedalam kelompok ini adalah penisilin, sefalosporin, basitrasin, vankomisin, dan sikloserin.
c. Antimikroba yang mengganggu keutuhan membran sel mikroba.
Obat yang termasuk ke dalam kelompok ini adalah polimiksin, golongan polien, serta berbagai antimikroba kemoteurapetik. Kerusakan membran sel menyebabkan keluarnya berbagai komponen penting dari dalam sel mikroba yaitu protein, asam nukleat, nukleotida dan lain-lain. d. Antimikroba yang menghambat sintesis protein sel mikroba.
Obat yang termasuk dalam golongan ini adalah golongan aminoglikosida, makrolid, linkomisin, tetrasiklin dan kloramfenikol. Sintesis protein berlangsung di ribosom, dengan bantuan tRNA dan mRNA. Pada bakteri, ribosom terdiri dua unit (30S dan 50S). Misalnya, streptomisin berikatan dengan komponen ribosom 30S dan menyebabkan kode pada mRNA salah dibaca oleh tRNA, akibatnya terbentuk protein yang abnormal dan nonfungsional bagi sel mikroba. e. Antimikroba yang menghambat sintesis asam nukleat sel mikroba.
Antimikroba yang termasuk dalam kelompok ini adalah rifampisin dan golongan kuinolon.
2.4 Uji Aktivitas Antimikroba
(Vanden & Vlientink, 1991 dalam Valgas, et al., 2007). Klasifikasi metode uji antimikroba dapat dilihat pada gambar 2. 3.
2.4.1 Metode Difusi
Metode difusi sering digunakan untuk uji antimikroba yang rentan terhadap senyawa murni, senyawa polar ataupun non polar (Steward, et al., 1999 dalam Choma & Grzelak, 2010). Pada prosedur ini, kertas filter cakram (kira-kira berdiameter 6 mm), berisi senyawa uji yang ditempatkan pada permukaan yang sebelumnya telah diinokulasi dengan mikroba uji. Agen antimikroba akan berdifusi ke dalam agar dan menghambat pertumbuhan dari mikroba uji. Cawan petri diinkubasi dan zona inhibisi diukur. Pada metode silinder, silinder dari stainless steel atau porcelin dengan ukuran yang seragam (biasanya 8mm x 6 mm x 10 mm) ditempatkan diatas agar terinokulasi didalam cawan petri, dan diisi dengan sampel dan standar. Setelah diinkubasi, silinder dipindahkan dan zona inhibisi yang terbentuk diukur (Choma & Grzelak, 2010).
Gambar 2.2 Klasifikasi metode uji antimikroba (Choma & Grzelak, 2010). dibuat seri pengenceran agen antimikroba pada medium cair yang ditambahkan dengan mikroba uji. Larutan uji agen antimikroba pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan mikroba uji
ditetapkan sebagai KHM. Larutan yang ditetapkan sebagai KHM dikultur ulang tanpa penambahan mikroba uji ataupun agen antimikroba, dan diinkubasi selama 18–24 jam pada suhu 37 0C. Media cair yang terlihat tetap jernih setelah diinkubasi ditetapkan sebagai KBM (Pratiwi, 2008).
Metode dilusi padat serupa dengan metode dilusi cair tapi menggunakan media padat (solid). Keuntungan metode ini adalah satu konsentrasi agen antimikroba yang diuji dapat digunakan untuk menguji beberapa mikoba uji (Pratiwi, 2008).
2.4.3 Bioautografi
Prosedur menggunakan metode bioautografi hampir sama dengan prosedur pada metode difusi. Perbedaannya bahwa senyawa uji berdifusi ke medium agar dari kromatografi, yang mengandung adsorben atau kertas (Meyers, et al., 1964 dalam Choma & Grzelak, 2010).
Bioautografi adalah suatu teknik laboratorium untuk mendeteksi zat yang mempengaruhi tingkat pertumbuhan organisme uji dalam campuran yang kompleks dan matriks (Choma, 2005). Metode bioautografi merupakan metode sederhana yang digunakan untuk menunjukkan adanya aktivitas antibakteri atau antikapang. Metode ini menggabungkan penggunaan tehnik kromatografi lapis tipis dengan respons dari mikroorganisme yang diuji berdasarkan aktivitas biologi dari suatu analit yang dapat berupa anti bakteri, anti kapang dan anti protozoa (Kusumaningtyas, et al., 2008).
Bidang utama yang digunakan dalam bioautografi adalah (Choma, 2005) :
a. Mencari zat antibiotik dan anti jamur baru, antitumor, dan senyawa antiprotozoa dengan mempelajari aktivitas biologis zat yang berasal dari tanaman, mikroorganisme atau kimia kombinatorial
b. Penyelidikan antibiotik dan senyawa biologis aktif lainnya dalam air limbah, air minum, cairan tubuh, pakan, dan makanan
d. Mencari senyawa antimikroba yang efektif melawan bakteri dan jamur patogen pada tanaman
e. Deteksi dan penentuan racun (misalnya, aflatoksin) atau senyawa fototoksik (misalnya, furokumarin).
Metode bioautografi dibagi menjadi tiga kategori (Choma, 2005): a. Bioautografi Kontak atau Difusi Agar
b. Imersi atau Bioautografi Agar Overlay c. Bioautografi Langsung.
2.4.3.1Bioautografi kontak atau Difusi Agar
Bioautografi kontak dilakukan dengan meletakkan lempeng kromatogram hasil eluasi senyawa yang akan diuji di atas media padat yang sudah diinokulasi dengan mikroba uji. Adanya senyawa antimikroba ditandai dengan adanya daerah jernih yang tidak ditumbuhi anti mikroba (Kusumaningtyas, et al., 2008).
Pada bioautografi kontak, terjadi difusi senyawa antimikroba dari
pelat atau kertas KLT ke agar yang diinokulasi bakteri uji (Meyers, et al., 1964 dalam Choma, 2005). Kromatogram ditempatkan
menghadap ke bawah lapisan agar yang diinokulasi bakteri dan dibiarkan beberapa menit atau beberapa jam untuk memungkinkan difusi.
Kromatogram kemudian dipindahkan dan kemudian diinkubasi (Choma, 2005).
Zona hambat diamati pada permukaan agar di tempat dimana agen antimikroba menempel dengan agar. Metode ini menyerupai metode cakram. Kelemahan dari bioautografi kontak ini adalah kesulitannya dalam memperoleh kontak yang lengkap antara agar dan lempeng uji serta daya adsorben terhadap permukaan agar (Choma, 2005).
2.4.3.2Imersi atau Bioautografi Agar Overlay
(Nicolaus, 1961 dalam Choma, 2005). Terkadang, sebelum proses inkubasi, pelat dibiarkan selama beberapa jam pada suhu rendah untuk memungkinkan difusi. Tehnik agar overlay merupakan gabungan dari bioautografi kontak dan langsung (Choma, 2005).
Antimikroba ditransfer dari pelat KLT ke lapisan agar seperti dalam uji kontak tetapi selama inkubasi dan visualisasi lapisan agar tetap berada pada plate seperti dalam bioautografi langsung. Dibandingkan dengan metode bioautografi langsung, kerugian utama dari metode ini adalah sensitivitas yang lebih rendah disebabkan oleh cairan antibakteri dalam lapisan agar. Metode agar overlay biasanya disarankan bila bioautografi langsung mustahil dilakukan (Choma, 2005).
2.4.3.3Bioautografi Langsung
Dalam bioautografi langsung, pelat dicelupkan dalam suspensi mikroorganisme yang tumbuh dalam kaldu yang cocok atau suspensi disemprotkan ke pelat (Homans, 1970 dalam Choma, 2005). Pelat diinkubasi dan mikroorganisme tumbuh langsung di atasnya. Oleh karena itu, pemisahan, prakondisi, inkubasi dan visualisasi yang dilakukan langsung di plate. Untuk lokasi dan visualisasi aktivitas antibakteri, garam tetrazolium biasanya digunakan, yang dikonversi oleh adanya aktivitas enzim dehidrogenase pada mikroorganisme hidup mereduksi tetrazolium menjadi zat yang berwarna intens/ ungu, formazan (Choma, 2005). Jika aktivitas antimikroba pada pelat KLT aktif membunuh bakteri, maka tidak terjadi pembentukan warna dan terbentuk zona penghambatan yang berwarna pucat pada latar yang berwarna ungu. Pewarna tetrazolium yang paling sering digunakan adalah 3-{4,5-Dimetiltiazol-2-il}-2,5-difeniltetrazoliumbromida, disebut MTT (Choma, 2005).
2.5 Kromatografi
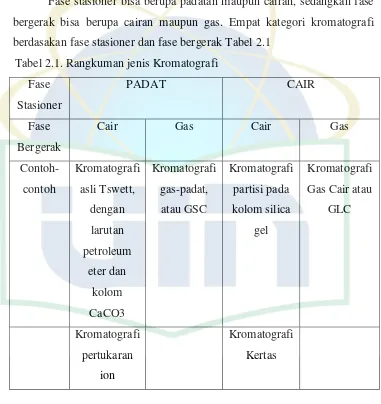
dalam kolom gas yang berisi kalsium karbonat (Gandjar & Rohman, 2007). Kromatografi adalah suatu metode pemisahan fisik, dimana komponen-komponen yang dipisahkan didistribusikan diantara dua fase, salah satu fase tersebut adalah suatu lapisan stasioner dengan permukaan yang luas, dan fase lain sebagai fluida yang mengalir di sepanjang landasan stasioner (Day & Underwood, 2002).
Fase stasioner bisa berupa padatan maupun cairan, sedangkan fase bergerak bisa berupa cairan maupun gas. Empat kategori kromatografi berdasakan fase stasioner dan fase bergerak Tabel 2.1
Tabel 2.1. Rangkuman jenis Kromatografi
Dalam semua tehnik kromatografi, zat-zat terlarut yang dipisahkan bermigrasi sepanjang kolom dan tentu saja dasar pemisahan terletak dalam
laju perpindahan yang berbeda untuk larutan yang berbeda (Day & Underwood, 2002).
2.5.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) dikembangkan oleh Izmailoff dan Schraiber pada tahun 1938. Kromatografi lapis tipis merupakan bentuk kromatografi planar, selain kromatografi kertas dan elektroforesis. Fase gerak yang dikenal sebagai pelarut pengembang akan bergerak sepanjang fase diam karena pengaruh kapiler pada pengembangan secara menaik (ascending), atau karena pengaruh gravitasi pada pengembangan secara menurun (descending) (Gandjar & Rohman, 2007).
Dalam kromatografi lapis tipis, peralatan yang digunakan lebih sederhana dan dapat dikatakan bahwa hampir semua laboratorium dapat melaksanakan setiap saat secara cepat (Gandjar & Rohman, 2007).
Beberapa keuntungan lain dari kromatografi lapis tipis adalah (Gandjar & Rohman, 2007):
a. Kromatografi lapis tipis banyak digunakan untuk tujuan analisis
b. Identifikasi pemisahan komponen dapat dilakukan dengan pereaksi warna, flouresensi, atau radiasi dengan sinar ultraviolet
c. Dapat dilakukan eluasi secara menaik (Ascending), menurun (descending) atau dengan cara elusi 2 dimensi.
d. Ketepatan penentuan kadar akan lebih baik karena komponen yang akan ditentukan merupakan bercak yang tidak bergerak.
paling sering digunakan adakah silika dan serbuk selulosa, sementara mekanisme sorpsi yang utama dalam KLT adalah adsorpsi dan partisi (Gandjar& Rohman, 2007).
Pada fase gerak dalam KLT, sistem yang paling sederhana ialah campuran dua pelarut organik karena daya elusi campuran kedua pelarut ini dapat mudah diatur sedemikian rupa sehingga pemisahan dapat terjadi secara optimal. Beberapa petunjuk dalam memilih dan mengoptimasi fase gerak adalah sebagai berikut (Gandjar & Rohman, 2007) :
1. Fase gerak harus mempunyai kemurnian yang sangat tinggi karena KLT merupakan tehnik yang sensitif
2. Daya elusi fase gerak harus diatur sedemikian rupa sehingga harga Rf antara 0,2-0,8 untuk memaksimalkan pemisahan.
3. Untuk pemisahan dengan menggunakan fase diam polar seperti silika gel, polaritas fase gerak akan menentukan kecepatan migrasi solut yang berarti juga menentukan nilai Rf. Penambahan pelarut yang bersifat sedikit polar seperti dietil eter ke dalam pelarut non polar seperti metil benzen akan meningkatkan harga Rf secara signifikan.
4. Solut-solut ionik dan solut-solut polar lebih baik digunakan campuran pelarut sebagai fase geraknya. Penambahan sedikit asam etanoat atau amonia masing-masing akan meningkatkan solut solut yang bersifat basa dan asam.
Pemisahan pada kromatografi lapis tipis yang optimal akan diperoleh hanya jika menotolkan sampel dengan ukuran bercak sekecil dan sesempit mungkin. Penotolan sampel yang tidak tepat akan menyebabkan bercak yag menyebar dan pucak ganda. Untuk memperoleh reprodusibilitas, volume sampel yang akan ditotolkan paling sedikit 0,5 μl. Jika volume sampel yang akan ditotolkan lebih besar dari 2-10 μl maka penotolan harus dilakukan secara bertahap dengan dilakukan pengeringan antar totolan (Gandjar & Rohman, 2007).
dan zat padat yang umumnya digunakan adalah alumina, gel silika, dan selulosa (Day & Underwood, 2002).
Sampel yang biasanya berupa campuran senyawa organik diteteskan di dekat salah satu sisi lempengan dalam bentuk larutan dalam jumlah kecil, biasanya beberapa mikrogram senyawa. Sebuah suntikan hipodermik atau sebuah pipet gelas kecil dapat digunakan. Noda sampel dikeringkan dan kemudian sisi lempengan tersebut dicelupkan ke dalam fase gerak yang sesuai. Pelarut bergerak naik di sepanjang lapisan tipis zat padat di atas lempengan, dan bersamaan dengan pergerakan pelarut tersebut, zat terlarut sampel dibawa dengan laju yang bergantung pada kelarutan zat terlarut tersebut dalam fase bergerak dan interaksinya dengan zat padat. Setelah garis depan pelarut bergerak sekitar 10 cm, lempengan dikeringkan dan noda-noda zat terlarutnya diperiksa seperti pada kromatografi kertas (Day & Underwood, 2002).
2.5.2 Nilai Rf
Pemisahan pada kromatografi planar (kromatografi kertas dan kromatografi lapis tipis) pada umumnya dihentikan sebelum semua fase gerak melewati seluruh permukaan fase diam. Solut pada kedua kromatografi ini dikarakterisasi dengan jarak ujung fase geraknya. Faktor retardasi solut (Rf) didefinisikan sebai perbandingan antara jarak yang ditempuh oleh solut terhadap jarak yang ditemput oleh fase gerak (Gandjar & Rohman, 2007).
Nilai maksimum Rf adalah 1 dan ini dicapai ketika solut mempunyai perbandingan distribusi (D) dan faktor retensi (K’) sama dengan 0 yang berarti solut bermigrasi dengan kecepatan yang sama dengan fase gerak. Nilai minimum Rf adalah 0 dan ini teramati jika solut
2.5.3 Kromatografi Kolom
Pada kromatografi kolom, berbagai ukuran kolom dapat digunakan, dimana hal utama yang dipertimbangkan adalah kapasitas yang memadai untuk menerima sampel-sampel tanpa melalui fase diamnya. Merupakan aturan praktis yang umum bahwa panjang kolom harus sekurang-kurangnya sepuluh kali ukuran diameternya. Bahan pengemasnya, suatu adsorben seperti alumina atau mungkin suatu resin pertukaran ion, dimasukkan dalam bentuk suspensi ke dalam porsi fase bergerak dan dibiarkan diam di dalam hamparan basah dengan sedikit cairan tetap berada di atas permukaannya (Day & Underwood, 2002).
Laju alir yang diinginkan diperoleh semata-mata dari gravitasi, dengan menyisipkan ujung keluaran kolom itu ke dalam bejana yang, atau dengan memompa cairan melalui ujung atas kolom, laju alir yang lazim dapat sebesar beberapa puluh milimeter per menit dan mungkin lebih cepat jika pemisahan tidak terlalu sulit (Day & Underwood, 2002). Terkadang tidak ada satupun fase bergerak yang cocok dengan elusi dari seluruh komponen sampel. Misalnya dalam adsorpsi, pelarut yang cukup nonpolar mungkin ideal untuk mengelusi beberapa zat terlarut yang kurang polar dimana zat terlarut yang lebih polar kemudian dapat memperlihatkan suatu retensi panjang yang berlebihan. Pada kasus seperti ini, teknik elusi gradien lebih bermanfaat. Komposisi fase gerak diubah secara kontinu dengan membiarkan pelarut yang lebih polar mengalir ke dalam reservoar yang mengandung zat terlarut yang kurang polar, pada saat campuran zat terlarut mengalir ke dalam kolom. Dimana zat terlarut yang lambat akan mengalir lebih cepat dengan meningkatnya kemampuan mengelusi dari campuran pelarut (Day & Underwood, 2002).
2.6 Bakteri Gram positif dan negatif
Bakteri merupakan sel prokariotik yang uniseluler (sel tunggal) dengan struktur internal sederhana. Tumbuh pada media laboratoris buatan. Reproduksi aseksual, khasnya dengan pembelahan sel sederhana. Ukuran khas 0,5 – 1,5 μm x 1,0- 3,0 μm. Sel-sel individu bakteri dapat berbentuk seperti elips, bola, batang (silindris), atau spiral (heliks) (Pelczar & Chan, 1986).
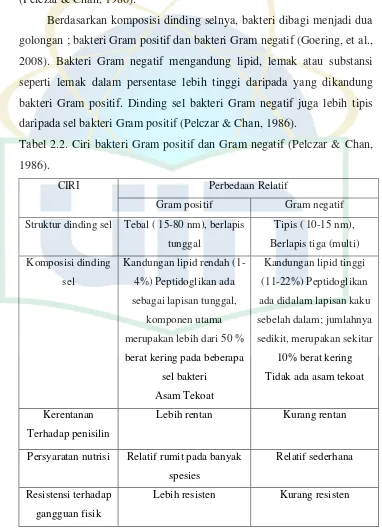
Berdasarkan komposisi dinding selnya, bakteri dibagi menjadi dua golongan ; bakteri Gram positif dan bakteri Gram negatif (Goering, et al., 2008). Bakteri Gram negatif mengandung lipid, lemak atau substansi seperti lemak dalam persentase lebih tinggi daripada yang dikandung bakteri Gram positif. Dinding sel bakteri Gram negatif juga lebih tipis daripada sel bakteri Gram positif (Pelczar & Chan, 1986).
Tabel 2.2. Ciri bakteri Gram positif dan Gram negatif (Pelczar & Chan, 1986).
CIRI Perbedaan Relatif
Gram positif Gram negatif
Struktur dinding sel Tebal ( 15-80 nm), berlapis
tunggal
Persyaratan nutrisi Relatif rumit pada banyak
spesies
Relatif sederhana
Resistensi terhadap
gangguan fisik
2.7 Bakteri Uji
2.7.1 Staphylococcus aureus
Staphylococcus merupakan bakteri kokus Gram positif,
berdiame-ter 1 μm (Parija, 2009). Kokusnya tersusun khas seperti setandan anggur
yang tidak teratur. Bentuk seperti anggur yang tidak teratur ini tampak bila bakteri ditumbuhkan pada media padat, tetapi biasanya terlihat seperti rantai pendek bila ditumbuhkan pada medium cair. Apusan yang diambil dari nanah menunjukkan keberadaan yang tunggal atau berpasangan, tandanan, atau rantai pendek yang terdiri dari tiga atau empat sel (Parija, 2009).
S. aureus menyebabkan penyakit pada berbagai jaringan, menye-barkan toksin, dan merangsang inflamasi. Bakteri ini menempel dan membahayakan kulit, mukosa dan permukaan jaringan. Staphylococcus aureus merupakan patogen primer pada manusia dan hewan, hidup pada kulit, kelenjar kulit dan membran mukus. Kira-kira 35-50 % terdapat pada orang dewasa, 10 % pada perinium dan 5 – 10% pada vagina (Parija, 2009). Bakteri ini juga menyebabkan penyakit toxin-mediated seperti keracunan makanan, toxic shock syndrome (TSS), dan staphylococcal scalded skin syndrome (Parija, 2009). Determinan utama tehadap patogenitas adalah enzim dan toksin. Enzim yang terkandung yaitu koagulase (karakteristik yang memperkuat), hialuronidase, stapilokinase, nuklease, dan penisillinase. Toksinnya adalah β-hemolysins, leukocidin, enterotoksin, eksfoliatif dan shock syndrome toxin. Bakteri menempati nasofaring dan kulit (Talaro, 2005).
2.7.2 Escherichia coli
Family : Enterobacteriaceae Genus : Escherichia
E. coli merupakan bakteri enterik utama. Bertindak sebagai patogen juga sebagai bakteri yang menguntungkan. Dan menyebabkan bermacam penyakit seperti diare, infeksi pada saluran urin (Talaro, 2005).
E. coli merupakan bacilus Gram negatif yang berukuran sekitar 1-3
x 0,4-0,7 μm. Basil tersusun secara tunggal atau berpasangan (Parija, 2009). Menurut Parija (2009), E. coli merupakan bakteri aerob dan
anaerob fakultatif. Tumbuh pada rentang suhu 10-140 C (suhu optimum 370 C) dan pH 7,2. Bakteri tumbuh pada berbagai media, termasuk Mueller-Hinton Agar, Nutrient Agar, Blood Agar, dan MacConkey Agar.
Isolasi utama dapat ditemukan dari Nutrient Agar dan Blood Agar (Parija, 2009).
3.1 Waktu dan Tempat
Penelitian ini dilakukan di Laboratorium Biosains, Bidang Botani, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong. Waktu pelaksanaan penelitian dimulai dari bulan April hingga Agustus 2013.
3.2 Alat dan Bahan 3.2.1 Alat
Alat –alat yang digunakan dalam penelitian ini antara lain: autoklaf (Hiclave HVE 5.0 Hirayama), cawan petri, jarum ose, lampu bunsen, kolom, kapas steril, pipa kapiler, pinset, pipet mikro, tabung reaksi (pyrex), spatula, shaker incubator, inkubator, vacuum rotary evaporator (Heidolph WB 2000), UV cabinet (CAMAG), chamber, Lamina Air Flow (LAF), 96 microwell titer plate, labu evaporator (pyrex), neraca analitik (and hr-202i), corong pisah, erlenmeyer dan alat-alat gelas lainnya.
3.2.2 Bahan
Bahan uji yang digunakan dalam penelitian ini adalah 23 isolat jamur endofit yang diisolasi dari bagian akar, batang, daun dan biji tumbuhan Rennellia elliptica koleksi Laboratorium Biosains, Bidang Botani, Puslit Biologi LIPI Cibinong (Tabel 3.1)
Bakteri uji yang digunakan meliputi bakteri uji Gram positif (Staphylococcus aureus LIPIMC 114), bakteri uji Gram negatif (Escherichia coli LIPIMC 186).
sephadex LH-20, pelarut kimia etil asetat, aseton, kloroform, metanol, n-heksana, alkohol 96 %, alkohol 70%, aquades, aquades steril, reagen warna p-iodonitrotetrazolium / INT (Sigma), pewarna trypan blue, kristal violet, safranin, larutan iodin, kloramfenikol (Sigma), eritromisin (Sigma), kertas saring, gas nitrogen dan penampak noda serium sulfat.
Tabel 3.1. Data 23 isolat jamur endofit dari tumbuhan Ginseng Kuning (Rennellia elliptica Korth)
No Asal Isolat Nama Jamur No Asal Isolat Nama Jamur
1 Akar GKA ¼ 1 Daun GKD 2
2 GKA 2 2 GKD 3/4
3 GKA 3 3 GKD 5
4 GKA 5 4 GKD 6
5 GKA 6 5 GKD 7
6 GKA 7 6 GKD 8
1 Biji GKB 1 1 Batang GKBt 1
2 GKB 2 2 GKBt 2
3 GKB 3 3 GKBt 3/4
4 GKB 4 4 GKBt 5/6
5 GKB 5
6 GKB 6
3.3 Tahapan Penelitian
1. Skrining bioproduksi metabolit sekunder ekstrak 2. Uji aktivitas antibakteri dengan metode bioautografi 3. Scaling up kultivasi jamur endofit GKBt 2
4. Ekstraksi jamur endofit hasil Scaling Up 5. Isolasi metabolit jamur endofit GKBt 2
6. Penentuan nilai Konsentrasi Hambat Minimum (KHM) 7. Identifikasi jamur endofit GKBt 2
3.4. Prosedur Kerja
3.4.1 Skrining Bioproduksi Metabolit Sekunder Ekstrak 3.4.1.1Kultivasi isolat jamur endofit ke dalam medium PDB a. Pembuatan medium kultivasi
Medium PDB dibuat sebanyak 750 mL dengan cara mensuspensikan 18 g PDB ke dalam 750 mL aquades. Setelah tercampur, medium dipanaskan hingga larut sempurna, kemudian dituangkan ke dalam 25 tabung uji masing-masing sebanyak 40 mL. Medium disterilkan dengan autoklaf pada suhu 121 oC selama 15 menit.
b. Kultivasi isolat jamur endofit
Kultivasi isolat jamur endofit dilakukan terhadap 23 isolat jamur endofit yang diisolasi dari bagian akar, biji, daun dan batang tumbuhan Ginseng Kuning (Rennellia elliptica Korth). Setiap isolat jamur endofit dinokulasikan sebanyak 1 ose ke dalam masing-masing tabung yang berisi medium PDB steril, kemudian diinkubasi dalam kondisi statis pada suhu kamar selama tiga minggu. Inkubasi juga dilakukan terhadap 1 tabung yang berisi medium PDB steril saja, sebagai kontrol sterilitas media.
3.4.1.2Ekstraksi isolat jamur endofit
Ekstraksi juga dilakukan terhadap satu tabung yang berisi medium PDB saja. Hasil ekstraksi dipekatkan dengan menggunakan vacuum rotary evaporator hingga didapat ekstrak pekat.
3.4.1.3 Skrining bioproduksi metabolit sekunder ekstrak
Sebanyak dua puluh tiga ekstrak etil asetat dari jamur endofit Ginseng Kuning dianalisis metabolit sekundernya dengan Kromatografi Lapis Tipis (KLT) menggunakan eluen diklorometan:metanol (10:1). Ekstrak dilarutkan ke dalam aseton dengan konsentrasi 10 mg/mL, volume penotolan sebanyak 10 µL. Penotolan dilakukan diatas pelat KLT 20x7 cm. Sebagai kontrol pelarut dan medium, ditotolkan pula ekstrak medium PDB dan aseton. Pola kromatogram yang terbentuk dimonitor dengan sinar UV pada panjang gelombang 254 nm dan 366 nm, lalu disemprot dengan pereaksi penampak noda serium sulfat/ Ce(SO4)2.
3.4.2 Uji aktivitas antibakteri dengan metode bioautografi 3.4.2.1Sterilisasi Alat dan Bahan
Semua alat dan bahan (media) yang akan digunakan untuk uji mikrobiologi disterilisasi dengan proses sterilisasi yang cocok. Sterilisasi dilakukan menggunakan autoklaf suhu 121 0C selama 15 menit. Sebelumnya, semua alat yang akan disterilisasi dibungkus dengan plastik tahan panas. Untuk pengerjaan uji antibakteri dilakukan di dalam Laminar Air Flow.
3.4.2.2 Pembuatan Medium a. Medium Peremajaan Bakteri
Medium Nutrient Agar (NA)
b. Medium Untuk Suspensi Bakteri.
Medium Brain Heart Infussion (BHI) cair
BHI ditimbang sebanyak 5,55 g dilarutkan dalam 150 mL aquades. Setelah semua bahan tercampur, medium dipanaskan hingga larut sempurna, lalu disterilkan dengan autoklaf pada suhu 121 oC selama 15 menit.
3.4.2.3Persiapan Inokulum
Bakteri uji yang digunakan dalam penelitian ini adalah Staphylococcus aureus dan Escherichia coli.
a. Identifikasi bakteri uji dengan pewarnaan Gram
Kaca objek dan kaca penutup dibersihkan dengan alkohol 70 %, bakteri uji disuspensikan ke dalam aquades steril yang terdapat diatas kaca objek, kemudian diratakan membentuk area apusan dan difiksasi dengan cara melewatkannya di atas api bunsen. Zat warna kristal violet diteteskan ke atas area apusan, dibiarkan selama 60 detik dan dicuci dengan air aquades kemudian dibiarkan beberapa saat. Larutan iodin diteteskan ke atas apusan dan dibiarkan selama 1 menit kemudian dicuci dengan alkohol hingga larutan yang mengalir tidak berwarna lagi dilanjutkan dengan pencucian dengan aquades, dibiarkan beberapa saat. Zat warna safranin diteteskan dan dibiarkan selama 60 detik. Kemudian dicuci dengan akuades, dibiarkan beberapa saat. Preparat ditutup dengan kaca penutup diamati dengan mikroskop cahaya.
b. Peremajaan Bakteri Uji
Bakteri uji diremajakan pada medium Nutrient Agar (NA) steril. Mikroba uji diinokulasi sebanyak satu ose ke dalam medium NA dan diinkubasi pada suhu 37 0C selama 20 jam. Pengerjaan dilakukan dalam kondisi steril di dalam Laminar Air Flow (LAF).
c. Pembuatan Suspensi Bakteri
diinkubasi selama 20 jam dalam shaker incubator 100 rpm pada suhu 37 0C. Pengerjaan dilakukan dalam kondisi steril di dalam Laminar Air Flow (LAF)
3.4.2.4Persiapan Sampel
Sebanyak dua puluh tiga ekstrak etil asetat jamur endofit dari Ginseng Kuning masing-masing dilarutkan dengan pelarut aseton sehingga didapat larutan dengan konsentrasi 10 mg/mL. Masing-masing ekstrak jamur, dan kontrol negatif (pelarut aseton dan ekstrak media PDB)
ditotolkan sebanyak 10 μL kedalam pelat KLT ukuran 8x8 cm.
Kloramfenikol sebagai kontrol positif dengan konsentrasi 1 mg/mL dalam pelarut metanol ditotolkan sebanyak 10 μL dan 5 μL pada pelat KLT ukuran 4x7 cm.
3.4.2.5Uji Aktivitas Antibakteri dengan Metode Bioautografi
Suspensi bakteri uji dibuat dengan mensuspensikan 5 mL inokulum ke dalam 45 mL medium BHI cair (perbandingan medium dan suspensi inokulum 9:1) di dalam cawan petri steril berdiameter 14,5 cm, kemudian suspensi bakteri uji diratakan dengan menggunakan spreader steril. Pelat KLT yang telah ditotolkan sampel, kontrol positif dan kontrol negatif dicelupkan ke dalam cawan petri yang berisi suspensi bakteri uji. Kemudian, pelat tersebut diletakkan kedalam cawan petri steril yang telah diletakkan kapas basah pada kedua sisi petri. Kemudian diinkubasi pada suhu 37 0C selama 20 jam. Pengerjaan dilakukan dalam kondisi steril di dalam Laminar Air Flow (LAF).
3.4.3 Scaling Up bioproduksi jamur endofit GKBt 2 3.4.3.1Pembuatan medium kultivasi
mL medium dalam erlenmeyer 2 L. Medium disterilkan dengan autoklaf selama 15 menit pada suhu 121 oC.
3.4.3.2Kultivasi Jamur Endofit
Koloni murni jamur GKBt 2 berumur 14 hari yang telah ditumbuhkan pada medium PDA diambil kira-kira seluas 1x1 cm sebanyak 3 blok dan diinokulasi ke dalam medium PDB steril. Kemudian, kultur diinkubasi pada suhu ruang dalam kondisi statis selama tiga minggu. Pengerjaan kultivasi jamur endofit GKBt 2 dilakukan dalam kondisi steril di dalam Laminar Air Flow (LAF)
3.4.4 Ekstraksi kultur jamur GKBt 2 Hasil Scaling Up
Hasil kultivasi jamur endofit GKBt 2 selanjutnya diekstraksi. Kultur jamur dipisahkan menjadi media jamur dan biomassa jamur. Media jamur GKBt 2 diekstraksi dengan pelarut etil asetat dengan perbandingan pelarut dan kultur media 1:1, proses ekstraksi dilakukan sebanyak tiga kali. Jumlah pelarut etil asetat yang digunakan adalah lima liter. Lapisan atas yang merupakan fraksi etil asetat dipisahkan dan dipekatkan dengan vacuum rotary evaporator.
254 nm dan 366 nm serta disemprot dengan pereaksi penampak noda serium sulfat/ Ce(SO4)2.
3.4.5 Fraksinasi Metabolit Ekstrak Etil Asetat GKBt 2 Kromatografi Kolom
Ekstrak etil asetat media GKBt 2 sebanyak 830 mg difraksinasi menggunakan kolom sephadex LH-20 dengan larutan pengelusi alkohol 96 %. Fraksi-fraksi yang keluar dari kolom ditampung dalam tabung reaksi dan setiap tabung dimonitor dengan KLT menggunakan eluen diklorometan:metanol (10:1). Selanjutnya, fraksi-fraksi yang memiliki noda yang sama digabung menjadi satu fraksi sehingga didapat 15 fraksi.
Dari hasil fraksinasi menggunakan fase diam Sephadex LH-20, Fraksi F.5 yang berjumlah 47 mg difraksinasi kembali menggunakan kromatografi kolom dengan fase diam silica gel (70-230 mesh). Fase gerak yang digunakan adalah kloroform:metanol dengan perbandingan masing-masing 10:1, 5:1 dan 0:1. Fraksi – fraksi yang keluar kemudian ditampung dalam tabung reaksi dan setiap tabung dimonitor dengan KLT menggunakan eluen diklorometan: metanol (10:1). Selanjutnya, fraksi-fraksi yang memiliki bercak noda yang sama digabung menjadi satu fraksi-fraksi sehingga didapatkan 10 fraksi.
KLT Preparatif
Fraksi F.5.8 sebanyak 9,8 mg dilanjutkan dengan purifikasi menggunakan KLT preparatif. Sebelumnya, larutan fraksi dilarutkan dalam aseton dengan konsentrasi 5 mg/mL dan dioptimasi dengan eluen yang sesuai untuk mendapatkan kondisi optimum untuk preparatif pada pelat KLT. Eluen yang digunakan adalah kloroform : metanol dengan perbandingan 7:1.
dipekatkan dengan vacuum rotary evaporator dan dikeringkan dengan gas nitrogen. Kemudian bobot fraksi ditimbang.
Uji kemurnian fraksi dilakukan dengan menggunakan KLT dua dimensi. Dimana fraksi tunggal yang didapatkan dielusi menggunakan dua sistem elusi yaitu kloroform: metanol (7:1) dan kloroform: metanol (5:1).
3.4.6 Uji aktivitas antibakteri hasil purifikasi
Hasil purifikasi diuji aktivitas antibakterinya dengan menentukan nilai KHM (Konsentrasi Hambat Minimum) menggunakan metode mikodilusi cair pada suatu microwellplate yang berjumlah 96 sumuran.
3.4.6.1Persiapan Medium
Medium pertumbuhan bakteri uji yang digunakan yaitu medium MHB dan MHA
a. Medium MHB (Mueller Hinton Broth) dibuat dua komposisi, yaitu medium MHB 1 dibuat dengan melarutkan 21 g MHB dalam 1 L aquadest dan medium MHB 2 dibuat dengan komposisi dua kali medium MHB 1 (42 g MHB dalam 1 L aquadest). Medium tersebut disterilkan dengan autoklaf selama 15 menit pada suhu 121 0C.
b. Medium MHA (Mueller Hinton Agar) dibuat dengan melarutkan 38 g MHA dalam 1 L aquadest. Setelah larut, medium disterilkan dengan autoklaf selama 15 menit pada suhu 121 0C, kemudian dituang dalam cawan petri dan dibiarkan memadat.
3.4.6.2 Persiapan Larutan Uji dan Larutan Kontrol
sebanyak 200 µL dan ditambah aquadest sebanyak 800 µL sehingga volume larutan menjadi 1 mL.
Kloramfenikol dan eritromisin sebagai kontrol positif dipersiapkan dengan membuat larutan masing-masing dengan konsentrasi 10 mg/mL dalam etanol 96% (larutan stock). Kemudian diencerkan menjadi konsentrasi 512 µg/mL sebanyak 5 mL, pembuatan larutan kontrol positif dibuat dengan dengan cara menambahkan 4744 µL aquadest ke dalam 256 µL larutan stock di dalam vial.
3.4.6.3Persiapan Inokulum
Bakteri uji yang digunakan adalah Staphylococcus aureus dan Escherichia coli.
a. Pembuatan suspensi inokulum
Sebanyak masing-masing 1 ose isolat bakteri uji diinokulasikan ke dalam 20 mL medium MHB. Kemudian, diinkubasi selama 20 jam dalam shaker incubator pada suhu 37 0C untuk memperoleh suspensi inokulum.
b. Perhitungan jumlah koloni suspensi
Suspensi yang didapat diencerkan untuk mempermudah perhitungan koloni, yaitu dengan cara dipipet 50 µL suspensi ke dalam 4,95 mL medium MHB. Suspensi tersebut diencerkan lagi dengan cara yang sama hingga didapat suspensi dengan pengenceran 10-4, 10-6, 10-8, dan 10-10. Suspensi dengan pengenceran diinokulasikan sebanyak 100 µL ke dalam medium MHA. Setelah itu diinkubasi selama 20 jam pada suhu 37 0C. Koloni yang tumbuh dihitung.
Jumlah koloni suspensi
c. Pengenceran suspensi inokulum
3.4.6.4Penentuan Nilai Konsentrasi Hambat Minimum (KHM) campuran. Kemudian, masing-masing sumur ditambahkan 100 µL inokulum bakteri uji.
2. Pengenceran Larutan kontrol positif : sumur yang pertama diisi 100 µL medium MHB 2, sumur 2-8 diisi 100 µ L medium MHB 1. Pada sumur 1 diisi 100 µL larutan kontrol positif dengan konsentrasi 512 µg/mL. Dihomogenkan dengan menggunakan pipet mikro. Diambil sebanyak 100 µL dan dimasukkan ke dalam sumur 2 dihomogenkan. Dilakukan hal yang sama hingga sumur 8. Pada sumur 8 dibuang sebanyak 100 µL campuran. Kemudian, masing-masing sumur ditambahkan 100 µL inokulum bakteri uji.
3. Sumur lain berisi 200 µ L broth (kontrol media/kontrol sterilisasi). 4. Sumur lain berisi 100 µL broth dan 100 µL inokulum bakteri uji
kemudian dihomogenkan dengan pipet mikro (kontrol pertumbuhan). 5. Sumur lain berisi 100 µL broth, 100 µL pelarut (etanol 20 %),
dihomogenkan dengan pipet mikro dan dibuang sebanyak 100 µL campuran. Kemudian ditambahkan 100 µL inokulum bakteri (kontrol pelarut)
6. Microwellplate kemudian diikubasi selama 20 jam pada suhu 37 0C.
3.4.6.5Penentuan Nilai KHM
3.4.7 Pengamatan Morfologi Jamur Endofit GKBt 2 pada medium PDA (Potato Dextrose Agar)
4.1. Skrining Bioproduksi Metabolit Sekunder
Secara keseluruhan, sampel isolat jamur endofit yang diisolasi dari Tumbuhan Ginseng Kuning (Rennellia elliptica Korth.) berjumlah 23 isolat yang terdiri dari 6 isolat jamur endofit yang berasal dari akar, 7 isolat jamur endofit yang berasal dari biji, 6 isolat jamur endofit yang berasal dari daun dan 4 isolat jamur endofit yang berasal dari batang (Tabel 4.1). Seluruh isolat tersebut dikultivasi pada medium Potato Dextrose Broth (PDB). Bobot masing-masing ekstrak etil asetat jamur endofit dari tumbuhan Ginseng Kuning ditimbang untuk mengetahui kemampuan masing-masing isolat jamur dalam memproduksi metabolit sekunder. Berdasarkan data yang didapat, diketahui bahwa ekstrak etil asetat dari isolat jamur endofit GKB 3 memiliki bobot ekstrak yang paling besar yaitu 92,1 mg. Hal ini menunjukkan bahwa isolat jamur endofit GKB 3 memiliki kemampuan terbesar dalam memproduksi metabolit sekunder. Sedangkan ekstrak etil asetat dari isolat jamur endofit GKBt 2 memiliki bobot ekstrak yang paling kecil yaitu 11,2 mg. Hal ini menunjukkan bahwa isolat jamur endofit GKBt 2 memiliki kemampuan terkecil dalam memproduksi metabolit sekunder.
Tabel 4.1. Bobot 23 ekstrak etil asetat asetat isolat jamur endofit yang diisolasi dari tumbuhan Ginseng Kuning (Rennellia elliptica Korth).
U n
Untuk mengetahui profil bioproduksi metabolit sekunder dari masing-masing ekstrak, maka dilakukan analisis dengan Kromatografi Lapis Tipis (KLT) dengan menggunakan eluen diklorometan : metanol perbandingan 10:1 terhadap 23 ekstrak etil asetat jamur endofit. Pola kromatogram yang terbentuk dimonitor dengan sinar UV pada panjang gelombang 254 nm dan 366 nm, lalu disemprot dengan pereaksi penampak noda Ce(SO4)2, hal ini bertujuan untuk memperjelas pengamatan bioproduksi metabolit sekunder ekstrak secara umum (Gambar 4.1).
(a)
(b)
7 Biji GKB 1 33,7 20 Batang GKBt 1 64,1
8 GKB 2 48,6 21 GKBt 2 11,2
9 GKB 3 92,1 22 GKBt ¾ 21,4
10 GKB 4 26,8 23 GKBt 5/6 18,7
11 GKB 5 18,1
12 GKB 6 36
(c)
Gambar 4.1. Hasil Skrining Bioproduksi Metabolit Sekunder dari 23 ekstrak etil asetat jamur endofit yang diisolasi dari tumbuhan Ginseng Kuning (Rennellia elliptica Korth) (a) Hasil monitor dengan sinar UV pada panjang gelombang 254 nm (b) Hasil monitor dengan sinar UV pada panjang gelombang 366 nm (c) Hasil Penyemprotan dengan pereaksi penampak noda Ce(SO4)2.
4.2. Uji Aktivitas Antibakteri 23 Ekstrak Jamur Endofit
Pengujian aktivitas antibakteri pada penelitian ini, dilakukan terhadap 23 ekstrak etil asetat dengan konsentrasi 10 mg/mL sebanyak 10 µL melawan bakteri uji Staphylococcus aures dan Escherichia coli. Uji aktivitas antibakteri dalam penelitian ini menggunakan metode bioautografi. Bioautografi adalah suatu teknik untuk mendeteksi zat yang mempengaruhi tingkat pertumbuhan organisme uji dalam campuran yang kompleks dan matriks (Choma, 2005). Metode ini menggabungkan penggunaan tehnik kromatografi lapis tipis dengan respons dari Keterangan Gambar :
1 GKA1/4 6 GKA 7 11 GKB 5 16 GKD 5 21 GKBt 2
2 GKA 2 7 GKB 1 12 GKB 6 17 GKD 6 22 GKBt ¾
3 GKA 3 8 GKB 2 13 GKB 7 18 GKD 7 23 GKBt 5/6
4 GKA 5 9 GKB 3 14 GKD 2 19 GKD 8 PDB
mikroorganisme yang diuji berdasarkan aktivitas biologi suatu sampel yang memiliki aktivitas antibakteri (Kusumaningtyas, et al., 2008).
Aktivitas antibakteri positif ditunjukkan apabila terbentuk zona hambat berwarna putih di sekitar ekstrak pada latar pelat KLT berwarna merah setelah penyemprotan larutan IodoNitroTetrazolium (INT). Hal ini disebabkan karena terjadinya reaksi enzimatik antara larutan INT dengan bakteri, dimana INT yang awalnya tidak berwarna akan direduksi oleh enzim dehidrogenase yang terdapat pada bakteri sehingga berubah menjadi formazan yang berwarna merah. Hasil uji aktivitas antibakteri larutan ekstrak etil asetat dari jamur endofit ginseng kuning dan kontrol positif/ kloramfenikol dengan menggunakan metode bioautografi ditunjukkan pada Gambar 4.2. Sedangkan untuk mengetahui berapa besar kemampuan antibakteri dari ekstrak maka dilakukan pengukuran diameter zona hambat yang ditunjukkan pada Tabel 4.2.
(c) (d)
Gambar 4.2. Hasil Skrining Antibakteri dengan Metode Bioautografi (a) Skrining antibakteri 23 ekstrak etil asetat jamur terhadap bakteri uji Escherichia coli (b) Skrining antibakteri 23 ekstrak etil asetat jamur terhadap bakteri uji Staphylococcus aureus (c) Bioautografi kloramfenikol / kontrol (+) terhadap bakteri uji Staphylococcus aureus (d) Bioautografi kloramfenikol / kontrol (+) terhadap bakteri uji Escherichia coli.
Keterangan Gambar
5 GKA 6 - - - - Ket : (-) Tidak ada aktivitas antibakteri ; (+) Ada aktivitas antibakteri
(a) (b) (c) (d)
Gambar 4.3. Hasil bioautografi elusi ekstrak etil asetat jamur GKBt 2 (a) Hasil monitor KLT ekstrak etil asetat GKBt 2 pada UV 254 nm
(b) Hasil monitor KLT ekstrak etil asetat GKBt 2 pada UV 366 nm (c) KLT-Bioautografi ekstrak etil asetat GKBt 2 terhadap bakteri uji Staphylococcus aureus
(d) KLT-Bioautografi ekstrak terhadap bakteri Escherichia coli.
Berdasarkan hasil bioautografi elusi terhadap bakteri uji Staphylococcus aureus, diduga bahwa pada ekstrak etil asetat dari jamur endofit GKBt 2, senyawa dengan nilai Rf 0-0,24 tidak aktif sebagai antibakteri, karena tidak terbentuk zona hambat pada perlakuan uji bioautografi antibakteri secara elusi. Sedangkan senyawa dengan nilai Rf 0,25-1 diduga memiliki aktivitas sebagai antibakteri karena tebentuk zona hambat. Sedangkan, hasil bioautografi terhadap bakteri uji Escherichia coli menunjukkan bahwa senyawa dengan nilai Rf 0,18-1 diduga memiliki aktivitas sebagai antibakteri karena tebentuk zona hambat pada hasil pengujian aktivitas antibakteri dengan metode bioautografi.
4.3. Scaling Up Kultivasi Jamur Endofit GKBt 2 pada medium PDB ( Potato Dextrose Broth)
media Potato Dextrose Broth/PDB steril. Selain itu isolat juga diinokulasikan kedalam media PDA miring dan disimpan sebagai stok kultur.
Secara keseluruhan, semua erlenmeyer yang berisi media dan inokulan diinkubasi dalam kondisi yang sama yaitu pada suhu kamar dalam kondisi statis selama 3 minggu. Selama proses Scaling Up, terjadi perubahan warna media dari kuning menjadi merah tua, hal ini menunjukkan bahwa jamur GKBt 2 mampu tumbuh dan menghasilkan metabolit sekunder pada media PDB tersebut.
4.4. Ekstraksi Kultur Jamur Endofit Hasil Scaling Up
Untuk mengetahui senyawa dengan nilai Rf (Retardation Factor) mana saja yang aktif sebagai antibakteri pada hasil partisi, maka dilakukan bioautografi elusi. Hasil bioautografi elusi ditunjukkan pada Gambar 4.4.e, 4.4.f, 4.4.g, dan 4.4.h
(a) (b) (c) (d) (e) (f) (g) (h)
Gambar 4.4. Hasil Kromatografi Lapis Tipis (KLT) ekstrak scalling Up media PDB
(a) Profil KLT ekstrak etil asetat media GKBt 2 setelah penyemprotan serium sulfat
(b) Profil KLT Ekstrak etil asetat biomassa jamur endofit GKBt 2 setelah penyemprotan reagen serium sulfat
(c) Profil KLT hasil partisi ekstrak etil asetat biomassa jamur endofit GKBt2 dengan heksana
(d) Profil KLT hasil partisi ekstrak etil asetat biomassa jamur endofit GKBt2 dengan metanol setelah penyemprotan reagen serium sulfat (e) Hasil KLT bioautografi hasil partisi ekstrak etil asetat biomassa jamur GKBt 2 fraksi metanol melawan bakteri S.aureus
(f) Hasil KLT bioautografi hasil partisi ekstrak etil asetat biomassa jamur GKBt 2 fraksi Metanol melawan bakteri E.coli
(h) Hasil KLT bioautografi hasil partisi ekstrak etil asetat biomassa jamur GKBt 2 fraksi Heksan melawan bakteri E.coli.
Dari hasil bioautografi, diketahui bahwa aktivitas senyawa yang memiliki aktivitas antibakteri pada ekstrak jamur partisi metanol lebih besar dibandingkan dengan ekstrak jamur hasil partisi menggunakan heksana. Diduga pada ekstrak jamur hasil partisi dengan metanol, senyawa dengan nilai Rf 0,45-1 memiliki aktivitas sebagai antibakteri.
4.5. Fraksinasi Metabolit Ekstrak Etil Asetat Media GKBt 2
Ekstrak media GKBt 2 sebanyak 830 mg difraksinasi menggunakan kolom sephadex LH-20 dengan larutan pengelusi alkohol 96 %. Hal ini bertujuan untuk memisahkan antara senyawa yang memiliki bobot molekul tinggi dengan senyawa yang bobot molekulnya rendah. Sephadex LH-20 merupakan gel yang umum digunakan dalam isolasi bahan alam untuk senyawa yang bersifat non polar atau semi polar (Sarker, et al., 2006). Dari fraksinasi menggunakan kolom sephadex LH-20 menghasilkan 15 fraksi dengan bobot masing-masing fraksi yaitu 205 mg (F.1), 387 mg (F.2), 58,9 mg (F.3), 40,2 mg (F.4), 47 mg (F.5), 9,7 mg (F.6), 21 mg (F.7), 4,1 mg (F.8), 1,5 mg (F.9), 2,2 (F.10), 22,2 mg (F.11), 1,8 mg (F.12), 1,2 mg (F.13), 0,6 mg (F.14), 15,2 mg (F.15).
Gambar 4.5.Hasil fraksinasi F.5 menggunakan kromatografi kolom dengan Fase diam Silica gel 70-230 mesh.
Gambar 4.6. Noda bercak yang muncul pada pelat KLT preparatif setelah dielusi dengan eluen koroform:metanol 7:1
Fraksi F.5.8 sebanyak 9,8 mg dilanjutkan dengan purifikasi menggunakan kromatografi kolom preparatif. Sebelumnya, larutan fraksi dilarutkan dalam aseton dengan konsentrasi 5 mg/mL dan dioptimasi dengan eluen yang sesuai untuk mendapatkan kondisi optimum untuk preparatif pada pelat KLT. Eluen yang digunakan adalah kloroform : metanol dengan perbandingan 7:1. Hasil elusi dapat dilihat pada gambar 4.7