BAB I PENDAHULUAN
1.1 Latar Belakang
Sampai saat ini telah banyak pemanfaatan tanaman obat tradisional oleh masyarakat Indonesia untuk menanggulangi beberapa penyakit. Manfaat penggunaan obat tradisional tersebut secara luas telah dirasakan oleh masyarakat. Hal ini juga tercermin dengan semakin meningkatnya penggunaan obat tradisional, atau meningkatnya produksi obat dari industri-industri obat tradisional. Seiring dengan ada slogan “back to nature”, penggunaan obat tradisional menjadi alternatif pengobatan di samping obat modern. Pemanfaatan tanaman obat tersebut meliputi pencegahan, pengobatan maupun pemeliharaan kesehatan. Upaya pemanfaatan tanaman sebagai sumber suatu obat menjadi pilihan utama saat ini bagi para peneliti obat di Indonesia.
Manggis (Garcinia mangostana L.) merupakan tumbuhan yang berasal dari daerah Asia Tenggara meliputi Indonesia, Malaysia, Thailand, Myanmar, Vietnam dan Kamboja.Buah manggis banyak mengandung antiinflamasi dan antioksidan yang bagus untuk kesehatan tubuh. Di dunia buah ini dikenal memiliki kandungan antioksidan yang sangat tinggi.Didalam kulit buah manggis kaya akan senyawa kimia yang bersifat sebagai antioksidan antara lain antosianin, xanton, tanin dan asam fenolat. Senyawa xanton bersifat sebagai antioksidan dengan kadar yang tinggi terdapat dalam kulit buah manggis dan tidak ditemukan pada buah-buahan lainnya. Pemanfaatan kulit buah manggis yaitu dengan mengupas kulit manggis bagian terluar terlebih dahulu karena mengandung banyak tanin yang memiliki efek menyamak dan bila dikonsumsi dapat menutup pori-pori sel usus yang dapat mengakibatkan usus kejang dan memicu terjadinya muntah hingga diare. Kemampuan antioksidan manggis melebihi vitamin C dan E yang selama ini dikenal sebagai antioksidan yang paling efektif. Antioksidan merupakan senyawa yang dapat menetralkan radikal bebas melalui perlindungan terhadap protein, sel, jaringan dan organ-organ tubuh. Antioksidan telah terbukti dapat mencegah penuaan dini (anti aging), mencegah penyakit jantung, mencegah berbagai jenis kanker, mencegah kebutaan dan meningkatkan kekebalan tubuh.
1.2 Rumusan Masalah
Rumusan masalah dari percobaan ekstraksi kulit manggis yaitu mengetahui manfaat kandungan antioksida yang terdapat pada buah manggis.
1.3 Tujuan Percobaan
Adapun tujuan dari percobaan ini adalah mengetahui proses ekstraksi suatu zat dari bahan yang terdapat dialam.
1.4 Ruang lingkup percobaan
Metode yang digunakan dalam percobaan ini yaitu metode ekstraksi dengan bahan utama yaitu kulit buah manggis dan etanol. Percobaan ini dilakukan di Laboratorium Rekayasa Produk dan Integrasi Proses Fakultas Teknik Universitas Sultan Ageng Tirtayasa.
BAB II
2.1 Pemisahan Campuran
Campuran dapat dipisahkan dengan menggunakan berbagai macam metode. Metode-metode tersebut, yaitu pengayakkan, penyaringan, sentrifugasi, evaporasi, pemisahan campuran dengan menggunakan magnet, sublimasi, destilasi, corong pisah, dan kromatografi. Metode dekantasi digunakan untuk memisahkan campuran yang penyusunnya berupa cairan dan padatan. Dalam hal ini, ukuran padatan cukup besar sehingga mengendap di bagian bawah cairan. Dekantasi dilakukan dengan menuang cairan ke wadah lain secara hati-hati supaya padatan terpisah dari campuran. Untuk mempermudah proses dekantasi, dapat digunakan pengaduk pada saat menuang cairan. Dengan demikian, cairan tidak mengalir keluar wadah dan dapat terpisah dari padatan dengan baik. Namun, metode ini tidak dapat memisahkan cairan dan padatan secara sempurna. Hal ini disebabkan kadang-kadang masih ada cairan yang tersisa dalam wadah semula. Bisa juga terjadi, sebagian padatan ikut masuk ke dalam wadah baru.
Kebanyakan materi yang terdapat di bumi ini tidak murni, tetapi berupa campuran dari berbagai komponen. Contohnya, tanah terdiri dari berbagai senyawa dan unsur baik dalam wujud padat, cair dan gas. Untuk memperoleh zat murni kita harus memisahkannya dari campurannya. Campuran dapat dipisahkan memlalui peristiwa fisika atau kimia, satu komponen atau lebih direaksikan dengan zat lain sehingga dapat dipisahkan. Cara atau teknik pemisahan campuran pada jenis, wujud dan sifat komponen yang terkandung di dalamnya. Jika komponen berwujud padat dan cair, misalnya pasir dan air, dapat dipisahkan dengan saringan. Saringan bermacam-macam, mulai dari porinya yang besar sampai yang sangat halus, contohnya kertas saring dan selaput semipermeabel. Kertas saring dipakai untuk memisahkan endapan atau padatan dari pelarutnya. Campuran homogen, seperti alkohol dalam air, tidak dapat dipisahkan dengan saringan, karena partikelnya lolos dalam pori-pori kertas saring da selaput semipermeabel. Campuran seperti itu dapat dipisahkan dengan cara fisika yaitu destilasi, rekristalisasi, ekstraksi dan kromatografi.[1]
yang akan dipisah berwujud padat dan yang lainnya cair pada suhu kamar. Contohnya garam dapat dipisahkan dari air karena garam berupa padatan. Air garam bila dipanaskan perlahan dalam bejana terbuka, maka air akan menguap sedikit demi sedikt. Pemanasan dihentikan saat larutan tepat jenuh. Jika dibiarkan akhirnya terbentuk kristal gara secara perlahan. Setelah pengkristalan sempurna, garam dapat dipisahkan dengan menyaring.
Seperti halnya dekantasi, proses penyaringan juga digunakan untuk memisahkan campuran yang zat penyusunnya cairan dan padatan. Bedanya, ukuran padatan cukup kecil sehingga tidak mengendap di dasar cairan, tetapi tersebar pada cairan. Jika campuran jenis ini dipisahkan dengan dekantasi, maka padatan dan cairan tidak terpisah dengan baik. Untuk itu dilakukan penyaringan. Penyaringan dilakukan dengan menuang campuran ke atas kertas saring dari sebuah corong gelas. Kertas saring akan menahan padatan yang lebih besar dari pada ukuran lubang saring. Padatan yang tertinggal pada kertas saring ini disebut residu. Sementara zat dengan ukuran partikel lebih kecil dari ukuran lubang saring akan lolos melalui kertas saring. Zat yang dapat melewati kertas saring ini disebut filtrat.
2.2 Ekstraksi
Ekstraksi adalah suatu proses pemisahan dari bahan padat maupun cair dengan bantuan pelarut. Pelarut yang digunakan harus dapat mengekstrak substansi yang diinginkan tanpa melarutkan material lainnya. Pelarut yang paling sering digunakan adalah dietil eter C2H5OC2H5, yang memiliki titik didih rendah (sehingga mudah disingkirkan) dan dapat melarutkan berbagai senyawa organik.
digunakan peralatan yang rumit, namun seringkali hanya diperlukan sebuah corong pisah. Seringkali suatu permisahan ekstrasi pelarut dapat diselesaikan dalam beberapa menit.
Ekstraksi merupakan proses pemisahan, penarikan atau pengeluaran suatu komponen cairan/campuran dari campurannya. Biasanya menggunakan pelarut yang sesuai dengan komponen yang diinginkan. Cairan dipisahkan dan kemudian diuapkan sampai pada kepekatan tertentu. Ekstraksi memanfaatkan pembagian suatu zat terlarut antar dua pelarut yang tidak saling tercampur untuk mengambil zat terlarut tersebut dari satu pelarut ke pelarut lain.
Ekstraksi memegang peranan penting baik di laboratorium maupun industri. Di laboratorium, ekstraksi seringkali dilakukan untuk menghilangkan atau memisahkan zat terlarut dalam larutan dengan pelaurt air yang diekstraksi dengan pelarut lain seperti eter, kloroform, karbondisulfida atau benzena.
Tujuan ekstraksi adalah untuk menarik semua komponen kimia yang terdapat dalam simplisia. Ekstraksi ini didasarkan pada perpindahan massa komponen zat padat ke dalam pelarut dimana perpindahan mulai terjadi pada lapisan antar muka, kemudian berdifusi masuk ke dalam pelarut. Secara umum, terdapat empat situasi dalam menentukan tujuan ekstraksi
Senyawa kimia telah diketahui identitasnya untuk diekstraksi dari organisme. Dalam kasus ini, prosedur yang telah dipublikasikan dapat diikuti dan dibuat modifikasi yang sesuai untuk mengembangkan proses atau menyesuaikan dengan kebutuhan pemakai.
Bahan diperiksa untuk menemukan kelompok senyawa kimia tertentu, misalnya alkaloid, flavanoid atau saponin, meskipun struktur kimia sebetulnya dari senyawa ini bahkan keberadaannya belum diketahui. Dalam situasi seperti ini, metode umum yang dapat digunakan untuk senyawa kimia yang diminati dapat diperoleh dari pustaka. Hal ini diikuti dengan uji kimia atau kromatografik yang sesuai untuk kelompok senyawa kimia tertentu
Sifat senyawa yang akan diisolasi belum ditentukan sebelumnya dengan cara apapun. Situasi ini (utamanya dalam program screening) dapat timbul jika tujuannya adalah untuk menguji organisme, baik yang dipilih secara acak atau didasarkan pada penggunaan tradisional untuk mengetahui adanya senyawa dengan aktivitas biologi khusus.[2]
2.3 Macam-macam Ekstraksi
Teknik ekstraksi dapat dibedakan menjadi tiga cara yaitu ekstraksi bertahap (batch-extraction = ekstraksi sederhana), ekstraksi kontinyu (ekstraksi berkesinambungan), dan ekstraksi arah berlawanan (counter current extraction). Ekstraksi bertahap merupakan cara yang paling sederhana. Caranya cukup dengan menambahkan pelarut pengekstraksi yang tidak bercampur dengan pelarut semula kemudian dilakukan pengocokan sehingga terjadi keseimbangan konsentrasi zat yang akan diekstraksi pada kedua lapisan, setelah ini tercapai lapisan didiamkan dan dipisahkan. Dalam ekstraksi ini pada tiap tahap selalu dipakai pelarut yang baru sampai proses ekstraksi selesai.
Ekstraksi kontinyu digunakan bila perbandingan distribusi relaitf kecil sehingga untuk pemisahan yang kuantitatif diperlukan beberapa tahap ekstraksi. Efesiensi yang tinggi pada ekstraksi tergantung pada viskositas fase dan faktor-faktor lain yang mempengaruhi kecepatan tercapainya suatu kesetimbangan, salah satu diantaranya adalah dengan menggunakan luas kontak yang besar. Dalam ekstraksi ini pelarut yang sama dipakai berulang-ulang sampai proses ekstraksi selesai.
Ekstraksi kontinyu counter current, fase cair pengekstraksi dialirkan dengan arah yang berlawanan dengan larutan yang mengandung zat yang akan diekstraksi. Biasanya digunakan untuk pemisahan zat, isolasi atau pemurnian.Sangat penting untuk fraksionasi senyawa orgnik tetapi kurang bermanfaat untuk senyawa-senyawa anorganik.[3]
Disamping itu, berdasarkan bentuk campuran yang diekstraksi, dapat dibedakan dua macam ekstraksi yaitu :
a) Ekstraksi padat-cair
proses yang bersifat fisik, karena komponen terlarut kemudian dikembalikan lagi ke keadaan semula tanpa mengalami perubahan kimiawi.
Ekstraksi dari bahan padat dapat dilakukan jika bahan yang diinginkan dapat larut dalam solvent pengekstraksi. Padatan yang akan diekstrak dilembutkan terlebih dahulu, dapat dengan cara ditumbuk atau dapat juga di iris-iris menjadi bagian-bagian yang tipis. Kemudian padatan yang telah halus di bungkus dengan kertas saring dan dimasukkan kedalam alat ekstraksi soxhlet. Pelarut organik dimasukkan ke dalam labu godog. Kemudian peralatan ekstraksi di rangkai dengan pendingin air. Ekstraksi dilakukan dengan memanaskan pelarut organik sampai semua analit terekstrak.
b) Ekstraksi cair-cair
Ekstraksi cair-cair jika substansi yang diekstraksi terdapat di dalam campurannya yang berbentuk cair. Merupakan metode pemisahan yang baik karena pemisahan ini dapat dilakukan dalam tingkat makro dan mikro. Dan yang menjadi pokok pembahasan dalam ekstraksi cair-cair ini adalah kedua fasa yang dipisahkan merupakan cairan yang tidak saling tercampur. Prinsip metode ini didasarkan pada distribusi zat terlarut dengan perbandingan tetentu antara dua pelarut yang tidak saling bercampur seperti benzene dan kloroform. Ekstraksi cair-cair digunakan sebagai cara untuk praperlakuan sampel atau clean-up sampel untuk memisahkan analit-analit dari komponen-komponen matriks yang mungkin menganggu pada saat kuantifikasi atau deteksi analit. Kebanyakan prosedur ekstraksi cair-cair melibatkan ekstraksi analit dari fasa air kedalam pelarut organik yang bersifat non-polar atau agak polar seperti n-heksana, metil benzene atau diklorometana. Meskipun demikian, proses sebaliknya juga mungkin terjadi. Analit-analit yang mudah tereksitasi dalam pelarut organik adalah molekul-molekul netral yang berikatan secara kovalen dengan konstituen yang bersifat non-polar atau agak polar.
Selain itu, Ekstraksi diklasifikasikan berdasarkan jenis sistem yang bekerja yakni sebagai berikut :
a) Ekstraksi Kelat
b) Ekstraksi Solvasi
Ialah ekstraksi dimana zat yang dekstraksi disolvasikan ke fasa organik. Contohnya ekstraksi Fe(ll) dari asam klorida dengan Dietil eter atau ekstraksi uranium dari media asam nitrat dengan Tributil Phosfat. Kedua ekstraksi dapat terjadi karena solvasi logam ke fasa organik.
c) Ekstraksi pembentukan pasangan ion
Ekstraksi ini berlangsung melalui pembentukan senyawa netral (yang tidak bermuatan) kemudian diekstraksi ke fasa organik. Contohnya Ekstraksi Scandium atau Uranium dengan Trioktil Amina. Pada ekstraksi ini terbentuk senyawa netral antara Uranium atau Scandium dalam larutan asam dengan amina mempunyai berat molekul besar.
d) Ekstraksi sinergis (efek saling memperkuat)
Keadaan ini diakibatkan oleh penambahan suatu pelarut pengekstraksi yang lain kepada sistem ekstraksi. Contohnya ekstraksi uranium dengan Tributil Phosfat (TBP) bersama-sama dengan 2-Thenoyl Trifluoro Aceton (TTA). Masing – masing dapat mengekstraksi uranium tetapi dengan menggunakan campuran dari dua pelarut tersebut dapat terjadi kenaikkan pada hasil ekstraksi.
2.4 Metode Ekstraksi
Berdasarkan prosesnya, metode estraksi terbagi menjadi 2 kelompok yakni metode secara dingin dan panas yang dijelaskan sebagai berikut : 1) Ekstraksi Secara Dingin
a) Metode Maserasi
Maserasi merupakan cara penyarian sederhana yang dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari selama beberapa hari pada temperatur kamar dan terlindung dari cahaya. Metode maserasi digunakan untuk menyari simplisia yang mengandung komonen kimia yang mudah larut dalam cairan penyari, tidak mengandung benzoin, tiraks dan lilin.
antara larutan di luar sel dan di dalam sel. Selama proses maserasi dilakukan pengadukan dan penggantian cairan penyari setiap hari. Endapan yang diperoleh dipisahkan dan filtratnya dipekatkan.
Keuntungan dari metode ini adalah peralatannya sederhana. Sedang kerugiannya antara lain waktu yang diperlukan untuk mengekstraksi sampel cukup lama, cairan penyari yang digunakan lebih banyak, tidak dapat digunakan untuk bahan-bahan yang mempunyai tekstur keras seperti benzoin, tiraks dan lilin.
b) Metode Perkolasi
Perkolasi adalah cara penyarian dengan mengalirkan penyari melalui serbuk simplisia yang telah dibasahi. Keuntungan metode ini adalah tidak memerlukan langkah tambahan yaitu sampel padat telah terpisah dari ekstrak. Penyarian zat aktif yang dilakukan dengan cara serbuk simplisia dimaserasi selama 3 jam, kemudian simplisia dipindahkan ke dalam bejana silinder yang bagian bawahnya diberi sekat berpori, cairan penyari dialirkan dari atas ke bawah melalui simplisia tersebut, cairan penyari akan melarutkan zat aktif dalam sel-sel simplisia yang dilalui sampai keadan jenuh. Gerakan ke bawah disebabkan oleh karena gravitasi, kohesi, dan berat cairan di atas dikurangi gaya kapiler yang menahan gerakan ke bawah. Perkolat yang diperoleh dikumpulkan, lalu dipekatkan. Kerugiannya adalah kontak antara sampel padat tidak merata atau terbatas dibandingkan dengan metode refluks, dan pelarut menjadi dingin selama proses perkolasi sehingga tidak melarutkan komponen secara efisien.[4]
2) Ekstraksi Secara Panas a) Metode Sokletasi
telah mencapai permukaan sifon, seluruh cairan akan turun kembali ke labu alas bulat melalui pipa kapiler hingga terjadi sirkulasi. Ekstraksi sempurna ditandai bila cairan di sifon tidak berwarna, tidak tampak noda jika di KLT, atau sirkulasi telah mencapai 20-25 kali. Ekstrak yang diperoleh dikumpulkan dan dipekatkan.
Keuntungan metode ini adalah dapat digunakan untuk sampel dengan tekstur yang lunak dan tidak tahan terhadap pemanasan secara langsung,digunakan pelarut yang lebih sedikit dan pemanasannya dapat diatur.
Kerugian dari metode ini yaitu karena pelarut didaur ulang, ekstrak yang terkumpul pada wadah di sebelah bawah terus-menerus dipanaskan sehingga dapat menyebabkan reaksi peruraian oleh panas, jumlah total senyawa-senyawa yang diekstraksi akan melampaui kelarutannya dalam pelarut tertentu sehingga dapat mengendap dalam wadah dan membutuhkan volume pelarut yang lebih banyak untuk melarutkannya,bila dilakukan dalam skala besar, mungkin tidak cocok untuk menggunakan pelarut dengan titik didih yang terlalu tinggi, seperti metanol atau air, karena seluruh alat yang berada di bawah komdensor perlu berada pada temperatur ini untuk pergerakan uap pelarut yang efektif,metode ini terbatas pada ekstraksi dengan pelarut murni atau campuran azeotropik dan tidak dapat digunakan untuk ekstraksi dengan campuran pelarut, misalnya heksan :diklormetan = 1 : 1, atau pelarut yang diasamkan atau dibasakan, karena uapnya akan mempunyai komposisi yang berbeda dalam pelarut cair di dalam wadah.[5]
b) Metode Refluks
Metode Reflux merupakan metode ektraksi cara panas (membutuhkan pemanasan pada prosesnya), secara umum pengertian refluks sendiri adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut yang ralatif konstan dengan adanya pendingin balik. Ekstraksi dengan cara ini pada dasarnya adalah ekstraksi berkesinambungan.
akan didinginkan dengan kondensor sehingga pelarut yang tadinya dalam bentuk uap akan mengembun pada kondensor dan turun lagi ke dalam wadah reaksi sehingga pelarut akan tetap ada selama reaksi berlangsung.
Keuntungan dari metode ini adalah digunakan untuk mengekstraksi sampel-sampel yang mempunyai tekstur kasar dan tahan pemanasan langsung. Kerugiannya adalah membutuhkan volume total pelarut yang besar dan sejumlah manipulasi dari operator.
c) Metode Destilasi Uap
Distilasi uap digunakan pada campuran senyawa-senyawa yang memiliki titik didih mencapai 200 °C atau lebih. Destilasi uap adalah metode yang popular untuk ekstraksi minyak-minyak menguap
(esensial) dari sampel tanaman
Metode destilasi uap air diperuntukkan untuk menyari simplisia yang mengandung minyak menguap atau mengandung komponen kimia yang mempunyai titik didih tinggi pada tekanan udara normal.
Penyarian minyak menguap dengan cara simplisia dan air ditempatkan dalam labu berbeda. Air dipanaskan dan akan menguap, uap air akan masuk ke dalam labu sampel sambil mengekstraksi minyak menguap yang terdapat dalam simplisia, uap air dan minyak menguap yang telah terekstraksi menuju kondensor dan akan terkondensasi, lalu akan melewati pipa alonga, campuran air dan minyak menguap akan masuk ke dalam corong pisah, dan akan memisah antara air dan minyak atsiri.
2.5 Destilasi
Salah satu penerapan terpenting dari metode destilasi adalah pemisahan minyak mentah menjadi bagian-bagian untuk penggunaan khusus seperti untuk transportasi, pembangkit listrik, pemanas, dan lain-lain. Udara didistilasi menjadi komponen-komponen seperti oksigen untuk penggunaan medis dan helium untuk pengisi balon. Destilasi juga telah digunakan sejak lama untuk pemekatan alkohol dengan penerapanpanas terhadap larutan hasil fermentasi untuk menghasilkan minuman suling.
Zat yang memiliki titik didih lebih rendah akan menguap lebih dulu. Metode ini termasuk sebagaiunit operasi kimia jenis perpindahan massa. Penerapan proses ini didasarkan pada teori bahwa pada suatu larutan, masing-masing komponen akan menguap pada titik didihnya. Model ideal destilasi didasarkan pada Hukum Raoult dan Hukum Dalton.
Ada 4 jenis distilasi yang akan dibahas disini, yaitu destilasi sederhana, destilasi fraksionasi, destilasi uap, dan destilasi vakum. Selain itu, ada pula destilasi azeotropis. [6]
1) Destilasi Sederhana
Pada destilasi sederhana, dasar pemisahannya adalah perbedaan titik didih yang jauh atau dengan salah satu komponen bersifat volatil. Jika campuran dipanaskan maka komponen yang titik didihnya lebih rendah akan menguap lebih dulu. Selain perbedaan titik didih, juga perbedaan kevolatilan, yaitu kecenderungan sebuah substansi untuk menjadi gas. Destilasi ini dilakukan pada tekanan atmosfer. Aplikasi destilasi sederhana digunakan untuk memisahkan campuran air dan alkohol.
2) Destilasi Fraksionasi
Fungsi destilasi fraksionasi adalah memisahkan komponen-komponen cair, dua atau lebih, dari suatu larutan berdasarkan perbedaan titik didihnya. Destilasi ini juga dapat digunakan untuk campuran dengan perbedaan titik didih kurang dari 20 °C dan bekerja pada tekanan atmosfer atau dengan tekanan rendah. Aplikasi dari destilasi jenis ini digunakan pada industri minyak mentah, untuk memisahkan komponen-komponen minyak.
Perbedaan destilasi fraksionasi dan destilasi sederhana adalah adanya kolom fraksionasi.Di kolom ini terjadi pemanasan secara bertahap dengan suhu yang beda pada setiap platnya. Pemanasan yang berbeda-beda ini bertujuan untuk pemurnian distilat yang lebih dari plat-plat di bawahnya Semakin ke atas, semakin tidak volatil cairannya.
3) Destilasi Uap
dari distilasi uap adalah untuk mengekstrak beberapa produk alam seperti minyak eucalyptus dari eucalyptus, minyak sitrus dari lemon atau jeruk. Campuran dipanaskan melalui uap air yang dialirkan ke dalam campuran dan mungkin ditambah juga dengan pemanasan. Uap dari campuran akan naik ke atas menuju ke kondensor dan akhirnya masuk ke labu destilat. 4) Destilasi Vakum
Destilasi vakum biasanya digunakan jika senyawa yang ingin didestilasi tidak stabil, dengan pengertian dapat terdekomposisi sebelum atau mendekati titik didihnya atau campuran yang memiliki titik didih di atas 150 °C. Metode destilasi ini tidak dapat digunakan pada pelarut dengan titik didih yang rendah jika kondensornya menggunakan air dingin, karena komponen yang menguap tidak dapat dikondensasi oleh air. Untuk mengurangi tekanan digunakan pompa vakum atau aspirator. Aspirator berfungsi sebagai penurun tekanan pada sistem distilasi ini. 5) Destilasi Azeotrop
Azeotrop adalah campuran dari dua atau lebih komponen yang memiliki titik didih yang konstan. Azeotrop dapat menjadi gangguan yang menyebabkan hasil distilasi menjadi tidak maksimal. Komposisi dari azeotrope tetap konstan dalam pemberian atau penambahantekanan. Akan tetapi ketika tekanan total berubah, kedua titik didih dan komposisi dari azeotrop berubah. Sebagai akibatnya, azeotrop bukanlah komponen tetap, yang komposisinya harus selalu konstan dalam interval suhu dan tekanan, tetapi lebih ke campuran yang dihasilkan dari saling memengaruhi dalam kekuatan intramolekuler dalam larutan.Azeotrop dapat didestilasi dengan menggunakan tambahan pelarut tertentu, misalnya penambahan benzena atau toluena untuk memisahkan air. Air dan pelarut akan ditangkap oleh penangkap Dean-Stark. Air akan tetap tinggal di dasar penangkap dan pelarut akan kembali ke campuran dan memisahkan air lagi.
2.6 Buah Manggis
Buah manggis berbentuk bulat dan berjuring (bercupat), sewaktu ,asih muda permukaan kulit buah berwarna hujau namun setelah tua atau matang berubah menjadi ungu kemerah - merahan atau merah muda. Pada bagian ujung buah terdapat juring atau cupat berbentuk bintang sekaligus menunjukkan cirri dari jumlah segmen daging buah, jumlahjuring buah ini berkisar 5 – 8 buah.[7]
2.7 Kandungan Kimia Manggis
Kulit buah manggis (Garcinia mangostana L.) mengandung flavonoid, xanton dan derivatnya, dan tannin. Senyawa metabolit sekunder yang bersifat bioaktif terbesar adalah senyawa xanton dan turunannya. Alfa-mangostin (α-mangostin) dan gamma-mangostin (γ-(α-mangostin) merupakan senyawa bioaktif xanton yang utama. Senyawa xanton lain yang terdapat dalam kulit buah manggis adalah β-mangostin, gartanin, 8-deoxygartanin dan isomangostin.
Senyawa xanton yang terkandung di dalam kulit manggis ini merupakan senyawa fenolik yang tergolong dalam kelas polifenol, yang memiliki aktivitas antioksidan dan manfaat lainnya dalam bidang kesehatan.
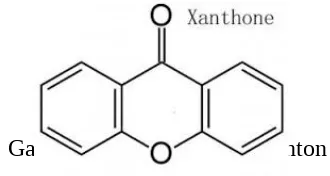
2.8 Xanton
Xanton adalah kelompok senyawa bioaktif yang mempunyai struktur cincin 6 karbon dengan kerangka karbon lengkap. Struktur inimenjadikan xanton bersifat stabil. Xanton merupakan kelas utama fenol dalam tanaman. Turunan xanton yang paling banyak terdapat dalam kulit manggis adalah α
-mangostin. Selain komposisinya yang banyak, α -mangostin juga memiliki aktivitas biologi yang paling banyak. [8]
Gambar 1. Struktur dasar Xanton
2.9 Alfa mangostin
molekul C23H26O6 dengan berat molekul sebesar 410.45964. Alfa mangostin
memilki nama IUPAC 1,3,6-Trihydroxy-7-methoxy-2,8-bis(3-methylbut-2-en-1-yl)-9H-xanthen-9-one.
Gambar 2. Struktur Alfa-Mangostin
Dalam penelitian disebutkan bahwa alfa-mangostin memiliki berbagai macam bioaktivitas dan merupakan mayor coumpound dalam ekstrak kulit manggis. Alfa-mangostin memiliki aktivitas sebagai antioksidan,anti-inflamasi, anti malaria, anti tumor, anti alergi, anti bakteri, anti fungi dan anti kanker.[9]
2.10 Etanol
Etanol, disebut juga etil alkohol, alkohol murni, alkohol absolut, atau alkohol saja, adalah sejenis cairan yang mudah menguap, mudah terbakar, tak berwarna, dan merupakan alkohol yang paling sering digunakan dalam kehidupan sehari-hari. Senyawa ini merupakan obat psikoaktif dan dapat ditemukan pada minuman beralkohol dan termometer modern. Etanol adalah salah satu obat rekreasi yang paling tua.
Etanol termasuk ke dalam alkohol rantai tunggal, dengan rumus kimia C2H5OH dan rumus empirisC2H6O. Ia merupakan isomer konstitusional dari dimetil eter. Etanol sering disingkat menjadi EtOH, dengan "Et" merupakan singkatan dari gugus etil (C2H5).
Fermentasi gula menjadi etanol merupakan salah satu reaksi organik paling awal yang pernah dilakukan manusia. Efek dari konsumsi etanol yang memabukkan juga telah diketahui sejak dulu. Pada zaman modern, etanol yang ditujukan untuk kegunaan industri seringkali dihasilkan dari etilena.
Adapun sifat-sifat fisik dan kimia etanol sebagai berikut[10]: 1) Sifat Fisik
Kadar : 95,63%
Wujud : Cairan tidak berwarna
Berat molekul : 46,07 g/mol
Titik didih : 78,5 ℃
Titik lebur : -114,1 ℃
2) Sifat Kimia
Reaksi asam-basa
Etanol dapat diubah menjadi konjugat basanya, ion etoksida (CH3CH2O−), dengan mereaksikannya dengan logam alkali seperti natrium:
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
Halogenasi
Etanol bereaksi dengan hidrogen halida dan menghasilkan etil halida seperti etil klorida dan etil bromida:
CH3CH2OH + HCl → CH3CH2Cl + H2O
Reaksi dengan HCl memerlukan katalis seperti seng klorida.
Pembentukan Ester
Kondisi di bawah katalis asam, etanol bereaksi dengan asam karboksilat dan menghasilkan senyawa etil eter dan air:
RCOOH + HOCH2CH3 → RCOOCH2CH3 + H2O.
Agar reaksi ini menghasilkan rendemen yang cukup tinggi, air perlu dipisahkan dari campuran reaksi seketika ia terbentuk.
Etanol juga dapat membentuk senyawa ester dengan asam anorganik. Dietil sulfat dan trietil fosfat dihasilkan dengan mereaksikan etanol dengan asam sulfat dan asam fosfat. Senyawa yang dihasilkan oleh reaksi ini sangat berguna sebagai agen etilasi dalam sintesis organik.
BAB III
METODOLOGI PERCOBAAN
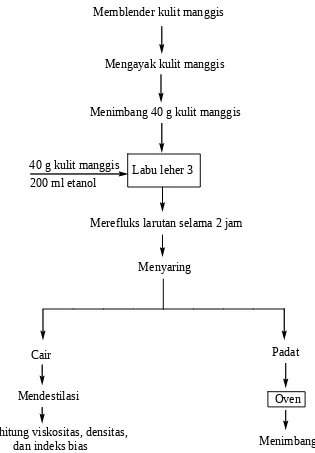
3.1 Diagram Alir
Menimbang 40 g kulit manggis
Labu leher 3 Mengayak kulit manggis
40 g kulit manggis 200 ml etanol
Merefluks larutan selama 2 jam
Menyaring
Padat Cair
Oven
Menimbang Mendestilasi
Menghitung viskositas, densitas, dan indeks bias
Memblender kulit manggis
Gambar 3. Diagram alir percobaan ekstraksi 3.2 Alat dan Bahan
3.2.1 Alat
Berikut alat-alat yang digunakan dalam percobaan: a. Alat ekstraksi refluks 1 buah
b. Alat destilasi 1 buah c. Alumunium foil 1 buah
e. Corong 2 buah
f. Erlenmeyer 2 buah
g. Gelas beker 500 ml 1 buah h. Gelas Ukur 100 ml 1 buah
i. HotPlate 1 buah
j. Kaca arloji 1 buah
k. Kertas saring 2 buah
l. Piknometer 1 buah
m. Pipet 2 buah
n. Timbangan 1 buah
o. Termometer 1 buah
p. Viskometer 1 buah
3.2.2 Bahan
Berikut bahan-bahan yang digunakan dalam percobaan a. Etanol
b. Kulit manggis
3.3 Prosedur Percobaan
Prosedur percobaan pada praktikum kali ini, yang pertama kali dilakukan adalah memblender kulit manggis. Kemudian mengayak kulit manggis. Lalu menimbang kulit manggis seberat 40 gram. Kemudian memasukkan 40 gram kulit manggis dan 200 ml etanol ke dalam labu leher tiga. Kemudian merefluks larutan selama 2 jam. Kemudian menyaring larutan hingga terbentuk 2 fase hasil, padat dan cair. Untuk hasil yang cair, mendestilasi larutan dan menghitung viskositas, densitas, dan indeks bias. Untuk yang padat, menaruhnya dalam oven, kemudian menimbang hasilnya.
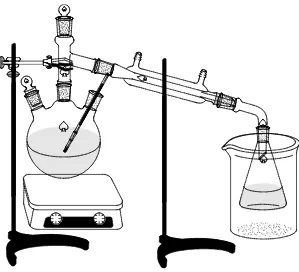
3.4 Gambar Alat
Gambar 4. Rangkaian Alat Destilasi
3.5 Variabel Percobaan