Penggunaan Metode Biologis Dan Nilai Impedansi Untuk Deteksi Daging Ayam Bangkai
Teks penuh
Gambar
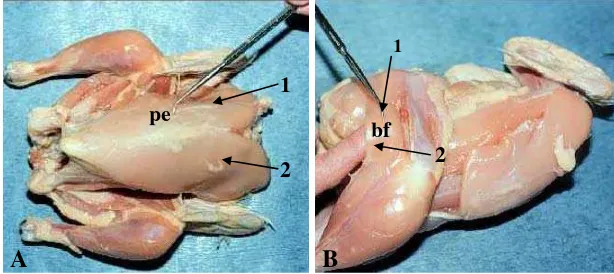
Dokumen terkait
Nilai pH berhubungan dengan kemampuan suatu produk untuk mengikat air, kesan jus daging, keempukan juga berhubungan dengan produk rataan nilai pH, Jumlah
Marinasi daging paha ayam menggunakan ekstrak buah pepaya dengan waktu yang berbeda memberikan perbedaan yang nyata terhadap aroma dan tingkat keempukan Perlakuan
Y ij = Kadar protein, kadar air, kadar lemak, WHC, dan pH dari daging ayam Kampung Persilangan yang memperoleh perlakuan ke -i dan ulangan ke – j. µ = Nilai rataan hasil
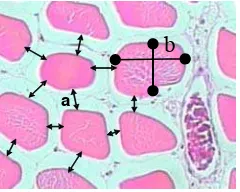
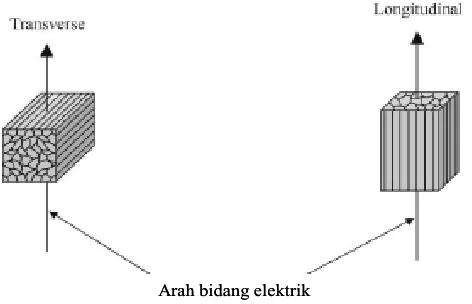
Mantawa (dalam kotak jingga) nilai impedansi akustik relatif kecil (defleksi kekiri) kemudian diapit dengan nilai impedansi akusik yang besar di atas dan bawah atau pada
Nilai impedansi akustik tertinggi terdapat pada sampel dengan desain permukaan berlubang yaitu 1,27 kg/m 2 s pada frekuensi 1000 Hz yang artinya saat gelombang bunyi
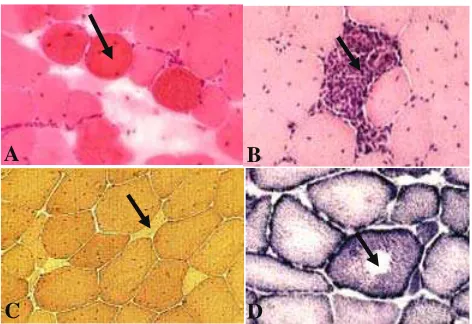
■ SIMPULAN Citra ultrasonografi maupun tomografi impedansi listrik mampu menunjukkan perbedaan komposisi lemak dalam otot berbeda pada ketiga jenis daging sapi potongan komer- sial
Berdasarkan penelitian ini akan dibuat suatu sistem pengolahan citra untuk mencari nilai daging ayam busuk dan daging ayam segar menggunakan metode Gray Level Co-occurrence Matrix GLCM,
Kadar Kolesterol Daging Tabel 5 menunjukkan hasil bahwa rataan kadar kolesterol daging ayam broiler perlakuan kontrol R0 sebesar 269,83 ± 1,29 mg/100g, perlakuan dengan penggunaan