Pemanfaatan Silika Mesopori MCM-48 Termodifikasi 3-Aminopropiltrimetoksisilan Sebagai Adsorben Logam Berat Ni(II)
Mashyta Dwi Pratiwia, Paulina Tabab, Yusafir Halab a
Laboratorium Kimia Fisika, Jurusan Kimia, Fakultas MIPA, Universitas Hasanuddin
b
Jurusan Kimia, Fakultas MIPA, Universitas Hasanuddin, jl. Perintis Kemerdekaan KM 10 Tamalanrea, Makassar, Indonesia 90245
ABSTRAK
Penelitian modifikasi silika mesopori MCM-48 menggunakan senyawa 3-APTMS telah berhasil dilakukan yang dikarakterisasi menggunakan Difraksi Sinar-X (XRD) dan
spektrofotometer FTIR. Hasil modifikasinya (NH2-MCM-48) dapat digunakan untuk
mengadsorpsi ion logam Ni(II). Adsorpsi ion Ni(II) dipelajari dengan variasi waktu kontak, pH, dan konsentrasi. Isotermal yang digunakan untuk mempelajari adsorpsi ion Ni(II) oleh
NH2-MCM-48 yaitu isotermal Langmuir dan Freundlich. Hasil penelitian menunjukkan bahwa
adsorpsi ion Ni(II) oleh NH2-MCM-48 sesuai dengan reaksi orde satu semu dan mengikuti
isotermal Langmuir dengan nilai kapasitas adsorpsi sebesar 25,4453 mg/g atau 0,4334 mmol/g. Adapun isotermal Freundlich diperoleh nilai kapasitas adsorpsi sebesar 11,8905 mg/g atau 0,2025 mmol/g.
Kata kunci: Adsorpsi, MCM-48, NH2-MCM-48, Ni(II)
ABSTRACT
The research of modification of MCM-48 mesophorous silica by using 3-APTMS compunds has been successfully done which were characterized by using X-Ray Diffraction
(XRD) and FTIR spectrophotometer. The modification results (NH2-MCM-48) can be used to
adsorb metals ion Ni(II). The adsorption ion Ni(II) was studied by the various contact time, pH,
and concentration. The isothermal adsorption which is used to study ion Ni(II) by NH2-MCM-48
is isothermal Langmuir and Freundlich. The result of the research shows that the adsorption of
ion Ni(II) by NH2-MCM-48 in accordance with one orde reaction and in accordance with the
Langmuir isothermal with adsorption capacity value of 25,4453 mg/g or 0,4334 mmol/g, while the Freundlich isotherm obtains the adsorption capacity value of 11,8905 mg/g or mmol/g.
Key words: Adsorption, MCM-48, NH2-MCM-48, Ni(II)
PENDAHULUAN
Pencemaran logam berat akibat limbah industri merupakan salah satu masalah serius yang terjadi di lingkungan perairan. Hal ini disebabkan karena logam berat dalam perairan tidak dapat didegradasi
secara biologi dan akan terakumulasi ke lingkungan, mengendap di dasar perairan membentuk senyawa kompleks bersama
bahan organik dan anorganik, serta
hidup di perairan tersebut (Rochyatun dan Rozak, 2007). Nikel merupakan salah satu logam berat yang berbahaya bagi kesehatan manusia dan lingkungan. Pada konsentrasi
toksik, nikel dapat meracuni darah,
mengganggu sistem pernapasan, merusak jaringan, selaput lendir, dan mengubah sistem sel dan kromosom (Sabilu, 2010).
Beberapa metode dapat digunakan untuk mengatasi logam berat yang ada di perairan salah satunya adalah metode
adsorpsi (Sediawan, 2000). Untuk
melakukan adsorpsi dibutuhkan adsorben, dan salah satu adsorben yang saat ini menjadi perhatian para peneliti adalah
material berpori. Berdasarkan ukuran
porinya material berpori terbagi menjadi tiga kelas yakni material mikropori dengan ukuran diameter pori kurang dari 2 nm, mesopori dengan ukuran diameter pori 2 sampai 50 nm dan makropori dengan ukuran diameter pori lebih dari 50 nm.
Silika mesopori merupakan salah satu contoh dari material mesopori dan salah satu famili silika mesopori adalah M41S
yang terdiri atas MCM-41 (Mobil
Composition of Matter number 41) yang
mempunyai struktur heksagonal dengan ukuran pori 1,5 sampai 10 nm, MCM-48
(Mobil Composition of Matter number 48)
yang mempunyai struktur kubik dengan kelompok ruang yang memiliki saluran mesopori rumit membentuk sistem saluran tiga dimensi (Taba, 2001), dan MCM-50
(Mobil Composition of Matter number 50)
yang mempunyai struktur lamelar dan tidak stabil dimana material ini mudah berubah menjadi amorf jika dipanaskan (Sutrisno, dkk., 2005). Silika mesopori MCM-48 memiliki kelebihan dengan adanya saluran tiga dimensinya yang memudahkan partikel masuk ke dalam interior material karena pori-porinya tidak berbatas pada satu arah (Taba, 2001) sehingga masalah yang ditimbulkan oleh adanya pemblokiran dapat diatasi.
Beberapa modifikasi telah dilakukan untuk meningkatkan kapasitas adsorpsi dari
MCM-48 dengan senyawa anorganik
maupun organik. Menurut beberapa hasil penelitian, penambahan gugus fungsi pada permukaan material silika dapat menjadi
pengkompleks logam berat seperti
penambahan gugus amino pada MCM-48
dapat menggunakan senyawa yang
mengandung gugus amino seperti
3-aminopropil trietoksisilan (3-APTES)
(Pirouzmand, dkk., 2008) dan menggunakan
senyawa 3-aminopropil trimetoksisilan
(3-APTMS) (Wang, dkk., 2007). Senyawa 3-APTMS lebih berpotensi digunakan dalam modifikasi MCM-48 dibanding senyawa 3-APTES karena ukuran senyawa 3-APTMS lebih kecil daripada senyawa 3-APTES sehingga memudahkan masuk ke dalam pori MCM-48.
Berdasarkan prinsip Hard Soft Acid
Base (HSAB), MCM-48 yang dimodifikasi
dengan gugus amino (-NH2) yang bersifat
basa keras, dapat mengikat logam berat yang bersifat asam keras, tetapi Buhani (2009) melaporkan bahwa silika yang dimodifikasi
dengan gugus amino juga dapat
mengadsorpsi ion Ni(II) yang bersifat
borderline.
METODE PENELITIAN Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah setiltrimetilamonium bromida (CTAB), Ludox HS40, Triton
X-100, natirum hidroksida, akuades,
akuabides, 3-aminopropiltrimetoksisilan
(3-APTMS) yang diperoleh dari, etanol,
asam klorida, Ni(NO3)2.6H2O, asam asetat,
kertas saring Whatman 42, kertas pH universal, toluena, kloroform dan asam nitrat.
Alat
Alat-alat yang digunakan dalam penelitian yaitu peralatan gelas yang biasa
digunakan dalam laboratorium kimia, neraca
analitik (Ohauss), magnetic stirrer, hotplate
stirrer, oven, termometer, cawan porselin,
pompa vakum, penyaring Buchner, pH meter, Spektrofotometer Serapan Atom,
Spektrofotometer Fourier Transform
Infrared (FTIR) dan X-ray Diffraction
(XRD).
Sintesis Silika Mesopori MCM-48
Silika mesopori MCM-48 disintesis dengan menggunakan Metode Ryoo yang dimodifikasi (Taba, 2001) sebagai berikut: 14,3 gram larutan Ludox HS40 dicampur dengan 45,25 gram larutan NaOH 1M. Campuran diaduk selama 2 jam sambil dipanaskan pada suhu 80 °C. Campuran surfaktan dibuat dengan melarutkan 6,12 gram CTAB dan 1,34 gram Triton X-100 secara bersamaan dalam 83,47 gram akuades sambil dipanaskan. Setelah larutan sodium tetrasilikat dan larutan surfaktan dingin, kedua larutan tersebut dicampurkan dengan cepat di dalam botol polipropilen. Botol langsung ditutup dan dikocok kuat selama 15 menit. Campuran gel yang dihasilkan kemudian dipanaskan pada kondisi statis pada suhu 100 °C selama 24 jam. Tahap ini mesofase surfaktan silika dibentuk. Botol yang berisi campuran sekali-sekali dikocok untuk menghindari pemisahan dari mesofase pada tahap awal pemanasan. Setelah itu campuran reaksi didinginkan pada suhu kamar dan ditambahkan asam asetat 30 % ke dalam campuran untuk mengatur pH sampai 10. Pada saat pH telah mencapai 10, campuran dipanaskan lagi pada suhu 100 °C selama 24 jam kemudian didinginkan pada suhu kamar. MCM-48 yang terbentuk disaring, dicuci dengan akuades, dan dikeringkan dalam oven pada suhu 120 °C. Untuk menghilangkan surfaktan, dilakukan pencucian menggunakan campuran HCl-etanol dimana 1 gram MCM-48 dicuci dengan 25 ml HCl 0,1 M dalam larutan etanol 50 % sambil diaduk selama 30 menit
pada suhu kamar. Pencucian diulang tiga kali lagi kemudian campuran disaring. Endapannya dicuci dengan air suling dan dikeringkan pada suhu 100 °C. Silika
mesopori MCM-48 dikarakterisasi
menggunakan XRD dan FTIR.
Modifikasi Silika Mesopori MCM-48
Modifikasi MCM-48 menggunakan metode Jonshon (2001) dalam Pirouzmand dkk. (2008), yaitu sebanyak 1 gram MCM-48 ditambahkan 50 mL toluena dan diaduk selama 1 jam. Kemudian 1,3 gram
3-APTMS ditambahkan dan direfluks
selama 2 jam. Hasil refluks disaring dan padatannya dicuci dengan toluena dan kloroform kemudian dikeringkan pada suhu kamar. Padatan yang dihasilkan
merupakan NH2-MCM-48 yang selanjutnya
dikarakterisasi dengan FTIR dan XRD.
Penentuan pH Optimum Adsorpsi
NH2-MCM-48 sebanyak 0,1 gram
dimasukkan ke dalam erlenmeyer berbeda
yang berisi 50 mL Ni2+ 20 ppm, campuran
diaduk selama 480 menit dengan variasi pH 3, 4, 5, 6, dan 7. Campuran tersebut kemudian disaring menggunakan penyaring vakum. Absorbansi filtrat diukur dengan
menggunakan spektrofotometer serapan
atom.
Penentuan Waktu Optimum Adsorpsi
NH2-MCM-48 sebanyak 0,1 gram
dimasukkan ke dalam erlenmeyer berbeda
yang berisi 50 mL Ni2+ 20 ppm pada kondisi
pH optimum. Campuran diaduk dengan magnetik stirer selama 30 menit lalu disaring. Absorbansi filtrat diukur dengan
menggunakan spektrofotometer serapan
atom. Percobaan diulang dengan variasi waktu pengadukan berturut-turut 30, 60, 120, 240, 300, dan 360 menit.
Penentuan Kapasitas Adsorpsi
NH2-MCM-48 sebanyak 0,1 gram
dimasukkan ke dalam 5 erlenmeyer berbeda
yang berisi 50 mL larutan Ni2+ dengan
variasi konsentrasi 20, 40, 80, 160, dan 320 ppm pada kondisi pH optimum. Larutan kemudian diaduk selama waktu optimum. Campuran kemudian disaring menggunakan penyaring vakum. Absorbansi filtrat diukur
dengan menggunakan spektrofotometer
serapan atom. Kapasitas adsorpsi ditentukan dengan menggunakan isotermal adsorpsi
yaitu dengan model Langmuir dan
Freundlich.
Isotermal Langmuir
qe = Efektivitas adsorpsi (mg/g)
Ce = Konsentrasi kesetimbangan adsorbat
(mg/L) Qo = Kapasitas adsorpsi (mg/g) b = Intensitas adsorpsi (L/mg) Isotermal Freundlich ( ) qe = Efektivitas adsorpsi (mg/g)
Ce = Konsentrasi kesetimbangan adsorbat
(mg/L)
k = Kapasitas adsorpsi (mg/g) n = Intensitas adsorpsi
Hasli dan Pembahasan
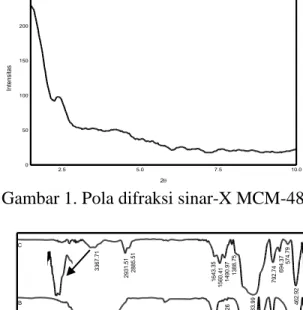
Pola difraksi sinar-X MCM-48 pada Gambar 1. menunjukkan adanya puncak 2
theta yang kuat pada 2,4° dengan indeks
Miller 211 yang merupakan puncak khas dari MCM-48 (Zhao, dkk., 2012).
Untuk mengetahui gugus fungsi yang
terdapat pada MCM-48 dan NH2-MCM-48
maka karakterisasi dilakukan dengan
menggunakan FTIR yang dapat dilihat pada Gambar 2.
Gambar 1. Pola difraksi sinar-X MCM-48
Gambar 2. Spektra (A) MCM-48 sebelum pencucian, (B) MCM-48 setelah pencucian 4
kali, (C) NH2-MCM-48
Pada spektra MCM-48 sebelum pencucian (Gambar 2A) terdapat pita
serapan dengan bilangan gelombang
3444,84 cm-1 yang merupakan vibrasi OH
dari gugus Si-OH. Hal ini didukung oleh pita serapan dengan bilangan gelombang
960,55 cm-1 dan 576,72 cm-1 yang
merupakan vibrasi Si-O dari Si-OH. Pita
serapan dengan bilangan gelombang
1064,71 cm-1, 792 cm-1, dan 453,27 cm-1
merupakan vibrasi dari regangan asimetris, regangan simetris, dan menekuk dari Si-O-Si. Pita serapan dengan bilangan
gelombang 2920,23 cm-1 dan 2850,79 cm-1
merupakan vibrasi regangan asimetris dan
simteris dari CH yang merupakan peak dari
surfaktan yang didukung oleh gugus metilen
(-CH2) pada bilangan gelombang 1481,33
cm-1. 0 50 100 150 200 250 2.5 5.0 7.5 10.0 2 In te n si ta s 500 1000 1500 2000 2500 3000 3500 4000 4500 5 4 3 ,7 5 5 7 6 .7 2 4 6 2 .9 2 5 7 4 .7 9 6 9 4 .3 7 7 9 2 .7 4 1 0 8 3 .9 9 1 3 8 8 .7 5 1 4 9 0 .9 7 1 5 6 0 .41 1 6 4 3 .3 5 2 8 8 5 .5 1 2 9 3 1 .5 1 3 3 6 7 .7 1 C 4 6 6 .7 7 8 0 0 .4 6 9 6 2 .4 8 1 0 89.7 8 1 4 5 6 .2 6 1 6 3 5 .6 4 3 4 4 6 .7 9 4 5 3 .2 7 7 9 2 .7 4 9 6 0 .5 5 1 0 6 4 .7 1 1 2 2 4 .8 0 1 4 8 1 .3 3 1 6 4 5 .2 8 2 8 5 0 .7 9 2 9 2 0 .2 3 3 4 4 4 .8 7 B A Bilangan Gelombang (cm-1) T % 0 5 10 15 20 0 1000 2000 3000 4000 5000
Pada spektra MCM-48 setelah pencucian 4 kali menggunakan HCl-etanol (Gambar 2B), intensitas CH berkurang yang menunjukkan hilangnya surfaktan. Pita
serapan dengan bilangan gelombang
1224,80 cm-1, dan 1064,71cm-1 bergeser ke
bilangan gelombang lebih besar yang menunjukkan adanya kontraksi kisi dengan hilangnya surfaktan (Taba, 2001).
Setelah MCM-48 dimodifikasi
menggunakan senyawa 3-APTMS (Gambar 2C) terlihat adanya perubahan bilangan gelombang yaitu munculnya pita serapan
dengan bilangan gelombang 2931,80 cm-1
dan 2885,51 cm-1 yang merupakan vibrasi
CH pada rantai propil dalam 3-APTMS serta
pada bilangan gelombang 1490,97 cm-1 yang
merupakan vibrasi dari gugus metilen
(-CH2). Pita serapan dengan bilangan
gelombang 3367,71 cm-1 merupakan vibrasi
NH dalam gugus NH2. Setelah dimodifikasi
pita serapan pada bilangan gelombang
960,55 cm-1 yang merupakan vibrasi Si-O
dari Si-OH berkurang karena berkurangnya gugus silanol akibat masuknya senyawa amin (3-APTMS) dan terbentuk serapan
pada bilangan gelombang 1560,41 cm-1 dan
1388,75 cm-1 yang menunjukkan vibrasi NH
primer dan CN (Younesi, dkk., 2009).
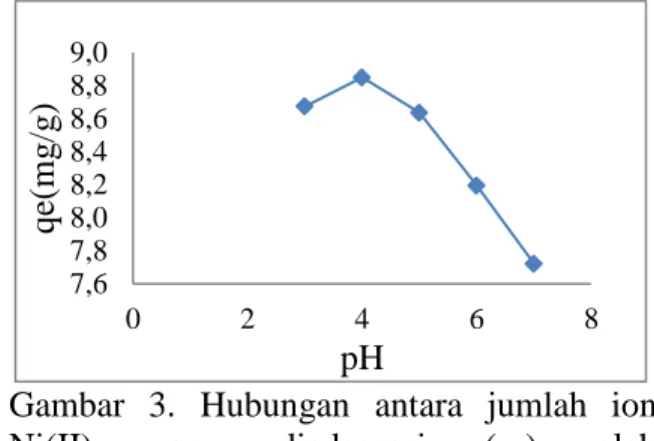
pH Optimum Adsorpsi Ion Ni(II) Oleh NH2-MCM-48
Jumlah ion Ni(II) yang teradsorpsi
oleh NH2-MCM-48 dapat dilihat pada
Gambar 3.
Berdasarkan Gambar 3 jumlah ion Ni(II) yang teradsorpsi meningkat dari pH 3 sampai 4, namun pada pH 5, 6, dan 7 jumlah ion yang teradsorpsi mengalami penurunan. Hal ini menunjukkan bahwa adsorpsi ion Ni(II) baik dilakukan pada suasana asam. Dapat dilihat pada jumlah Ni(II) yang di
adsorpsi (qe) pada pH 3 yaitu 8,6741 mg/g
kemudian pada pH 4 mengalami
peningkatan sebesar 8,8499 mg/g dan setelah itu pada pH 5, 6, dan 7 mengalami
penurunan berturut-turut sebesar 8,6358 mg/g, 8,1949 mg/g, dan 7,7205 mg/g.
Gambar 3. Hubungan antara jumlah ion
Ni(II) yang diadsorpsi (qe) oleh
NH2-MCM-48 dengan pH larutan.
Pada pH rendah ion Ni(II) yang di adsorpsi lebih kecil karena pada kondisi ini terjadi protonasi pada atom N dalam gugus
amin dari adsorben NH2-MCM-48 yang
dapat membentuk NH3 (Younesi, dkk.,
2009). Sedangkan pada pH yang lebih tinggi permukaan adsorben bermuatan negatif yang menguntungkan dalam proses adsorpsi, akan tetapi ion logam mudah terhidrolisis
sehingga terbentuk endapan spesies
hidroksida logam Ni(OH)2. Dari penelitian
ini diperoleh pH optimum untuk adsorpsi
ion Ni oleh NH2-MCM-48 yaitu pada pH 4
dan digunakan untuk penelitian ke tahap selanjutnya.
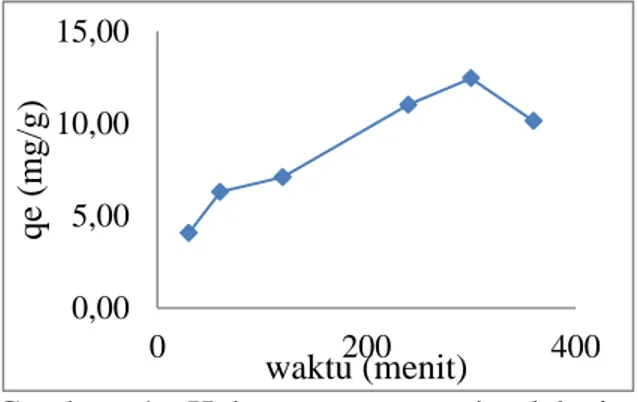
Waktu Optimum dan Kinetika Adsorpsi Ion Ni(II) Oleh NH2-MCM-48
Jumlah ion Ni(II) yang teradsorpsi
oleh NH2-MCM-48 dapat dilihat pada
Gambar 4.
Berdasarkan Gambar 4 adsorpsi ion Ni(II) meningkat dengan bertambahnya waktu kontak antara adsorben dan ion Ni(II). Hal ini dapat dilihat dari jumlah ion
Ni(II) yang di adsorpsi (qe) dimana pada
waktu kontak 30 menit jumlah ion Ni(II) yang diadsorpsi adalah 4,0575 mg/g. Jumlah ion Ni(II) kemudian terus meningkat dengan bertambahnya waktu dan pada waktu kontak
7,6 7,8 8,0 8,2 8,4 8,6 8,8 9,0 0 2 4 6 8 qe (mg /g ) pH
300 menit jumlah ion Ni(II) yang di adsorpsi adalah 12,4601 mg/g. Setelah 300 menit,
nilai qe mengalami penurunan yang
disebabkan karena permukaan adsorben telah jenuh. Kondisi ini sesuai dengan konsep adsorpsi yang menyatakan bahwa semakin lama waktu kontak antara adsorben dengan adsorbat maka akan semakin banyak adsorbat yang teradsorpsi, namun jumlah adsorbat yang terjerap akan mencapai batas maksimum pada waktu tertentu dimana adsorben tidak dapat lagi mengadsorpsi adsorbat. Dari penelitian ini, diperoleh waktu kontak optimum untuk adsorpsi ion
Ni(II) oleh NH2-MCM-48 yaitu selama 300
menit yang akan digunakan untuk penelitian ke tahap selanjutnya.
Gambar 4. Hubungan antara jumlah ion
Ni(II) yang diadsorpsi (qe) oleh
NH2-MCM-48 dengan waktu adsorpsi.
Proses laju adsorpsi dapat
memberikan informasi mengenai jalur reaksi
adsorpsi ion Ni(II) oleh NH2-MCM-48.
Untuk mengetahui model kinetika adsorpsi
ion Ni(II) oleh NH2-MCM-48 digunakan
persamaan orde satu semu dan persamaan orde dua semu. Model kinetik adsorpsi yang
sesuai dapat ditentukan dengan
membandingkan nilai garis kuadran terkecil
R2 (Malik dalam Lawakka, 2005). Model
kinetik adsorpsi dapat dilihat pada Gambar 5 dan Gambar 6.
Gambar 6 menunjukkan nilai R2
yang diperoleh sebesar 0,9552 dengan nilai
tetapan kinetik k1 = 0,0082 menit-1 untuk
model kinetik orde satu semu sedangkan
pada Gambar 8 menunjukkan nilai R2 yang
diperoleh sebesar 0,9372 dengan nilai
tetapan kinetik k2 = 0,0007 menit-1 untuk
model kinetik orde dua semu. Nilai R2 untuk
kedua model tersebut lebih besar dari 0,9
tetapi nilai qe berdasarkan model kinetik
orde satu semu (11,2512 mg/g) lebih
mendekati nilai qe secara praktek (12,4601
mg/g) dibandingkan dengan nilai qe
berdasarkan orde dua semu (14,4300 mg/g). Data ini menunjukkan bahwa adsorpsi ion
logam Ni(II) oleh NH2-MCM-48 mengikuti
orde satu semu.
Gambar 5. Model kinetik orde satu semu untuk adsorpsi ion logam Ni(II) oleh
NH2-MCM-48.
Gambar 6. Model kinetik orde dua semu untuk adsorpsi ion logam Ni(II) oleh
NH2-MCM-48.
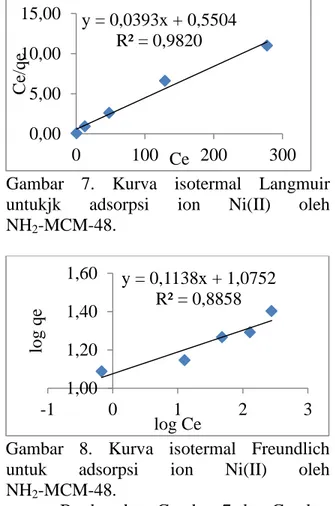
Kapasitas Adsorpsi Ion Ni(II) Oleh NH2-MCM-48
Untuk menentukan kapasitas
adsorpsi digunakan model isotermal
adsorpsi yang umum digunakan yaitu dengan model Langmuir dan Freundlich
dengan mengalurkan Ce/qe terhadap Ce
0,00 5,00 10,00 15,00 0 200 400 qe ( mg /g ) waktu (menit) y = -0,0036x + 1,0512 R² = 0,9552 0,00 0,50 1,00 0 100 200 300 log (q o -q t ) t(menit) y = 0,0693x + 6,1110 R² = 0,9372 0,00 10,00 20,00 30,00 0 100 200 300 t/q t (me nit .g /m g ) t (menit)
untuk persamaan Langmuir dan log qe
terhadap log Ce untuk persamaan
Freundlich. Dari intersep persamaan
Freundlich diperoleh nilai k yang
merupakan kapasitas adsorpsi dan dari slope
persamaan Langmuir diperoleh nilai Qo
yang berhubungan dengan kapasitas
adsorpsi. Kemudian dengan
membandingkan nilai garis kuadran terkecil, maka akan diperoleh isotermal adsorpsi yang sesuai. Gambar 7 dan Gambar 8 secara
berturut-turut menunjukkan isotermal
Langmuir dan isotermal Freundlich adsorpsi
ion Ni(II) oleh NH2-MCM-48.
Gambar 7. Kurva isotermal Langmuir
untukjk adsorpsi ion Ni(II) oleh
NH2-MCM-48.
Gambar 8. Kurva isotermal Freundlich
untuk adsorpsi ion Ni(II) oleh
NH2-MCM-48.
Berdasarkan Gambar 7 dan Gambar
8, adsorpsi ion Ni(II) oleh NH2-MCM-48
memenuhi isotermal Langmuir dimana dapat
terlihat dari nilai kuadran terkecilnya (R2)
yang mendekati 1 yaitu sebesar 0,9820 sedangkan pada isotermal Freundlich nilai
R2 tidak mendekati 1 yaitu sebesar 0,8858.
Berdasarkan isotermal Langmuir nilai
kapasitas adsorpsi (Qo) ion Ni(II) oleh
NH2-MCM-48 yaitu 0,4334 mmol/g dengan
intensitas adsorpsi (b) sebesar 0,0714 L/mg.
Interaksi Ion Ni(II) dengan NH2-MCM-48
Interaksi ion Ni(II) dengan
NH2-MCM-48 dipelajari dengan
menggunakan FTIR. Gambar 9
menunjukkan spektra IR NH2-MCM-48
sebelum dan sesudah adsorpsi ion Ni(II).
Gambar 9. Spektra FTIR (A) NH2-MCM-48
dan (B) NH2-MCM-48 + ion Ni(II)
Pita serapan pada bilangan
gelombang 1560,41 cm-1 yang merupakan
vibrasi NH mengalami pergeseran bilangan
gelombang menjadi 1548,64 cm-1 setelah
adsorpsi yang menunjukkan adanya peranan
gugus NH2 dalam mengikat ion Ni(II)
melalui donor pasangan elektron. Hal ini ditunjang oleh adanya pergeseran pita serapan pada bilangan gelombang 3367,71
cm-1 menjadi 3442,94 cm-1 setelah adsorpsi.
Pita serapan pada bilangan gelombang
1388,75 cm-1 merupakan vibrasi CN
mengalami peningkatan intensitas setelah
adsorpsi yang disebabkan karena
meningkatnya kepolaran dalam struktur
NH2-MCM-48 yang diakibatkan karena ion
logam berikatan dengan NH2.
y = 0,0393x + 0,5504 R² = 0,9820 0,00 5,00 10,00 15,00 0 100 200 300 C e/qe Ce y = 0,1138x + 1,0752 R² = 0,8858 1,00 1,20 1,40 1,60 -1 0 1 2 3 log qe log Ce 500 1000 1500 2000 2500 3000 3500 4000 4500 5 7 2 .8 6 6 9 0 .5 2 3 4 7 .1 9 4 6 4 .8 4 7 9 4 .6 7 1 0 8 5 .9 2 1 6 4 5 .2 8 1 3 8 2 .9 6 1 5 4 8 .6 4 2 8 8 3 .5 1 2 9 2 7 .9 4 3 4 4 2 .9 4 3 5 4 .9 0 4 6 2 .9 2 5 7 4 .7 9 6 9 4.3 7 7 9 2 .7 4 1 0 8 3 .9 9 1 3 8 8 .7 5 1 4 9 0 .9 7 1 5 6 0.4 1 1 6 4 3 .3 5 2 8 8 5 .5 1 2 9 3 1 .5 1 3 3 6 7 .7 1 B A Bilangan Gelombang (cm-1) T %
Kesimpulan
Dari hasil penelitian dapat
disimpulkan bahwa waktu kontak optimum
adsorpsi ion Ni(II) oleh NH2-MCM-48 yaitu
300 menit dengan pH optimum pada pH 4. Laju adsorpsi yang diperoleh memenuhi persamaan orde satu semu. Adsorpsi ion
Ni(II) oleh NH2-MCM-48 mengikuti
isotermal Langmuir dengan kapasitas
adsorpsi sebesar 0,4334 mmol/g.
Daftar Pustaka
Buhani, Narsito, Nuryono, dan Kunarti, E.S., 2009, Amino and Mercapto-Silica Hybrid for Cd(II) Adsorption
in Aqueous Solution, Indo. J.
Chem., 9 (2), 170-178.
Lawakka, I., 2005, Adsorpsi Merah
Reaktif-1 oleh Karbon Aktif dari Tempurung Kenari sebagai Fungsi Waktu dan
Jumlah Adsorben, Skripsi tidak
dipublikasikan, Jurusan Kimia
FMIPA Universitas Hasanuddin,
Makassar.
Pirouzmand, M., Amini, M.M., and Safari, N., 2008, Immobilization of Iron
Tetrasulfophthalocyanine on
functionalized 48 and MCM-41 Mesoporous Silicas: Catalysts for
Oxidation of Styrene, J. Colloid
Interface Sci., 319 (1), 199-205.
Rochyatun, E., dan Rozak, A., 2007, Pemantauan Kadar Logam Berat dalam Sedimen di Perairan Teluk
Jakarta, Lembaga Ilmu Pengetahuan
Indonesia, 11 (1), 28-36.
Sabilu, K., 2010, Dampak Toksisitas Nikel Terhadap Kondisi Hematologi Ikan
Bandeng Chanos chanos Forsskal,
Studi Lanjut Respon Fisiologi,
Paradigma, 14 (2), 205-216.
Sediawan, W.B., 2000, Berbagai Teknologi
Proses Pemisahan, Jurusan Teknik
Kimia UGM, Yogyakarta.
Sutrisno, H., Arianingrum, R.,dan Ariswan,
2005, Silikat dan Titanium Silikat
Mesopori-Mesotruktur Berbasis
Struktur Heksagonal dan Kubik,
Jurnal Matematika dan Sains, 10 (2),
69-74.
Taba, P., 2001, Mesoporous Solids as
Adsorbent, PhD Thesis, The
University of New South Wales: Australia.
Wang, L., Li, J., Miao, X., Hao, Y., Zhao, J., and Sun, X., 2007, Synthesis
Amino-Functionalization of
Mesoporous Silica and Its
Adsorption of Cr(VI), J. Colloid
Interface Sci, 318 (1), 309-314.
Younesi, H., Heidari, A., and Mehraban, Z., 2009, Removal of Ni(II), Cd(II), and Pb(II) From a Ternary Aqueous Solution by Amino Functionalized Mesoporous and Nano Mesoporous
Silica, Chem. Eng. J., 153 (1),
70-79.
Zhao, Y.N., Li, S.X., and Han, C.S., 2012, Effect of Template Removal on
Synthesis of Organic-Inorganic
Hybrid Mesoporous MCM-48,