LAPORAN TAHUNAN
PENELITIAN HIBAH BERSAING
Aplikasi Adsorben Berbasis Biomassa Yang Dimodifikasi Untuk Penyerapan Limbah Cair Jenis Logam Berat
Tahun ke-1 dari rencana 2 tahun
Ketua/Anggota Tim
Dr. Farid Mulana, ST., M.Eng/ NIDN 0008027203 Dr. Ir. Mariana, M.T/ NIDN 0015076703 Ir. Pocut Nurul Alam, M.T/NIDN 0022086602
Dibiayai oleh Direktorat Penelitian Pengabdian kepada Masyarakat, Direktorat Jenderal Pendidikan Tinggi, Kementerian Pendidikan dan Kebudayaan, sesuai dengan Surat Perjanjian Penugasan Pelaksanaan Hibah Penelitian bagi Dosen Perguruan Tinggi Batch I
Universitas Syiah Kuala Tahun Anggaran 2015
Nomor: 035/SP2H/PL/Dit.Litabmas/II/2015 Tanggal 5 Pebruari 2015
Universitas Syiah Kuala November, 2015
ii
Limbah cair logam berat Pb(II) sebagai hasil samping dari aktivitas industri sering menimbulkan permasalahan bagi lingkungan. Untuk meminimalkan kadar logam Pb(II) tersebut maka dilakukan berbagai pengolahan, diantaranya adsorpsi dengan menggunakan adsorben. Sekam padi berpotensi digunakan sebagai bahan penyerap karena mengandung lignin, selulosa dan hemiselulosa. Penelitian ini bertujuan untuk menjadikan sekam padi sebagai adsorben, dengan cara diaktivasi menggunakan natrium oksida dan asam sitrat. Juga untuk mempelajari kemampuan mengadsorpsi ion logam Pb(II) oleh sekam padi terhadap kapasitas dan efisiensi penyerapan dengan memvariasikan konsentrasi sampel dan pengaruh aktivasi dengan asam sitrat. Untuk mengetahui gugus yang tersubstitusi maka dilakukan analisa menggunakan Fourier Transform Infrared. Sedangkan untuk mengetahui jumlah adsorbat yang terserap pada adsorben dilakukan dengan metode Atomic Absorption Spectroscopy. Hasil penelitian menunjukkan bahwa kapasitas penyerapan dan efisiensi optimum masing-masing sebesar 5,08 mg/g dan 84,52%, pada konsentrasi adsorbat Pb(II) 60,107 ppm dan aktivasi dengan konsentrasi asam sitrat 0,8 M yang dikontakkan selama 150 menit.
Kata kunci: ion Pb(II), isothermal adsorpsi, kinetika adsorpsi, modifikasi asam sitrat, sekam padi
iii Assalamualaikum wr. Wb.
Segala puji dan syukur kami ucapkan atas segala rahmat dan hidayah yang telah dilimpahkan Allah SWT sehingga kami dapat menyelesaikan penelitian ini dan dapat menyerahkan laporan akhir ini tepat waktu. Selawat dan salam juga kami sampaikan keharibaan Nabi Besar Muhammmad SAW yang telah menghantarkan kita ke dunia yang penuh dengan ilmu pengetahuan dan teknologi ini. Kami menyadari bahwa riset ini dapat terlaksana dengan baik berkat adanya pembiayaan dari Universitas Syiah Kuala, Kementerian Riset, Teknologi dan Pendidikan Tinggi, sesuai dengan Surat Perjanjian Penugasan Dalam Rangka Pelaksanaan Program Penelitian Hibah Bersaing Tahun Anggaran 2015. Terima kasih kami kepada Fakultas Teknik melalui Jurusan Teknik Kimia Universitas Syiah Kuala, yang mana sebagian besar aktifitas riset ini dilakukan di laboratorium-laboratorium yang ada di Jurusan Teknik Kimia. Akhirnya rasa terima kasih kami juga disampaikan kepada semua kawan-kawan dan rekan-rekan yang telah memberikan kontribusi langsung maupun tidak langsung dalam pelaksanaan riset ini.
Kami menyadari hasil laporan ini belum memberikan hasil yang optimal, untuk itu saran yang membangun sangat kami nantikan. Kami berharap semoga hasil penelitian ini dapat memberikan kontribusi yang nyata bagi pengembangan ilmu pengetahuan khususnya bidang adsorpsi.
Penyusun
Dr. Farid Mulana, ST, M.Eng.
iv
HALAMAN PENGESAHAN . . . .. . . i
RINGKASAN . . . .. . . ii
PRAKATA . . . iii
DAFTAR ISI . . . iv
DAFTAR GAMBAR . . . .. . . v
BAB I PENDAHULUAN . . . 1
BAB II TINJAUAN PUSTAKA . . . .. . . 3
BAB III TUJUAN DAN MANFAAT PENELITIAN . . . .. . . 15
BAB IV METODE PENELITIAN . . . .. . . 16
BAB V HASIL YANG DICAPAI . . . 20
BAB VI RENCANA TAHAPAN BERIKUTNYA . . . 30
BAB VII KESIMPULAN DAN SARAN . . . .. . . 31
DAFTAR PUSTAKA . . . .. . . 32 LAMPIRAN
Lampiran 1 Instrumen Pelaksanaan Penelitian
Lampiran 2 Biodata Personalia Ketua Peneliti dan Anggota Peneliti Lampiran 3 Publikasi Ilmiah/Luaran Penelitian
1
PENDAHULUAN
1.1 Latar Belakang
Limbah cair sebagai hasil samping dari aktivitas industri sering menimbulkan permasalahan bagi lingkungan. Pencemaran air oleh logam-logam berat dapat berasal dari proses-proses industri seperti industri metalurgi, industri penyamakan kulit, industri pembuatan fungisida, industri cat dan zat warna tekstil.
Zat pencemar yang berupa logam-logam berat merupakan masalah yang lebih serius dibandingkan dengan polutan organik karena ion-ion logam berat merupakan racun bagi organisme serta sangat sulit diuraikan secara biologi maupun kimia. Pencemaran logam berat merupakan masalah yang serius terhadap kondisi lingkungan saat ini. Logam berat banyak ditemukan pada hampir semua jenis limbah industri (Jaleel dkk., 2009). Semakin berkembangnya industri akan menyebabkan peningkatan pencemaran terhadap sumber-sumber air yang berasal dari limbah industri yang dibuang ke perairan tanpa pengolahan terlebih dahulu.
Kadar logam yang berlebihan dalam air minum khususnya logam berat Pb(II) sangat membahayakan penggunanya, sehingga untuk meminimalkan kadar logam tersebut maka dilakukan berbagai pengolahan (treatment), salah satunya adalah adsorpsi dengan menggunakan adsorben. Pemanfaatan sumber daya alam yang terbaharui dan terdegradasi dipilih sebagai bahan baku alternatif pada pembuatan adsorben. Pemilihan ini didasarkan pada pertimbangan yang ekonomis, jumlah bahan baku yang melimpah serta dampak terhadap lingkungan yang sangat diutamakan. Terdapatnya lignin, selulosa dan hemiselulosa menjadikan sekam padi berpotensi untuk digunakan sebagai bahan penyerap (Nugraha dan Setyawati, 2001).
Selama ini, pemanfaatan sekam masih sangat terbatas, antara lain sebagai media tanaman hias, pembakaran bata merah, alas pada petelur, dan keperluan lokal yang masih sangat sedikit karena sifatnya yang bulky (memerlukan tempat yang besar). Sekam padi juga memiliki pori-pori yang berguna untuk terjadinya proses adsorpsi. Pertimbangan yang paling penting adalah senyawa aromatik
dengan gugus fungsional yang terkandung dalam lignin sekam padi. Sehingga gugus tersebut akan disubstitusi oleh ion logam. Maka dari itu, diperlukan teknik pengolahan sekam padi yang tepat, yaitu untuk diolah menjadi adsorben. Sekam padi yang dijadikan adsorben adalah sekam padi yang sudah diaktifkan, baik dengan proses aktivasi fisika maupun aktivasi kimia sehingga pori-porinya terbuka dan dengan demikian daya adsorpsinya tinggi. Berdasarkan pertimbangan-pertimbangan di atas, maka akan dilakukan studi pada masing- masing konsentrasi aktivator asam sitrat untuk melihat pengaruh adsorpsi logam berat Pb(II) oleh sekam padi sebagai adsorben.
1.2 Perumusan Masalah
Limbah yang mengandung kontaminan logam berat Pb(II) merupakan salah satu sumber pencemaran yang sangat membahayakan, baik bagi kesehatan manusia maupun lingkungan. Limbah ini dapat berasal dari industri, maupun limbah rumah tangga (domestic water). Ketika tanah tidak mampu lagi (jenuh) untuk menyerap komponen limbah secara selektif, ion-ion logam akan mengkontaminasi air (air sumur dan air sungai).
Pencemaran kontaminan ini dapat diminimalkan dengan berbagai cara konvensional seperti resin penukar ion, elektrolisis, dan reverse osmosis. Namun penggunaan cara tersebut tidak ekonomis, sehingga adsorpsi dipilih sebagai proses yang lebih murah dengan memanfaatkan adsorben biomassa yang mampu mengikat ion logam berat Pb(II).
Pemilihan sekam padi sebagai adsorben disebabkan oleh kandungan gugus fungsional seperti hidroksil dalam substrat serat lignoselulosa seperti lignin.
Gugus hidroksil dalam serat lignoselulosa memiliki kemampuan untuk mengikat ion-ion logam secara aktif. Namun, gugus hidroksil memiliki kemampuan yang lebih rendah dalam mengikat ion logam berat dibandingkan dengan gugus karboksil (Torresdey et al., 2003). Sehingga untuk meningkatkan aktivitas adsroben, maka dilakukan suatu modifikasi dengan menggunakan asam sitrat.
BAB II
TINJAUAN PUSTAKA
2.1 Sekam Padi
Limbah pertanian dapat berbentuk bahan buangan tidak terpakai dan bahan sisa dari hasil pengolahan. Proses penghancuran limbah secara alami berlangsung lambat, sehingga tumpukan limbah dapat mengganggu lingkungan sekitarnya dan berdampak terhadap kesehatan manusia. Padahal, melalui pendekatan teknologi limbah pertanian dapat diolah lebih lanjut menjadi hasil samping yang berguna di samping produk utamanya. Salah satu bentuk limbah pertanian adalah sekam yang merupakan buangan pengolahan padi.
Selama ini pemanfaatan kulit padi atau sekam masih kurang, hanya sebatas untuk pembuatan arang dan keperluan lainnya. Sekam padi mempunyai beberapa keunggulan seperti kemampuan menahan kelembaban, tidak mudah terbakar, tidak mudah berjamur, tidak berbau dan lain-lain. Pemanfaatan limbah sekam masih berpeluang besar untuk digunakan sebagai bahan rekayasa. Dengan menambahkan perekat yang murah, sekam padi ini berpotensi untuk direkayasa menjadi produk core fleksibel untuk pembuatan panel komposit sandwich.
Sekam padi merupakan lapisan keras yang membungkus kariopsis butir gabah, terdiri atas dua belahan yang disebut lemma dan palea yang saling bertautan. Pada proses penggilingan gabah, sekam akan terpisah dari butir beras dan menjadi bahan sisa atau limbah penggilingan. Dari proses penggilingan gabah akan dihasilkan 16,3-28% sekam. Sekam dikategorikan sebagai biomassa yang dapat digunakan untuk berbagai kebutuhan seperti bahan baku industri, pakan ternak, dan energi.
2.2 Berbagai Jenis Aktivator
Jenis bahan kimia yang dapat digunakan sebagai aktivator adalah hidroksida logam alkali garam-garam karbonat, klorida, sulfat, fosfat dari logam alkali tanah dan khususnya ZnCl2, asam-asam anorganik seperti H2SO4 dan
H4PO4, dan uap air pada suhu tinggi. Unsur-unsur mineral dari persenyawaan kimia yang ditambahkan tersebut akan meresap ke dalam adsorben dan membuka permukaan yang semula tertutup oleh komponen kimia sehingga volume dan diameter pori bertambah besar. Pemilihan jenis aktivator akan berpengaruh terhadap kualitas adsorben, dimana masing-masing jenis aktivator akan memberikan efek/pengaruh yang berbeda-beda terhadap luas permukaan maupun volume pori-pori adsorben yang dihasilkan (Roy dan Glenn, 1995). Berbagai jenis aktivator antara lain sebagai berikut:
1. Asam Sulfat (H2SO4)
Terikatnya molekul air yang ada pada arang aktif oleh H2SO4
menyebabkan pori-pori pada arang aktif semakin besar. Semakin besar pori-pori maka luas permukaan arang aktif semakin bertambah. Bertambahnya luas permukaan ini mengakibatkan semakin meningkatnya kemampuan adsorpsi dari arang aktif (Roy dan Glenn, 1995).
2. Asam Klorida (HCl)
Pada adsorpsi naftol (zat pewarna tekstil), ternyata penggunaan asam klorida sebagai pengaktif menghasilkan kemampuan adsorpsi terhadap rhodamin B yang setingkat dengan kemampuan adsorpsi bentonit teraktivasi asam sulfat.
Hal ini mungkin disebabkan kerusakan struktur bentonit akibat pengasaman H2SO4 lebih besar dibandingkan dengan HCl (Indrawati dan Widodo, 2005).
3. Asam Sitrat (C6H8O7)
Peneliti menggunakan asam sitrat sebagai aktivator adsorben dalam upaya perbaikan kualitas adsorben, mengingat asam sitrat adalah material organik yang aman dan bisa untuk dikonsumsi. Selain itu, asam sitrat memiliki keunggulan dalam proses meningkatkan luas permukaan adsorben sehingga dapat mengadsorpsi senyawa logam dengan disertai reaksi kimia membentuk senyawa kimia komplek yang tidak terlarut dalam adsorbat, sehingga proses pemisahan antara adsorben dan adsorbat dapat dilakukan dengan penyaringan (Anonimous, 2012a)
2.2.1 Sifat Fisika dan Kimia Asam Sitrat
Keasaman asam sitrat didapatkan dari tiga gugus karboksil COOH yang dapat melepas proton dalam larutan. Jika hal ini terjadi, ion yang dihasilkan adalah ion sitrat. Sitrat sangat baik digunakan dalam larutan penyangga untuk mengendalikan pH larutan. Ion sitrat dapat bereaksi dengan banyak ion logam membentuk garam sitrat. Selain itu, sitrat dapat mengikat ion-ion logam dengan pengkelatan, sehingga digunakan sebagai pengawet dan penghilang kesadahan air.
Beberapa sifat kimia asam sitrat adalah:
1. Pada pemanasan 175°C, asam sitrat berubah menjadi aconitic acid. Aconitic acid jika ditambah dengan hidrogen berubah menjadi tricarballylic acid.
2. Pada pemanasan 175°C, asam sitrat jika dieliminasi dengan oksigen dan dihilangkan karbon dioksida berubah menjadi acetonedicarboxylic acid.
3. Pada pemanasan 175°C, asam sitrat jika dihilangkan karbon dioksida berubah menjadi itaconic acid.
Pada temperatur kamar, asam sitrat berbentuk serbuk kristal berwarna putih. Serbuk kristal tersebut dapat berupa bentuk anhydrous (bebas air), atau bentuk monohidrat yang mengandung satu molekul air untuk setiap molekul asam sitrat. Bentuk anhydrous asam sitrat mengkristal dalam air panas, sedangkan bentuk monohidrat didapatkan dari kristalisasi asam sitrat dalam air dingin.
Bentuk monohidrat tersebut dapat diubah menjadi bentuk anhydrous dengan pemanasan di atas 74°C. Secara kimia, asam sitrat bersifat seperti asam karboksilat lainnya. Jika dipanaskan di atas 175°C, asam sitrat terurai dengan melepaskan karbon dioksida dan air (Anonimous, 2012a).
2.2.2 Kegunaan Asam Sitrat
Kemampuan asam sitrat untuk mengikat logam pada air sadah, memungkinkan sabun dan deterjen membentuk busa dan berfungsi dengan baik tanpa penambahan zat penghilang kesadahan. Demikian pula, asam sitrat digunakan untuk memulihkan bahan penukar ion yang digunakan pada alat penghilang kesadahan dengan menghilangkan ion-ion logam yang terakumulasi
pada bahan penukar ion tersebut sebagai kompleks sitrat. Sifat racun logam timbal terikat dalam gugus sulfhidril (-SH) dalam enzim seperti karboksil sisteinil, histidil, hidroksil, dan fosfatil dari protein dan purin. Toksisitas dan sifat letal logam berat Timbal (Pb) pada tubuh biota air dapat dihilangkan dengan penambahan larutan asam sitrat. Terjadinya reaksi antara zat pengikat logam (asam sitrat) dengan ion logam menyebabkan ion logam kehilangan sifat ionnya dan mengakibatkan logam berat tersebut kehilangan sebagian besar toksisitasnya.
Berdasarkan pernyataan tersebut maka jelas penggunaan asam sitrat dapat diasumsikan memiliki daya pelarut yang cukup efektif terhadap logam berat timbal, sehingga dapat menurunkan konsentrasi logam berat timbal di lingkungan (Anonimous, 2012a).
Kulit kedelai yang dimodifikasi dengan asam sitrat pada suhu tinggi dapat meningkatkan kapasitas adsorpsi ion logam. Hal ini menjelaskan bahwa anhidrida asam sitrat merupakan produk kondensasi yang dikombinasikan dengan kelompok hidroksil selulosa membentuk hubungan ester dan menjadikannya gugus karboksil. Kelompok-kelompok tambahan fungsional karboksil meningkatkan pengikatan dengan ion logam bermuatan positif (Marshall, 1999).
2.3. Logam Berat (Timbal)
Timbal (Pb) banyak digunakan untuk berbagai keperluan karena sifatnya sebagai berikut:
1. Timbal mempunyai titik cair rendah sehingga jika digunakan dalam bentuk cair dibutuhkan teknik yang cukup sederhana dan tidak mahal.
2. Timbal merupakan logam yang lunak sehingga mudah diubah menjadi berbagai bentuk.
3. Sifat kimia timbal (Pb) menyebabkan logam ini dapat berfungsi sebagai lapisan pelindung jika kontak dengan udara lembab.
4. Timbal dapat membentuk alloy dengan logam lainnya, dan alloy yang terbentuk mempunyai sifat berbeda dengan timbal (Pb) yang murni.
2.3.1. Sumber Pencemaran Timbal (Pb) 1.Sumber Alami
Kadar timbal (Pb) yang terdapat di tanah berkadar sekitar 5-25 mg/kg dan di air bawah tanah (ground water) berkisar antara 1-60 µg/liter. Kadar timbal (Pb) pada air telaga dan air sungai adalah sebesar 1-10 µg/liter. Di dalam air laut kadar timbal (Pb) lebih rendah dari dalam air tawar. Laut Bermuda yang dikatakan terbebas dari pencemaran mengandung timbal (Pb) sekitar 0,07 µg/liter.
Kandungan timbal (Pb) dalam air danau dan sungai berkisar antara 1-10 µg/liter.
Secara alami timbal (Pb) juga ditemukan di udara yang kadarnya berkisar antara 0,0001-0,001 µg/m3 (Anonimous, 2010a).
2.Sumber dari Industri
Industri yang berpotensi sebagai sumber pencemaran timbal (Pb) adalah semua industri yang memakai Timbal (Pb) sebagai bahan baku maupun bahan penolong, misalnya:
a. Industri pengecoran maupun pemurnian. Industri ini menghasilkan timbal konsentrat (primary lead), maupun secondary lead yang berasal dari potongan logam (scrap).
b. Industri baterai. Industri ini banyak menggunakan logam timbal (Pb) terutama lead antimony alloy dan lead oxides sebagai bahan dasarnya.
c. Industri bahan bakar. Timbal (Pb) berupa tetra ethyl lead dan tetra methyl lead banyak dipakai sebagai anti-knock pada bahan bakar.
d. Industri kabel. Industri kabel memerlukan timbal (Pb) untuk melapisi kabel.
e. Industri kimia, yang menggunakan bahan pewarna.Pada industri ini seringkali dipakai timbal (Pb) karena toksisitasnya relatif lebih rendah jika dibandingkan dengan logam pigmen yang lain (Anonimous, 2010a).
2.3.2 Berbagai Macam Metode Pengolahan Limbah Cair 1. Penukar ion
Ion exchange merupakan proses reaksi kimia bersifat reversibel dimana suatu ion (atom atau molekul) yang telah hilang atau memperoleh suatu elektron
dan dengan demikian memperoleh suatu muatan elektrik dalam larutan yang digantikan dengan ion yang bermuatan sama dari partikel butir padat immobile.
Partikel padat ion exchange ini bisa dalam bentuk anorganik zeolit (alami) dan juga sintetik dalam bentuk resin organik. Resin organik buatan merupakan jenis yang banyak digunakan saat ini, sebab memiliki karakteristik yang dapat dikhususkan pada aplikasi spesifik (Anonimous, 2009b)
2. Pengendapan kimia
Prinsip yang digunakan untuk mengolah limbah cair secara kimia adalah menambahkan bahan kimia (koagulan) yang dapat mengikat bahan pencemar yang dikandung air limbah, kemudian memisahkannya (mengendapkan atau mengapungkan). Kekeruhan dalam air limbah dapat dihilangkan melalui penambahan atau pembubuhan sejenis bahan kimia yang disebut flokulan. Pada umumnya bahan seperti aluminium sulfat (tawas), fero sulfat, poli amonium khlorida atau polielektrolit organik dapat digunakan sebagai flokulan. Dalam pengolahan limbah cara ini, hal yang penting harus diketahui adalah jenis dan jumlah polutan yang dihasilkan dari proses produksi. Umumnya zat pencemar industri kain terdiri dari tiga jenis yaitu padatan terlarut, padatan koloidal, dan padatan tersuspensi (Anonimous, 2012c).
3. Elektrokimia
Pengolahan limbah cair logam berat dengan menggunakan proses elektrokimia pada prinsipnya mengalirkan arus listrik kedalam air limbah, sehingga arus tersebut menyebabkan ketidakstabilan partikel tersuspensi dalam air limbah,termasuk logam, hidrokarbon dan organik. ketika partikel-partikel tersebut tidak stabil, terjadi gaya tarik menarik antara ion yang muatanya berlawanan membentuk partikel yang lebih besar sehingga mudah mngendap (Anonimous, 2007).
4. Penyaringan membran
Teknik pemisahan dengan membran umumnya berdasarkan ukuran partikel dan berat molekul dengan gaya dorong berupa beda tekan, medan listrik dan beda konsentrasi. Proses pemisahan dengan membran yang memakai gaya dorong berupa beda tekan umumnya dikelompokkan menjadi empat jenis
diantaranya mikromembran, ultramembran, nanomembran dan reverse osmosis.
Membran berfungsi memisahkan material berdasarkan ukuran dan bentuk molekul, menahan komponen dari umpan yang mempunyai ukuran lebih besar dari pori-pori membran dan melewatkan komponen yang mempunyai ukuran yang lebih kecil. Larutan yang mengandung komponen yang tertahan disebut konsentrat dan larutan yang mengalir disebut permeat (Notodarmodjo dan Deniva, 2004).
5. Penggunaan bakteri
Pengolahan limbah secara anaerob dilakukan untuk menurunkan COD yang tinggi, sedangkan pengolahan secara aerob dilakukan setelah nilai COD kurang dari 1500 ppm untuk mempersingkat waktu pengolahan. Berbagai jenis mikroba dapat digunakan untuk mengefektifkan pengolahan limbah secara aerob maupun aerob sehingga keluaran limbah dapat memenuhi baku mutu lingkungan dan tentunya dalam waktu yang relatif lebih singkat (Franson dan Ann, 1989).
6. Metode adsorpsi
Berbagai metode yang telah disebutkan di atas memiliki beberapa kelemahan, yaitu penanganannya yang tidak bersifat ekonomis dan mahal. Oleh karena itu digunakan suatu metode yang sangat konvensional, yaitu adsorpsi.
Adsorpsi bersifat sangat ekonomis karena memanfaatkan limbah biomassa yang dapat digenerasi dan dapat terdegradasi (Bernasconi dkk., 1995).
2.4. Adsorpsi
2.4.1 Pengertian Adsorpsi
Adsorpsi adalah proses dimana molekul-molekul fluida menyentuh dan melekat pada permukaan padatan. Adsorpsi adalah fenomena fisik yang terjadi saat molekul-molekul gas atau cair dikontakkan dengan suatu permukaan padatan dan sebagian dari molekul-molekul tadi mengembun pada permukaan padatan tersebut. Walaupun adsorpsi biasanya dikaitkan dengan perpindahan dari suatu gas atau cairan kesuatu permukaan padatan, perpindahan dari suatu gas ke suatu permukaan cairan juga terjadi. Adsorpsi adalah suatu proses yang terjadi ketika suatu fluida (cairan maupun gas) terikat kepada suatu padatan dan akhirnya
membentuk suatu film (lapisan tipis) pada permukaan padatan tersebut. Berbeda dengan absorpsi, dimana fluida terserap oleh fluida lainnya dengan membentuk suatu larutan.
Untuk mengetahui karakteristik yang terjadi dalam proses adsorpsi dapat diilustrasikan dengan Gambar 2.4 dibawah ini:
Tahap 1. Difusi Tahap 2. Migrasi Tahap 3. Pembentukan pada permukaan ke dalam pori monolayer adsorben adsorben adsorben
Gambar 2.1 Mekanisme proses adsorpsi
Padatan berpori yang menghisap (adsorption) dan melepaskan (desorption) suatu fluida disebut adsorben. Molekul fluida yang dihisap tetapi tidak terakumulasi/melekat kepermukaan adsorben disebut adsoptive, sedangkan yang terakumulasi/melekat disebut adsorbat.
Jika fenomena adsorpsi disebabkan terutama oleh gaya van der Waals, dan gaya hidrostatik antara molekul adsorbat, maka atom yang membentuk permukaan adsorben tanpa adanya ikatan kimia disebut adsorpsi fisika. Biasanya interaksi antara padatan dan molekul yang mengembun tadi relatif lemah. Dan jika terjadi interaksi secara kimia antara adsorbat dan adsorben, maka fenomenanya disebut adsorpsi kimia. Pada dasarnya adsorben dibagi menjadi tiga yaitu:
1. Adsorben yang mengadsorpsi secara fisik (karbon aktif, silika gel, dan zeolit).
2. Adsorben yang mengadsorpsi secara kimia (calcium chloride, metal hydride, dan complex salts), dan
3. Composite adsorbent, adsorben yang mengadsorpsi secara kimia dan fisik.
2.4.2 Adsorpsi Secara Fisik
Pada adsorpsi jenis ini, adsorpsi terjadi tanpa adanya reaksi antara molekul-molekul adsorbat dengan permukaan adsorben. Molekul-molekul adsorbat terikat secara lemah karena adanya gaya van der Waals. Adsorpsi ini relatif berlangsung cepat dan bersifat reversibel (dapat dikembalikan). Proses adsorpsi fisik terjadi tanpa memerlukan energi aktivasi, sehingga proses tersebut membentuk lapisan jamak (multilayer) pada permukaan adsorben. Ikatan yang terbentuk dalam adsorpsi fisika dapat diputuskan dengan mudah, yaitu dengan cara degassing (pemanasan) pada temperatur 150-200°C selama 2-3 jam (Alberty dan Daniels, 1983).
2.4.3 Adsorpsi Secara Kimia
Dalam adsorpsi kimia, proses adsorpsi terjadi dengan adanya pembentukan ikatan kimia dengan sifat yang spesifik karena tergantung pada jenis adsorben dan adsorbatnya. Yaitu reaksi yang terjadi antara zat padat dengan zat terlarut yang teradsorpsi. Adsorpsi ini bersifat spesifik dan melibatkan gaya yang jauh lebih besar daripada adsorpsi fisika. Panas yang dilibatkan adalah sama dengan panas reaksi kimia (Alberty dan Daniels, 1983). Tabel 2.6 memperlihatkan perbedaan antara adsorpsi fisika dan kimia.
Tabel 2.2 Perbedaan Adsorpsi Fisik dan Kimia
Adsorpsi Fisik Adsorpsi Kimia
Molekul terikat pada adsorben oleh gaya van der waals
Molekul terikat pada adsorben oleh ikatan kimia
Mempunyai entalpi reaksi 4 sampai 40 kJ/mol
Mempunyai entalpi reaksi 40 sampai 800 kJ/mol
Dapat membentuk lapisan multilayer Membentuk lapisan monolayer Adsorpsi hanya terjadi pada suhu di
bawah titik didih adsorbat
Adsorpsi dapat terjadi pada suhu tinggi
Tidak melibatkan energi aktifasi tertentu Melibatkan energi aktifasi tertentu Bersifat tidak spesifik Bersifat sangat spesifik
(Anonimous, 2011)
2.4.4 Faktor-faktor yang mempengaruhi adsorpsi
Faktor-faktor yang mempengaruhi proses adsorpsi adalah sebagai berikut:
1. Pengadukan (Agitation)
Tingkat adsorpsi dikontrol baik oleh difusi film maupun difusi pori, tergantung pada tingkat pengadukan pada sistem.
2. Kelarutan Adsorbat
Senyawa terlarut memiliki gaya tarik-menarik yang kuat terhadap pelarutnya sehingga lebih sulit diadsorpsi dibandingkan senyawa tidak larut.
3. Ukuran Molekul Adsorbat
Tingkat adsorpsi pada alifatik, aldehid, dan alkohol biasanya naik diikuti dengan kenaikan ukuran molekul. Hal ini dapat dijelaskan dengan kenyataan bahwa gaya tarik antara adsorben dan molekul (adsorbat) akan semakin besar ketika ukuran molekul semakin mendekati ukuran pori adsorben. Tingkat adsorpsi tertinggi terjadi jika pori adsorben cukup besar untuk dilewati oleh molekul (adsorbat).
4. Karakteristik Adsorben
a. Kemurnian adsorben, sebagai zat untuk mengadsorpsi maka adsorben yang lebih murni lebih diinginkan karena kemampuan adsorpsi lebih baik.
b. Luas permukaan dan volume pori adsorben, jumlah molekul adsorbat yang teradsorp meningkat dengan bertambahnya luas permukaan dan volume pori adsorben.
5. pH
Asam organik lebih mudah teradsorpsi pada pH rendah, sedangkan adsorpsi basa organik efektif pada pH tinggi.
6. Temperatur
Tingkat adsorpsi naik diikuti dengan kenaikan temperatur dan turun dengan penurunan temperatur. Temperatur yang dimaksud adalah temperatur adsorbat. Pada saat molekul-molekul gas atau adsorbat melekat pada
permukaan adsorben akan terjadi pembebasan sejumlah energi yang dinamakan peristiwa exothermic. Meningkatnya temperatur akan menambah jumlah adsorbat yang teradsorpsi demikian juga untuk peristiwa sebaliknya.
7. Waktu Kontak
Semakin lama waktu kontak antara adsorben dengan adsorbat, maka daya adsorpsinya akan semakin besar (Benefield, 1982).
2.5 Adsorben
Zat pengadsorpsi (adsorben) biasanya merupakan bahan-bahan yang sangat berpori, dan adsorpsi berlangsung pada dinding-dinding pori atau pada tempat tertentu dalam partikel tersebut. Pori-pori pada permukaan adsorben menyebabkan luas permukaan adsorben semakin besar hingga mencapai 2000 m2/g.
Karakteristik adsorben yang dibutuhkan untuk adsorpsi yang baik adalah sebagai berikut:
1. Luas permukaan adsorben. Semakin besar luas permukaan maka semakin besar pula daya adsorpsinya, karena proses adsorpsi terjadi pada permukaan adsorben.
2. Tidak ada perubahan volume yang berarti selama proses adsorpsi dan desorpsi.
3. Kemurnian adsorben. Adsorben yang memiliki tingkat kemurnian tinggi, daya adsorpsinya lebih baik.
Dibandingkan dengan adsorben dari sumber lain, adsorben yang berasal dari limbah pertanian memiliki karakteristik yang unik seperti kemudahan regenerasi dan desorpsi dengan larutan dasar (basic solutions) atau asam. Hal ini dapat disebabkan oleh fakta bahwa mereka memiliki kelompok permukaan fungsional seperti hidroksil dan karboksilat yang memiliki afinitas tinggi untuk kation logam (Kurniawan dkk., 2010).
Lignin merupakan senyawa aromatik berbentuk amorf, terdapat pada lamela tengah dan dinding sel yang berfungsi sebagai perekat antar sel. Sekam padi dengan kandungan lignin yang lebih banyak bersifat kaku dan rapuh. Lignin
dalam sekam adalah senyawa yang melekatkan serat yang satu dengan serat lainnya. Pada penggilingan padi, dihasilkan hampir 50% sekam yang banyak mengandung selulosa, lignin, dan mineral Na dan K yang mempunyai daya saponifikasi. Selulosa dalam sekam padi dapat dipergunakan untuk makanan ternak, tetapi kandungan ligninnya harus dihilangkan terlebih dahulu, biasanya dengan menggunakan KOH. Di beberapa negara misalnya Taiwan, telah diusahakan untuk melarutkan lignin dengan NH4OH sebagai pengganti KOH.
Penambahan NH4OH ini mempunyai keuntungan berupa penambahan sumber N dalam makanan ternak. Di samping itu NH4OH harganya jauh lebih murah dibandingkan dengan KOH.
Penghilangan logam berat oleh sekam padi dapat terjadi akibat adsorpsi maupun pertukaran ion. Nada dkk., (2008) menyebutkan bahwa lignin yang mengandung asam asetat peroksida mempunyai kemampuan lebih untuk berikatan dengan ion logam (ion exchange) dibandingkan lignin. Hal ini disebabkan oleh perbedaan keelektronegatifan antar ion.
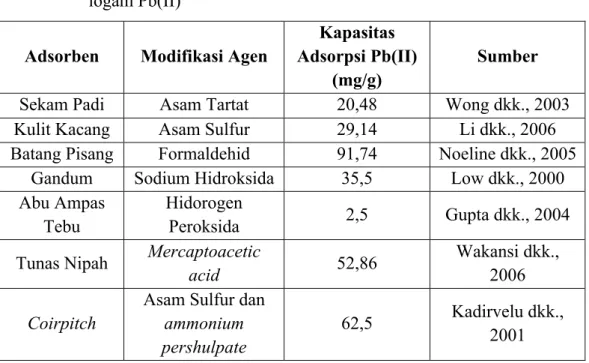
Tabel 2.3 Perbandingan kemampuan beberapa adsorben dalam menyerap ion logam Pb(II)
Adsorben Modifikasi Agen
Kapasitas Adsorpsi Pb(II)
(mg/g)
Sumber
Sekam Padi Asam Tartat 20,48 Wong dkk., 2003
Kulit Kacang Asam Sulfur 29,14 Li dkk., 2006
Batang Pisang Formaldehid 91,74 Noeline dkk., 2005 Gandum Sodium Hidroksida 35,5 Low dkk., 2000 Abu Ampas
Tebu
Hidorogen
Peroksida 2,5 Gupta dkk., 2004
Tunas Nipah Mercaptoacetic
acid 52,86 Wakansi dkk.,
2006 Coirpitch
Asam Sulfur dan ammonium pershulpate
62,5 Kadirvelu dkk., 2001
BAB III
TUJUAN DAN MANFAAT PENELITIAN
3.1 Tujuan Penelitian
Penelitian ini bertujuan untuk:
Mempelajari kemampuan adsorpsi ion logam Pb2+ oleh sekam padi hasil modifikasi terhadap kapasitas dan efisiensi penyerapan dengan memvariasikan konsentrasi sampel dan pengaruh perendaman (aktivasi) dengan asam sitrat.
3.2 Manfaat Penelitian
Penelitian ini dimaksudkan untuk menjadikan sekam padi sebagai adsorben penyerap ion logam Pb(II), karena sebelumnya telah diaktivasi secara kimiawi sehingga penggunaannya dapat bermanfaat dalam menangani pencemaran kontaminan logam Pb(II).
BAB IV
METODE PENELITIAN
4.1 Bahan dan Alat
Bahan baku yang digunakan adalah sekam padi yang diayak dengan ukuran 18-35 mesh, dan NaOH/asam sitrat sebagai aktivator kimia. Sekam padi diperoleh dari kawasan Aceh Besar dan NaOH/asam sitrat dibeli secara komersial dari Sigma- Aldrich. Alat yang digunakan dalam penelitian ini diantaranya: Hot plate, gelas ukur, oven dryer, ball mill dan shaker, desikator, timbangan digital, buchner funnel, termometer, beker gelas, pH meter dan labu ukur 1 L, sedangkan alat analisa meliputi AAS AA 6300 Shimadzu dan FTIR Prestise-21 Shimadzu.
4.2 Variabel Penelitian
Variabel percobaan yang dilakukan mencakup variabel tetap dan variabel berubah.
4.2.1 Variabel Tetap
a) Suhu Pengeringan sekam padi : 120°C (Marshall dkk, 2000) b) Massa Adsorben yang diadsorpsi : 1 gram (Marshall dkk, 1999) c) Volume NaOH : 500 mL (0,5 M) (Min dkk, 2004)
d) Kecepatan Pengadukan : 80 rpm
f) Ukuran Partikel : 18-35 mesh
4.2.2 Variabel Berubah
a) Konsentrasi Asam Sitrat : 0,5; 0,6; 0,7 dan 0,8 M b) Waktu Adsorpsi Pb(NO3)2 : 0 sampai 150 menit c) Konsentrasi Sampel Pb(NO3)2 : 20, 40, 60 dan 80 ppm
4.3 Prosedur Penelitian
Penelitian ini dilakukan dalam tiga (3) tahapan proses yaitu sebagai berikut:
- Tahap 1: Persiapan aktivasi
- Tahap 2: Proses aktivasi
- Tahap 3: Proses adsorpsi (penyerapan)
4.3.1 Persiapan Aktivasi
Sekam padi yang diperoleh dari penggilingan padi hasil pertanian di Desa Keude Bieng, Kecamatan Lhoknga, Kabupaten Aceh Besar, dicuci bersih beberapa kali dengan aquades untuk menghilangkan debu dan kotoran. Pertama sekali sekam padi direndam dalam air bersih (100°C) selama 1 jam, selanjutnya dikeringkan dibawah sinar matahari selama 4 jam. Sekam padi yang telah kering ini selanjutnya dimasukkan ke dalam oven dryer dan dikeringkan lagi pada temperatur 120°C selama 1 jam. Hasil pengeringan ini kemudian digiling dengan menggunakan ball mill dan diayak menggunakan sieve shaker pada ukuran 18-35 mesh (15 menit). Sekam padi yang telah halus selanjutnya dikeringkan lagi pada temperatur 120°C selama 3 jam dan kemudian disimpan di dalam desikator.
Untuk mengidentifikasi kandungan gugus hidroksil dalam substrat adsorben, maka diambil 1 mg adsorben yang telah dihaluskan untuk di analisis dengan menggunakan spektroskopi inframerah (FTIR).
4.3.2 Proses Aktivasi
Beberapa gram sekam padi kering yang telah diayak dimasukkan ke dalam 500 mL NaOH 0,5 M (Min dkk., 2004). Hal ini dilakukan untuk menghilangkan silikat dalam sekam padi, sehingga memungkinkan proses adsorpsi berjalan lebih baik. NaOH akan masuk ke dalam struktur selulosa dan bereaksi dengan silikat yang terdapat pada sekam padi sehingga membentuk natrium silikat (Kurniawan dan Notodarmojo, 2010). Menurut Sciban dkk (2006a), NaOH meningkatkan proses adsorpsi dengan menyebabkan pembentukan lokasi baru adsorpsi pada permukaan adsorben.
Campuran tersebut kemudian diaduk dengan menggunakan shaker pada 80 rpm selama 60 menit pada suhu kamar. Sekam padi yang sudah dicampur dengan NaOH kemudian dimasukkan ke dalam 500 mL aquades dan diaduk pada 80 rpm
selama 30 menit, prosedur ini diulang sampai diperoleh pH ± 7. Kemudian dikeringkan pada temperatur 50°C selama 2 jam (Marshall dkk, 1999).
Sekam padi yang sudah netral dicampur dengan asam sitrat 0,5 M, dengan memasukkan 1 gram adsorben ke dalam beker gelas 250 mL yang mengandung 100 mL asam sitrat tersebut. Rendaman diaduk selama 2 jam pada 80 rpm menggunakan shaker, kemudian dikeringkan selama 3 jam pada temperatur 50°C.
Prosedur tersebut diulangi untuk konsentrasi asam sitrat 0,6; 0,7, dan 0,8 M.
Sekam yang telah dimodifikasi ditempatkan pada kertas saring, dan dicuci dengan aquades untuk menghilangkan kelebihan dari asam sitrat sampai pH ± 7, yang diikuti dengan pengeringan kembali selama 24 jam pada temperatur 50°C (Marshall dkk., 2000).
Untuk mengidentifikasi adanya gugus hidroksil yang tersubstitusi oleh gugus karboksil dari asam sitrat, maka diambil 1 mg adsorben yang telah dihaluskan untuk dianalisis dengan menggunakan spektroskopi inframerah (FTIR).
4.3.3 Proses Adsorpsi (Penyerapan)
Sekam padi yang telah diaktivasi dengan asam sitrat dimasukkan ke dalam erlenmeyer 250 mL yang mengandung larutan Pb(NO3)2 20 ppm sebanyak 1 gram dari 100 mL larutan Pb(NO3)2 tersebut, dan selanjutnya dilakukan proses pengadukan 80 rpm menggunakan shaker selama waktu tertentu (0 sampai 150 menit) pada temperatur kamar. Setelah proses penyerapan selesai, larutan sampel diambil untuk dianalisis kadar Pb dengan AAS. Perlakuan di atas diulangi untuk konsentrasi 40, 60, dan 80 ppm.
4.3.4 Prosedur Analisis dengan AAS Shimadzu AA 6300
Pengujian kadar timbal dalam sampel (SNI 06-2517-1991) secara langsung dilakukan pada panjang gelombang 283,3 nm. Sampel yang akan dianalisis dimasukkan ke dalam tabung reaksi masing-masing sebanyak 20 mL.
Kemudian dihubungkan dengan pipa kapiler pada alat AAS.
4.3.5 Prosedur Analisis dengan FTIR Shimadzu IR Prestige 21
Sampel diuji pada kisaran panjang gelombang inframerah 400 cm-1 sampai 4000 cm-1. KBr digunakan sebagai background dalam analisis sampel serbuk (padatan). Sebanyak 10% berat sampel dihomogenkan dengan 90% KBr menggunakan mortar (Qaiser dkk., 2007).
BAB V
HASIL YANG DICAPAI
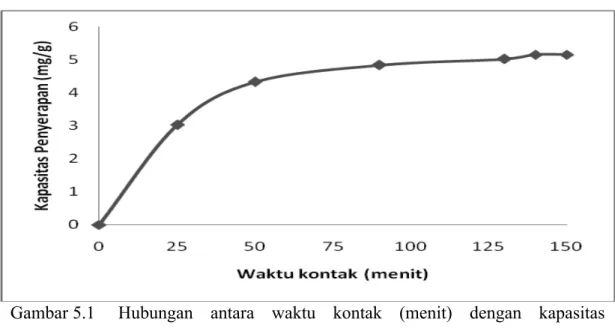
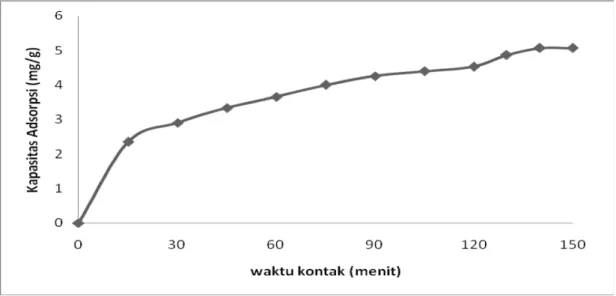
5.1 Penentuan Waktu Equilibrium Adsorpsi Pb(II) pada Uji Pendahuluan Pada uji pendahuluan ini waktu kontak divariasikan yaitu 0, 25, 50, 90, 130, 140 dan 150 menit dengan konsentrasi Pb(II) 80 mg/L, dengan adsorben yang diaktivasi oleh konsentrasi asam sitrat 0,8 M dan kecepatan pengaduk 80 rpm. Untuk mengetahui pengaruh waktu equilibrium (waktu dimana tidak terjadi lagi penyerapan) terhadap ion timbal (Pb) yang diserap oleh sekam padi yang telah diaktivasi, maka dilakukan uji pendahuluan dengan memvariasikan waktu kontak.
Gambar 5.1 Hubungan antara waktu kontak (menit) dengan kapasitas ! penyerapan (mg/g) untuk konsentrasi Pb(II) 80 mg/L dan adsorben dengan aktivasi asam sitrat 0,8 M
Pada Gambar 5.1 dapat dilihat bahwa waktu kontak optimum yang diperoleh pada konsentrasi 80 mg/L adalah pada waktu 150 menit dengan kapasitas penyerapan sebesar 5,15 mg/g. Hal ini disebabkan karena menit ke 150 cenderung tidak lagi terjadi peningkatan kapasitas penyerapan secara signifikan, bila dibandingkan dengan menit sebelum 150. Kondisi ini menunjukkan bahwa kapasitas penyerapan adsorben menuju titik kesetimbangan. Lamanya waktu kontak antara adsorbat dengan adsorben mempengaruhi kapasitas penyerapan, hal
ini dikarenakan semakin lama waktu kontak yang dilakukan, maka penyerapan akan mencapai kesetimbangan (equilibrium).
Semakin lama waktu kontak maka ion logam Pb (II) yang terserap akan semakin meningkat sampai terjadinya kesetimbangan. Hal yang sama juga dikemukakan (Makinde dkk., 2007), yang mengatakan bahwa pengaruh waktu kontak terjadi ketika adsorpsi belum mencapai kesetimbangan pada pengembangan biomaterial untuk manajemen limbah industri. Sebaliknya, pada saat kesetimbangan waktu kontak tidak berpengaruh terhadap kapasitas penyerapan. Hal ini juga sesuai dengan hasil penelitian yang telah dilakukan.
5.2 Pengaruh Waktu Kontak Terhadap Efisiensi Penyerapan pada Uji Pendahululan
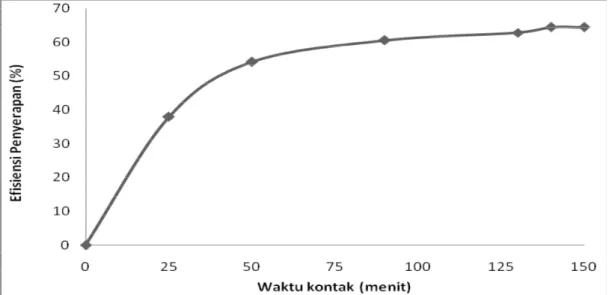
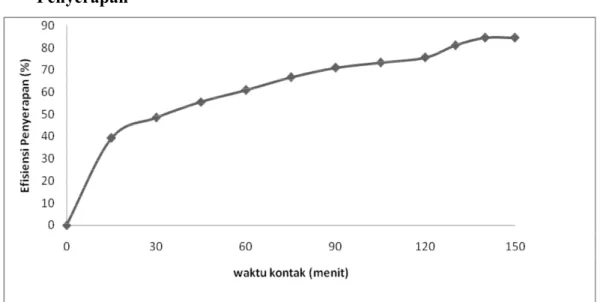
Untuk mengetahui pengaruh waktu kontak terhadap efisiensi penyerapan logam Pb (II) yang diserap maka dilakukan pengujian dengan memvariasikan waktu kontak. Pengujian ini hanya dilakukan untuk konsentrasi 80 mg/L dengan konsentrasi asam sitrat 0,8 M. Gambar 5.2 menjelaskan bahwa waktu kontak berbanding eksponensial dengan efisiensi penyerapan.
Gambar 5.2 Hubungan waktu kontak (menit) terhadap efisiensi penyerapan (%) pada konsentrasi Pb(II) 80 mg/L dan konsentrasi asam sitrat 0,8 M
Pada Gambar 5.2 dapat dilihat pada konsentrasi 80 mg/L dengan aktivator 0,8 M pada kecepatan pengaduk 80 rpm, diperoleh efisiensi penyerapan pada saat menit 0, 25, 50, 90, 130, 140 dan 150 berturut-turut adalah 0; 37,84; 54,11; 60,49;
62,73; 64,43 dan 64,43%. Berdasarkan Gambar 5.2 dapat dilihat bahwa efisiensi penyerapan terbesar terdapat pada menit ke 140 dan 150. Sedangkan pada menit ke 130 sampai 140 perbedaan efesiensi penyerapan hanya sedikit yaitu 1,7%, hal ini dikarenakan kapasitas penyerapan cenderung stabil dengan berjalannya waktu (jenuh) pada menit 130 ke menit 140. Dari hasil di atas dapat dilihat bahwa tidak terjadi penurunan efisiensi penyerapan, ini menandakan bahwa adsorpsi berlangsung secara fisika. Lamanya waktu kontak menyebabkan ruang adsorben yang terisi lebih banyak, sehingga semakin sulitnya adsorbat untuk menemukan ruang kosong yang tersedia. Hal ini menyebabkan kuantitas adsorbat yang diserap oleh adsorben pada waktu tertentu akan mulai memasuki keadaan statis atau dengan peningkatan yang relatif rendah. Teori di atas sesuai dengan uji pendahuluan yang telah dilakukan, yaitu semakin lama waktu kontak maka ion Pb (II) yang terserap akan semakin meningkat hingga mencapai kesetimbangan.
5.3. Pengaruh Konsentrasi Awal Adsorbat terhadap Kapasitas Penyerapan Hubungan antara konsentrasi awal adsorbat dengan kapasitas penyerapan ditampilkan pada Gambar 5.3 berikut.
! Gambar 5.3 Hubungan konsentrasi awal Pb(II) (ppm) terhadap kapasitas penyerapan (mg/g)pada waktu equilibrium (150 menit).
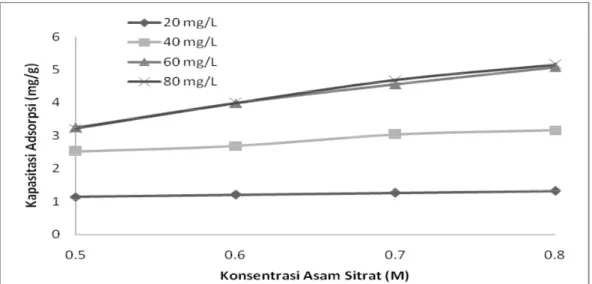
Dari Gambar 5.3 dapat dilihat pada konsentrasi asam sitrat 0,8 M, kapasitas adsorpsi pada konsentrasi awal 20, 40, 60 dan 80 mg/L adalah sebesar 1,33; 3,17; 5,08 dan 5,15 mg/g. Dari data tersebut dapat dilihat bahwa terjadi kenaikan yang cukup signifikan dari konsentrasi 40 mg/L ke 60 mg/L, sehingga didapati bahwa konsentrasi awal optimum adalah 60 mg/L.
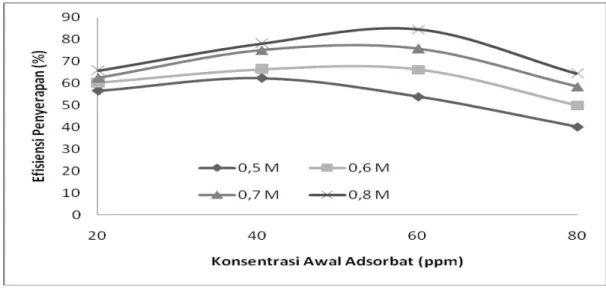
5.4. Pengaruh Konsentrasi Awal Adsorbat terhadap Efisiensi Penyerapan
Gambar 5.4 Hubungan konsentrasi awal Pb(II) (ppm) terhadap efisiensi penyerapan (%) dengan waktu 150 menit
Gambar 5.4 diatas menjelaskan hubungan antara konsentrasi awal adsorbat dengan efisiensi penyerapan ion Pb(II). Pada masing-masing konsentrasi asam sitrat terjadi peningkatan efisiensi penyerapan untuk setiap konsentrasi adsorbat.
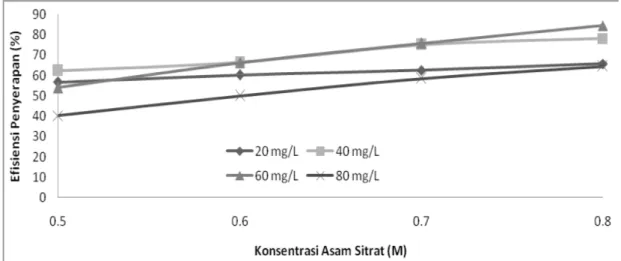
Efisiensi penyerapan terendah diperoleh pada konsentrasi asam sitrat 0,5 M dan efisiensi penyerapan terbesar diperoleh pada 0,8 M. Penentuan efisiensi penyerapan optimum dapat dilihat dari selisih kenaikan efisiensi penyerapan.
Sebagai contoh, untuk konsentrasi asam sitrat 0,7 M pada 20, 40, 60 dan 80 mg/L selisih efisiensinya berturut-turut adalah 12,30%; 0,71% dan terjadi penurunan efisiensi sebesar 17,21%. Begitu pula pada konsentrasi 20, 40, 60 dan 80 mg/L, yang memiliki kecenderungan kenaikan efisiensi yang terbesar pada konsentrasi asam sitrat 0,8 M, yaitu 12,32%; 6,39% dan terjadi penurunan efisiensi sebesar
20,1%. Berdasarkan hal tersebut dapat disimpulkan bahwa efisiensi penyerapan optimum berada pada konsentrasi asam sitrat 0,8 M.
Dari Gambar 5.4 didapatkan bahwa efisiensi optimum pada konsentrasi Pb(II) 60 mg/L dan konsentrasi asam sitrat 0,8 M, yaitu sebesar 84,52 %. Hal ini dapat dilihat pada Gambar 5.3 sebelumnya yaitu pada konsentrasi asam sitrat 0,8 M, selisih kapasitas adsorpsi pada konsentrasi awal 20, 40, 60 dan 80 mg/L adalah sebesar 1,84; 1,91 dan 0,07. Dari data tersebut dapat dilihat bahwa terjadi kenaikan yang cukup signifikan dari konsentrasi 40 mg/L ke 60 mg/L, sehingga didapat bahwa konsentrasi awal yang optimum yaitu pada konsentrasi Pb(II) 60 mg/L dan konsentrasi asam sitrat 0,8 M.
5.5 Pengaruh Konsentrasi Asam Sitrat terhadap Kapasitas Penyerapan Penentuan uji konsentrasi Pb(II) terhadap kapasitas penyerapan ini dilakukan dengan memvariasikan konsentrasi asam sitrat yaitu 0,5; 0,6; 0,7; 0,8 M, pada masing-masing konsentrasi Pb (II) 20, 40, 60 dan 80 mg/L terhadap waktu kontak 150 menit. Penentuan waktu kontak ini dilihat dari uji pendahuluan yang memperoleh waktu optimum yaitu 150 menit. Untuk menentukan kapasitas penyerapan terhadap konsentrasi asam sitrat, maka ditampilkan grafik antara konsentrasi asam sitrat (M) terhadap kapasitas penyerapan (mg/g).
Gambar 5.5 Pengaruh konsentrasi asam sitrat (M) terhadap kapasitas adsorpsi (mg/g) pada waktu kontak 150 menit
Dari Gambar 5.5 dapat disimpulkan bahwa pada masing-masing konsentrasi Pb(II) terjadi peningkatan kapasitas penyerapan untuk setiap konsentrasi asam sitrat. Kapasitas penyerapan paling rendah diperoleh pada konsentrasi asam sitrat 0,5 M dan kapasitas penyerapan optimum diperoleh pada konsentrasi asam sitrat 0,8 M.
5.6 Pengaruh Konsentrasi Asam Sitrat terhadap Efisiensi Penyerapan
Konsentrasi asam sitrat juga mempengaruhi efisiensi penyerapan adsorben terhadap adsorbatnya. Hal tersebut dapat dilihat dari Gambar 5.6 yang menyatakan hubungan antara kenaikan konsentrasi asam sitrat terhadap efisiensi adsorpsi.
Gambar 5.6 Pengaruh konsentrasi asam sitrat (M) terhadap efisiensi penyerapan (%) pada waktu 150 menit
Sama halnya seperti kenaikan kapasitas penyerapan, kenaikan konsentrasi asam sitrat pada perendaman juga mempengaruhi efisiensi adsorpsi dari sekam padi. Efisiensi paling tinggi yaitu pada konsentrasi asam sitrat 0,8 M dengan konsentrasi awal Pb(II) 60 mg/L. Pada konsentrasi asam sitrat 0,5; 0,6 dan 0,7 M, kapasitas adsorpsi juga meningkat, namun tidak terlalu signifikan.
5.7 Hubungan Waktu Kontak pada Kondisi Optimum terhadap Kapasitas Penyerapan
Untuk mengetahui pengaruh waktu kontak dan konsentrasi ion Pb(II) yang diserap, maka dilakukan pengujian dengan memvariasikan waktu kontak pada konsentrasi Pb(II) dan konsentrasi asam sitrat optimum yaitu 60 mg/L dan 0,8 M.
Dari percobaan, didapat bahwa lamanya waktu kontak Pb(II) dengan adsorben mempengaruhi kapasitas penyerapan. Semakin lama waktu kontak maka ion Pb2+
yang terserap akan semakin meningkat. Gambar 5.7 menjelaskan bahwa waktu kontak berbanding eksponensial dengan kapasitas penyerapan.
Gambar 5.7 Hubungan waktu kontak (menit) terhadap kapasitas penyerapan (mg/g) pada konsentrasi Pb(II) 60 mg/L dan konsentrasi asam sitrat 0,8 M.
Untuk mengetahui pengaruh waktu kontak dan konsentrasi ion Pb(II) yang diserap, maka dilakukan pengujian dengan memvariasikan waktu kontak pada konsentrasi Pb(II) dan konsentrasi asam sitrat optimum yaitu 60 mg/L dan 0,8 M.
Dari percobaan, didapat bahwa lamanya waktu kontak Pb(II) dengan adsorben mempengaruhi kapasitas penyerapan. Semakin lama waktu kontak maka ion Pb2+
yang terserap akan semakin meningkat. Gambar 5.7 di atas menjelaskan bahwa waktu kontak berbanding eksponensial dengan kapasitas penyerapan.
5.8 Hubungan Waktu Kontak pada Kondisi Optimum terhadap Efisiensi Penyerapan
Gambar 5.8 Hubungan waktu kontak terhadap efisiensi penyerapan pada konsentrasi Pb(II) 60 mg/L dan konsentrasi asam sitrat 0,8 M.
Pada Gambar 5.8 di atas dapat dilihat bahwa konsentrasi Pb(II) dan konsentrasi asam sitrat optimum, diperoleh efisiensi penyerapan pada saat menit 15, 30, 45, 60, 75, 90, 105, 120, 130, 140 dan 150 masing-masing adalah 39,23%;
48,48%; 55,54%; 60,92%; 66,68%; 70,97%; 73,31%; 74,80%; 74,92%; 84,52%
dan 84,52%. Berdasarkan Gambar 5.8 dapat dilihat bahwa pada proses penyerapan adsorbat, efesiensi penyerapan terbesar terlihat pada menit ke 140 dan 150. Akan tetapi pada menit 130 terlihat perbedaan efisiensi penyerapan dengan menit ke 140 hanya sekitar 3,4%, hal ini dikarenakan kapasitas penyerapan cenderung stabil dengan berjalannya waktu (jenuh) pada menit 140 ke menit 150.
5.9 Pengaruh Modifikasi Asam Sitrat pada Adsorben
Pengaruh modifikasi asam sitrat pada aktivasi sekam padi dapat dilihat dengan menggunakan Fourier Transform Infrared (FTIR) atau spektrofotometri inframerah. Grafik panjang gelombang spektra inframerah ditunjukkan pada Gambar 5.9 di bawah ini:
Gambar 5.9 Panjang gelombang spektra inframerah pada adsorben
transmitance (%)
Panjang Gelombang (cm-‐1)
Sekam Padi (Tanpa aktivasi Asam Sitrat) Aktivasi Asam Sitrat 0,5 M
Aktivasi Asam Sitrat 0,6 M
Aktivasi Asam Sitrat 0,7 M
Aktivasi Asam Sitrat 0,8 M
Aktivasi Asam Sitrat & Adsorbsi Timbal 0,8 M Gugus O-‐H
Gugus O-‐H pada
asam karboksilat Gugus C=O
Gugus C-‐O
Gugus C≡C
Dari Gambar 5.9 di atas grafik sekam padi (tanpa aktivasi), terlihat bahwa adsorben mempunyai ikatan hidroksil yaitu dengan berubahnya serapan pada bilangan gelombang 3244 cm-1. Gugus karbonil hadir karena pengaruh dari aktivasi asam sitrat. Pada aktivasi adsorben dengan konsentrasi asam sitrat 0,5 M telah hadir gugus karboksil yaitu dengan terjadinya serapan pada panjang gelombang 1087 cm-1 yang menandakan adanya gugus C-O, dan pada 1718 cm-1 menandakan adanya gugus C=O. Hal ini juga berlaku pada aktivasi dengan konsentrasi asam sitrat 0,6; 0,7 dan 0,8 M, dimana terjadi penyerapan paling besar yaitu pada aktivasi asam sitrat 0,8 M.
Pada konsentrasi 0,5 M terlihat gugus serapan karboksil memiliki daerah serapan (peak) yang kecil (sempit), seiring dengan bertambahnya konsentrasi asam sitrat terlihat bahwa daerah serapan (peak) semakin lebar. Hal ini dapat dilihat pada konsentrasi 0,6; 0,7 dan 0,8 M dimana konsentrasi 0,8 M mempunyai daerah serapan yang lebih besar (lebar), menandakan bahwa semakin banyak gugus karbonil yang terbentuk dengan semakin bertambahnya konsentrasi asam sitrat.
Pada panjang gelombang 2567 cm-1 terjadi serapan yang menandakan adanya gugus O-H pada asam karboksilat, yaitu pada aktivasi 0,5 M. Hal ini terjadi karena pangaruh aktivasi asam sitrat. Pada aktivasi asam sitrat dari 0,5 M sampai 0,8 M terlihat bahwa terjadi pergeseran pada serapan dari kanan ke kiri (panjang gelombang yang lebih besar), yang juga dipengaruhi oleh konsentrasi aktivator asam sitrat yang semakin besar. Pada grafik adsorben yang telah di adsorpsi, terlihat bahwa grafiknya tidak jauh berbeda dengan adsorben yang belum di adsorpsi. Perbedaan hanya terdapat pada panjang gelombang 2100 cm-1, dimana pada daerah tersebut memiliki gugus alkuna (C≡C).
Nieman dkk, (1998) memperoleh panjang gelombang spektra inframerah gugus hidroksil yaitu 3600-3200 cm-1, gugus hidroksil pada asam karboksilat 2700-2500 cm-1 dan gugus C=O pada 1760-1690 cm-1 dan C-O pada 1300-1050 cm-1. Oleh karena itu, dapat disimpulkan bahwa asam sitrat memberikan pengaruh terhadap adsorben yaitu dengan mensubstitusikan gugus karbonil pada gugus hidroksil.
BAB VI
RENCANA TAHAPAN BERIKUTNYA
Rencana kerja selanjutnya adalah:
a. Untuk tahun kedua akan dilakukan riset dengan menggunakan adsorben sekam padi dengan pengaktifan menggunakan NaOH 0,5 M sebagai bahan co-activator dan asam sitrat 0,8 M sebagai aktivator utama dalam mengadsorbsi larutan limbah cair Cd, Cr dan Zn pada berbagai konsentrasi awal yang divariasikan.
b. Selain itu dalam penelitian tahun kedua ini akan dilakukan kajian tentang kinetika reaksi dan adsorpsi isoterm dari adsorben terbaik pada larutan limbah cair Cd, Cr dan Zn.
BAB VII
KESIMPULAN DAN SARAN
7.1 Kesimpulan
Berdasarkan penelitian yang telah dilakukan, maka dapat diambil kesimpulan sebagai berikut:
1. Pada proses penyerapan ion logam Pb(II) didapatkan kapasitas penyerapan dan efisiensi optimum masing-masing sebesar 5,08 mg/g dan 84,52 %, yang terdapat pada konsentrasi 60 mg/L dan konsentrasi asam sitrat 0,8 M dengan waktu kontak 150 menit.
2. Aktivasi asam sitrat sangat berpengaruh dalam proses adsorpsi. Pada konsentrasi Pb(II) 20 mg/L dengan aktivasi asam sitrat 0,5; 0,6; 0,7 dan 0,8 M, diperoleh kapasitas adsorpsi berturut-turut adalah sebesar 1,14;
1,21; 1,26 dan 1,33 mg/g. Hal ini menunjukkan bahwa terjadi peningkatan kapasitas penyerapan seiring dengan bertambahnya konsentrasi aktivator.
3. Pengaruh modifikasi adsorben dapat dibuktikan dengan menggunakan FTIR. Gugus karboksil (C=O) hadir karena pengaruh dari aktivasi asam sitrat. Pada aktivasi adsorben dengan konsentrasi asam sitrat 0,5 M telah hadir gugus karboksil yaitu dengan terjadinya serapan pada panjang gelombang 1087 cm-1 yang menandakan adanya gugus C-O, dan pada 1718 cm-1 menandakan adanya gugus C=O.
7.2 Saran
Untuk menyempurnakan penelitian ini, maka perlu disarankan beberapa hal untuk penelitian selanjutnya, yaitu:
1. Untuk mendapatkan hasil maksimal, dapat dikaji pengaruh pH dan temperatur.
2. Sebaiknya dilakukan pengujian awal adsorben dengan menggunakan SEM sebelum dan sesudah adsorpsi.
Ucapan Terima Kasih
Penulis mengucapkan terimakasih atas pendanaan penelitian ini kepada Universitas Syiah Kuala, Kementrian Pendidikan dan Kebudayaan, sesuai dengan Surat Perjanjian Penugasan Dalam Rangka Pelaksanaan Program Penelitian Hibah Bersaing Tahun Anggaran 2015. Terima kasih disampaikan juga kepada mahasiwa Jurusan Teknik Kimia Universitas Syiah Kuala atas segala dukungan dan bantuannya baik administrasi maupun dalam pelaksanaan riset.
DAFTAR PUSTAKA
Alberty dan Daniels, 1983, Physical Chemistry, John Willey, Singapore.
Anonimous, 2007, Pengolahan Limbah dengan Elektrokimia, http://118.97.104.179/perpusBBIA/detail_artikel_majalah.php?id=4739 Diunduh pada 14 Juni 2015, pukul 08.00 WIB
Anonimous, 2009, Pengolahan Limbah dengan Penukar Ion, http://environergy.wordpress.com/2009/07/27/pengolahan-
limbahradioaktif-dengan-penukar-ion-ion-exchanger/ diunduh pada 14 Juni 2015, pukul 02.00 WIB.
Anonimous, 2010, Timbal (Pb),
http://repository.usu.ac.id/bitstream/123456789/17455/4/Chapter%20II.pdf diunduh pada 03 April 2015, pukul 13.30 WIB.
Anonimous,2011,Adsorpsi,http://www.slideshare.net/EvaMuslimahFarmasi/adsor psi diunduh pada 20 April 2015, pukul 14.00 WIB.
Anonimous, 2012, Asam Sitrat, http://id.wikipedia.org/wiki/Asam_sitrat diunduh pada 20 April 2015, pukul 14.00 WIB.
Anonimous, 2012, Pengolahan Limbah Cair secara Kimia,
http://www.scribd.com/doc/94188903/Pengolahan-Limbah-Cair-Secara- Kimia diunduh pada 14 Juni 2015, pukul 02.00 WIB.
Benefield, 1982, Process Chemistry for Water dan Waste Water Treatment.
Prentice Hall Inc. New Jersey.
Bernasconi, G., Gerster, H dan Hauser, H., 1995. Teknologi Kimia Bagian 2. Edisi pertama. Terjemahan Lienda Handojo, Pradnya Paramita. Jakarta. hal:204.
Franson dan Ann, M., 1989, Standard Method for Water and Wastewater Examination, American Public Health Association.
Gupta, V.K., Jain, C.K., Ali, I., Sharma, M dan Saini, V. K., 2004, Removal of lead(II) and nickel from wastewater using bagasse fly ash – a sugar industry waste. Water Res. 37, 4038–4044.
Indrawati, V dan Widodo, A., 2005, Pengaruh aktivator asam klorida terhadap daya adsorpsi bentonit pada rhodaminB, Skripsi, Jurdik Kimia, FMIPA, UNY.
Jaleel, C. A., Riadh, K., Gopi, R., Manivannan, P., Ines, J., Al-Juburi, H., Chang- Xing, Z., Hong-Bo, S dan Panneerselvam, R., 2009, Antioxidant defense responses: physiological plasticity in higher plants under abiotic constraints. Acta Physiologiae Plantarum 31: 427-436.
Kadirvelu, K., Thamaraiselvi, K dan Namasivayam, C., 2001, Adsorption of Pb(II) from aqueous solution onto activated carbon prepared from coirpith.
Sep. Purif. Technol. 24, 497–505.
Kurniawan, H dan Notodarmojo, S., 2010, Penggunaan Jerami Padi untuk Menyisihkan Limbah Warna Industri Tekstil Color Index Reactiva Orange 84, Jurusan Teknik Lingkungan, Fakultas Teknik Sipil dan Lingkungan, ITB.
Li, Q., Zhai, J., Zhang, W., Wang, M dan Zhou, J., 2006. Kinetic studies of adsorption of Pb(II), Cr(III) and Cu(II) from aqueous solution by sawdust and modified peanut husk. J. Hazard. Mater. B 141, 163–167.
Low, K.S., Lee, C. K dan Liew, S.C., 2000. Sorption of cadmium and lead from aqueous solutions by spent grain. Process Biochem. 36, 59–64.
Makinde, W. O., Adetunji, G. J., Oladipo, A. A., Adekunle, A. S., 2007, Biomaterial Development for Industrial Waste Management, Electronic Journal of Environment Agricultural and Food Chemistry, ISSN: 1573- 4377, p.2120-2129
Marshall, W. E., Wartelle, L. H., Boler, D. E., Johns, M. Mdan Toles, C. A., 1999, Enhanced metal adsorption by soybean hulls modified with citric acid, Bioresource Technology, 69, pp.263-268.
Marshall, W. E., Wartelle, L. H., Boler, D. E dan Toles, C. A., 2000, Metal ion adsorption by soybean hulls modified with citric acid: a comparative study, Environmental Technology, 21, pp.601–607.
Min, S. H., Han, J. S., Shin, E. W dan Park, J. K., 2004. Improvement of Cadmium ion Removal by Base Treatment of Juniper Fiber. Water Res. 38, 1289- 1295.
Nada, A. M. A., Kassem, N. F., Mohamed, S. H., 2008, Ion exchangers from precipitated lignin, BioResources Journal, vol 3, no. 2, p.538-548
Notodarmodjo, S dan Deniva, A., 2004, Penurunan zat organik dan kekeruhan menggunakan teknologi membran ultrafiltrasi dengan sistem aliran Dead- end. Proceeding ITB Sains & Tek. Vol 36 A, No. 1,. Fakultas Teknik Sipil dan Perencanaan. Departemen Teknik Lingkungan , ITB
Nieman D, A., Timothy, A., Skoog, F., Holler, J., 1998, Principles of Instrumental Analysis, National Library of Australia.
Noeline, B.F., Manohar, D. M dan Anirudhan, T.S., 2005. Kinetic and equilibrium modeling of lead(II) sorption from water and wastewater by polymerized banana stem in a batch reactor. Sep. Purif. Technol. 45, 131–140.
Nugraha, S dan Setyawati, J., 2001, Peluang Agrobisnis Abu Sekam, Balai Pertanian Pascapanen Pertanian, balitpasca2001@hotmail.com, hal. 1-2.
Qaiser, S., Saleemi, A. RdanAhmad, M. M., 2007, Heavy Metal Uptake by Agro Based Waste Materials, Journal of Biotechnology, vol.10, no.3, p. 409-416.
Roy, M dan Glenn., 1995, Activated Carbon Applications in the Food dan Pharmaceutical Industries, Lewis Publisher , United States of America.
Sciban, M., Klasˇnja, M dan Sˇkrbic´, B., 2006. Modified softwood sawdust as adsorbent of heavy metal ions from water. J. Hazard. Mater. B 136,266–
271.
Torresdey, G., Tiemann, K. J., Videa, J. R. P., Armendariz, V., Parsons, J. G., 2003, Binding of Silver(I) Ions by Alfalfa Biomass (Medicago sativa) Batch pH, Time,Temperature and Ionic Strength Studies, Journal of Hazardous Substance Research, vol.4, p.1-14.
Wakansi, D., Horsfall Jr., M dan Spiff, A.I., 2006. Sorption kinetics of Pb(II) and Cu(II) ions from aqueous solution by Nipah palm (Nypa fruticans Wurmb) shoot biomass. Elec. J. Biotechnol. 9, 587–592.
Wong, K.K., Lee, C.K., Low, K. S dan Haron, M.J., 2003. Removal of Cu and Pb by tartaric acid modified rice husk from aqueous solutions. Chemosphere 50, 23–28.
Gambar 1 Sekam padi yang telah di aktivasi
Gambar 2 Pelepah kelapa sawit dan kulit jeruk yang sebelum dihaluskan
Gambar 3 Proses adsorpsi menggunakan shaker
Gambar 4 Proses filtrasi adsorben dan filtrat menggunakan corong buchner
Gambar 5 Sampel larutan ion logam Pb2+ setelah proses adsorpsi
A. Identitas Diri Ketua Peneliti
1 Nama Lengkap (dengan gelar) Dr. Farid Mulana, ST, M.Eng.
2 Jabatan Fungsional Lektor
3 Jabatan Struktural Ketua Career Development Centre (CDC) Unsyiah 4 NIP/NIK/No. Identitas lainnya 197202081997021001
5 NIDN 0008027203
6 Tempat dan Tanggal Lahir Dilip Lamtengah/08-02-1972
7 Alamat Rumah Jl. Prada 1 Lr. Seulanga No 20 Kp. Pineung Banda Aceh 8 Nomor Telepon/Faks/HP 08126989750
9 Alamat Kantor Jurusan Teknik Kimia Fakultas Teknik Unsyiah 10 Nomor Telepon/Faks 0651-7412301
11 Alamat e-mail farid.mulana@unsyiah.ac.id
12 Lulusan yang telah dihasilkan S1 = 74 Orang, S2 = 18 Orang, S3 = - Orang 13 Matakuliah yang diampu 1. Proses Industri Kimia 1
2. Proses Industri Kimia 2
3. Termodinamika Teknik Kimia 1 4. Termodinamika Teknik Kimia 2 5. Neraca massa dan energi
B. Riwayat Pendidikan
S1 S2 S3
Nama Perguruan Tinggi UNSYIAH Banda Aceh
Toyohashi University of Technology, Jepang
Toyohashi University of Technology, Jepang Bidang Ilmu Teknik Kimia Materials Science Functional Materials
Engineering Tahun Masuk - Lulus 1990 - 1996 2000 - 2002 2002 - 2005 Judul Skripsi/Tesis/
Disertasi
Pra-rencana Pabrik Asam Salisilat
Preparation And Characterization Of Hydrogen Absorbing Composites
Development Of Hydrogen Absorbing Composites Prepared By Mechanical Milling Of Transition Metals And Alanates With Carbonaceous Materials Nama Pembimbing/
Promotor
Ir. Faisal Daud.
M.Sc (Alm)
Prof. Dr. Nobuyuki Nishimiya
Prof. Dr. Nobuyuki Nishimiya
C. Pengalaman Penelitian Dalam 5 Tahun Terakhir
No Tahun Judul Penelitian
Pendanaan
Sumber Jml (Juta Rp) 1 2015 Peningkatan Nilai Jual Mineral Magnesit Ore Kawasan
Aceh Besar Menjadi Pupuk Kiserit
Program Unggulan Unsyiah DIPA Unsyiah
Rp 85 Juta
2 2015 Aplikasi Adsorben Berbasis Biomassa Yang Dimodifikasi Untuk Penyerapan Limbah Cair Jenis Logam Berat (Tahun ke-1) – Sebagai Ketua
Hibah Bersaing, Program Desentralisasi, DIPA Unsyiah
Rp 56 Juta
3 2015 Production of Methane and Compost from Biomass Residue using Thermophilic Stirred Anaerobic Reactor (Tahun ke-3) – Sebagai Anggota
Penelitian KLN dan Publikasi Internasional, DIKTI
Rp 200 Juta
4 2014 Production of Methane and Compost from Biomass Residue using Thermophilic Stirred Anaerobic Reactor (Tahun ke-2) – Sebagai Anggota
Penelitian KLN dan Publikasi Internasional, DIKTI
Rp 200 Juta
5 2013 Studi Pembuatan Biokomposit Berbasis Sekam Padi dan Recycled Plastic dengan Penambahan Coupling Agent
Hibah Bersaing, Program
Rp 45 Juta