PENGGUNAAN KARBON AKTIF KULIT JERUK SEBAGAI ADSORBEN UNTUK MENGADSORPSI METHYL ORANGE
TUGAS AKHIR
Oleh:
DESY NATALYA PANJAITAN 140407023
Pembimbing
Prof.Dr. Ir. MuhammadTurmuzi, M. S.
PROGRAM STUDI TEKNIK LINGKUNGAN FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA MEDAN
2019
TA/TL-USU/2019/121
Universitas Sumatera Utara
PENGGUNAAN KARBON AKTIF KULIT JERUK SEBAGAI ADSORBEN UNTUK MENGADSORPSI METHYL ORANGE
TUGAS AKHIR
Oleh:
DESY NATALYA PANJAITAN 140407023
TUGAS AKHIR INI DIAJUKAN UNTUK MELENGKAPI SEBAGIAN PERSYARATAN MENJADI SARJANA TEKNIK
PROGRAM STUDI TEKNIK LINGKUNGAN FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA MEDAN
2019
Universitas Sumatera Utara
ii KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa atas berkat dan karunia-Nya sehingga penulis dapat menyelesaikan Tugas Akhir dengan judul
“Penggunaan Karbon Aktif Kulit Jeruk sebagai Adsorben untuk Mengadsorpsi Methyl Orange” sebagai syarat penyelesaian sarjana pendidikan di Program Studi Teknik Lingkungan Universitas Sumatera Utara. Penulis ingin mengucapkan terima kasih kepada seluruh pihak yang telah membantu serta memberikan dukungan dari awal sampai akhir proses pembuatan Tugas Akhir ini, khususnya kepada:
1. Bapak Prof. Dr. Ir. Muhammad Turmuzi, M.S selaku dosen pembimbing, yang telah memberikan bimbingan, ilmu, masukan, dukungan, waktu serta bantuan kepada penulis selama pengerjaan Tugas Akhir ini.
2. Ibu Ir. Netti Herlina, M.T., selaku Ketua Program Studi Teknik Lingkungan USU, atas segala bimbingan dan bantuan yang telah diberikan.
3. Bapak Dr. Amir Husin, S.T., M.T., selaku Sekretaris Jurusan Program Studi Teknik Lingkungan USU.
4. Ibu Isra’ Suryati, S.T., M.Si., selaku Koordinator Tugas, atas segala bimbingan dan bantuan yang telah diberikan.
5. Seluruh dosen Program Studi Teknik Lingkungan USU atas ilmu yang sudah diberikan.
6. Saudari Devi selaku Koordinator dan Saudara Aji selaku asisten Laboratorium Penelitian Fakultas Farmasi yang memberi arahan saat melakukan aktivasi, pengujian adsorpsi dan pengujian FTIR di laboratorium.
7. Seluruh asisten Lab. Ekologi, Lab. PIK, Lab. Rekayasa Beton dan Lab. OTK yang memberi bantuan dalam penggunaan alat di laboratorium.
8. Bapak Juna selaku Koordinator Laboratorium Pengembangan PTKI yang memberi bantuan dalam menganalisa sampel.
9. Saudari Riana selaku Koordinator Laboratorium Fisika UNIMED yang memberi bantuan dalam pengujian SEM-EDS.
10. Semua pihak yang tidak bisa disebutkan namanya satu per satu yang turut membantu penyelesaian Tugas Akhir ini.
Universitas Sumatera Utara
iii Penulis menyadari bahwa tugas akhir ini masih jauh dari kesempurnaan. Segala kritik, saran dan masukan dari semua pihak sangat diharapkan agar di masa yang akan datang Tugas Akhir ini lebih sempurna. Akhir kata, penulis berharap semoga Tugas Akhir ini dapat memberikan manfaat bagi kita semua.
Medan, April 2019
Penulis
iv ABSTRAK
Penggunaan ekstensif bahan kimia dan zat pewarna merupakan sumber utama pencemaran air dalam limbah industri tekstil. Salah satu zat pewarna tekstil yang banyak digunakan adalah methyl orange. Methyl orange berbahaya karena merupakan pewarna anionik azoik yang dapat larut dalam air dan bersifat toksik pada kehidupan organisme. Salah satu metode penyisihan zat pewarna tekstil adalah adsorpsi. Penelitian ini menggunakan dua jenis adsorben, yaitu biosorben dari kulit jeruk (tanpa perlakuan) dan karbon aktif dari kulit jeruk (diaktivasi dengan H3PO4 lalu dipirolisis). Sampel biosorben dan karbon aktif dikarakterisasi dengan SEM-EDS, FTIR dan bilangan iodin. Tujuan penelitian ini adalah untuk mengkaji pengaruh variasi variabel terhadap efisiensi penyisihan methyl orange menggunakan biosorben dan karbon aktif dari kulit jeruk, serta mengkaji model kinetika dan isoterm adsorpsi yang sesuai untuk menggambarkan proses adsorpsi yang terjadi. Model kinetika adsorpsi dianalisa menggunakan orde pertama semu dan orde kedua semu, sedangkan untuk isoterm adsorpsi dianalisa menggunakan Langmuir dan Freundlich. Variabel penelitian terdiri dari waktu kontak, pH dan dosis adsorben. Hasil penelitian menunjukkan bahwa biosorben mampu untuk menyisihkan methyl orange dengan kondisi optimum waktu kontak 30 menit, pH 5 dan dosis sebesar 2 g/L. Efisiensi penyisihan yang diperoleh sebesar 50,0%. Sedangkan, karbon aktif mampu menyisihkan methyl orange dengan kondisi optimum waktu kontak 60 menit, pH 5 dan dosis sebesar 5 g/L. Efisiensi penyisihan yang diperoleh sebesar 81,2%. Model kinetika adsorpsi yang sesuai untuk biosorben dan karbon aktif adalah orde kedua semu. Isoterm adsorpsi yang tepat untuk menggambarkan proses yang terjadi adalah isoterm Langmuir.
Kata kunci : Adsorpsi, methyl orange, kulit jeruk, asam fosfat, biosorben, karbon aktif
Universitas Sumatera Utara
v ABSTRACT
The extensive uses of chemicals and dyes are the main sources of water pollution in the textile industry effluent. One of the most widely used dye is methyl orange. Methyl orange is dangerous because it is an anionic azoic dye which can dissolve in water and is toxic to the life of the organism. One of the textile dye removal method is adsorption. This study used two types of adsorbents, namely biosorbent from orange peel (without treatment) and activated carbon from orange peel (activated with H3PO4 and then pyrolized). Biosorbent and activated carbon samples were characterized by SEM-EDS, FTIR and iodine number. The purpose of this research were to examine the effect of variable variations on the efficiency of removal of methyl orange using biosorbent and activated carbon from orange peel, as well as to determine the suitable adsorption kinetic and adsorption isoterm models to describe the occurring adsorption process. The adsorption kinetic models were analyzed using Pseudo First Order and the Pseudo Second Order, meanwhile for adsorption isotherms analyzed using Langmuir and Freundlich.
Research variables consist of the influence of contact time (0, 5, 15, 30, 60 and 90 minutes), pH (2, 3, 4, 5 and 6) and adsorbent dose (1 g/L, 2 g/L, 3 g/L, 4 g/L and 5 g/L). The result showed that biosorbent was able to remove methyl orange with the optimum condition of contact time for 30 minutes, pH 5 and dose of 2 g/L. The removal efficiency reached was 50,0%. Meanwhile, activated carbon was able remove methyl orange with the optimum condition of contact time for 60 minutes, pH of 5 and dose of 5 g/L. The removal efficiency reached was 81,2%. The suitable adsorption kinetic’s model for biosorbent and activated carbon were Pseudo Second Order models. The best adsorption isoterm to describe the occuring process was Langmuir isoterm.
Keywords : Adsorption, methyl orange, orange peel, phosphoric acid, biosorbent, activated carbon
vi DAFTAR ISI
KATA PENGANTAR ii
ABSTRAK iv
ABSTRACT v
DAFTAR ISI vi
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR PERSAMAAN xi
BAB I PENDAHULUAN I-1
1.1 Latar Belakang I-1
1.2 Rumusan Masalah I-4
1.3 Tujuan Penelitian I-4
1.4 Ruang Lingkup I-4
1.5 Manfaat Penelitian I-5
BAB II TINJAUAN PUSTAKA II-1
2.1 Limbah Tekstil II-1
2.2 Methyl Orange II-1
2.3 Kulit Jeruk dan Karakteristiknya II-2
2.4 Karbon aktif II-2
2.5 Proses Aktivasi Karbon Aktif II-3
2.6 Karakterisasi Adsorben II-4
2.7 Adsorpsi II-5
2.7.1 Faktor yang Mempengaruhi Adsorpsi Warna II-7
2.7.2 Mekanisme Adsorpsi II-9
2.8 Pemodelan Batch Adsorpsi II-9
2.8.1 Model Kinetika Adsorpsi II-10
2.8.2 Model Isotherm Adsorpsi II-11
BAB III METODE PENELITIAN III-1
3.1 Lokasi Penelitian III-1
3.2 Waktu Penelitian III-1
3.3 Jenis Penelitian III-1
Universitas Sumatera Utara
vii
3.4 Variabel Penelitian III-1
3.5 Sumber Data III-2
3.6 Kerangka Penelitian III-2
3.7 Langkah Percobaan III-4
3.7.1 Pembuatan Limbah Cair Sintetik III-4
3.7.2 Reaktor Percobaan III-4
3.8 Persiapan dan Pengujian Adsorben III-4
3.8.1 Pembuatan Adsorben III-4
3.8.2 Proses Percobaan pada Reaktor Batch III-5
3.9 Pengujian Daya Serap Iodin III-6
3.10 Analisa Sampel III-7
3.11 Analisa Data III-7
3.12 Kapasitas Adsorpsi III-7
3.13 Kinetika Adsorpsi III-7
3.14 Isoterm Adsorpsi III-8
BAB IV HASIL DAN PEMBAHASAN IV-1
4.1 Hasil Scanning Electron Microscope (SEM), Energy Dispersion Spectrometry (EDS) Permukaan Biosorben dan Karbon Aktif Kulit
Jeruk IV-1
4.2 Uji Karakteristik Fourier Transform Infra-Red (FTIR) IV-3
4.3 Uji Daya Serap Iodin IV-5
4.4 Pengaruh Waktu Kontak terhadap Penyisihan Methyl Orange IV-6 4.5 Pengaruh pH terhadap Penyisihan Methyl Orange IV-7 4.6 Pengaruh Dosis terhadap Penyisihan Methyl Orange IV-9
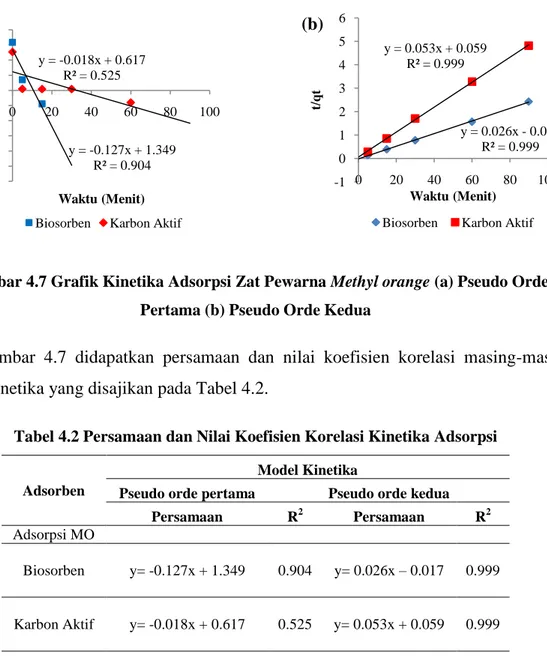
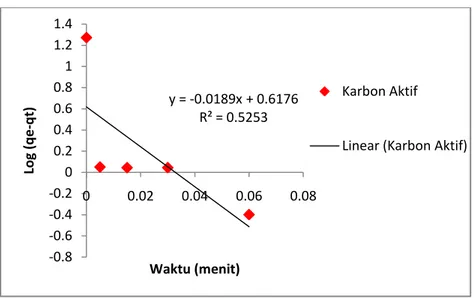
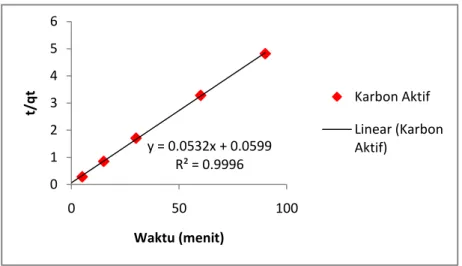
4.7 Kinetika Adsorpsi IV-11
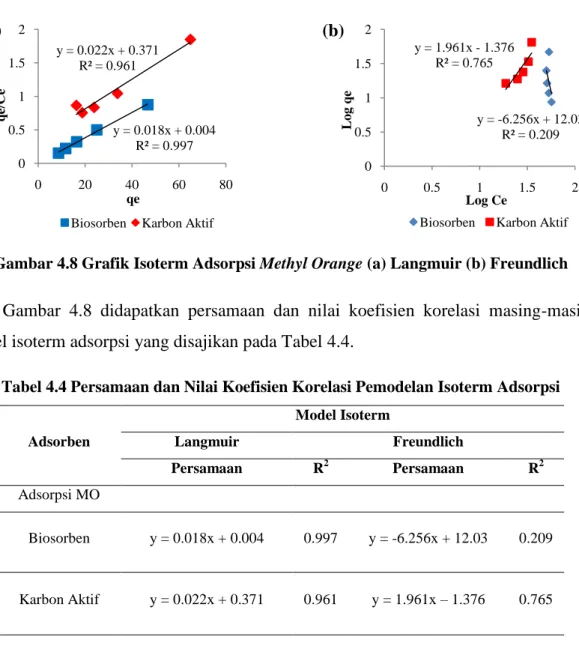
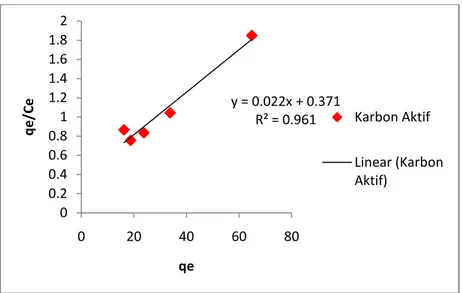
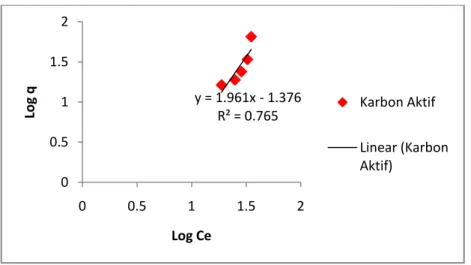
4.8 Isoterm Adsorpsi IV-14
BAB V PENUTUP V-1
5.1 Kesimpulan V-1
5.2 Saran V-2
DAFTAR PUSTAKA LAMPIRAN
viii DAFTAR TABEL
4.1 Hasil Uji Daya Serap Iodin IV-5
4.2 Persamaan dan Nilai Koefisien Korelasi Kinetika Adsorpsi IV-12 4.3 Parameter Model Kinetika Adsorpsi Methyl Orange IV-13 4.4 Persamaan dan Nilai Koefisien Korelasi Isoterm Adsorpsi IV-15 4.5 Parameter Model Isoterm Adsorpsi Methyl Orange IV-16
Universitas Sumatera Utara
ix DAFTAR GAMBAR
2.1 Struktur Zat Pewarna Methyl Orange ... II-1 3.1 Diagram Alir Penelitian ... III-3 3.2 Reaktor Batch ... III-4 4.1 Hasil Uji SEM (a) Biosorben dan (b) Karbon Aktif Kulit Jeruk ... IV-1 4.2 Hasil Uji EDS (a) Biosorben dan (b) Karbon Aktif Kulit Jeruk ... IV-2 4.3 Uji FTIR Spectrofotometry pada Biosorben dan Karbon Aktif Kulit Jeruk IV-3 4.4 Pengaruh Waktu Kontak terhadap Penyisihan Methyl Orange ... IV-6 4.5 Pengaruh pH terhadap Penyisihan Methyl Orange ... IV-8 4.6 Pengaruh Dosis terhadap Penyisihan Methyl Orange ... IV-9 4.7 Grafik Linier Kinetika Adsorpsi Methyl Orange (a) Pseudo Orde
Pertama (b) Pseudo Orde Kedua ... IV-12 4.8 Grafik Linier Kinetika Adsorpsi Methyl Orange (a) Langmuir
(b) Freundlich ... IV-15
x DAFTAR PERSAMAAN
2.1 Daya Serap Iodin ... II-5 2.2 Kapasitas Adsorpsi ... II-6 2.3 Efisiensi Penyisihan ... II-6 2.4 Model Orde Semu Pertama ... II-10 2.5 Integrasi Log Orde Semu Pertama ... II-10 2.6 Bentuk Linier Orde Semu Pertama ... II-10 2.7 Model Orde Semu Kedua ... II-10 2.8 Bentuk Linier Orde Semu Kedua ... II-11 2.9 Persamaan Non-Linier Langmuir ... II-11 2.10 Persamaan Linier Langmuir ... II-11 2.11 Parameter Kesetimbangan ... II-12 2.12 Bentuk Empiris Isoterm Freundlich ... II-12 2.13 Bentuk Linier Isoterm Langmuir ... II-13
Universitas Sumatera Utara
BAB I PENDAHULUAN
1.1 Latar Belakang
Industri tekstil dan produk tekstil (TPT) adalah salah satu industri penting karena merupakan gabungan dari industri berteknologi tinggi, padat moral dan keterampilan sumber daya manusia yang menyerap tenaga kerja (Asmara dkk, 2013). Industri tekstil menjadi sektor yang tumbuh dengan cepat diantara semua industri. Ini dibuktikan dari pemasaran global, dimana permintaan bahan kimia dan zat pewarna tekstil mengalami peningkatan produksi sebesar 2,8% per tahun (Ghaly et al., 2014). Produksi tekstil membutuhkan sejumlah besar bahan kimia, zat pewarna dan air tawar dalam berbagai proses (pewarnaan, finishing, ukuran dan pembilasan). Penggunaan ekstensif bahan kimia dan zat pewarna merupakan sumber utama pencemaran air dalam limbah industri tekstil (Halder dan Islam, 2015).
Salah satu zat pewarna yang banyak digunakan dalam industri tekstil adalah methyl orange. Methyl orange merupakan pewarna anionik azoik yang larut dalam air dan banyak digunakan dalam industri tekstil, pabrik kertas dan percetakan (Zhang et al., 2016). Pewarna ini memiliki kromatisitas dan komponen organik yang tinggi, kualitas kimia yang stabil sehingga sulit untuk didegradasi (Xin et al., 2015) dan merupakan senyawa toksik pada kehidupan organisme (Shakoor dan Abu, 2016). Kandungan berbahaya pada methyl orange dapat menyebabkan ancaman serius terhadap sifat fisika- kimia air tawar dan ekosistem perairan (Subbaiah dan Dong-Su, 2016), seperti dapat mengurangi penetrasi sinar matahari sehingga proses fotosintesis menjadi terganggu yang pada akhirnya menyebabkan kerusakan ekosistem perairan (Zhang et al., 2016).
Oleh karena itu, penyisihan zat pewarna tekstil dari effluen sangat diperlukan sebelum dibuang ke badan air (Tang et al., 2012). Ada beberapa metode yang telah digunakan dalam pengolahan limbah tekstil, seperti proses oksidasi, nanofiltrasi, biodegradasi, elektrolisis, ozonisasi, koagulasi/flokulasi dan adsorpsi (Kanchi et al., 2017). Dari metode-metode tersebut, adsorpsi menjadi metode yang paling banyak digunakan untuk mengolah limbah pewarna tekstil karena biayanya murah, desainnya sederhana serta mudah didapat dan mampu untuk mengolah zat warna dalam konsentrasi yang lebih
I-2 tinggi (Velmurugan et al., 2011). Beberapa bahan berupa karbon aktif telah diuji untuk menyerap zat pewarna ini dari larutan cair (Hashemian et al., 2014).
Karbon aktif merupakan sorben yang efektif dan telah banyak digunakan dalam pengolahan air limbah zat pewarna (Deniz., 2013). Menurut Zhul-quarnain et al (2018), proses adsorpsi menggunakan karbon aktif telah terbukti menjadi salah satu metode paling efisien untuk menyisihkan zat warna. Ini dikarenakan karbon aktif memiliki luas permukaan yang besar, struktur mikro dan kapasitas adsorpsi tinggi (Montoya et al., 2014). Beberapa jenis karbon aktif yang telah digunakan secara komersial adalah zeolit, silika gel dan karbon. Namun, biayanya yang cukup tinggi membuat karbon aktif tersebut terbatas untuk digunakan dalam menangani limbah cair tekstil pada skala industri (Asgher dan Haq, 2012). Saat ini, ada banyak penelitian tentang pengembangan adsorben yang murah, yaitu menggunakan bahan limbah untuk menyisihkan zat pewarna dari limbah cair (Mohammadi et al., 2010).
Menurut Kanchi et al (2017), beberapa tahun terakhir dilakukan penyisihan zat warna menggunakan limbah pertanian dan menjadi sorotan karena sangat murah dan dapat dijadikan sebagai bahan alternatif. Beberapa limbah pertanian yang digunakan untuk mengadsorpsi zat pewarna meliputi: kulit kentang (Arampatzidou dan Eleni, 2016), kulit limau kupas (Shakoor dan Abu, 2016), limbah fermentasi (Kanchi et al., 2017), kulit jeruk (Munagapati dan Dong-Su, 2016), kulit pisang, kulit pear, brokoli dan banyak lagi (Cid et al., 2016). Chen et al (2011), juga menambahi bahwa produk limbah pertanian mengandung selulosa, hemiselulosa dan lignin yang dianggap bermanfaat untuk adsorpsi. Namun, kapasitas adsorpsi limbah pertanian untuk pewarna anionik diperoleh relatif rendah, karena permukaan limbah pertanian biasanya bermuatan negatif pada badan air alami, yang tidak bermanfaat untuk menyerap anion. Oleh karena itu, permukaan limbah pertanian harus dimodifikasi untuk meningkatkan kapasitas adsorpsinya pada pewarna anionik.
Beberapa adsorben yang telah digunakan dalam penyisihan methyl orange sebelumnya, yaitu limbah lidah buaya (Khaniabadi et al., 2016), debu tanaman kelor (Bazrafshan et al., 2014), surfaktan yang dimodifikasi dengan ulat sutra (Chen et al., 2011), monolit dilapisi karbon (Hosseini et al., 2011) dan masih banyak lagi. Selain dari adsorben tersebut, salah satu limbah pertanian yang berpotensi dijadikan sebagai bahan baku
Universitas Sumatera Utara
I-3 adsorben dengan biaya murah adalah kulit jeruk (Mafira et al., 2013). Kulit jeruk merupakan salah satu bahan limbah berharga yang dibuang dari industri jus dengan produksi jeruk dunia diperkirakan > 60 juta ton per tahun. Akumulasi limbah jeruk di industri jeruk telah menghasilkan dua masalah penting, yaitu penggunaan lahan dan polusi dengan senyawa fenolik akibat pembuangan limbah ini. Masalah tersebut dapat diselesaikan dengan daur ulang limbah kulit jeruk yang masih memiliki kandungan senyawa potensial untuk dimanfaatkan (Nemr et al., 2009). Berdasarkan penelitian Munagapati dan Dong-Su (2016), kulit jeruk pada dasarnya terdiri dari selulosa, pektin, hemiselulosa, lignin, zat warna klorofil dan hidrokarbon dengan berat molekul rendah lainnya. Penelitian tersebut memberikan informasi ilmiah bahwa kulit jeruk menjadi bahan adsorben potensial untuk menyisihkan pewarna dari larutan encer. Dalam proses adsorpsi biasanya dilakukan proses aktivasi, baik secara fisika maupun kimia. Aktivasi dilakukan untuk memperbesar pori pada karbon sehingga penyerapannya dapat lebih maksimal dengan menggunakan larutan pengaktivasi (activator).
Aktivasi yang umum digunakan adalah aktivasi secara fisika dan secara kimia. Pada aktivasi fisika, preskursor diaktifkan dibawah uap H2O atau aliran CO2 dalam rentang suhu (800-1100⁰C) (Laksaci et al., 2013) sedangkan aktivasi secara kimia dapat dilakukan dengan menggunakan larutan kimia sebagai aktivator seperti ZnCl2, NaCl, H3PO4, H2S, H2SO4 dan KOH (Permatasari et al., 2014). Erprihana dan Dhoni (2014), dalam penelitiannya mengatakan bahwa aktivator ZnCl bersifat korosif dan berbahaya karena mengeluarkan gas klor, berbeda dengan aktivator H3PO4 yang jauh lebih baik digunakan karena dapat menghasilkan daya serap yang tidak jauh berbeda dari ZnCl dan rendemen yang lebih besar.
Berdasarkan hasil penelitian yang telah dilakukan diatas, maka dalam studi penelitian ini, penulis ingin menganalisis penggunaan biosorben dan karbon aktif dari kulit jeruk untuk penyisihan zat pewarna methyl orange. Penelitian ini meliputi pengaruh waktu kontak, pH dan dosis biosorben pada sistem batch, serta menentukan kinetika adsorpsi (Pseudo-First Order dan Model Pseudo-Second Order) dan isoterm adsorpsi (Langmuir dan Freundlich.
.
I-4 1.2 Rumusan Masalah
Air limbah tekstil yang memiliki kandungan methyl orange yang tinggi jika dibuang secara langsung ke badan air dapat bersifat toksik pada kehidupan organisme. Selain itu juga mencemari lingkungan yang berdampak pada gangguan keseimbangan ekosistem perairan dan nilai estetika lingkungan. Oleh karena itu, penyisihan methyl orange sebelum dibuang ke badan air sangat diperlukan. Penggunaan metode adsorpsi dengan karbon aktif telah banyak digunakan dan sangat baik untuk mengadsorpsi kandungan methyl orange dalam badan air dengan memperhatikan beberapa faktor-faktor yang mempengaruhi kinerjanya dalam penyisihan. Penelitian ini diarahkan kepada keefektifan penggunaan biosorben dan karbon aktif kulit jeruk sebagai adsorben untuk mengadsorpsi methyl orange pada variabel waktu kontak, pH dan dosis biosorben untuk mengetahui efisiensi penyisihan optimal.
1.3 Tujuan Penelitian
Tujuan penelitian dari rumusan masalah diatas adalah sebagai berikut :
1. Mengkaji pengaruh waktu kontak, pH dan dosis adsorben terhadap efisiensi penyisihan methyl orange dalam sistem batch menggunakan biosorben (tanpa perlakuan) dan karbon aktif dari kulit jeruk (diaktivasi dengan H3PO4 lalu dipirolisis).
2. Mengkaji model kinetika dan isoterm adsorpsi.
1.4 Ruang Lingkup
Ruang lingkup penelitian ini akan dibatasi pada masalah sebagai berikut :
1. Limbah yang digunakan dalam penelitian ini adalah air limbah yang berasal dari air limbah sintetik dengan melarutkan sejumlah methyl orange dalam aquades.
2. Parameter yang akan diuji dalam penelitian ini adalah methyl orange.
3. Proses pengolahan limbah cair dilakukan dengan metode adsorpsi menggunakan biosorben (tanpa perlakuan) dan karbon aktif kulit jeruk (diaktivasi dengan H3PO4
lalu dipirolisis) dalam sistem batch.
4. Percobaan ini dilakukan dengan variasi bebas sebagai berikut:
a. Waktu kontak (menit) : 0, 5, 15, 30, 60, 90
b. pH : 2, 3, 4, 5, 6
c. Dosis adsorben (gram/liter) : 0, 1, 2, 3, 4, 5
Universitas Sumatera Utara
I-5 1.5 Manfaat Penelitian
Manfaat penelitian ini adalah :
1. Dapat diketahui kemampuan penyisihan zat pewarna methyl orange dengan menggunakan adsorben kulit jeruk dan kondisi optimal yang dibutuhkan agar penyisihan dapat berjalan dengan efektif.
2. Memberikan alternatif yang lebih efektif dan efisien untuk penyisihan zat pewarna methyl orange dalam limbah cair.
3. Meningkatkan nilai ekonomis dari kulit jeruk dengan pemanfaatannya sebagai karbon aktif pada pengolahan limbah zat warna apabila dikembangkan dalam skala besar sehingga dapat dimanfaatkan pada industri lain yang berkaitan.
BAB II
TINJAUAN PUSTAKA
2.1 Limbah Tekstil
Effluen dari proses pewarnaan dan proses akhir industri tekstil diketahui mengandung jenis kandungan warna yang tinggi, jumlah surfaktan yang tinggi, padatan terlarut dan kemungkinan logam berat yang berbahaya seperti Cr, Ni dan Cu (Nemr et al., 2009).
USEPA (Environmental Protection Agency) mengklasifikasikan limbah tekstil menjadi empat kelompok, limbah yang dapat didispersi, sulit diolah, bervolume tinggi serta berbahaya dan beracun. Pembuangan limbah cair tekstil ini menyebabkan masalah signifikan, seperti meningkatkan toksisitas dan COD dari limbah, mengurangi penetrasi cahaya yang merugikan fotosintesis. Pemerintah diminta untuk menghentikan pembuangan jenis limbah ini ke saluran air umum, kecuali jika diolah dengan benar.
Oleh karena itu, penyisihan limbah tekstil penting bagi lingkungan (Arami et al., 2005).
2.2 Methyl Orange
Methyl orange merupakan pewarna anionik yang larut dalam air dan telah banyak digunakan dalam industri tekstil, percetakan dan pembuatan kertas (Khaniabadi et al., 2017). Pewarna ini memiliki rumus molekul C14H14N3NaO3S (Jalil et al., 2010). Methyl orange memiliki kandungan kromatisitas yang tinggi, komponen organik yang kompleks dan kualitas kimia yang stabil sehingga lebih sulit untuk diolah dalam limbah cair (Xin et al., 2015). Akibat dari toksisitas dan sifatnya yang sulit terurai, menyebabkan ancaman serius terhadap karakteristik fisika-kimia air tawar dan kehidupan akuatik. Berbagai pengolahan kimiawi, biologis dan fisika telah digunakan untuk mengolah zat warna azo. Umumnya, zat warna resistan terhadap biodegradasi aerobik, molekul organik membandel dan stabil terhadap larutan pengoksidasi, maka proses adsorpsi terbukti sebagai tindakan terpercaya dan efektif untuk pengolahan ini (Cheah et al., 2012). Struktur methyl orange dapat dilihat pada Gambar 2.1 dibawah ini.
Gambar 2.1 Struktur Zat Pewarna Methyl Orange
Universitas Sumatera Utara
II-2 2.3 Kulit Jeruk dan Karakteristiknya
Kandungan utama kulit jeruk terdiri dari selulosa, pektin, hemiselulosa, lignin, zat warna klorofil dan hidrokarbon dengan berat molekul rendah lainnya. Komponen ini mengandung berbagai kelompok fungsional seperti karboksil dan hidroksil yang membuat kulit jeruk menjadi bahan adsorben potensial untuk menghilangkan berbagai senyawa ionik dari larutan encer (El-Said et al., 2013).
Penggunaan kulit jeruk sebagai adsorben merupakan alternatif yang baik karena efektif, efisien, tidak beracun dan mudah didapatkan (Abdurrahman et al., 2013). Disamping itu, komponen kulit jeruk secara luas digunakan sebagai adsorben untuk menyerap gas (CO2) (Mahdi, 2014) dan ion Ni(II) dari larutan encer (Serin dan Selen, 2012). Kulit jeruk juga mengandung 1,72% potasium oksida (K2O), 1,31% kalsium oksida (CaO) dan senyawa kecil lainnya. Karena itu dengan sejumlah besar komponen karbon yang dihasilkan dari kulit jeruk dan kulit jeruk itu sendiri merupakan salah satu adsorben yang potensial untuk menyerap warna anionik dan pencemar berbeda dalam larutan encer (Mahdi, 2014). Berdasarkan karakteristiknya, kulit jeruk digunakan dalam pengolahan air limbah yang tidak hanya ekonomis, namun juga dapat mengatasi masalah pembuangan limbah padat dan pengolahan limbah cair dengan karbonisasi (Nemr et al., 2009).
2.4 Karbon Aktif
Karbon merupakan padatan berpori yang mengandung 85-95% karbon, dihasilkan dari bahan-bahan yang mengandung karbon dengan pemanasan pada suhu tinggi. Karbon aktif merupakan bahan adsorpsi dengan permukaan lapisan yang luas dengan bentuk butiran atau serbuk, dan digunakan untuk menyerap kontaminan di dalam air.
Kontaminan dalam air terserap karena tarikan dari permukaan karbon aktif lebih kuat dibandingkan dengan daya kuat yang menahan di dalam larutan. Senyawa-senyawa yang mudah terserap karbon aktif umumnya memiliki nilai kelarutan yang lebih kecil dari karbon aktif. Kontaminan dapat masuk ke dalam pori karbon aktif dan terakumulasi didalamnya, apabila kontaminan terlarut di dalam air dan ukuran pori kontaminan lebih kecil dibandingkan dengan ukuran pori karbon aktif.
Syauqiah et al (2011), menganalisis karbon aktif dengan porositas yang besar mempunyai kemampuan menyerap lebih tinggi dibandingkan dengan karbon aktif yang
II-3 memiliki porositas kecil. Untuk meningkatkan porositas dapat dilakukan dengan mengaktivasi secara fisika seperti mengalirkan uap panas ke dalam pori-pori karbon aktif atau mengaktivasi secara kimia.
2.5 Proses Aktivasi Karbon Aktif
Aktivasi merupakan perlakuan terhadap karbon yang bertujuan untuk memperbesar pori, yaitu dengan cara penghilangan hidrokarbon, gas-gas, air dan memecahkan ikatan hidrokarbon sehingga karbon mengalami perubahan sifat, baik fisika atau kimia, yaitu luas permukaannya bertambah besar dan berpengaruh terhadap daya adsorpsi (Yulianti dkk, 2010).
Proses aktivasi karbon aktif dapat dibedakan menjadi dua jenis, yaitu aktivasi fisika dan aktivasi kimia. Proses-proses tersebut, antara lain:
1. Proses Aktivasi secara Fisika
Proses aktivasi secara fisika dilakukan dengan cara pirolisis. Pirolisis adalah proses dekomposisi suatu bahan pada suhu tinggi tanpa adanya udara atau udara terbatas.
Proses dekomposisi pada pirolisis ini juga sering disebut dengan devolatilisasi. Proses pirolisis menghasilkan produk berupa bahan bakar padat yaitu karbon, cairan berupa campuran tar dan beberapa zat lainnya. Produk lain adalah gas berupa karbon dioksida (CO2), metana (CH4) dan beberapa gas yang memiliki kandungan kecil. Hasil pirolisis berupa tiga jenis produk yaitu padatan, gas dan cairan. Umumnya proses pirolisis berlangsung pada suhu di atas 300⁰C dalam waktu 4-7 jam. Namun keadaan ini sangat bergantung pada bahan baku dan cara pembuatannya (Ridhuan dan Joko, 2016).
2. Proses Aktivasi secara Kimia
Aktivasi kimia merupakan proses pemutusan rantai karbon dari senyawa organik dengan pemakaian bahan-bahan kimia. Aktivator yang digunakan adalah bahan-bahan kimia seperti: hidroksida logam alkali garam-garam karbonat, klorida, sulfat, fosfat dari logam alkali tanah dan khususnya ZnCl2, asam-asam anorganik seperti H2SO4 dan H3PO4 yang merupakan penyerap air (dehydrating agent).
Proses aktivasi kimia dilakukan dengan merendam karbon hasil karbonisasi dalam bahan-bahan kimia untuk melarutkan pengotor-pengotor dalam pori-pori karbon aktif
Universitas Sumatera Utara
II-4 sehingga luas permukaan, ukuran pori lebih besar dan gugus fungsi karbon aktif bertambah (Yulianti dkk, 2010).
2.6 Karakterisasi Adsorben
Sebelum dilakukannya studi adsorpsi, dilakukan terlebih dahulu karakterisasi adsorben.
Adapun karakterisasi adsorben yang dilakukan pada penelitian ini meliputi uji SEM, EDS, FTIR dan daya serap iodin.
1. Scanning Electron Microscope (SEM): mengetahui morfologi permukaan karbon aktif (Hosseini et al, 2011). SEM adalah mikroskop elektron yang menghasilkan gambar dari permukaan padat dengan memindai dengan berkas elektron. Balok elektron menyerang atom-atom permukaan sampel yang menghasilkan berbagai sinyal. Sinyal-sinyal ini dideteksi oleh detektor elektron. Sinyal-sinyal ini membawa detail tentang komposisi dan struktur permukaan sampel. Hanya sampel dengan ukuran yang sesuai yang dapat digunakan karena sampel harus ditempatkan di ruang yang hanya sesuai dengan sampel ukuran tertentu. Konduktivitas listrik di permukaan adalah kriteria paling penting untuk karakterisasi SEM sampel.
Persiapan sampel dilakukan dengan melapisinya dengan emas untuk menghindari ionisasi sampel (Laxmi, 2014).
2. Energy Dispersion Spectrometry (EDS): menganalisa komposisi kimia karbon aktif (Khaniabadi et al, 2016).
3. Fourier Transform Infra Red (FTIR): menganalisa gugus fungsi karbon aktif dengan aksesori pengambilan sampel ATR universal (Cid et al, 2016). FTIR telah banyak digunakan untuk prediksi senyawa organik yang ada dalam sampel dengan penyerapan cahaya energi rendah yaitu sinar ultraviolet dari setiap panjang gelombang. Diperoleh spektrum serapan senyawa yang merupakan refleksi unik dari susunan molekul senyawa dalam sampel. Spektrum ini adalah grafik yang berisi persen transmitansi sepanjang sumbu Y dan frekuensi atau panjang gelombang sepanjang sumbu X. Dengan mempelajari puncak antara frekuensi tertentu yaitu celah atau pita, jenis kelompok fungsional yang ada dapat diprediksi dengan bantuan tabel yang tersedia. Untuk kasus kulit jeruk, FTIR menunjukkan perubahan sifat permukaan adsorben pada penambahan pewarna hijau perunggu (Laxmi, 2014).
II-5 4. Daya serap iodin: menujukkan daya adsorpsi karbon aktif terhadap larutan iod.
Penentuan daya adsorpsi karbon aktif terhadap iod memiliki korelasi dengan luas permukaan dari karbon aktif, karena semakin besar angka iodine (iodine number) maka semakin besar pula kemampuan karbon aktif dalam mengadsorpsi adsorbat.
Berlangsungnya proses adsorpsi terjadi ketika molekul iodin menempel pada pori karbon aktif dan banyaknya iodin yang teradsorpsi oleh karbon aktif ditentukan sebagai angka iodin yang menyatakan banyaknya iodin yang mampu diadsorpsi oleh karbon aktif (mg/g) (Bangun dkk, 2016).
Berdasarkan Standar Nasional Indonesia (SNI No.06-3730-95), kadar iodin dalam karbon aktif mencapai nilai minimum 750 mg/g (Erprihana dan Dhoni, 2014).
Rumus perhitungan daya jerap iodin dapat dilihat pada persamaan 2.1.
Daya serap iodin = 10− b×a N×126.9 fp
gram contoh × 100% (2.1)
Dimana:
b = jumlah titar untuk contoh (ml) a = normalitas larutan (N)
N = normalitas larutan Na2SO3 (N) Berat molekul iodin = 126,9
Untuk menentukan konsentrasi larutan iodin hasil adsorpsi dengan cara batch maupun kontinu digunakan metode titrasi. Penentuan daya serap iodin dilakukan dengan menimbang 1 gram arang aktif, selanjutnya ditambahkan dengan pipet 25 ml larutan ion monoklorida dan erlenmeyer ditutup dengan tutup yang dibasahi dengan Kl, keudian dikocok dengan hati-hati dan disimpan di tempat yang gelap selama 2 jam, ke dalam Erlenmeyer ditambahkan 10 ml larutan Kalium Iodida (Kl) 20% dan 150 ml air suling, kemudian dikocok dan seterusnya dititrasi dengan larutan tiosulfat 0,1 N. Sebagai penunjuk adalah larutan pati/kanji dan untuk perbandingan digunakan larutan blanko dengan cara yang sama (SNI 06-3730, 1995).
2.7 Adsorpsi
Adsorpsi adalah proses dimana berbagai molekul, ion dan atom dari cairan atau gas melekat pada permukaan adsorben. Proses ini berbeda dengan absorpsi karena pada
Universitas Sumatera Utara
II-6 absorpsi, substrat yang biasanya dalam bentuk cairan meresap kedalam adsorben (Ramakrishna, 2013). Dalam adsorpsi, digunakan istilah adsorben dan adsorbat, dimana adsorben merupakan media penyerap berupa senyawa karbon, sedangkan adsorbat adalah substansi yang akan dipisahkan dari pelarutnya. Adsorpsi dipengaruhi oleh sifat fisika dan kimia adsorben, seperti luas permukaan, struktur molekul adsorbat, konsentrasi adsorbat, temperatur, pH, kecepatan pengadukan, waktu kontak dan waktu kesetimbangan. Semakin luas permukaan adsorben, maka semakin banyak adsorbat yang teradsorpsi (Syauqiah et al., 2011). Proses adsorpsi dapat terjadi karena perbedaan berat molekul atau perbedaan polaritas yang dapat menyebababkan melekatnya molekul polutan di permukaan partikel adsorben. Di dalam proses pengolahan air, proses adsorpsi umumnya digunakan untuk menyerap atau menghilangkan senyawa polutan dengan konsentrasi yang sangat kecil (polutan mikro), penghilangan warna, penghilangan bau, dan lainnya (Said, 2017).
Adapun kapasitas adsorpsi pada waktu t, qt (mg/g) diberikan pada persamaan berikut (Kanchi et al., 2017).
Qt = (C0−Ct)v
W (2.2)
Keterangan:
C0 = konsentrasi methyl orange mula-mula dalam fase cair (mg/l) Ct = konsentrasi methyl orange pada waktu t dalam fase cair (mg/l) v = volume larutan (L)
w = massa adsorben (g)
Untuk efisiensi penyisihan diberikan pada persamaan berikut (Kanchi et al., 2017).
Efisiensi penyisihan (%) = (C0−Ct)
C0 × 100% (2.3)
Keterangan : E = efisiensi
C0 = konsentrasi methyl orange mula-mula dalam fase cair (mg/l) Ct = konsentrasi methyl orange pada waktu t dalam fase cair (mg/l)
II-7 2.7.1 Faktor-Faktor yang Mempengaruhi Adsorpsi Warna
Ada banyak faktor yang mempengaruhi jumlah penyerapan adsorbat ke adsorben antara lain: area permukaan adsorben, konsentrasi pewarna awal, suhu, pH, waktu kontak antara adsorbat dan adsorben dan sebagainya.
1. Konsentrasi Warna
Konsentrasi pewarna awal penting dalam adsorpsi, karena massa adsorben hanya dapat mengadsorpsi jumlah pewarna yang tetap. Pada umumnya, persentase penghapusan pewarna menurun dengan peningkatan pewarna awal konsentrasi, yang mungkin karena kejenuhan daya adsorpsi pada adsorben permukaan. Di sisi lain peningkatan konsentrasi pewarna awal akan menyebabkan peningkatan kapasitas adsorben, ini mungkin disebabkan oleh kekuatan penggerak yang tinggi untuk transfer massa pada konsentrasi pewarna awal yang tinggi.
2. Dosis Adsorben
Dosis adsorben merupakan parameter penting untuk menentukan kapasitas adsorben terhadap jumlah adsorben pada kondisi beroperasi. Secara umum, presentase penyisihan pewarna meningkat dengan meningkatnya dosis adsorben (Singh dan Mani, 2000).
Pengaruh dari dosis adsorben memberikan ide untuk kemampuan adsorpsi zat warna untuk diadsorpsi dengan jumlah adsorben terkecil, untuk mengetahui kemampuan zat warna dari sudut pandang ekonomis (Yagub et al., 2014).
3. pH
Faktor pH sangat penting dalam proses adsorpsi terutama untuk adsorpsi pewarna. pH akan mengendalikan besarnya muatan elektrostatik yang diberikan oleh molekul pewarna terionisasi. Akibatnya, laju adsorpsi akan bervariasi dengan pH larutan. Pada larutan pH rendah, presentase penyisihan warna akan menurun untuk adsorpsi pewarna kationik, sedangkan untuk pewarna anion, presentase penyisihan warna akan meningkat.
Sebaliknya, pada larutan pH tinggi, presentase penyisihan warna akan meningkat untuk adsorpsi pewarna kationik dan penurunan untuk adsorpsi zat warna anionik (Ramesh, 2013).
Untuk asam-asam organik, adsorpsi akan meningkat bila pH diturunkan, yaitu dengan penambahan asam-asam mineral. Ini disebabkan karena kemampuan asam mineral
Universitas Sumatera Utara
II-8 untuk mengurangi ionisasi asam organik tersebut. Sebaliknya bila pH asam organik dinaikkan yaitu dengan menambahkan alkali, adsorpsi akan berkurang sebagai akibat terbentuknya garam.
4. Temperature/Suhu
Pemanasan adsorben akan meningkatkan daya serap adsorben terhadap adsorbat, dan menyebabkan pori-pori adsorben lebih terbuka. Pemanasan yang terlalu tinggi menyebabkan rusaknya adsorben sehingga kemampuan penyerapannya menurun. Hal ini disebabkan oleh molekul yang teradsorpsi memiliki energi yang lebih besar sehingga memungkinkan molekul tersebut untuk lepas dari permukaan adsorben (Mafira et al., 2013).
Aktivator memiliki rentang suhu tertentu dimana aktivator dapat bereaksi dengan karbon sehingga membentuk pori-pori. Jika suhu yang digunakan untuk proses aktivasi tidak berada di rentang suhu tersebut, maka dapat dipastikan bahwa aktivator tidak dapat bereaksi dengan optimum dengan karbon saat proses aktivasi. Aktivasi kimia menggunakan ZnCl2 dan H3PO4, biasanya dilakukan pada suhu 450⁰C-600⁰C. Suhu aktivasi 600⁰C merupakan suhu aktivasi yang dapat berjalan optimum, hal ini disebabkan ada proses aktivasi, kotoran-kotoran yang menutupi pori-pori karbon ikut terlepas (menguap) seiring penambahan suhu aktivasi (Erprihana dan Dhoni, 2014).
5. Waktu Kontak
Waktu kontak merupakan waktu yang dibutuhkan oleh karbon aktif untuk mengadsorpsi zat warna. Hubungan antara adsorpsi zat warna dan waktu kontak dilakukan untuk mengetahui nilai presentase zat warna yang teradsorpsi. Semakin lama waktu kontak antara zat warna dengan karbon aktif, maka presentase zat warna yang teradsorpsi akan semakin meningkat (Eprihana dan Dhoni, 2014).
Pengadukan juga mempengaruhi waktu kontak. Bila pengadukan terlalu lambat maka proses adsorpsi berlangsung lambat, tetapi bila pengadukan terlalu cepat kemungkinan struktur adsorben cepat rusak, sehingga proses adsorpsi kurang optimal.
II-9 2.7.2 Mekanisme Adsorpsi
Mekanisme adsorpsi terbagi atas dua yaitu proses secara fisika dan secara kimia. Proses adsorpsi secara fisika (physical adsorption) yaitu proses terkonsentrasinya molekul- molekul zat yang akan diadsorpsi (adsorbate) dalam air ke permukaan adsorben karena adanya gaya tarik-menarik antara molekul karbon aktif dengan molekul-molekul adsorbate yang ada di dalam air (gaya Van der Walls) (Said, 2017). Sedangkan proses adsorpsi secara kimia yaitu disebabkan melalui reaksi kimia antara molekul-molekul adsorbat dengan atom-atom penyusun permukaan adsorben.
Adsorpsi dapat diklasifikasikan menjadi dua jenis, antara lain:
1. Adsorpsi Fisika
Adsorpsi fisika terjadi sebagai akibat dari perbedaan energi dan /atau daya tarik listrik memaksa gaya van der Walls yang lemah, dimana molekul adsrobat terikat secara fisik ke permukaan adsroben. Adsorpsi ini berlangsung dengan pembentukan lapisan tunggal atau ganda dari adsorbat pada permukaan adsorben dan ditandai oleh enthalpi adsorpsi (Jemal, 2015).
2. Adsorpsi Kimia
Adsorpsi kimia berlangsung ketika terjadi reaksi kimia antara molekul yang teradsorpsi dengan adsorben. Adosrpsi ini berlangsung dengan pembentukan satu lapisan adsorbat yang melekat pada permukaan adsorben oleh ikatan kimia. Jenis interaksi ini kuat dengan ikatan kovalen antara adsorbat dengan permukaan adsorben yang ditandai dengan entalpi tinggi dari adsorpsi (Beyene, 2014).
2.8 Pemodelan Batch Adsorpsi
Eksperimen Batch digunakan untuk perbandingan kapasitas adsorpsi antar adsorben dengan variasi waktu dan variasi larutan pada adsorpsi (Nur, 2014). Proses adsorpsi dikarakteristikan ke dalam dua bagian yaitu kesetimbangan adsorpsi dan kinetika adsorpsi.
Penting untuk mempelajari model isoterm untuk proses adsorpsi untuk mengetahui mekanisme dan kapasitas adsorpsi dari sebuah adsorben. Parameter isoterm dapat membantuk untuk memahami interaksi antara adsorben dengan adsorbat. Dalam
Universitas Sumatera Utara
II-10 penelitian ini, model adsorpsi isoterm Langmuir dan Freundlich digunakan untuk studi isotermal (Habiba et al., 2018).
2.8.1 Model Kinetika Adsorpsi
Kinetika adsorpsi digunakan untuk memahami dan menyelidiki mekanisme proses yang mengontrol laju adsorpsi. Hal ini berguna untuk pemilihan kondisi operasi optimum (Meroufel et al., 2013). Menurut Mohammed (2013); Jemal (2015), studi mengenai kinetika adsorpsi sangat penting untuk mengetahui efisiensi adsorpsi. Desain sistem adsorpsi pengolahan air dapat dipengaruhi atau bahkan dikendalikan oleh kinetika adsorpsi. Laju adsorpsi dapat dikontrol melalui transfer massa, difusi intra-partikel atau kinetika kimia permukaan. Beberapa model untuk fase cair telah banyak digunakan untuk menggambarkan data eksperimen, diantaranya model orde semu pertama dan orde semu kedua.
Model orde semu pertama ditunjukkan sebagai berikut:
dqt
dt = k1 (qe – qt) (2.4)
Dimana qe dan qt masing-masing merupakan kapasitas adsorpsi pada kesetimbangan dan pada waktu t (mg/g). k1 merupakan konstanta laju kesetimbangan adsorpsi orde semu pertama (g/mg min-1). Dengan menggabungkan persamaan 2.4 pada kondisi batas t=0 sampai t=t dan qt=0 sampai qt=qt, menghasilkan:
Log qe
qe −qt = k1
2.303t (2.5)
Persamaan 2.5 dapat disusun kembali untuk mendapatkan bentuk linier berikut:
Log (qe-qt) = log (qe) - k1
2.303t (2.6)
Model orde semu kedua ditunjukkan sebagai berikut:
dqt
dt = k2 (qe – qt)2 (2.7)
Integrasi persamaan 2.7 untuk kondisi batas qt=0 sampai qt=qt pada t=0 sampai t=t disederhanakan dan dapat disusun kembali dan dilinierisasi untuk didapatkan:
II-11
t qt = 1
k2 qe ²
+
tqe (2.8)
Keterangan :
qe dan qt : jumlah yang terserap pada waktu t (mg/g) pada waktu kesetimbangan k2 : konstanta laju kesetimbangan adsorpsi orde semu kedua (g/mg min-1) 2.8.2 Model Isoterm Adsorpsi
Studi isoterm adsorpsi menggambarkan interaksi antara adsorben dan adsorbat yang dapat membantu dalam mendesain sistem adsorpsi (Zahra dkk, 2014). Data ini memberikan informasi tentang kapasitas adsorben atau jumlah yang diperlukan untuk menghilangkan satuan massa polutan dalam konsentrasi sistem. Dua persamaan isoterm yang paling umum, yaitu Langmuir dan Freundlich telah diuji untuk menganalisis data kesetimbangan zat terlarut antara adsorben dengan larutan pewarna (El-Said et al., 2013)
1. Model Isoterm Langmuir
Persamaan model isoterm Langmuir awalnya dikembangkan untuk menggambarkan dan mengukur penyerapan pada satu set situs adsorpsi lokal yang berbeda, dan telah digunakan untuk menggambarkan baik adsorpsi fisika dan kimia. Model ini didasarkan pada asumsi utama berikut (Langmuir, 1916; Jemal 2015).
a. Setiap situs aktif berinteraksi hanya dengan satu molekul yang dapat menyerap b. Molekul adsorbat tradsorpsi pada situs yang dilokalkan dengan baik dan cakupan
kejenuhan berkoresponden untuk melengkapi penempatan situs-situs ini
c. Situs teradsorpsi semuanya sama-sama bertenaga dan tidak ada interaksi antara molekul teradsorpsi yang berdekatan.
Berdasarkan pemikiran ini, hubungan Langmuir antara qe dan Ce (persamaan non linear) adalah sebagai berikut:
qe = qmkLCe
1+ kLCe (2.9)
Persamaan linear Ce/qe vs Ce untuk isoterm Langmuir adalah:
.qe
Ce = Kl. Qm − Kl. qe (2.10)
Universitas Sumatera Utara
II-12 Keterangan:
qe : jumlah methyl orange yang terserap per satuan massa adsorben pada saat kesetimbangan (mg/g)
Ce : konsentrasi methyl orange pada saat kesetimbangan (mg/l)
KL : konstanta afinitas Langmuir yang berhubungan dengan energy sorpsi.desorpsi (L/mg)
qm : jumlah maksimum methyl orange yang terserap per satuan massa adsorben (mg/g)
Model isoterm Langmuir adalah isoterm adsorpsi yang paling banyak diterapkan dan telah menghasilkan kesepakatan yang baik dengan berbagai data eksperimen. Isoterm Langmuir juga dapat dinyatakan dalam istilah konstanta tanpa dimensi dari faktor pemisahan atau parameter kesetimbangan, RL, yang didefinisikan sebagai : (Kanchi et al., 2017).
RL = 1
1+Kl C0 (2.11)
Dimana Kl dan C0 merupakan konstanta Langmuir dan konsentrasi awal dari molekul zat warna. Nilai RL mengindikasikan bahwa isoterm akan dibentuk sesuai dengan karakteristik adsorpsi berikut : 0 < R < 1, favorable; R > 1, unforable; R = 1, linear; R
= 0, irreversible.
2. Model Isoterm Freundlich
Isoterm Freundlich adalah persamaan empiris yang menjelaskan bahwa permukaan adsorben menjadi heterogen selama proses adsorpsi. Ini kemungkinan disebabkan oleh situs pengikatan yang lebih kuat ditempati terlebih dahulu dan afinitas pengikatan mengalami penurunan dengan meningkatnya kadar situs yang ditempati (Ramakrishna, 2013). Persamaan Freundlich merupakan hubungan empiris yang menggambarkan adsorpsi zat terlarut dari cairan ke permukaan padatan (Jemal, 2015). Adapun persaman model Freundlich, yaitu:
Bentuk empiris murni persamaan isoterm Freundlich adalah : qe = Kf Ce1/n
(2.12)
II-13 Bentuk linier persamaan Freundlich adalah sebagai berikut:
Log qe = log kf + 1
𝑛 log Ce (2.13)
Keterangan:
Ce : konsentrasi methyl orange pada saat kesetimbangan (mg/l)
qe : jumlah methyl orange yang terserap per satuan massa adsorben pada saat kesetimbangan (mg/g)
Kf : konstanta isoterm adsorpsi Freundlich yang berkaitan dengan tingkat kapasitas adsorpsi
1/n : intensitas adsorpsi yang bervariasi sesuai dengan heterogenitas bahan (rentang nilai n=1-10)
Nilai 1/n, salah satu konstanta Freundlich, mengindikasikan isoterm adsorpsi. Ketika 0<1/n<1, adsorpsi sesuai (favorable); ketika 1/n=1, adsorpsi irreversible dan ketika 1/n>1, adsorpsi tidak sesuai (unfavorable) (Munagapati et al., 2011).
Universitas Sumatera Utara
BAB III
METODE PENELITIAN
Kajian yang dilakukan adalah penyisihan methyl orange menggunakan biosorben dan karbon aktif dari kulit jeruk. Kulit jeruk yang digunakan berasal dari limbah pedagang jeruk peras di Jalan Harmonika, Medan. Uji adsorpsi yang dilakukan menggunakan reaktor batch dengan variasi waktu kontak, pH dan dosis adsorben. Hasil uji dianalisa untuk mendapatkan data kinetika dan isoterm adsorpsi.
3.1 Lokasi Penelitian
Penelitian dilaksanakan di Laboratorium Ekologi Teknik Kimia USU dan Laboratorium Bahan dan Rekayasa Beton Teknik Sipil USU untuk pengeringan sampel kulit jeruk.
Laboratorium Operasi Teknik Kimia USU untuk penghalusan ukuran sampel menggunakan ball mill. Laboratorium Penelitian Fakultas Farmasi USU untuk aktivasi adsorben, pengujian adsorpsi methyl orange dan analisa FTIR. Laboratorium Proses Industri Kimia USU untuk pirolisis bahan karbon aktif. Laboratorium Fisika Unimed untuk analisa SEM-EDS adsorben. Laboratorium Pengembangan PTKI Medan untuk analisa konsentrasi methyl orange dalam limbah cair sintesis dan uji daya serap iodin.
3.2 Waktu Penelitian
Penelitian dilakukan selama ± 4 bulan yaitu mulai bulan Agustus s.d November 2018 yang dilanjutkan dengan pengolahan dan penyusunan data serta penyusunan laporan.
3.3 Jenis Penelitian
Penelitian ini termasuk dalam jenis penelitian yang bersifat eksperimental yang dilaksanakan dalam skala laboratorium dengan metode penelitian secara kuantitatif.
3.4 Variabel Penelitian
Variabel penelitian yang digunakan dalam penelitian ini adalah:
1. Variabel bebas (independent variable) meliputi:
Pengolahan limbah cair untuk proses adsorpsi dengan variasi variabel meliputi:
a. Waktu kontak (menit) : 0, 5, 15, 30, 60, 90
b. pH : 2, 3, 4, 5, 6
c. Dosis adsorben (gram/liter) : 0, 1, 2, 3, 4, 5
III-2 2. Variabel Terikat (dependent variable) meliputi:
Kandungan methyl orange yang berasal dari limbah cair sintetik.
3.5 Sumber Data
Data yang dikumpulkan meliputi:
1. Data Primer
Data primer merupakan data yang diperoleh dari hasil analisa penelitian di laboratorium ataupun penelitian di lapangan secara langsung mulai dari pengujian awal sampai pengujian akhir.
2. Data Sekunder
Data sekunder merupakan data yang diperoleh dari studi literatur pustaka.
3.6 Kerangka Penelitian
Penelitian diawali dengan perumusan masalah yang didukung dengan studi literatur untuk menentukan tujuan penelitian. Penyusunan laporan penelitian dilakukan dengan mengumpulkan data dari sumber primer dan data sekunder. Pengumpulan data primer dilakukan melalui percobaan dan data sekunder melalui studi literatur. Untuk lebih jelasnya, kerangka penelitian tugas akhir ini dapat dilihat dala bentuk diagram alir penelitian pada Gambar 3.1.
Universitas Sumatera Utara
III-3 Gambar 3.1 Diagram Alir Penelitian
Studi Literatur
Persiapan Alat dan Bahan
Analisa Sampel Adsorben Preparasi dan Pembuatan
Adsorben
Perlakuan Variasi 1. Waktu Kontak 2. pH
3. Dosis adsorben 1. Uji daya serap iodin 2. Uji SEM-EDS 3. Uji FTIR
Percobaan pada Reaktor Batch
Pengolahan dan Analisa Data serta Pembahasan
Kesimpulan dan Saran
Selesai
Pembuatan Limbah Cair Sintetik Perumusan Masalah
Tujuan Penelitian
Pengumpulan Data:
Data Primer
Data Sekunder Mulai
Pengujian Sampel (methyl orange) dengan spektrofotometer UV-Vis
III-4 3.7 Langkah Percobaan
3.7.1 Pembuatan Limbah Cair Sintetik
Pembuatan limbah cair sintetik dilakukan dengan menyiapkan larutan persediaan 100 mg/L dengan melarutkan 100 mg methyl orange dalam 1 L air aquades dan dihomogenkan.
3.7.2 Reaktor Percobaan
Percobaan ini menggunaakan erlenmeyer sebagai reaktor batch yang ditempatkan di waterbath shaker yang berfungsi sebagai pengaduk. Reaktor batch (Gambar 3.2) merupakan tempat berlangsungnya proses adsorpsi antara adsorben dengan adsorbat.
Gambar 3.2 Reaktor Batch
3.8 Persiapan dan Pengujian Adsorben
Penelitian dilakukan dalam dua tahap, yaitu persiapan dan pengujian adsorben. Tahap persiapan merupakan tahap pembuatan biosorben dan karbon aktif kulit jeruk.
Selanjutnya, kedua adsorben akan digunakan pada tahap pengujian. Tahap pengujian adsorben dilakukan dengan menerapkan sistem batch menggunakan reaktor batch.
3.8.1 Tahap Persiapan Adsorben
Tahap ini diawali dengan preparasi kulit jeruk yang kemudian dilanjutkan dengan pembuatan biosorben (tanpa perlakuan) dan pembuatan karbon aktif (diaktivasi dengan H3PO4 lalu dipirolisis). Adapun langkah-langkah tersebut sebagai berikut :
Universitas Sumatera Utara
III-5 1. Preparasi Kulit Jeruk
Kulit jeruk dikumpulkan sebanyak 3 kg, kemudian dicuci dengan air bersih untuk menghilangkan debu dan kotoran dari permukaannya. Selanjutnya, kulit jeruk dijemur dibawah sinar matahari selama 5 hari dan dikeringkan di dalam oven 110⁰C selama waktu tertentu (4 jam) hingga didapatkan berat yang konstan.
2. Pembuatan Biosorben
Kulit jeruk yang telah dipreparasi dihaluskan menggunakan ballmill, kemudian diayak hingga lolos pada ayakan 70 mesh. Biosorben kemudian disimpan dalam wadah tertutup dan kedap udara untuk digunakan lebih lanjut.
3. Pembuatan Karbon Aktif
Kulit jeruk kering dimasukkan ke dalam erlenmeyer, kemudian ditambahkan larutan H3PO4 70% dengan perbandingan massa karbon : massa H3PO4 70% adalah 1:10.
Reaktor berisi campuran tersebut diaduk dalam waterbath shaker selama 1 jam pada suhu 80⁰C. Selanjutnya, campuran disaring dan disimpan selama 24 jam pada suhu ruangan, kemudian dikeringkan dalam oven pada suhu 80⁰C selama 8 jam. Sampel yang diimpregnasi kemudian dipirolisis menggunakan alat pirolisis beraliran N2 selama 1 jam pada suhu 550⁰C dengan laju alir 5 m3/s. Karbon aktif hasil pirolisis dicuci dengan aquades sampai pH netral dan dikeringkan pada suhu 105⁰C selama 4 jam. Karbon aktif dihaluskan menggunakan mortar dan disimpan untuk digunakan lebih lanjut.
3.8.2 Tahap Pengujian Adsorpsi Methyl Orange
Setelah pembuatan adsorben dari kulit jeruk berupa biosorben dan karbon aktif selesai, penelitian dilanjutkan dengan tahap pengujian menggunakan reaktor batch. Pengujian yang dilakukan adalah pengujian pengaruh waktu kontak, pH dan dosis untuk menentukan model kinetika dan isoterm adsorpsi yang sesuai untuk menggambarkan proses adsorpsi yang terjadi. Dalam penelitian, volume limbah cair sintesis yang digunakan adalah sebanyak 200 mL per reaktor batch dan diambil sebanyak 50 mL sampel effluen untuk dianalisa konsentrasinya menggunakan spektrofotometer UV-Vis.
1. Kinetika Adsorpsi
Kinetika adsorpsi dilakukan dengan memasukkan 1 gram adsorben kedalam reaktor yang telah berisi limbah cair sintetis. Reaktor batch diaduk dalam waterbath shaker
III-6 dengan kecepatan 150 rpm selama waktu tertentu (0, 5, 15, 30, 60 dan 90 menit) pada suhu ruangan. Setiap selang waktu yang telah ditetapkan, sampel diambil lalu disaring dengan kertas whattman nomor 40 untuk dianalisa konsentrasi methyl orange akhir.
2. Isoterm Adsorpsi
Pengujian isoterm adsorpsi diawali dengan pengujian pengaruh pH dan pengaruh dosis adsorben. Pengujian pH dilakukan dengan memasukkan 1 gr adsorben ke dalam reaktor batch yang telah berisi limbah cair sintesis dengan pH yang berbeda (pH 2, 3, 4, 5 dan 6). Pengaturan pH menggunakan larutan 0,1 M CH3COOH atau 0,1 M NaOH. Reaktor diletakkan di dalam waterbath shaker untuk diaduk dengan kecepatan 150 rpm selama waktu optimum (menggunakan waktu kontak dengan hasil efisiensi penyisihan methyl orange tertinggi dari uji kinetika adsorpsi sebelumnya). Setelah pengadukan selesai, sampel diambil untuk dianalisa konsentrasi methyl orange akhir.
Uji penentuan isotherm adsorpsi dilanjutkan dengan uji pengaruh dosis terhadap penyisihan methyl orange. Limbah cair sintesis dengan pH optimum (pH limbah cair sintesis disesuaikan dengan pH yang memiliki hasil efisiensi penyisihan tertinggi pada pengujian pengaruh pH) dimasukkan ke dalam reaktor batch, kemudian ditambahkan adsorben dengan dosis yang berbeda (0, 1, 2, 3, 4 dan 5 gr/l) pada suhu ruangan (24 ± 1°C). Reaktor dimasukkan ke dalam waterbath shaker untuk diaduk dengan kecepatan 150 rpm selama waktu optimum (menggunakan waktu kontak dengan hasil efisiensi penyisihan tertinggi dari pengujian kinetika adsorpsi) sehingga tercapai kesetimbangan adsorpsi. Selanjutnya, dianalisa konsentrasi methyl orange akhir.
3.9 Pengujian Daya Serap Iodin
Penentuan daya serap iodin dilakukan dengan menimbang 1 gram arang aktif, selanjutnya ditambahkan dengan pipet 25 ml larutan ion monoklorida dan erlenmeyer ditutup dengan tutup yang dibasahi dengan Kl, keudian dikocok dengan hati-hati dan disimpan di tempat yang gelap selama 2 jam, ke dalam erlenmeyer ditambahkan 10 ml larutan Kalium Iodida (Kl) 20% dan 150 ml air suling, kemudian dikocok dan seterusnya dititrasi dengan larutan tiosulfat 0,1 N. Sebagai penunjuk adalah larutan pati/kanji dan untuk perbandingan digunakan larutan blanko dengan cara yang sama (SNI 06-3730, 1995). Persamaan yang digunakan untuk menghitung daya serap iodin adalah Persamaan 2.1 sebagai berikut :
Universitas Sumatera Utara
III-7 Daya jerap iodin = 10− b×a N×126.9 fp
gram contoh × 100% (2.1)
Keterangan :
b = jumlah titar untuk contoh (ml) a = normalitas larutan (N)
N = normalitas larutan Na2SO3 (N) Berat molekul iodin = 126,9
3.10 Analisa Sampel
Pengukuran konsentrasi limbah cair sintesis dan sampel dilakukan menggunakan spektrometer UV-Vis.
3.11 Analisa Data
Data hasil pengujian akan disajikan dalam bentuk tabel dan grafik dengan permodelan persamaan reaktor batch. Analisa data yang dilakukan yaitu kapasitas adsorpsi, model kinetika dan isoterm adsorpsi.
3.12 Efisiensi Penyisihan
Data yang diperoleh akan menunjukkan nilai yang paling optimal tentang perubahan konsentrasi methyl orange. Untuk mengetahui efisiensi penurunan konsentrasi methyl orange pada sampel air limbah, maka dalam penelitian ini dapat dihitung efisiensinya dengan membandingkan influen dan effluen yang dinyatakan dalam persen (%).
Persamaan yang digunakan untuk perhitungan efisiensi penyisihan adalah Persamaan 2.3 sebagai berikut :
Efisiensi penyisihan (%) = (C0−Ct)
C0 × 100% (2.3)
Keterangan : E = efisiensi
C0 = konsentrasi methyl orange sebelum treatment Ct = konsentrasi methyl orange setelah treatment 3.13 Kinetika Adsorpsi
Penentuan model kinetika adsorpsi yang sesuai perlu dilakukan untuk menjelaskan proses adsorpsi yang terjadi. Laju adsorpsi dievaluasi menggunakan model kinetika
III-8 adsorpsi Orde Pertama Semu (Pseudo First Order) dan Orde Kedua Semu (Pseudo Second Order).
3.14 Isoterm Adsorpsi
Penentuan model kinetika adsorpsi yang sesuai perlu dilakukan untuk menjelaskan proses adsorpsi yang terjadi. Data percobaan isoterm adsorpsi dianalisis menggunakan model Langmuir dan Freundlich.
Universitas Sumatera Utara
BAB IV
HASIL DAN PEMBAHASAN
Analisa data hasil pengujian dilakukan untuk mengetahui kondisi optimum adsorpsi methyl orange dari masing-masing adsorben. Adsorben yang digunakan adalah kulit jeruk dengan dua perlakuan adsorben, yaitu biosorben dan karbon aktif. Pembuatan biosorben kulit jeruk dilakukan tanpa aktivasi, sedangkan pembuatan karbon aktif kulit jeruk dilakukan dengan proses aktivasi menggunakan H3PO4 70%. Data yang dianalisa adalah data hasil pengujian pengaruh waktu kontak, pH dan dosis adsorben yang kemudian digunakan untuk penentuan model kinetika dan isoterm adsorpsi.
Karakterisasi adsorben juga dilakukan dengan pengujian Scanning Electron Microscope (SEM), Energy Dispersion Spectrometry (EDS), Fourier Transform Infra Red (FTIR) dan uji daya serap iodin.
4.1 Hasil Scanning Electron Microscope (SEM), Energy Dispersion Spectrometry (EDS) Permukaan Biosorben dan Karbon Aktif Kulit Jeruk
Analisis SEM-EDS dilakukan pada sampel adsorben sebelum dan sesudah aktivasi. Uji Scanning Electron Microscope (SEM) dilakukan untuk mengetahui bentuk morfologi permukaan biosorben dan karbon aktif kulit jeruk, sedangkan uji EDS (Energy Dispersion Spectrometry) dilakukan untuk mengetahui komponen utama secara kuantitatif untuk biosorben dan karbon aktif kulit jeruk. Pengujian dilakukan dengan ukuran perbesaran 100X. Hasil pengujian SEM dapat dilihat pada Gambar 4.1.
(a) (b)
Gambar 4.1 Hasil Uji SEM (a) Biosorben dan (b) Karbon Aktif Kulit Jeruk
IV-2 Hasil uji SEM biosorben dan karbon aktif kulit jeruk pada Gambar 4.1 menunjukkan adanya perbedaan morfologis yang jelas dari permukaan adsorben. Gambar 4.1 (a) menunjukkan permukaan biosorben kulit jeruk sangat heterogen. Mafira et al (2013) juga mengamati karakteristik yang sama dalam adsorben kulit jeruk. Gambar 4.1 (b) menunjukkan karbon aktif yang diberi perlakuan dengan bahan aktivator memiliki permukaan yang lebih tidak teratur dan lebih berpori daripada biosorben, maka luas permukaan lebih spesifik. Karakteristik permukaan ini akan menghasilkan kapasitas adsorpsi yang lebih tinggi (Ning-Chuan dan Guo, 2012). Selain itu, permukaan karbon aktif yang lebih berpori ini membuktikan bahwa proses pirolisis mengarah pada pengembangan permukaan yang sangat berpori (Hosseini et al., 2011).
(a)
(b)
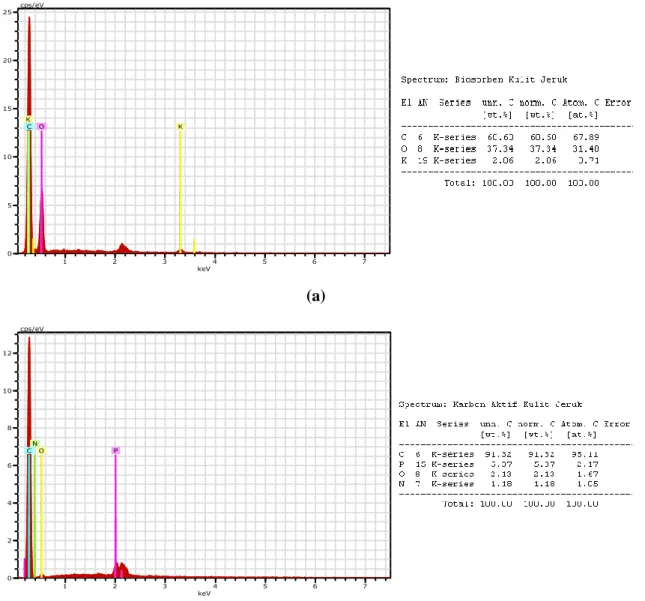
Gambar 4.2 Hasil Uji EDS (a) Biosorben dan (b) Karbon Aktif Kulit Jeruk
1 2 3 4 5 6 7
keV 0
5 10 15 20 25 cps/eV
C O K
K
1 2 3 4 5 6 7
keV 0
2 4 6 8 10 12
cps/eV
C N O P
Universitas Sumatera Utara
IV-3 Berdasarkan Gambar 4.2, diperoleh unsur-unsur yang terdapat pada biosorben kulit jeruk, yaitu C, O dan K, sedangkan unsur-unsur yang terdapat pada karbon aktif, yaitu C, P, O dan N. Analisa EDS dari kedua adsorben menunjukkan bahwa atom C merupakan elemen utama dari adsorben dan dapat dilihat perbedaan nilai konsentrasi unsur yang signifikan. Hasil tersebut menampilkan perolehan nilai konsentrasi C pada karbon aktif meningkat menjadi 95,11% setelah aktivasi, hal ini menunjukkan bahwa proses pirolisis berhasil (Hosseini et al., 2011). Peningkatan kandungan karbon juga terjadi karena penggunaan larutan aktivator asam fosfat. Selain itu, terbentuk unsur P dan N pada karbon aktif, dimana unsur N terbentuk karena modifikasi oleh H3PO4 (Khaniabadi et al., 2016).
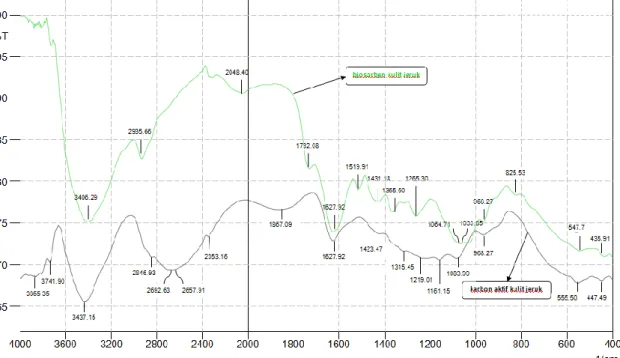
4.2 Uji Karakteristik Fourier Transform Infra-Red (FTIR)
Analisis FTIR merupakan analisis yang dilakukan pada adsorben untuk menentukan gugus fungsi permukaan (Hosseini et al., 2011). Menurut Pirajan dan Liliana (2013) FTIR spectrophotometry digunakan untuk memahami formasi dari komposisi adsorben.
Adapun hasil FTIR spectrophotometry biosorben dan karbon aktif kulit jeruk disajikan pada Gambar 4.3.
Gambar 4.3 Uji FTIR Spectrofotometry pada Biosorben dan Karbon Aktif Kulit Jeruk