PENGARUH KOMBINASI NAPHTHALENE ACETIC ACID (NAA) DAN KINETIN
PADA KULTUR IN VITRO EKSPLAN DAUN TEMBAKAU
(Nicotiana tabacum L. var. Prancak 95)
Daniar robbiani*, Tutik Nurhidayati1, Nurul Jadid1
Program Studi Biologi, Fakultas Matematika Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember Surabaya
ABSTRAK
Penelitian Pengaruh Kombinasi Naphthalene Acetic Acid (NAA) dan Kinetin Terhadap Kultur In vitro Eksplan Daun Tembakau (Nicotiana tabacum L. var. Prancak 95) bertujuan untuk menentukan kombinasi konsentrasi NAA dan Kinetin yang efektif dan mengetahui pengaruh morfogenesis eksplan dari kombinasi tersebut. Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tumbuhan Program Studi Biologi ITS Surabaya. Penelitian ini disusun dalam Rancangan Acak Lengkap (RAL) dengan dua faktor. Faktor pertama konsentrasi NAA, terdiri atas 6 level yaitu 0 ppm; 0,5 ppm; 1 ppm; 1,5 ppm; 2 ppm, dan 2,5 ppm. Faktor kedua konsentrasi Kinetin, terdiri atas 5 level yaitu 0 ppm; 1 ppm; 2 ppm; 3 ppm; and 4 ppm. Hasil menunjukkan bahwa jumlah proliferasi tunas tertinggi diperoleh pada perlakuan dengan 0 ppm NAA dan 4 ppm Kinetin (62,75 tunas/eksplan) dan perlakuan dengan 2,5 ppm NAA dan 0 ppm Kinetin memberikan hasil terbaik untuk proliferasi akar (37,75 akar/eksplan). Kalus yang didapatkan paling dominan berwarna putih kehijauan dan tekstur kompak.
Kata kunci: Nicotiana tabacum L. var. Prancak 95, NAA, Kinetin, Kalus, Kultur jaringan tumbuhan
ABSTRACT
The research of the influence of Naphthalene Acetic Acid (NAA) and Kinetin combination on in vitro culture of Tobacco leaf explant (Nicotiana tabacum L. var. Prancak 95) was conducted to determine the effective combination of NAA and Kinetin concentration and to observe the explant morphogenetic effect of its combination. This research was carried out in the plant tissue culture laboratory, department of Biology ITS, Surabaya. This research was designed with completely randomize design with two factors. The first factor was the NAA concentration, consisted of six levels i.e. 0 ppm; 0.5 ppm; 1 ppm; 1,5 ppm; 2 ppm; and 2,5 ppm. The second factor was Kinetin concentration, consisted of five levels i.e. and 0 ppm ; 1 ppm; 2 ppm, 3 ppm, and 4 ppm. The result showed that highest amount of shoot proliferation was obtained from treatment with 0 ppm NAA and 4 ppm Kinetin (62,75 shoot/explant) and the treatment for 2,5 ppm NAA and 0 ppm Kinetin gave the best result for root proliferation (37,75 root/explant). The most dominant callus obtained were white greenish in colour and compact in texture.
Key words: Nicotiana tabacum L. var. Prancak 95, NAA, Kinetin, Callus, Plant Tissue Culture
*Corresponding author Phone : +6285719149996 e-mail : niar.snoopy21@gmail.com
1 Alamat sekarang : Prodi Biologi, Fak MIPA,
Institut Teknologi Sepuluh Nopember, Surabaya
I PENDAHULUAN
Penanaman dan penggunaan tembakau di
Indonesia
Penanaman dan penggunaan
tembakau di Indonesia sudah dikenal sejak
lama. Komoditi tembakau mempunyai arti
yang cukup penting, tidak hanya sebagai
serangga
sehingga
nikotin
dapat
dimanfaatkan
oleh
manusia
sebagai
bioinsektisida (Susilowati, 2006). Tembakau
juga dapat dimanfaatkan sebagai pewarna
kain sutera dengan menggunakan daunnya
untuk menjadi larutan celup pada proses
pencelupan kain sutera (Santosa, 2007).
Keistimewaan dan manfaat yang besar dari
tembakau membuat tembakau mempunyai
potensi untuk dikembangkan dalam berbagai
bidang.
Salah satu tanaman yang sering
dikembangkan adalah tembakau Madura.
Pada saat ini tembakau Madura yang
berkembang sebagai bahan baku rokok
adalah adalah var.
Prancak 95
dan
Cangkring 95
(Basuki
et al
., 1999).
Keunggulan tembakau var.
Prancak 95
adalah memiliki sifat hasil sedang, mutu
tinggi, aromanya khas, kadar nikotin rendah,
tahan terhadap penyakit lanas dan sesuai
ditanam di lahan tegal dan gunung. Selama
ini budidaya tembakau Madura dilakukan
secara konvensional. Budidaya tembakau
secara konvensional memerlukan proses
yang tidak sederhana dan waktu yang relatif
lama, selain itu sifat-sifat genetis tidak sama
persis seperti induknya. Seiring dengan
berkembangnya ilmu pengetahuan, tanaman
tembakau juga mulai dibudidayakan melalui
program pemuliaan tanaman. Hal tersebut
bertujuan
untuk
meningkatkan
jumlah
produksi tanaman tembakau.
Salah
satu
program
pemuliaan
tanaman tembakau tersebut adalah dengan
teknik kultur jaringan. Manfaat utama kultur
jaringan adalah menghasilkan tanaman baru
dalam jumlah yang besar dalam jangka
waktu yang relatif singkat dengan sifat dan
kualitas yang diharapkan sama dengan
induknya (Rahardja, 1995 dalam Yunus,
2007). Salah satu perbanyakan tanaman
tembakau secara
in vitro
yang efisien adalah
dengan mengkulturkan organ yaitu eksplan
dari daun muda tembakau (Hendaryono,
1994). Penggunaan eksplan dari jaringan
muda lebih sering berhasil karena sel-selnya
aktif membelah, dinding sel tipis karena
belum terjadi penebalan lignin dan selulose
yang menyebabkan kekakuan pada sel.
Selain
itu
faktor
lain
yang
memberikan pengaruh terhadap keberhasilan
perbanyakan tanaman secara
in vitro
adalah
zat pengatur tumbuh. Zat pengatur tumbuh
yang banyak digunakan dalam kultur
jaringan adalah auksin dan sitokinin. NAA
(
Naphthalene Acetic Acid
) merupakan salah
satu
auksin
yang
berperan
dalam
perpanjangan sel. Sedangkan Kinetin (
6-furfury amino purine
) adalah salah satu
sitokinin yang berperan untuk pembelahan
sel. Sitokinin bersama-sama dengan auksin
akan
memberikan
pengaruh
interaksi
terhadap diferensiasi jaringan dalam kultur
jaringan tanaman (Hendaryono, 1994).
Penelitian terhadap interaksi antara
kinetin dan auksin pada kultur tembakau
telah membuktikan adanya peranan dari
kedua zat tumbuh ini terhadap pertumbuhan.
Kinetin yang berimbang dengan auksin dapat
menyebabkan pertumbuhan kalus (Abidin,
1985 dalam Fitrianti, 2006). Jumlah auksin
dan sitokinin yang perlu ditambahkan
kedalam kultur tergantung kandungan auksin
dan
sitokinin
endogen
pada
eksplan.
Berdasarkan penelitian Maryanto (1987)
dalam Suryowinoto (1991) pada kultur
tembakau (
Nicotiana tabacum
) dengan
perbandingan auksin : kinetin 5:0 atau 4:1
hanya terjadi pertumbuhan akar saja. Pada
jumlah perbandingan sebaliknya yaitu auksin
: kinetin 0:5 atau 1:4 hanya terjadi tunas
besar, tanpa ada akar sama sekali. Sedangkan
menurut
Suryowinoto
(1991)
dalam
Hendaryono (1994), pada kultur in vitro
daun muda tembakau pada medium MS
perlu ditambahkan zat pengatur tumbuh IAA
dan Kinetin dengan perbandingan 2:3 ppm.
II METODOLOGI
1 Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Februari – Maret 2010 di Laboratorium Kultur Jaringan Program Studi Biologi ITS. Jenis tembakau Madura yang digunakan adalah (Nicotiana tabacum L.var. Prancak 95) yang diperoleh dari PT. Sadhana-Pasuruan.
2 Alat, Bahan, dan Cara Kerja 2.1 Tahap Persiapan
a. Sterilisasi Alat dan Ruang Kerja
Semua peralatan baik alat pembuatan media (botol kultur) dan alat inokulasi eksplan (cawan petri, scalpel blade, gunting eksplan, pinset, kertas saring, dll) disterilisasi dengan autoklaf dengan suhu 121oC tekanan 1,5 atm selama 15 menit (Nugroho, 2004).
Laminair Air Flow (LAF) disemprot dengan alkohol 70% dan alat-alat yang dimasukkan ke dalam LAF juga harus disemprot dengan alkohol 70%. Ruang tanam disterilisasi dengan sinar UV selama 1 jam sebelum LAF digunakan. Ketika LAF digunakan maka sinar UV harus dimatikan dan blower dihidupkan (Fitrianti, 2006).
b. Sterilisasi Eksplan
Sterilisasi permukaan eksplan daun ini ada 2 tahap yaitu sterilisasi tahap I yang dilakukan di ruang persiapan dan sterilisasi tahap II yang dilakukan di LAF. Sterilisasi tahap I meliputi: Daun tembakau muda (daun kedua sampai ketiga dari pucuk) diambil dari green house dibilas dengan air mengalir hingga bersih. Sedangkan sterilisasi tahap II meliputi: Daun tembakau dimasukkan ke dalam 70 % etanol selama 0,5 menit. Kemudian dibilas dengan aquades steril selama 5 menit. Potongan daun tembakau disterilisasi dengan 1% sodium hypochlorite (Bayclin ™) selama ± 10 menit. Kemudian dibilas tiga kali dengan aquades steril selama 5 menit sebanyak 3 kali sambil digojog. Selanjutnya eksplan diambil dengan pinset dan ditiriskan pada kertas saring. (Fowke, L.C. et al,
1983).
2.2 Pembuatan Media
a. Pembuatan Stok Zat Pengatur Tumbuh NAA dan Kinetin
Untuk pembuatan larutan stok NAA (MerckTM), dilakukan penimbangan bahan sebanyak 10 mg dan dimasukkan ke dalam erlenmeyer berukuran 100 ml yang diberi aquades sedikit. Sambil diaduk, diteteskan sedikit demi sedikit larutan NaOH 1 N dengan hati-hati sambil dikocok sampai zat pengatur
tumbuh larut benar. Kemudian ditambahkan aquades steril ke dalam erlenmeyer hingga volume mendekati 70 ml sambil dikocok-kocok. Kemudian ditambahkan kembali aquades steril ke dalam erlenmeyer sampai volume menjadi 100 ml. Kemudian larutan dipindahkan ke dalam wadah stok, ditutup rapat dengan aluminium foil dan kapas dan diberi label NAA. Selanjutnya disimpan dalam lemari es. Untuk pembuatan larutan stok Kinetin (TCITM) caranya juga sama seperti pembuatan larutan stok NAA. Apabila zat pengatur tumbuh belum larut, dapat dibantu dengan memanaskannya dengan pemanas atau
hot plate (Santoso dan Nursandi, 2003).
Perhitungan perlakuan zat pengatur tumbuh (Lampiran 4) menggunakan rumus pengenceran yaitu:
V1.M1 = V2.M2
V1 = volume larutan stok yang dicari M1 = dosis larutan stok yang tersedia V2 = volume medium yang akan dibuat M2 = dosis medium yang akan dibuat
(Hendaryono, 1994).
perlakuan dan disimpan di dalam ruang steril (Hendaryono, 1994).
2.3 Inokulasi Eksplan
Proses inokulasi dilakukan di laminar air flow dengan kondisi aseptik. Alat-alat inokulasi ditata didalam laminar air flow. Setiap alat tersebut dicelupkan ke dalam alkohol 70% dan dipanaskan di atas nyala api bunsen selama 1-2 menit. Bunsen yang akan dipakai hendaknya terisi penuh. Daun Nicotiana tabacum L.
dikeluarkan dari botol sterilisasi dan diletakkan pada cawan petri steril yang telah dilapisi kertas tissue/kertas serap steril untuk menyerap aquades. Kemudian daun dipotong-potong persegi di atas petridish dengan ukuran 0,5 - 1 cm2. Eksplan tersebut kemudian diinokulasikan ke dalam botol kultur yang telah berisi media MS modifikasi dengan posisi horizontal (mendatar) dan bagian abaksial menempel pada permukaan medium (Dhaliwal et al., 2004). Media MS modifikasi ini terdiri atas unsur makro, unsur mikro, sukrosa, vitamin, agar, zat pengatur tumbuh NAA dan Kinetin. Setiap botol kultur berisi 2 eksplan. Botol ditutup rapat dan diberi label yaitu tanggal dilakukan inokulasi eksplan dan konsentrasi hormon yang digunakan. Kemudian ditata rapi dalam rak kultur bertingkat. Botol berisi eksplan diinkubasi pada suhu 25-28oC, kelembaban 70% dengan fotoperiode 12 jam terang dan 12 jam gelap selama ± 1 bulan. Setiap kolom rak kultur diberi pencahayaan dengan lampu flourescen 40 watt (Gunawan, 1995).
3. Rancangan Penelitian dan Hipotesis
3.1 Rancangan Penelitian
Rancangan penelitian ini menggunakan rancangan acak lengkap (RAL) pola faktorial yang terdiri dari 2 faktor (Faktor 1= konsentrasi NAA dan Faktor 2=konsentrasi Kinetin) dan masing-masing 4 kali ulangan. Rancangan penelitian disajikan pada tabel 2.
3.2 Uji Kuantitatif
Jika eksplan yang ditumbuhkan menghasilkan tunas atau akar, maka akan dihitung jumlah tunas dan jumlah akar, selanjutnya seluruh data yang diperoleh dianalisis dengan menggunakan ANOVA dan jika ada pengaruh maka dilanjutkan dengan uji Tukey dengan tingkat kesalahan 5% menggunakan Minitab.
Adapun hipotesis dalam penelitian ini adalah sebagai berikut :
H0 = Tidak ada pengaruh kombinasi zat pengatur tumbuh NAA dan Kinetin terhadap morfogenesis eksplan tanaman tembakau.
H1 = Ada pengaruh kombinasi zat pengatur tumbuh NAA dan Kinetin terhadap morfogenesis eksplan tanaman tembakau. Sedangkan variabel yang digunakan adalah :
Variabel bebas : perbandingan konsentrasi zat pengatur tumbuh NAA
Jika eksplan yang ditumbuhkan menghasilkan kalus maka dilakukan pengamatan secara deskriptif yaitu morfologi kalus. Menurut Ali et al. (2007) warna kalus yang terbentuk antara lain kuning, kehijauan, dan hijau terang sedangkan tekstur kalus yang terbentuk adalah lunak, keras, dan kompak (Lampiran 3).
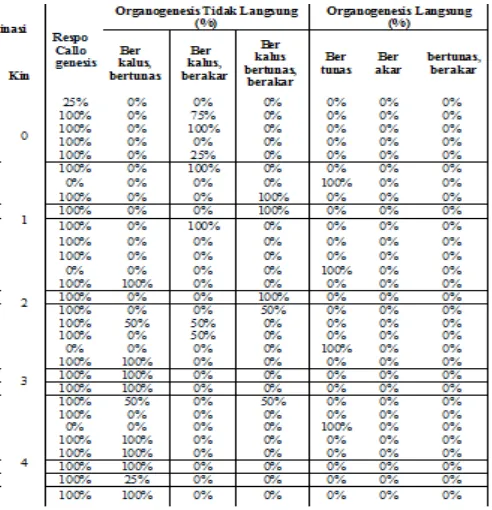
b. Respon Organogenesis dan Callogenesis Respon organogenesis dan callogenesis dilakukan pengukuran persentase pertumbuhan eksplan yang meliputi respon callogenesis (eksplan membentuk kalus), respon organogenesis tidak langsung (eksplan berkalus bertunas, eksplan berkalus berakar, eksplan berkalus bertunas berakar), dan respon organogenesis langsung (eksplan bertunas, eksplan berakar, eksplan bertunas dan berakar).
IV HASIL DAN PEMBAHASAN
4.1 Respon Callogenesis Kultur In Vitro Nicotiana tabacum L. var Prancak 95
Penambahan zat pengatur tumbuh NAA dan Kinetin pada kultur in vitro eksplan daun tembakau Madura (Nicotiana tabacum L. var.
Prancak 95) dengan konsentrasi yang berbeda yaitu sebanyak 30 kombinasi memberikan respon organogenesis dan callogenesis yang bervariasi. Penelitian dilakukan selama 30 hari untuk mengetahui respon morfogenesis dari Nicotiana tabacum var. Prancak 95 yang ditandai dengan terbentuknya kalus, tunas, dan akar dalam bentuk persentase (Tabel 4.1).
yang ditandai dengan terbentuknya kalus yang mulai terbentuk pada bagian tepi eksplan (bagian perlukaan) bagian atas maupun bagian bawah yang bersentuhan dengan media, tetapi kalus lebih cepat terbentuk pada bagian yang bersentuhan dengan media, yaitu bagian abaksial daun. Hal ini kemungkinan berkaitan dengan proses pengambilan nutrisi medium oleh eksplan. Penyerapan unsur hara akan lebih baik karena terjadi kontak langsung antara media dengan bagian abaksial daun. Munculnya kalus pada bagian yang terluka diduga karena adanya rangsangan dari jaringan pada eksplan untuk menutupi lukanya. Hal ini sesuai pendapat dari Thomas dan Davey (1975) dalam George and Sherington (1993), mengemukakan bahwa pembelahan sel yang mengarah pada terbentuknya kalus terjadi dari adanya respon terhadap luka dan suplai hormon alamiah atau buatan dari luar ke dalam eksplan. Pada perlakuan 0 ppm NAA dan 0 ppm Kinetin eksplan memberikan respon dengan penambahan volume yaitu eksplan agak membesar dan melengkung dan terbentuk tonjolan kecil yaitu kalus tanpa disertai adanya respon organogenesis yang nantinya akan tumbuh menjadi tunas, atau akar (Gambar 4.1).
Gambar 4.1. Eksplan dengan perlakuan 0 ppm NAA dan 0 ppm Kinetin
Berdasarkan Tabel 4.1, respon callogenesis pada eksplan Nicotiana tabacum L. terjadi pada semua perlakuan dengan persentase 100% dan 25 %, kecuali pada perlakuan 0 ppm NAA dengan penambahan Kinetin dengan persentase 0% (Tabel 4.1).
Tumbuhnya kalus pada perlakuan 0 ppm NAA dan 0 ppm Kinetin disebabkan adanya pengaruh hormon endogen yang terkandung dalam eksplan itu sendiri. Hormon endogen tersebut juga mampu memacu sel untuk berkembang dan memperbanyak diri tetapi waktu yang dibutuhkan cenderung lama karena jumlah hormon yang tidak tersedia secara pasti. Hal ini membuktikan bahwa terbentuknya kalus sangat dipengaruhi oleh peran jenis zat pengatur tumbuh. Menurut Zulfiqar et al., (2009) kondisi tersebut membuktikan bahwa pertumbuhan dan morfogenesis tanaman secara in vitro
dikendalikan oleh keseimbangan dan interaksi dari ZPT yang ada dalam eksplan baik endogen maupun eksogen yang diserap dari media.
dalam medium kultur, maka tidak akan ada pengaruh apapun tehadap tumbuhnya kalus karena Kinetin lebih berperan terhadap pembelahan sel serta diferensiasi terbentuknya tunas. Namun, jika Kinetin ditambahkan bersama-sama dengan auksin maka sel-sel akan mengalami pembelahan dan perkembangan secara terus menerus. Rasio sitokinin terhadap auksin mengontrol diferensiasi sel. Ketika konsentrasi kedua hormon tersebut hampir sama, massa sel akan terus bertambah (terbentuk kalus). Penggunaan medium MS dengan penambahan NAA dengan konsentrasi lebih tinggi daripada konsentrasi Kinetin dapat menginduksi proliferasi kalus. Zia et al., (2007) menyebutkan bahwa bahwa kalus dapat tumbuh pada beragam konsentrasi dan jenis zat pengatur tumbuh, namun untuk zat pengatur tumbuh Kinetin pada eksplan daun, kalus hanya tumbuh pada Kinetin dengan konsentrasi yang rendah yaitu dibawah 1 ppm, dan diatas 1 ppm kalus tidak dapat tumbuh. Sedangkan pada zat pengatur tumbuh NAA, kalus dapat tumbuh di semua konsentrasi dan sebagian besar menunjukkan persentase 100%. Selain itu, interaksi zat pengatur tumbuh juga berpengaruh tehadap warna dan tekstur kalus. Adapun tekstur dan warna kalus disajikan pada Tabel 4.2
Morfologi kalus yang terbentuk pada
pengamatan selama 30 hari meliputi warna
putih, putih kehijauan, hijau, dan coklat.
Sedangkan tekstur yang terbentuk yaitu
kompak dan remah (Gambar 4.2).
organogenesis
dalam
kultur
jaringan
tumbuhan.
Kalus kompak memiliki struktur
yang terorganisasi dan ditandai dengan nodul
berwarna hijau dan sangat baik untuk
regenerasi planlet. Tekstur kalus kompak
merupakan efek dari sitokinin yang berperan
dalam transport zat hara. Sistem transport
sitokinin dari bagian basal ke apeks akan
membawa air dan zat hara melalui pembuluh
pengangkut dan mempengaruhi potensial
osmotik dalam sel. Penambahan sukrosa
dalam medium akan mengalir melalui
pembuluh floem dan menimbulkan tekanan
turgor. Tekanan tersebut muncul akibat
adanya
perbedaan
konsentrasi
larutan,
sehingga air dan zat hara (sukrosa) dari
medium akan masuk kedalam sel melalui
cara osmosis. Hal ini akan membuat
dinding-dinding sel semakin kaku, sehingga sel kalus
akan menjadi kompak. Sukrosa yang
merupakan karbohidrat sebagai cadangan
makanan ini akan diubah menjadi pati yang
digunakan sebagai energi pada proses
morfogenesis
eksplan,
sehingga
dapat
membantu sel untuk terus membelah.
Menurut Purwianingsih (2007),
struktur
kalus yang kompak dan terjadi perubahan
warna
kekuningan
atau
kehijauan,
mengindikasikan terjadinya diferensiasi sel.
Kalus remah didapatkan pada perlakuan
dengan NAA lebih tinggi dari Kinetin dan
berwarna coklat karena terdapat pengaruh
komposisi medium dan zat pengatur tumbuh.
Kalus remah ini terjadi melalui proses
pertumbuhan
yang
mengarah
pada
pembentukan sel-sel yang berukuran kecil
dan berikatan longgar. Dalam hal ini, auksin
memiliki peran terhadap pembentukan kalus
remah. NAA menstimulasi pemanjangan sel
dengan cara penambahan plastisitas dinding
sel menjadi longgar, sehingga air dapat
masuk ke dalam dinding sel dengan cara
osmosis dan sel mengalami pemanjangan.
Oleh karena itu, kalus
yang
remah
mengadung banyak air karena belum
mengalami lignifikasi dinding sel, antara
kumpulan sel yang satu dengan yang lain
relatif mudah untuk dipisahkan. Pada
penelitian ini, kalus remah pada perlakuan
NAA dengan konsentrasi yang tinggi tumbuh
akar, namun tidak mengalami pemanjangan,
sedangkan pada perlakuan kombinasi NAA
dan Kinetin yang tinggi tidak dapat
berdiferensiasi menjadi tunas atau akar,
karena
zat
pengatur
tumbuh
dengan
konsentrasi
tinggi
ini
cenderung
menghambat diferensiasi kalus.
Peristiwa pencoklatan ini adalah peristiwa
alamiah, yang merupakan suatu proses
perubahan adaptif bagian tanaman akibat
adanya pengaruh seperti respon dari bekas
perlukaan pada eksplan dan juga merupakan
tahapan awal perubahan warna kalus menjadi
putih kehijauan. Hal ini terbukti pada kalus
yang berwarna coklat juga terdapat kalus
remah yang berwarna putih dan massa kalus
semakin bertambah dan juga ada yang
tumbuh akar.
Perubahan warna juga diduga
karena adanya sintesis senyawa fenolik
akibat adanya cekaman berupa pelukaan
pada jaringan. Pernyataan tersebut diperkuat
oleh Verpoorte
et al. (1993), bahwa
terjadinya
pencokelatan pada jaringan adalah
karena
aksi
polifenol
oksidase
yang
disintesis akibat dari oksidasi jaringan ketika
terluka.
Selain itu warna coklat ini berarti
terdapat proses degradasi klorofil karena
tidak ada penambahan Kinetin dan
konsentrasi Kinetin yang rendah, dimana
Kinetin disini berperan dalam pembentukan
klorofil, sehingga menyebabkan warna hijau
tidak muncul. Hal ini sesuai dengan pendapat
Santosa dan Nursandi (2002) bahwa kalus
yang tidak hijau disebabkan oleh hilangnya
polarisasi,
sehingga
terjadi
proses
dekomposisi klorofil.
4.2 Respon Organogenesis Kultur In Vitro
Nicotiana tabacum L. var Prancak 95
pembentukan kalus (Dhaliwal
et al.,
2003).
Menurut Attfield dan Evans (1991) dalam
Dhaliwal
et al
(2003), eksplan daun
tembakau dapat membentuk tunas dan akar
secara langsung atau tidak langsung,
tergantung zat pengatur tumbuh dalam
medium
kultur.
Eksplan
menunjukkan
respon secara organogenesis tidak langsung
seperti pada perlakuan 0,5 ppm NAA dan 1
ppm Kinetin dapat dilihat pada Gambar 4.3.
Gambar 4.3.Eksplan membentuk kalus,
tunas, dan akar pada perlakuan
0,5 ppm NAA dan 1 ppm Kinetin
Respon organogenesis dapat dilihat melalui
Tabel
4.3
dan
4.4.
Adanya
respon
organogenesis
yang
diamati
berupa
proliferasi tunas dan akar.
4.2.1 Proliferasi Tunas
Hasil penelitian menunjukkan bahwa terdapat interaksi yang nyata antara NAA dan Kinetin terhadap jumlah tunas. Sementara Kinetin sebagai faktor tunggal berpengaruh nyata terhadap pembentukan tunas, dan NAA sebagai faktor tunggal tidak berpengaruh nyata terhadap pembentukan tunas (Lampiran 4). Berdasarkan hasil analisis uji tukey dengan selang kepercayaan 95% bahwa jumlah tunas pada perlakuan
Kinetin 4 ppm dan NAA 0 ppm
berbeda nyata dengan perlakuan yang lainnya (Tabel 4.3). Rerata jumlah tunas pada medium dengan berbagai kombinasi NAA dan Kinetin disajikan pada Tabel 4.3.
Berdasarkan Tabel 4.3 bahwa respon proliferasi tunas dipengaruhi oleh kadar zat pengatur tumbuh yang ditambahkan ke dalam media kultur MS. Pada perlakuan Kinetin tanpa penambahan NAA, yang terbentuk hanyalah tunas dengan jumlah yang banyak tanpa disertai dengan pembentukan kalus dan akar dengan hasil analisis ragam berbeda nyata dengan perlakuan 0 ppm NAA dan 0 ppm Kinetin.
Gambar 4.4. Grafik perbandingan rata-rata jumlah tunas dengan konsentrasi zpt
Berdasarkan Gambar 4.4. menunjukkan interaksi zat pengatur tumbuh yang menghasilkan tunas paling banyak adalah kombinasi 0 ppm NAA dan 4 ppm Kinetin dengan rata-rata jumlah tunas yang dihasilkan adalah 62,75 tunas/eksplan. Terbentuknya tunas pada perlakuan Kinetin tanpa penambahan NAA ini dikarenakan zat pengatur tumbuh yang ditambahkan adalah Kinetin yang termasuk sitokinin, dan fungsi sitokinin lebih memicu pembentukan tunas dan pembelahan sel namun cenderung menghambat pembentukan akar, sedangkan auksin cenderung memicu pembentukan kalus dan akar. Hal ini menunjukkan bahwa sitokinin sangat efektif untuk menginisiasi tunas secara langsung maupun tidak langsung. Selain itu konsentrasi Kinetin yang tinggi juga menjadi penyebab terhambatnya pemanjangan tunas, karena tidak ada faktor NAA yang mempengaruhi dalam
Kalus
Tunas
pemanjangan sel. Konsentrasi Kinetin 4 ppm yang ditambahkan disini merupakan konsentrasi optimal untuk memicu pembentukan tunas. Hal ini sesuai dengan penelitian Yunus (2007), bahwa jumlah tunas terbanyak tumbuh pada perlakuan Kinetin tunggal 4 ppm. Tunas yang terbentuk pada perlakuan Kinetin 4 ppm tanpa penambahan NAA dapat dilihat pada Gambar 4.5.
Gambar 4.5. Tunas yang terbentuk pada perlakuan 0 ppm NAA dan 4 ppm Kinetin
Sedangkan perlakuan dengan penambahan zat pengatur tumbuh NAA tanpa Kinetin tidak menghasilkan tunas, hanya kalus dan akar saja dengan hasil analisis ragam tidak berbeda nyata dengan perlakuan 0 ppm NAA dan 0 ppm Kinetin. Hal ini dikarenakan zat pengatur tumbuh yang ditambahkan adalah NAA. Auksin lebih berperan dalam inisiasi kalus dan akar. Tidak terbentuknya tunas dikarenakan tidak adanya Kinetin yang berperan dalam pembelahan sel serta diferensiasi sel yang lebih ke arah pembentukan tunas. Sehingga dapat diketahui bahwa sitokinin sangat penting dalam mengiduksi tunas eksplan daun tembakau
Nicotiana tabacum L.
Adapun interaksi antara zat pengatur tumbuh NAA dan Kinetin dengan jumlah tunas dapat dilihat pada gambar 4.4. Adanya interaksi antara NAA dan Kinetin dapat mempengaruhi terbentuknya tunas dengan baik. Hal ini dibuktikan pada perlakuan interaksi tersebut banyak yang menghasilkan tunas. Hal ini dikarenakan terdapat pengaruh faktor NAA dan Kinetin sebagai zat pengatur tumbuh. Keseimbangan antara NAA dan Kinetin sangat penting dalam menginduksi tunas karena masing-masing zat pengatur tumbuh tersebut mempunyai peranan dalam menginduksi tunas. Skoog dan Miller (1950) dalam Kieber (2002) mengungkapkan bahwa dengan adanya auksin dan sitokinin dalam medium dapat menstimulasi sel-sel jaringan parenkim tembakau untuk
membelah. Pemanjangan sel, pembelahan sel, morfogenesis dan pengaturan pertumbuhan merupakan proses yang sangat penting dalam pembetukan kalus dan selanjutnya diikuti pembentukan tunas. Hal ini menunjukkan bahwa sitokinin (Kinetin) dan auksin (NAA) berperanan saling melengkapi dalam menginduksi tunas.
Tunas sebagian besar terbentuk pada bagian abaksial daun, sedangkan akar tumbuh pada bagian adaksial daun. Dhaliwal et al (2004) mengatakan bahwa pada eksplan daun tembakau primordia tunas tumbuh dari sel-sel mesofil palisade yang terletak di bagian adaksial daun, sedangkan akar tumbuh dari barisan sel parenkim dekat dengan pembuluh vaskuler. Skoog and Miller, (1957) dalam Kieber (2002) mengatakan sitokinin terlibat dalam berbagai aspek pada pertumbuhan dan perkembangan tanaman terutama pembentukan tunas. Proses perkembangan bakal tunas diawali dengan pembelahan sel secara periklinal di sisi lateral (periferal), agak di bawah daerah distal meristem pucuk. Pembelahan sel secara periklinal yang diikuti dengan pertumbuhan sel anak yang menyebabkan tonjolan yang membentuk primordial daun, sedangkan pembelahan sel secara antiklinal dapat meningkatkan luas permukaan primordia daun. Primordial daun ditopang oleh sel prokambium, selanjutnya prokambium tersebut akan menjadi tulang daun (Qosim, 2005).
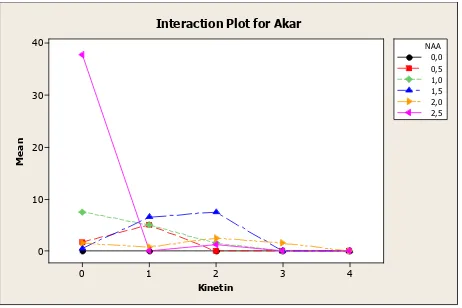
4.2.2 Proliferasi Akar
Berdasarkan Tabel 4.4 dapat diketahui bahwa pada perlakuan tanpa penambahan NAA, tidak terbentuk akar sama sekali, karena memang tidak ada faktor yang mempengaruhi terbentuknya akar yaitu auksin (NAA). Peran auksin disini untuk menginduksi akar, sedangkan sitokinin untuk mendorong proses morfogenesis tunas. Pada perlakuan NAA tanpa penambahan Kinetin, eksplan menunjukkan tumbuhnya akar dengan rerata yang berbeda dan hasil analisis ragam tidak berbeda nyata pada uji Tukey, kecuali perlakuan 2,5 ppm NAA dan 0 ppm Kinetin (Tabel 4.4). Kombinasi konsentrasi optimum untuk pertumbuhan akar adalah 0 ppm Kinetin dan 2,5 ppm NAA dengan rata-rata jumlah akar adalah 37,75 akar/eksplan. Akar yang terbentuk sangat banyak, hal ini menunjukkan bahwa kadar NAA sebesar 2,5 ppm merupakan konsentrasi optimum yang memberikan efek proliferasi akar yang baik dibanding dengan perlakuan yang lain (Gambar 4.6).
Gambar 4.6 Akar yang terbentuk pada perlakuan 2,5 ppm NAA dan 0 ppm Kinetin
Adanya penambahan NAA ini dapat membuat kalus berdiferensiasi menjadi akar. Dalam hal ini berarti auksin yang ditambahkan dalam medium dapat memicu pembentukan akar baik dalam konsentrasi rendah maupun tinggi. Hal ini sesuai dengan penelitian Maryanto (1971) dalam Suryowinoto (1996) bahwa pada kultur in vitro tembakau dengan konsentrasi auksin dan sitokinin 0 ppm:5 ppm hanya terbentuk akar saja dengan jumlah yang sangat banyak.
Sedangkan interaksi antara NAA dan Kinetin pada medium tidak berbeda nyata, hal ini dapat dilihat degan kecilnya rerata jumlah akar pada perlakuan kombinasi NAA dan Kinetin (Tabel 4.4). Setiap eksplan memberikan respon yang berbeda-beda terhadap tiap perlakuan yang diujikan.
Gambar 4.7. Grafik perbandingan rata-rata jumlah akar dengan konsentrasi zpt
Berdasarkan gambar 4.7 terdapat interaksi antara zat pengatur tumbuh NAA dan Kinetin dengan rata-rata jumlah akar yang terbentuk. Akar-akar yang terbentuk sedikit, namun tidak semua kombinasi dalam perlakuan ini tumbuh akar, meskipun dalam media telah ditambahkan NAA dan Kinetin, akar tidak dapat terinduksi. Hal ini berarti terdapat faktor inhibitor dengan adanya penambahan Kinetin. Kinetin disini cenderung memicu pembentukan tunas dan menghambat pembentukan akar. Lee et al, (2002) menyatakan bahwa keberadaan sitokinin juga menghambat kerja auksin dalam hal pemanjangan sel pada hipokotil. Son et al
(2004) juga menyatakan bahwa respon transport auksin dihambat oleh penambahan sitokinin dalam hal pemanjangan akar pada daerah meristem apikal akar. Hal ini sejalan dengan azas keseimbangan auksin dan sitokinin yang dikemukakan oleh George and Sherington (1993) bahwa pembentukan akar memerlukan auksin tanpa sitokinin atau sitokinin dalam konsentrasi rendah.
karena menghasilkan jumlah akar yang lebih sedikit. Menurut Sugiharto (2007) kadar sitokinin yang optimal untuk pertumbuhan tunas dapat menghambat pertumbuhan dan pembentukan akar. Pernyataan ini sesuai dengan hasil penelitian bahwa pada konsentrasi Kinetin 4 ppm yang dikombinasikan dengan berbagai macam konsentrasi NAA, tidak merespon pembentukan akar.
George and Sherington (1993) menyatakan bahwa auksin berpengaruh luas terhadap pertumbuhan, merangsang dan mempercepat pertumbuhan akar, serta meningkatkan kualitas dan kuantitas akar. Semakin cepatnya saat terbentuk akar pada media yang ditambahkan NAA menunjukkan bahwa auksin dapat mengaktifkan enzim-enzim yang berperan dalam pembuatan komponen sel sehingga begitu mulai terjadinya pembelahan sel maka NAA akan merangsang pembentukan sel-sel dengan cepat, sehingga dapat menginisiasi pembentukan akar (Wattimena, 1991).
IV KESIMPULAN
Berdasar hasil penelitian dapat
diperoleh kesimpulan sebagai berikut :
1. Penambahan zat pengatur tumbuh
Naphthalene Acetic Acid (NAA) dan Kinetin memberikan pengaruh terhadap jumlah tunas, jumlah akar pada kultur in vitro eksplan daun tembakau (Nicotiana tabacum L. var.
Prancak 95).
2. Respon Jumlah Tunas terbaik ditunjukkan pada perlakuan dengan penambahan 4 ppm Kinetin 0 ppm NAA, dengan rata-rata sebesar 62,75 tunas/eksplan. Sedangkan respon jumlah akar terbaik ditunjukkan pada perlakuan dengan penambahan 2,5 ppm NAA 0 ppm Kinetin dengan rata-rata sebesar 37,75 tunas/eksplan.
3. Organogenesis pada eksplan terjadi secara langsung dan tidak langsung dan Callogenesis terjadi pada eksplan pada semua perlakuan kecuali perlakuan tanpa penambahan NAA.
DAFTAR PUSTAKA
Abdullah, Ahmad dan Soedarmanto. 1982.
Budidaya Tembakau. CV Yasaguna.
Jakarta.
Ali, G., F. Hadi, Z. Ali, M. Tariq, and M. A. Khan. 2007. Callus Induction and in vitro
Complete Plant Regeneration of Different Cultivars ot Tobacco (Nicotiana tabacum
L.) on Media of Different Hormonal
Concentration. Biotechnology. Vol 6(4): 561-566
Basuki, S, Suwarso, A. Herwati, dan S.
Yulaikah. 1999. Biologi dan Morfologi
Tembakau Madura. Balai Penelitian
Tembakau dan Tanaman Serat. Malang Dhaliwal, H. S., E. C. Yeung, and T. A. Thorpe.
2004. Tiba Inhibition of In vitro Organogenesis in Excised Tobacco Leaf Explants. In vitro cell. Dev. Biol. Plant 40:235-238. Plant Physiology Research
Group, Departement of Biological
Sciences, University of Calgary, Calgary, Alberta, T2N 1N4, Canada
Fitrianti, A. 2006. Efektivitas Asam 2,4-Diklorofenoksiasetat (2,4-D) dan Kinetin pada Medium MS dalam Induksi Kalus Sambiloto dengan Eksplan Potongan
Daun. Skripsi. Biologi FMIPA UNS:
Semarang
Fowke, L. C., P. J. Rennie, and F. Constable. 1983. Organelles Associated with the Plasma Membran of Tobacco Leaf Protoplast. Plant Cell Report 2(1983): 292-295
George, E. F., and Sherrington, Ph.D. 1993.
Plant Propagation by Tissue Culture.
Exegetic Limited. London.
Gunawan, L.W., 1995. Teknik kultur jaringan
tumbuhan. Laboratorium Kultur Jaringan
Tumbuhan, Pusat Antar Universitas
(PAU), Institut Pertanian Bogor (IPB). Bogor.
Hanum, Chairani. 2008. Teknik Budidaya
Tanaman Jilid 3. Direktorat Pembinaan
Sekolah Menengah Kejuruan, Direktorat
Jenderal Manajemen Pendidikan Dasar
dan Menengah, Departemen Pendidikan
Nasional. Jakarta
Hendaryono, Daisy.P.S dan Ari Wijayani. 1994.
Teknik Kultur Jaringan (Pengenalan dan Petunjuk Perbanyakan Tanaman Secara Vegetatif-Modern). Penerbit Kanisius. Yogyakarta
Hidayat. 2007. Induksi Pertumbuhan Eksplan Endosperm Ulin dengan IAA dan Kinetine. Agritrop, 26 (4) : 147 – 152. Fakultas Pertanian Universitas Udayana Denpasar Bali - Indonesia
Imelda Maria, Wulansari Aida, Poerba Yuyu Suryasari. 2008. Regenerasi Tunas dari Kultur Tangkai Daun Iles-iles (Amorphophallus muelleri Blume).
Judd. 2002. Plant Systematics. Sinauer Associates, Inc. Publisher. Sunder Land, Massachusetts U.S.A
Julia, H.L. 1990. Nicotiana tabacum L. Seccion Toxicologia Hospital de Clinicas "José de San Martin" Cordoba 2351 Capital Federal
1120 Argentina.
http://www.IPCS-INCHEM
Kieber, Joseph J., and Ingrid B D’Agostino. 2002. Molecular mechanisms of cytokinin action. Plant Biology 1999, 2:359–364.
Department of Biological Sciences. Chicago
Lee, Dong Ju, Sung Soo Kim, Soung Soo Kim. 2002. The Regulation Of Korean Radish Cationic Peroxidase Promoter By a Low Ratio of Cytokinin To Auxin. Plant Science 162 (2002) 345–353.
Leupin, Ruth E., Leupin Marianne, Charles Ehret, Karl H. Erismann, And Witholt Bernard. 2000. Compact Callus Induction And Plant Regeneration Of A Non-Beberapa Taraf Konsentrasi 6-Benzil Amino Purine (BAP) dan 1 -Napthalene Acetic Acid (NAA). Jurnal-Jurnal Ilmu Pertanian Indonesia, volume 7 no-1: 8-14
Nugroho, A. 2004. Pedoman Pelaksanaan
Teknik Kultur Jaringan. Penebar Swadaya. Jakarta.
Pant, B., and Manandhar, S. 2007. In Vitro Propagation Of Carrot (Daucus Carota) L. Scientific World, Vol. 5, No. 5, June. Central Department Of Botany, Tribhuvan University, Kirtipur, Kathmandu, Nepal.
Pauline, D. Kasi & Sumaryono. 2008. Perkembangan Kalus Embriogenik Sagu (Metroxylon sagu Rottb.) pada tiga sistem kultur in vitro. Menara Perkebunan, 76(1), 1-10. Balai Penelitian Bioteknologi Perkebunan Indonesia, Bogor.
Purwianingsih, Widi.Dra.M.Si, Kusdianti R, Dra.M.Si, Yuniarti Linda, S.Si. Anatomi Kalus Yang Berasal Dari Eksplan Daun
Catharanthus Roseous (L). G. Don (Tapak Dara). Skripsi Yuniarti.
Qosim, Warid Ali, Poerwanto. R, Wattimena. G.A, Dan Witjaksono. 2005. Pembentukan Planlet Manggis Dari Kalus Nodular In Vitro. Zuriat, Vol. 16, No. 2. Bogor
Rachman, A. Machfudz Dan Heri Istiana. 1997.
Teknik Budidaya Tembakau Madura. Balai
Penelitian Tanaman Tembakau Dan
Tanaman Serat. Malang.
Rahardja, P. C. 1995. Kultur Jaringan Teknik
Perbanyakan Tanaman Secara Modern.
Penebar Swadaya. Jakarta
Salisbury, F. B dan C.W. Ross. 1995. Fisiologi Tumbuhan. Jilid 3. Bandung: ITB.
Santosa, E. K. 2007. Pemanfaatan Daun Tembakau (Nicotiana Tabacum) Sebagai Pewarna Kain Sutera dengan Menggunakan Mordan Jeruk Nipis (Citrus Aurantifolia Swingle) Diterapkan Pada Lenan Rumah Tangga. Skripsi. Jurusan Teknologi Jasa dan Produksi Fakultas Teknik UNS. Semarang
Santoso, U. dan Nursandi, F. 2003. Kultur
Jaringan Tanaman. Penerbit Universitas Muhammadiyah Malang. Malang.
Silva, J. A. T. 2005. Simple Multiplication and Effective Genetic Transformation (Four Methods) of in vitro-grown Tobacco by
Stem Thin Cell Layers. Plant Science 169:
1046-1058
Smith dan Wood. 1992. Mollecular and Cell
Biochemistry. Cell Biology. Chapman & Hall. London
Son, Ora, Hee-Yeon Choa, Kim Mi-Ran. 2004. Induction of a Homeodomain–Leucine Zipper Gene By Auxin Is Inhibited By Cytokinin In Arabidopsis Roots.
Biochemical and Biophysical Research Communications 326 (2005) 203–209. Korea
Steenis, Van. 2008. Flora Untuk Sekolah
Menengah di Indonesia. PT Pradnya Paramita : Jakarta
Sudarmadji. 2003. Penggunaan Benzil Amino Purine Pada Pertumbuhan Kalus Secara In Vitro. Buletin Teknik Pertanian Vol 8 No. 1 2003.
Sugiharto Bowo, Rahayu Triastuti, Faatih Mukhiissul. 2007. Propagasi Tanaman Nilam (Pogostemon Cablin Benth.) Secara In Vitro Dengan Kombinasi Sitokinin Dan Auksin 2,4 D. MIPA, Vol. 17, No. 1, Januari 2007: 39 – 47. Jurusan Pendidikan Biologi FKIP UNS
Sunarjono, H. 2002. Budidaya Pisang Dengan
Bibit Kultur Jaringan. Penebar Swadaya. Jakarta.
Suryowinoto, M. 1996. Pemuliaan Tanaman
Secara In Vitro. Penerbit
Susilowati, E. Y. 2006. Identifikasi Nikotin dari Daun Tembakau Kering (Nicotiana tabacum) dan Uji Efektivitas Ekstrak Daun Tembakau sebagai Insektisida Penggerek Batang Padi (Scirpophaga innonata). Skripsi. Kimia FMIPA UNS. Semarang
Suwarso. 1991. Pemuliaan Tanaman Tembakau
Virginia dan Tembakau asli dalam Prosiding Pemuliaan Tanaman I. PPTI Komda jatim. Malang.
Suwarso, A. Herwati, A. Rachman, dan Slamet.
1999. Pemuliaan Tembakau Madura.
Balai Penelitian Tembakau dan Tanaman Serat: Malang
Suwarso, A. Herwati, dan A. S. Murdiyati. 2006.
Varietas-varietas Baru Tembakau
Madura. Balai Penelitian Tembakau dan Tanaman Serat: Malang
Suwarso, Anik Herwati. 2008. Varietas Unggul
Tembakau Prancak 95.
www.bpatp.litbang.deptan.go.id
Tohari. 1992. Tembakau dalam fisiologi tanaman
budidaya tropik. Gajah Mada University Press p.747-836. Yogyakarta
Verpoorte R, Van der Heijden R, Schripsema J. 1993. Plant biotechnology for the production of alkaloids; present status and prospect. J Nat Prod 56:186-207.
Wang, H., M. Zhao, B. Yang, Y. Jiang, and G. Rao. 2008. Identification of Polyphenols in Tobacco Leaf and Their Antioxidant and Antimicrobial Activities. Food Chemistry 107: 1399–1406
Wattimena, G. A. 1992. Diktat Zat Pengatur
Tumbuh Tanaman. Laboratorium Kultur Jaringan Tanaman PAU Bioteknologi IPB-Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan dan Kebudayaan. Bogor
Widiastoety, D. dan A.Santi. 1994. Pengaruh Air Kelapa terhadap Pembentukan Proticorm Like Bodies (PLBs) dari Anggrek Vanda
dalam Medium Cair. Jurnal Hortikultura
Volume 4 No. 2.
Yunus, Ahmad. 2007. Pengaruh IAA dan Kinetin terhadap Pertumbuhan Eksplan Bawang Merah (Allium ascalonicum L.) secara In Vitro. Jurnal Akta Agrosia Edisi Khusus No. 1: 53-58
Yusnita. 2003. Kultur Jaringan : Cara
Memperbanyak Tanaman Secara Efisien.
Jakarta. Agromedia Pustaka.
Zia, Muhammad, Riaz-ur-Rehman, and Chaudhary Muhammad Fayyaz. 2007.
Hormonal regulation for callogenesis and organgenesis of Artemisia absinthium L.
African Journal of Biotechnology Vol. 6 (16), pp. 1874-1878. Plant Physiology Laboratory, Faculty of Biological Sciences, Quaid-i-Azam University, Islamabad, Pakistan.
Zulfiqar, Bushra, Akhtar Abbasi Nadeem, Ahmad Touqeer, and Ishfaq Ahmed Hafiz. 2009. Effect of explant sources and different Concentrations of plant growth regulators on in vitro shoot proliferation and rooting of avocado(persea americana
mill.). Pak. J. Bot., 41(5): 2333-2346. Department of Horticulture, Pir Mehr Ali Shah Arid Agriculture University, Rawalpindi, Pakistan.
Zulkarnain. 2009. Kultur Jaringan Tanaman.