PERBANYAKAN CENDANA (
Santalum album
Linn.)
SECARA KULTUR
IN-VITRO
DENGAN PEMBERIAN ZAT PENGATUR TUMBUH
SITOKININ (BAP DAN KINETIN)
Oleh :
EKA PRIMAWATI
DEPARTEMEN KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
PERBANYAKAN CENDANA (
Santalum album
Linn.)
SECARA KULTUR
IN-VITRO
DENGAN PEMBERIAN ZAT PENGATUR TUMBUH
SITOKININ (BAP DAN KINETIN)
EKA PRIMAWATI
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Kehutanan pada
Departemen Konservasi Sumberdaya Hutan dan Ekowisata Fakultas Kehutanan
Institut Pertanian Bogor
DEPARTEMEN KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
Judul Penelitian : Perbanyakan Cendana (Santalum album Linn.) secara Kultur In-vitro dengan Pemberian Zat Pengatur Tumbuh Sitokinin (BAP dan Kinetin)
Nama mahasiswa : Eka Primawati
NRP : E34101035
Departemen : Konservasi Sumberdaya Hutan dan Ekowisata Fakultas : Kehutanan
Disetujui
Komisi Pembimbing
Ir. Edhi Sandra, M.Si. Mia Kosmiatin, S.Si, M.Si.
Ketua Anggota
Diketahui
Dekan Fakultas Kehutanan
Prof. Dr. Ir. Cecep Kusmana, M.S.
RINGKASAN
Eka Primawati. E34101035. Perbanyakan Cendana (Santalum album Linn.) secara Kultur In-vitro dengan Pemberian Zat Pengatur Tumbuh Sitokinin (BAP dan Kinetin). Dibimbing oleh: Ir Edhi Sandra, M.Si. dan Mia Kosmiatin, S.Si, M.Si.
Cendana (Santalum album Linn.) merupakan hasil hutan kayu yang khas dari Nusa Tenggara Timur (NTT) dan Timor Timur (Timtim). Tanaman ini mempunyai nilai ekonomis tinggi, karena dapat menghasilkan minyak atsiri dengan aroma spesifik, sebagai bahan dasar parfum, sabun dan kemenyan serta mempunyai khasiat sebagai obat pereda kejang, mual dan demam. Keberadaan Cendana sekarang merupakan tanaman langka, hal ini tercatat dalam IUCN Red List 1994 merupakan Threatened Species. Oleh sebab itu segera dilakukan tindakan budidaya, salah satunya melalui kultur in-vitro dengan pemberian zat pengatur tumbuh (ZPT) Sitokinin yaitu BAP benzylaminopurine), Kinetin (6-furfurylaminopurine) dan kombinasinya. Supaya mendapatkan perbanyakan Cendana optimal, maka penelitian ini perlu dilakukan. Penelitian ini bertujuan untuk mengetahui efektivitas pemberian zat pengatur tumbuh kelompok Sitokinin yaitu BAP, Kinetin atau kombinasinya pada perbanyakan Cendana.
Kegiatan Penelitian berlangsung di Unit Kultur Jaringan Laboratorium Konservasi Tumbuhan Departemen Konservasi Sumberdaya Hutan dan Ekowisata Fakultas Kehutanan IPB, selama 5 bulan mulai dari bulan Mei sampai September 2005. Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) dengan 1 faktorial yaitu pemberian ZPT berupa BAP, Kinetin dan kombinasinya, diberikan pada media Murashige and skoog (MS) terdiri atas 10 perlakuan dengan masing-masing perlakuan 10 ulangan. Perlakuan A1 (BAP 0 mg/l : Kinetin 0 mg/l), A2 (BAP 0.5 mg/l : Kinetin 0 mg/l), A3 (BAP 1 mg/l : Kinetin 0 mg/l), A4 (BAP 1.5 mg/l : Kinetin 0 mg/l), A5 (BAP 2.0 mg/l : Kinetin 0 mg/l), A6 (BAP 0 mg/l : Kinetin 0.2 mg/l), A7 (BAP 0.5 mg/l : Kinetin 0.2 mg/l), A8 (BAP 1.0 mg/l : Kinetin 0.2 mg/l), A9 (BAP 1.5 mg/l : Kinetin 0.2 mg/l), dan A10 (BAP 2.0 mg/l : Kinetin 0.2 mg/l). Peubah-peubah yang diamati dan diukur adalah pengamatan visual, jumlah tunas, jumlah buku, tinggi dan jumlah daun.
Berdasarkan hasil pengamatan visual terjadi kontaminasi, namun cukup rendah sebesar 17%. Eksplan berupa pucuk yang digunakan menunjukan gejala pencoklatan terutama pada bagian yang dipotong. Terdapat pertumbuhan kalus, namun tidak mendominasi pada setiap perlakuan, hanya terdapat pada beberapa eksplan pada perlakuan A9 (BAP 1.5 mg/l : Kinetin 0.2 mg/l). Kerontokan daun terjadi hingga mencapai presentase 15.61%, kemudian dilakukan tindakan subkultur dengan dilakukan penambahan Glutamin sebanyak 100 mg/l pada media. Persentase rata-rata kerontokan daun mengalami penurunan sebesar 6.70%.
pertambahan jumlah tunas terbesar terdapat pada perlakuan A9 yaitu media MS dengan penambahan BAP1.5 mg/l dan Kinetin 0.2 mg/l dengan angka sebesar 1.40, sedangkan nilai rata-rata terendah terdapat pada perlakuan A1 (BAP 0 mg/l : Kinetin 0 mg/l) dan A3 (BAP 1 mg/l : Kinetin 0 mg/l) dengan angka sebesar 0.00.
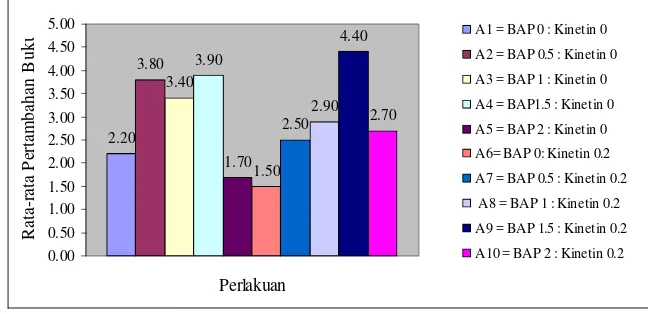
Berdasarkan hasil analisis sidik ragam menunjukkan bahwa pemberian ZPT BAP memberikan pengaruh berbeda sangat nyata, sedangkan Kinetin dan kombinasinya tidak memberikan pengaruh terhadap pertambahan jumlah buku. Nilai rata-rata pertambahan jumlah buku terbesar terdapat pada perlakuan A9 (BAP 1.5 mg/l : Kinetin 0.2 mg/l) yaitu 4.40, sedangkan pada perlakuan A6 (BAP 0 mg/l : Kinetin 0.2 mg/l) memberikan pengaruh terhadap rata-rata pertambahan jumlah buku terendah sebesar 1.50.
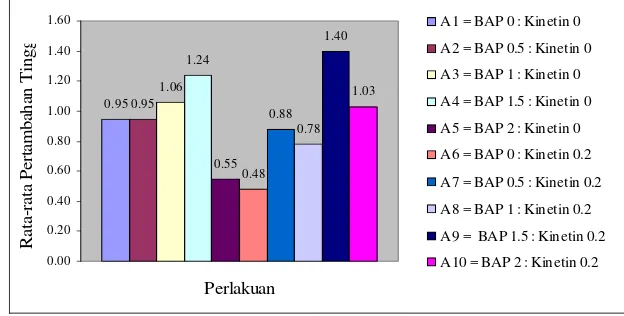
Hasil analisis sidik ragam menunjukkan bahwa pemberian ZPT BAP memberikan pengaruh berbeda sangat nyata, Kinetin memberikan pengaruh tidak berbeda nyata dan kombinasinya memberikan pengaruh berbeda nyata terhadap tinggi eksplan. Dapat dilihat nilai rata-rata pertambahan tinggi terbesar terdapat pada perlakuan A9 yaitu media MS dengan penambahan kombinasi BAP 1.5 mg/l dan Kinetin 0.2 mg/l menunjukkan angka pertambahan tinggi sebesar 1.40 cm, sedangkan nilai rata-rata pertambahan tinggi terendah terdapat pada perlakuan A6 dengan pemberian Kinetin 0.2 mg/l menunjukkan angka pertambahan 0.48 cm.
Berdasarkan hasil analisis sidik ragam menunjukkan bahwa pemberian ZPT BAP, Kinetin dan kombinasinya memberikan pengaruh terhadap pertambahan jumlah daun tahap ke-1. Rata-rata pertambahan tinggi terbesar terdapat pada perlakuan A3 yaitu Media MS dengan penambahan BAP 1 mg/l dengan angka pertambahan sebesar 13.20 helai, sedangkan nilai rata-rata terendah terdapat pada perlakuan A6 (BAP 0 mg/l : Kinetin 0.2 mg/l) dengan angka sebesar 2.80 helai.
Berdasarkan hasil analisis sidik ragam pemberian ZPT Kinetin memberikan pengaruh berbeda sangat nyata, sedangkan BAP dan kombinasinya tidak berpengaruh terhadap pertambahan jumlah daun pada tahap ke-2 pengamatan. Rata-rata pertambahan jumlah daun terbesar terdapat pada perlakuan A4 yaitu media MS dengan penambahan BAP 1.5 mg/l dengan nilai sebesar 4.30 helai, sedangkan pertambahan jumlah daun terendah terdapat pada perlakuan A6 (BAP 0 mg/l : Kinetin 0.2 mg/l) dengan nilai 0.50 helai.
RIWAYAT HIDUP
Penulis dilahirkan di Bojonegoro pada tanggal 19 November 1983, merupakan anak pertama dari dua bersaudara dari pasangan Bapak Dwijono dan Ibu Mas’ulah. Pendidikan formal penulis dimulai pada tahun 1987 di TK Dharmawanita Ngambon. Pada tahun 1989 melanjutkan ke SD Negeri Ngambon I dan lulus pada tahun 1995. Penulis melanjutkan pendidikan ke SLTP Negeri 1 Ngambon dan lulus pada tahun 1998. Pendidikan selanjutnya ditempuh di SMU Negeri 2 Bojonegoro dan lulus pada tahun 2001. Pada tahun yang sama penulis diterima menjadi mahasiswa Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) di Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas Kehutanan.
Selama mengikuti pendidikan di Fakultas Kehutanan IPB, penulis aktif di Himpunan Profesi (HimPro) Mahasiswa Konservasi Sumberdaya Hutan (HIMAKOVA) Kelompok Pemerhati Flora (KPF), Kelompok Pemerhati Kupu-kupu (KPK) periode 2002-2004. Asean Forestry Student Asosiation (AFSA) LC IPB (2002).
Penulis pernah mengikuti magang di Taman Nasional Meru Betiri (TNMB) serta di Perum Perhutani Unit II Jawa Timur BKPH Pradok, KPH Bojonegoro pada tahun 2003. Pada tahun 2004 penulis mengikuti Praktek Pengenalan dan Pengelolaan Hutan (P3H). Praktek Pengenalan Hutan dilaksanakan di BKPH Rawa Timur, KPH Banyumas Barat dan BKPH Gunung Slamet Barat, KPH Banyumas Timur. Praktek Pengelolaan Hutan dilakukan di KPH Ngawi. Praktek Kerja Lapang Profesi (PKLP) di laksanakan di Taman Nasional Ujung Kulon (TNUK) pada tahun 2005.
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan karunia yang telah diberikan, sehingga karya ilmiah ini berhasil diselesaikan. Tema dalam penelitian yang dilaksanakan sejak bulan Mei 2005 ialah budidaya secara in vitro, dengan judul ” Perbanyakan Cendana (Santalum album Linn.) secara Kultur In-vitro dengan Pemberian Zat Pengatur Tumbuh Sitokinin (BAP dan Kinetin) ”.
Dengan penuh rasa hormat, penulis menyampaikan ucapan terima kasih yang sebesar-besarnya kepada Bapak Ir. Edhi Sandra, M.Si. dan Ibu Mia Kosmiatin, S.Si, M.Si. selaku dosen pembimbing atas segala bimbingan dan pengarahannya selama penulis menyelesaikan skripsi. Bapak Dr. Ir. Imam Wahyudi, M.S. selaku dosen penguji dari Departemen Hasil Hutan dan Bapak Drs. Simon Taka Nuhamara, M.S. selaku dosen penguji dari Departemen Menejemen Hutan. Bapak dr. Sugiyanto selaku kepala Laboratorium P.T Agro Sejati atas bantuan penyediaan eksplan Cendana. Staf Laboratorium Kultur Jaringan Departemen KSH Pak Husen dan Pak Santa atas segala fasilitas laboratorium, bimbingan dan bantuan serta kerjasamanya selama penelitian berlangsung. KPAP Departemen KSH Ibu Evan, Ibu Titin, Ibu Tuti, Ibu Vivi, Ibu Eti dan Pak Acu atas segala bantuan administrasi. Teh Sri dan Mas Insan atas bantuan literatur yang telah diberikan. Keluarga tercinta Bapak, Ibu dan Dek Erista atas segala kasih sayang dan dukungannya. Eko, Mungki, Desi, Ari, Rita, Sari, Nanang, Kaka, Catur, Santun, dan Ernest atas segala bantuan dan dukungan kepada penulis. Rekan-rekan seperjuangan KSH’ 38 dan Fahutan atas inspirasi dan dukungannya. Semua pihak yang tidak dapat disebutkan satu-persatu. Semoga Allah SWT memberikan balasan atas segala bantuan yang telah diberikan kepada penulis.
Penulis menyadari bahwa karya ilmiah ini masih belum sempurna. Untuk itu kritik dan saran membangun sangat diharapkan oleh penulis. Akhirnya semoga karya ilmiah ini bermanfaat bagi pihak-pihak yang berkepentingan.
Bogor, Januari 2006
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... ii
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN ... vi
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 2
Hipotesis ... 2
Manfaat ... 2
TINJAUAN PUSTAKA Cendana ( Santalum album Linn.) ... 3
Taksonomi dan Morfologi ... 3
Penyebaran dan Habitat ... 5
Perbanyakan Cendana yang pernah dilakukan ... 5
Kegunaan ... 6
Kandungan ... 6
Kultur Jaringan ... 7
Pengertian kultur jaringan dan Culture in-vitro ... 7
Media Kultur ... 8
Zat Pengatur Tumbuh ... 9
Sitokinin ... 9
Perbanyakan Tanaman ... 10
Kultur Pucuk (Shoot tip culture) ... 10
Pertumbuhan dan Perkembangan ... 11
METODE PENELITIAN Lokasi dan Waktu Penelitian ... 12
Bahan dan Alat ... 12
Rancangan Percobaan ... 13
Pelaksanaan Percobaan ... 14
Kegiatan sterilisasi ... 14
Penanaman ... 15
Subkultur ... 16
Pengamatan ... 16
HASIL DAN PEMBAHASAN Pengamatan Visual ... 17
Kontaminasi ... 17
Gejala Pencoklatan ... 18
Kalus ... 18
Pertumbuhan Vegetatif... 19
Jumlah Tunas ... 20
Jumlah Buku ... 22
Tinggi ... 24
Jumlah Daun ... 26
Jumlah Daun tahap ke-1 ... 29
Jumlah Daun tahap ke-2 ... 31
KESIMPULAN DAN SARAN Kesimpulan ... 34
Saran ... 34
DAFTAR PUSTAKA ... 35
DAFTAR TABEL
No. Halaman
1. Rekapitulasi analisa sidik ragam terhadap berbagai peubah
pertambahan dalam perbanyakan Cendana pada 12 MST ... 19 2. Rekapitulasi uji lanjut Duncan pengaruh pemberian ZPT Sitokinin
(BAP, Kinetin dan kombinasinya) terhadap berbagai peubah
DAFTAR GAMBAR
No. Halaman
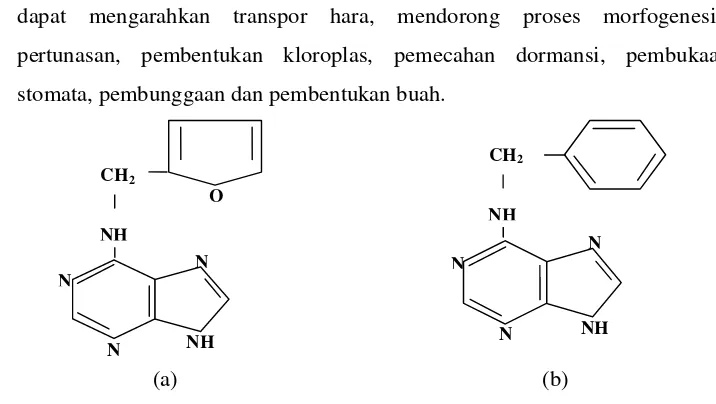
1. Rumus bangun ZPT Sitokinin (a) Kinetin (b) BAP ... 10
2. Kontaminasi pada botol kultur ... 17
3. Pencoklatan pada eksplan ... 18
4. Pertumbuhan kalus ... 19
5. Rata-rata pertambahan jumlah tunas pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya) pada 12 MST ... 21
6. Rata-rata pertumbuhan jumlah tunas pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya)... 22
7. Rata-rata pertambahan jumlah buku pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya) pada 12 MST ... 23
8. Rata-rata pertumbuhan jumlah buku pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya)... 24
9. Rata-rata pertambahan tinggi pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya) pada 12 MST ... 25
10.Rata-rata pertumbuhan tinggi pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya) ... 26
11.Kerontokan daun ... 27
12.Rata-rata pertambahan jumlah daun tahap ke-1 pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya) pada 12 MST ... 30
13.Rata-rata pertumbuhan jumlah daun tahap ke-1 pada perlakuan pemberian zatpengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya) ... 31
14.Rata-rata pertambahan jumlah daun tahap ke-2 pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya) pada 12 MST ... 32
DAFTAR LAMPIRAN
No. Halaman
1. Daftar sidik ragam pengaruh zat pengatur tumbuh BAP, Kinetin
dan kombinasinya terhadap pertambahan jumlah tunas Cendana... 37
2. Daftar sidik ragam pengaruh zat pengatur tumbuh BAP, Kinetin dan kombinasinya terhadap pertambahan jumlah buku Cendana ... 37
3. Daftar sidik ragam pengaruh zat pengatur tumbuh BAP, Kinetin dan kombinasinyaterhadap pertambahan tinggi Cendana ... 37
4. Daftar sidik ragam pengaruh zat pengatur tumbuh BAP, Kinetin dan kombinasinya terhadap pertambahan jumlah daun Cendana tahap ke-1 ... 37
5. Daftar sidik ragam pengaruh zat pengatur tumbuh BAP, Kinetin dan kombinasinya terhadap pertambahan jumlah daun Cendana tahap ke-2 ... 37
6. Rata-rata pertumbuhan jumlah tunas ... 38
7. Rata-rata pertumbuhan jumlah buku ... 38
8. Rata-rata pertumbuhan Tinggi ... 39
9. Rata-rata pertumbuhan jumlah daun tahap ke-1 ... 39
10.Rata-rata pertumbuhan jumlah daun tahap ke-2 ... 40
11.Pembuatan larutan stok untuk media Murashige & Skoog (MS) ... 40
12.Komposisisi garam makro, mikro, vitamin dan komponen lainnya dalam media Murashige & Skoog (MS) ... 41
PENDAHULUAN
Latar Belakang
Cendana (Santalum album Linn.) merupakan hasil hutan kayu yang khas dari Nusa Tenggara Timur (NTT) dan Timor Timur (Timtim). Tumbuhan ini mempunyai nilai ekonomis tinggi dan telah menjadi komoditas perdagangan sejak berabad-abad yang lalu, sebab dapat menghasilkan minyak atsiri dengan aroma spesifik (Badan Penelitian dan Pengembangan Kehutanan, 1992). Cendana digunakan sebagai bahan dasar parfum, sabun dan kemenyan serta merupakan tumbuhan yang mempunyai khasiat sebagai obat pereda kejang, mual dan demam.
Keberadaan Cendana sekarang merupakan tanaman langka, hal ini ditunjukkan dengan semakin berkurangnya jumlah tegakan Cendana. Data Badan Pusat Statistik (BPS) tahun 1999 menyebutkan, populasi Cendana di NTT hingga tahun 1997 tercatat 685.170 pohon. Rinciannya, pohon induk 182.133 batang dan pohon muda 502.584 batang. Sumber yang sama mencatat, produksi Cendana tahun 1997 sebanyak 16,586 ton (Kompas, 2001). IUCN Red List 1994 menyebutkan bahwa Cendana termasuk dalam Threatened Species (http://www.redlist.org/search/details.php?species=31852, 2005).
Upaya pemulihan potensi Cendana NTT telah banyak dilakukan, seperti usaha pengembangan dengan penanaman Cendana dari pembibitan maupun pemeliharaan anakan yang berasal dari penyebaran alamiah. Namun keberhasilannya sangat rendah karena kurangnya dukungan informasi dan teknologi pembudidayaanya. Hal ini di didukung pula adanya anggapan petani NTT bahwa penanaman Cendana dengan pembibitan sangat rendah keberhasilannya, bahkan sebagian masyarakat masih berpendapat bahwa Cendana tidak bisa ditanam (Rahayu, Wawo, Noordwijk, Hairiah, 2002).
Untuk mendapatkan media perbanyakan Cendana melalui kultur in-vitro khususnya dalam pertumbuhan dan morfogenesis, perlu diketahui penambahan zat pengatur tumbuh yang berperan dalam memacu pemanjangan sel, pembesaran dan pembelahan sel serta mengarahkan transpor hara pada eksplan. Supaya mendapatkan hasil perbanyakan yang optimal, maka diperlukan adanya formulasi khusus yaitu kombinasi zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya) dalam media kultur yang digunakan.
Tujuan Penelitian
Mempelajari efektivitas pemberian zat pengatur tumbuh BAP, Kinetin atau kombinasinya pada perbanyakan Cendana.
Hipotesis
Pemberian zat pengatur tumbuh Sitokinin yaitu BAP, Kinetin dan kombinasinya dapat meningkatkan perbanyakan atau multiplikasi tunas pada Cendana.
Manfaat
TINJAUAN PUSTAKA
Cendana (Santalum album)
Taksonomi dan Morfologi
Lawrence (1946) dalam Hermawan (1993) mengklasifikasikan Cendana (Santalum album Linn) sebagai berikut :
Kerajaan : Plantae
Divisi : Spermathophyta
Anak Divisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Santales
Anak Bangsa : Santalineae
Suku : Santalaceae
Marga : Santalum
Jenis : Santalum album Linn
Cendana merupakan pohon berukuran sedang yang selalu hijau, tinggi rata-rata mencapai 12-15 m (Rahayu et al, 2002; Hermawan 1993). Rahayu et al (2002) menyebutkan diameter batang Cendana sekitar 20-35 cm dengan kulit batang berwarna putih keabu-abuan. Hal ini berbeda dengan Hermawan (1993) menyebutkan batang pohon Cendana tegak dan bentuk bulat panjang dengan diameter rata-rata 40 cm serta cabang yang banyak, kulit batang kasar berwarna kelabu sampai coklat merah.
Pohon Cendana mempunyai daun tunggal berbentuk elips sampai lanset dengan ujung yang runcing. Panjang daun 4-8 cm, lebar 2-4 cm dan panjang tangkai daun 1-1,5 cm. Kedudukan daun berhadapan kadang-kadang berseling dan tidak mempunyai daun penumpu (Rahayu et al, 2002; Hermawan 1993).
Buah merupakan tipe buah batu, bentuknya bulat berbiji satu dan berukuran sebesar kacang polong, garis tengah 3-8 mm, saat muda berwarna hijau dan apabila masak berwarna hitam keunguan. Kulit buah tipis dan keras dengan 3 jalur dari atas sampai tengah. Biji berbentuk sederhana, tidak mempunyai rasa, mengandung endosperma yang berdaging, tanpa kulit biji (Rahayu et al, 2002; Hermawan 1993; Hamzah, 1976).
Sistem perakaran Cendana adalah akar tunjang yang jelas dengan banyaknya akar-akar cabang yang kuat. Akar yang muda mempunyai sedikit rambut akar. Akar cabang bentuknya panjang dan ramping, mempunyai kemampuan menjelajah tanah sejauh 30-40 m untuk mencapai inangnya (Rahayu et al, 2002; Hermawan, 1993; Hamzah, 1976).
Cendana adalah tanaman yang bersifat setengah parasit (hemi parasit), sehingga membutuhkan tanaman inang untuk memasok beberapa unsur hara yang digunakan untuk pertumbuhan (Rahayu et al, 2002; Hermawan 1993; Hamzah, 1976). Lebih lanjut Rahayu et al (2002) menyebutkan unsur hara yang diambil dari inang adalah Nitrogen (N), Pospor (P), Kalium (K) dan asam amino, sedangkan unsur kalsium (Ca) diambil sendiri dari dalam tanah. Tumbuhan inang juga berfungsi sebagai peneduh ketika Cendana masih dalam tingkat semai.
Parasitisme Cendana dengan inangnya terjadi melalui kontak akar. Setelah kontak akar terjadi maka nutrisi dari akar inang mengalir ke akar Cendana. Parasitisme ini secara morfologi dapat dilihat dari adanya titik sambung akar. Kontak tersebut diawali dengan terbentuknya houstorium yang tumbuh pada bulu-bulu akar Cendana. Houstorium adalah modifikasi akar Cendana yang menempel pada akar tanaman inangnya dan digunakan sebagai alat untuk menyerap unsur hara dari tanaman inangnya (Rahayu et al, 2002). Lebih lanjut disebutkan houstorium pada Cendana dewasa berbentuk piramida sedangkan pada tanaman muda berbentuk bola berwarna hijau kekuningan.
pada tingkat awal pertumbuhan yaitu pembibitan. Jenis inang primer yang dapat digunakan antara lain : Kaliandra (Caliandra callothyrsus), Knamok (Cassia timorensis), Gude atau Kacang turis (Cajanus cajan), Lamtoro (Leucaena glauca), Cabe (Capsicum annum) dan Turi (Sesbama grandiflora).
Inang sekunder adalah inang yang mendampingi Cendana dalam waktu yang lama. Terdapat lebih dari 50 jenis tumbuhan yang dijadikan sebagai inang sekunder Cendana. Suatu tanaman dikatakan sebagai inang sekunder apabila tanaman tersebut membentuk formasi dengan Cendana atau berada disekitar Cendana. Tanaman inang sekunder yang cocok untuk Cendana antara lain : Cemara laut (Casuarina equisentifolia L.), Johar (Senna siamea), Akasia (Acasia spp.), Petes merah (Acasia filosa) dan Kaliandra (Caliandra callothyrsus).
Penyebaran dan Habitat
Di Indonesia Cendana tumbuh secara alami di Jawa Timur, Nusa Tenggara Timur, Sulawesi dan Maluku (Hermawan, 1993). Disebutkan pula bahwa Cendana dapat tumbuh dengan baik pada tanah yang sifat peresapan air baik, seperti tanah yang berbatu dan mengandung kapur. Tempat yang disukai Cendana adalah daerah yang kering dan panas, dengan suhu terendah 20 ºC dan kelembaban udara 65%.
Iklim yang optimal untuk pertumbuhan Cendana adalah pada kondisi kering dengan rata-rata curah hujan 625-1625 mm/tahun (tipe iklim D-E, Schmidt Ferguson), dengan rata-rata temperatur 10–35ºC. Kondisi tanah yang optimal adalah tanah sarang/berdrainase baik dengan bantuan induk kapur atau vulkanik, dan terletak pada ketinggian 50-1200 mdpl (Hermawan, 1993; Sinaga dan Buharman, 1996). Lebih lanjut di sebutkan pada kondisi seperti ini, pertumbuhan di daerah pegunungan menunjukan hasil yang lebih baik dibanding di dataran rendah.
Perbanyakan Cendana yang pernah dilakukan
batang, menggunakan ranting yang berdiameter 3-5 mm dan panjang 30 cm (Hamzah, 1976; Hermawan 1993). Lebih lanjut Hermawan (1993) menyebutkan penanaman dengan stek akar tidak dianjurkan, karena persentase tumbuhnya tidak lebih dari 20%.
Cendana juga dapat diperbanyak melalui bijinya, yaitu terlebih dahulu disemaikan dalam kantung plastik. Guna menunjang kesuburan bibit perlu dipersiapkan biji tanaman inang. Setelah berumur 4-6 bulan, bibit Cendana baru siap dipindah tanamkan ke tempat penanamannya (Hamzah, 1976).
Kegunaan
Kayu Cendana dapat diolah menjadi berbagai barang kerajinan. Salah satu industri kecil Sari Wangi di Kupang telah menghasilkan barang cinderamata dengan pengelolaan yang sederhana. Selain barang cinderamata, usaha ini juga menghasilkan limbah kayu Cendana yang serpihan potongannya tidak beraturan. Serpihan kayu Cendana sangat kuat dan kenyal sehingga sukar untuk diolah lebih lanjut. Pengolahan lanjut limbah kayu ini menjadi serbuk dapat digunakan untuk membuat hio, dupa, atau wewangi lain (Bagia, Harijono dan Parsa, 2005). Hermawan (1993) menyebutkan bahan-bahan sintesis belum mampu mengeser kedudukan Cendana dalam industri parfum maupun industri barang ukir-ukiran, kipas, patung dan sebagainya.
Kayu Cendana berkhasiat sebagai penghalus kulit, peluruh keringat, pereda kejang, pencegah mual dan daunnya untuk obat sakit demam. Untuk menghaluskan kulit dipakai kayu Cendana yang sudah kering diserut halus lalu ditumbuk dan ditambah air hingga menyerupai pasta, kemudian dilulurkan keseluruh badan, setelah kering dibasuh dengan air bersih (http://iptek.apjii.or.id/artikel/ttg_tanaman_obat/depkes/buku4/4-082.pdf, 2005).
Dalam bidang keagamaan, kayu Cendana ada hubungannya dengan pengaruh agama Hindu dan Budha, sebab digunakan untuk membangun candi dan kuil serta membakar mayat orang-orang menurut ajaran Hindu (Hermawan, 1993).
Kandungan
kayu terasnya. Minyak Atsiri mengandung 80-90% senyawa santalol. Kandungan santalol sangat tergantung pada umur tanaman (Rahayu et al, 2002). Teras batang mengandung mengandung minyak 4.50-4.75%, sedangkan akar 5.50-5.70%, tetapi kadar santalol teras batang lebih tinggi dari dari pada teras akar (Hermawan, 1993).
Kandungan kimia daun, akar dan batang Cendana yaitu saponin dan flavonoida. Disamping itu daunnya juga mengandung antrakinon, akarnya mengandung polifenol dan batangnya mengandung tanin (http://iptek.apjii.or.id/artikel/ttg_tanaman_obat/depkes/buku4/4-082.pdf, 2005).
Kultur Jaringan
Pengertian Kultur Jaringan dan Culture in–vitro
Kultur jaringan tanaman adalah salah satu pendekatan budidaya pertanian yang sudah berpijak pada konsep how to create yang melengkapi serta memungkinkan peningkatan efektivitas dan produktivitas bertanam tradisional (Santoso dan Nursandi, 2003). Kultur jaringan tanaman terdiri dari sejumlah teknik untuk menumbuhkan organ, jaringan dan sel tanaman. Jaringan dapat dikulturkan pada agar padat atau dalam medium hara cair (Wetter and Constabel, 1991).
Pada pemahaman sederhana Culture mengandung arti budidaya sedangkan in–vitro dalam botol, berarti Culture in–vitro merupakan budidaya tanaman dalam botol. Pengertian lebih luas dari istilah itu adalah teknik budidaya sel, jaringan dan organ tanaman dalam suatu lingkungan yang terkendali dan dalam keadaan aseptik atau bebas mikroorganisme (Santoso dan Nursandi, 2003). Sel-sel, jaringan atau organ tanaman ditanam secara in-vitro (diluar lingkungan tumbuhnya) dengan menggunakan larutan bahan hara sintetik, ternyata dapat beregenerasi menjadi tunas dan akar yang selanjutnya dapat berkembang menjadi tanaman normal yang mampu hidup mandiri (Wetter and Constabel, 1991).
tumbuhan bersifat totipoten artinya sel bukan embrionik memiliki kemampuan untuk berdeferensiasi menjadi sel embrionik, kemudian berkembang menjadi individu baru yang lengkap, jika lingkungan mendukung (Salisbury and Ross, 1995).
Media Kultur
Kesuksesan kegiatan kultur jaringan akan ditentukan dan sangat tergantung oleh pemilihan media yang digunakan. Teknik kultur jaringan menekankan lingkungan yang cocok agar eksplan dapat tumbuh dan berkembang. Lingkungan yang cocok sebagian akan terpenuhi bila media yang dipilih mempertimbangkan segala sesuatu yang dibutuhkan oleh tanaman.
Media kultur jaringan mengandung bahan-bahan esensial dan komponen pengoptimal. Bahan esensial terdiri atas garam-garam mineral, sumber karbon dan energi, vitamin dan zat pengatur tumbuh. Sedang komponen yang berperan untuk optimalisasi adalah N-organik, asam organik subtrat komplek, arang aktif dan lain-lain (Santoso dan Nursandi, 2003).
Wetherell (1982) menyatakan tanaman membutuhkan garam mineral yang terdiri dari enam elemen makronutrien yaitu Nitrogen, Kalium, Magnesium, Kalsium, Belerang dan Fosfor. Sedangkan elemen mikro nutrien terdiri dari tujuh elemen yaitu Besi, Mangan, Seng, Tembaga, Boron, Molibdenum dan Khlor dalam bentuk ikatan kimia dan perbandingan yang sesuai.
Zat Pengatur Tumbuh (ZPT)
Zat Pengatur Tumbuh (ZPT) adalah senyawa organik bukan nutrisi yang dalam konsentrasi rendah (< 1mM) mampu mendorong, menghambat atau secara kualitatif mengubah pertumbuhan dan perkembangan tanaman (Santoso dan Nursandi, 2003).
Keberadaan ZPT dalam kegiatan kultur jaringan adalah perlu, karena kegiatan kultur jaringan menggunakan bahan tanam (sel, jaringan, organ) dan budidayanya terkendali. Proses tumbuh dan berkembangnya eksplan dapat disesuaikan dengan harapan. Pengaturan ini dapat dilakukan dengan mengatur macam dan konsentrasi ZPT tertentu sehingga menghasilkan kombinasi yang tepat sesuai dengan harapan (Santoso dan Nursandi, 2003).
Zat pengatur tumbuh memegang peranan penting dalam pertumbuhan dan perkembangan kultur. Faktor yang perlu mendapat perhatian dalam penggunaan zat pengatur tumbuh, antara lain : (1) jenis ZPT yang akan digunakan, (2) konsentrasi ZPT, (3) urutan penggunaan, (4) periode masa induksi dalam kultur tertentu, (5) kelemahan aktifitasnya (Gunawan, 1995).
Sitokinin
Sitokinin merupakan nama kelompok hormon tumbuh sangat penting sebagai pemacu pertumbuhan dan morfogenesis dalam kultur jaringan. Sitokinin alami di dalam tanaman yang paling banyak digunakan adalah Zeatin ( 4-hydroksi-3-memethyl-trans-2-butenylaminopurin) dan 2-iP (N6-(2-isopentyl) adenin). Biosintesis Zeatin terutama di ujung akar dan dalam biji yang sedang berkembang. Translokasi dari Zeatin terutama melalui xylem.
Sitokinin sintetik (Gambar 1) yang umum digunakan dalam kegiatan kultur jaringan adalah Kinetin furfurylaminopurine), BAP atau BA (6-benzylaminopurine/6-benzyladenin), Thidiazuron, PBA, 2CI-4PU dan 2,6 CI-4PU (Santoso dan Nursandi, 2003). Lebih lanjut disebutkan peranan Sitokinin diantaranya :
3. dapat mengarahkan transpor hara, mendorong proses morfogenesis, pertunasan, pembentukan kloroplas, pemecahan dormansi, pembukaan stomata, pembunggaan dan pembentukan buah.
(a) (b)
Gambar 1 Rumus bangun ZPT Sitokinin.
(a) Kinetin (BM : 215.22 g/mol) (b) BAP (BM : 225.26 g/mol)
Perbanyakan Tanaman
Perbanyakan tanaman secara umum berdasarkan pada perkembangan siklus hidupnya dapat digolongkan menjadi 2 yaitu perbanyakan secara seksual dan perbanyakan aseksual. Pada perbanyakan melalui siklus secara aseksual, perbanyakan vegetatif masih mampu mempertahankan karakteristik unik dari individu tanaman (tanaman induk).
Perbanyakan secara vegetatif melalui kultur jaringan sudah sangat berkembang di belahan bumi, dan menjadi pemilihan perbanyakan tanaman yang lebih komersiil. Perbanyakan tanaman dengan kultur jaringan memiliki kelebihan yaitu tanaman dapat diperbanyak setiap saat tanpa tergantung musim karena dilakukan di ruang tertutup, daya multiplikasi tinggi dari bahan tanaman kecil, tanaman dihasilkan seragam bebas penyakit terutama bakteri dan cendawan (Wattimena, Gunawan, Mattjik, Syamsudin, Wiendi, Ernawati, 1992).
Kultur Pucuk (Shoot tip culture)
Bagian tanaman yang digunakan sebagai eksplan disini adalah ujung tunas lateral atau terminal yang panjangnya kurang lebih 2 cm. Ukuran pucuk yang digunakan sebagai eksplan mempengaruhi keberhasilan cara ini. Pucuk dengan
ukuran lebih besar ternyata lebih tahan saat dipindahkan pada kondisi in-vitro, pertumbuhan lebih cepat (Wattimena et al, 1992).
Pada dekade tahun 1970 an banyak hasil penelitian yang dipublikasikan tentang perbanyakan tanaman melalui kultur pucuk ini. Beberapa faktor penyebab cara ini banyak digunakan untuk perbanyakan tanaman yaitu :
• Metode kultur pucuk dapat diterapkan pada berbagai jenis tanaman dengan memakai prinsip yang sama.
• Memungkinkan untuk mengontrol tunas yang dihasilkan bebas virus
• Tanaman yang dihasilkan secara genetik seragam
• Pada banyak tanaman, laju perbanyakannya lebih tinggi
Pertumbuhan dan Perkembangan
Pertumbuhan tanaman sering didefinisikan sebagai pertambahan ukuran, berat, dan atau jumlah sel. Ukuran tanaman sebagai indikator pertumbuhan dapat dilihat secara satu dimensi misalnya dengan mengukur tinggi tanaman (Lakitan, 1996).
Perkembangan tanaman lebih terlihat dari proses pembentukan jaringan dan organ-organ tanaman sehingga masing-masing individu tanaman mempunyai bentuk morfologis yang khas. Perkembangan tanaman tidak difokuskan pada pertambahan ukuran dan beratnya, walaupun tentu saja selama proses pembentukan jaringan dan organ tersebut akan diikuti pertambahan berat dan ukurannya.
Selama pertumbuhan dan perkembangan tanaman akan membentuk bermacam-macam organ. Secara umum organ tanaman terdiri dari organ vegetatif dan organ generatif. Akar, batang dan daun dikelompokkan sebagai organ vegetatif. Organ-organ vegetatif akan terbentuk lebih awal daripada organ generatif. Fase dimana tanaman hanya membentuk organ-organ vegetatif disebut fase pertumbuhan vegetatif.
METODE PENELITIAN
Lokasi dan Waktu Penelitian
Penelitian berlangsung di Unit Kultur Jaringan Laboratorium Konservasi Tumbuhan Departemen Konservasi Sumberdaya Hutan dan Ekowisata Fakultas Kehutanan IPB. Kegiatan ini berlangsung selama 5 bulan mulai dari bulan Mei sampai September 2005.
Bahan dan Alat
Bahan yang digunakan dalam kegiatan penelitian terdiri dari : 1. Bahan sterilisasi
Bahan yang digunakan untuk sterilisasi selama kegiatan penelitian berlangsung diantaranya adalah air steril, alkohol 70% dan larutan Baycline 5% serta antiseptik (betadine).
2. Bahan media
Media dasar yang digunakan dalam penelitian adalah Media Murashige and skoog (MS) terdapat pada Lampiran 12. Dalam media ditambahkan zat pengatur tumbuh jenis Sitokinin yaitu BAP 0.5 ; 1.0 ; 1.5 ; 2.0 dan kinetin 0.2 mg/l atau kombinasi keduanya, guna membantu pertumbuhan eksplan.
3. Bahan tanaman
Bahan tanaman yang digunakan adalah pucuk in-vitro yang berasal dari biakan in-vitro Cendana.
Peralatan yang digunakan adalah sebagai berikut : 1. Kegiatan sterilisasi
Autoklaf untuk mensterilkan alat dan media
Oven mensterilkan botol kultur
Pembakar spirtus digunakan untuk mensterilkan alat yang digunakan untuk menanam
Kompor gas digunakan untuk memanaskan Autoklaf 2. Kegiatan pembuatan media
Pipet 10 ml untuk pengambilan larutan dalam pembuatan media
Hot Plate and magnetik stirrer sebagai tungku pemanas listrik dan pengaduk magnetik dalam pembuatan media
Gelas piala 1000 ml digunakan sebagai wadah dalam pembuatan media
Labu takar 500 ml
Kertas pH untuk mengatahui asam atau basa dalam pembuatan media
Batang magnetik untuk mengaduk media 3. Kegiatan penanaman
Petridisk digunakan sebagai tempat memotong eksplan
Pisau untuk memotong eksplan
Gunting untuk memotong eksplan
Pinset digunakan menanam eksplan
Laminar air flow untuk ruang penanaman eksplan
Botol kultur sebagai tempat eksplan
Rak kultur sebagai tempat botol kultur
Rancangan Percobaan
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL). Penambahan zat pengatur tumbuh jenis Sitokinin (BAP, Kinetin dan kombinasinya), diberikan pada masing-masing media MS terdiri atas 10 perlakuan dengan 10 ulangan, sehingga total kultur yang diamati adalah 10 x 10 = 100 satuan percobaan.
Keterangan mengenai faktor yang terlibat dalam rancangan adalah sebagai berikut:
A9 = MS + Kinetin 0.2 + BAP 1.5 A10 = MS + Kinetin 0.2 + BAP 2.0
Model umum rancangan acak lengkap adalah sebagai berikut :
Yij = µ + Ai + Eij
Keterangan : Yij = Hasil pengamatan terhadap percobaaan kultur jaringan Cendana pada perlakuan ke-i dan ulangan ke-j
µ = Nilai tengah umum Ai = Pengaruh perlakuan ke-i
Eij = Pengaruh acak perlakuan ke-i dan ulangan ke-j
E(ij)k = Pengaruh ulangan ke-k dalam perlakuan kombinasi perlakuan (ij)
Pengujian dengan Analisis Sidik Ragam (ANOVA) apabila : F hitung >, maka hipotesis diterima
F hitung <, maka hipotesis ditolak
Apabila hasil sidik ragam memberikan hasil berpengaruh nyata atau sangat nyata, maka selanjutnya dilakukan uji Duncan untuk mengetahui beda perlakuan. Data diolah menggunakan komputer dengan pogram SPSS 11.0.
Pelaksanaan Percobaan
Kegiatan sterilisasi
Kegiatan sterilisasi meliputi sterilisasi lingkungan kerja dan sterilisasi alat-alat serta media kultur. Lingkungan kerja dijaga agar tetap bersih dan steril yaitu dengan membatasi orang yang masuk dan membersihkan ruangan dengan zat desinfektan secara rutin. Blower dan lampu ultraviolet pada laminar air flow dinyalakan sebelum pemakaian dan permukaannya disemprot dengan alkohol 70% dibersihkan dengan menggunakan tisu.
Sterilisasi alat yang digunakan seperti botol, gelas piala, petridisk, pipet dan lain-lain dibungkus kertas kemudian disterilkan dengan menggunakan oven pada suhu 100 ºC dalam waktu sekitar 1 jam. Sedangkan peralatan tanam disterilkan dengan menggunakan alkohol 70% dan kemudian dibakar di atas api bunsen.
Pembuatan media
Tahap pertama dalam pelaksanaan kultur in vitro adalah persiapan media. Dalam media diberikan berbagai garam mineral, air, gula, asam amino, vitamin, zat pengatur tumbuh, dan agar sebagai pemadat media. Hal ini bermanfaat bagi pertumbuhan dan perkembangan eksplan. Adapun tahapan awal dalam pembuatan media MS padat sebanyak 1 liter adalah sebagai berikut :
• Menuangkan 500 ml aquadest dalam gelas piala 1000 ml.
• Tambahkan larutan stok, terdiri dari komposisi Larutan A sebanyak 20 ml/l, Larutan B sebanyak 20 ml/l, Larutan C sebanyak 5 ml/l, Larutan D sebanyak 5 ml/l, Larutan E sebanyak 5 ml/l, Larutan F sebanyak 5 ml/l, Vitamin sebanyak 5 ml/l dan Myoinositol sebanyak 10 ml/l, pembuatan larutan stok untuk media MS (Lampiran 11).
• Timbang dan dimasukkan 30 gram gula.
• Menambahkan zat pengatur tumbuh Sitokinin sesuai dengan kebutuhan (BAP, Kinetin atau kombinasi keduanya).
• Jadikan volume larutan mendekati 1000 ml, dengan batang magnetik di dalamnya kemudian ukur pH pada 5,6 – 6,8.
• Tambahkan pemadat yaitu agar-agar sebanyak 7 gram. Kemudian di panaskan hingga agar-agar larut dan mendidih sampai warna larutan bening.
• Tahapan terakhir adalah menuangkan larutan ke dalam botol kultur, kemudian disterilkan dengan Autoklaf.
Penanaman
Subkultur
Kegiatan perbanyakan pucuk Cendana dilakukan pada media MS selama 6 minggu, kemudian dilakukan subkultur kedua yaitu eksplan dipindahkan pada media baru (fresh media) dengan perlakuan sama, namun ditambahkan Glutamin sebanyak 100 mg/l.
Pengamatan
HASIL DAN PEMBAHASAN
Pengamatan Visual
Kontaminasi
Kegiatan pengamatan visual meliputi pengamatan secara keseluruhan kondisi umum eksplan yang ada, pengamatan dilakukan setiap hari. Berdasarkan hasil pengamatan, telah terjadi kontaminasi. Namun kontaminasi yang telah terjadi cukup rendah sekitar 17% (Gambar 2). Kontaminasi terdapat pada beberapa perlakuan diantaranya A1 (BAP 0 : Kinetin 0), A3 (BAP 1 : Kinetin 0), A5 (BAP 2 : Kinetin 0), A6 (BAP 0 : Kinetin 0.2), A7 (BAP 0.5 : Kinetin 0.2) dan A8 (BAP 1 : Kinetin 0.2).
Gambar 2 Kontaminasi pada botol kultur
Kontaminasi adalah gangguan yang sangat umum terjadi dalam kegiatan kultur jaringan. Munculnya gangguan ini bila dipahami merupakan hal yang wajar sebagai konsekwensi penggunaan media yang diperkaya (Santoso dan Nursandi, 2003). Lebih lanjut disebutkan bahwa fenomena kontaminasi, menunjukkan semakin diperkaya suatu media maka tingkat kontaminasinya juga semakin besar, demikian pula sebaliknya. Kontaminasi merupakan salah satu faktor yang dapat mempengaruhi dalam keberhasilan dalam kegiatan kultur jaringan.
digunakan kurang steril akibat pencucian yang kurang bersih, terbawa oleh sirkulasi udara dalam laminar air flow pada proses penanaman dan peralatan tanam yang digunakan pada saat kegiatan penanaman kurang steril serta penutupan botol yang kurang rapat.
Gejala Pencoklatan
Eksplan berupa pucuk yang digunakan menunjukan gejala pencoklatan terutama pada bagian yang dipotong (Gambar 3). Gejala pencoklatan ini diduga adanya senyawa fenolik yang dihasilkan dari pucuk Cendana yang tergolong tanaman berkayu. Wattimena (1992) menyatakan bahwa jika tanaman dilukai sering terjadi penimbunan senyawa-senyawa fenolik disekitar luka, seakan-akan menutup daerah luka tersebut.
Santoso dan Nursandi (2003) menyebutkan pencoklatan adalah suatu karakter yang munculnya warna coklat atau hitam yang sering membuat tidak terjadinya pertumbuhan dan perkembangan eksplan. Peristiwa pencoklatan sesungguhnya merupakan peristiwa alamiah biasa yang terjadi pada sistem biologi, suatu perubahan adaptif bagian tanaman akibat pengaruh fisik atau biokimia (memar, pengupasan, pemotongan, serangan penyakit atau kondisi lain yang tidak normal).
Gambar 3 Pencoklatan pada eksplan
Kalus
perlakuan, hanya terdapat pada beberapa eksplan pada perlakuan A9 (BAP 1.5 mg/l dan Kinetin 0.2 mg/l). Kondisi sedikit terbentuknya kalus dapat memperkecil kemungkinan terjadinya penyimpangan genetik.
Gambar 4 Pertumbuhan kalus
Pertumbuhan Vegetatif
Pertumbuhan vegetatif meliputi kegiatan pengambilan data berupa jumlah tunas, jumlah buku dan tinggi serta jumlah daun. Pada setiap perlakuan pengambilan data dan pengukuran setiap 1 minggu sekali selama 12 minggu.
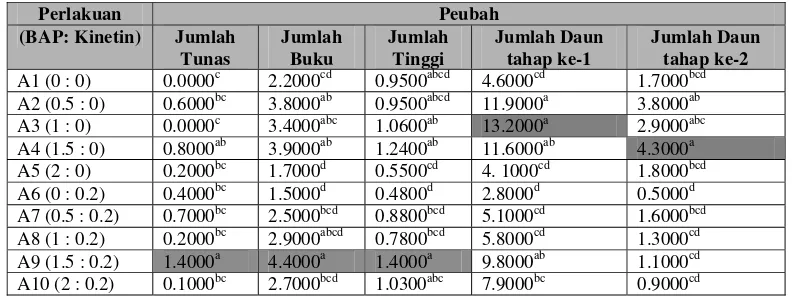
Data hasil analisa sidik ragam peubah yang diukur pada perbanyakan Cendana dengan pengaruh pemberian zat pengatur tumbuh Sitokinin yaitu BAP, Kinetin dan kombinasinya terhadap jumlah tunas, jumlah buku, tinggi dan jumlah daun (Tabel 1).
Tabel 1 Rekapitulasi analisa sidik ragam terhadap berbagai peubah pertambahan dalam perbanyakan Cendana pada 12 MST.
Perlakuan
Peubah Pertambahan
Jumlah Tunas
Jumlah
Buku Tinggi (cm)
Jumlah Daun tahap
ke-1
Jumlah Daun tahap
ke-2
BAP 0.000** 0.000** 0.002** 0.000** 0.073tn
Kinetin 0.086tn 0.515tn 0.771tn 0.000** 0.000**
BAP+Kinetin 0.551tn 0.125tn 0.029* 0.001** 0.510tn
Keterangan ** = berbeda sangat nyata pada selang kepercayaan 95%
* = berbeda nyata selang kepercayaan 95%
Analisa sidik ragam menunjukkan bahwa peubah jumlah tunas, jumlah buku, tinggi dan jumlah daun tahap ke-1 serta jumlah daun tahap ke-2 memberikan pengaruh berbeda sangat nyata, berbeda nyata dan tidak berbeda nyata pada selang kepercayaan 95%. Uji lanjut Duncan selanjutnya dilakukan untuk mendapatkan nilai beda nyata (Tabel 2).
Tabel 2 Rekapitulasi uji lanjut Duncan pengaruh pemberian ZPT Sitokinin (BAP, Kinetin dan kombinasinya) terhadap berbagai peubah pada 12 MST.
Perlakuan Peubah
(BAP: Kinetin) Jumlah Tunas
Keterangan : Nilai rata-rata yang diikuti huruf sama tidak berbeda nyata pada selang kepercayaan 95%.
Jumlah Tunas
Berdasarkan hasil analisis sidik ragam (Tabel 1), menunjukkan bahwa pemberian zat pengatur tumbuh Sitokinin yaitu BAP memberikan pengaruh berbeda sangat nyata, sedangkan Kinetin dan kombinasinya memberikan pengaruh tidak berbeda nyata terhadap jumlah tunas pada selang kepercayaan 95%.
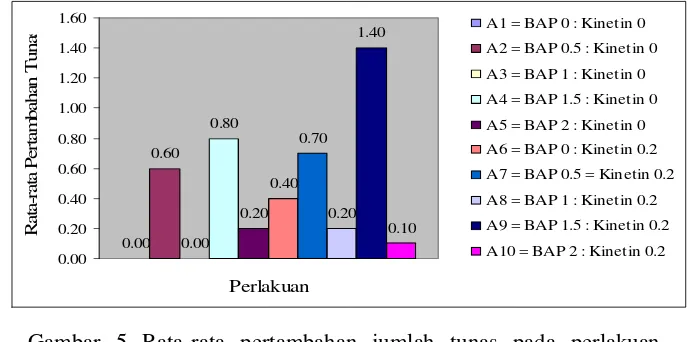
Gambar 5 Rata-rata pertambahan jumlah tunas pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya) pada 12 MST
Nilai rata-rata pertambahan jumlah tunas terbesar terdapat pada perlakuan A9 yaitu media MS dengan penambahan BAP1.5 mg/l dan Kinetin 0.2 mg/l dengan nilai sebesar 1.40, sedangkan nilai rata-rata terendah terdapat pada perlakuan A1 (BAP 0 mg/l : Kinetin 0 mg/l) dan A3 (BAP 1 mg/l : Kinetin 0 mg/l) dengan angka sebesar 0.00 (Gambar 5).
Perlakuan A9 yaitu Media MS dengan kombinasi BAP1.5 mg/l dan Kinetin 0.2 mg/l memberikan pengaruh nilai rata-rata jumlah tunas terbesar, kondisi tersebut diduga disebabkan konsentrasi zat pengatur tumbuh Sitokinin kombinasi yang telah ditambahkan tepat. Hal ini sesuai dengan teori yang menyebutkan bahwa peran zat pengatur tumbuh Sitokinin dalam kegiatan kultur jaringan dapat menstimulir terjadinya pembelahan sel, proliferasi kalus, pembentukan tunas, mendorong proliferasi meristem ujung, menghambat pembentukan akar, mendorong pembentukan klorofil pada kalus (Santoso dan Nursandi, 2003).
Perlakuan A1 (BAP 0 mg/l : Kinetin 0 mg/l) memberikan pengaruh nilai rata-rata jumlah tunas rendah, hal ini menunjukkan bahwa pembentukan tunas pada Cendana diduga pada perlakuan tersebut tidak memerlukan penambahan zat pengatur tumbuh Sitokinin yaitu BAP dan Kinetin.
Perlakuan A3 (BAP 1 mg/l : Kinetin 0 mg/l) memberi pengaruh nilai rata-rata jumlah tunas yang rendah pula, keadaan ini tidak sesuai dengan peran fisiologis Sitokinin mendorong pertunasan. Hal ini diduga pada perlakuan ini,
0
eksplan memberikan respon kurang aktif terhadap Sitokinin berupa BAP yang telah ditambahkan.
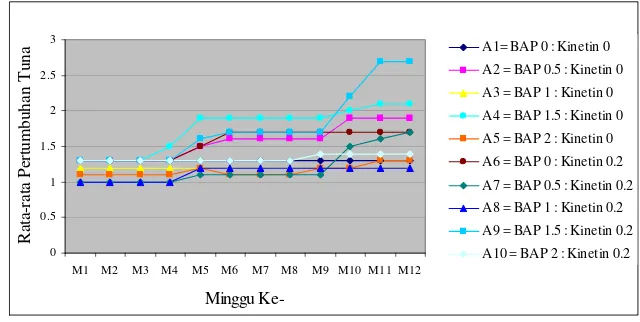
Pertumbuhan dari minggu pertama sampai minggu terakhir pengamatan yaitu 12 minggu setelah tanam (MST), pada semua perlakuan mengalami pertumbuhan jumlah tunas kecuali pada perlakuan A1 (BAP 0 mg/l : Kinetin 0 mg/l) dan A3 (BAP 1.5 mg/l : Kinetin 0 mg/l) mengalami pertumbuhan stagnan (Gambar 6). Secara keseluruhan pada semua perlakuan pertumbuhan tiap minggu sempat mengalami stagnan, pada 4 MST grafik menunjukkan kenaikan, kemudian stagnan lagi pada 5 MST sampai dengan 9 MST. Kondisi pertumbuhan stagnan tersebut diduga disebabkan adanya kejenuhan. Pertumbuhan mulai terlihat pada saat grafik mengalami kenaikan kembali pada 10 MST, kondisi seperti ini dimungkinkan akibat pengaruh kegiatan subkultur dengan penambahan Glutamin sebanyak 100 mg/l. Telah diketahui bahwa unsur N dipergunakan terutama untuk pertumbuhan vegetatif tanaman.
Gambar 6 Rata-rata pertumbuhan jumlah tunas pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya).
Jumlah Buku
Berdasarkan hasil analisis sidik ragam (Tabel 1), menunjukkan bahwa pemberian zat pengatur tumbuh Sitokinin BAP memberikan pengaruh berbeda sangat nyata, sedangkan Kinetin dan kombinasinya memberikan pengaruh tidak berbeda nyata pada selang kepercayaan 95% terhadap pertambahan jumlah buku.
Uji lanjut Duncan menunjukkan bahwa zat pengatur tumbuh Sitokinin pada perlakuan A9 (BAP1.5 mg/l : Kinetin 0.2 mg/l) memberikan pengaruh terbaik terhadap pertambahan jumlah buku, sedangkan perlakuan A6 (BAP 0 mg/l : Kinetin 0.2 mg/l) dan A5 (BAP 2 mg/l : Kinetin 0 mg/l) terlihat tidak memberikan pengaruh terhadap pertambahan jumlah buku. Hal ini dapat dilihat dari nilai rata-rata pertambahan jumlah buku terbesar terdapat pada perlakuan A9 (BAP 1.5 mg/l : Kinetin 0.2 mg/l) yaitu 4.40, sedangkan pada perlakuan A6 (BAP 0 mg/l : Kinetin 0.2 mg/l) memberikan pengaruh terhadap rata-rata pertambahan jumlah buku terendah sebesar 1.50.
Gambar 7 Rata-rata pertambahan jumlah buku pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya) pada 12 MST.
Perlakuan A9 yaitu Media MS dengan penambahan kombinasi BAP 1.5 mg/l dan Kinetin 0.2 mg/l memberikan pengaruh rata-rata jumlah buku terbesar, hal tersebut diduga ada hubungannya dengan kondisi tinggi dan jumlah daun yang dimiliki eksplan. Berdasarkan pertambahan jumlah daun, pada perlakuan A9 menunjukkan nilai pertambahan cukup besar pada peubah tersebut. Sehingga diduga berpengaruh pula terhadap pertambahan jumlah buku.
2.20
A6= BAP 0: Kinetin 0.2
A7 = BAP 0.5 : Kinetin 0.2
A8 = BAP 1 : Kinetin 0.2
A9 = BAP 1.5 : Kinetin 0.2
0 Perlakuan A6 (BAP 0 mg/l : Kinetin 0.2 mg/l) memberikan pengaruh rata-rata jumlah buku terendah, kondisi seperti ini diduga ada hubungannya dengan nilai rata-rata pertambahan jumlah daun pada perlakuan ini menunjukkan nilai yang rendah pula.
Grafik pertumbuhan jumlah buku (Gambar 8) dari minggu pertama sampai dengan minggu terakhir pengukuran dan pengamatan pada semua perlakuan menunjukkan adanya kenaikan dari 2 MST sampai dengan 6 MST, kemudian pada 6 MST sampai dengan 8 MST grafik terlihat stagnan. Namun kondisi ini berubah, pada 9 MST grafik terlihat mengalami kenaikan kembali walaupun sangat kecil. Hal ini terjadi diduga adanya penambahan N-organik yaitu Glutamin berpengaruh pula terhadap pertambahan jumlah buku.
Gambar 8 Rata-rata pertumbuhan jumlah buku pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya).
Tinggi
Tinggi tanaman merupakan indikator pertumbuhan yang paling mudah diukur. Tinggi tanaman sebagai indikator pertumbuhan dapat dianjurkan pada tanaman berbatang tunggal dengan percabangan lateral yang terbatas dengan kondisi intensitas cahaya yang optimal (Lakitan, 1996).
kombinasinya memberikan pengaruh berbeda nyata terhadap tinggi eksplan pada selang kepercayaan 95%.
Uji lanjut Duncan menunjukkan pada perlakuan A6 (BAP 0 mg/l : Kinetin 0.2 mg/l) tidak memberikan pengaruh terhadap pertambahan tinggi, sedangkan perlakuan A9 (BAP1.5 mg/l : Kinetin 0.2 mg/l) memberikan pengaruh terbaik terhadap pertambahan tinggi Cendana. Dapat dilihat nilai rata-rata pertambahan tinggi terbesar terdapat pada perlakuan A9 yaitu media MS dengan penambahan kombinasi BAP 1.5 mg/l : Kinetin 0.2 mg/l menunjukkan angka pertambahan tinggi sebesar 1.40 cm, sedangkan nilai rata-rata pertambahan tinggi terendah terdapat pada perlakuan A6 dengan pemberian Kinetin 0.2 mg/l menunjukkan angka pertambahan 0.48 cm.
Gambar 9 Rata-rata pertambahan tinggi pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya) pada 12 MST.
Nilai terbesar untuk peubah pertambahan tinggi terdapat pada perlakuan A9 yaitu kombinasi BAP1.5 mg/l dan Kinetin 0.2 mg/l (Gambar 9). Kondisi seperti ini diduga merupakan pengaruh dari nilai rata-rata pertambahan jumlah buku yang sangat tinggi pada perlakuan ini. Salisbury and Ross (1995) menyebutkan bahwa pertumbuhan normal batang dan akar diduga membutuhkan Sitokinin, namun Sitokinin endogen jarang ditemukan sebagai faktor pembatas pertumbuhan. Akibatnya pemberian Sitokinin eksogen tidak berhasil meningkatkan pertumbuhan organ tersebut. Kesimpulan umum tidak berlaku karena baru diujikan pada beberapa spesies saja (hanya tumbuhan dikotil).
0
Perlakuan A6 (BAP 0 mg/l : Kinetin 0.2 mg/l) memberikan pengaruh rata-rata pertambahan tinggi dengan nilai terendah. Keadaan seperti ini didukung pula dengan nilai rata-rata pertambahan jumlah buku yang menunjukkan nilai rendah juga, data dapat dilihat pada histogram rata-rata pertambahan jumlah buku (Gambar 7).
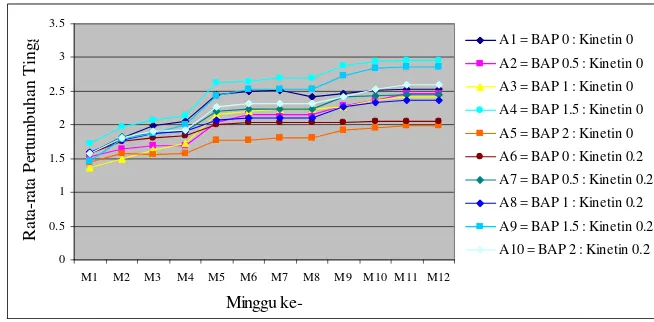
Rata-rata pertumbuhan tinggi pada semua perlakuan terus mengalami kenaikan setiap minggunya sampai dengan akhir pengamatan. Namun pada perlakuan A6 (BAP 0 mg/l : Kinetin 0.2 mg/l) pertumbuhannya terlihat sangat lambat (Gambar 10). Keadaan ini sesuai dengan teori yang menyatakan bahwa penambahan Sitokinin eksogen tidak berhasil meningkatkan organ tersebut, diduga eksplan pada perlakuan A6 tidak memberikan respon terhadap penambahan zat pengatur tumbuh Kinetin dengan konsentrasi 0.2 mg/l dan membutuhkan penambahan BAP yang aktifitasnya lebih kuat .
Gambar 10 Rata-rata pertumbuhan tinggi pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya).
Jumlah Daun
Jumlah dan ukuran daun dipengaruhi oleh genotipe dan lingkungan. Posisi daun pada tanaman (jumlah plastokron), yang terutama dikendalikan oleh genotipe, juga mempunyai pengaruh nyata terhadap laju pertumbuhan daun, dimensi akhir (Gardner, Pearce, Mitchell, 1991).
tanaman mempunyai pola pertumbuhan determinate sedangkan organ-organ yang lain bersifat in-determinate. Pola pertumbuhan determinate dicirikan oleh pertumbuhan organ tersebut sampai mencapai ukuran maksimal, kemudian pertumbuhan terhenti, organ menjadi tua (senescence) dan akhirnya rontok. Organ tanaman yang mempunyai pola pertumbuhan determinate salah satunya adalah daun (Lakitan, 1996).
Luruhnya daun dari batang atau proses absisi didahului oleh perubahan struktur dan susunan kimia pada daerah di sekitar pangkal petiola. Tempat ini disebut daerah absisi. Pada dikotil berkayu di daerah absisi terdapat dua lapisan yang berbeda yaitu lapisan pemisah dan lapisan pelindung (Tjondronegoro Natasaputra, Kusumaningrat, Gunawan, Djaelani, Suwanto, 1989). Lapisan pemisah menyebabkan pemisahan dan lapisan pelindung yang melindungi permukaan yang terdedah dari kekeringan dan serangan parasit (Hidayat, 1995).
Tjitrosomo (1984) menyebutkan bahwa gugurnya daun adalah sifat tumbuhan berkayu. Jatuhnya daun dipercepat oleh faktor-faktor lingkungan, seperti mengerutnya petiol pada hari terang dan panas, pukulan air hujan pada daun, atau pembentukan kristal es pada lapisan. Sebelum daun gugur atau segera setelah itu, suatu lapisan pelindung dari gabus terbentuk tepat dibawah lapisan pemisah dan melindungi jaringan batang yang terbuka.
Gambar 11 Kerontokan daun
Kerontokan daun terjadi mulai pada 3 MST pada beberapa perlakuan. Sampai dengan 6 MST kerontokan masih tetap terjadi dan menunjukkan angka persentase sebesar 15.61 % (Gambar 11), persentase kerontokan pada setiap perlakuan dapat dilihat pada Tabel 3. Kondisi seperti ini dimungkinkan karena di
dalam media terjadi kekurangan unsur hara Nitrogen (N) dan perubahan pH serta terjadi akumulasi zat pengatur tumbuh lainnya yaitu Asam Abisat (ABA) yang terdapat pada eksplan Cendana.
Unsur hara yang paling berpengaruh terhadap pertumbuhan dan perkembangan daun adalah Nitrogen. Konsentrasi Nitrogen tinggi umumnya menghasilkan daun yang besar (Lakitan, 1996). Gardner et al (1991) menyebutkan bahwa mineral yang lain rupanya kurang berpengaruh jika di bandingkan dengan Nitrogen terhadap pertumbuhan dan penuaan daun.
Sel-sel tanaman yang ditumbuhkan secara in-vitro mempunyai toleransi pH yang relatif sempit dengan titik optimum 5.0 dan 6.0, bila pertumbuhan dimulai pH lingkungan kultur umumnya akan bergeser naik apabila nutrien habis dipakai (Wetherell, 1982).
Baberapa pakar meyakini bahwa ABA berperan penting dalam menyebabkan penguguran daun, bunga atau buah. Jenis lain juga diduga berperan dalam proses perontokan organ–organ tanaman tersebut adalah etilen (Lakitan, 1996). Salisbury and Ross (1995) menyebutkan bahwa ABA berperan tidak langsung dengan menyebabkan penuaan pada sel prematur pada sel organ yang akan gugur, dan itu yang mendorong naiknya produksi etilen.
Tabel 3 Rekapitulasi rata-rata persentase kerontokan daun
Perlakuan % kerontokan daun
Tahap ke-1 Tahap ke-2
A1 (BAP 0 : kinetin 0) 37.28 0
A2 (BAP 0.5 : kinetin 0) 10.52 13.10
A3 (BAP 1 : kinetin 0) 6.83 7.18
A4 (BAP 1.5 : kinetin 0) 9.29 11.78
A5 (BAP 2 : kinetin 0) 27.76 4.67
A6 (BAP 0 : kinetin 0.2) 10.59 1.67
A7 (BAP 0.5 : kinetin 0.2) 12.14 4.61
A8 (BAP 1 : kinetin 0.2) 11.40 14.38
A9 (BAP 1.5 : kinetin 0.2) 19.01 6.22
A10 (BAP 2 : kinetin 0.2) 11.26 3.42
Rata-rata 15.61 6.70
pemberian konsentasi BAP dan Kinetin yang terdapat dalam media cukup efektif. Sedangkan pada perlakuan A2 (BAP 0.5 : kinetin 0), A3 (BAP 1 : kinetin 0), A4 (BAP 1.5 : kinetin 0) dan A8 (BAP 1 : kinetin 0.2) memgalami kenaikan. Kondisi ini diduga adanya konsentrasi BAP kecil serta tidak terdapatnya Kinetin dalam perlakuan tersebut Khusus untuk perlakuan A8 walaupun terdapat Kinetin 0.2 dan konsentrasi BAP cukup tinggi sebesar 1 mg/l, akan tetapi tetap saja persentase kerontokan mengalami kenaikan. Hal ini diduga eksplan telah mengalami kejenuhan. Namun secara keseluruhan nilai rata-rata persentase kerontokan mengalami penurunan hingga mencapai angka 6.70%.
Melihat kondisi kerontokan yang terjadi, maka segera dilakukan tindakan subkultur, yaitu dengan dilakukan penambahan Glutamin sebanyak 100 mg/l pada media. Penambahan ini dimaksudkan agar dapat mengurangi tingkat kerontokan yang terjadi, penambahan Glutamin dilakukan pada 7 MST. Khusus untuk parameter jumlah daun dilakukan pengukuran dan pengamatan selama 12 minggu, namun data dipisah menjadi dua tahap yaitu jumlah daun tahap ke-1 pengukuran dimulai dari 1 MST sampai 6 MST dan jumlah daun tahap ke-2 dimulai dari 7 MST sampai dengan 12 MST.
Jumlah Daun tahap ke-1. Berdasarkan hasil analisis sidik ragam yang tersaji pada Tabel 1, menunjukkan bahwa pemberian zat pengaruh tumbuh BAP, Kinetin dan kombinasinya memberikan pengaruh berbeda sangat nyata pada tingkat kepercayaan 95% terhadap pertambahan jumlah daun tahap ke-1 yaitu pada pengukuran dan pengamatan selama 6 minggu pertama.
Gambar 12 Rata-rata pertambahan jumlah daun tahap ke-1 pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya) pada 12 MST.
Rata-rata pertambahan jumlah daun terbesar terdapat pada perlakuan A3 yaitu Media MS dengan penambahan BAP 1 mg/l dengan angka pertambahan sebesar 13.20 helai, sedangkan nilai rata-rata terendah terdapat pada perlakuan A6 (BAP 0 mg/l : Kinetin 0.2 mg/l) dengan angka sebesar 2.80 helai (Gambar 12).
Perlakuan A3 yaitu media MS dengan penambahan BAP 1 mg/l memberikan pengaruh terhadap rata-rata jumlah daun terbesar, hal ini diduga pada pemberian Sitokinin yaitu BAP pada tingkat konsentrasi tersebut cukup efektif. Lakitan (1996) menyatakan bahwa Sitokinin meningkatkan sitokinesis dan pembesaran sel, tetapi pengaruhnya lebih nyata pada pembesaran sel. Pertumbuhan yang dipacu oleh Sitokinin mencakup pembesaran sel yang lebih cepat dan pembentukan sel-sel yang lebih besar. Lebih lanjut (Salisbury and Ross, 1995) menyebutkan bahwa efek rangsangan terhadap perluasan daun tumbuhan dikotil terjadi setelah pemberian Sitokinin berulang-ulang. Sitokinin eksogen memacu pembesaran sel pada daun muda, kotiledon, koleoptil gandum dan hipokotil semangka.
Perlakuan A6 (BAP 0 mg/l : Kinetin 0.2 mg/l) memberikan pengaruh rata-rata pertambahan jumlah daun terendah, karena pada perlakuan tersebut pertambahan daun sedikit, sedangkan tingkat kerontokan pada perlakuan ini tinggi sebesar 10.59 %. Hal ini diduga pula terdapat kandungan zat pengatur tumbuh ABA dan etilen yang berperan dalam proses pengguguran. Wattimena (1992) menyebutkan penelitian-penelitian terakhir menunjukkan bahwa ABA
0
berinteraksi dengan zat pengatur tumbuh lainnya, biasanya sebagai inhibitor (penghambat).
Pertumbuhan jumlah daun tahap ke-1 pengamatan, yaitu pada 1 MST sampai dengan minggu 6 MST mengalami peningkatan pada sebagian besar perlakun (Gambar 13). Terlihat pada grafik bahwa kenaikkan paling signifikan terjadi pada 4 MST, namun kondisi ini terlihat berbeda pada perlakuan A5 (BAP 2 mg/l : Kinetin 0 mg/l) dan A6 (BAP 0 mg/l : Kinetin 0.2 mg/l) menunjukkan penurunan. Kondisi ini terjadi akibat adanya rata-rata pertambahan jumlah daun yang rendah, sedangkan kerontokan daun pada kedua perlakuan ini cukup tinggi yaitu dengan presentase sebesar 27.76 % dan 10.59 %, sehingga berpengaruh pada jumlah daun menjadi berkurang.
Gambar 13 Rata-rata pertumbuhan jumlah daun tahap ke-1 pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya).
Jumlah Daun tahap ke-2. Pengukuran dan pengamatan jumlah daun pada tahap ke-2 setelah dilakukan kegiatan subkultur, yaitu dengan penambahan sebanyak 100 mg/l Glutamin pada media MS. Persentase rata-rata kerontokan daun yang terjadi mengalami penurunan hingga menunjukkan angka sebesar 6.70%. Kondisi ini diduga pemberian Glutamin berpengaruh dan mendapat respon dari eksplan pada semua perlakuan.
kepercayaan 95% terhadap pertambahan jumlah daun pada tahap ke-2 pengamatan.
Gambar 14 Rata-rata pertambahan jumlah daun tahap ke-2 pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinsinya) pada 12 MST.
Rata-rata pertambahan jumlah daun terbesar terdapat pada perlakuan A4 yaitu media MS dengan penambahan BAP 1.5 mg/l dengan nilai sebesar 4.30 helai, sedangkan pertambahan jumlah daun terendah terdapat pada perlakuan A6 (BAP 0 mg/l : Kinetin 0.2 mg/l) dengan nilai 0.50 helai (Gambar 14).
Gambar 15 Rata-rata pertumbuhan jumlah daun tahap ke-2 pada perlakuan pemberian zat pengatur tumbuh Sitokinin (BAP, Kinetin dan kombinasinya).
KESIMPULAN DAN SARAN
Kesimpulan
1. Rata-rata pertambahan jumlah tunas, jumlah buku dan tinggi eksplan Cendana yang terbaik terdapat pada perlakuan A9 dengan pemberian ZPT kombinasi yaitu BAP 1.5 mg/l dan Kinetin 0.2 mg/l.
2. Rata-rata pertambahan jumlah daun tahap ke-1 nilai tertinggi terdapat pada perlakuan A3 dengan pemberian BAP konsentrasi 1 mg/l, sedangkan pertambahan jumlah daun tahap ke-2 nilai tertinggi terdapat pada ZPT BAP konsentrasi 1.5 mg/l yaitu perlakuan A4.
3. Penambahan Glutamin 100 mg/l pada media dengan penambahan BAP dan Kinetin berhasil mengurangi kerontokan daun.
Saran
1. Mengadakan penelitian lebih lanjut untuk konsentrasi BAP dan Kinetin yang optimal dalam multiplikasi Cendana yaitu dengan penggunaan selang konsentrasi yang lebih sempit lagi, dengan skala 0.1 mg/l guna mendapatkan informasi yang lebih akurat.
DAFTAR PUSTAKA
Badan Penelitian dan Pengembangan Kehutanan. 1992. Perkembangan Penelitian dan Pengembangan di Nusa Tenggara. Balai Penelitian Kehutanan. Kupang.
Bagia, N., Harijono dan I. M. Parsa. 2005. Alat Pemotong Serpihan Limbah Kayu Cendana. Universitas Nusa Cendana/Sari Wangi. Kupang. http://www.dikti.org/p3m/vucer9/04042s.html. Di akses tanggal 13 Januari 2005.
Dwidjoseputro, D. 1980. Pengantar Fisiologi Tumbuhan. PT Gramedia Indonesia Jakarta.
Gardner, F. P., R. B. Pearce and R. L. Mitchell. 1991. Fisiologi Tanaman Budidaya. Terjemahan. Herawati Susilo. Penerbit universitas Indonesia. Jakarta.
Gunawan, L. W. 1995. Teknik Kultur In vitro dalam Hortikultura. Penerbit Penebar Swadaya. Jakarta.
Hamzah, Z. 1976. Sifat Silvika dan Silvikultur Cendana (Santalum album Linn.) di Pulau Timor. Laporan No. 277. Penerbit Lembaga Penelitian Hutan. Bogor.
Hermawan, R. 1993. Pedoman Teknis Budidaya Kayu Cendana (Santalum album Linn.). Jurusan Konservasi Sumberdaya Hutan. Fakultas Kehutanan. Institut Pertanian Bogor. Bogor.
Hidayat, E. B. 1995. Anatomi Tumbuhan Berbiji. Penerbit ITB. Bandung.
http://www.alor-island.com/indonesia/komoditi/kehutanan/cendanagaharu.htm. Di akses tanggal 13 Januari 2005.
http://www2.bonet.co.id/dephut/dagang1f.gif. Di akses tanggal 13 Januari 2005. http://iptek.apjii.or.id/artikel/ttg_tanaman_obat/depkes/buku4/4-082.pdf. Di akses
tanggal 13 Januari 2005.
http://www.redlist.org/search/details.php?species=31852. Di akses pada tanggal 12 Augutus 2005.
Kompas. 2001. Kayu Cendana secara Ekonomis Telah Punah. Kupang. Sabtu 10 Februari 2001. http://www.kompas.com/kompas-cetak/0102/10/iptek/ kayu10.htm. Di akses tanggal 13 Januari 2005.
Lakitan, B. 1996. Fisiologi Perumbuhan dan Perkembangan Tanaman. PT Raja Grafindo Persada Jakarta.
Rahayu, S., A. H. Wawo, M. V. Noordwijk, K. Hairiah. 2002. Cendana ; Deregulasi dan Strategi Pengembangannya. Word Agroforestry Center Craff. Bogor.
Salisbury, F. B and C. W. Ross. 1995. Fisiologi Tumbuhan ; Perkembangan Tumbuhan dan Fisiologi Lingkungan. Jilid Tiga. Edisi keempat. Terjemahan R Lukman dan Sumaryono. ITB. Bandung
Santoso, U dan F. Nursandi. 2003. Kultur Jaringan Tanaman. Penerbit Universitas Muhammadiyah Malang. Malang
Sinaga, M. dan Buharman. 1996. Teknologi Budidaya Cendana (Santalum Album Linn) Dan Kajian Kelembagaannya. Sylva Tropika No. 04, Oktober 1996. http://www2.bonet.co.id/dephut/st1096.htm - 16k. Di akses tanggal 13 Januari 2005.
Tjitrosoepomo, G. 1985. Morfologi Tumbuhan. Fakultas Biologi. Universitas Gadjah Mada. Gajah Mada University Press. Yogyakarta
Tjitrosomo, S.S. 1984. Botani Umum 2. Penerbit Angkasa. Bandung.
Tjondronegoro, P. D., M . Natasaputra, T. Kusumaningrat, A. W. Gunawan, M. Djaelani, A. Suwanto. 1989. Botani Umum III. Departemen Pendidikan dan Kebudayaan Direktorat Jendral Pendidikan Antar Universitas Ilmu Hayat IPB. Bogor.
Wattimena, G. A. 1992. Zat Pengatur Tumbuh Tanaman. Pusat antar Universitas Institut Pertanian Bogor. Bogor.
Wattimena, G. A., L. W. Gunawan, N. A. Mattjik, E. Syamsudin, N. M. A. Wiendi, A. Ernawati. 1992. Bioteknologi Tanaman. Laboratorium Kultur Jaringan Tanaman. Departemen Pendidikan dan Kebudayaan, Direktorat Jendral Pendidikan Tinggi, Pusat antar Universitas Bioteknologi. Institut Pertanian Bogor. Bogor.
Wetherell, D.F. 1982. Pengantar Propagasi Tanaman secara In vitro. Terjemahan Koensoemardiyah (ed.). Fivery Publishing Group Inc. Wayne, New Jersey.
Lampiran 1 Daftar sidik ragam pengaruh zat pengatur tumbuh BAP, Kinetin dan kombinasinya terhadap pertambahan jumlah tunas Cendana
Sumber Keragaman DB JK KT F hitung F 0,05 F 0,01
Keterangan :** = sangat nyata pada selang kepercayaan 95%
Lampiran 2 Daftar sidik ragam pengaruh zat pengatur tumbuh BAP, Kinetin dan kombinasinya terhadap pertambahan jumlah buku Cendana
Sumber Keragaman DB JK KT F hitung F 0,05 F 0,01
Keterangan :** = sangat nyata pada selang kepercayaan 95%
Lampiran 3 Daftar sidik ragam pengaruh zat pengatur tumbuh BAP, Kinetin dan kombinasinya terhadap pertambahan tinggi Cendana
Sumber Keragaman DB JK KT F hitung F 0,05 F 0,01
Keterangan : ** = sangat nyata pada selang kepercayaan 95% * = nyata pada selang kepercayaan 95%
Lampiran 4 Daftar sidik ragam pengaruh zat pengatur tumbuh BAP, Kinetin dan kombinasinya terhadap pertambahan jumlah daun Cendana tahap ke-1
Sumber Keragaman DB JK KT F hitung F 0,05 F 0,01
BAP 4 635.360 158.840 9.922** 2.48 3.54
Kinetin 1 196.000 196.000 12.243** 3.95 6.93
BAP+Kinetin 4 413.600 103.400 6.459** 2.48 3.54
Galat 90 1440.800 16.009
Total 100 8584.000
Keterangan : ** = sangat nyata pada selang kepercayaan 95%
Lampiran 5 Daftar sidik ragam pengaruh zat pengatur tumbuh BAP, Kinetin dan kombinasinya terhadap pertambahan jumlah daun Cendana tahap ke-2
Sumber Keragaman DB JK KT F hitung F 0,05 F 0,01
BAP 4 44.440 11.110 2.217 2.48 3.54
Kinetin 1 82.810 82.810 16.522** 3.95 6.93
BAP+Kinetin 4 16.640 4.160 0.830 2.48 3.54
Galat 90 451.100 5.012
Total 100 991.000
87 Lampiran 6 Rata-rata pertumbuhan jumlah tunas
Perlakuan Minggu ke-
1 2 3 4 5 6 7 8 9 10 11 12
A1 1.3 1.3 1.3 1.3 1.3 1.3 1.3 1.3 1.3 1.3 1.3 1.3
A2 1.3 1.3 1.3 1.3 1.5 1.6 1.6 1.6 1.6 1.9 1.9 1.9
A3 1.2 1.2 1.2 1.2 1.2 1.2 1.2 1.2 1.2 1.2 1.2 1.2
A4 1.3 1.3 1.3 1.5 1.9 1.9 1.9 1.9 1.9 2.0 2.1 2.1
A5 1.1 1.1 1.1 1.1 1.2 1.1 1.1 1.1 1.2 1.2 1.3 1.3
A6 1.3 1.3 1.3 1.3 1.5 1.7 1.7 1.7 1.7 1.7 1.7 1.7
A7 1.0 1.0 1.0 1.0 1.1 1.1 1.1 1.1 1.1 1.5 1.6 1.7
A8 1.0 1.0 1.0 1.0 1.2 1.2 1.2 1.2 1.2 1.2 1.2 1.2
A9 1.3 1.3 1.3 1.3 1.6 1.7 1.7 1.7 1.7 2.2 2.7 2.7
A10 1.3 1.3 1.3 1.3 1.3 1.3 1.3 1.3 1.4 1.4 1.4 1.4
Lampiran 7 Rata-rata pertumbuhan jumlah buku
Perlakuan Minggu ke-
1 2 3 4 5 6 7 8 9 10 11 12
A1 2.9 2.9 3.2 3.5 3.5 5.0 5.1 5.1 5.3 5.3 5.3 5.3
A2 3.7 3.7 4.0 4.4 4.4 7.0 7.5 7.5 7.5 7.5 7.5 7.5
A3 3.6 3.4 4.6 5.0 5.0 6.6 7.0 7.0 7.3 7.3 7.3 7.3
A4 3.7 3.7 4.5 5.1 5.1 7.0 7.6 7.6 7.9 7.9 7.9 7.9
A5 3.3 3.3 3.6 3.9 3.9 5.0 5.0 5.0 5.0 5.0 5.0 5.0
A6 3.3 3.3 3.8 4.1 4.3 4.8 4.8 4.8 5.2 5.2 5.2 5.2
A7 3.9 3.9 4.5 4.7 4.9 6.4 6.4 6.4 6.9 6.9 6.9 6.9
A8 3.5 3.5 4.5 5.0 5.4 6.4 6.4 6.4 6.4 6.4 6.4 6.4
A9 3.4 3.4 3.9 4.7 5.1 7.8 7.8 7.8 7.8 7.8 7.8 7.8
88 Lampiran 8 Rata-rata pertumbuhan Tinggi
Perlakuan Minggu ke-
1 2 3 4 5 6 7 8 9 10 11 12
A1 1.58 1.81 1.99 2.05 2.45 2.49 2.51 2.41 2.46 2.51 2.53 2.53
A2 1.52 1.65 1.70 1.70 2.04 2.16 2.16 2.16 2.29 2.37 2.47 2.47
A3 1.36 1.5 1.62 1.73 2.16 2.20 2.23 2.23 2.26 2.36 2.42 2.42
A4 1.72 1.97 2.07 2.14 2.63 2.64 2.69 2.69 2.87 2.94 2.96 2.96
A5 1.44 1.58 1.56 1.57 1.77 1.77 1.80 1.80 1.93 1.96 1.99 1.99
A6 1.57 1.76 1.80 1.84 2.01 2.03 2.03 2.03 2.04 2.05 2.05 2.05
A7 1.57 1.83 1.87 1.9 2.20 2.23 2.23 2.23 2.41 2.43 2.45 2.45
A8 1.59 1.77 1.87 1.91 2.07 2.1 2.10 2.10 2.27 2.33 2.37 2.37
A9 1.46 1.79 1.87 2.00 2.44 2.53 2.53 2.53 2.72 2.84 2.86 2.86
A10 1.57 1.8 1.91 1.93 2.26 2.32 2.32 2.32 2.42 2.53 2.60 2.60
Lampiran 9 Rata-rata pertumbuhan jumlah daun tahap ke-1
Perlakuan Minggu ke-
0 1 2 3 4 5 6
A1 7.5 6.9 6.7 7.0 7.4 7.4 7.5
A2 7.0 8.7 9.7 9.6 14.7 17.0 17.0
A3 3.9 7.5 9.1 9.0 15.1 15.5 15.9
A4 7.6 10.1 11.7 12.1 17.1 17.2 17.5
A5 7.4 8.1 8.0 8.1 8.8 8.9 8.5
A6 5.9 6.8 7.1 7.1 7.8 7.6 7.6
A7 8.5 8.9 9.5 10 11.2 12.0 12.0
A8 7.4 9.9 10.8 11.1 11.2 11.6 11.6
A9 5.3 7.0 8.6 8.4 10.9 12.2 12.2
Lampiran 10 Rata-rata pertumbuhan jumlah daun tahap ke-2
Perlakuan Minggu ke-
6 7 8 9 10 11 12
Lampiran 11 Pembuatan larutan stok untuk media Murashige & Skoog (MS)
Nama Stok Komposisi Jumlah Stok
(g/l)
Asam nikotinat 0.1
Piridoksin HCL 0.1
Lampiran 12. Komposisisi garam makro, mikro, vitamin dan komponen lainnya dalam media Murashige & Skoog (MS)
Nama Komposisi Jumlah
(mg/l)
Garam makro
NH4NO3 1650.0
KNO3 1900.0
CaCl2. H2O 440.0
MgSO4.7H2O 370.0
KH2PO4 170.0
Garam mikro
H3BO3 6.2
Na2MoO4. 2H2O 0.25
CoCl2. 2H2O 0.025
Kl 0.83
MnSO4. 4H2O 22.3
ZnSO4. 4H2O 8.6
CuSO4. 5H2O 0.025
Na2EDTA 37.3
FeSO4.7H2O 27.8
Vitamin + Komponen lain
Tiamin HCL 0.1
Asam nikotinat 0.5
Piridoksin HCL 0.5