ORGANOGENESIS TANAMAN JAGUNG(
Zea mays
L.)
TERHADAP BERBAGAI KONSENTRASI NAA KINETIN
DAN CASEIN HIDROLISA SECARA
IN
-
VITRO
Rahman Hairuddin1), Suarti2)1)
Dosen Program Studi Agroteknologi Fakultas Pertanian Universitas Cokroaminoto Palopo
2)
Mahasiswa Program Studi Agroteknologi Fakultas Pertanian Universitas Cokroaminoto Palopo
Abstrak
Penelitian ini bertujuan untuk mengetahui pengaruh organogenesis tanaman jagung (Zea mays L.) pada berbagai konsentrasi NAA, Kinetin, Casein Hidrolisa Secara In-Vitro. Dilaksanakan diLaboratorium Kultur Jaringan Fakultas Pertanian Universitas Cokroaminoto Palopo, dimulai Pada Bulan Mei sampai September 2015. Percobaan ini disusun berdasarkan Rancangan Acak Lengkap (RAL) yang terdiri dari 4 perlakuan masing-masing P0 (Kontrol) P1 (1ppm NAA, 1ppm Kinetin, 1ppm Casein hidrolisa) P2 (2ppm NAA, 2ppm Kinetin, 2ppm Casein hidrolisa) P3 (3ppm NAA, 3ppm Kinetin, 3ppm Casein hidrolisa) masing-masing perlakuan diulang sebanyak 3 ulangan. Data dianalisis secara statistika dengan uji F pada taraf nyata 5% dan 1 % dan apabila F hitung perlakuannya lebih besar dari F tabel 5% dan 1% maka dilanjutkan dengan uji beda nyata jujur (BNJ) pada taraf 5%. Hasil ;penelitian menunjukkan bahwa zat pengatur tumbuh NAA, Kinetin, Casein Hidrolisa memberikan pengaruh yang tidak nyata terhadap umur berkecambah, hari muncul akar, tinggi tanaman, lebar daun, panjang daun, jumlah akar, panjang akar, jumlah daun, bobot planlet pada pertumbuhan tanaman jangung dan yang terbaik pertumbuhannya yaitu P3 media MS + biji jagung + 3ml NAA, Kinetin, Casein hidrolisa
Kata kunci: eksplan biji jagung, zat pengatur tumbuh PENDAHULUAN
Latar Belakang
Di Indonesia Jagung merupakan salah satu komoditi strategis dan bernilai ekonomissertamempunyai peluang untuk dikembangkan karenakedudukannya sebagai sumber utama karbohidratdan protein yang mensubstitusi beras. Nilai kalori jagung hampir sama dengan beras bahkanjagung mempunyai keunggulan bila dibandingkan dengan beras disebabkan jagung mengandungasam lemak esensil yang sangat bermanfaat bagipencegahan penyakit arteriosclerosis, yaknisemacam penyempitan pembuluh darah. Selainitu kandungan minyak jagung yang non kolesterol ini juga dapat mencegah penyakit Pellegra (penyakit kulit kasar) (Warisno,1998).
Sumber karbohidrat kedua setelah beras, jagung memegang peranan penting sebagai bahan pangan di Indonesia. Selain sebagai bahan pangan, jagungpun dimanfaatkan sebagai bahan makanan ternak dan bahan baku industri dengantingkat kebutuhan yang besar. Bahkan penggunaan jagung sebagai pakan ternak menunjukan tendensi semakin meningkat pada setiap tahun dan sebaliknya
penggunaan sebagai bahan pangan mengalami penurunan (Adisarwanto dan Widyastuti, 2009).
Upaya peningkatan produktivitas usaha tani jagung sangat bergantung pada kemampuan penyediaan dan penerapan teknologi sistim budidaya yang benar-benar sesuai anjuran diantaranya, penggunaan benih bermutu, pengaturan jarak tanam, pengairan, pembrantasan hama dan penyakit, serta penggunaan pupuk (Sudadi dan Widada, 2001). Hal ini mutlak dilakukan untuk memenuhi kebutuhan hara, demi menopang pertumbuhan dan produksi tanaman jagung.
Salah satu jenis jagung yang masih banyak dikembangkan dibeberapa daerah di Sulawesi Selatan adalah jenis jagung pulut atau waxy corn. jagung pulut digunakan sebagai jagung rebus dan jagung bakar karena rasanya enak dan pulen. Jagung pulut juga digunakan untuk pembuatan kue, jagung marning dan bubur jagung (bassang). Peningkatan potensi hasil jagung pulut belum mendapat perhatian yang serius yang ada ditingkat petani dan di pasaran sekarang ini merupakan jagung pulut lokal jenis bersari bebas, ukuran tongkol kecil, agak panjang dengan diameter 10-12 cm (Iriany dkk, 2003). Oleh karena itu permintaan jagung pulut terutama untuk industri jagung marning tidak dapat dipenuhi. Salah satu cara untuk meningkatkan produksi jagung ini yaitu dengan menciptakan varietas jagung pulut yang unggul melalui kegiatan pemuliaan (Sudadi dan Widada, 2001).
Kinetin merupakan turunan dari hormon sitokinin. Adapun fungsi utama sitokinin adalah merangsang pembelahan sel. Beberapa dari protein dapat berupa enzim yang diperlukan dalam mitosis. Proses penuaan kondisi yang menyertai pertambahan umum, yang mengarah kematian organ atau organisme tersebut mengalami penuaan (senescence) (Salisbury, 1995).
Hormon kinetin termasuk turunan dari hormon sitokinin yang berfungsi untuk memacu pembelahan sel. Terdapat bukti utama yang menyatakan keterlibatan sitokinin yaitu banyak jenis sitokinin yang mampu menggantikan sebagian faktor yang dibutuhkan akar untuk menunda penuaan dan kandungan sitokinin helai daun meningkat berlipat ganda ketika akar liar terbentuk pada tanaman bunga matahari kandungan sitokinin pada cairan xilem meningkat selama masa pertumbuhan cepat, kemudian sangat menurun saat pertumbuhan berhenti dan tanaman mulai berbunga, hal tersebut menunjukkan bahwa berkurangnya pengangkutan sitokinin dari akar ketajuk mengakibatkan penuaan lebih cepat(Sasmitamiharja, 1996).
Casein hidrolisa merupakan sumber asam amino yang ditambakan untuk memperbaiki pertumbuhan dan morfogenesis, terutama media yang tidak mengandung ion anonium (Green et al, 1974).
Casein hidrolisa berperan sebagai sumber asam amino dan oligopeptida merupakan suatu produk yang dibuat dari protein keju (Siregar et al, 2010). Casein hidrolisa telah memberikan hasil yang signifikan dalam kultur jaringan (Ageel dan Elmeer, 2011).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh organogenesis tanaman jagung (Zea mays L.)pada berbagai konsentrasi NAA, Kinetin, Casein Hidrolisa Secara In-Vitro.
Manfaat penelitian
Sebagai bahan informasi untuk mendapatkan tanaman baru dalam jumlah banyak dalam waktu yang relatif singkat.
METODE PENELITIAN Tempat Dan Waktu
Penelitian dilaksanakan di Kampus 2 Laboratorium Kultur Jaringan Fakultas Pertanian Universitas Cokroaminoto Palopo Pada Bulan Mei sampai September 2015.
Bahan Dan Alat
Bahan yang digunakan dalam penelitian ini adalah biji jagung, gula putih, air kelapa, akuades, agar-agar puti (swallow globe) Auksin Kinetin, NAA, Casein Hidrolisa 70% Alkohol, 95% Alkohol.
Alat yang di gunakan dalam penelitian ini yaitu autoklaf, LAF (laminar air flow cabinet), botol kultur, rak kultur, AC, pH meter, pinset, bunsen atau lampu pembakar, cawan petri/petridish, timbangan, label, pulpen, penggaris, kamera, gelas ukur, gelas piala dan scalpel.
Metode Percobaan
Penelitian ini menggunakan metode rancangan acak lengkap (RAL) yang terdiri atas 4 perlakuan yang diulang sebanyak 3 kali sehingga terdapat 12 unit percobaan. Adapun perlakuanya yaitu:
P0 :Kontrol (tanpa perlakuan)
P1 :media MS + biji jagung + 1ml NAA, Kinetin, Casein hidrolisa P2 :media MS + biji jagung + 2ml NAA, Kinetin, Casein hidrolisa P3 :media MS + biji jagung + 3ml NAA, Kinetin, Casein hidrolisa
Data yang diperoleh dianalisis secara statistik dengan menggunakan sidik ragam (uji F). Apabila analisis sidik ragam menunjukkan pengaruh nyata, maka dilakukan uji nilai tengah dengan BNJ/Uji tukey.
Metode Pelaksanaan
1. Sterilisasi Botol dan Alat
Tahap yang pertama dilakukan saat melakukan strelisasi yaitu mencuci botol, cawan petri, scalpel, pingset dengan menggunakan sabun (sanglait) sampai bersi setelah itu botol dan alat dimasukkan kedalam autoklaf dan tutup autoklaf tersebut, setelah itu nyalakan tombol on. Selanjutnya tunggu autoklaf hingga
mengeluarkan uap pada salah satu katup autoklaf. Apabilah salah satu katup autoklaf mengeluarkan uap kemudian katup tersebut ditutup dan diamkan autoklaf selama 35-45 menit setelah itu keluarkan botol tersebut dari autoklaf lalu simpan ditempat yang steril.
2. Pembuatan Media (MS)
Disiapkan bahan-bahan dan alat yang diperlukan seperti gelas ukur, gula, agar dan pH setelah itu timbang terlebih dahulu agar-agar sekitar 3,5 g dan gila 15g kemudian masukkan air kelapa kedalam gelas ukur sekitar 100ml setelah semua bahan sudah ditimbang maka ukur dosis masing-masing sesuai dengan dosis yang diperlukan kemudian satukan semua bahan jadi satu setelah itu ukur pH terlebih dahulu sebelum dipindakan ketempat panci kecil setelah pH sudah diukur maka siap untuk dimasak sampe mendidih kemudian siap untuk dimasukkan kedalam botol yang sudah steril kemudian tutup dengan alumunium foil setelah itu masukkan lagi kedalam autoklaf tunggu sekitar 15 menit. Setelah waktunya sudah cukup maka botol-botol siap untuk dipindahkan ke dalam ruangan yang steril.
1. Sterilisasi Eksplan
Eksplan biji jagung yang akan digunakan direndam dalam campuran larutan diten 0,1 g dalam 100ml aquades selama 15 menit kemudian dibilas dengan aquades steril. Langkah yang terakhir yaitu eksplan dibilas dengan aquades steril selama 3 kali sampai bersih.
2. Penanaman Eksplan
Penanaman eksplan dilakukan diLAF (laminar air flow cabinet), sebelum botol ditanami, terlebih dahulu dibagian mulut botol dipanaskan agar kontaminasi terhindarkan. Dengan hati-hati tutup botol selanjutnya dibuka. Untuk menjaga sterilisasi dari alat, scalpel dan pingset selalu dipanaskan sebelum digunakan. Plastik penutup botol dibuka, eksplan diambil dengan pingset steril, kemudian eksplan ditanam diatas media. Setelah selesai penanaman, mulut botol dipanaskan kembali. Tutup botol sebaiknya dipanaskan sebelum digunakan untuk menutup. botol ditutup rapat dengan menggunakan alumunium foil dengan klipbort
kemudian diberi label perlakuan dan disimpan di rak penyimpanan. 3. Pemeliharaan
Pemeliharaan dilakukan setiap pagi dan sore dengan cara menyemprotkan alkohol kebotol-botol tanaman jagung agar tanaman jagung dalam botol tidak terkontaminasi.
Parameter Pengamatan
Adapun karakteristik yang diamati dan diukur yaitu : 1. Umur berkecambah (Hari)
2. Hari muncul akar (Hari) 3. Tinggi tanaman (cm)
4. Lebar daun (cm) 5. Panjang daun (cm) 6. Jumlah akar (helai) 7. Panjang akar(cm) 8. Jumlah daun (helai) 9. Bobot planlet (g)
HASIL DAN PEMBAHASAN Hasil
1. Umur Berkecambah Tanaman Jagung (hari)
Hasil penelitian menunjukkan bahwa zat pengatur tumbuh Kinetin, NAA dan Casein Hidrolisa memberikan pengaruh tidak nyata terhadap umur kecambah tanaman jagung. Hasil tersebut dapat dilihat pada gambar diagram umur kecambah tanaman jagung dibawah ini.
Gambar1. Diagram Rata-rata Umur Berkecambah Tanaman Jagung Organogenesis Tanaman Jagung (Zea Mays L) Terhadap Berbagai Konsentrasi NAA Kinetin dan Casein Hidrolisa Secara In-Vitro. Berdasarkan gambar diatas perlakuan P0 (Kontrol) menunjukkan rata-rata umur berkecambah tanaman jagung 4,8 hari perlakuan P1 (1ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata 4,8 hari perlakuan P2 (2ml NAA, Kinetin, Casein hidrolisa) menunjukkan nilai rata-rata 5,5 hari perlakuan P3 (3ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata 4,8. Semua perlakaun di atas diagram yang paling tinggi yaitu P2 rata-rata 5,5 hari dan yang terendah adalah perlakuan P0 dengan rata-rata 4,8 hari.
4,2 4,4 4,6 4,8 5,0 5,2 5,4 5,6 P0 P1 P2 P3 4,8 4,8 5,5 4,8 Um u r K e cam b ah ( h ar i)
2. Hari Muncul Akar Tanaman Jagung (hari)
Hasil penelitian menunjukkan bahwa zat pengatur tumbuh Kinetin NAA dan Casein Hidrolisa memberikan pengaruh tidak nyata terhadap hari muncul akar tanaman jagung. Hasil tersebut dapat dilihat pada gambar diagram hari muncul akar tanaman jagung dibawah ini.
Gambar 2. Diagram Rata-rata Hari Muncul Akar Tanaman Jagung Organogenesis Tanaman Jagung (Zea Mays L) Terhadap Berbagai Konsentrasi NAA Kinetin dan Casein Hidrolisa Secara In-Vitro. Berdasarkan gambar diagram diatas hari muncul akar sehingga dapat disimpulkan bahwa rata-rata hari muncul akar pada perlakuan P0 (Kontrol) menunjukkan hari muncul akar tanaman jagung dengan nilai rata-rata 4,0 hari kemudian perlakuan P1 (1ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata 4,0 hari dan perlakuan P2 (2ml NAA, Kinetin, Casein hidrolisa) menunjukkan nilai rata-rata 4,0 hari kemudian menyusul perlakuan P3(3ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata 4,0 hari Berdasarkan diagram diatas dapat kita lihat bahwa semua perlakaun hari muncul akar sama-sama penyerapan zat pengatur tumbuh dengan nilai yang sama denga rata-rata 4,0 hari.
3. Tinggi Tanaman Jagung (cm)
Hasil penelitian menunjukkan bahwa zat pengatur tumbuh Kinetin NAA dan Casein Hidrolisa memberikan pengaruh tidak nyata terhadap tinggi tanaman jagung . Hasil tersebut dapat dilihat pada gambar diagram tinggi tanaman dibawah ini. 0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 P0 P1 P2 P3 4,0 4,0 4,0 4,0 H ar i M u n cu l A kar ( H ar i)
Gambar 3. Diagram Rata-rata Tinggi Tanaman Jagung Organogenesis Tanaman Jagung (Zea Mays L) Terhadap Berbagai Konsentrasi NAA Kinetin dan Casein Hidrolisa Secara In-Vitro.
Gambar di atas menunjukkan bahwa rata-rata tinggi tanaman yang paling tingi yaitu terdapat pada perlakuan P3 (3ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata tinggi tanaman 17,2 cm untuk tinggi tanaman pada perlakuan P1 (1ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata 16,2 cm selanjutnya menyusul nilai yang paling rendah terdapat pada perlakuan P2 (2ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata 14,3 cm kemudian menyusul perlakuan P0 (Kontrol) dengan nilai rata-rata 14,5 cm.
4. Lebar Daun Tanaman Jagung (cm)
Hasil penelitian menunjukkan bahwa zat pengatur tumbuh Kinetin NAA dan Casein Hidrolisa memberi pengaruh tidak nyata terhadap lebar daun tanaman jagung. Hasil tersebut dapat dilihat pada gambar diagram lebar daun tanaman jagung dibawah ini.
Gambar 4. Diagram Rata-rata Lebar Daun Tanaman Jagung Organogenesis Tanaman Jagung (Zea Mays L) Terhadap Berbagai Konsentrasi NAA Kinetin dan Casein Hidrolisa Secara In-Vitro.
12,5 13,0 13,5 14,0 14,5 15,0 15,5 16,0 16,5 17,0 17,5 P0 P1 P2 P3 14,5 16,2 14,3 17,2 T ing g i T a na m a n (cm )
Perlakuan (NAA + Kinetin + Casein Hidrolisa)
0,0 0,5 1,0 1,5 P0 P1 P2 P3 1,2 1,1 1,1 1,3 Leb ar D au n ( cm )
Diagram batang di atas memperlihatkan bahwa rata-rata lebar daun pada perlakuan P1 (1ml NAA, Kinetin, Casein hidrolisa) memperlihatkan lebar daun tanaman jagung yang paling terendah dengan nilai rata-rata 1,1 cm dan P2 (2ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata yaitu 1,1 cm sedangkan untuk lebar daun tanaman jagung yang terbaik yaitu terdapat pada perlakuan P3 (3ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata 1,3 cm kemudian menyusul P0 (Kontrol) dengan nilai rata-rata 1,2cm. Dari 4 perlakuan di atas hanya 1 lebar daun yang paling bagus yaitu terdapat pada perlakua P3. dikarnakan karena penyerapan zptnya lebih bagus dari pada perlakuan yang lainya.
5. Panjang Daun Tanaman Jagung (cm)
Hasil penelitian menunjukkan bahwa zat pengatur tumbuh Kinetin NAA dan Casein Hidrolisa memberi pengaruh tidak nyata terhadap panjang daun tanaman jagung. Hasil tersebut dapat dilihat pada gambar diagram panjang daun tanaman jagung dibawah ini.
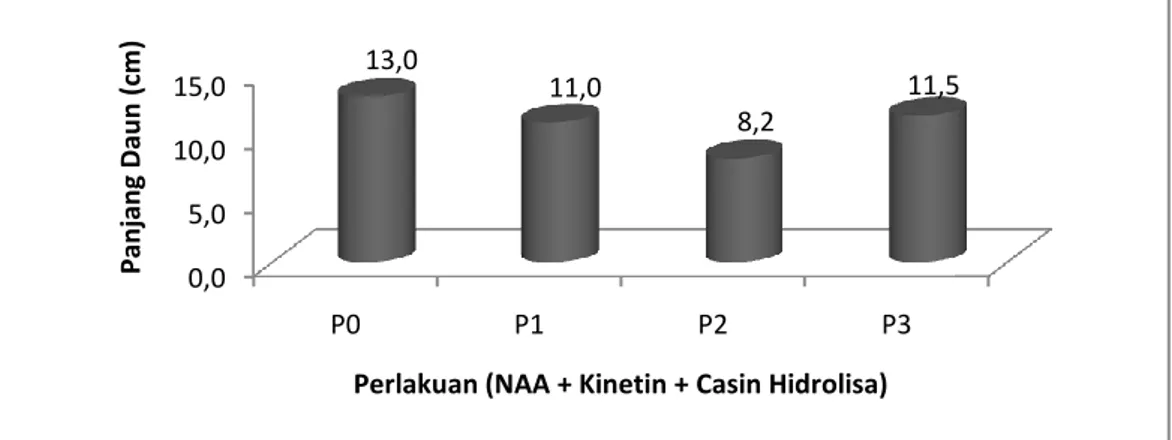
Gambar 5. Diagram Rata-rata Panjang Daun TanamanJagung Organogenesis Tanaman Jagung (Zea Mays L) Terhadap Berbagai Konsentrasi NAA Kinetin dan Casein Hidrolisa Secara In-Vitro.
Gambar 5 diagram panjang daun tanaman jagung menunjukkan bahwa rata-rata panjang daun pada perlakuan P0 (Kontrol) memperlihatkan panjang daun tanaman jagung yang lebih baik dari perlakuan lainnya yaitu dengan nilai rata-rata 13,0cm untuk panjang daun tanaman jagung yang terbaik kedua pada perlakuan P3 (3ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata 11,5cm sedangkan untuk panjang daun tanaman jagung yang terbaik ke tiga yaitu P1 (1ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata 11,0cm selanjutnya untuk panjang daun tanaman jagung yang paling terendah terdapat pada perlakuan P2 (2ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata 8,2cm.
6. Jumlah Akar Tanaman Jagung (helai)
Hasil penelitian menunjukkan bahwa zat pengatur tumbuh Kinetin NAA dan Casein Hidrolisa memberi pengaruh tidak nyata terhadap jumlah akar tanaman jagung. Hasil tersebut dapat dilihat pada gambar jumlah akar tanaman jagung daun di bawah ini.
0,0 5,0 10,0 15,0 P0 P1 P2 P3 13,0 11,0 8,2 11,5 Pan jan g Dau n ( cm )
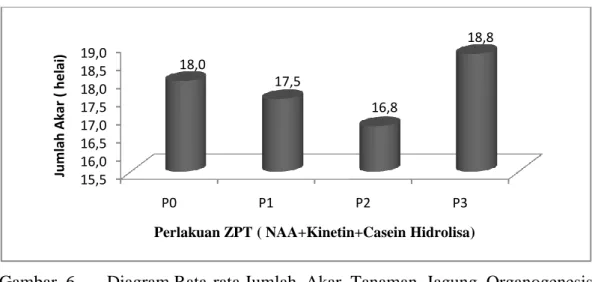
Gambar 6. Diagram Rata-rata Jumlah Akar Tanaman Jagung Organogenesis TanamanJagung (Zea Mays L) Terhadap Berbagai Konsentrasi NAA Kinetin dan Casein Hidrolisa Secara In-Vitro.
Diagram rata-rata jumlah akar tanaman jagung dengan pemberian zat pengatur tumbuh Kinetin, NAA, Casein Hidrolisa menunjukkan bahwa konsentrasi P0 (Kontrol) P1 (1ml NAA, Kinetin, Casein hidrolisa) P2 (2ml NAA, Kinetin, Casein hidrolisa) P3 (3ml NAA, Kinetin, Casein hidrolisa) jumlah akar yang paling tinggi terdapat pada perlakuan yaitu P3 dengan nilai rata-rata 18,8 helai dan P0 dengan nilai rata-rata 18,0 helai kemudian menyusul perlakuan P1 yaitu dengan nilai rata-rata 17,5 helai dan yang paling terendah diantara 4 perlakuan yaitu P2 dengan nilai rata- rata 16,8 helai.
7. Panjang Akar Tanaman Jagung (cm)
Hasil penelitian menunjukkan bahwa zat pengatur tumbuh Kinetin NAA dan Casein Hidrolisa memberi pengaruh tidak nyata terhadap panjang akar tanaman jagung. Hasil tersebut dapat dilihat pada gambar diagram panjang akar dibawah ini.
Gambar 7. Diagram Rata-rata Panjang Akar Tanaman Jagung Organogenesis Tanaman Jagung (Zea Mays L) Terhadap Berbagai Konsentrasi NAA Kinetin dan Casein Hidrolisa Secara In-Vitro.
15,5 16,0 16,5 17,0 17,5 18,0 18,5 19,0 P0 P1 P2 P3 18,0 17,5 16,8 18,8 Ju m lah A kar ( h e lai )
Perlakuan ZPT ( NAA+Kinetin+Casein Hidrolisa)
0,0 2,0 4,0 6,0 8,0 10,0 12,0 P0 P1 P2 P3 10,1 7,6 5,2 7,6 Pan jan g ak ar (c m )
Gambar diagram di atas menunjukkan bahwa rata-rata dari segi panjang akar tanaman jagung dari ke 4 perlakuan diatas yang paling cepat terdapat pada perlakuan P0 (Kontrol) dengan nilai rata-rata 10,1 cm kemudian panjang akar tanaman jagung yang berikutnya terdapat pada perlakuan P1 (1ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata 7,6 cm kemudian menyusul perlakuan P3 dengan nilai yang sama dengan nilai rata-rata yaitu 7,6 cm sedangkan panjang akar tanaman jagung yang paling terendah terdapat pada perlakuan P2 (2ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata 5,2 cm.
8. Jumlah Daun Tanaman Jagung (helai)
Hasil penelitian menunjukkan bahwa zat pengatur tumbuh NAA Kinetin dan Casein Hidrolisa memberi pengaruh tidak nyata terhadap jumlah daun tanaman jagnug. Hasil tersebut dapat dilihat pada gambar diagram jumlah daun di bawah ini.
Gambar 8. Diagram Rata-rata Jumlah Daun Jagung Organogenesis Tanaman Jagung (Zea Mays L) Terhadap Berbagai Konsentrasi NAA Kinetin dan Casein Hidrolisa Secara In-Vitro.
Hasil diagram di atas menujukkan bahwa pada jumlah daun pada tanaman jagung pada perlakuan P3 (3ml NAA, Kinetin, Casein hidrolisa) memperlihatkan jumlah daun yang paling baik dengan nilai rata-rata 3,3 helai kemudian menyusul perlakuan berikutnya yaitu P0 (Kontrol) dengan nilai rata-rata 3,3 helai sedangkan jumlah daun tanaman jagung yang paling rendah yaitu terdapat pada perlakuan P1 (1ml NAA, Kinetin, Casein hidrolisa) dengan nilai rata-rata 3,0 helai dan P2 dengan nilai yang sama yaitu 3,0 helai.
2,9 2,9 3,0 3,0 3,1 3,1 3,2 3,2 3,3 P0 P1 P2 P3 3,3 3,0 3,0 3,3 Ju m lah D au n ( H e lai )
9. Bobot Planlet Tanaman Jagung (g)
Hasil penelitian menunjukkan bahwa zat pengatur tumbuh NAA Kinetin dan Casein Hidrolisa memberi pengaruh tidak nyata terhadap bobot planlet tanaman jagung. Hasil tersebut dapat dilihat pada gambar diagram bobot planlet dibawah ini.
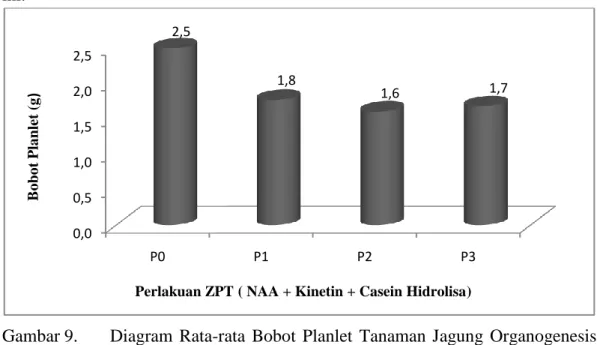
Gambar 9. Diagram Rata-rata Bobot Planlet Tanaman Jagung Organogenesis Tanaman Jagung (Zea Mays L) Terhadap Berbagai Konsentrasi NAA Kinetin dan Casein Hidrolisa Secara In-Vitro.
Hasil diagram data bobot planlet menunjukkan bahwa tanaman jagung dengan konsentrasi yang rendah P0 (Kontrol) P1 (1ml NAA, Kinetin, Casein hidrolisa) P2 (2ml NAA, Kinetin, Casein hidrolisa) P3 (3ml NAA, Kinetin, Casein hidrolisa) berat bobot planlet yang paling berat terdapat pada perlakuan P0 dengan nilai rata-rata 2,5g kemudian menyusul perlakuan P1 dengan nilai rata-rata 1,8g dan perlakuan P3 yaitu nilai rata-rata 1,7g dan yang paling terendah yaitu perlakuan P2 dengan nilai rata-rata 1,6g. bahwa pemberian zpt tumbuh tidak berpengaruh pada berat tanaman jagung.
Pembahasan
Pemberian zat pengatur tumbuh NAA, Kinetin dan Casein Hidrolisa dengan berbagai konsentrasi yaitu P0 (kontrol) P1 (1ml NAA, Kinetin, Casein hidrolisa) P2 (2ml NAA, Kinetin, Casein hidrolisa) P3(3ml NAA, Kinetin, Casein hidrolisa) terhadap karakteristik umur kecambah, hari muncul akar, tinggi tanaman, lebar daun, panjang daun, jumlah akar, panajang akar, jumlah daun, bobot planlet memberi pengaruh yang tidak nyata terhadap pertumbuhan tanaman jagung, dilihat dari karesteristik dari segi umur kecambah yang lebih dominan berkecambah yaitu P2 dengan nilai rata-rata 5,5 dan yang terendah yaitu perlakuan P0 dengan nilai rata-rata 4,8, karna dalam ZPT sudah sudah terdapat
0,0 0,5 1,0 1,5 2,0 2,5 P0 P1 P2 P3 2,5 1,8 1,6 1,7 B o bo t P la nlet ( g )
auksin. (Hendaryono 2008), menyebutkan bahwa ketepatan ZPT yang ditambahkan sangat penting dalam organogenesis, karena akan terjadi interaksi antara ZPT yang digunakan dengan zat-zat endogen yang terdapat dalam jaringan tumbuhan. Apabila persentase eksplan tumbuh pada media dengan konsentrasi auksin (NAA) rendah berarti ada kemungkinan sudah terdapat auksin endogen yang mencukupi.
Panjang akar (cm) memperlihatkan perbedaan yang tidak nyata pada tiap perlakuan rata-rata akar terpanjang yaitu P0 (Kontrol) dengan nilai rata-rata 10,1 cm diperoleh dari media MS tampa auksin karna pemberian auksin yang berlebihan akan menghambat perpanjang akar, Panjangnya akar pada perlakuan P0 (Kontrol) bahwa penghambatan panjang akar sejalan dengan konsentrasi auksin yang semakin meningkat. Hal ini didukung oleh (Maynerd et al, 1991) dalam (Gati et al, 1993), yang menyatakan bahwa kelebihan auksin dapat menghambat elongasi akar (Salguero, 2000). Menyatakan pula bahwa auksin eksogen akan menghambat proses elongasi akar, yang ditandai dengan meningkatnya jumlah etilen pada ujung akar. Dalam hal ini etilen menimbulkan efek penghambatan pada perpanjangan akar.
Jumlah daun (helai) tanaman jagung pada semua perlakuan tidak berbeda nyata dapat kita liat pada diagram rata-rata jumlah daun tanaman jagung yaitu P0 (Kontrol) dengan nilai rata-rata 3,3 helai karna perlakuan P0 mungkin banyak mengandung unsur hara, diduga tingginya kadar unsur hara tersedia tersebut dapat memacu aktivitas hormonal dalam pembentukan daun (Goldsworthy dan Fisher, 1992). Menyatakan bahwa pembentukan daun dipengaruhi oleh banyak rangsangan hormonal. Sedangkan dari segi panjang daun pada perlakuan yang tidak diberikan ZPT P0 (Kontrol) dengan nilai rata-rata 13,0 cm maupun yang telah diberikan zat pengatur tumbuh tidak berbeda nyata terhadap panjang daun. Bahan organik banyak mengandung unsur-unsur diperlukan dalam pertumbuhan daun, sehingga pertambahan panjang daun akan semakin cepat. Sedangkan auksin lebih berperan dalam pembentukan daun dari pada pertumbuhanya. Penambahan auksin justru akan menghambat pertumbuhan daun karna auksin justru akan lebih aktif membentuk daun.
Perlakuan P0, P1,P2,P3 pada muncul akar tanaman jagung dengan nilai rata-rata 4,0 hari dari ke 4 perlakaun menunjukkan bahwa pada hari muncul akar P0(Kontrol) P1(1ml NAA, Kinetin, Casein hidrolisa) P2 (2ml NAA, Kinetin, Casein hidrolisa) P3 (3ml NAA, Kinetin, Casein hidrolisa) dapat kita lihat pada diagram 2 bahwa hari muncul akar sama dengan nilai rata-rata 4,0 hari memberi pengaruh tidak nyata terhadap tanaman jagung karena tanaman jagung telah mencukupi kebutuhan saat pembentukan akar dalam tanaman jagung sudah mengandung masing-masing auksin tertentu (Menurut Agustina, 2002). Menyatakan bahwa munculnya akar disebabkan oleh masih tingginya auksin yang terdapat dalam eksplan (endogen) sehingga walaupun ditambahkan auksin secara eksogen dengan konsentrasi rendah akan dapat membentuk akar. Akar merupakan
organ vegetatif utama yang memasok air, mineral dan bahan-bahan untuk pertumbuhan dan perkembangan tanaman, serta menjadi faktor yang penting dalam menyerap unsur-unsur yang terdapat dalam media kultur (Rukmana, 2009).
Perlakuan P3 dan P0pada jumlah akar gambar diagram yang disajikan yang lebih tinggi P3dan P0 dengan rata-rata P3 18,8 helai sedangkan P0 rata-rata 18,0 helai dan yang terendah yaitu P2 dan P1 rata-rata P2 16,8 helai dan P1 rata-rata 17,5 helai banyaknya akar yang terbentuk diduga diakibatkan konsentrasi auksin yang lebih tinggi. Penambahan auksin sintetik (NAA) dalam konsentrasi rendah menyebabkan pemunculan akar yang cepat jika dibandingkan dengan perlakuan kontrol, yang diikuti dengan pemanjangan akar yang cepat. Namun demikian, pertumbuhan akar terlihat terhambat karena ukuran akar yang relatif kecil. Hal tersebut sesuai dengan penelitian (Wightman et al, 1980). Bahwa aplikasi auksin eksogen pada media kultur dapat meningkatkan inisiasi akar dan pembentukan akar yang lebih cepat, serta mempengaruhi pemanjangan akar jika digunakan dalam konsentrasi rendah.
Tinggi tanaman jagung dengan konstrasi yang paling tinggi yaitu P3 (3ml NAA, Kinetin, Casein hidrolisa) menunjukkan nilai rata-rata 17,2 cm hal ini dapat terjadi karena pemberian dosis casein hidrolisa yang paling tinggi menyebabkan pertumbuhan dan hasil tanaman jagung juga lebih tinggi (Widyastoety dan Nurmalinda, 2010), menyatakan bahwa casein hidrolisat merupakan sumber nitrogen organik yang dapat merangsang pertumbuhan dan perkembangan jaringan tanaman.
Panambahan lebar daun dan panjang daun dapat kita liat pada diagram rata-rata lebar daun dari perlakuan yang paling tinggi yaitu P3 rata-rata-rata-rata 1,3 cm sedangkan yang terendah terdapat pada perlakuan P1 rata-rata 1,1 cm karana dalam pemberian konsentrasi yang tinggi sehingga jaringan meristem lebih aktif (Salisbury dan Ross, 1995). Menyatakan bahwa aktifitas penambahan lebar daun pada tanaman disebabkan oleh aktifitas jaringan meristem yang menghasilkan sejumlah sel yang efektif sepanjang tepi poros daun dan dan diakibatkan oleh pembelahan secara antiklinal, dan panjang daun dapat kita lihat pada diagram dengan perlakuan yang terendah yaitu P2 rata-rata 8,2cm dan tertinggi dengan perlakauan P0 dengan nilai rata-rata 13,0 cm karena tampah pemberian zpt lebih cepat merangsang pembelahan sel menurut (Lakitan, 2004). Panjang daun dipengaruhi oleh pembelahan sel yang berangsung-angsung secara antic linak dan pertilinak.
KESIMPULAN DAN SARAN Kesimpulan
Berdasarkan hasil penelitian maka dapat disimpulkan bahwa pada umur berkecambah yang paling cepat pada perlakuan P2 dengan nilai rata-rata yaitu 5,5 hari muncul akar yang paling cepat pada perlakuan P3 dengan nilai rata-rata 4,0
hari, tinggi tanaman yang paling tinggi yaitu P3 dengan nilai rata-rata 17,2 cm, lebar daun yang paling tinggi yaitu P3 dengan nilai rata-rata 1,3 cm, panjang daun yang paling tinggi yaitu P0 dengan nilai rata-rata 13,0 cm, jumlah akar yang banyak yaitu P3 dengan nilai rata-rata 18,8 helai, panjang akar yang paling panjang yaitu P0 dengan nilai rata-rata 10,1cm, jumlah daun yang paling banyak yaitu P0 dengan nilai rata-rata 3,3 helai, bobot planlet yang paling berat yaitu P0 dengan nilai rata-rata 2,5 g.
Saran
Saran yang dapat penulis sampaikan berdasarkan pengalaman baik saat melaksanakan penelitian adalah diharapkan kepada mahasiswa yang akan melakukan penelitian dilaboratorium supaya lebih menjaga kebersihan didalam ruang laboratorium dan menjaga sterilisasi bahan dan alat supaya tanaman tidak mudah terkontaminasi.
DAFTAR PUSTAKA
Armini, N. M., G. A. Wattimena dan L.W. Gunawan. 1991. Perbanyakan tanaman. Hal 17-149. Dalam: Tim Laboratorium Kultur JaringanTanaman (Eds.). Bioteknologi Tanaman1.Pusat Antar Universitas Bioteknologi.Insitut Pertanian Bogor. Bogor.
Ageel, S., and K. Elmeer. 2011. Effects of Casein Hydrolysates and Glutamine on Callus and Somatic Embryogenesis of Date Palm (Phoenix dactylifera L.).New York Science Journal 4(7):121-125.
Adisarwanto, T., dan Y. E. Widyastuti, 2009. Meningkatkan Produksi Jagung di Lahan Kering, Sawah dan Pasang Surut. Penebar swadaya Jakarta. 86 hal
Agustina, L. 2002. Nutrisi Tanaman. Rineka Cipta. Jakarta.
Arteca, R.N, 1996. Plant Growt Subtances, Priciples and Application. Chapman & Hall. 332p.
Fisher, N. M. dan P. R. Goldsworty., 1996. Jagung Tropik dalam Fisiologi Tanaman Budidaya tropik. UGM-Press, Yogyakarta. Hal 281-315.
Fitrianti, A. 2006.” Efektivitas Asam 2,4-Diklorofenoksiasetat (2,4-D) dan Kinetin pada Medium MS dalam Induksi Kalus Sambiloto dengan Eksplan Potongan Daun”. Skripsi. Biologi FMIPA UNS: Semarang
Gamborg, O. L. dan J. K. Shyluk. 1981. Nutrition,media and characteristic of plant cell and tissue culture. P: 21-24. In: T.A. Thorpe (Ed). Plant Tissue Culture Methods and Application in Agriculture. Academic Press Inc. New York.
Gunawan, L. W. 1987. Teknik Kultur Jaringan. Laboratorium Kultur Jaringan Tanaman. Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor. Bogor. 252 hal.
George, E. F. dan P. D. Sherrington. 1984. Plant Propagation by Tissue Culture. Handbook and Directory of Commercial Laboratories. Exegetics Ltd., England. 596 p.
George, EF and PD Sherrington, Plant Propagation by Tissue CultureIn Practice,
( Part 1 and 11) pedition, England : Exegetics Limitit, 1984.
George EF, Sherrington. 1984. Plant Propagation by Tissue Culture. London: Eastern Press.
Gati, E., I. Mariska dan D. Seswita, 1993. Daya regenerasi tanaman piretrum setelah penyimpanan melalui kultur jaringan.Prosiding Hasil Penelitian dalam Rangka Pemanfaatan Pestisida Nabati. Bogor: 126 – 131.
Goldsworthy, P. R dan N. M. Fisher. 1992. Fisiologi Tanaman Budidaya Tropik(terjemahan). Gadjah Mada University Press. Yogyakarta, hal.295. Harjadi. 2009. Zat pengatur tumbuh Bogor.
Hendaryono, J. R. P. dan A. Wijaya. 2008. Teknik Kultur Jaringan. Kanisius.
Harjadi, S. S. 1989. Dasar-dasar Hortikultura. Jurusan Budidaya Pertanian. Faperta. IPB. Bogor. 506 hal.
Lakitan, B. 2004. Hortikultura : Teori, Budidaya dan Pasca Panen. Jakarta. Rajawali Press. 219hal.
Nugroho A, Sugito H. 2002. Pedoman PelaksanaanTeknik Kultur Jaringan. Jakarta. Penebar Swadaya.
Rubatzky, V. E. dan M. Yamaguchi, 1998. Sayuran Dunia 2 Prinsip, Produksi, dan Gizi. ITB, Bandung.
Rukmana, R. 2009. Usaha Tani Kentang Sistem Mulsa Plastik . Penerbit Kanasius. Yogyakarta.
Rasco Jr., E. T. dan M. A. D. Maquilan. 2005. Initial studies on in vitrogermination and early seedling growth of Nepenthes truncata Macf. Carnivorous Plant Newsletter. June (34): 51.
Slavona. O.I., and nikiti, D.I., 2005 Immosibation of oligotrophic bacteria by Adesorption on porous carrier. Microbiology 97, 371 – 373.
Salisbury, FB., Ross, CW., 1995 . Fisiologi Tumbuhan Jilid 1. Penerbit ITB. Bandung.
Salisbury, F.B. dan C.W. Ross. 1995. Fisiologi Tumbuhan jilid III. Bandung. Institut Teknologi
Bandung. 343 hal.
Salguero, J., 2000. Exogenous effects on root growth and ethylene production in maize primary roots . http://abs tracts.aspb.org/aspp2000/public/P28/ 0129.html.
Sayekti, U. 2007.Pengaruh Media Terhadap Pertumbuhan dan Perkembangan Kecambah Kantong Semar (Nepenthes mirabilis) secara In Vitro. Skripsi. Fakultas Pertanian, Institut Pertanian Bogor. Bogor. 62 hal.
Sandra 2010, Kultur jaringan. Cara mudah memahami dan menggapai kultur skala tangga. Penerbit pustaka lentera.
Triharyanto A. 2005. Multiplikasi Tunas Tanaman Gaharu (Aquilaria malaccensislamk) Secara In Vitro [skripsi]. Bogor: Fakultas Kehutanan, InstitutPertanian Bogor.
Wetherell DF. 1982. Pengantar PropagasiTanaman Secara In Vitro. (Terjemahan). New Jersey: Avery Publishing Group Inc. Wayne.
Warisno. 1998. Jagung Hibrida. Kanisius. Yogyakarta Widiastoety, D. dan Nurmalinda. 2010.Pengaruh Suplemen Nonsintetik terhadap Pertumbuhan Planlet Anggrek Vanda. J. Hort. 20(1):60-66.
etherell DF. 1982. Pengantar PropagasiTanaman Secara In Vitro. (Terjemahan). New Jersey: Avery Publishing Group Inc. Wayne.
Wattimenna L. W. Gunawan, N. A. Matjik, E. Syamsudin, N. M. Armini dan A. Ernawati. 1992. Bioteknologi Tanaman Laboratorium Kultur Jaringan. Pusat Antar Universitas. Institut Pertanian Bogor. Bogor. 309 hal.