commit to user
EFEK HEPATOPROTEKTOR PROPOLIS TERHADAP KERUSAKAN
SEL HEPAR MENCIT (Mus musculus) YANG
DIINDUKSI PARASETAMOL
SKRIPSI
Untuk Memenuhi Persyaratan
Memperoleh Gelar Sarjana Kedokteran
Apriany Darma Wulan
G0008199
FAKULTAS KEDOKTERAN
UNIVERSITAS SEBELAS MARET
SURAKARTA
commit to user
ABSTRAK
Apriany Darma Wulan, G0008199, 2011, Efek Hepatoprotektor Propolis
Terhadap Kerusakan Sel Hepar Mencit (Mus musculus) yang Diinduksi
Parasetamol. Skripsi, Fakultas Kedokteran, Universitas Sebelas Maret, Surakarta.
Tujuan Penelitian : Penelitian ini bertujuan untuk mengetahui efek pemberian
propolis dalam mencegah kerusakan sel hepar mencit yang diinduksi parasetamol dan efek peningkatan dosis propolis dalam meningkatkan daya proteksi terhadap kerusakan sel hepar mencit yang diinduksi parasetamol.
Metode Penelitian :Penelitian ini bersifat eksperimental laboratorik dengan post
test only controlled group design. Jumlah sampel sebanyak 28 ekor mencit jantan, galur Swiss webster, umur 2-3 bulan, berat badan + 20 gr. Teknik pengambilan sampel dengan incidental sampling. Sampel dibagi dalam 4 kelompok, dimana masing-masing kelompok terdiri dari 7 ekor mencit. Pada kelompok K dan P1, mencit diberi aquades selama 14 hari. Kelompok P2 mencit diberi propolis dosis I dan kelompok P3 mencit diberi propolis dosis II, keduanya diberikan selama 14 hari. Parasetamol diberikan pada kelompok P1, P2 dan P3 pada hari ke-12, 13 dan
14. Hari ke-15, mencit dikorbankan dan organ hepar mencit dibuat preparat
dengan metode blok parafin dan pengecatan HE. Gambaran histologis hepar dinilai berdasarkan penjumlahan piknosis, karioreksis dan kariolisis. Data dianalisis dengan menggunakan uji One Way ANOVA (α = 0,05) dan dilanjutkan dengan uji Post Hoc Multiple Comparisons (LSD)(α = 0,05).
Hasil Penelitian : Dari hasil uji One Way ANOVA menunjukkan adanya perbedaan
yang bermakna antara keempat kelompok perlakuan. Pada hasil uji Post Hoc
Multiple Comparisons (LSD) menunjukkan terdapat perbedaan yang bermakna
antara KK dan KP1, KK dan KP2, KK dan KP3, KP1 dan KP2, KP1 dan KP3,
serta KP2 dan KP3.
Simpulan Penelitian : Propolis dapat mencegah kerusakan sel hepar mencit yang
diinduksi parasetamol dan peningkatan dosis propolis dapat meningkatkan daya proteksi terhadap kerusakan sel hepar mencit yang diinduksi parasetamol.
commit to user
ABSTRACT
Apriany Darma Wulan, G0008199, 2011, The Hepatoprotector Effect of
Propolis to Liver Cell Damage of Mice (Mus musculus) which is Induced by
Paracetamol. Script, Faculty of Medicine, Sebelas Maret University, Surakarta.
Objective : The objectives of this research are to know about the effect of propolis
in preventing the liver cell damage of mice by Paracetamol and also the increase
of propolis dose can increase protection effect to the hepar cell damage of mice
which is induced by paracetamol.
Methods : This was laboratory experimental research with post test only
controlled group design. Samples were 28 male mice, Swiss webster type, 2-3
months old age and + 20 gr of each weight. Those samples divided into 4 groups, each group has 7 mice. Sampling technique was incidental sampling. The group of K and P1, mice were given aquades for 14 days. The group of P2, mice were given a first propolis dose and the group of P3, mice were given a second propolis dose for 14 days. Paracetamol was given to groups of P1, P2, and P3, on the 12th, 13th, and 14th day. The 15th day, mice were sacrificed and hepars made preparations by the method of paraffin block and stained by HE. Hepar histological features were assessed based on quantifying of pyknosis, karyorhexis, and karyolysis. Data were analyzed using the One Way ANOVA test (α = 0.05)
and continued by Post Hoc Multiple Comparisons (LSD) test(α = 0.05).
Result: The result of One Way ANOVA testshowed that there was a significant
difference between 4 groups. The result of Post Hoc Multiple Comparisons (LSD)
showed that there was a significant difference between KK and KP1, KK and KP2, KK and KP3, KP1 and KP2, KP1 and KP3, and also KP2 and KP3.
Conclusion : Propolis can prevent the hepar cell damage of mice which is
induced by paracetamol and the increase of propolis dose can increase protection effect to the hepar damage of mice which is induced by paracetamol.
commit to user
PERNYATAAN
Dengan ini saya menyatakan bahwa dalam skripsi ini tidak terdapat karya
yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu Perguruan
Tinggi dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat
yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis
diacu dalam naskah dan disebutkan dalam daftar pustaka.
Surakarta, Desember 2011
Apriany Darma Wulan
commit to user
vi
Syukur Alhamdulillah atas kehadirat Allah SWT dengan segala karunia dan rahmat yang dilimpahkan-Nya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Efek Hepatoprotektor Propolis terhadap Kerusakan Sel Hepar Mencit (Mus musculus) yang Diinduksi Parasetamol”.
Penyusunan skripsi ini merupakan salah satu syarat memperoleh gelar sarjana di Fakultas Kedokteran Universitas Sebelas Maret Surakarta. Dalam penyusunan skripsi ini, penulis tidak terlepas dari hambatan dan kendala. Namun dapat teratasi atas pertolongan Allah SWT melalui bimbingan dan dukungan oleh banyak pihak. Untuk itu, perkenankan penulis mengucapkan terima kasih kepada :
1. Prof. Dr. Zainal Arifin Adnan, dr., Sp.PD-KR-FINASIM., selaku Dekan Fakultas Kedokteran Universitas Sebelas Maret Surakarta.
2. Muthmainah, dr., M. Kes., selaku Ketua Tim Skripsi Fakultas Kedokteran
Universitas Sebelas Maret Surakarta.
3. Isdaryanto, dr., MARS., selaku Pembimbing Utama yang telah banyak
memberikan bimbingan, saran dan nasihat bagi penulis.
4. Bagus Wicaksono, drs., M.Si., selaku Pembimbing Pendamping yang telah
memberikan bimbingan, saran dan nasihat bagi penulis.
5. Suyatmi, dr., M. Biomed., Sc., selaku Penguji Utama yang telah memberikan saran dan nasihat bagi penulis.
6. Arif Suryawan, dr., AIFM, selaku Anggota Penguji yang telah memberikan saran dan nasihat bagi penulis.
7. Tim Skripsi Fakultas Kedokteran Universitas Sebelas Maret Surakarta.
8. Staf Laboratorium Histologi Fakultas Kedokteran Universitas Sebelas Maret Surakarta yang telah membantu dalam pelaksanaan penelitian.
9. Papaku sayang Kamarudin, the strong woman mamaku sayang Maryati dan
kakakku sayang Erwin dan Bulan, serta my special one yang selalu memberikanku dorongan, kasih sayang, nasihat dan mendoakanku.
10. Teman-temanku STKB dan sahabatku terima kasih atas nasihat dan dorongannya. 11. Teman-temanku kelompok tutorial A4 terima kasih atas kebersamaannya.
12. Semua pihak yang telah membantu dalam penulisan skripsi ini.
Penulis menyadari bahwa dalam penulisan skripsi ini masih banyak kekurangan sehingga penulis sangat mengharapkan kritik serta saran untuk peningkatan karya ini. Semoga karya sederhana ini dapat bermanfaat bagi semua.
Surakarta, 21 Desember 2011
commit to user
A. Latar Belakang ……….………..….……...1
B. Perumusan Masalah...3
C. Tujuan Penelitian...3
D. Manfaat Penelitian...4
BAB II LANDASAN TEORI...5
A. Tinjauan Pustaka...5
1. Hepar………...………..………5
2. Parasetamol………....….…..…...……….9
3. Propolis………....….….……...………12
4. Mikroskopis Kerusakan Hepar Setelah Pemberian Parasetamol Dosis Toksik………...….………...……….……16
5. Mekanisme Perlindungan Propolis terhadap Kerusakan Hepar Akibat Induksi Parasetamol………..…….………..………18
B. Kerangka Pemikiran………....…………...……….…20
C. Hipotesis...21
BABIII METODE PENELITIAN...22
A. Jenis Penelitian...22
B. Lokasi Penelitian...22
commit to user
vii viii
D. Teknik Sampling...23
E. Rancangan Penelitian...23
F. Identifikasi Variabel Penelitian………..25
1. Variabel Bebas………..25
2. Variabel Terikat………....25
3. Variabel Luar………....25
G. Definisi Operasional Variabel Penelitian………...…....26
H. Alat dan Bahan Penelitian...28
I. Cara Kerja...29
J. Teknik Analisis Data Statistik...36
BAB IV HASIL PENELITIAN...37
A. Data Hasil Penelitian………..……….……37
B. Analisis Data………..……….…….38
BAB V PEMBAHASAN……….……42
BAB VI SIMPULAN DAN SARAN...49
A. Simpulan………..……….…....49
B. Saran……….………49
DAFTAR PUSTAKA
commit to user
1 BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Masyarakat saat ini cenderung untuk kembali ke alam (back to nature)
dan lebih memilih memakai substansi bioaktif alami untuk agen terapeutik
(Son et al., 2004). World Health Organization (WHO) juga memperkirakan
80% penduduk dunia saat ini bergantung pada pengobatan herbal dalam
aspek kesehatan primer (Ernest et al., 2007).
Propolis merupakan produk lebah madu kaya akan zat-zat essensial
yang bermanfaat bagi manusia. Propolis atau ’bee glue’ adalah suatu
substansi yang mengandung resin dan lilin lebah, bersifat lengket dan
dikumpulkan dari berbagai sumber tanaman, terutama pucuk daun dan bunga.
Komposisi propolis terdiri dari resin (50%), lilin (30%), minyak esensial
(10%), pollen (5%), dan sisanya adalah mineral, vitamin dan senyawa
organik lainnya (Sorkun et al,. 2001). Kandungan zat kimianya yang
kompleks mempunyai banyak manfaat bagi manusia, diantaranya adalah
sebagai antimikroba, antioksidan, imunitas tubuh, antibiotik, antiinflamasi,
antikanker, serta hepatoprotektor (Russo et al,. 2002).
Menurut catatan sejarah, penggunaan propolis sebagai obat sudah
dilakukan sejak abad ke-12. Orang-orang Yunani dan Romawi telah
menggunakan propolis untuk mengobati luka. Di Mesir selain sebagai obat,
commit to user
Krell (1996) menyatakan bahwa kandungan flavonoid yang tinggi di
dalam propolis berfungsi sebagai antioksidan dan antibiotik, dimana dapat
memperbaiki kondisi patologi dari bagian tubuh yang sakit, serta
meningkatkan sistem kekebalan tubuh baik humoral maupun seluler.
Berbagai penelitian juga menegaskan bahwa flavonoid dapat mencegah
terjadinya oksidasi oksigen akibat dari radikal bebas sehingga dapat
mencegah kerusakan organ tubuh, termasuk hepar. Pada antioksidan fenol
efektif untuk pertahanan tubuh melawan stres oksidatif (Russo et al., 2002).
Turunan asam fenolik yang berupa asam dicaffeoylquinic diketahui dapat
memberikan perlindungan terhadap kerusakan hati yang disebabkan oleh
alkohol (Basnett et al., 2003). Namun, penelitian tentang propolis di
Indonesia baru diketahui akhir-akhir ini karena penelitiannya yang belum
banyak dilakukan, sehingga penulis tertarik untuk melakukan penelitian
tentang efek hepatoprotektor pada propolis.
Penelitian akan dilakukan terhadap mencit (Mus musculus) yang
dirusak heparnya dengan parasetamol dosis toksik (Burke et al., 2006).
Peneliti memilih parasetamol karena penggunaannya yang sudah banyak di
masyarakat sehingga dapat menyebabkan semakin meluasnya penggunaan
parasetamol sebagai obat analgetik antipiretik (Sunarsih, 1995). Hal ini dapat
memicu penggunaan parasetamol yang salah, dalam dosis tinggi dan waktu
lama sehingga dapat menimbulkan efek samping yang tidak diinginkan,
commit to user
sel-sel hepar (Sheen et al., 2002). Hal ini disebabkan oleh metabolit
parasetamol berupa N-asetil-p-benzokuinon (NAPQI) yang tidak dapat
dinetralisir semuanya oleh glutation hepar. NAPQI bersifat toksik dan sangat
reaktif sehingga dapat menyebabkan terjadinya reaksi radikal bebas
(Wilmana dan Gunawan, 2007). Maka dari itu, diharapkan dari penelitian ini
pemberian propolis dapat mencegah kerusakan sel hepar mencit akibat
induksi parasetamol, serta dapat meningkatkan efek proteksinya.
B. Rumusan Masalah
Rumusan masalah pada penelitian ini adalah:
1. Apakah pemberian propolis dapat mencegah kerusakan sel hepar mencit
(Mus musculus) yang diinduksi parasetamol?
2. Apakah peningkatan dosis propolis dapat meningkatkan daya proteksi
terhadap kerusakan sel hepar mencit (Mus musculus) yang diinduksi
parasetamol?
C. Tujuan Penelitian
Penelitian ini bertujuan:
1. Untuk mengetahui efek pemberian propolis dalam mencegah kerusakan
sel hepar mencit (Mus musculus) yang diinduksi parasetamol.
2. Untuk mengetahui efek peningkatan dosis propolis dalam meningkatkan
daya proteksi terhadap kerusakan sel hepar mencit (Mus musculus) yang
commit to user D. Manfaat Penelitian
1. Manfaat Teoritis
a. Penelitian ini diharapkan dapat memberikan informasi ilmiah
mengenai pengaruh propolis dalam mencegah kerusakan sel hepar
mencit (Mus musculus)yang diinduksi parasetamol.
b. Penelitian ini diharapkan dapat berguna sebagai bahan acuan untuk
penelitian lebih lanjut.
2. Manfaat Aplikatif
Penelitian ini dapat dijadikan sebagai bahan pertimbangan bagi
masyarakat untuk menggunakan propolis sebagai obat alternatif untuk
commit to user
5
BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Hepar
Hepar atau hati adalah organ tubuh terbesar dan merupakan kelenjar
terbesar, dengan berat antara 1,2-1,8 kg atau kurang lebih 25% berat badan
orang dewasa. Hepar terletak pada rongga perut bagian bawah diafragma
dan menempati sebagian besar kuadran kanan atas abdomen. Hepar
merupakan pusat metabolisme tubuh dengan fungsi yang sangat kompleks,
dimana fungsinya dalam sistem sirkulasi adalah untuk menampung,
mengubah, menimbun metabolit, menetralisasi dan mengeluarkan substansi
toksik yang terbawa oleh aliran darah. Sebagian besar darah yang menuju
ke hepar dipasok dari vena porta dan sebagian kecilnya dipasok dari arteri
hepatika (Amirudin, 2007; Junqueira et al., 2005).
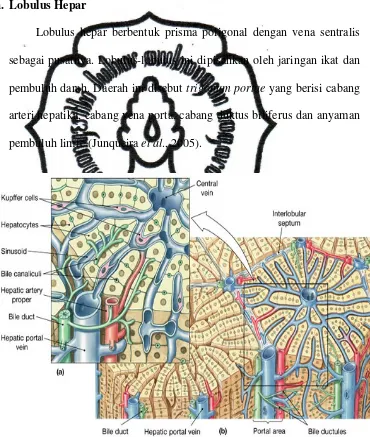
Makroskopis hepar terbagi atas beberapa lobus dan tiap lobusnya
terbagi lagi menjadi struktur yang dinamakan lobulus, yang merupakan unit
mikroskopis dan fungsional organ. Secara mikroskopis, di dalam hepar
manusia terdapat 50.000-100.000 lobuli. Setiap lobulus berbentuk
heksagonal dan terdiri dari lembaran-lembaran sel hepar berbentuk kubus
yang tersusun radial mengelilingi vena sentralis. Diantara lembaran sel
hepar, terdapat kapiler-kapiler yang disebut sinusoid, dimana merupakan
commit to user
arteri hepatika yang melingkari bagian perifer lobulus hepar, juga terdapat
saluran empedu yang membentuk kapiler empedu, yaitu kanalikuli empedu
yang berjalan diantara lembaran-lembaran sel hepar (Amirudin, 2007; Price
dan Wilson, 1994).
a. Lobulus Hepar
Lobulus hepar berbentuk prisma poligonal dengan vena sentralis
sebagai pusatnya. Lobulus-lobulus ini dipisahkan oleh jaringan ikat dan
pembuluh darah. Daerah ini disebut trigonum portae yang berisi cabang
arteri hepatika, cabang vena porta, cabang duktus biliferus dan anyaman
pembuluh limfe (Junqueira et al., 2005).
commit to user
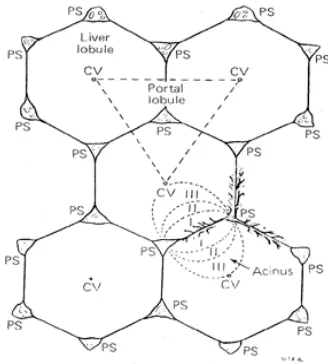
Secara fungsional, lobulus hepar dibagi dalam tiga zona:
1) Zona 1: zona aktif, sel-sel paling dekat dengan pembuluh darah,
akibatnya zona ini yang pertama kali dipengaruhi oleh
perubahan darah yang masuk.
2) Zona 2: zona intermedia, sel-selnya memberi respon kedua terhadap
darah.
3) Zona 3: zona pasif, aktivitas sel-selnya rendah dan tampak aktif bila
kebutuhan meningkat (Leeson et al., 1996).
Gambar 2. Pembagian Zona Lobulus Hepar (Junqueira et al., 2005)
b.Parenkim Hepar
Parenkim hepar terdiri atas sel-sel hepar (hepatosit) yang tersusun
berderet secara radier di dalam lobulus hepar. Lempeng-lempeng
hepatosit ini secara radial bermula dari tepian lobulus menuju ke vena
sentralis sebagai pusatnya. Lempeng-lempeng tersebut bercabang dan
beranastomosis bebas. Sel hepar berbentuk poligonal dengan enam atau
commit to user
bulat atau lonjong dengan permukaan teratur dan besarnya bervariasi.
Permukaan sel hepar kontak dengan dinding sinusoid melalui celah
Disse dan kontak dengan permukaan hepatosit lain (Junqueira et al.,
2005; Lesson et al., 1996).
c. Sinusoid Hepar
Sinusoid merupakan pembuluh melebar yang tidak teratur dan
hanya terdiri dari satu lapis endotel yang tidak kontinyu. Sinusoid
terdapat diantara lempeng-lempeng sel hepar dan mengikuti
percabangannya, serta mempunyai pembatas yang tidak sempurna
sehingga memungkinkan terjadi pengaliran makromolekul dengan
mudah dari lumen ke sel-sel hepar dan sebaliknya. Sinusoid dikelilingi
dan disokong oleh selubung serabut retikuler halus untuk
mempertahankan bentuknya. Sel-sel endotel dipisahkan dari hepatosit
yang berdekatan oleh celah subendotel yang disebut celah Disse
(Eroschenko, 2000).
Pada sinusoid terdapat sel-sel fagosit dari retikuloendotelial yang
dikenal sebagai sel Kupffer, selnya berbentuk stelat, bervakuola jernih,
lisosom dan retikuloendoplasmanya granular yang tersebar di seluruh
sitoplasma. Inilah yang membedakan sel-sel Kupffer dengan sel-sel
endotel. Pada ruang-ruang sinusoid berbeda dengan kapiler, dimana
garis tengahnya lebih besar (9-12 um) dan sel pembatasnya tidak seperti
endotel biasa. Kemudian lamina basal pada sinusoid terputus-putus
commit to user 2. Parasetamol
Asetaminofen (parasetamol) merupakan metabolit fenasetin yang
memiliki efek antipiretik yang sama dan telah digunakan sejak tahun 1893
(Wilmana dan Gunawan, 2007). Di Indonesia, parasetamol tersedia sebagai
obat bebas dan dapat dengan mudah mendapatkannya. Parasetamol
bertanggung jawab atas efek analgesik dan antipiretiknya, serta tidak
termasuk golongan AINS karena efek antiinflamasinya yang sangat kecil.
Efek antipiretik parasetamol ditimbulkan oleh gugus aminobenzen.
Parasetamol bekerja dengan menghambat sintesa prostaglandin dalam
susunan saraf pusat yang mempengaruhi pusat hipotalamus untuk
pengontrolan suhu tubuh. Efek analgesiknya yaitu menghilangkan atau
mengurangi nyeri ringan sampai sedang seperti nyeri kepala, mialgia dan
keadaan lain. Sebaiknya parasetamol tidak diberikan terlalu lama karena
dapat menimbulkan nefropati analgesik. Parasetamol tidak menimbulkan
gangguan pernafasan dan keseimbangan asam basa. Reaksi alergi karena
parasetamol jarang terjadi, yaitu berupa eritema atau urtikaria. Parasetamol
juga dapat menyebabkan anemia hemolitik, terutama pemakaian kronik. Hal
ini dapat terjadi karena mekanisme autoimun, defisiensi G6PD dan metabolit
yang abnormal (Katzung, 2004; Wilmana dan Gunawan, 2007).
Parasetamol diberikan secara peroral, dimana absorbsinya cepat dan
sempurna melalui saluran cerna, tergantung pada kecepatan pengosongan
lambung (Katzung, 2004). Konsentrasi tertinggi dalam plasma dicapai dalam
commit to user
seluruh cairan tubuh. Dalam plasma, 25% parasetamol terikat oleh protein
plasma dan sebagian lagi dimetabolisme oleh enzim mikrosom hati. Pada
kondisi normal parasetamol mengalami glukoronidasi dan sulfasi, 80% akan
dikonjugasi dengan asam glukoronat dan sebagian kecilnya dengan asam
sulfat, kemudian hasil akhirnya akan dieliminasi lewat urin. Selain itu, dalam
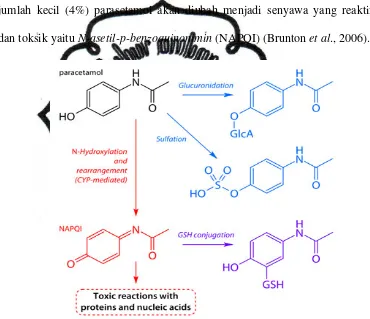
jumlah kecil (4%) parasetamol akan diubah menjadi senyawa yang reaktif
dan toksik yaitu N-asetil-p-benzoquinonimin (NAPQI) (Brunton et al., 2006).
Gambar 3. Metabolisme Parasetamol Dosis Toksik Menjadi NAPQI
(Mycek et al., 2001)
Kemudian oleh glutation hati, NAPQI akan segera diubah menjadi
metabolit sistin dan merkapturat yang non toksik. Namun pada dosis tinggi,
jalur konjugasi parasetamol akan menjadi jenuh sehingga banyak yang
commit to user
glutation hati dapat habis (paling tidak berkurang 20-30% dari normal)
(Rochmah, 2000). Akibatnya NAPQI membentuk ikatan kovalen dengan
protein sel hati secara irreversibel sehingga menyebabkan terjadinya
kematian sel atau nekrosis sel hati. Nekrosis tubular ginjal dapat juga terjadi
(Mycek et al., 2001). Metabolit ini juga dapat menyebabkan pengikatan
kovalen pada makromolekul seperti DNA, RNA dan protein. Jika demikian,
maka dapat berakibat buruk terhadap fungsi sel yang akan segera terlihat
nyata (Murray et al., 2003).
Parasetamol aman diberikan dengan dosis 325-500 mg 4 kali sehari
pada orang dewasa dan untuk anak-anak dalam dosis yang lebih kecil yang
sebanding (Katzung, 2004). Pemberian parasetamol juga dapat menimbulkan
efek samping, namun tergantung pada dosis yang diberikan. Akibat dari dosis
toksik parasetamol yang paling serius adalah nekrosis hati, nekrosis tubulus
renalis, serta koma hipoglikemi. Hepatotoksisitas dapat terjadi apabila
pemberian dosis tunggal 10-15 gram (200-250 mg/kg BB) setelah 48 jam
menelan parasetamol. Kerusakan yang timbul berupa nekrosis sentrolobularis
(Wilmana dan Gunawan, 2007). Dosis 20-25 gram atau lebih dapat berakibat
fatal. Sekitar 10% pasien keracunan yang tidak mendapatkan pengobatan
spesifik akan berakibat buruk menjadi kerusakan hati yang hebat, 10-20%
akhirnya meninggal karena kegagalan fungsi hati. Kegagalan ginjal akut juga
terjadi pada beberapa pasien (Suarsana dan Budiasa, 2005). Hepatotoksisitas
karena parasetamol pada manusia pertama kali dilaporkan pada tahun 1966
commit to user 3. Propolis
Gambar 4. Lebah Madu Menggunakan Propolis Sebagai Pertahanan
Sarangnya Terhadap Ancaman Dari luar (Krell, 1996)
Propolis berasal dari bahasa Yunani yaitu pertahanan kota, dimana
digunakan oleh lebah sebagai pertahanan sarang terhadap ancaman virus,
bakteri, jamur, serangga, cuaca, serta memperkuat stabilitas stuktural sarang
lebah (Brumfitt et al,. 2000). Propolis atau ‘bee glue’ adalah suatu substansi
resin dan lilin lebah, yang dikumpulkan oleh lebah dari berbagai sumber
tanaman, terutama dari bunga dan pucuk daun (Suranto, 2010). Sifatnya
pekat, lengket, biasanya berwarna coklat kehitaman, mempunyai bau yang
khas dan rasanya agak pahit (Toprakci, 2005).
Komposisi propolis terdiri dari resin 50%, lilin dan asam lemak 30%,
minyak essensial 10%, pollen 5%, serta sisanya mineral, vitamin dan zat-zat
organik lainnya (Sorkun et al,. 2001). Namun karena dari sumber dan waktu
pengambilan yang berbeda-beda, maka warna, komposisi dan aroma dari
propolis dapat bervariasi (Brown, 2009). Propolis diketahui mengandung
commit to user
kecuali vitamin K, semua mineral kecuali sulfur, rantai asam amino esensial,
serta zat aktif lainnya (Marcucci, 1995).
Sebagai produk organik yang dihasilkan oleh lebah, penggunaan
propolis sebagai obat sudah dilakukan sejak abad ke-12. Di Yunani dan
Romawi, propolis telah dikenal sebagai pengobatan berbagai luka dan semua
zat-zat beracun. Orang Mesir menggunakan propolis selain sebagai obat, juga
menggunakannya untuk simbol keagamaan. Hipocrates bapak kedokteran
modern (460-377SM), sering mengobati luka dan tukak dengan
menggunakan propolis, baik untuk luka dalam maupun luar tubuh. Pada
perang Boer (1888-1902) antara penduduk Afrika Selatan dan Inggris,
propolis digunakan untuk membersihkan dan menyembuhkan luka dengan
cepat (Awan, 2009).
Penelitian tentang propolis mulai berkembang setelah ditemukannya
seekor tikus yang mati dalam sarang lebah lebih dari 5 tahun tidak mengalami
pembusukan (Wikipedia, 2011). Kini dengan dukungan riset dan teknologi,
telah membawa manusia menemukan manfaat propolis dalam berbagai segi
kehidupan, yaitu:
• Kosmetik dan kesehatan kulit
• Industri makanan
• Pestisida dan pengawet alami
• Industri lain
commit to user
Pada penelitian farmakologi, efek propolis mencakup sebagai anestetik,
antialergi, antibiotik, antijamur, antiperadangan, antiradiasi, pengawet,
antiseptik, antikanker, immunostimulator, serta antioksidan (Suranto, 2010).
Kandungan flavonoid dalam propolis yang berupa pinocembrin,
pinostrobin dan ester asam kafeat, dapat berkhasiat sebagai anestetik.
Khususnya pinocembrin dan ester asam kafeat, yang terbukti mempunyai efek
anestetik sepersepuluh kali daripada lidokain (Suranto, 2010).
Aktifitas antibiotik dari propolis antara lain disebabkan oleh berbagai
turunan asam organik seperti cinnamic, ferrulic, benzoic, caffeic, coumaric,
terpenes dan turunan-turunan berikutnya seperti limonene, p-cymene, eugenol,
galangin dan quercetin (Faten et al., 2002). Kelebihan propolis dibanding
antibiotik lainnya adalah efek sampingnya yang sangat kecil dan tidak
menimbulkan resistensi. Asam ferulat selain efektif terhadap bakteri gram
positif dan negatif, juga bersifat agglutinating (sebagai pembekuan darah)
(Santoso, 2010). Pada pinocembrin, quercetin dan sakauranetin dapat bersifat
sebagai antifungal (Rumah madu, 2010). Quercetin diketahui juga bersifat
sebagai antialergi (Suranto, 2010).
Ikatan fenol yang dikenal sebagai Caffeic Acid Phenethyl Ester (CAPE),
berfungsi sebagai antikanker. Ini dibuktikan oleh S. Scheller, dkk yang
menguji efektifitas antikanker dari ekstrak etanol propolis (EEP) pada mencit
yang diinduksi dengan Ehrlich Carcinoma Cells, menunjukkan mencit dapat
commit to user
Ehrlich Carcinoma Cells ini juga berkaitan dengan kandungan flavonoid yang
terdapat dalam propolis (Grunberger et al., 2008).
Propolis juga efektif digunakan sebagai pencuci mulut, sudah dilakukan
di Brazil dan Jepang. Bahkan pasien bedah mulut di Jepang menggunakan
propolis sebagai pencuci mulut, khasiatnya lebih cepat sembuh dibanding
dengan pencuci mulut pabrik. Propolis yang dicampur madu terbukti
menyembuhkan luka lebih cepat dari Silver Sulfadiazine (Scott et al,. 2002).
Propolis mengandung zat-zat aktif yang dapat berperan melindungi hepar
dari kerusakan (hepatoprotektor), baik melalui peningkatan glutation maupun
sebagai antioksidan. Antioksidan merupakan senyawa yang mampu menangkal
atau meredam dampak negatif oksidan di dalam tubuh, dengan cara
mendonorkan satu elektronnya kepada senyawa yang bersifat oksidan sehingga
kerusakan sel dapat dihambat (Winarsi, 2007). Beberapa senyawa yang
diketahui sebagai antioksidan di dalam propolis diantaranya adalah flavonoid,
fenol, vitamin (A, C dan E), beberapa mineral (Se, Zn, Cu, Fe, Mn), asam
ferulik dan caffeic, serta zat aktif lainnya (Krell, 1996).
Menurut penelitian, kandungan flavonoid dalam satu tetes propolis setara
dengan flavonoid yang dihasilkan dari 500 buah jeruk (Wikipedia, 2011).
Flavonoid merupakan senyawa polifenol yang diketahui dapat menghambat
oksidasi lipid dan pembentukan lipid peroksida melalui mekanisme
penangkapan radikal bebas dan metal chelation (Hegazi dan El-Hady, 2007).
commit to user
antioksidan dan antibiotik yang dapat menguatkan dan mengantisipasi terhadap
kerusakan jaringan, serta meningkatkan tumbuhnya jaringan. Dari hasil
penelitian pada ekstrak propolis, ditemukan bahwa terdapat empat senyawa
dari asam dicaffeoylquinic yang dapat melindungi hati dari kerusakan
(hepatoprotektor) akibat alkohol (Basnett et al., 2003). Bankova et al. (2006)
menambahkan bahwa ekstrak propolis berperan sebagai antioksidan karena
mengandung kafeik dan asam ferulik beserta esternya.
4. Mikroskopis Kerusakan Sel Hepar Setelah Pemberian Parasetamol Dosis
Toksik
Hepar memiliki kapasitas regenerasi yang luar biasa karena paling sering
menerima jejas. Pada jejas ringan, hepar dapat segera beregenerasi kembali
pada fungsi semula. Namun kapasitas cadangan hepar dapat habis apabila
hepar terkena penyakit yang menyerang seluruh parenkim hepar sehingga dapat
timbul kerusakan pada hepar (Crawford, 2007). Kerusakan stuktur hepar dapat
disebabkan oleh berbagai macam zat, diantaranya adalah alkohol, zat halotan
(CCL4), zat kimia makanan, serta obat-obatan (Murray et al., 2003).
Pada kondisi normal, parasetamol dikonjugasikan dengan asam
glukoronat dan asam sulfat, lalu sebagian kecilnya dihidroksilasi oleh sitokrom
P-450 menjadi metabolit N-asetil-p-benzoquinonimin (NAPQI). Oleh glutation
hepar, metabolit ini akan diubah menjadi metabolit sistin dan merkapturat,
kemudian hasil akhir dibuang melalui urin (Wilmana dan Gunawan, 2007).
commit to user
cadangan asam glukoronat dan asam sulfat dalam hepar akan habis sehingga
terbentuklah metabolit reaktif yang berlebihan. Selama glutation tersedia untuk
mendetoksifikasi NAPQI tersebut, maka tidak akan terjadi reaksi radikal bebas.
Namun, jika glutation terus terpakai hingga akhirnya terjadi pengosongan
glutation dan penimbunan metabolit NAPQI (Katzung, 2004).
NAPQI merupakan metabolit minor parasetamol yang reaktif dan toksik
bagi hepar dan ginjal. Metabolit ini akan bereaksi dengan makromolekul sel
hepar, seperti protein sehingga dapat menyebabkan nekrosis sel hepar
(Wilmana dan Gunawan, 2007). Selain itu, NAPQI dapat menimbulkan stres
oksidatif sehingga juga dapat menyebabkan peroksidasi lipid. Dimana
peroksidasi lipid merupakan bagian dari proses atau rantai reaksi terbentuknya
dari radikal bebas (chain reaction). (Widjaja, 1997).
Kerusakan hepar akibat parasetamol dapat terjadi karena toksik, alergi
dan radikal bebas. Biasanya kerusakan yang terjadi merupakan nekrosis di
sekitar sentrolobularis karena aktivitas sitokrom P-450 paling banyak terdapat
didaerah tersebut (Wenas, 1996). Kematian sel dapat terjadi bersamaan dengan
pecahnya membran plasma. Perubahan morfologis awal berupa edema
sitoplasma, dilatasi retikulum endoplasma dan disagregasi polisom. Terjadi
akumulasi trigliserid sebagai butiran lemak dalam sel dan terjadi
pembengkakan mitokondria yang progresif dengan kerusakan krista. Stadium
selanjutnya, sel dapat mengalami degenerasi hidropik, fragmentasi sel, dan inti
sel piknotik (kariopiknotik). Kemudian inti sel hancur dan membentuk
commit to user
karioreksis. Pada akhirnya kromatin basofil menjadi pucat (kariolisis) dan
terjadilah penghancuran serta pelarutan inti sel sehingga inti sel menghilang,
membran plasma pecah, dan terjadilah nekrosis sel (Wilson, 2006).
5. Mekanisme Perlindungan Propolis terhadap Kerusakan Sel Hepar akibat
Induksi Parasetamol
Propolis mengandung berbagai jenis zat aktif yang dapat meningkatkan
kadar glutation dan bersifat sebagai antioksidan. Kandungan antioksidan di
dalam propolis diantaranya adalah flavonoid, fenol, asam dicaffeoylquinic,
asam caffeic dan ferulik, vitamin C, E dan A, mineral Se, fe, Cu dan Zn, serta
asam amino essensial (Krell, 1996). Senyawa antioksidan tersebut mampu
meredam dampak negatif dari oksidan dengan cara memberikan elektronnya
sehingga dapat mengubah oksidan menjadi molekul yang tidak berbahaya
(Bagiada, 1995). Antioksidan juga dapat mencegah pembentukan radikal bebas
dan memperbaiki kerusakan yang terjadi (Widjaja, 2007).
Flavonoid merupakan sekelompok senyawa polifenol tanaman yang
tersebar luas dalam berbagai konsentrasi. Senyawa flavonoid dapat
menghambat oksidasi lipid dan pembentukan lipid peroksida melalui
mekanisme penangkapan radikal bebas (Hegazi dan El-Hady, 2007).
Disamping itu, flavonoid memiliki afinitas yang sangat kuat terhadap ion Fe
(Fe diketahui dapat mengkatalisis beberapa beberapa proses yang
menyebabkan terbentuknya radikal bebas). Aktivitas antiperoksidatif flavonoid
commit to user
Zat besi (Fe) dan seng (Zn) adalah kandungan mineral terbanyak
yang terdapat di dalam propolis (Suranto, 2010), yang berfungsi sebagai
kofaktor SOD (Superoksida Dismutase). Kofaktor adalah suatu elemen
yang dengannya suatu faktor lain harus bersatu untuk dapat berfungsi.
Selenium (Se) berperan sebagai kofaktor enzim yang terlibat dalam
oksidasi asam lemak (Hartanto et al., 2000). Vitamin E merupakan
vitamin yang larut dalam lemak, berperan dalam menghambat peroksidasi
lipid sehingga dapat mencegah kerusakan sel membran yang lebih lanjut.
Pada vitamin C bekerja sebagai donor elekron, dengan cara memindahkan
satu elektronnya. Vitamin C berinteraksi dengan senyawa radikal bebas di
bagian cairan sel, karena senyawa ini mudah larut dalam air. Selain itu,
vitamin C juga berperan sebagai penyetabil keberadaan vitamin E
(Almatsier, 2002). Senyawa fenol, asam caffeic dan ferulik, asam
dicaffeoilquinic beserta esternya, dan vitamin A bermanfaat dalam
commit to user
Variabel luar yang tak terkendali: kondisi psikologis, keadaan awal hepar dan reaksi
commit to user C. Hipotesis
Hipotesis pada penelitian ini adalah:
1. Pemberian propolis dapat mencegah kerusakan sel hepar mencit (Mus
musculus) yang terpapar parasetamol.
2. Peningkatan dosis propolis dapat meningkatkan efek proteksi terhadap
commit to user
22 BAB III
METODE PENELITIAN
A. Jenis Penelitian
Penelitian ini bersifat eksperimental laboratorik.
B. Lokasi Penelitian
Penelitian dilakukan di Laboratorium Histologi Fakultas Kedokteran
Universitas Sebelas Maret Surakarta.
C. Subjek Penelitian
Populasi : Mencit jantan dengan galur Swiss webster berusia 2-3 bulan
dengan berat badan ± 20 gram.
Sampel : Jumlah sampel yang digunakan berdasarkan rumus Federer
(Ratnasari, 2009) yaitu:
(k-1)(n-1) > 15
(4-1)(n-1) > 15
3(n-1) > 15
3n > 15 + 3
n > 6 ≈ 7
Keterangan:
k : jumlah kelompok
commit to user
Pada penelitian ini jumlah sampel untuk tiap kelompok adalah sebanyak
7 ekor mencit (n > 6). Jumlah kelompok mencit ada 4, sehingga pada
penelitian ini membutuhkan 28 ekor mencit dari populasi yang ada.
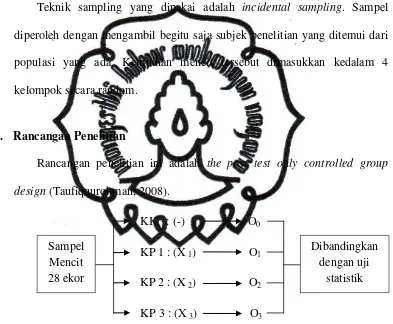
D. Teknik Sampling
Teknik sampling yang dipakai adalah incidental sampling. Sampel
diperoleh dengan mengambil begitu saja subjek penelitian yang ditemui dari
populasi yang ada. Kemudian mencit tersebut dimasukkan kedalam 4
kelompok secara random.
E. Rancangan Penelitian
Rancangan penelitian ini adalah the post test only controlled group
design (Taufiqqurohman, 2008).
KK : (-) O0
KP1 : (X 1) O1
KP2 : (X 2) O2
KP 3 : (X 3) O3
Gambar 5. Skema Rancangan Penelitian
Keterangan:
KK : Kelompok kontrol tanpa diberi propolis maupun parasetamol.
KP 1 : Kelompok perlakuan 1 diberi parasetamol tanpa diberi propolis.
KP 2 : Kelompok perlakuan 2 diberi parasetamol dan propolis dosis I.
commit to user
(-) : Pemberian aquades peroral 0,1 ml/20 gr BB mencit setiap hari
selama 14 hari berturut-turut.
(X 1) : Pemberian aquades peroral 0,1 ml/20 gr BB mencit setiap hari
selama 14 hari berturut-turut dan pada hari ke-12, 13 dan 14 diberi
parasetamol 0,1 ml/20 gr BB mencit perhari.
(X 2) : Pemberian propolis peroral dosis I yaitu 0,0104 ml/20 gr BB
mencit selama 14 hari berturut-turut dan pada hari ke-12, 13 dan 14
diberi parasetamol 0,1 ml/20 gr BB mencit 1 jam setelah pemberian
propolis.
(X 3) : Pemberian propolis peroral dosis II yaitu 0,0208 ml/20 gr BB
mencit selama 14 hari berturut-turut dan pada hari ke-12, 13 dan 14
diberi parasetamol 0,1 ml/20 gr BB mencit 1 jam setelah
pemberian propolis.
O0 : Pengamatan jumlah inti sel hepar piknosis, karioreksis dan kariolisis
dari 100 sel di sentrolobuler hepar kelompok kontrol.
O1 : Pengamatan jumlah inti sel hepar piknosis, karioreksis dan kariolisis
dari 100 sel di sentrolobuler hepar kelompok perlakuan 1.
O2 : Pengamatan jumlah inti sel hepar piknosis, karioreksis dan kariolisis
dari 100 sel di sentrolobuler hepar kelompok perlakuan 2.
O3 : Pengamatan jumlah inti sel hepar piknosis, karioreksis dan kariolisis
commit to user
Pada hari ke-15 setelah diberikan perlakuan, semua hewan percobaan
dikorbankan dengan cara dislokasi vertebra servicalis agar efek dari
perlakuan masih tampak nyata. Selanjutnya dilakukan proses pembuatan
preparat hepar dengan metode blok parafin dan pengecatan hematoksilin
eosin (HE).
F. Identifikasi Variabel Penelitian
1. Variabel Bebas
Pemberian propolis
2. Variabel Terikat
Kerusakan sel hepar mencit (Mus musculus)
3. Variabel Luar
Variabel luar terdiri dari variabel yang dapat dikendalikan dan yang tidak
dapat dikendalikan
a. Variabel luar yang dapat dikendalikan
Variasi genetik, jenis kelamin, umur, berat badan, dan jenis makanan
mencit semuanya diseragamkan.
b. Variabel luar yang tidak dapat dikendalikan
Kondisi psikologis, reaksi hipersensitivitas, dan keadaan awal hepar
commit to user G. Definisi Operasional Variabel Penelitian
1. Variabel bebas : pemberian propolis.
Propolis yang dipakai dalam penelitian ini adalah propolis cair asli
Indonesia, dengan nama dagang PropolisKU. Setiap 1 ml propolis
mengandung 150 mg ekstrak propolis asli Indonesia dengan zat aktif
flavonoid tidak kurang dari 3%. Dalam proses ekstraksi maupun seluruh
tahap produksinya tidak menggunakan alkohol sehingga aman untuk
dikonsumsi ibu hamil dan anak, penduduk di negara muslim, atau
konsumen yang memiliki faktor kesehatan tertentu (Suranto, 2010).
Propolis diberikan peroral dengan sonde lambung (ukuran 1,0 ml)
dalam 2 dosis mencit dalam 2 dosis, yaitu:
Dosis I : 0,0104 ml/20 gr BB mencit yang diencerkan hingga 0,2 ml
diberikan pada mencit KP 2.
Dosis II : 0,0208 ml/20 gr BB mencit yang diencerkan hingga 0,4 ml
diberikan pada mencit KP 3.
Skala pengukuran variabel ini adalah ordinal.
2. Variabel terikat : kerusakan sel hepar mencit (Mus musculus)
Kerusakan sel hepar mencit adalah gambaran mikroskopis sel hepar
mencit yang diinduksi parasetamol setelah diberi propolis. Hal ini dinilai
dari jumlah sel hepar yang mengalami piknosis, karioreksis dan kariolisis
yang dihitung dari 100 sel pada zona sentrolobuler. Kemudian dari
jumlah sel yang mengalami kerusakan dihitung jumlah skor
commit to user Adapun tanda-tanda kerusakan sel :
a. Sel yang mengalami piknosis intinya kisut dan bertambah basofil,
berwarna gelap batasnya tidak teratur.
b. Sel yang mengalami karioreksis inti mengalami fragmentasi atau
hancur degan meninggalkan pecahan-pecahan zat kromatin yang
tersebar di dalam sel.
c. Sel yang mengalami kariolisis yaitu kromatin basofil menjadi pucat,
inti sel kehilangan kemampuan untuk diwarnai dan menghilang begitu
saja (Wilson, 2006).
Pada penelitian ini, masing-masing dari derajat kerusakan diberi
skor 1. Skala pengukuran variabel ini adalah rasio.
3. Variabel Luar
a. Variabel luar yang dapat dikendalikan. Variabel ini dapat
dikendalikan melalui homogenisasi.
1) Variasi genetik
Jenis hewan coba yang digunakan adalah mencit dengan galur
Swiss webster.
2) Jenis kelamin
Jenis kelamin mencit yang digunakan adalah jantan.
3) Umur
commit to user 4) Berat badan
Berat badan hewan percobaan + 20 gr.
5) Jenis makanan
Makanan yang diberikan berupa pellet dan minuman dari air PAM
(Perusahaan Air Minum).
b. Variabel luar yang tidak dapat dikendalikan.
1) Kondisi psikologis mencit dipengaruhi oleh lingkungan sekitar.
Lingkungan yang terlalu ramai dan gaduh, pemberian perlakuan
yang berulang kali dan perkelahian antar mencit dapat
mempengaruhi kondisi psikologis mencit.
2) Reaksi hipersensitivitas dapat terjadi karena adanya variasi
kepekaan mencit terhadap zat yang digunakan.
3) Keadaan awal hepar mencit tidak diperiksa pada penelitian ini
sehingga mungkin saja ada mencit yang sebelum perlakuan
heparnya sudah mengalami kelainan.
H. Alat dan Bahan Penelitian
1. Alat
a. Kandang mencit 4 buah masing-masing untuk 7 ekor mencit
b. Timbangan hewan
c. Timbangan obat
d. Alat bedah hewan percobaan (scalpel, pinset, gunting, jarum, meja
commit to user
e. Sonde lambung
f. Alat untuk pembuatan preparat histologi
g. Mikroskop cahaya medan terang
h. Gelas ukur dan pengaduk
i. Optilab
2. Bahan
a. Parasetamol
b. Makanan hewan percobaan (pellet)
c. Aquades
d. Bahan untuk pembuatan preparat histologi dengan pengecatan HE
(Hematoksilin Eosin)
e. Propolis
I. Cara Kerja
1. Dosis dan Pengenceran Propolis
Propolis yang digunakan dalam penelitian ini adalah propolis cair
dengan nama dagang propolisKU. Setiap 1 ml propolis mengandung 150
mg ekstrak propolis. Pada manusia, dosis konsumsi propolis untuk
perawatan atau pemeliharaan kesehatan adalah dua sendok makan sehari
atau setara dengan 400-600 mg ekstrak propolis per hari (Suranto, 2010).
Penentuan dosis yang diberikan kepada mencit adalah berdasarkan pada
hasil konversi dari manusia ke mencit (Ngatidjan, 1991), yang setara
commit to user
berat badan 70 kg. Dosis pemberian propolis ini dibedakan dalam dua
dosis, yaitu dosis I = 0,0104 ml/20 gr BB mencit dan dosis II = 0,0208
ml/20 gr BB mencit. Masing-masing dosis propolis yang diberikan dengan
menggunakan sonde lambung (ukuran 1,0 ml) adalah propolis yang telah
diencerkan dengan aquades menjadi volume 0,2 ml dan 0,4 ml. Propolis
dosis I diberikan pada KP 2 sehari sekali selama 14 hari berturut-turut,
sedangkan propolis dosis II diberikan pada KP 3 sehari sekali selama 14
hari berturut-turut.
Perhitungan dosis propolis :
a. Dosis I propolis setara dengan 600 mg ekstrak propolis pada manusia.
1 ml Propolis mengandung 150 mg ekstrak propolis
4 ml Propolis mengandung 600 mg ekstrak propolis
Dosis I = Nilai konversi x 4 ml propolis
= 0,0026 x 4 ml
Pengenceran Propolis:
5,2 ml propolis + aquades 100 ml larutan propolis
Dalam 1 ml larutan mengandung 0,052 ml propolis
Dalam 0,2 ml larutan mengandung 0,0104 ml propolis
Propolis yang disondekan adalah propolis yang diencerkan. Propolis
yang disondekan pada 1 ekor mencit (20 gr) pada KP 2 sebanyak 0,2 ml
commit to user b. Dosis II propolis
Propolis dosis II adalah 2 kali propolis dosis I. Jadi, propolis yang
disondekan pada 1 ekor mencit (20 g) pada KP 3 sebanyak 0,4 ml dan
diberikan selama 14 hari berturut-turut.
Pemberian propolis selama 14 hari berturut-turut bertujuan untuk
memberikan cadangan glutation di hepar sehingga ketika diinduksi
parasetamol dosis toksik, glutation dalam hepar tidak habis dan kerusakan
hepar dapat dicegah. Di luar jadwal perlakuan, mencit diberi makan pellet
dan minum air PAM ad libitum.
2. Dosis dan pengenceran Parasetamol
Dosis fatal (LD-50/Lethal Dossage-50) untuk mencit peroral yang telah
diketahui adalah 338 mg/kg BB atau 6,76 mg/20 gr BB mencit (Wishart dan
Knox, 2006). Dosis parasetamol yang digunakan untuk menimbulkan efek
kerusakan hepar berupa nekrosis sel hepar tanpa menyebabkan kematian
mencit adalah dosis 3/4 LD-50 perhari (Alberta dan Canada dalam Ratnasari,
2009). Dosis yang digunakan adalah 338 mg/Kg BB × 0,75 = 253,5 mg/Kg
BB = 5,07 mg/20 gr BB mencit. Parasetamol 500 mg dilarutkan dalam
aquades hingga 9,86 ml, sehingga dalam 0,1 ml larutan parasetamol
mengandung 5,07 mg parasetamol.
Parasetamol diberikan selama 3 hari berturut-turut yaitu pada hari ke-12,
13 dan 14. Pemberian parasetamol dengan cara ini bertujuan untuk
menimbulkan kerusakan berupa nekrosis sel hepar yang berupa nekrosis pada
commit to user
Wilmana dan Gunawan (2007) pemberian parasetamol dosis tunggal sudah
dapat menimbulkan kerusakan sel hepar berupa nekrosis pada daerah
sentrolobularis dalam waktu 2 hari setelah pemberian parasetamol.
3. Persiapan Mencit
Mencit diadaptasikan terlebih dahulu selama tujuh hari di Laboratorium
Histologi, Fakultas Kedokteran Universitas Sebelas Maret, Surakarta. Sesudah
adaptasi, keesokan harinya dilakukan penimbangan untuk menentukan dosis
dan dilakukan perlakuan.
4. Pengelompokan Subjek
Pada minggu kedua mulai dilakukan percobaan. Subjek dikelompokkan
menjadi empat kelompok secara random, dan masing-masing kelompok terdiri
dari 7 mencit. Adapun pengelompokan subjek adalah sebagai berikut:
a. KK : Kelompok kontrol diberi aquades peroral sebanyak 0,1 ml/20 gr
BB mencit setiap hari selama 14 hari berturut-turut.
b. KP 1 : Kelompok perlakuan 1 diberi aquades peroral sebanyak
0,1 ml/20 gr BB mencit setiap hari selama 14 hari berturut-turut
dan pada hari ke-12, 13 dan 14 juga diberi parasetamol 0,1 ml/20
gr BB mencit peroral perhari.
c. KP 2 : Kelompok perlakuan 2 diberi propolis peroral dosis I yaitu 0,0104
ml/20 gr BB mencit selama 14 hari berturut-turut, dimana pada
hari ke-12, 13, dan 14 diberi parasetamol 0,1 ml/20 gr BB mencit 1
commit to user
d. KP 3 : Kelompok perlakuan 3 diberi propolis peroral dosis II yaitu 0,0208
ml/20 gr BB mencit selama 14 hari berturut-turut, dimana pada
hari ke-12, 13, dan 14 diberi parasetamol 0,1 ml/20 gr BB mencit 1
jam setelah pemberian propolis.
Setiap sebelum pemberian parasetamol dan propolis, mencit dipuasakan
dahulu ± 5 jam untuk mengosongkan lambung. Pemberian parasetamol
dilakukan ± 1 jam setelah pemberian propolis agar terabsorbsi terlebih dahulu.
5. Pemberian Perlakuan
Gambar 6. Skema Langkah-langkah Penelitian Aquades 0,1ml/20 gr BB mencit
Sampel 28 ekor mencit
Kelompok
Dipuasakan selama + 5 jam
Setelah + 1 jam
Perlakuan diberikan sampai hari ke-14. Pembuatan preparat dilakukan pada hari ke-15. 0,1 ml parasetamol dosis 5,07mg / 20 grBB mencit pada hari ke-12, 13, 14 Aquades 0,1ml/20 gr
commit to user 6. Pengukuran hasil
Pada hari ke-15 setelah perlakuan pertama diberikan, semua hewan
percobaan dikorbankan dengan cara dislokasi vertebra servicalis,
kemudian organ hepar diambil untuk selanjutnya dibuat preparat histologi
dengan metode blok paraffin dengan pengecatan HE. Pembuatan preparat
dilakukan pada hari ke-15 agar efek perlakuan tampak nyata. Lobus hepar
yang diambil adalah lobus kanan dan irisan untuk preparat diambil pada
bagian tengah dari lobus tersebut, hal ini dilakukan untuk mendapatkan
preparat yang seragam. Dari tiap lobus kanan hepar dibuat 3 irisan dengan
tebal tiap irisan 3-8 um. Jarak antar irisan satu dengan yang lain kira-kira
25 irisan.
Tiap hewan percobaan dibuat 3 preparat. Dari masing-masing
preparat diambil 1 daerah di sentrolobuler yang terlihat kerusakannya
paling berat. Dari 1 zona tersebut akan didapatkan 1 skor untuk tiap 100
sel sentrolobuler. Sehingga didapatkan 3 skor dari 1 hewan percobaan.
Dalam percobaan ini menggunakan 7 hewan percobaan dalam tiap
kelompoknya sehingga akan diperoleh 21 skor untuk tiap kelompok
percobaan. Pengamatan preparat dengan pembesaran 100 kali dan 400 kali
untuk mengamati seluruh lapang pandang, kemudian ditentukan daerah
yang akan diamati pada sentrolobuler lobulus hepar dan dipilih 1 daerah
commit to user
Dari tiap zona sentrolobuler lobulus hepar tersebut dengan
pembesaran 1000 kali kemudian ditentukan jumlah inti yang mengalami
piknosis, karyoreksis dan karyolisis dari tiap 100 sel.
Hasil yang diperoleh kemudian diberi skor dengan ketentuan :
a. Piknosis diberi skor 1,
b. Karioreksis diberi skor 1 dan,
c. Kariolisis diberi skor 1.
Jadi, misalnya dari satu daerah zona sentrolobuler dari 100 sel yang
diamati, ternyata terdapat 25 sel dengan inti piknosis, 15 dengan
karyoreksis dan 5 dengan karyolisis maka jumlah skor dari satu daerah
zona sentrolobuler tersebut adalah (25x1) + (15x1) + (5x1) = 45. Sehingga
dari tiap preparat diperoleh satu nilai skor. Jadi dari 3 preparat akan
didapatkan 3 skor dari 1 hewan percobaan. Dalam percobaan ini
menggunakan 7 hewan percobaan dalam tiap kelompoknya sehingga akan
diperoleh 21 skor untuk tiap kelompok percobaan. Selanjutnya rata-rata
skor dari masing-masing kelompok dibandingkan dengan uji Oneway
ANOVA dan jika terdapat perbedaan yang bermakna maka dilanjutkan
commit to user J. Teknik Analisa Data Statistik
Data yang diperoleh akan dianalisa dengan menggunakan uji statistik
Oneway ANOVA (Analysis of Variance). Jika terdapat perbedaan yang
bermakna, maka dilanjutkan dengan uji Post Hoc Multiple Comparisons
(LSD). Apabila data yang diperoleh ternyata tidak memenuhi syarat uji
statistik parametrik Oneway ANOVA, maka sebagai alternatifnya akan
digunakan uji statistik non parametrik yaitu Kruskal Wallis. Derajat
kemaknaan yang digunakan adalah α = 0,05 (Dahlan, 2007). Analisis data
akan dilakukan dengan menggunakan program komputer Statistical
commit to user
37 37 BAB IV
HASIL PENELITIAN
A. Data Hasil Penelitian
Setelah dilakukan penelitian tentang efek hepatoprotektor propolis
terhadap kerusakan sel hepar mencit akibat induksi parasetamol, didapatkan
data hasil pengamatan pada masing-masing kelompok perlakuan. Hasil
pengamatan jumlah inti sel hepar yang mengalami piknosis, karioreksis dan
kariolisis untuk masing-masing kelompok, serta jumlah total sel hepar yang
rusak disajikan pada lampiran 4 tabel 5 – 8. Hasil rata-rata jumlah kerusakan
sel hepar mencit yang diinduksi parasetamol pada masing-masing kelompok
disajikan pada tabel 1.
Tabel 1. Rata-rata Skor Kerusakan Sel Hepar Mencit yang Diinduksi
Parasetamol pada Masing-masing Kelompok.
Kelompok Rata-rata Jumlah Standar Deviasi
KK (aquades) 24,57 3,823
KP 1 (parasetamol) 82,43 5,287
KP 2 (dosis propolis I) 41,14 2,268
KP 3 (dosis propolis II) 34,43 4,962
commit to user Keterangan :
KK : Kelompok Kontrol
KP 1 : Kelompok Perlakuan 1
KP 2 : Kelompok Perlakuan 2
KP 3 : Kelompok Perlakuan 3
Dari tabel 1 di atas dapat diketahui bahwa rata-rata jumlah kerusakan
hepar mencit yang paling tinggi adalah pada KP 1 (parasetamol dosis toksik)
yaitu 82,43 ± 5,287, sedangkan rata-rata jumlah kerusakan yang paling rendah
adalah pada KK (hanya aquades) yaitu 24,57 ± 3,823.
Gambaran kerusakan histologis (fotomikrograf) pada zona
sentrolubuler lobulus hepar mencit pada KK, KP 1, KP 2 dan KP 3 yang
ditandai dengan piknosis, karioreksis dan kariolisis dapat dilihat pada
lampiran 5.
B. Analisis Data
Data yang diperoleh dari hasil penelitian mula-mula dianalisis secara
statistik dengan uji One-Way ANOVA (ANOVA tidak berpasangan) untuk
mengetahui adakah perbedaan rata-rata jumlah kerusakan sel hepar mencit
pada zona sentrolobuler yang bermakna antara keempat kelompok. Jika
terdapat perbedaan yang bermakna, maka analisis data dapat dilanjutkan
dengan Uji Post Hoc Multiple Comparisons. Derajat kemaknaan yang
commit to user
menggunakan program komputer SPSS (Statistical Product and Service
Solution) 15.0 for Windows.
Syarat menggunakan uji One-Way ANOVA :
1. Hanya digunakan pada masalah skala pengukuran numerik. Masalah
skala pengukuran numerik pada hipotesis komparatif adalah masalah
skala pengukuran variabel yang mencari asosiasi antara skala variabel
numerik (interval atau rasio) dan kategorik (ordinal atau nominal).
2. Skala variabel numerik harus memiliki sebaran data normal, dibuktikan
dengan uji normalitas data metode analitik yaitu uji Kolmogorov-Smirnov
atau Saphiro-Wilk yang memiliki nilai p lebih besar daripada nilai α.
Misal, α = 0,05 maka nilai p untuk uji sebaran data normal harus
p > 0,05.
3. Varians data harus sama. Kesamaan varians data dapat diketahui dengan
menggunakan uji Homogenity of Variances. Jika varians data sama, maka
nila p > nilai α.
Jika ketiga syarat diatas tidak terpenuhi, maka dapat digunakan uji
hipotesis alternatif, yaitu berupa uji hipotesis non-parametrik Kruskall-Wallis
(Dahlan, 2007).
Data pada penelitian ini adalah kerusakan sel hepar mencit yang
dinyatakan dengan skala rasio (skala variabel numerik) dan kelompok
perlakuan yang dinyatakan dengan skala ordinal (skala variabel kategorik).
commit to user
menghasilkan masalah skala pengukuran numerik. Dapat dinyatakan bahwa
syarat pertama untuk menggunakan uji One-Way ANOVA terpenuhi.
Metode analisis yang lazim digunakan untuk menentukan jenis sebaran
data adalah uji Kolmogorov-Smirnov jika jumlah sampel > 50 atau uji
Saphiro-Wilk jika jumlah sampel ≤ 50 (Dahlan, 2007). Pada penelitian ini
menggunakan 28 sampel, maka digunakan uji Saphiro-Wilk untuk
menentukan apakah sebaran data normal atau tidak. Hasil uji Saphiro-Wilk
dapat dilihat pada lampiran 4 tabel 10.
Nilai p dari hasil uji Saphiro-Wilk untuk kelompok K, P1, P2, dan P3
berturut-turut adalah 0,096; 0,699; 0603; 0,975. Keempat nilai diatas lebih
besar dari α = 0,05, maka dapat ditarik kesimpulan bahwa sebaran data dari
keempat kelompok tersebut terdistribusi secara normal. Oleh karena itu,
syarat kedua untuk menggunakan uji ANOVA terpenuhi. Selanjutnya,
dilakukan uji Homogenity of Variance untuk mengetahui apakah varians data
sama atau tidak.
Sebaran data secara deskriptif dapat dilihat pada lampiran 4 tabel 9 dan
hasil uji Homogenity of Variance dapat dilihat pada tabel 12. Pada uji
Homogenity of Variance didapatkan nilai 0,184, dimana nilai tersebut lebih
besar dari α = 0,05 sehingga dapat ditarik kesimpulan bahwa terdapat
kesamaan varians data antar kelompok. Dengan kata lain, syarat ke-3 uji
commit to user
Hasil uji ANOVA dapat dilihat pada lampiran 4 tabel 13. Dari hasil
perhitungan uji ANOVA didapatkan nilai sig. untuk uji ANOVA adalah
0,000, dimana nilai ini lebih kecil dari nilai α (0,05) sehingga dapat ditarik
kesimpulan bahwa terdapat perbedaan rata-rata skor kerusakan histologis sel
sel hepar yang bermakna antara KK, KP 1, KP 2 dan KP 3.
Karena didapatkan adanya perbedaan yang bermakna (signifikan) dari
masing-masing kelompok tersebut, maka uji statistik dilanjutkan dengan Uji
Post Hoc untuk mengetahui antar kelompok mana perbedaan rata-rata skor
jumlah kerusakan histologis sel hepar dan yang digunakan dalam penelitian
ini adalah Uji LSD. Hasil uji Post Hoc Multiple Comparisons (LSD) dapat
dilihat pada lampiran 4 tabel 14. Ringkasannya adalah sebagai berikut:
Tabel 2. Ringkasan hasil uji LSD (α = 0,05)
Kelompok p Perbedaan
KK-KP 1 0,000 Bermakna
KK-KP 2 0,000 Bermakna
KK-KP 3 0,000 Bermakna
KP 1-KP 2 0,000 Bermakna
KP 1-KP 3 0,000 Bermakna
KP 2-KP 3 0,007 Bermakna
Dari hasil perhitungan dengan menggunakan uji statistik LSD tampak
adanya perbedaan yang bermakna (signifikan) dari semua pasangan antar
commit to user
42 BAB V
PEMBAHASAN
Hepar merupakan organ yang sangat rentan mengalami kerusakan akibat
paparan zat-zat toksik. Hal ini berkaitan dengan fungsi hepar sebagai pusat
disposisi metabolik dari semua bahan-bahan asing yang masuk ke dalam tubuh
melalui saluran cerna. Respon hepar terhadap paparan suatu zat tergantung pada
intensitas paparan, populasi sel yang terkena, dan jenis paparan yang diterima
(akut atau kronik) (Crawford, 2007).
Daerah sentrolobularis merupakan lokasi yang paling sering mengalami
kerusakan akibat toksikan. Hal ini terjadi karena di daerah tersebut banyak
terdapat retikulum endoplasma halus yang merupakan tempat aktivitas enzim
sitokrom P-450 (C-P450), sehingga banyak ditemukan sel-sel hepar (hepatosit)
yang nekrosis pada daerah sentrolubularis (Cullen, 2005).
Secara teoritis, paparan parasetamol dosis toksik terhadap sel hepar mencit
dapat mengakibatkan kematian sel yang disebut nekrosis. Nekrosis merupakan
proses kematian sel yang bersifat patologis dan melibatkan sekelompok sel. Sel
yang mengalami nekrosis akan terlihat membengkak (hidropic), kehilangan
integritas membran, terjadi kebocoran lisosom dan kemudian mengalami lisis
(Thompson et al., 2002). Umumnya perubahan-perubahan lisis yang terjadi pada
merupakan petunjuk paling jelas pada kematian sel (Mitchell dan Cotran, 2007).
Pada penelitian ini, parameter yang digunakan pada sistem penilaian
commit to user
karioreksis dan kariolisis. Ketiga jenis kerusakan tersebut masing-masing diberi
skor 1. Proses kerusakan tersebut merupakan kelanjutan satu sama lain, yang akan
berakhir menjadi kematian sel (necrosis).
Sel hepar (hepatosit) mencit yang diinduksi dengan parasetamol dosis
toksik akan mengalami kerusakan yang digambarkan dengan inti sel yang
piknosis, karioreksis dan kariolisis. Pemberian dengan propolis selama 14 hari
berturut-turut ditambah dengan parasetamol dosis toksik pada hari ke-12, 13 dan
14 menunjukkan hasil berupa kerusakan sel hepar yang lebih sedikit dibandingkan
dengan pemberian parasetamol tanpa propolis. Hal ini disebabkan propolis
memiliki efek hepatoprotektif terhadap efek toksik parasetamol.
Kelompok kontrol digunakan sebagai pembanding terhadap kelompok
perlakuan dengan pemberian parasetamol dan kelompok perlakuan dengan
pemberian parasetamol dan propolis. Kelompok kontrol hanya diberikan aquades
sebagai plasebo. Pada kelompok kontrol juga terlihat gambaran inti piknosis,
karioreksis dan kariolisis. Fotomikrograf kelompok kontrol ditampilkan pada
lampiran 5 gambar 7. Hal ini terjadi karena secara fisiologis semua sel normal
akan mengalami proses apoptosis, yaitu kematian sel secara fisiologis dan bukan
“pembunuhan” sel yang terjadi pada kematian sel nekrotik. Setiap sel dalam tubuh
selalu akan mengalami penuaan yang diakhiri dengan kematian sel dan digantikan
oleh sel baru melalui proses regenerasi (Mitchell dan Cotran, 2007). Selain itu,
pengaruh variabel luar yang tidak dapat dikendalikan juga dapat menjadi
commit to user
Dari hasil uji Oneway ANOVA, didapatkan perbedaan yang bermakna dari
nilai rata-rata jumlah kerusakan sel hepar mencit antara keempat kelompok.
Selanjutnya, hasil uji LSD menunjukkan perbedaan bermakna pada semua
pasangan antar kelompok data, yaitu antara kelompok K-P1, K-P2, K-P3, P1-P2,
P1-P3, dan P2-P3.
Pada hasil uji LSD menunjukkan terdapat perbedaan bermakna dari nilai
rata-rata jumlah kerusakan sel hepar antara kelompok K dan kelompok P1,
disebabkan karena sel-sel hepar mencit pada kelompok P1 mengalami kerusakan
akibat pemberian parasetamol dosis toksik, sedangkan pada kelompok K relatif
normal. Hal ini sesuai dengan teori yang menyatakan bahwa parasetamol dosis
toksik mampu menginduksi kerusakan sel hepar akibat adanya metabolit NAPQI
yang reaktif dan toksik. Fotomikrograf kelompok P1 ditampilkan pada lampiran 5
gambar 8.
Ketika asupan parasetamol jauh melebihi dosis terapeutik, jalur
glukoronidasi dan sulfasi dipisahkan dan jalur sitokrom P-450 bebas menjadi
penting. Selama glutation masih tersedia untuk konjugasi, parasetamol tidak akan
dapat menimbulkan hepatotoksisitas. Namun dengan perjalanan waktu, glutation
yang terpakai akan lebih cepat daripada regenerasinya sehingga akhirnya akan
terjadi pengosongan glutation dan terjadi penimbunan metabolit yang toksik dan
reaktif, yaitu N-asetil-p-benzoquinonimin (NAPQI). Kemudian NAPQI akan
membentuk ikatan kovalen dengan gugus sulfihidril pada makromolekul hepatosit
commit to user
Reaksi antara NAPQI dengan makromolekul hepatosit menyebabkan
disfungsi sistem enzim, serta kekacauan stuktural dan metabolik hepatosit.
NAPQI juga dapat memicu terbentuknya radikal bebas baru, dimana jika bereaksi
dengan asam lemak tak jenuh pada membran sel, maka akan menyebabkan
peroksidasi membentuk lipid peroksidasi. Kerusakan membran sel menyebabkan
terganggunya metabolisme energi dan hilangnya pengaturan volume yang dapat
berujung pada kematian sel (Goodman dan Gilman’s 2006; Winarsih, 2007).
Kematian sel ditandai oleh kerusakan pada sel, dimana kerusakan ini tampak pada
KP 1 yang terjadi peningkatan kerusakan pada inti sel. Glutation merupakan suatu
kofaktor yang esensial untuk enzim antioksidan yaitu glutation peroksidase.
Pada KP 2 merupakan kelompok perlakuan pemberian propolis dengan
dosis 0,0104 ml/20 gr BB mencit (dosis I) dan parasetamol dosis toksik,
sedangkan KP 3 merupakan kelompok perlakuan pemberian propolis dosis 0,0208
ml/20 gr BB mencit (dosis II) dan parasetamol dosis toksik. Hasil analisis data,
kerusakan sel hepar pada KP 2 dan KP 3 sama-sama menunjukkan perbedaan
bermakna dengan KK dan KP 1. Hal ini berarti bahwa pemberian propolis dengan
dosis I dan dosis II selama 14 hari berturut-turut dapat mengurangi kerusakan sel
hepar mencit akibat pemberian parasetamol dosis toksik, walaupun tidak dapat
mengembalikan sel hepar mencit ke kondisi normal, seperti pada kelompok
kontrol (KK). Fotomikrograf kelompok P1 dan P2 dapat dilihat pada lampiran 5,
gambar 9 dan 10. Dari data hasil penelitian, didapatkan rata-rata skor kerusakan
histologis hepar mencit pada KP 2 lebih tinggi daripada KP 3. Setelah dianalisis
commit to user
bermakna. Hal ini berarti bahwa peningkatan propolis dapat meningkatkan efek
proteksinya terhadap kerusakan sel hepar mencit yang diinduksi parasetamol,
meskipun tidak dapat mengembalikan sel hepar mencit ke kondisi semula.
Menurut Ismail et al. (2010), status stres oksidatif sangat berkaitan dengan
terjadinya kerusakan sel-sel hepar. Maellaro et al. (2004) menyebutkan dalam
penelitiannya bahwa kerusakan sel hepar yang diinduksi oleh agen pendeplesi
glutation dapat dikurangi dengan pemberian zat-zat antioksidan. Sistem
antioksidan, baik enzimatik maupun non-enzimatik akan mengeliminasi
peroksidan dan radikal bebas yang berbahaya bagi kelangsungan hidup sel
(Dimascio et al, 2001). Propolis mengandung berbagai jenis senyawa antioksidan
yang mampu mencegah dan menghambat dari efek toksik parasetamol.
Kandungan antioksidan yang terdapat di dalam propolis antara lain adalah
flavonoid, fenol, asam dicaffeoylquinic, asam caffeic dan ferulik, vitamin C, E
dan A, mineral Se, fe, Cu dan Zn, serta asam amino essensial (Krell, 1996).
Semua jenis antioksidan yang terkandung dalam propolis berperan penting dalam
menentukan TAS (total antioxidant status). TAS mampu memberikan elektron
kepada molekul radikal bebas dan memutuskan reaksi berantai (chain reaction)
dari radikal bebas sehingga dapat menghambat dan mencegah terjadinya stres
oksidatif (Almatsier, 2002; Winarsih, 2007).
Senyawa flavonoid dapat menghambat oksidasi lipid dan pembentukan
lipid peroksida, dengan menangkap radikal bebas (Hegazi dan El-Hady, 2007).
Disamping itu, flavonoid memiliki afinitas yang sangat kuat terhadap ion Fe (Fe
commit to user
terbentuknya radikal bebas). Kostyuk et al.,(2001) juga melaporkan bahwa
interaksi antara senyawa flavonoid dengan ion Zn memiliki tambahan 1 pusat
radical scavenging sehingga kerja antioksidannya dapat lebih kuat.
Mineral besi (Fe) dan seng (Zn) berfungsi sebagai kofaktor SOD
(Superoksida Dismutase), dimana kofaktor merupakan suatu elemen yang
dengannya suatu faktor lain harus bersatu untuk dapat berfungsi. Selenium (Se)
berperan sebagai kofaktor enzim yang terlibat dalam oksidasi asam lemak
(Hartanto et al., 2000). Vitamin E merupakan vitamin larut dalam lemak, berperan
dalam menghambat peroksidasi lipid sehingga dapat mencegah kerusakan sel
membran yang lebih lanjut. Pada vitamin C bekerja sebagai donor elekron,
dengan cara memindahkan satu elektronnya. Selain itu, vitamin C juga berperan
sebagai penyetabil keberadaan vitamin E (Almatsier, 2002)
Penelitian tentang efek antioksidan propolis juga sudah banyak dilakukan.
Basnett et al. (1996) menyatakan bahwa turunan asam fenolik yang berupa asam
dicaffeoylquinic dalam propolis dapat memberikan perlindungan terhadap
kerusakan hati (hepatoprotector). Selain itu, penelitian Ichikawa et al. (2002)
dengan propolis hijau Brazil dan Kumazawa et al. (2004) dengan propolis
beberapa negara menjelaskan bahwa kemampuan propolis sebagai antioksidan
dapat menangkap radikal hidroksi dan superoksida kemudian menetralkan radikal
bebas tersebut sehingga keutuhan struktur sel dan jaringan serta membran lipid
commit to user
Berdasarkan hal di atas, hasil penelitian yang didapatkan para peneliti
kandungan propolis terdahulu dapat mendukung dan sejalan dengan hasil
penelitian ini. Kandungan dalam propolis (propolisKU), dapat memberikan efek
protektif terhadap kerusakan sel hepar mencit, terutama akibat dari induksi