LAPORAN PRAKTIKUM KIMIA DASAR
KECEPATAN REAKSI
Disusun Oleh :
1. Achmad Zaimul Khaqqi (132500030)
2. Dinda Kharisma Asmara (132500014)
3. Icha Restu Maulidiah (132500033)
4. Jauharatul Lailiyah (132500053)
Dosen Pembimbing :
Arif Yahya., S.Si., M.Si
Prodi Biologi
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS PGRI ADI BUANA SURABAYA
Jl. Dukuh Menanggal XII Surabaya 60234
Universitas PGRI Adi Buana Surabaya | i
HALAMAN PENGESAHAN
Makalah Kimia Dasar ”Kecepatan Reaksi”
ini diajukan untuk memenuhi tugas mata pelajaran Kimia Dasar semester ganjil tahun ajaran 2013/2014. Makalah Kimia Dasar ini telah diperiksa dan disetujui
oleh
Bapak Arif Yahya, S.Si., M.Si
pada tanggal………
Mengesahkan,
Universitas PGRI Adi Buana Surabaya | ii
KATA PENGANTAR
Puji syukur kehadirat Allah SWT atas limpahan rahmat dan karunia-Nya, sehingga Makalah Kecepatan Reaksi ini akhirnya selesai. Tugas ini kami buat untuk memenuhi tugas Kimia Dasar semester ganjil tahun ajaran 2013/2014.
Makalah Kimia Dasar ini kami buat untuk memberikan wawasan pengetahuan utamanya bagi para pemuda-pemudi atau para mahasiswa tentang Kecepatan Reaksi. Sehingga bisa mengetahui bagaimana proses Kecepatan Reaksi.
Dengan selesainya Makalah Kimia Dasar ini, kami mengucapkan banyak terima kasih kepada Bapak Arif Yahya, S.Si., M.Si., yang telah membimbing pembuatan Makalah Kimia Dasar ini. Semoga bimbingan yang Bapak berikan dapat bermanfaat Amin.
Makalah Kimia Dasar ini masih banyak kekurangan di dalamnya. Oleh sebab itu dengan penuh rendah hati, kami mohon agar para pembaca beserta dosen pembimbing berkenan memberikan kritik dan saran yang membangun guna sempurnanya tugas ini.
Dengan segala kekurangan dan keterbatasannya, semoga Makalah Kimia Dasar ini dapat bermanfaat dan berguna terutama bagi para mahasiswa Amin.
Universitas PGRI Adi Buana Surabaya | iii DAFTAR ISI
Halaman Pengesahan i
Kata Pengantar ii
Daftar Isi iii
I. Tujuan 1
II. Dasar Teori 1
III. Bahan dan Alat 6
IV. Cara Kerja 6
V. Hasil Pengamatan 8
VI. Pembahasan 10
VII. Kesimpulan 12
Universitas PGRI Adi Buana Surabaya | 1 I. TUJUAN
Tujuan percobaan praktikum ini adalah
1. Mengetahui pengaruh konsentrasi terhadap kecepatan reaksi 2. Mengetahui pengaruh suhu terhadap kecepatan reaksi
II. DASAR TEORI
Mekanisme terjadinya perubahan-perubahan dalam suatu reaksi kimia dan kecepatan reaksi dapat diterangkan dengan teori kinetika dan kesetimbangan kimia. Mekanisme reaksi kimia menerangkan melalui langkah-langkah mankah suatu zat pereaksi berubah menjadi hasil reaksi. Laju reaksi (kecepatan reaksi) menerangkan seberapa cepat reaksi berlangsung. Laju reaksi suatu reaksi kimia biasanya didefinisikam sebagai perubahan konsentrasi zat yang ikut serta dalam reaksi per satuan waktu.
Persamaan ini menunjukkan bahwa laju reaksi suatu reaksi kimia berbanding terbalik terhadap waktu dan berbanding lurus dengan konsentrasi. Hasil percobaan membuktikan hasil reaksi tidak selalu berupa fungsi linear dari konsentrasi zat pereaksi. Untuk reaksi diatas hal ini dapat dinyatakan secara empiris dalam persamaan:
r = [A]p . [B]q
P dan Q dikenal dengan tingkat reaksi, (p + q) dikenal sebagai total tingkat reaksi.
Andaikan suatu reaksi mempunyai total tingkat reaksi n, maka laju reaksinya sebanding dengan [konsentrasi]n dan berbanding terbalik dengan t :
Universitas PGRI Adi Buana Surabaya | 2 Sehingga jika dibuat grafik [konsentrasi]n versus 1/t, maka akan diperoleh grafik berupa garis lurus. Dengan demikian tingkat reaksi kimia dapat ditentukan dengan membuat grafik [konsentrasi]n VS 1/t.
Tingkat reaksi Penentuan tingkat reaksi dengan membuat grafik 1 [konsentrasi]1 VS 1/t 2 [konsentrasi]2 VS 1/t 3 [konsentrasi]3 VS 1/t
Kecepatan reak dapat diukur dari laju terbentuknya hasil reaksi, misalnya reaksi antara HCL + Al dapat diukur dari laju pembentukan gas H2
Al + HCL(aq) --- AlCl3(aq) + H2 (g)
Dalam suatu reaksi kimia berlangsungnya suatu reaksi dari keadaan semula (awal) sampai keadaan akhir diperkirakan melalui beberapa tahap reaksi. Contoh : 4 HBr(g) + O2(g) 2 H2O(g) + 2 Br2(g)
Dari persamaan reaksi di atas terlihat bahwa tiap 1 molekul O2
bereaksi dengan 4 molekul HBr. Suatu reaksi baru dapat berlangsung apabila ada tumbukan yang berhasil antara molekul-molekul yang bereaksi. Tumbukan sekaligus antara 4 molekul HBr dengan 1 molekul O2 kecil sekali kemungkinannya untuk berhasil.
Tumbukan yang mungkin berhasil adalah tumbukan antara 2 molekul yaitu 1 molekul HBr dengan 1 molekul O2. Hal ini berarti reaksi
Universitas PGRI Adi Buana Surabaya | 3 Dari contoh di atas ternyata secara eksperimen kecepatan berlangsungnya reaksi tersebut ditentukan oleh kecepatan reaksi pembentukan HOOBr yaitu reaksi yang berlangsungnya paling lambat.
Rangkaian tahap-tahap reaksi dalam suatu reaksi disebut "mekanisme reaksi" dan kecepatan berlangsungnya reaksi keselurahan ditentukan oleh reaksi yang paling lambat dalam mekanisme reaksi. Oleh karena itu, tahap ini disebut tahap penentu kecepatan reaksi.
Pada laju reaksi terdapat faktor-faktor yang dapat mempengaruhi laju
reaksi. Selain bergantung pada jenis zat yang beraksi laju reaksi
dipengaruhi oleh :
a. Konsentrasi Pereaksi
Pada umumnya jika konsentrasi zat semakin besar maka laju
reaksinya semakin besar, dan sebaliknya jika konsentrasi pula, dan
sebaliknya jika sentrasi suatu zat semakin kecil maka laju reaksinya pun
semakin kecil. Untuk beberapa reaksi, laju reaksinya pun semakin kecil.
Untuk beberapa reaksi, laju reaksi dapat dinyatakan dengan persamaan
matematik yang dikenal dengan hukum laju reaksi atau reaksi dinamakan
orde reaksi. Menentukan orde reaksi dari suatu reaksi kimia pada
prinsipnya menentukan seberapa besar pengaruh perubahan konsentrasi
pereaksi terhadap laju reaksi.
b. Luas Permukaan
Suatu reaksi mungkin melibatkan pereaksi dalam bentuk padat, luas
permukaan (total) zat padat akan bertambah jika ukurannya diperkecil.
Semakin zat padat terbagi menjadi bagian kecil, semakin cepat reaksi
berlangsung. Bubuk zat padat biasanya menghasilkan reaksi yang lebih
cepat dibandingkan sebuah bongkah zat padat dengan massa yang sama.
Bubuk padat memiliki permukaan yang lebih besar dari pada sebuah
bengkah zat padat.
c. Suhu atau Temperatur
Laju reaksi juga dapat di percepat atau diperlambat dengan
mengubah suhunya. Ketika suhunya dinaikkan maka laju reaksi akan
Universitas PGRI Adi Buana Surabaya | 4
sebagai reaksi berlangsung dengan suhu ruangan maka laju reaksi akan
berlipat ganda setiap kenaikan 100C.
Perkiraan ini bukan keadaan yang mutlak dan tidak bisa diterapkan
pada seluruh reaksi. Bahkan bila pun mendekati benar, laju reaksi akan
berlipat ganda setiap 90C atau 110C atau setiap suhu tertentu. Angka dari
derajat suhu yang diperlukan untuk melipat gandakan laju reaksi akan
berubah secara bertahap seiring dengan meningkatnya suhu.
Beberapa reaksi pada hakikatnya sangat cepat, sebagai contoh
reaksi perpanasan melibatkan ion yang terlarut menjadi zat padat yang
tidak larut, atau reaksi ion hidrogen dengan asam dan ion hidroksi dari
Alkali didalam larutan, sehingga memanaskan salah satu dari contoh ini
tidak memperoleh perbedaan laju reaksi yang baik di laboratorium
maupun industri akan berlangsung lebih cepat apabila di panaskan.
d. Tekanan
Bayak reaksi yang melibatkan pereaksi dalam wujud gas. Kelajuan
dari reaksi seperti itu juga dipengaruhi oleh tekanan. Penambahan
tekanan dengan memperkecil Volume akan memperbesar konsentrasi,
dengan demikian dapat memperbesar laju reaksi.
Peningkatan tekanan pada reaksi yang melibatkan gas pereaksi akan
meningkatkan laju reaksi. Perubahan tekanan pada suatu reaksi yang
melibatkan hanya zat padat maupun zat cair tidak memberikan perubahan
apapun pada laju reaksi.
Dalam proses pembuatan amonia dengan proses Haber, laju reaksi
antara Hidrogen dan Nitrogen ditingkatkan dengan menggunakan
tekanan yang sangat tinggi. alasan utama menggunakan tekanan tinggi
adalah untuk meningkatkan persentasi amonia di dalam keseimbangan
campuran, namun hal ini juga memberikan perubahan yang berarti pada
laju reaksi juga.
Industri yang melibatkan produksi berupa gas yang banyak
dilangsungkan pada tekanan tinggi, misalnya pembuatan amonia yang
menggunakan tekanan hingga 400 atm.
Universitas PGRI Adi Buana Surabaya | 5
Katalis adalah zat yang dapat mempercepat laju reaksi, tetapi zat itu
sendiri tak mengalami perubahan yang kekal (tidak diskon asumsi atau
tidak dihabiskan). Katalis dibagi 2 yaitu :
Katalis Positif.
Katalis positif berfungsi untuk mempercepat laju reaksi dengan
cara menurunkan energi pengaktifan, katalis positif disebut juga
katalisator.
Katalis Negatif
Katalis negatif berfungsi untuk memperkuat laju reaksi. Katalis
negatif disebut juga inhibator.
Adapun Jenis-jenis katalis yaitu :
Katalis homogen
Wujud katalis homogen ini sama dengan wujud pereaksi. Jenis
katalis ini umumnya ikut beraksi tetapi pada akhirnya akan kembali
lagi ke bentuk semula.
Katalis Heterogen
Wujud katalis homogen ini berbeda dari wujud pereaksi. Jenis
katalis ini umumnya berupa logam-logam dan bereaksi yang
dipercepat adalah reaksi gas-gas katalis ini tidak ikut bereaksi,
tetapi melalui reaksi permukaan yaitu permukaan logam menyerap
molekul-molekul udara hingga apabila dua molekul gas yang dapat
bereaksi terserap maka gas-gas itu akan mudah bereaksi katalis ini
kebanyakan digunakan dalam reaksi industri.
Katalis biokimia
Katalis biokimia ini berfungsi untuk mempercepat reaksi-reaksi
yang terjadi pada makhluk hidup. Katalis ini berupa enzim-enzim.
Dalam laju reaksi terdapat pula teori tumbukan, reaksi berlangsung
sebagai hasil tumbukan antara partikel pereaksi. Akan tetapi tidaklah
setiap tumbukan antara partikel menghasilkan reaksi, melainkan hanya
tumbukkan antar partikel yang memiliki energi yang cukup serta arah
tumbukan yang tepat. Sehingga dapat dikatakan bahwa laju reaksi dapat
Universitas PGRI Adi Buana Surabaya | 6
Frekuensi Tumbukan
Fraksi tumbukan yang melibatkan partikel dengan energi cukup
Fraksi partikel dengan energi cukup yang tumbuhannya dengan
arah yang tepat.
Tumbukan yang menghasilkan reaksi disebut dengan tumbukan
efektif, energi minimum yang harus dimiliki oleh partikel pereaksi
sehingga menghasilkan tumbukan efektif yang disebut juga energi
pengaktifan untuk memahami arti dari energi pengaktifan perlu
diperhatikan pelan-pelan benda yang ada di sekitar kita yang dapat
terbakar.
Adapun persamaan laju reaksi dan orde reaksi yaitu sebagai berikut:
mA + nB pC = qD
Persamaan laju : V = K [A] x [B]x
Dengan ketetapan rumus :
- K : Ketetapan Jenis Reaksi
- X : Orde Reaksi terhadap pereaksi A
- Y : Orde reaksi terhadap pereaksi B
- m,n,p,q : Koefisien masing-masing zat yang terlihat dalam
reaksi
Ketetapan jenis reaksi (K) adalah salah satu tetapan yang
harganya bergantung pada jenis pereaksi dan suhu., setiap reaksi
mempunyai harga K tertentu pada suhu tertentu. Harga K berubah jika
suhu berubah, kenaikan suhu dan katalisator umumnya dan memperbesar
Universitas PGRI Adi Buana Surabaya | 7 III. BAHAN DAN ALAT
Larutan HCL konsentrasi 0,5; 1; 2; 4 N Potongan Aluminium foil
Akuades 2x2mm), kedalam masing-masing tabung reaksi.
3) Catat waktu habisnya/hilangnya aluminium foil didalam larutan HCL. 4) Buat kurva antara waktu yang digunakan untuk bereaksi (sumbu y)
dengan konsentrasi HCL (sumbu x).
B. Hubungan antara kecepatan reaksi dengan konsentrasi aluminium
1) Isilah 5 tabung reaksi berturut-turut dengan potongan aluminium foil 1; 2; 3; 4; dan 5 potongan.
2) Masukkan 5 ml larutan HCL 0,2N ke dalam masing-masing tabung reaksi.
3) Catat waktu habisnya/hilangnya aluminium foil di dalam larutan HCL. 4) Buat kurva antar waktu yang digunakan untuk bereaksi dengan
konsentrasi aluminium.
C. Hubungan antara kecepatan reaksi dengan temperature
Universitas PGRI Adi Buana Surabaya | 8 2) Catat suhunya, inilah suhu awal reaksi.
3) Tambahkan pada tabung pertama 5 mL larutan HCL 0,2N, amati dan catat waktunya sampai potongan aluminium hilang.
4) Catat suhunya, ini adalah suhu akhir reaksi.
5) Ulangi percobaan diatas untuk tabung ke-2, 3, 4, dan 5 tetapi percobaan dilakukan dengan suhu zat pereaksi 35oC; 40 oC; 45 oC; 50oC.
Pemanasan zat pereaksi dilakukan dengan mencelupkan tabung yang berisi zat pereaksi kedalam penangas air.
Universitas PGRI Adi Buana Surabaya | 9 V. HASIL PENGAMATAN
A.Hubungan antara kecepatan reaksi dengan konsentrasi HCL
No. tabung Konsentrasi larutan HCl Waktu (detik)
1 0,5 N 5277
2 1 N 3126
3 2 N 1686
4 4 N 1677
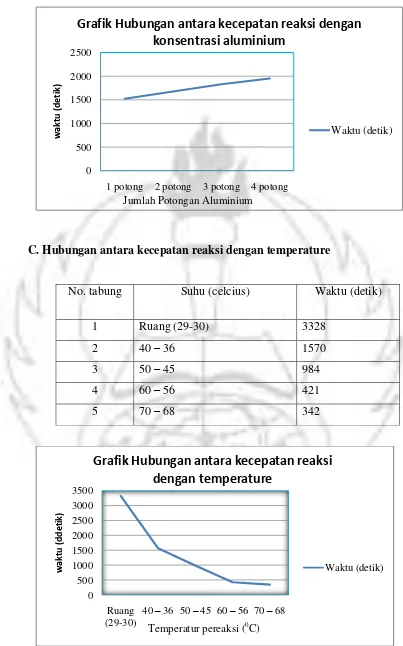
B.Hubungan antara kecepatan reaksi dengan konsentrasi aluminium
No. tabung Jumlah potongan aluminium Waktu (detik)
1. 1 potong 1521
Grafik Hubungan antara kecepatan reaksi dengan
konsentrasi HCL
Waktu (detik)
Universitas PGRI Adi Buana Surabaya | 10 C.Hubungan antara kecepatan reaksi dengan temperature
1 potong 2 potong 3 potong 4 potong
wak
tu
(d
e
tik)
Grafik Hubungan antara kecepatan reaksi dengan
konsentrasi aluminium
Grafik Hubungan antara kecepatan reaksi
dengan temperature
Waktu (detik) No. tabung Suhu (celcius) Waktu (detik)
1 Ruang (29-30) 3328
2 40 – 36 1570
3 50 – 45 984
4 60 – 56 421
5 70 – 68 342
Universitas PGRI Adi Buana Surabaya | 11 VI. PEMBAHASAN
A. Berdasarkan percobaan pertama yakni hubungan antara kecepatan reaksi dengan konsentrasi HCl. Perlakuan yang diberikan adalah penggunaan konsentrasi HCl dengan konsentrasi 4 N, 2 N, 1 N, 0,5 N yang direaksikan dengan aluminium foil. Dari keempat perlakuan konsentrasi HCl yang digunakan, aluminium foil yang direaksikan dengan larutan HCl dengan konsentrasi 4 N lebih cepat bereaksi (habis) dalam waktu 1677 detik (27 menit 57 detik). Dibandingkan dengan aluminium foil yang direaksikan pada larutan HCl dengan konsentrasi 2 N, 1 N, ataupun 0,5 N dalam waktu lebih dari 28 menit. Hal ini dikarenakan makin besar konsentrasi zat-zat yang bereaksi makin cepat reaksinya berlangsung. Makin besar konsentrasi makin banyak zat-zat yang bereaksi sehingga makin besar kemungkinan terjadinya tumbukan dengan demikian makin besar pula kemungkinan terjadinya reaksi.
Universitas PGRI Adi Buana Surabaya | 12 semakin lambat karena membutuhkan waktu yang lama untuk terjadinya tumbukan dan semakin lama pula terjadinya reaksi (habis).
Universitas PGRI Adi Buana Surabaya | 13 VII. KESIMPULAN
Dari hasil pngamatan dapat disimpilkan bahwa :
Kecepatan reaksi dipengaruhi oleh konsentrasi HCl. Semakin besar konsentrasi zat-zat yang bereaksi, semakin cepat reaksi berlangsung. Sehingga makin besar kemungkinan terjadinya tumbukan dengan demikian makin besar pula kemungkinan terjadinya reaksi.
Kecepatan reaksi dipengaruhi oleh konsentrasi Aluminium. Semakin kecil atau semakin sedikit potongan aluminium maka semakin cepat bereaksi karena semakin cepat terjadinya tumbukan dengan demikian semakin cepat pula kemungkinan terjadinya reaksi. Sebaliknya jika semakin besar maka semakin lama terjadinya reaksi.