BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Situlan (Macaranga Dipterocarpifolia Merrill)
2.1.1 Sistematika Tumbuhan Situlan
Kingdom : Plantae
Divisi : Spermatophyta
Class : Dicotyledoneae
Ordo : Euphorbiales
Famili : Euphorbiaceae
Genus : Macaranga
Spesies : Macaranga dipterocarpifolia Merrill
Nama Lokal : Situlan
(Herbarium Medanense,2017)
2.1.2 Morfologi dan Manfaat Tumbuhan Situlan
Tumbuhan Situlan (Macaranga dipterocarpifolia Merrill) merupakan pohon kecil dengan tinggi sekitar 7 meter. Ukuran daun sekitar 4-10 cm dan bentuknya melebar dan sedikit berbulu. Cabang pohonnya berupa cabang aksila dan terkadang cukup rapat. Penyebaran tumbuhan ini antara lain China, Taiwan, Filipina, dan Sulawesi (Whitmore,T.C,1995).
2.2 Senyawa Organik Bahan Alam
Contoh yang dapat segera diketahui adalah pembuatan bahan makanan, pewarnaan benda, obat-obatan atau stimulan, dan sebagainya (Sastrohamidjojo, 1996).
Sejak kira-kira pertengahan abad ke 18, telah dapat dipisahkan beberapa senyawa organik dari mahluk hidup serta hasil produksinya. Seorang ahli kimia Jerman, Karl Eilhelm Scheele (1742-1786) sangat terkenal dengan keahliannya dalam bidang ini, beliau telah berhasil memisahkan beberapa senyawa sederhana. Biogenesis dari produk alami, meskipun pada mulanya berkaitan dengan kimia organik dan biokimia, menjadi berlainan karena mempunyai tujuan yang berlainan. Kimia organik terutama mempelajari struktur, sifat-sifat kimia dan fisika, serta cara sintesisnya, baik secara alami ataupun in vitro dari zat-zat kimia tetapi cenderung untuk mengabaikan sifat-sifat khusus dari bahan alam, misalnya tentang cara pembentukan dan peran biologisnya. Biokimia, berusaha menjawab pertanyaan-pertanyaan yang paling banyak diajukan terutama tentang metabolisme primer, dan mengabaikan proses-proses sekunder misalnya tentang pembentukan alkaloid, terpena dan lain-lain (Manitto, 1981).
Pengenalan dasar-dasar biosintesis merupakan perkembangan yang paling nyata pada kimia bahan alam. Selama akhir abad ini sejumlah besar struktur baru telah ditentukan. Pada mulanya kimiawan organik hanya tertuju pada pengungkapan struktur bahan alam dan pengelompokannya sesuai dengan asalnya, aktivitas farmakalogi atau struktur. Namun kemudian dengan adaya informasi yang cukup maka mereka perlu bekerja lebih diarahkan yang sesuai dengan biogenesis (Sastrohamidjojo, 1996).
1. Klasifikasi Berdasarkan Struktur Kimia
Klasifikasi ini adalah klasifikasi formal berdasarkan kerangka struktur molekul, yaitu:
a. Senyawa lemak rantai terbuka atau alifatik, seperti asam-asam lemak, gula-gula, dan hampir semua asam amino
b. Senyawa sikloalifatik atau alisiklik, seperti terpenoid, steroid, dan beberapa alkaloid
c. Senyawa benzenoid atau aromatik, seperti fenol dan kuinon.
d. Senyawa heterosiklik, seperti alkaloid, flavonoid, dan basa-basa nukleat.
2. Klasifikasi Berdasarkan Aktivitas Fisiologi
Biasanya pengembangan bahan alam didahului dengan pengamatan dan pengalaman empirik khasiat bahan alam tersebut untuk menyembuhkan penyakit tertentu. Oleh karena itu, salah satu cara penyelidikan bahan obat dari tumbuhan atau bahan alam lainnya adalah melalui ekstraksi dan penetapan khasiat farmakologi ekstrak, diikuti dengan isolasi komponen murni.
Sebagai contoh, berbagai steroid dengan struktur yang berbeda, aktivitas kardiotoniknya (kardenolida dan bufadienolida) ditunjukkan secara spesifik oleh (a) ikatan cis cincin A/B, (b) adanya gugus gula pada C3, dan (c) gugus lakton
(dengan 5 atau 6 atom karbon) terkonjugasi pada C17.
O
Walaupun beberapa metabolit selama ini diketahui spesifik pada tumbuhan tertentu, tetapi sekarang telah diketahui tersebar di dalam berbagai tumbuhan, misalnya alkaloid dan isoprenoid telah dapat diisolasi dari berbagai genus, spesies, suku, atau ordo. Bahkan di dalam satu spesies terdapat sejumlah komponen yang memiliki struktur dasar yang berkaitan. Sebagai contoh, opium dari Papaver somniferum mengandung lebih dari 20 alkaloid seperti morfin, kodein, tebain dan narkotin yang semuanya merupakan hasil biosintesis dari prekursor 11-benzilisokuinolin dengan kopling oksidatif.
Pengetahuan tentang kandungan komponen tumbuhan berkembang dengan sangat pesat karena berkembangnya metode ekstraksi, isolasi dan karakterisasinya. Hal ini mendorong berkembangnya suatu bidang baru yang disebut kemotaksonomi (chemotaxonomy) atau sistematik kimia (chemosystematic) yang mengarah ke pembagian kandungan tumbuhan berdasarkan taksa tumbuhan. Dengan kata lain, isi kandungan tumbuhan dianggap sebagai tanda bagi evolusi dan kalsifikasi tumbuhan.
Biogenesis dan biosintesis memiliki arti yang sama dan sering kali digunakan tanpa perbedaan. Namun, istilah biogenesis biasanya digunakan untuk reaksi pembentukan yang masih dalam taraf hipotesis, sedangkan jika reaksi tersebut telah dibuktikan secara eksperimen, digunakan istilah biosintesis.
Berbagai teori tentang pembentukan senyawa metabolit primer dan metabolit sekunder telah dikemukakan di dalam berbagai publikasi. Diawali dengan teori aturan isoprena pada tahun 1930, yang menyatakan bahwa semua terpenoid dibentuk dari unit isoprena 5-C, dilanjutkan dengan teori poliketometilena untuk senyawa fenolik, yang merupakan saran pertama bagi biosintesis asetogenin (poliketida).
Komponen pembangun utama untuk atom-atom karbon dan nitrogen di dalam semua senyawa bahan alam berasal dari 5 kelompok prekursor, yaitu:
a. asetil ko-A → unit 2C (MeCO-) → poliketida (asetogenin) malonil ko-A
b. asam sikimat → unit 6C-3C (6C-1C atau 6C-2C) → senyawa fenolik c. asam mevalonat → unit prenil → isoprenoid
( CH2=C-CH2-CH2-)
Me
d. unit asam amino seperti fenilanalina, tirosina, ornitina, lisina, dan triptofan
→ alkaloid
e. 5-5’-deoksiadenilmetionina → unit 1C (Wiryowidagdo, 2008).
2.3 Metabolit Sekunder
Fisik tanaman sebagian besar terdiri atas air. Kandungan air mencapai lebih dari 90% pada daun, bunga, buah (buah yang berair banyak), dan bagian tanaman yang berada dibawah tanah. Pada jaringan yang miskin organ penyimpanan, kandungan airnya menurun hingga sekitar 50%,yaitu pada kulit dan kayu. Yang mengandung air paling sedikit ± 10%.
(amilum, protein, lipoprotein) atau untuk memenuhi fungsi metabolisme penting lainnya (protein dan enzim). Senyawa kimia dari tanaman yang bebeda-beda dapat disaring dengan pelarut umum (air, etanol, eter, benzena, eter minyak bumi) (Sirait,2007).
Proses-proses kimia jenis lain terjadi hanya pada spesies tertentu sehingga memberikan prosuk yang berlainan, sesuai dengan spesiesnya. Reaksi yang demikian nampaknya tidak merupakan proses yang terpenting bagi eksistensi dari suatu organisme, karena itu disebut proses metabolisme sekunder, produk-produk metabolisme sekunder, serupa dengan yang semula disebut sebagai produk alami oleh para ahli kimia organik, misalnya senyawa-senyawa terpena, alkaloid, pigmen. Metabolit sekunder, meskipun tidak sangat penting bagi eksistensi suatu individu, sering berperan pada kelangsungan hidup suatu spesies, dalam perjuangan menghadapi spesies-spesies lain. Misalnya: zat kimia untuk pertahanan, penarik seks, dan feromon. Beberapa penulis percaya, bahwa mereka adalah produk detoksikasi dari timbunan metabolit yang beracun, dan tak dapat dibuang oleh organisme dengan cara lain (Manitto,1981).
Pengelompokkan senyawa kimia tananam berdasarkan sifat khas yang dimiliknya (antara lain warna, rasa, bau, pH, kelarutan), merupakan hal penting sehingga sampai sekarang masih banyak dipakai. Berikut contoh pengelompokkan senyawa kimia seperti tersebut diatas.
1. Minyak Atsiri. Baunya khas dan dapat dipisahkan dari senyawa kimia tanaman lainnya, karena sukar larut dalam air dan dapat menguap bersama uap air.
2. Alkaloid. Senyawa yang bersifat basa dapat dipisahkan dari yang netral dan asam. Pertemuan dua sifat basa dan kerja farmakologi, pada umumnya dimiliki oleh senyawa kimia yang mengandung N.
3. Zat Pahit. Berpedoman pada rasa pahit adalah suatu metode yang mudah untuk memisahkan senyawa kimia tanaman, perlu waktu yang cukup sehingga seluruh zat pahit dalam sari menjadi zat yang dapat dikristalkan. Tidak jarang zat pahit dalam sari menjadi zat yang bersamaan, kerja farmakologisnya dikenal mencolok. Contoh yang paling terkenal adalah glikosida yang bekerja pada jantung. Cara untuk mengisolasi glikosida jantung ini seperti pada zat pahit, jadi tidak dilakukan pengujian farmakologisnya terhadap jantung.
4. Zat warna. Jumlah zat warna dari tanaman diperkirakan ± 2000 jenis. Pigmen tanaman mempunyai struktur kimia yang berlainan, begitu juga sifat fisika, kelarutan, warna, fuoresensi, dan sebagainya.
5. Tannin (Zat Samak). Tanin ditandai oleh sifatnya yang dapat menciutkan dan mengendapkan protein dari larutan dengan membentuk senyawa yang tidak larut.
6. Glikosida. Hasil penelitian menunjukkan bahwa sari tanaman pada umumnya mengandung senyawa bersifat alkohol atau fenol yang cukup larut baik dalam air, tetapi gugus hidroksi dari alkohol atau fenol tidak bebas, kebanyakan terikat pada satu atau lebih gula. Karena itu senyawa ini dimasukkan kedalam golongan
“glikosida”.
2.3.1 Pengambilan Sampel
Pengambilan sampel merupakan masalah yang sangat penting dalam analisis kimia sebab untuk mengetahui kadar atau konsentrasi suatu senyawa tertentu dalam sampel, hanya dilakukan terhadap jumlah kecil sampel. Oleh karena itu, cara pengambilan sampel yang salah meskipun metode analisisnya tepat dan teliti, hasilnya tidak akan memberikan petunjuk yang benar mengenai sifat yang akan diselidiki.
Aturan umum yang pasti mengenai cara pengambilan sampel dan berapa besarnya sampel yang harus diambil tidak dapat dirumuskan secara umum sebab cara pengambilan sampel sangat bergantung pada sifat dan jumlah bahan yang dianalisis. Cara pengambilan sampel padat akan berbeda dengan cara pengambilan zat cair dan akan berbeda pula dengan zat gas. Namun, pada prinsipnya sampel untuk dianalisa harus bersifat representatif, artinya sampel yang akan dianalisis benar-benar mewakili populasinya (Rohman, 2009).
2.4 Senyawa Flavonoida
Adapun struktur flavonoida adalah struktur yang mempunyai dua cincin aromatik yang dihubungkan dengan tiga karbom yang membentuk suatu cincin yang terdapat gugus eter (C-O-C) dan satu karbonil (C=O) yang dinotasikan cincin C. Kedua cincin aromatik ini dinotasikan cincin A dan B. Pada cincin A dan B ada dijumpai atau terdapat substituen hidroksil (-OH) atau metoksi, juga gugus gula yang bentuk C-glikosida atau O-glikosida.
Sistem penomoran untuk turunan senyawa flavonoid diberikan di bawah :
2.4.1 Kegunaan Senyawa Flavonoida
Tidak ada benda yang begitu menyolok seperti flavonoida yang memberikan konstribusi keindahan dan kesemarakan pada bunga dan buah-buahan di alam. Flavin memberikan warna kuning atau jingga, antosianin memberikan warna merah,ungu atau biru, yaitu semua warna yang terdapat pada pelangi kecuali warna hijau. Secara biologis, flavonoid memainkan peranan penting dalam kaitan penyerbukan pada tanaman oleh serangga. Sejumlah flavonoida mempunyai rasa pahit hingga dapat bersifat menolak sejenis ulat tertentu (Sastrohamidjojo, 1996).
Senyawa flavonoida sangat bermanfaat dalam makanan karena berupa senyawa fenolik, senyawa ini yang bersifat antioksidan kuat. Banyak kondisi penyakit yang diketahui bertambah parah oleh adanya radikal bebas seperti superoksida dan hidroksil, dan flavonoida memiliki kemampuan untuk menghilangkan dan secaara efektif menyapu spesies pengoksidasi yang merusak itu. Oleh karena itu, makanan yang kaya akan flavonoida dianggap penting untuk mengobati penyakit (Heinrich et al, 2009).
2.4.2 Biosintesis Flavonoida
Senyawa flavonoida diturunkan dari unit C6– C3 (fenil propana) yang bersumber
dari asam sikimat (via fenilalanin) dan unit C6 yang diturunkan dari jalur
poliketida. Fragmen poliketida ini disusun dari tiga molekul malonil-KoA yang bergabung dengan unit C6 - C3 (sebagai KoA tioester) untuk membentuk unit awal
triketida. Oleh karena itu, flavonoida yang berasal dari biosintesis gabungan terdiri atas unit-unit yang diturunkan dari asam sikimat dan jalur poliketida (Heinrich et al, 2009).
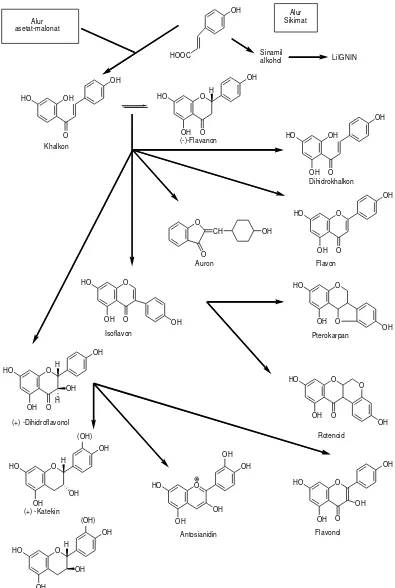
Semua varian flavonoida saling berkaitan karena alur biosintesis yang sama yang melalui alur sikimat dan alur asetat-malonat. Flavonoida yang pertama kali terbentuk pada biosintesis adalah khalkon dan semua bentuk diturunkan darinya melalui berbagai alur. Modifikasi flavonoida lebih lanjut mungkin terjadi pada berbagai tahap dan menghasilkan: penambahan atau pengurangan hidroksilasi, metilasi gugus hidroksil atau inti flavonoida, metilenasi gugus orto-hidroksil, dimerisasi (pembentukan biflavonoida), dan glikolisasi gugus hidroksil (pembentukan flavonoida O-glikosida) atau inti flavonoida (pembentukan flavonoida C-glikosida).
Skema biosintesis dari turunan asam sikimat:
Asam sikimat → asam prefenat → asam p-hidroksifenil piruvat → asam p
-hidroksifenillaktat → asam p-hidroksisinamat → flavanon. Hidroksilasi pada cincin A dan B terjadi setelah pembentukan cincin sempurna (Sirait, 2007).
Beberapa segi metabolisme yang paling menarik ialah pengendaliannya oleh pengatur tumbuh seperti etilena, tanggapannya terhadap infeksi oleh gugus dan kaitannya dengan metabolisme asam nukleat. Beberapa pengganti flavonoida terjadi kecuali isoflavonoida pengganti ini sangat lambat.
HOOC
2.4.3 Klasifikasi Senyawa Flavonoida
Dalam tumbuhan, flavonoida terdapat dalam berbagai bentuk struktur. Keragaman struktur flavonoida ini disebabkan karena perbedaan tahap modifikasi lanjutan dari struktur dasar flavonoida, antara lain:
1. Flavonoid O-glikosida.
Flavonoida biasanya terdapat sebagai flavonoida O-glikosida, pada senyawa tersebut satu gugus hidroksi flavonoida (atau lebih) terikat pada satu gula (atau lebih) terikat pada satu gula (atau lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh glikosilasi meyebabkan flavonoida menjadi kurang reaktif dan lebih mudah larut dalam air (cairan). Sifat terakhir ini memungkinkan penyimpanan flavonoida didalam vakuola sel (disinilah biaanya flavonoida berada). Walaupum gugus hidroksil pada setiap posisi dalam inti flavonoida dapat diglikolisasi, kenyataannya hidroksil pada tempat tertentu mempunyai peluang lebih besar untuk terglikolisasi ketimbang tempat-tempat lain. Sudah diakui bahwa dalam tumbuhan O-glikosilasi (dan metilasi) terjadi sebagai salah satu tahap akhir pada biosintesis dan katalisasi oleh enzim yang sangat khas. Ada kalanya glikosida mengalami modifikasi lebih lanjut, yaitu asilasi. Glikosida terasilasi mempunyai satu gugus hidroksil gula yang berikatan dengan asam seperti asam asetat atau asam ferulat. Glukosa merupakan gula yang paling umum terlibat, walaupun galaktosa, ramnosa, xilosa, dan arabinosa sering juga terdapat. Gula lain yang ditemukan adalah alosa, manosa, fruktosa, apiosa dan asam glukuronat serta galakturonat.
2. Flavonoid C-glikosida.
inti flavonoid. Jenis gula yang terlibat ternyata jauh lebih sedikit ketimbang jenis gula pada O-glikosida. Jenis aglikon flavonoid yang terlibat pun sangat terbatas. Jadi, walau pun isoflavon, flavanon, dan flavonol kadang-kadang terdapat dalam bentuk C-glikosida, hanya flavon C-glikosida yang paling lazim ditemukan.
3. Flavonoid Sulfat
Gabungan flavonoid lain yang mudah larut dalam air yang mungkin ditemukan hanya flavonoid sulfat. Senyawa ini mengandung satu ion sulfat atau lebih, yang terikat pada hidroksil fenol atau gula.
4. Biflavonoid
Biflavonod adalah flavonoid dimer, walau pun prosianidin dimer (satuan dasarnya katekin) biasanya tidak dimasukkan ke dalam golongan ini. Flavonoid yang biasanya terlibat adalah flavon dan flavanon yang secara biosintesis mempunyai pola oksigenasi yang sederhana 5,7,4’ (atau
kadang-kadang 5,7,3’,4’) dan ikatan antar-flavonoid berupa ikatan karbon-karbon atau kadang-kadang ikatan eter. Biflavonoid jarang ditemukan sebagai glikosida, dan penyebarannya terbatas, terdapat terutama pada gimnospermae.
5. Aglikon flavonoid yang aktif-optik
Aglikon flavonoid mempunyai atom karbon asimetrik dan dengan demikian menunjukkan keaktifan optik (yaitu memutar cahaya terpolarisasi-datar). Yang termasuk dalam golongan flavonid ini ialah flavanon, dihidroflavonol, katekin, pterokarpan, rotenoid, dan beberapa biflavonoid (Markham, 1988).
1. Flavon
Flavon bersamaan dengan flavonol merupakan senyawa yang paling tersebar luas dari semua pigmen tumbuhan kuning, meskipun warna kuning tumbuhan jagung biasanya disebabkan oleh karotenoid. Senyawa ini biasanya larut dalam air panas dan alkohol, meskipun beberapa flavonoid yang termetilasi tidak larut dalam air. Flavon berbeda dengan flavonol dimana pada flavon tidak terdapat gugus 3-hidroksi. Flavon dianggap sebagai induk dalam nomenklatur kelompok senyawa flavonoid.
O
O
A C
B
2. Flavonol
Flavonol paling sering terdapat sebagai glikosida, biasanya 3-glikosida. Larutan flavonol dalam suasana basa (tetapi flavon tidak) dioksidasi oleh udara tetapi tidak begitu cepat sehingga pengunaan basa pada pengerjaannya masih dapat dilakukan
O
O OH
A C
B
3. Isoflavon
Isoflavon merupakan senyawa yang tidak begitu mencolok, tetapi senyawa ini penting sebagai fitoaleksin (senyawa pelindung) dalam tumbuhan untuk pertahanan terhadap penyakit.
O
O
A C
4. Flavanon
Senyawa ini terdapat hanya sedikit sekali jika dibandingkan dengan flavonoid lain. Tidak berwarna atau hanya kuning sedikit. Flavanon (dihidroflavon) sering terjadi sebagai aglikon, tetapi beberapa glikosidanya dikenal misalnya hesperidin dan naringan dari jaringan kulit buah jeruk.
O
O
A C
B
5. Flavanonol
Flavanonol (atau dihidroflavonol) barangkali merupakan flavonoid yang paling kurang dikenal, dan tidak dapat diketahui apakah senyawa ini terdapat sebagai glikosida. Senyawa ini stabil dalam asam klorida panas tetapi terurai oleh udara.
O
O OH
A C
B
6. Antosianin
Antosianin adalah pigmen daun bunga merah sampai biru yang biasa, banyaknya sampai 30% bobot kering dalam beberapa bunga. Antosianin terdapat juga dalam bagian lain tumbuhan tinggi kecuali fungus. Antosianin selalu terdapat dalam bentuk glikosida.
O
OH
A C
7. Katekin
Katekin dan proantosianidin adalah dua golongan senyawa yang mempunyai banyak kesamaan. Semuanya senyawa tanpa warna, terdapat pada seluruh dunia tumbuhan tetapi terutama dalam tumbuhan berkayu.
O
OH HO
OH
OH OH
A C
B
8. Leukoantosianidin
Merupakan monomer flavan 3,4-diol, leukoantosianidin jarang terdapat sebagai glikosida, namun beberapa bentuk glikosida yang dikenal adalah apiferol, dan peltoginol.
O
OH
HO OH
OH OH
A C
B HO
9. Auron
Berupa pigmen kuning emas terdapat dalam bunga tertentu dan bryofita. Dalam larutan senyawa ini menjadi merah ros.
O
O CH
10. Kalkon
Pada kenyataan, pengubahan kalkon menjadi flavanon terjadi dengan mudah dalam larutan asam dan reaksi kebalikannya dalam basa. Reaksi ini mudah diamati karena kalkon warnanya jauh lebih kuat daripada warna flavanon, terutama dalam larutan basa warnya merah jingga. Oleh karena itu, hidrolisis glikosida kalkon dalam suasana asam menghasilkan aglikon flavanon sebagai senyawa jadi, bukan kalkon (Robinson, 1995).
A
O
B
2.4.4 Sifat Kelarutan Senyawa Flavonoida
Senyawa flavonoida merupakan senyawa polar karena mempunyai sejumlah gugus hidroksil atau gula sehingga dapat larut dalam pelarut polar seperti etanol (EtOH), metanol (MeOH), butanol (BuOH), aseton, air dan lain-lain. Adanya gula yang terikat pada flavonoida cenderung menyebabkan flavonoida lebih mudah larut dalam air dan dengan demikian campuran pelarut diatas dengan air merupakan pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon yang kurang polar seperti isoflavon, flavanon dan flavon cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform (Markham,1988).
2.5Skrining Fitokimia
Banyak reagen yang dapat digunakan untuk mengetahui keberadaan dari flavonoid, meskipun beberapa juga akan bereaksi positif dengan senyawa polifenol. Reagen yang biasa digunakan adalah :
xanton. Penggunaan zinc sebagai pengganti magnesium dapat dilakukan, dimana hanya flavanonol yang memberikan perubahan warna merah pekat sampai magenta, flavanon dan flavonol akan memberi warna merah muda yang lemah sampai magenta.
2. H2SO4(p), flavon dan flavonol akan memberikan perubahan larutan kuning
pekat. Kalkon dan auron menghasilkan larutan berwarna merah atau merah kebiru-biruan. Flavanon memberikan warna orange sampai merah (Cannell, 1998).
3. NaOH 10% , menghasilkan larutan biru violet
4. FeCl3 5% telah digunakan secara luas untuk mengidentifikasi senyawa
fenol, tetapi tidak dapat digunakan untuk membedakan macam-macam golongan flavonoid. Pereaksi ini memberi warna kehijauan, warna biru, dan warna hitam-biru (Robinson, 1995).
2.6Teknik Pemisahan
Teknik pemisahan memiliki tujuan untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen-komponen lainnya. Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan.
2.6.1 Ekstraksi
Sampel yang berasal dari tanaman setelah diidentifikasi, kemudian digolongkan menjadi spesies dan famili, sampel kemudian dikumpulkan dari bagian arialnya (daun, batang, kulit kayu pada batang, kulit batang, dan akar). Sampel ini kemudian dikeringkan dengan cara diangin-anginkan untuk menghindari penguraian komponen oleh udara atau mikroba.
Jika telah dikeringkan, biomassa kemudian digiling menjadi partikel-partikel kecil menggunakan blender atau penggilingan. Proses penggilingan ini penting karena ektraksi efektif pada partikel kecil, dikarenakan memiliki luas permukaan yang lebih besar.
Pemilihan pelarut ekstraksi sangat penting. Jika tanaman diteliti dari sudut pandang etnobotani, ektraksi harus mengikuti pemakaiannya secara tradisional. Kegagalan mengekstraksi biomassa dapat menyebabkan kehilangan akses untuk mendapatkan zat aktif.
Terdapat sejumlah metode ekstraksi, yang paling sederhana adalah ekstraksi dingin (dalam labu besar berisi biomassa), dengan cara ini bahan kering hasil gilingan diekstraksi pada suhu kamar secara berturut-turut dengan pelarut yang kepolarannya makin tinggi. Keuntungan utama cara ini adalah merupakan metode ekstraksi yang mudah karena ekstrak tidak dipanaskan sehingga kemungkinan kecil bahan alam terurai. Penggunaan pelarut dengan peningkatan kepolaran secara berurutan memungkinkan pemisahan bahan alam berdasarkan kelarutannya (dan polaritasnya) dalam ektraksi. Hal ini sangat mempermudah proses isolasi. Ekstraksi dingin memungkinkan banyak senyawa terekstraksi, meskipun beberapa senyawa memiliki kelarutan terbatas dalam pelarut ekstraksi pada suhu kamar (Heinrich et al, 2009).
perkolasi, ekstraksi sokletasi, ekstraksi dengan refluks, dan didestilasi uap dalam ekstraksi padat-cair, bahan tanaman ditempatkan dalam sebuah wadah, dan dibiarkan terjadi kontak dengan pelarut. Proses yang terjadi dari seluruh proses dinamis tersebut dapat diuraikan menjadi beberapa tahap, yaitu tahap pertama pelarut akan berdifusi ke dalam sel, kemudian pelarut akan melarutkan metabolit, dan pada akhir pelarut akan berdifusi keluar dari sel bersama dengan metabolit (Sarker, 2006).
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif terhadap senyawa yang diekstraksi.Untuk mendapatkan larutan ekstrak pekat, biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator (Harborne, 1996).
2.6.2 Partisi
Metode pemisahan yang mungkin paling sederhana adalah partisi, yang banyak digunakan sebagai tahap awal pemurnian ekstrak. Partisi menggunakan dua pelarut tak bercampur yang ditambahkan kedalam ekstrak tersebut, hal ini dapat dilakukan secara terus menerus dengan menggunakan dua pelarut yang tak bercampur yang kepolarannya meningkat. Partisi biasanya dilakukan melalui dua tahap:
1. Air/petroleum eter ringan (heksana) untuk menghasilkan fraksi nonpolar di lapisan organik
2.6.3 Kromatografi
Kromatografi adalah suatu teknik pemisahan yang pertama kali dipakai untuk memisahkan zat-zat warna tanaman, pemisahan dengan teknik ini dijalankan dengan mengadakan manipulasi atas dasar perbedaan sifat-sifat fisik dari zat-zat yang menyusun campuran (Adnan, 1997).
Saat ini kromatografi merupakan teknik pemisahan yang paling umum digunakan dan sering digunakan dalam bidang kima analisis dan dimanfaatkan untuk analisis, baik secara kulitatif dan kuantitatif bahkan analisis preparatif. Teknik kromatografi telah berkembang dan digunakan untuk memisahkan dan mengkuantifikasi komponen-komponen yang kompleks, baik organik maupun anorganik (Sudjadi, 1986).
Proses pemisahan analit-analit dalam sampel terdistribusi antara dua fase, yaitu fase diam dan fase gerak. Fase diam dapat berupa bahan padat dalam bentuk molekul kecil. Fase gerak dapat berupa gas atau cairan. Apabila fase geraknya adalah gas maka proses ini dikenal sebagai kromatografi gas. Apabila fase gerak yang digunakan adalah cairan, maka proses ini digunakan dalam kromatografi kertas dan kromatografi lapis tipis.
Pemisahan kromatografi planar (kromatografi lapis tipis dan kromatografi kertas) pada umumnya dihentikan sebelum semua fase gerak melewati seluruh permukaan fase diam. Solut pada kedua kromatografi ini dicirikan dengan faktor retardasi atau jarak migrasi solut terhadap jarak ujung fase geraknya. Faktor retardasi solut (Rf) didefenisikan sebagai:
Nilai maksimum Rf adalah 1 dan ini dicapai ketika solut mempunyai perbandingan distribusi (D) dan faktor retensi sama dengan 0 yang berarti solut bermigrasi dengan kecepatan yang sama dengan fase gerak.
Nilai minimum Rf adalah 0 dan ini teramati jika solut tertahan pada posisi titik awal di permukaan fase diam (Rohman, 2009).
Proses Sorpsi
Sorpsi merupakan proses pemindahan solut dari fase gerak ke fase diam, sementara itu proses sebaliknya (pemindahan solut dari fase diam ke fase gerak) disebut dengan desorpsi. Kedua proses ini (sorpsi dan desorpsi) terjadi secara terus menerus selama pemisahan kromatografi karenanya sistem kromatografi berada dalam keadaan kesetimbangan dinamis. Solut akan terdistribusi diantara dua fase yang bersesuaian dengan perbandingan distribusinya (D) untuk menjaga keadaan kesetimbangan ini. Ada 4 jenis mekanisme sorpsi dasar dan umumnya 2 atau lebih mekanisme ini terlibat dalam satu jenis kromatografi. Keempat jenis tersebut adalah adsorpsi, partisi, pertukaran ion, dan eksklusi ukuran.
Adsorben
Silika gel merupakan jenis adsorben (fase diam) yang penggunaannya paling luas. Permukaan silika gel terdiri atas gugus Si-O-Si dan gugus silanol (Si-OH). Gugus silanol bersifat sedikit asam dan polar karenanya gugus ini mampu membentuk ikatan hidrogen dengan solut-solut yang agak polar sampai sangat polar.
2.6.3.1 Kromatografi Lapis Tipis
Teknik kromatografi lapis tipis (KLT) sangat bermanfaat untuk analisis obat dan bahan lain dalam laboratorium karena hanya memerlukan peralatan sederhana, waktu cukup singkat (15-60 menit), dan jumlah zat yang diperiksa cukup kecil (±0,01 g senyawa murni atau 0,1 g simplisia). Selain itu, KLT tidak memerlukan ruang yang besar dan teknik pengerjaannya juga sederhana. Plat KLT yang biasa digunakan adalah plat dengan ukuran pori silika 60 Å dan ketebalan lapisan 25 µm dalam penyangga poliester atau aluminium, beberapa dengan menggunakan atau tanpa menggunakan indikator fluoresensi (Cseke et al, 2006).
Penjerap yang sering digunakan dalam kromatografi lapis adalah silika dan serbuk selulosa, sementara mekanisme sorpsi yang utama pada KLT adalah partisi dan adsorbsi. Fase gerak yang dikenal sebagai pelarut pengembangan bergerak sepanjang fase diam akibat adanya pengaruh kapiler pada pengembangan secara menaik (ascending) ataupun pengaruh gravitasi pada pengembangan secara menurun (descending) (Sudjadi, 2007).
Pemisahan pada kromatografi lapis tipis yang optimal akan diperoleh hanya jika menotolkan sampel dengan ukuran bercak sekecil dan sesempit mungkin. Penotolan sampel dapat dilakukan sebagai suatu bercak, pita atau dalam bentuk zig zag. Sampel dengan bentuk pita yang sempit akan menjamin resolusi yang paling tinggi bahkan ketika sampel mengandung sejumlah besar komponen dengan perbedaan-perbedaan nilai Rf yang minimal. Penotolan secara zig zag
akan menghasilkan suatu bentuk yang memungkinkan sejumlah sampel dalam jumlah besar ditotolkan tanpa dilakukan pencucian lapis tipis.
. Cara fisika yang dapat digunakan untuk menampakkan bercak adalah dengan pencacahan radioaktif dan dengan fluoresensi dibawah sinar ultraviolet. Jika senyawa tidak dapat berfluoresensi, maka bahan penyerapnya akan diberi indikator yang berfluoresensi, dengan demikian bercak akan kelihatan hitam karena menyerap sinar ultraviolet sedang latarnya akan kelihatan berfluoresensi (Rohman, 2009).
Kromatografi lapis tipis pada flavonoida ialah sebagai cara analisis cepat yang memerlukan bahan yang sangat sedikit. KLT berguna untuk tujuan berikut: a. Mencari pelarut untuk kromatografi kolom
b. Analisis fraksi yang diperoleh dari kromatografi kolom c. Identifikasi flavonoida secara ko-kromatografi
d. Isolasi flavonoida murni secara kecil (Markham, 1998)
2.6.3.2 Kromatografi Kolom
Metode pemisahan kromatografi didasarkan pada perbedaan distribusi molekul komponen diantara fase gerak dan fase diam berdasarkan tingkat kepolaran. Komponen akan bergerak lebih cepat meninggalkan kolom bila molekul-molekul komponen tersebut berinteraksi secara lemah dengan fase diam.
Bila eluen berupa larutan dari zat yang lebih kuat terikat pada berupa larutan dari zat yang lebih kuat terikat pada adsorben, komponen-komponen yang dipisahkan lebih murni dan keluar secara berurut dari kolom. Tekinik ini disebut displacement analysis dan digunakan untuk tujuan preparatif. Apabila eluen yang digunakan adalah pelarut murni, komponen-komponen dapat terpisah dengan sempurna sehingga cocok untuk tujuan analisis.
Ukuran keseluruhan kolom sungguh beragam, tetapi biasanya panjangnya sekurang-kurangnya 10 kali garis tengah dalamnya dan mungkin saja sampai 100 kalinya. Ukuran kolom dan banyaknya penjerap yang dipakai ditentukan oleh bobot campuran sampel yang akan dipisahkan.
Fraksi kolom yang mengandung senyawa yang sama (diperiksa dengan KLT) atau tampaknya berasal dari satu puncak (memakai pendeteksian sinambung) digabungkan, dan pelarutnya diuapkan, lebih baik dengan tekanan rendah. Jika pelarut dan penjerap murni maka fraksi-fraksi pun murni
(Gritter, 1991).
Adsorben dan Pelarut
Adsorben yang digunakan hendaknya memenuhi persyaratan sebagai berikut: 1. Tidak larut dalam pelarut yang digunakan
2. Inert (tidak bereaksi dengan sampel)
3. Cukup aktif sehingga memungkinkan perambatan sampel 4. Tidak berwarna agar pemisahan dapat diamati
5. Memungkinkan fase gerak mengalir dengan baik (Harmita, 2015).
2.7 Teknik Spektroskopi
2.7.1 Spektroskopi Ultraviolet (UV-Vis)
Senyawa polifenol memiliki dua karakteristik pita penyerapan Ultraviolet dengan maksimal jarak 240 sampai 285 nm dan 300 sampai 550 nm. Berbagai macam golongan flavonoid dapat dikenali dari spektrum UV mereka masing-masing, karakteristik spektra UV dari masing-masing flavonoid yang mengandung jumlah dari golongan hidroksil aglikon, pola substituen glikosida, dan golongan asil aromatik bahan alam.
Saat ini penggunaan Spektroskopi UV-Visible paling sering digunakan dalam aplikasi untuk analisa kuantitatif, dan nilai dari metode ini dapat mengurangi perbandingan informasi yang banyak dari teknik spektroskopi yang lainnya seperti NMR dan MS (Andersen, 2006).
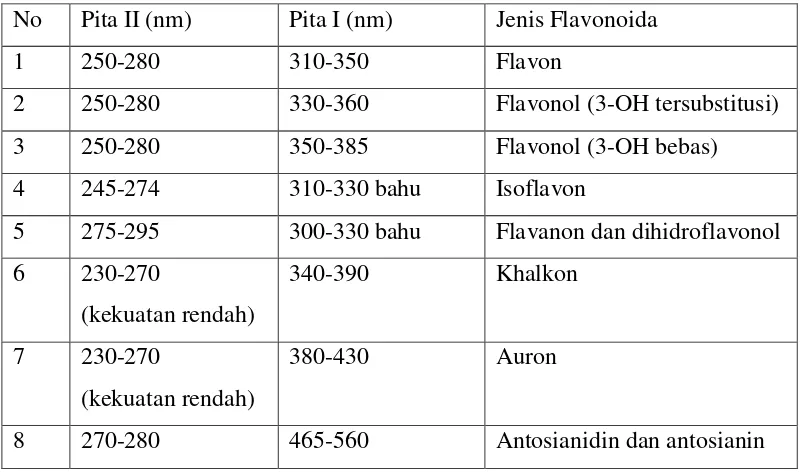
Ciri spektrum khas jenis flavonoid utama dengan pola oksigenasi yang setara disajikan pada tabel dibawah :
Tabel 2.1 Rentangan Serapan Spektrum UV-Visible golongan Flavonoida No Pita II (nm) Pita I (nm) Jenis Flavonoida
1 250-280 310-350 Flavon
2 250-280 330-360 Flavonol (3-OH tersubstitusi)
3 250-280 350-385 Flavonol (3-OH bebas)
4 245-274 310-330 bahu Isoflavon
5 275-295 300-330 bahu Flavanon dan dihidroflavonol 6 230-270
(kekuatan rendah)
340-390 Khalkon
7 230-270
(kekuatan rendah)
380-430 Auron
8 270-280 465-560 Antosianidin dan antosianin
2.7.2 Spektroskopi Inframerah (FT-IR)
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi getaran (vibrasi) yang berlainan. Inti-inti atom yang terikat oleh ikatan kovalen mengalami getaran (vibrasi) atau osilasi (oscillation) dengan cara serupa dengan dua bola yang terikat oleh suatu pegas.
Dengan demikian spektrometri inframerah dapat digunakan untuk mengidentifikasi adanya gugus fungsi dalam suatu molekul. Banyaknya energi yang diserap juga beraneka ragam dari ikatan ke ikatan.Ini disebabkan sebagian
oleh perubahan dalam momen dipol (µ≠0) pada saat energi diserap. Ikatan nonpolar (seperti C-H atau C-C) menyebabkan absorpsi lemah, sedangkan ikatan polar (seperti misalnya O-H, N-H, dan C=O) menunjukkan absorpsi yang lebih kuat.
Suatu ikatan dalam sebuah molekul dapat mengalami berbagai vibrasi molekul. Secara umum terdapat dua tipe vibrasi molekul:
1. Streching (vibrasi regang/ulur): vibrasi sepanjang ikatan sehingga terjadi perpanjangan atau pemendekan ikatan.
2. Bending (vibrasi lentur/tekuk): vibrasi yang disebabkan oleh sudut ikatan sehingga terjadi pembesaran atau pengecilan sudut ikatan.
Oleh karena itu suatu ikatan tertentu dapat menyerap energi lebih dari satu panjang gelombang. Contohnya, ikatan O-H menyerap energi pada frekuensi 3330 cm-1, energi pada panjang gelombang ini menyebabkan kenaikan vibrasi regang ikatan O-H itu. Suatu ikatan O-H itu juga menyerap pada kira-kira 1250 cm-1, energi pada panjang gelombang ini menyebabkan kenaikan vibrasi lentur. Tipe vibrasi yang berlain-lainan ini disebut cara vibrasi fundamental (Supratman, 2010).
2.7.3 Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR)
Kemampuan terhebat resonansi inti magnetik timbul karena tidak semua proton dalam molekul memiliki resonansi yang identik pada frekuensi yang sama. Hal ini sesuai dengan fakta bahwa berbagai macam proton dalam molekul dikelilingi oleh elektron dan memiliki sedikit perbedaan dalam lingkungan elektronik dari satu dan yang lainnya. Proton akan terlindungi oleh elektron yang mengelilingi mereka. Dalam daerah magnetik, peredaran elektron valensi dari daerah penghasil proton yang bertentangan dengan daerah magnetik yang berlaku.
Pergeseran kimia dalam unit δ ditunjukkan dalam jumlah resonansi proton yang bergeser dari TMS dalam bagian per juta (ppm) dari frekuensi dasar spektroskopi
δ=frekuensi spektrometer dalam MH pergeseran dalam H
Unsur dasar dari spektrometer nmr adalah ilustrasi skematis. Sampel dilarutkan dalam pelarut yang tidak memiliki proton (biasanya CCl4) dan dalam
jumlah yang kecil dari TMS yang ditambahkan sebagai pusat referensi internal.
Semua proton dalam molekul yang identik dalam lingkungan kimia akan memiliki pergerseran kimia yang sama. Dengan demikian, semua proton dari TMS atau semua proton dalam benzena, siklopentana, atau aseton memiliki nilai