PENETAPAN KADAR PHLOROTANNIN DALAM FRAKSI ETIL ASETAT ALGA COKLAT (Padina vickersiae Hoyt.) DENGAN METODE
FOLIN-CIOCALTEAU
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh:
Maria Delarosa Dipta Dharmesti NIM: 048114113
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
PENETAPAN KADAR PHLOROTANNIN DALAM FRAKSI ETIL ASETAT ALGA COKLAT (Padina vickersiae Hoyt.) DENGAN METODE
FOLIN-CIOCALTEAU HALAMA
N JUDUL SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh:
Maria Delarosa Dipta Dharmesti NIM: 048114113
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iii Skripsi
HALAMAN PERSETUJUAN PEMBIMBING
PENETAPAN KADAR PHLOROTANNIN DALAM FRAKSI ETIL ASETAT ALGA COKLAT (Padina vickersiae Hoyt.) DENGAN METODE
FOLIN-CIOCALTEAU
Oleh:
Maria Delarosa Dipta Dharmesti NIM: 048114113
Telah disetujui oleh
iv
Skripsi Berjudul
v
HALAMAN PERSEMBAHAN
“To him who knows to do good
and does not do it,
to him it is sin.” (James 4:17)
Karya ini kupersembahkan untuk:
Ibu, Bapak, dan adikku tercinta,
Para sahabat yang kusayangi,
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Maria Delarosa Dipta Dharmesti
Nomor Mahasiswa : 048114113
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
“Penetapan Kadar Phlorotannin dalam Fraksi Etil Asetat Alga Coklat (Padina vickersiae Hoyt.) dengan Metode Folin-Ciocalteau”
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, me-ngalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di Internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal : 12 Maret 2008
Yang menyatakan
vi PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Mahabaik atas segala kasih karunia-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul “PENETAPAN KADAR PHLOROTANNIN DALAM FRAKSI ETIL ASETAT ALGA COKLAT (Padina vickersiae Hoyt.) DENGAN METODE FOLIN-CIOCALTEAU”.
Dalam menyelesaikan skripsi ini, penulis menyadari telah mendapatkan bantuan, bimbingan, dorongan, dan dukungan dari berbagai pihak, baik secara langsung maupun tidak langsung. Pada kesempatan ini, dengan segala kerendahan hati penulis menyampaikan rasa terima kasih kepada:
1. Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Ignatius Yulius Kristio Budiasmoro, M.Si., selaku dosen pembimbing yang telah memberi bimbingan dan mendukung penulis mulai dari saat penyusunan proposal penelitian hingga penyelesaian skripsi ini. 3. Nora Iska Harnita, M.Si., Apt., dosen pembimbing secara de facto,
yang telah rela meluangkan waktu untuk membimbing penulis selama penelitian di laboratorium, memberikan solusi, semangat, serta dukungan saat penulis mengalami kebingungan dan kegagalan.
vii
5. Erna Tri Wulandari, M.Si., Apt., selaku dosen penguji yang telah memberi kritik dan saran dalam penyusunan skripsi ini.
6. Dr. Sabikis, Apt., selaku dosen yang telah memberi masukan dan saran, juga dukungan selama penelitian dan penyusunan skripsi ini. 7. Abdul Razaq Chasani, M.Si., dan Dr. Rina Sri Kasiamdari dari
Laboratorium Taksonomi Tumbuhan Fakultas Biologi Universitas Gadjah Mada Yogyakarta yang telah membantu mengidentifikasi alga coklat Padina vickersiae Hoyt.
8. Segenap laboran, Mas Parlan, Pak Prapto, Mas Kunto, Mas Sarwanto, Mas Ottok, Mas Sigit, Mas Wagiran, Pak Mukmin, dan juga Pak Kasiran yang telah membantu penulis selama bekerja di laboratorium. 9. Ibuku Theresia Ekamtiningsih dan Bapakku Josaphat Sudarsono
tercinta yang telah memberikan doa, cinta kasih, serta dukungan yang tulus dan tak terhingga.
10.Rekan seperjuangan, ”Tim Alga”, Dewi, Hendry, Angel, Andri, Fanny, dan Elsa, yang telah bekerjasama dengan penulis selama melakukan penelitian di laboratorium dan menyusun skripsi ini.
11.Dona, Ririt, dan Lidia, teman-teman yang telah bersedia mendengarkan uneg-uneg penulis, memberi bantuan, semangat, dan juga penghiburan.
viii
13.Adikku, Theresia Rasika Seta Dharmesti, atas bantuan dan dukungannya.
14.Teman-teman Fakultas Ekonomi Universitas Gadjah Mada Yogyakarta, atas segala dukungannya. Mohon maaf jika penulis sering tidak bisa mengerjakan tugas kelompok karena kesibukan di laboratorium.
15.Semua pihak yang telah berpartisipasi memberi dukungan dan bantuan hingga skripsi ini dapat terselesaikan.
Penulis menyadari bahwa dalam pembuatan skripsi ini masih banyak terdapat kekurangan dan ketidaksempurnaan. Oleh karena itu, dengan besar hati penulis menerima segala kritik, saran, dan pertanyaan yang berguna.
Akhir kata, penulis berharap semoga skripsi ini berguna bagi pihak-pihak yang membutuhkan dan dapat memberikan sumbangan bagi ilmu pengetahuan, khususnya mengenai alga coklat.
Yogyakarta, Januari 2008,
ix
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 12 Maret 2008
Penulis
x
DAFTAR ISI
Halaman
HALAMAN JUDUL... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN... iv
HALAMAN PERSEMBAHAN ... v
PRAKATA... vi
PERNYATAAN KEASLIAN KARYA ... ix
DAFTAR ISI... x
DAFTAR GAMBAR ... xiii
DAFTAR TABEL... xiv
DAFTAR LAMPIRAN... xv
DAFTAR LAMPIRAN... xv
INTISARI... xvii
ABSTRACT... xviii
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 2
C. Keaslian Penelitian... 3
D. Manfaat ... 3
BAB II. TINJAUAN PUSTAKA... 5
A. Alga Coklat Padina vickersiae Hoyt. ... 5
B. Polifenol Alga (Phlorotannin) ... 7
C. Soxhletasi... 8
D. Spektrofotometri UV-Visibel... 9
xi
F. Metode Folin-Ciocalteau... 13
G. Validasi Metode Analisis ... 14
H. Keterangan Empiris... 18
BAB III. METODE PENELITIAN ... 20
A. Jenis Rancangan Penelitian ... 20
B. Variabel Penelitian dan Definisi Operasional ... 20
1. Variabel Penelitian ... 20
a. Variabel pengacau terkendali... 20
b. Variabel pengacau tidak terkendali... 20
2. Definisi Operasional ... 20
C. Bahan dan Alat... 21
1. Bahan ... 21
2. Alat... 22
D. Tata Cara Penelitian ... 22
1. Preparasi sampel alga coklat Padina vickersiae Hoyt.... 22
2. Screening fitokimia alga ... 23
a. Preparasi ekstrak ... 23
b. Uji tannin dan polifenol ... 23
3. Isolasi crude phlorotannin dari alga coklat Padina vickersiae Hoyt... 24
4. Optimasi metode kolorimetri (Metode Folin-Ciocalteau) ... 25
a. Pembuatan larutan standar ... 25
b. Penentuan Operating Time (OT)... 25
c. Penentuan panjang gelombang maksimum (λ maks)... 26
d. Pembuatan kurva baku phloroglucinol... 26
5. Validasi metode analisis... 26
6. Estimasi kadar polifenol total pada fraksi etil asetat alga coklat Padina vickersiae Hoyt.... 27
7. Analisis hasil ... 28
a. Analisis hasil uji kualitatif untuk tannin dan polifenol ... 28
xii
BAB IV. HASIL DAN PEMBAHASAN ... 29
A. Preparasi Sampel Alga Coklat Padina vickersiae Hoyt.... 29
B. Screening Fitokimia Alga ... 32
C. Isolasi Crude Phlorotannin dari Alga Coklat Padina vickersiae Hoyt... 33
D. Prinsip Reaksi Kolorimetri (Metode Folin-Ciocalteau)... 34
E. Optimasi Metode... 37
1. Pembuatan larutan standar ... 37
2. Penentuan Operating Time (OT)... 37
3. Penentuan panjang gelombang maksimum (λ maks)... 39
4. Pembuatan kurva baku phloroglucinol... 41
F. Validasi Metode Analisis ... 43
1. Akurasi ... 43
2. Presisi ... 45
3. Linearitas... 46
G. Estimasi Kadar Phlorotannin Dalam Fraksi Etil Asetat Alga Coklat Padina vickersiae Hoyt.... 46
BAB V. KESIMPULAN DAN SARAN... 49
A. Kesimpulan ... 49
B. Saran... 49
DAFTAR PUSTAKA ... 50
LAMPIRAN... 54
xiii
DAFTAR GAMBAR
Halaman
Gambar 1. Padina vickersiae Hoyt... 5
Gambar 2. Derivat phlorotannin... 7
Gambar 4. Diagram tingkat energi elektronik... 10
Gambar 5. Reaksi fenol dengan pereaksi FeCl3... 32
Gambar 6. Oksidasi fenol dalam suasana basa ... 35
Gambar 7. Reaksi fenol dengan pereaksi Folin-Ciocalteau ... 36
Gambar 8. Spektra operating time phloroglucinol yang direaksikan dengan pereaksi Folin-Ciocalteau... 38
Gambar 9. Spektra hasil scanning panjang gelombang maksimum phloroglucinol pada tiga konsentrasi (A = 1,0 ppm; B = 3,0 ppm; C = 6,0 ppm) setelah direaksikan dengan pereaksi Folin-Ciocalteau... 40
xiv
DAFTAR TABEL
xv
DAFTAR LAMPIRAN
Halaman Lampiran 1. Hasil determinasi alga dari Laboratorium Taksonomi Tumbuhan
Fakultas Biologi Universitas Gadjah Mada Yogyakarta... 54
Lampiran 2. Hasil perhitungan kadar air serbuk alga coklat Padina vickersiae Hoyt. dengan Metode Karl Fischer ... 56
Lampiran 3. Hasil screening fitokimia Padina vickersiae Hoyt. ... 58
Lampiran 4. Foto uji kualitatif ... 59
Lampiran 5. Foto fraksinasi ... 61
Lampiran 6. Hasil Operating Time (OT) ... 63
Lampiran 7. Hasil scanning panjang gelombang maksimum (λ maks) ... 64
Lampiran 8. Hasil scanning panjang gelombang maksimum (λ maks) konsentrasi 1,0 ppm ... 64
Lampiran 9. Hasil scanning panjang gelombang maksimum (λ maks) konsentrasi 3,0 ppm ... 65
Lampiran 10. Hasil scanning panjang gelombang maksimum (λ maks) konsentrasi 6,0 ppm ... 65
Lampiran 11. Penimbangan baku phloroglucinol... 66
Lampiran 12. Contoh perhitungan kurva baku phloroglucinol... 67
Lampiran 13. Hasil pembacaan seri baku replikasi pertama pada panjang gelombang 750,1 nm... 68
Lampiran 14. Hasil pembacaan seri baku replikasi kedua pada panjang gelombang maksimum hasil scanning... 68
Lampiran 15. Hasil pembacaan seri baku replikasi ketiga pada panjang gelombang 750,1 nm... 69
Lampiran 16. Validasi Metode Analisis... 70
Lampiran 17. Analisis statistik regresi-linier kurva baku replikasi pertama... 72
Lampiran 18. Analisis statistik regresi-linier kurva baku replikasi kedua ... 73
Lampiran 19. Analisis statistik regresi-linier kurva baku replikasi ketiga... 74
xvi
Lampiran 21. Penimbangan sampel ... 75
Lampiran 22. Absorbansi sampel... 76
Lampiran 23. Contoh perhitungan kadar sampel ... 76
xvii INTISARI
Alga coklat banyak tumbuh dan tersebar di perairan Indonesia. Salah satunya adalah Padina vickersiae Hoyt. Potensi hasil laut Indonesia sangat melimpah, namun belum digunakan secara optimal untuk bahan pangan maupun sebagai bahan obat-obatan. Penelitian ini berfokus pada senyawa polifenol alga, khususnya spesies alga coklat Padina vickersiae Hoyt., yaitu phlorotannin.
Tujuan penelitian ini adalah mendapatkan crude phlorotannin dari alga coklat Padina vickersiae Hoyt. dan menetapkan kadar phlorotannin dalam fraksi etil asetat alga coklat Padina vickersiae Hoyt. dengan metode Folin-Ciocalteau. Ekstraksi menggunakan metode soxhletasi dengan pelarut metanol pro analisis (p.a.). Fraksinasi ekstrak yang didapat dilakukan menggunakan klorofom p.a., aquadestilata, dan etil asetat p.a.
Konsentrasi phlorotannin dalam fraksi etil asetat ditetapkan dengan metode Folin-Ciocalteau. Standar yang digunakan adalah phloroglucinol dengan konsentrasi 0,5; 1,0; 2,0; 3,0; 4,0; 5,0; dan 6,0 ppm dengan pelarut aseton 75%. Konsentrasi phlorotannin dihitung ekuivalen dengan phloroglucinol (mg PE/g sampel).
Hasil penetapan kadar phlorotannin pada tiga replikasi sampel yaitu sebesar 10,19 mg PE/g sampel; 11,95 mg PE/g sampel; dan 13,95 mg PE/g sampel, diukur dengan panjang gelombang 750,1 nm dan persamaan kurva baku y = 0,1233 x + 0,0151. Kadar phlorotannin pada alga coklat Padina vickersiae Hoyt. diperoleh sebesar 12,03 + 1,88 mg PE/g sampel.
xviii
ABSTRACT
Brown algae grow and spread widely in Indonesia marine territorial. Padina vickersiae Hoyt. is a species of brown alga. The potency of Indonesian marine product is very high, but not yet optimally used as neither foods nor medicines. This research focused on phlorotannin, some algal polyphenolic compound in brown alga Padina vickersiae Hoyt.
This research’s objectives are to get phlorotannin crude of brown alga Padina vickersiae Hoyt. and to determine phlorotannin concentration in ethyl acetate fraction of brown alga Padina vickersiae Hoyt. using Folin-Ciocalteau method. Padina vickersiae Hoyt. was soxhletated with methanol pro analysis (p.a.). The extract was fractionated using chloroform p.a., aquadestilata, and ethyl acetate p.a.
Phlorotannin concentration was determined using Folin-Ciocalteau method and phloroglucinol as a standard with concentration 0.5; 1.0; 2.0; 3.0; 4.0; 5.0; and 6.0 ppm in 75% acetone. Phlorotannin concentration was equivalently calculated with phloroglucinol (mg PE/g sample).
Phlorotannin concentrations in three replications are 10.19 mg PE/g sample; 11.95 mg PE/g sample; and 13.95 mg PE/g sample, measured using 750.1 nm wavelength and phloroglucinol’s linear regression equation y = 0.1233 x + 0.0151. The phlorotannin concentration is 12.03 + 1.88 mg PE/g sample.
1 BAB I PENGANTAR
A. Latar Belakang
Saat ini telah dikenal 8000 senyawa fenolik alam dengan struktur yang digambarkan sebagai suatu fenol (cincin aromatik yang berikatan sedikitnya dengan 1 gugus hidroksil) seperti asam kafein, asam ferulat, kuersetin, apigenin, genistein, resveratrol, asam nordihidroguaiaretat, asam karnosat, silimarin, polifenol teh, dan tannin. Senyawa-senyawa fenolik tersebut terbukti mempunyai efek protektif terhadap kerusakan kulit yang diinduksi radiasi UV (Svobodova et al., 2003).
Eksplorasi senyawa fenolik seperti asam fenolik, flavonoid, dan polifenol untuk mendapatkan agen fotoprotektif baru terus dilakukan. Namun kebanyakan eksplorasi tersebut masih mengandalkan tumbuhan-tumbuhan terrestrial. Perubahan orientasi dan fokus pengembangan produk alam dari terrestrial menjadi pengembangan berbasis kelautan sangat diperlukan mengingat Indonesia sebagai “the largest marine-mega biodiversity” (Dahuri, 2003).
meningkatkan nilai ekonomis alga tersebut. Di masa yang akan datang, phlorotannin alga coklat dapat digunakan sebagai zat aktif pada sediaan kosmetik seperti sunscreen.
Zhang et al. (2006) telah melakukan penelitian tentang metode sederhana untuk estimasi kandungan polifenol total pada rumput laut dan ekstraknya berdasarkan reaksi kolorimetri Ciocalteau. Keuntungan metode Folin-Ciocalteau diantaranya adalah prosedurnya yang lebih mudah dan praktis karena hanya memerlukan satu jenis pereaksi. Sementara itu, Pavia et al. (2003) melaporkan variasi intraspesifik kandungan phlorotannin dalam alga coklat Ascophyllum nodosum. Dilaporkan pula bahwa efikasi antiproliferasi ekstrak alga berkorelasi positif dengan kandungan total polifenol yang diduga berhubungan dengan kandungan phlorotannin (Yuan and Walsh, 2006).
Penelitian ini merupakan bagian dari program hibah penelitian A3 Fakultas Farmasi Universitas Sanata Dharma Yogyakarta yang diampu oleh Ignatius Yulius Kristio Budiasmoro, M.Si. dan Agnes Nora Iska Harnita, M.Si., Apt. Pengambilan data dilakukan secara bersama-sama oleh Maria Delarosa Dipta Dharmesti, Hendry Kurniawan, Dewi Riana Primawati, Andriani Noerlita Ningrum, Maria Stephanie, Angela Woro Dwi Priharina, dan Elizabeth Budi Gunawan.
B. Perumusan Masalah
1. Apakah phlorotannin dapat diisolasi dari alga coklat Padina vickersiae Hoyt.? 2. Berapakah kadar phlorotannin dalam fraksi etil asetat alga coklat Padina
vickersiae Hoyt. yang ditetapkan menggunakan metode Folin-Ciocalteau?
C. Keaslian Penelitian
Sepengetahuan peneliti, penelitian mengenai isolasi dan penetapan kadar phlorotannin dalam fraksi etil asetat alga coklat Padina vickersiae Hoyt. menggunakan metode Folin-Ciocalteau belum pernah dilakukan.
D. Manfaat 1. Manfaat teoritis
Hasil penelitian ini diharapkan mampu memberikan pengetahuan mengenai kadar phlorotannin pada alga coklat Padina vickersiae Hoyt. sehingga dapat dikembangkan sebagai senyawa bioaktif.
2. Manfaat praktis
Hasil penelitian ini diharapkan dapat memberi sumbangan bagi ilmu pengetahuan mengenai biota laut dan pemanfaatannya, khususnya alga coklat Padina vickersiae Hoyt., dalam industri makanan, farmasi, dan kosmetik.
E. Tujuan 1. Tujuan umum
2. Tujuan khusus
5 BAB II
TINJAUAN PUSTAKA
A. Alga Coklat Padina vickersiae Hoyt.
Alga coklat Padina vickersiae Hoyt. termasuk famili Dictyotaceae, genus Padina, dan spesies Padina vickersiae Hoyt. Sinonimnya adalah Padina gymnospora (Kützing) Sonder, Zonaria gymnospora Kützing, dan Padina crassa Yamada (Abbott and Huisman, 2004).
Padina vickersiae Hoyt. berukuran panjang 5 cm hingga 20 cm, tinggi 5 cm hingga 10 cm, memiliki thallus dengan konsistensi membran yang tebal, berbentuk seperti paku pada bagian bawah dan bagian atas membuka seperti kipas angin dan terdiri dari 2 hingga 8 lapisan seperti pisau. Alga ini berwarna putih kekuningan hingga transparan dengan garis-garis yang lebih gelap dan sedikit berambut pada kedua sisinya (gambar 1). Padina vickersiae Hoyt. menyimpan kalsium dalam permukaan lapisan kipasnya. Alga ini bertumpu pada substrat dengan beberapa rhizoid yang dapat dilihat pada bagian dasar alga (Anonim, 2003a).
Habitat Padina vickersiae Hoyt. adalah pada daerah yang banyak sinar matahari di kedalaman yang berbatu-batu, dan daerah kaya substrat di kedalaman rendah. Padina vickersiae Hoyt. banyak tersebar di bagian laut yang dangkal, namun juga dapat ditemukan pada kedalaman lebih dari 20 meter. Alga ini menyukai peningkatan suhu dan cahaya matahari (Anonim, 2003a).
Padina vickersiae Hoyt. tersebar di Laut Mediterania, Laut Hitam, dan Samudera Atlantik bagian timur-laut dan barat-laut (Anonim, 2003a). Alga ini juga terdapat di Samudera Hindia, diantaranya di Kepulauan Andaman, Australia, Bahrain, Bangladesh, India, Indonesia (Sumatra dan Timor), Kenya, Kuwait, Madagaskar, Mauritius, Qatar, Saudi Arabia, Singapura, Somalia, Tanzania, dan Yemen (Anonim, 2007).
Reproduksi Padina vickersiae Hoyt. terjadi pada musim panas. Organ reproduksinya terletak pada lapisan yang berbentuk bulat pada bagian kipasnya. Reproduksi mudah terjadi di bagian laut yang dangkal (Anonim, 2003a).
Komposisi kimiawi alga coklat Padina vickersiae Hoyt. diantaranya dua belas macam sterol dari fraksi sterol. Dua jenis sterol utama yaitu kolesterol dan fucosterol. Mayoritas asam lemak adalah asam palmitat, diikuti asam oleat, dan asam miristat. Asam lemak tak jenuh ditemukan dalam konsentrasi sangat rendah. Fraksi volatil bebas asam lemak didominasi ester aromatik, benzil alkohol, dan benzaldehid. Pada fraksi ini juga terdapat senyawa-senyawa terpenoid, fenol, dan sulfur dalam konsentrasi rendah. Ekstrak n-butanol Padina vickersiae Hoyt. didominasi asam lemak dan senyawa poli-ol (Kamenarska et al., 2002).
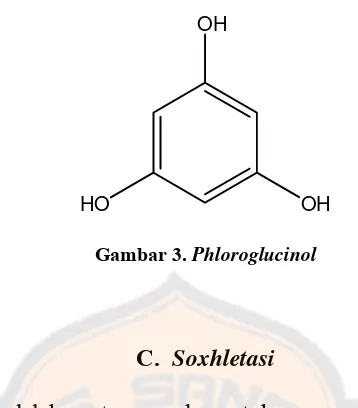
B. Polifenol Alga (Phlorotannin)
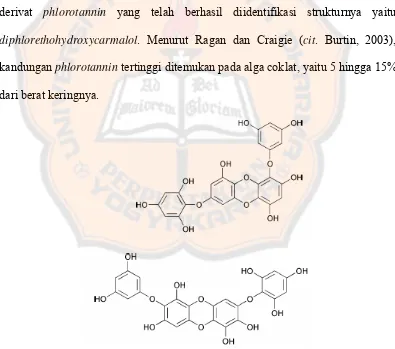
Polifenol alga yang juga disebut phlorotannin berbeda dengan polifenol pada tumbuhan terrestrial. Polifenol dari tumbuhan terrestrial terdiri dari asam galat dan elagat, sedangkan polifenol alga terdiri dari unit-unit phloroglucinol (1,3,5-trihidroksibenzen) (gambar 3). Phlorotannin tersusun dari sekumpulan molekul yang heterogen (tingkat heterogenitas struktur dan polimerisasi tinggi), sehingga memiliki rentang potensi aktivitas biologis yang luas. Beberapa contoh struktur senyawa derivat phlorotannin ditunjukkan pada gambar 2. Salah satu derivat phlorotannin yang telah berhasil diidentifikasi strukturnya yaitu diphlorethohydroxycarmalol. Menurut Ragan dan Craigie (cit. Burtin, 2003), kandungan phlorotannin tertinggi ditemukan pada alga coklat, yaitu 5 hingga 15% dari berat keringnya.
OH
HO OH
Gambar 3. Phloroglucinol
C. Soxhletasi
Soxhletasi adalah suatu prosedur untuk memperoleh kandungan senyawa organik dari jaringan tumbuhan kering seperti biji kering, akar, dan daun, dengan mengekstraksi terus-menerus serbuk bahan dengan alat soxhlet menggunakan pelarut secara berganti-ganti: eter, lalu petroleum eter, dan kloroform untuk mengekstraksi lipid dan terpenoid, kemudian alkohol dan etil asetat untuk senyawa yang lebih polar. Metode ini biasa digunakan untuk sampel dengan skala ukuran berat gram. Suatu senyawa yang sama mungkin didapati dengan perbandingan berbeda dalam beberapa fraksi senyawa tersebut (Harborne, 1987).
D. Spektrofotometri UV-Visibel
Spektrofotometri UV-Visibel adalah salah satu teknik analisis fisika-kimia yang mengamati interaksi atom atau molekul dengan radiasi elektromagnetik pada panjang gelombang 190-380 (UV) dan 380-780 nm (visibel) dengan menggunakan instrumen spektrofotometer (Mulja dan Suharman, 1995).
Prinsip kerja spektrofotometri adalah berdasarkan atas interaksi antara radiasi elektromagnetik dengan materi berupa atom, ion atau molekul. Radiasi elektromagnetik merupakan salah satu jenis energi yang ditransmisikan dalam ruang dengan kecepatan tinggi (Khopkar, 1990). Interaksi antara molekul yang mempunyai gugus kromofor dan radiasi elektromagnetik pada daerah sinar ultraviolet dan sinar tampak akan menghasilkan spektra absorbansi elektronik. Spektra absorbansi ini dapat digunakan untuk analisis kuntitatif karena jumlah radiasi elektromagnetik yang diserap memiliki hubungan dengan jumlah molekul penyerap (Skoog, 1985).
Pada umumnya semua molekul dapat menyerap radiasi elektromagnetik di daerah UV dan visibel karena mereka memiliki elektron, baik berkelompok maupun tunggal yang dapat tereksitasi ke tingkat energi yang lebih tinggi. Panjang gelombang yang menunjukkan terjadinya absorbansi tergantung pada kekuatan ikatan elektron dalam molekul tersebut (Day and Underwood, 1986).
orbital elektron anti-bonding (Mulja dan Suharman, 1995). Diagram tingkat energi elektron pada keadaan dasar dan keadaan tereksitasi ditunjukkan pada gambar 4.
Gambar 4. Diagram tingkat energi elektronik (Mulja dan Suharman, 1995)
Transisi-transisi elektron mencakup perpindahan suatu elektron dari keadaan dasar (σ, π atau n) ke salah satu dari dua keadaan tereksitasi (σ* atau π*) (Fessenden and Fessenden, 1999). Adapun jenis-jenis transisi yang mungkin terjadi antara lain dapat diuraikan sebagai berikut :
Transisi σ → σ*. Transisi ini terjadi pada senyawa organik dengan ikatan tunggal (Mulja dan Suharman, 1995). Elektron yang terdapat pada orbital σ akan tereksitasi ke orbital anti bonding σ*, dengan mengabsorpsi radiasi. Absorpsi ini jarang terlihat pada daerah UV yang dekat (100-190 nm) (Khopkar, 1990).
gelombang lebih panjang yaitu antara 150 -250 nm.
Transisi n → π*. Transisi ini meliputi transisi elektron n ke orbital anti bonding π*. Absorbansi ini terjadi pada panjang gelombang yang panjang dan memiliki intensitas rendah (Sastrohamidjojo, 1991). Kenaikan polaritas pelarut pada transisi ini akan mengakibatkan pergeseran pita absorbansi menuju ke panjang gelombang yang lebih pendek (pergeseran biru = hipsokromik). Hal ini disebabkan ikatan hidrogen dengan keadaan dasar elektron n lebih mantap dibandingkan keadaan π* yang energinya turun menjadi π1*.
Transisi π → π*. Transisi ini terjadi pada senyawa dengan ikatan rangkap dua dan tiga. Pada transisi jenis ini, kenaikan polaritas pelarut akan mengakibatkan pergeseran merah. Hal ini disebabkan pelarut yang polar akan lebih memantapkan keadaan π* (Mulja dan Suharman, 1995).
Transisi elektronik yang berguna dalam eksperimen yaitu transisi n → π* dan transisi π → π* yang memberikan spektra pada 200-700 nm. Kedua
transisi ini memerlukan adanya kromofor dalam struktur molekulnya (Day and Underwood, 1986). Kromofor adalah gugus tak jenuh kovalen yang dapat menyerap radiasi pada daerah ultraviolet (Sastrohamidjojo, 1991). Terikatnya gugus auksokrom pada gugus kromofor akan mengakibatkan perubahan panjang gelombang maupun intensitas absorbansi (Silverstain et al., 1986).
kuantitatif pengukuran absorbansi dilakukan pada panjang gelombang saat absorbansi maksimum, disebabkan dua alasan:
a. Sensitivitas maksimum diperoleh dengan melakukan pengukuran pada panjang gelombang maksimum karena konsentrasi yang diukur pada panjang gelombang tersebut memberikan respon yang paling kuat.
b. Pada panjang gelombang maksimum, perubahan yang kecil akan memberikan perubahan absorbansi yang minimal (kecuali kalau pita absorpsi sangat tajam) (Fatah, 1989).
E. Kolorimetri
Metode kolorimetri merupakan salah satu metode analisis yang didasarkan pada gugus yang dapat bereaksi membentuk warna serta memiliki rantai panjang rangkap terkonjugasi. Pengukuran intensitas warna dilakukan menggunakan instrumen spektrofotometer visibel. Fokus metode ini adalah pada bagian spektrum elektromagnetik, yaitu pada daerah tampak mata manusia, yaitu sekitar 400-700 nm atau 4000-7000 Å (1 nm = 10 Å). Metode ini melibatkan perbandingan intensitas warna secara visual, artinya warna larutan senyawa yang diteliti dibandingkan dengan warna suatu standar atau seri standar (Butz and Nobel, 1961).
meningkat tertentu dan membandingkan warnanya dengan senyawa yang hendak dianalisis. Kolorimetri mencakup pengubahan senyawa tidak berwarna menjadi zat yang berwarna dan penentuan fotometrinya dilakukan dalam daerah sinar tampak (400–800 nm) (Roth and Baschke, 1994).
F. Metode Folin-Ciocalteau
Metode Folin-Ciocalteau merupakan oksidasi atau reduksi kolorimetrik untuk mengukur semua senyawa fenolik. Pereaksi Folin-Ciocalteau merupakan larutan kompleks ion polimerik yang dibentuk dari asam fosfomolibdat dan asam heteropolifosfotungstat. Pereaksi ini terbuat dari air, tungstat, natrium-molibdat, asam fosfat, asam klorida, lithium sulfat, dan bromin (Folin and Ciocalteau, 1944).
G. Validasi Metode Analisis
Validasi metode merupakan proses terdokumentasi yang menjamin bahwa pelaksanaan metode analisis telah sesuai dengan tujuan pelaksanaannya (Mulja dan Hanwar, 2003). Pengembangan suatu metode analisis akan menentukan parameter-parameter validasi, yaitu:
1. Akurasi, yaitu kedekatan hasil analisis yang diperoleh menggunakan metode analisis tertentu dengan nilai yang sebenarnya. Penentuan akurasi metode analisis dapat dilakukan dengan membandingkan kadar terukur dari sejumlah tertentu senyawa standar yang sengaja ditambahkan ke dalam sampel pada jumlah yang tertentu pula. Nilai perbandingan tersebut dikenal sebagai persen perolehan kembali (recovery) (Anonim, 2003b). Menurut Harmita (2004), nilai perolehan kembali suatu metode analisis dikatakan baik bila masuk dalam rentang 98-102 % jika konsentrasi analit yang diukur 100 %.
3. Sensitivitas, yaitu kemampuan metode untuk mengidentifikasi perbedaan yang kecil antarkonsentrasi analit. Faktor yang mempengaruhi sensitivitas adalah kemiringan kurva baku dan presisi. Semisal terdapat dua metode analisis dengan tingkat presisi yang sama tetapi kemiringan kurva baku keduanya berbeda, maka metode yang lebih sensitif adalah metode yang kurva bakunya lebih curam, begitu pula sebaliknya (Skoog, 1985).
4. Spesifisitas. Anonim (2003b) dalam United States Pharmacopeia 26 mendefinisikan spesifisitas sebagai kemampuan suatu metode untuk membedakan dan mengukur secara akurat dan spesifik suatu analit, terpisah dari komponen-komponen sampel yang lain. Ada dua cara dalam menentukan spesifisitas, yaitu:
a. Semua komponen sampel yang mengganggu dapat memisah dengan resolusi yang baik.
b. Menggunakan detektor selektif yang dapat merespon senyawa tertentu dan tidak dapat merespon senyawa lain (Snyder et al., 1997).
6. Rentang (range), merupakan rentang antara kadar terendah hingga kadar tertinggi analit yang dapat diukur secara kuantitatif menggunakan metode analisis tertentu dan menghasilkan akurasi, presisi, dan linearitas yang memadai. Range biasanya mempunyai satuan yang sama dengan satuan yang digunakan untuk hasil analisis, misalnya: persen, ppm (Anonim, 2003b).
Menurut Mulja dan Suharman (1995), kesalahan dalam analisis kimia dapat dikategorikan menjadi 2 kelas utama, yaitu:
1. Kesalahan Sistematik (determinate errors)
Kesalahan sistematik adalah hasil analisis yang menyimpang secara tetap dari nilai kadar yang sebenarnya karena proses pelaksanaan prosedur analisis, sehingga kesalahan ini disebut juga kesalahan prosedur (Mulja dan Suharman, 1995). Faktor-faktor penyebab kesalahan sistematik antara lain:
a. Kesalahan personil dan operasi
Kesalahan ini disebabkan oleh cara pelaksanaan analisis dan bukan karena metode. Kesalahan operasi umumnya bersifat fisis (bukan khemis), misalnya kesalahan pengamatan visual pada titik akhir titrasi, kekeliruan cara pencucian endapan, dan sebagainya. Kesalahan ini bersifat individual dan sangat dipengaruhi oleh keterampilan analis dalam melakukan pekerjaan analisis.
b. Kesalahan alat dan pereaksi
dengan pipet ukur atau gelas ukur, penggunaan buret 50 ml (buret makro) untuk analisis mikro, dan sebagainya.
c. Kesalahan metode
Kesalahan ini dapat disebabkan oleh kesalahan pengambilan sampel, kesalahan akibat reaksi kimia yang tidak sempurna, atau ikut mengendapnya zat-zat yang tidak diinginkan (Day and Underwood, 1986).
Kesalahan sistematik dapat dihindari atau diperkecil dengan:
1). Mengkalibrasi instrumen dan melakukan koreksi secara berkala (biasanya setiap 3 bulan atau disesuaikan dengan frekuensi pemakaian alat).
2). Memilih metode dan prosedur standar dari badan resmi. 3). Memakai bahan kimia dengan derajat untuk analisis. 4). Meningkatkan pengetahuan dan keterampilan para analis. 5). Melakukan penetapan blanko atau kontrol dengan zat baku. 6). Melakukan penetapan paralel (in duplo atau in triplo). 2. Kesalahan Tidak Sistematik (indeterminate errors)
H. Keterangan Empiris
Dalam Padina vickersiae Hoyt. terdapat senyawa polifenol alga. Ekstrak n-butanol Padina vickersiae Hoyt. didominasi asam lemak dan senyawa poli-ol (Kamenarska et al., 2002). Menurut Ragan dan Craigie (cit. Burtin, 2003), kandungan phlorotannin tertinggi ditemukan pada alga coklat, yaitu 5 hingga 15% dari berat keringnya. Kandungan polifenol dalam alga coklat Padina vickersiae Hoyt. dapat diteliti secara kualitatif menggunakan pereaksi FeCl3. Apabila terdapat polifenol di dalamnya, filtrat ekstrak serbuk alga akan bereaksi positif membentuk warna coklat kehijauan saat ditetesi pereaksi FeCl3 (Fong et al., 1992).
Polifenol alga (phlorotannin) dapat diekstraksi dengan cara maserasi maupun soxhletasi menggunakan pelarut metanol. Kerugian cara maserasi adalah waktu pengerjaan yang lama dan penyariannya kurang sempurna. Soxhletasi lebih efisien karena menggunakan panas dan ekstraksi secara berkesinambungan (Anonim, 1986). Struktur polifenol alga dapat dipertahankan hingga suhu 170°C. Oleh karena itu, soxhletasi digunakan untuk mengekstraksi polifenol dalam alga Padina vickersiae Hoyt..
Pereaksi Folin-Ciocalteau spesifik terhadap gugus fenol, sehingga dapat bereaksi dengan polifenol alga, mengoksidasi gugus fenolik-hidroksil, membentuk kompleks fosfotungstat-fosfomolibdat berwarna biru, dan dapat dibaca absorbansinya pada spektrofotometer visibel (Khadambi, 2007).
20 BAB III
METODE PENELITIAN
A. Jenis Rancangan Penelitian
Penelitian ini termasuk dalam penelitian non-eksperimental karena tidak ada intervensi atau perlakuan terhadap parameter yang diamati.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel Penelitian
a. Variabel pengacau terkendali
Variabel pengacau terkendali dalam penelitian ini yaitu waktu panen alga, tempat pengambilan sampel, suhu penyimpanan sampel, merek pereaksi, merek pelarut, peralatan yang digunakan, suhu dan kelembaban ruang spektrofotometer.
b. Variabel pengacau tidak terkendali
Variabel pengacau tidak terkendali dalam penelitian ini yaitu umur alga, suhu air laut, kondisi tanah atau karang tempat tumbuh alga, suhu dan kelembaban ruangan percobaan.
2. Definisi Operasional
b. Phlorotannin adalah polifenol alga yang spesifik dan mempunyai molekul dengan gugus yang sangat heterogen (struktur dan heterogenitas pada tingkat polimerisasi) yang memberikan aktivitas biologik yang luas.
c. Ekstrak kering adalah ekstrak metanol alga coklat hasil soxhletasi selama 56 jam hingga pelarut jernih dan diuapkan pelarutnya dengan vacuum rotary evaporator sampai pekat kemudian dikeringkan di atas waterbath. d. Fraksi etil asetat alga coklat adalah fraksi yang diperoleh dari fraksinasi
ekstrak simplisia menggunakan etil asetat dan diuapkan pelarutnya dengan vacuum rotary evaporator sampai pekat kemudian dikeringkan di atas waterbath.
e. Parameter validasi metode analisis yang digunakan dalam penelitian ini adalah akurasi, presisi, dan linearitas.
f. Kadar phlorotannin adalah kadar polifenol alga coklat yang dihitung ekivalen dengan phloroglucinol (mg PE/g sampel).
C. Bahan dan Alat 1. Bahan
2. Alat
Alat yang digunakan adalah autoklaf Sanshenyiliaogixie YX-400Z, oven Memmert ULM 500, UM 400, dan U 50, oven Termaks seri 88725, blender Retsch bv, seperangkat alat titrasi Karl Fischer Mettler DL-18, seperangkat spektrofotometer UV-VIS Perkin Elmer Lambda 20, timbangan elektrik BP 160 dan Scaltec SBC 22 readability 0,01 mg, vacuum rotary evaporator (Buchi), waterbath (Abo-tech), mikropipet 100-1000 µl (Acura 825, Socorex), tabung reaksi bertutup (Scott-Germany), Soxhlet, Labu Alas Bulat (LAB), heating mantle, corong pisah 500 mL, alat sentrifus, homogenizer (Vortex Genie), dan alat-alat gelas.
D. Tata Cara Penelitian 1. Preparasi sampel alga coklat Padina vickersiae Hoyt.
dilakukan dengan cara menimbang spuit berisi air, kemudian dimasukkan 1 tetes air ke dalam alat. Spuit ditimbang kembali untuk menentukan berat air yang dimasukkan. Hitung kesetaraan air. Masukkan 1 mL metanol ke dalam alat titrasi menggunakan spuit dan dititrasi dengan alat (blanko). Hitung kadar air. Sampel ekstrak metanol serbuk alga coklat Padina vickersiae Hoyt. dimasukkan 1 mL ke dalam alat titrasi menggunakan spuit, dititrasi dengan alat, dan dihitung kadar air dalam sampel. Kadar air dalam sampel dihitung dengan menggunakan rumus:
x - blanko (10)
berat sampel yang ditimbang (mg)
x 100% Kadar air =
x = angka yang muncul pada alat (%) dikalikan 10.000 (mg) atau berat yang
dimaksudkan untuk konversi.
2. Screening fitokimia alga a. Preparasi ekstrak
Tiga puluh mL metanol 80 % ditambahkan pada 10 g serbuk alga coklat
Padina vickersiae Hoyt. dengan derajat halus 20/30. Lalu dimasukkan ke dalam
wadah dan dipanaskan pada waterbath selama ± 1 jam. Campuran didinginkan
pada suhu ruang, disaring menggunakan corong dan kertas saring, kemudian
ditambahkan kembali 5 mL metanol 80 % dan disaring menggunakan corong dan
kertas saring (Fong et al., 1992).
b. Uji tannin dan polifenol
Sejumlah volume yang setara dengan 10 g ekstrak metanol 80 % yang
menggunakan waterbath, ditambahkan 25 mL akuadest panas dan dicampur
secara merata. Campuran dibiarkan hingga dingin pada suhu kamar, lalu
ditambahkan 3-4 tetes larutan NaCl 10 %. Ekstrak disaring dengan menggunakan
vacuum. Filtrat dibagi ke dalam 4 tabung masing-masing 3 mL. Pada tabung I
ditambahkan 4-5 tetes larutan gelatin 1 %. Pada tabung II ditambahkan 4-5 tetes
pereaksi garam gelatin (gelatin 1% ditambahkan NaCl 10 %). Pada tabung III
ditambahkan 3-4 tetes ferri klorida (FeCl3) LP. Tabung IV dijadikan kontrol dan
tidak ditambahkan pereaksi apapun. Diamati warna yang terbentuk pada setiap
tabung (Fong et al., 1992).
3. Isolasi crude phlorotannin dari alga coklat Padina vickersiae Hoyt.
Serbuk alga coklat Padina vickersiae Hoyt. ditimbang sebanyak 40 g,
atau sesuai kapasitas soxhlet, kemudian dimasukkan ke dalam kertas filter
Schleicher & Schuell dan dimasukkan ke labu soxhlet. Setelah itu, pelarut metanol
diberikan sebanyak 2 kali sirkulasi. Soxhletasi dilakukan dengan suhu 120 ± 20oC sampai tetesan pelarut jernih, kurang lebih selama 56 jam.
Hasil soxhletasi diuapkan menggunakan vacuum rotary evaporator
sampai 1/10 volume semula, lalu ditambahkan metanol hingga 120 mL,
ditambahkan 120 mL kloroform, dan 45 mL air dalam corong pisah 500 mL,
kemudian digojog dan didiamkan hingga membentuk dua lapisan. Lapisan atas
dipisahkan dan diekstraksi dengan etil asetat dua kali masing-masing 75 mL dan
air masing-masing 10 mL. Fraksi etil asetat dikumpulkan dan diuapkan hingga
4. Optimasi metode kolorimetri (Metode Folin-Ciocalteau) a. Pembuatan larutan standar
Standar (phloroglucinol) ditimbang seksama lebih kurang 0,05 g,
kemudian dilarutkan dalam aseton 75% sampai volume 50,0 mL. Seri
konsentrasi larutan intermediet dipipet dari larutan induk sebanyak 0,5; 1,0;
2,0; 3,0; 4;0; 5,0; dan 6,0 mL dan dimasukkan ke dalam labu ukur 10,0 mL,
untuk konsentrasi 0,5; 1,0; 2,0; 3,0; 4;0; 5,0; dan 6,0 ppm. Larutan intermediet
dipipet sebanyak 0,5 mL dan dimasukkan ke dalam labu ukur 50,0 mL yang
mengandung 2,5 mL pereaksi fenol Folin-Ciocalteau yang diencerkan (1:1),
biarkan selama 2 menit. Selanjutnya ditambahkan 7,5 mL Na2CO3 1,9 M dan
dicampur dengan akuadest sampai 50,0 mL. Campuran divortex setiap 15
menit, selama 30 detik, sebanyak 2 kali vortex. Kemudian disentrifus selama 5
menit dengan kecepatan 4000 rpm dan diambil supernatannya.
b. Penentuan Operating Time (OT)
Larutan intermediet 4,0 ppm dipipet sebanyak 0,5 mL dan dimasukkan ke
dalam labu ukur 50,0 mL yang mengandung 2,5 ml pereaksi fenol
Folin-Ciocalteau yang telah diencerkan dengan akuadest (1:1). Campuran didiamkan
selama 2 menit lalu ditambahkan 7,5 ml Na2CO3 1,9 M, dan ditambah
akuadest sampai volume 50,0 mL. Operating time diukur pada
spektrofotometer visibel. Pengukuran dilakukan pada panjang gelombang
c. Penentuan panjang gelombang maksimum (λ maks)
Larutan intermediet phloroglucinol dengan konsentrasi 1,0; 3,0; dan 6,0
ppm dipipet sebanyak 0,5 mL dan dimasukkan ke dalam labu takar 50,0 ml
yang mengandung 2,5 ml pereaksi fenol Folin-Ciocalteau yang telah
diencerkan dengan akuadest (1:1). Campuran didiamkan selama 2 menit, lalu
ditambah 7,5 ml Na2CO3 1,9 M, dan akuadest sampai volume 50,0 mL.
Campuran diinkubasi pada suhu ruang selama OT. Pada 15 menit pertama dan
15 menit kedua, campuran divortex selama 30 detik, kemudian campuran hasil
reaksi disentrifus dengan kecepatan 4000 rpm selama 5 menit. Ketiga larutan
di-scan menggunakan spektrofotometer visibel untuk menentukan panjang
gelombang maksimumnya.
d. Pembuatan kurva baku phloroglucinol
Dibuat larutan standar seperti pada prosedur 4a. Absorbansi diukur pada
panjang gelombang maksimum hasil scanning. Persamaan kurva baku
dihitung menggunakan regresi-linier yang menyatakan hubungan antara
konsentrasi terhadap absorbansi.
5. Validasi metode analisis
Dibuat larutan standar seperti pada prosedur 4a. Absorbansi diukur
pada panjang gelombang maksimum hasil scanning dan panjang gelombang
teoritis phloroglucinol dengan spektrofotometer visibel. Persamaan kurva
baku dihitung dan dibuat replikasi sebanyak 3 kali. Recovery, kesalahan
% Recovery = konsentrasi standar phloroglucinol terukur konsentrasi standar phloroglucinol sebenarnya
x 100%
% Kesalahan sistematik = 100 % – % Recovery
% Coefficient of Variation (CV) = Standar Deviasi (SD) konsentrasi terukur rata-rata konsentrasi terukur
x 100%
6. Estimasi kadar polifenol total pada fraksi etil asetat alga coklat Padina vickersiae Hoyt.
Fraksi etil asetat alga coklat Padina vickersiae Hoyt. ditimbang lebih
kurang 0,05 g dengan seksama, kemudian dilarutkan dalam aseton 75 % hingga
volumenya 50,0 mL. Pipet 5,0 mL larutan sampel dan masukkan ke dalam labu
ukur 50,0 mL yang mengandung 2,5 mL pereaksi Folin-Ciocalteau yang
diencerkan dengan akuadest (1:1), biarkan selama 2 menit. Selanjutnya
ditambahkan 7,5 mL Na2CO3 1,9 M dan dicampur dengan akuadest sampai
volume 50,0 mL. Campuran tersebut diinkubasi pada suhu ruang selama
operating time (OT) sambil divortex setiap 15 menit, selama 30 detik, sebanyak 2
kali vortex. Kemudian campuran disentrifus selama 5 menit dengan kecepatan
4000 rpm dan diukur absorbansinya pada panjang gelombang yang digunakan
untik membaca absorbansi larutan baku dengan spektrofotometer visibel.
Absorbansi dimasukkan ke persamaan kurva baku. Konsentrasi polifenol total
7. Analisis hasil
a. Analisis hasil uji kualitatif untuk tannin dan polifenol
Warna hasil reaksi pada uji tabung dibandingkan dengan warna zat yang
tidak diberi tambahan pereaksi. Perubahan warna yang terjadi menunjukkan
adanya konstituen fenolik dan sebaliknya, bila tidak ada reaksi dengan larutan
FeCl3 maka tidak ada senyawa tannin maupun senyawa fenolik. Apabila
terbentuk warna hijau kebiruan atau hitam kehijauan setelah penambahan
larutan FeCl3 (diasumsikan terbentuk endapan setelah penambahan garam
gelatin) maka terdapat senyawa tannin tipe katekol, sedangkan jika terbentuk
warna hitam kebiruan setelah penambahan larutan FeCl3 (diasumsikan terjadi
endapan setelah penambahan garam gelatin) maka terdapat senyawa tannin
tipe pirogalol. Apabila tidak ada endapan tetapi terjadi perubahan warna
menjadi kehijauan atau hitam kebiruan maka tidak terdapat senyawa tannin
(Fong et al., 1992).
b. Analisis hasil penetapan kadar phlorotannin dalam fraksi etil asetat Padina
vickersiae Hoyt. menggunakan Metode Folin-Ciocalteau
Hasil berupa kadar dihitung dengan memasukkan absorbansi sampel ke
persamaan kurva baku phloroglucinol. Konsentrasi polifenol total dihitung
29 BAB IV
HASIL DAN PEMBAHASAN
A. Preparasi Sampel Alga Coklat Padina vickersiae Hoyt.
Sampel alga coklat diambil dari Pantai Drini, Gunungkidul Yogyakarta
pada tanggal 23 Maret 2007. Alga coklat dipanen pada musim penghujan, pukul
16.00–17.00 WIB, saat air laut surut dengan suhu air laut 27°C. Variasi
kandungan polifenol pada alga coklat dapat disebabkan oleh habitat, spesies, umur
alga, dan masa panen. Identifikasi spesies alga dilakukan di Laboratorium
Taksonomi Tumbuhan Fakultas Biologi Universitas Gadjah Mada Yogyakarta dan
hasilnya adalah alga coklat sampel termasuk famili Dictyotaceae, genus Padina,
dan spesies Padina vickersiae Hoyt (lampiran 1).
Preparasi sampel Padina vickersiae Hoyt. dilakukan untuk mendapatkan
sampel yang layak uji dan meminimalkan cemaran yang mungkin terkandung di
dalamnya. Alga tumbuh dalam suatu populasi biota laut yang terdiri atas berbagai
spesies alga. Sebelum digunakan, alga dipisahkan dengan spesies lain dengan
melihat ciri-ciri fisiknya, yaitu thallus dengan konsistensi membran yang tebal,
berbentuk seperti paku pada bagian bawah dan bagian atas membuka seperti kipas
angin dan terdiri dari 2 hingga 8 lapisan seperti pisau, warna putih kekuningan
hingga transparan dengan garis-garis yang lebih gelap dan sedikit berambut pada
kedua sisinya. Pencucian alga utuh dengan air mengalir dilakukan untuk
menghilangkan kotoran, berupa pasir (silikat), zat kapur, epifit, sedimen, dan
mengganggu sampel yang akan diteliti. Senyawa-senyawa yang tidak diketahui
dalam bahan organik asing dapat turut mereduksi kompleks asam dalam pereaksi
Folin-Ciocalteau, sehingga akan berpengaruh terhadap warna larutan sampel yang
dihasilkan (membentuk warna biru-hijau). Menurut Auterhoff dan Knabe (1978),
silika dapat membentuk kompleks molibdat H6[SiMo12O40].n H2O dengan
pereaksi Folin-Ciocalteau, sehingga bila terdapat unsur silika akan mengganggu
analisis sampel.
Alga coklat Padina vickersiae Hoyt. memiliki thallus berbentuk kipas
dengan zat kapur (kalsium) di bagian ujungnya. Kalsium akan ikut tercuci saat
preparasi, namun kemungkinan sisa kalsium tidak akan mengganggu reaksi yang
terjadi karena kalsium bukan merupakan reduktor yang dapat mereduksi kompleks
molibdat-tungstat pada Folin-Ciocalteau.
Sebelum dikeringkan, alga sampel dipanaskan menggunakan panas uap
dengan suhu di atas 100°C untuk inaktivasi enzim polifenol oksidase. Menurut
Yagar dan Sagiroglu (2000), polifenol oksidase relatif termostabil. Polifenol
oksidase hanya kehilangan 65% kemampuannya pada suhu 70°C dalam waktu 30
menit. Maka, untuk inaktivasi polifenol oksidase, diperlukan suhu lebih dari
100°C. Polifenol oksidase dibuat inaktif agar rantai polifenol pada alga tidak
bertambah panjang. Polifenol alga yang akan ditetapkan kadarnya adalah
polifenol berpolimer sedang karena memiliki panjang gugus kromofor tertentu,
sehingga dapat memberi absorbansi pada panjang gelombang UVA (400–320 nm)
dan UVB (320–280 nm). Apabila rantai polimer terlalu panjang, maka akan
sinar visibel tidak berbahaya terhadap kulit manusia, sedangkan radiasi UV dapat
menyebabkan iritasi, bahkan kanker pada kulit manusia. Polifenol dengan rantai
sangat panjang tidak dapat dikembangkan menjadi bahan aktif sediaan sunscreen
karena tidak dapat memberikan absorbansi pada panjang gelombang UV.
Sampel Padina vickersiae Hoyt. disimpan dalam bentuk kering dan
diserbuk menggunakan blender. Sebelum diserbuk, Padina vickersiae Hoyt.
disimpan dalam oven bersuhu 90°C hingga benar-benar kering. Panas dalam oven
harus merata untuk mencegah tumbuhnya jamur dan mikrobia lain yang dapat
merusak senyawa-senyawa yang terkandung dalam alga. Bagian-bagian alga akan
lebih mudah diperkecil menggunakan kekuatan mekanis blender dalam kondisi
kering dan tidak lembab.
Menurut Standar Nasional Indonesia (SNI) 01-2690-1992, salah satu
kriteria persyaratan kualitas rumput laut kering yang baik adalah kadar air dengan
nilai maksimum yang berkisar antara 15% hingga 35%, tergantung pada jenis
alga, karena apabila kandungan air melebihi batasan tersebut, maka dapat
memudahkan tumbuhnya mikroba yang dapat merusak kandungan kimia alga.
Oleh karena itu, dilakukan penetapan kadar air terhadap sampel atau serbuk
kering Padina vickersiae Hoyt.
Penetapan kadar air dalam serbuk alga coklat Padina vickersiae Hoyt.
dilakukan menggunakan metode Karl Fischer. Prinsip metode ini adalah reaksi
kuantitatif air dengan larutan anhidrat sulfur dioksida dan iodium dengan adanya
buffer yang bereaksi dengan ion hidrogen, ditunjukkan dengan persamaan reaksi:
Sampel yang diukur kadar airnya adalah ekstrak metanol serbuk alga
coklat Padina vickersiae Hoyt. Dengan adanya metanol, satu mol air akan
membutuhkan satu mol iod untuk bereaksi. Hasil penetapan kadar air pada
replikasi sampel masing-masing 6,40 %b/b, 5,42 %b/b, dan 4,22 %b/b. Pada
penelitian ini, didapatkan kadar air sampel Padina vickersiae Hoyt. sebesar 5,35 +
1,092 %b/b, sehingga sampel telah memenuhi persyaratan SNI.
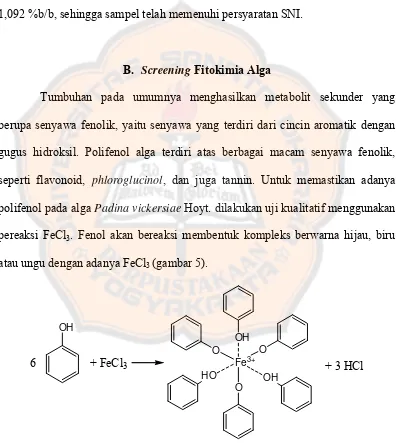
B. Screening Fitokimia Alga
Tumbuhan pada umumnya menghasilkan metabolit sekunder yang
berupa senyawa fenolik, yaitu senyawa yang terdiri dari cincin aromatik dengan
gugus hidroksil. Polifenol alga terdiri atas berbagai macam senyawa fenolik,
seperti flavonoid, phloroglucinol, dan juga tannin. Untuk memastikan adanya
polifenol pada alga Padina vickersiae Hoyt. dilakukan uji kualitatif menggunakan
pereaksi FeCl3. Fenol akan bereaksi membentuk kompleks berwarna hijau, biru
atau ungu dengan adanya FeCl3 (gambar 5).
OH
kompleks berwarna hijau hingga ungu 6
Hasil uji kualitatif menunjukkan adanya endapan setelah penambahan
gelatin dan NaCl, yang menandakan adanya tannin. Prinsip reaksi pengendapan
ini adalah tannin (zat samak) mendenaturasi gelatin (protein) (Fong et al., 1992).
Warna coklat tua kehijauan setelah penambahan FeCl3 menandakan adanya
polifenol. Maeda et al. (2005) mengemukakan bahwa alga coklat mengandung
pigmen fucoxanthin, karotenoid yang membuat alga berwarna coklat, sehingga
hasil uji kualitatif berwarna coklat tua kehijauan.
C. Isolasi Crude Phlorotannin dari Alga Coklat Padina vickersiae Hoyt. Sebelum dilakukan isolasi crude phlorotannin, serbuk alga kering
diekstraksi dengan cara soxhletasi, yaitu salah satu metode ekstraksi pelarut.
Prinsip metode ini adalah memisahkan senyawa berdasarkan polaritas.
Phlorotannin merupakan senyawa yang relatif polar sehingga dapat larut dalam
pelarut yang relatif polar seperti metanol. Proses ekstraksi berulang dengan
pemanasan pada soxhletasi akan menghasilkan ekstrak lebih banyak dengan
jumlah pelarut tertentu. Metode soxhletasi dipilih karena prosesnya cepat dan
jumlah hasil ekstrak yang didapat lebih banyak dibandingkan metode maserasi.
Pertimbangan lainnya yaitu polifenol alga tahan terhadap pemanasan hingga
170°C, sehingga soxhletasi dapat dilakukan pada suhu 100°C hingga 120°C.
Soxhletasi sampel alga Padina vickersiae Hoyt. dilakukan selama 56 jam, hingga
pelarut menjadi jernih.
Fraksinasi crude phlorotannin dilakukan menggunakan pelarut yang
bawah, berdasarkan berat jenisnya). Berdasarkan kepolarannya, phlorotannin
akan lebih tertarik pada fraksi metanol-air. Senyawa seperti lipid dan karotenoid
akan lebih tertarik pada fraksi kloroform. Phlorotannin pada fraksi metanol-air
kemudian dipisahkan dari senyawa non-fenolik lainnya menggunakan etil asetat.
Phlorotannin yang akan ditetapkan kadarnya adalah phlorotannin yang memiliki
kepolaran intermediate sehingga akan tertarik kepada fraksi etil asetat. Saat etil
asetat ditambahkan, sampel tidak memisah dan perlu penambahan air agar dapat
terpisah dari fraksi metanol-air. Penambahan air berfungsi untuk menarik metanol,
sehingga fraksi etil asetat dapat memisah. Berdasarkan berat jenisnya fraksi etil
asetat berada di bagian atas, sedangkan fraksi metanol-air berada di bagian bawah.
Crude phlorotannin didapat dengan menguapkan fraksi etil asetat di atas
waterbath. Setelah pelarut menguap, fraksi disimpan di dalam oven bersuhu 50°C
agar tidak menjadi lembab dan rusak karena terpapar udara bebas yang
mengandung uap air.
D. Prinsip Reaksi Kolorimetri (Metode Folin-Ciocalteau)
Estimasi konsentrasi polifenol dalam crude phlorotannin hasil fraksinasi
dilakukan secara kolorimetri menggunakan pereaksi Folin-Ciocalteau. Pereaksi
Folin-Ciocalteau pada kondisi normal berwarna kuning. Menurut G. Jender (cit.
Auterhoff and Knabe, 1978), pereaksi Folin-Ciocalteau dapat digunakan dalam
spektrofotometri pada suasana asam, karena dengan penambahan asam,
Folin-Ciocalteau akan berwujud cair non-koloid. Selain itu, Folin-Folin-Ciocalteau akan lebih
digunakan dalam penelitian ini sudah berada dalam suasana asam sehingga
memiliki konsistensi cair non-koloid. Asam yang ditambahkan saat pembuatan
pereaksi Folin-Ciocalteau umumnya asam fosfat, tungstat, maupun wolframat.
Pereaksi Folin-Ciocalteau dengan tambahan asam fosfat memiliki rumus
(NH4)3[P(Mo3O10)4].6H2O.
Menurut Auterhoff dan Knabe (1978), pereaksi Folin Ciocalteau relatif
stabil dan tidak mudah rusak karena perubahan suhu, sehingga apabila diperlukan
dapat digunakan pemanasan untuk mempercepat reaksi reduksi-oksidasi dengan
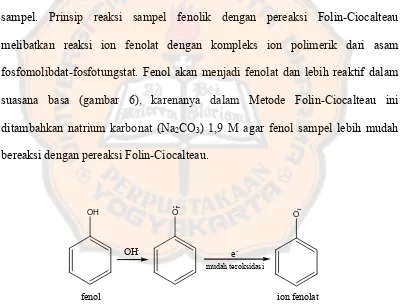
sampel. Prinsip reaksi sampel fenolik dengan pereaksi Folin-Ciocalteau
melibatkan reaksi ion fenolat dengan kompleks ion polimerik dari asam
fosfomolibdat-fosfotungstat. Fenol akan menjadi fenolat dan lebih reaktif dalam
suasana basa (gambar 6), karenanya dalam Metode Folin-Ciocalteau ini
ditambahkan natrium karbonat (Na2CO3) 1,9 M agar fenol sampel lebih mudah
bereaksi dengan pereaksi Folin-Ciocalteau.
O O
OH- e
-mudah teroksidasi
OH
fenol ion fenolat
Ion fenolat dioksidasi oleh asam dalam pereaksi Folin-Ciocalteau dan
kompleks molibdenum-tungstat akan direduksi sebagian oleh sampel hingga
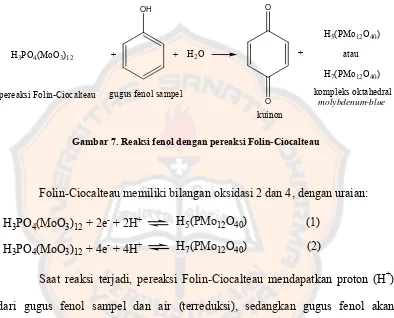
menghasilkan warna biru (molybdenum-blue) (gambar 7).
H3PO4(MoO3)12 + molybdenum-blue
Gambar 7. Reaksi fenol dengan pereaksi Folin-Ciocalteau
Folin-Ciocalteau memiliki bilangan oksidasi 2 dan 4, dengan uraian:
H3PO4(MoO3)12 + 2e- + 2H+ H5(PMo12O40)
H3PO4(MoO3)12 + 4e- + 4H+ H7(PMo12O40)
(1)
(2)
Saat reaksi terjadi, pereaksi Folin-Ciocalteau mendapatkan proton (H+)
dari gugus fenol sampel dan air (terreduksi), sedangkan gugus fenol akan
mendapatkan tambahan oksigen dari air dan pereaksi (teroksidasi), sehingga
membentuk kompleks oktahedral molybdenum-blue dan kuinon. Kompleks
oktahedral yang terbentuk merupakan kompleks MoO3-fosfat dengan fosfor (P)
sebagai pusatnya. Molibdat pada kompleks dapat disubstitusi oleh tungsten (W).
Kompleks molybdenum-blue yang terbentuk berupa koloid dan akan
menjadi encer dengan adanya asam fosfat pada pereaksi Folin-Ciocalteau,
E. Optimasi Metode 1. Pembuatan larutan standar
Standar yang digunakan dalam penelitian ini adalah phloroglucinol yang
merupakan salah satu monomer phlorotannin. Phloroglucinol mudah larut dalam
aseton 75%. Larutan standar digunakan sebagai pembanding dalam penetapan
kadar phlorotannin, dan kadar phlorotannin dihitung ekivalen terhadap
phloroglucinol.
Larutan standar phloroglucinol direaksikan dengan pereaksi
Folin-Ciocalteau, dibiarkan selama 2 menit, lalu ditambah Na2CO3 1,9 M untuk
memberi suasana basa agar fenol lebih mudah bereaksi. Setelah penambahan basa,
larutan mulai berwarna biru dan kemudian divortex agar warna yang terbentuk
homogen. Sebelum dibaca absorbansinya, larutan disentrifugasi selama 5 menit
dengan kecepatan 4000 rpm untuk mengendapkan senyawa atau unsur tidak
diketahui yang tidak dapat larut dalam aseton maupun air. Dari hasil sentrifugasi
didapatkan supernatan berwarna biru dan endapan berwarna putih. Supernatan
berwarna biru akan dibaca absorbansinya pada spektrofotometer visibel.
2. Penentuan Operating Time (OT)
Penentuan operating time dilakukan untuk menentukan saat yang tepat
untuk membaca absorbansi sampel setelah direaksikan karena pada saat
pembacaan absorbansi hendaknya sampel memberikan absorbansi yang stabil.
Penentuan OT perlu dilakukan karena kompleks molybdenum-blue yang akan
pereaksi Folin-Ciocalteau pada waktu tertentu. Operating time diukur pada
spektrofotometer visibel menggunakan panjang gelombang teoritis
phloroglucinol, yaitu 750,0 nm dengan metode time drive, yaitu mengukur
absorbansi pada satu panjang gelombang yang telah ditetapkan selama rentang
waktu tertentu.
Hasil pengukuran operating time pada gambar 8 menunjukkan bahwa
senyawa memberikan absorbansi yang stabil, ditandai dengan spektra yang lurus
pada menit ke-50 hingga menit ke-90, terhitung sejak saat sampel direaksikan.
3. Penentuan panjang gelombang maksimum (λ maks)
Panjang gelombang maksimum ditentukan dan digunakan untuk
membaca absorbansi sampel. Spektrofotometer akan lebih sensitif dalam
membaca absorbansi sampel pada panjang gelombang maksimumnya dan sedikit
perubahan konsentrasi akan dapat terdeteksi (Fatah, 1989).
Menurut Zhang et al. (2006), panjang gelombang maksimum untuk
phloroglucinol yang direaksikan dengan pereaksi Folin-Ciocalteau adalah 750,0
nm. Oleh karena itu, scanning panjang gelombang dilakukan pada rentang
400-900 nm. Verifikasi panjang gelombang hasil scanning menggunakan panjang
gelombang maksimum teoritis phloroglucinol dilakukan karena terdapat beberapa
perbedaan kondisi percobaan, antara lain perbedaan waktu, tempat, iklim, alat dan
bahan yang digunakan, serta individu yang melakukan percobaan.
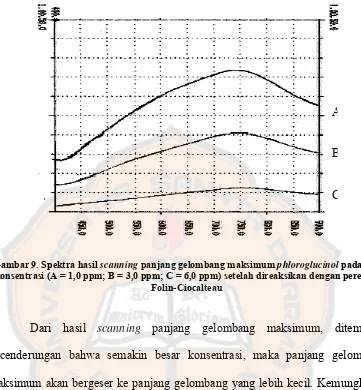
Panjang gelombang maksimum didapat dari hasil scanning tiga
konsentrasi baku phloroglucinol, yaitu 1,0; 3,0; dan 6,0 ppm yang direaksikan
dengan pereaksi Folin-Ciocalteau. Ketiga konsentrasi tersebut dipilih karena
dianggap mewakili konsentrasi rendah, medium, dan tinggi. Panjang gelombang
Gambar 9. Spektra hasil scanning panjang gelombang maksimum phloroglucinol pada tiga konsentrasi (A = 1,0 ppm; B = 3,0 ppm; C = 6,0 ppm) setelah direaksikan dengan pereaksi
Folin-Ciocalteau
Dari hasil scanning panjang gelombang maksimum, ditemukan
kecenderungan bahwa semakin besar konsentrasi, maka panjang gelombang
maksimum akan bergeser ke panjang gelombang yang lebih kecil. Kemungkinan
hal ini disebabkan oleh phloroglucinol yang mudah teroksidasi menjadi fenolat
dalam suasana basa, hingga membentuk kuinon yang memiliki kromofor yang
dapat menyerap radiasi cahaya tampak pada energi yang lebih rendah.
Pada penelitian ini, baku phloroglucinol dibaca absorbansinya pada
ketiga panjang gelombang hasil scanning. Hasil pembacaan absorbansi tidak
menunjukkan perbedaan yang signifikan. Karenanya dipilih panjang gelombang
maksimum yang paling mendekati teoritis, yaitu 750,1 nm (gambar 10), untuk
pembacaan absorbansi seri baku dan sampel.
A
B
Gambar 10. Hasil scanning panjang gelombang maksimum (λ maks) 750,1 nm
4. Pembuatan kurva baku phloroglucinol
Replikasi kurva baku dilakukan sebanyak tiga kali supaya hasil yang
diperoleh menggambarkan kondisi yang sebenarnya. Pengukuran absorbansi
kurva baku dilakukan pada panjang gelombang 750,1 nm sehingga didapat tiga
Tabel I. Data replikasi seri baku phloroglucinol setelah direaksikan dengan pereaksi Folin-Ciocalteau
Replikasi I Replikasi II Replikasi III
Konsentrasi
0,0512 0,075 0,0523 0,070 0,0508 0,074 0,1024 0,138 0,1046 0,132 0,1016 0,121 0,2048 0,269 0,2091 0,257 0,2032 0,238 0,3071 0,405 0,3137 0,407 0,3048 0,379 0,4095 0,516 0,4182 0,514 0,4064 0,542 0,5119 0,648 0,5228 0,643 0,5080 0,602 0,6143 0,768 0,6274 0,712 0,6096 0,720
A 0,015 A 0,020 A 0,011 B 1,233 B 1,155 B 1,190 r 0,9998 r 0,9968 r 0,9959
Keterangan: A = intercept persamaan kurva baku B = slope atau kemiringan kurva baku
r =koefisien korelasi antara konsentrasi teoritis (ppm) dengan absorbansi
phloroglucinol
Hubungan yang linier antara konsentrasi phloroglucinol dan absorbansi
yang dihasilkan dapat dilihat pada koefisien korelasi (r) masing-masing replikasi
yang lebih besar daripada nilai r tabel dengan taraf kepercayaan 95% dan degree
of freedom (df) 5, yakni 0,755 (tabel I). Dengan demikian ketiga persamaan kurva
baku dapat diterima. Dari ketiga replikasi dipilih satu persamaan yang memiliki
linearitas yang paling baik untuk menghitung kadar phlorotannin pada alga coklat
Padina vickersiae Hoyt., yaitu kurva baku replikasi pertama dengan nilai r sebesar
0,9998 (gambar 11). Persamaan kurva baku yang digunakan adalah y = 0,1233 x +
y = 1,233 x + 0,015
Konsentrasi baku phloroglucinol (mg/100mL)
A
bs
or
bans
i
Gambar 11. Kurva baku phloroglucinol
F. Validasi Metode Analisis
Validasi metode analisis adalah suatu penilaian terhadap parameter
tertentu berdasarkan percobaan di laboratorium, untuk membuktikan bahwa
parameter tersebut memenuhi persyaratan untuk digunakan (Harmita, 2004).
Untuk mengetahui validitas Metode Folin-Ciocalteau dilakukan analisis akurasi,
presisi, dan linearitas terhadap replikasi seri baku phloroglucinol.
1. Akurasi
Penilaian akurasi didasarkan pada nilai perolehan kembali (recovery) dari
data hubungan antara konsentrasi baku phloroglucinol dengan absorbansi yang
Tabel II. Data recovery baku phloroglucinol 2,0476 2,0598 100,60 3,0714 3,1631 102,98 4,0952 4,0635 99,23 5,1190 5,1344 100,30 I
6,1428 6,1078 99,43 0,5228 0,4344 83,09 1,0456 0,9712 92,89 2,0912 2,0536 98,20 3,1368 3,3525 106,88 4,1824 4,2790 102,31 5,2280 5,3961 103,21 II
6,2736 5,9936 95,54 0,5080 0,5311 104,54 1,0160 0,9259 91,13 2,0320 1,9086 93,93 3,0480 3,0930 101,48 4,0640 4,4621 109,80 5,0800 4,9661 97,76 III
6,0960 5,9573 97,72
Berdasarkan data pada tabel II, persentase baku phloroglucinol berada
dalam rentang 83,09-109,80%. Hasil tersebut masih berada dalam rentang
recovery yang baik untuk bahan baku sebagai analit dengan kadar sekitar 1 ppm
saat dianalisis. Nilai recovery yang masih bisa diterima berkisar antara 80-120%
(Mulja dan Suharman, 1995). Dengan demikian, dapat dikatakan bahwa metode
2. Presisi
Presisi suatu metode analisis dinyatakan dalam persentase Coefficient of
Variation (CV). Tabel III menunjukkan persentase CV untuk setiap konsentrasi
baku phloroglucinol.
Tabel III. Data Coefficient of Variation (CV) baku phloroglucinol
% Recovery untuk konsentrasi phloroglucinol
Replikasi
0,5 ppm 1,0 ppm 2,0 ppm 3,0 ppm 4,0 ppm 5,0 ppm 6,0 ppm I 94,95 97,39 100,60 102,98 99,23 100,30 99,43 II 83,09 92,89 98,20 106,88 102,31 103,21 95,54 III 104,54 91,13 93,93 101,48 109,80 97,76 97,72 Rata-rata 94,19 93,80 97,58 103,78 103,78 100,42 97,56
SD 10,75 3,23 3,38 2,79 5,44 2,73 1,95 CV (%) 11,41 3,44 3,46 2,69 5,24 2,72 2,00
Nilai % CV seri konsentrasi phloroglucinol pada tabel III berada pada
rentang 2,00-11,41%. Presisi dikatakan baik jika memiliki nilai % CV < 2% untuk
konsentrasi 1% atau lebih (Anonim, 2004). Dengan demikian, hanya baku dengan
konsentrasi 6,0 ppm yang memiliki presisi yang baik. Menurut sistem standar
deviasi relatif (RSD), % CV yang dipersyaratkan untuk analisis yang baik dengan
recovery 85-115% adalah % CV < 4,1% (Harmita, 2004). Konsentrasi yang
memenuhi standar RSD adalah 1,0; 2,0; 3,0; 5,0; dan 6,0 ppm. Persentase CV
terburuk adalah pada konsentrasi 0,5 ppm, yaitu sebesar 11,41%. Hal ini
disebabkan dalam penelitian, biasanya % CV meningkat dengan menurunnya
konsentrasi analit. Semakin kecil kadar, risiko kesalahannya akan semakin besar.
Untuk kadar analit satu per sejuta (ppm) nilai % CV yang masih dapat diterima
sesuai dengan standar RSD, namun masih dapat diterima karena kadar analit
dihitung dalam satu per sejuta (ppm).
3. Linearitas
Nilai koefisien korelasi (r) untuk replikasi I adalah 0,9998, replikasi II =
0,9968, dan replikasi III = 0,9959. Ketiga nilai r dapat diterima karena lebih besar
daripada nilai r tabel dengan taraf kepercayaan 95% dan degree of freedom (df) 5,
yakni 0,755. Persamaan kurva baku yang digunakan untuk menghitung kadar
sampel adalah persamaan hasil replikasi I dengan pertimbangan nilai r yang paling
mendekati 1. Menurut Mulja dan Suharman (1995) dan Anonim (2004), data
linearitas dapat diterima jika memiliki nilai r > 0,999. Persamaan kurva baku
replikasi I memiliki r sebesar 0,9998 sehingga memenuhi persyaratan tersebut.
G. Estimasi Kadar Phlorotannin Dalam Fraksi Etil Asetat Alga Coklat
Padina vickersiae Hoyt.
Prosedur estimasi dilakukan dengan terlebih dahulu menimbang seksama
fraksi etil asetat alga coklat Padina vickersiae Hoyt. sebanyak 0,05 g. Replikasi
dilakukan sebanyak tiga kali penimbangan. Sampel fraksi untuk setiap replikasi
diambil dari masing-masing cawan porselen tempat penguapan fraksi etil asetat.
Penimbangan sebaiknya dilakukan dalam ruangan dengan kelembaban rendah
karena fraksi etil asetat Padina vickersiae Hoyt. memiliki sifat higroskopis.
Apabila sampel menjadi lembab, maka akan sulit untuk ditimbang.
Sampel yang sudah ditimbang dilarutkan dalam aseton 75%. Untuk