METODE CEPAT UNTUK KUANTIFIKASI RESERPIN
DALAM OBAT DAN EKSTRAK Rauwolfia serpentina SECARA
SPEKTROFOTOMETRI DERIVATIF ULTRAVIOLET
WORO DINA RACHMANTI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2006
ABSTRAK
WORO DINA RACHMANTI. Metode Cepat untuk Kuantifikasi Reserpin dalam Obat dan Ekstrak Rauwolfia serpentina secara Spektrofotometri Derivatif Ultraviolet. Dibimbing oleh ELLY SURADIKUSUMAH dan LATIFAH KOSIM DARUSMAN.
Reserpin merupakan salah satu komponen aktif utama yang terdapat dalam
Rauwolfia serpentina dan banyak digunakan untuk obat antihipertensif. Metode cepat dan dapat dipercaya sangat dibutuhkan untuk mendukung pemeriksaan formula obat dan pengawasan mutu di industri farmasi. Spektrofotometri derivatif ultraviolet (SDUV) digunakan sebagai metode alternatif untuk menentukan kadar reserpin dalam akar R. serpentina dan tablet obat tanpa penambahan reagen pembentuk warna kemudian hasilnya dibandingkan dengan spektrofotometri konvensional sebagai metode rujukan.
Metode SDUV dilakukan berdasarkan pengukuran amplitudo puncak spektrum dari garis dasar (Dz) pada turunan pertama di panjang gelombang 277.4 nm untuk tablet obat
dan 312 nm untuk ekstrak akar. Hasil analisis secara SDUV untuk obat dan akar menunjukkan kadar reserpin berturut-turut sebesar 0.2202 mg per tablet dan 3.1122 mg per gram serbuk akar. Hasil analisis secara spektrofotometri konvensional untuk obat dan akar menunjukkan kadar reserpin berturut-turut sebesar 0.2289 mg per tablet dan 5.3741 mg per gram serbuk akar. Analisis statistika yang dilakukan dengan uji-t dan F me- nunjukkan kedua metode berbeda nyata pada limit kepercayaan 95% untuk analisis akar, sedangkan analisis obat menunjukkan hasil kedua metode tersebut tidak berbeda nyata. Validasi metode SDUV pada tablet obat dilakukan pada beberapa parameter. Metode SDUV menghasilkan koefisien korelasi (r) sebesar 0.9998 pada kisaran 10-50 mg/l, ketelitian sebesar 1.68% yang dinyatakan sebagai simpangan baku relatif, ketepatan perolehan kembali sebesar 60.34–94.61%, limit deteksi sebesar 1.1890 mg/l, dan limit kuantisasi 3.9634 mg/l.
WORO DINA RACHMANTI. A Rapid Method for Quantification of Reserpin in Tablet and Rauwolfia serpentina Extract by Ultraviolet Derivative Spectrophotometry. Supervised by ELLY SURADIKUSUMAH and LATIFAH KOSIM DARUSMAN.
Reserpine is one of major active compounds in Rauwolfia serpentina and is widely used as an antihypertensive agent. A fast and reliable method for determination of reser-pine is highly desirable to support formula checking and quality control in pharmaceutical industries. Ultraviolet derivative spectrophotometry (UVDS) was performed to determine reserpine in the root of R. serpentina and the corresponding tablet without chromogenic reagent and was compared with conventional spectrophotometry as a reference method.
UVDS method is based on the measurement of peak to baseline amplitude (Dz) in first derivative spectra at 277.4 nm for tablet and at 312 nm for R. serpentine.UVDS method showed the concentration reserpine in tablet was 0.2202 mg per tablet and 3.1122 mg per gram of root powder. Conventional spectrophotometry showed the con-centration of reserpine in tablet was 0.2289 mg per tablet and 5.3741 mg per gram of root powder. Statistical analysis by t-test and F at 95% confidence level showed a significant difference between the results of the two methods for root analysis whereas for tablet analysis did not show significant difference between the results of the two methods. Validation of UVDS method were determined in tablet analysis for several parameters. UVDS method gave a correlation coefficient (r) of 0.9998 in the range of 10–50 mg/l, precision of 1.68% as relative standard deviation, recovery of 60.34–94.61%, limit of detection of 1.1890 mg/l, and limit of quantitation of 3.9634 mg/l.
METODE CEPAT UNTUK KUANTIFIKASI RESERPIN
DALAM OBAT DAN EKSTRAK Rauwolfia serpentina SECARA
SPEKTROFOTOMETRI DERIVATIF ULTRAVIOLET
WORO DINA RACHMANTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2006
Judul Skripsi : Metode Cepat untuk Kuantifikasi Reserpin dalam Obat dan Ekstrak Rauwolfia serpentina secara Spektrofotometri Derivatif
Ultraviolet
Nama : Woro Dina Rachmanti
NIM : G44201065
Menyetujui:
Pembimbing I, Pembimbing II,
Ir. Elly Suradikusumah, M.S. Prof. Dr. Latifah K. Darusman, M.S.
NIP 130350043 NIP 130536681
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono, M.S. NIP 131473999
PRAKATA
Alhamdulillahi robbil’aalamin, puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Laporan ini disusun berdasarkan hasil penelitian yang dilaksanakan mulai tanggal 8 Juni 2005 sampai 12 Januari 2006 di Laboratorium Kimia Analitik dan Pusat Studi Biofarmaka, Bogor dengan judul Metode Cepat untuk Kuantifikasi Reserpin dalam Obat dan Ekstrak
Rauwolfia serpentina secara Spektrofotometri Derivatif Ultraviolet . Skripsi ini ditulis berdasar pada data yang diperoleh selama penelitian baik melalui pengujian di laboratorium, wawancara, maupun studi pustaka.
Penulis mengucapkan terima kasih kepada Ir. Elly Suradikusumah, MS. dan Prof. Dr. Ir. Latifah K. Darusman selaku pembimbing atas segala arahan, perhatian selama penelitian dan penulisan laporan ini, Hibah Penelitian A2 atas bantuan dana yang diberikan, Lab Pusat Studi Biofarmaka atas fasilitas yang diberikan, dan Mohamad Rafi, S.Si. yang telah banyak membantu mengatasi kesulitan penulis.Terima kasih penulis ucapkan kepada kedua orang tua tercinta atas segala kasih sayang dan didikan yang diberikan serta kepada Mas Arief, untuk kebersamaan dan kasih sayangnya. Penghargaan dan terima kasih penulis sampaikan kepada Om Em atas bantuan dan semangat yang diberikan kepada penulis, Kak Budi atas diskusi-diskusi yang berharga, Bapak Rudi, Ibu Irmanida, Kak Atep, Mbak Salina, Ibu Nunuk, Ibu Enung, Bapak Ridwan, Bapak Manta, dan Bapak Kosasih.
Ungkapan terima kasih juga disampaikan untuk Agung Nugraha yang merelakan hati, telinga, dan dirinya menemani penulis setiap saat. Sahabat satu tim (Ira, Novie, Nersy, Wiji, dan Egun), Dewi, Anie, Sekar, Maya, Putri, Rachmanita, Steven, Mas Heri, dan semua teman-teman Kimia angkatan 38 atas kebersamaan, semangat, bantuan, dan dorongannya, dan semua pihak yang tidak dapat disebut satu per satu.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2006
Penulis dilahirkan di Jakarta pada tanggal 27 Agustus 1983 dari ayah Suyudi dan ibu Dra. Amien Widjijati. Penulis merupakan putri kedua dari dua bersaudara.
Tahun 2001 penulis lulus dari SMA negeri 61 dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Ujian Masuk Perguruan Tinggi Negeri. Penulis memilih Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi asisten mata kuliah Kimia Dasar pada tahun ajaran 2003/2004, Kimia D3 Analisis Lingkungan pada tahun ajaran 2004/2005, Kimia Analitik Teknik Pangan dan Gizi pada tahun 2004/2005, dan Kimia Analitik III pada tahun ajaran 2005/2006. Tahun 2004 Penulis melaksanakan Praktik Lapangan di laboratorium Sucofindo, Cibitung.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN... ix PENDAHULUAN ... 1 TINJAUAN PUSTAKA Spektrofotometri ... 1 Spektrofotometri Derivatif... 2 Reserpin ... 3
Validasi Metode Analisis... 3
BAHAN DAN METODE Bahan dan Alat ... 5
Metode Penelitian ... 5
HASIL DAN PEMBAHASAN Penentuan Kondisi Optimum... 6
Pengukuran Reserpin dengan Metode Spektrofotometri UV-VIS... 10
Perbandingan Metode SDUV dan Spektrofotometri UV-VIS... 11
Validasi Metode Spektrofotometri Derivatif ... 11
SIMPULAN DAN SARAN Simpulan ... 13
Saran ... 13
DAFTAR PUSTAKA ... 12
1 Kondisi optimum pada analisis reserpin dengan metode SDUV ... 9
2 Hasil uji statistik metode SDUV dan metode rujukan dalam obat ... 10
3 Hasil uji statistik metode SDUV dan metode rujukan dalam akar ... 10
4 Persamaan kurva standar sebanyak tiga kali ulangan ... 11
5 Parameter statistika kurva standar rata-rata ... 11
6 Data ketelitian reserpin dalam tablet obat menggunakan metode SDUV ... 12
7 Data perolehan kembali reserpin dalam tablet obat dengan metode SDUV... 12
DAFTAR GAMBAR
Halaman 1 Prinsip hukum Beer ... 12 Spektrum turunan dari absorbans pita Gauss... 2
3 Macam-macam amplitudo (a) Ds, (b) DL, dan (c) Dz... 3
4 Struktur reserpin ... 3
5 Spektrum standar pada turunan ke nol (a) dan turunan pertama (b) ... 7
6 Spektrum standar reserpin dan akar R. serpentina pada turunan ke nol (a), pertama (b), dan kedua (c) ... 8
7 Spektrum turunan standar reserpin (−), contoh obat Serpasil® (−), dan contoh ekstrak akar Rauwolfia serpentina (−) ... 9
8 Kurva standar reserpin untuk obat (a) dan akar (b) ... 10
9 Kurva standar reserpin dalam analisis tablet obat... 10
10 Kurva standar reserpin dalam analisis akar R. serpentina... 10
DAFTAR LAMPIRAN
Halaman 1 Diagram alir penelitian ... 16 2 Spektrum serapan standar reserpin dan contoh obat turunan ke nol pada
ulangan (a)1, (b) 2, (c) 3, (d) 4, (e) 5, (f) 6, (g) 7, (h) 8, (i) 9 ... 17 3 Spektrum serapan standar reserpin dan contoh akar turunan ke nol pada
ulangan (a)1, (b) 2, (c) 3, (d) 4, (e) 5, (f) 6, (g) 7, (h) 8, (i) 9 ... 18 4 Spektrum serapan standar reserpin pada kecepatan penyapuan 200 nm/menit dan penghalusan kedua... 19 5 Spektrum serapan standar reserpin dan contoh obat pada kondisi optimum
ulangan (a)1, (b) 2, (c) 3, (d) 4, (e) 5, (f) 6, (g) 7, (h) 8, (i) 9 ... 20 6 Spektrum serapan standar reserpin dan contoh akar pada kondisi optimum
ulangan (a)1, (b) 2, (c) 3, (d) 4, (e) 5, (f) 6, (g) 7, (h) 8, (i) 9 ... 22 7 Persamaan kurva standar dan kadar reserpin dalam obat untuk penentuan
kondisi optimum ... 24 8 Penentuan kadar reserpin dalam obat menggunakan metode SDUV ... 31 9 Penentuan kadar reserpin dalam akar menggunakan metode SDUV ... 32 10 Penentuan kadar reserpin dalam obat menggunakan metode spektrofotometri
UV-VIS... 33 11 Penentuan kadar reserpin dalam akar mengguankan metode spektrofotometri
UV-VIS... 34 12 Penentuan uji t dan uji F antara metode SDUV dan spektrofotometri
UV-VIS (rujukan) ... 35 13 Penentuan parameter statistika kurva standar rata-rata metode SDUV... 36 14 Penentuan presisi kadar reserpin dalam obat metode SDUV ... 37 15 Penentuan perolehan kembali (recovery) kadar reserpin dalam obat
PENDAHULUAN
Perkembangan industri farmasi meningkat sejalan dengan kemajuan teknologi dan ilmu pengetahuan. Hal tersebut tentu harus sejalan dengan prosedur pengawasan mutu sediaan farmasi yang efisien (Ansari et al. 2004). Ka-dar senyawa kimia aktif dalam sediaan farma-si memerlukan pengawasan karena aktivitas zat tersebut dapat mempengaruhi keamanan dan khasiat obat.
Salah satu senyawa kimia aktif dalam obat ialah reserpin. Reserpin merupakan salah satu alkaloid yang terkandung dalam akar tanaman Rauwolfia serpentina yang berfungsi menekan sistem saraf pusat dan digunakan di dalam pengobatan hipertensi (Saunders 1974). Re-serpin berbentuk tablet obat diperkenalkan dalam psikiatri untuk pengobatan skizofrenia pada permulaan tahun 1950-an setelah ter- bukti khasiatnya untuk mengobati penderita gangguan jiwa.
Metode yang digunakan untuk memeriksa kadar reserpin dalam sediaan farmasi dan akar diantaranya adalah kromatografi cair kinerja tinggi (USP 1995; Alexander et al. 1998), dan spektrofotometri UV-Vis (Singh et al. 2004; British Pharmacopiea 1993). Teknik kromato-grafi diatas relatif mahal. Spektrofotometri merupakan teknik yang cepat dan mudah dalam penentuan senyawa kimia, tetapi teknik ini tidak dapat digunakan pada contoh yang mempunyai matriks yang kompleks.
Teknik spektrofotometri derivatif ultra-violet (SDUV) merupakan pengembangan dari teknik spektrofotometri UVkonvensional. Teknik ini digunakan untuk penentuan jumlah senyawa kimia yang memiliki matriks yang kompleks. Metode SDUV telah banyak di-gunakan dalam analisis kimia, antara lain penentuan kadar losartan di dalam sediaan farmasi (Ansari et al. 2004), kafein di dalam minuman (Alpdogan et al. 2000), total flavonoid dalam tanaman Brazil (Rolim et al 2005), methemoglobin dalam darah (Tauller et al. 1987), nikel (Eskandari 2003), asam askorbat dalam sayuran (Aydogmus et al. 2001), hidrokuinon di dalam gel dan krim (Garcia et al. 2005), parakuat dalam plasma darah (Fell et al. 1981), dan porfirin dalam air seni (Jones & Sweeney 1979). Metode SDUV dapat digunakan untuk mengatasi gangguan matriks yang sering terdapat dalam contoh. Keunggulan metode ini ialah dapat memisah-kan pita spektrum yang tumpang tindih dalam analisis mutu dan mengurangi pengaruh gang-guan dari penghamburan, matriks, atau penyerapan komponen lain di dalam analisis
kuantitatif (Skujins 1986; Owen 1996). Meto-de ini juga memberikan beberapa keuntungan seperti menghemat waktu dan biaya karena penentuan kandungan bahan aktif di dalam contoh dapat dilakukan secara sederhana dan cepat. Oleh karena itu, dalam penelitian ini dikembangkan metode SDUV untuk analisis kadar reserpin dalam tablet obat dan akar R. serpentina. Ketelitian dan keakuratan metode yang diusulkan dievaluasi dengan kriteri yang ditetapkan seperti linearitas, ketelitian, limit deteksi, ketepatan, dan limit kuantisasi (ICH diacu dalam Chan 2004). Tujuan penelitian ini adalah menentukan kadar reserpin dalam obat dan ekstrak akar dari tanaman R. serpentina menggunakan metode SDUV dan menguji validitas metode SDUV untuk pengukuran reserpin dalam obat dan akar R. serpentina.
TINJAUAN PUSTAKA
Spektrofotometri
Analisis dengan spektrofotometri UV di-dasarkan pada penyerapan energi sinar dengan panjang gelombang tertentu oleh molekul dalam suatu senyawa. Semua molekul dapat menyerap radiasi dalam daerah UV-tampak karena mengandung elektron yang dapat di-eksitasi ke tingkat energi yang lebih tinggi. Sumber radiasi yang dipancarkan harus memi-liki panjang gelombang yang sama untuk penyerapan agar memenuhi hukum Beer (Gambar 1).
P0
P
b
Gambar 1 Prinsip hukum Beer. Keterangan:
Po= Intensitas radiasi yang masuk
P = Intensitas radiasi yang keluar
= o P P Transmitan (T) A = - log (T) A = Absorbans = a x b x c a = absorptivitas
b = jarak tempuh cahaya c = konsentrasi
Hukum Beer menyatakan bahwa fraksi penyerapan sinar tidak bergantung pada
inten-sitas sumber cahaya, tetapi sebanding dengan banyaknya molekul yang menyerap (Sudjadi 1985).
Spektrofotometri derivatif
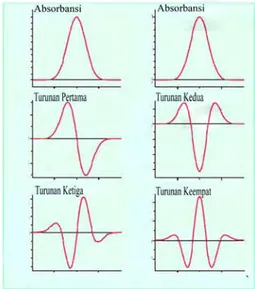
Metode spektrofotometri derivatif telah lama dikenal sebagai metode yang diakui keakuratannya tetapi metode ini belum di gunakan secara luas pada dekade awal per-kembangannya. Hal ini disebabkan oleh kerumitan pada penurunan fungsi kurva. Ber-kembangnya teknologi mikrokomputer dalam 10 tahun terakhir menyebabkan perhatian peneliti mulai beralih kembali ke metode ini. Teknik ini mempunyai kelebihan meningkat-kan resolusi spektrum yang tumpang tindih, mengurangi penyerapan matriks, dan dapat memilih puncak yang tajam di antara spek-trum yang lebar. Spektrofotometri derivatif juga dapat menghasilkan daerah sidik jari yang lebih baik bila dibandingkan dengan spektrum absorpsi yang umum (Karpinska et al. 1998).
Setiap senyawa mempunyai serapan yang khas pada panjang gelombang tertentu. Pan-jang gelombang yang memberikan serapan maksimum disebut panjang gelombang mak-simum (λmaks). Penentuan panjang gelombang
maksimum terkadang memberikan pita yang lebar, hal ini disebabkan adanya serapan matriks, noise, dan puncak yang tumpang tindih. Metode spektrofotometri derivatif dapat membedakan pita serapan yang lebar terhadap pita serapan terdekatnya yang tumpang tindih. Hal ini disebabkan amplitudo (Dn) pita Gauss pada turunan ke-n berbanding
terbalik terhadap lebar pita (W) turunan ke-n.
w
nn
D ≈ 1
Turunan pertama adalah perubahan rata-rata dari absorbans terhadap panjang gelom-bang. Spektrum tersebut berawal dan berakhir pada nilai absorbans nol dan mempunyai nilai absorbans nol pada panjang gelombang yang sama dengan λmaks. Turunan ini mempunyai
pita positif dan negatif yang menunjukkan nilai maksimum dan minimum pada panjang gelombang yang sama sebagai perubahan pita absorbansi. Fungsi dua kutub ini merupakan ciri khas dari seluruh spektrum turunan. Hal ini dapat dilihat pada Gambar 2. Turunan kedua mempunyai ciri khas , yaitu pita negatif yang bernilai minimum merupakan puncak dari panjang gelombang maksimum pada pita berorde nol. Turunan ini juga mempunyai dua pita positif yang mengapit pita minimum. Turunan ketiga merupakan kebalikan dari
turunan pertama, begitu pula dengan turunan keempat merupakan kebalikan dari turunan kedua (Owen 1996).
Kesalahan di dalam menginterpretasikan spektrum yang disebabkan oleh penyerapan matriks dapat dikurangi dengan menaikkan derajat penurunan spektrum. Analisis kuanti-tatif dari metode ini didasarkan pada hukum Lambert-Beer. Hukum ini dapat menghitung kisaran konsentrasi yang diinginkan pada pan-jang gelombang monokromatik pada turunan ke-n :
d
c
d
d
d
A
d
n n n n×
×
=
λ
ε
λ
A adalah absorbans, ε adalah absorptivitas molar (L mol-1cm-1), c adalah konsentrasi
(mol L-1), dan d adalah jarak tempuh cahaya
(cm).
Proses derivatisasi spektrum menghasilkan efek yang tidak diharapkan seiring kenaikan orde turunan, yaitu penurunan nisbah sinyal terhadap noise (S/N). Hal ini menyebabkan penurunan kemampuan untuk membedakan pita yang tumpang tindih dan fakta bahwa noise mempunyai puncak yang tajam dalam spektrum. Proses smoothing (penghalusan) diiringi dengan pengaturan peubah number of point (jumlah jendela) diperlukan dalam me-tode ini untuk mengurangi pengaruh noise (Popovic et al. 1999).
Scan speed (kecepatan penyapuan) bergu-na untuk merekam interval serapan abergu-nalat tiap panjang gelombang tertentu.
Gambar 2 Spektrum turunan dari absorbans pita Gauss.
Konsentrasi analat dalam contoh ditentu-kan menggunaditentu-kan persamaan garis yang
dida-3
pat dari hubungan amplitudo dengan konsen-trasi standar pada panjang gelombang tertentu. Macam-macam amplitudo yang dikenal dalam spektrofotometeri derivatif adalah DL, yaitu tinggi puncak yang paling panjang (puncak ke puncak), Dz, yaitu tinggi puncak yang dihitung dari garis dasar, dan Ds, yaitu tinggi puncak yang dihitung dari sembarang puncak(Gambar 3).
(a) (b) (c) (a) (b) (c) Gambar 3 Macam-macam amplitudo (a) Ds, (b) DL, dan (c) Dz.
Reserpin
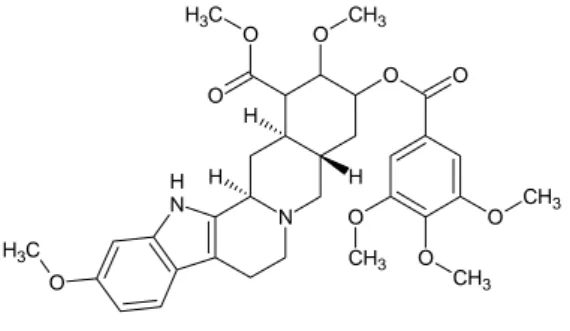
Reserpin adalah alkaloid dari tanaman R. serpentina yang berasal dari daerah Asia. Reserpin berfungsi menekan sistem saraf pusat, digunakan dalam pengobatan hipertensi dan gangguan mental. Tanaman R. serpentina, yang termasuk keluarga Apocynaceae, bebe-rapa abad yang lalu telah digunakan sebagai penangkal sengatan dan gigitan serangga, pe-nurun demam, perangsang kontraksi uterin, dan terutama digunakan untuk penyakit gang-guan jiwa. Penggunaannya dalam mengobati hipertensi terdapat dalam kepustakaan India pada tahun 1918.
Akar R. serpentina mempunyai tiga ke-lompok komponen aktif alkaloid.Kelompok pertama merupakan basa kuat (mempunyai amonium kuaterner): serpentin, sarpagin, dan samatin. Kelompok kedua merupakan turunan amina tersier: yohimbin, ajmalin, ajmalisin, tetrafilin, dan tetrafilisin. Kelompok ketiga merupakan basa lemah: reserpin (Gambar 4), resinamin, deserpidin, raunesin, dan kanesin. Reserpin berkhasiat hipotensif. Ajmalin, ser-pentin, dan resinamin berkhasiat sedatif sedangkan yohimbin merangsang proses pem-bentukan testosteron yang dapat membangkit-kan gairah seks.
Cara kerja reserpin sebagai zat hipotensif, yaitu menghambat pengangkutan aktif kateko-lamin dan amina neurohormon ke jaringan penyimpanan. Enzim monoamin oksidase akan menonaktifkan senyawa amina sehingga secara cepat terjadi pengosongan amina -amina (norepinefrin dan dopamin) di ujung-ujung saraf yang mengakibatkan menurunnya tonus simpatetik. Penurunan tonus ini akan menyebabkan penurunan tekanan darah, ber-kurangnya kecepatan jantung,dan memberikan
efek penenangan pada sistem saraf pusat (Siswandono 1995; Liska 2004). Reserpin di serap secara cepat setelah pem-berian oral. Obat antihipertensi yang digunakan dalam penelitian ini adalah Serpasil® dari Novartis.
Tiap tablet Serpasil® mengandung 0.25 mg
reserpin. Pengobatan dengan obat ini tidak boleh melebihi 4 tablet per hari dalam dosis terbagi. Selain ramuan terapeutik yang bersi fat aktif, formulasi ini pun masih mengandung sejumlah unsur-unsur nonterapeutik, yaitu bahan tambahan farmasetik, seperti zat penstabil, zatpengawet, surfaktan, zat pemberi rasa, zat pewarna, dan zat pemanis. Di dalam tubuh, zat berkhasiat harus dilepaskan dari bentuk sediaannya dalam jumlah yang sebenarnya (Ansel 1989). N H N H H H O O O CH3 O CH3 O CH3 O C H3 O CH3 O O C H3
Gambar 4 Struktur reserpin. Rumus kimia reserpin ialah C33H40N2O9
dengan nama kimia metil 11,17α-dimetoksi- 18β-(3,4,5-trimetoksibenzoiloksi)-3β-20α-yohimban-16β-karboksilat. Reserpin merupa- kan serbuk hablur, mudah terurai oleh cahaya dan oksidasi terutama dalam bentuk larutan, berwarna putih sampai agak kekuningan, dan tidak berbau. Reserpin tidak larut dalam air, mudah larut dalam asam asetat dan kloroform dan sukar larut dalam etanol dan eter (British Pharmacopiea 1993).
Validasi Metode Analisis
Validasi metode adalah proses penetapan dan evaluasi unjuk kerja sebuah metode analisis sesuai dengan cara-cara yang ditentu- kan oleh konsensus bersama antar organisasi internasional seperti Association of Officia Analytical Chemists (AOAC) (Hidayat 1989). Parameter yang digunakan dalam validasi meliputi linearitas, ketelitian, ketepatan, limit deteksi, dan limit kuantisasi.
Linearitas menyatakan kemampuan suatu metode untuk mendapatkan hasil yang seban-ding dengan konsentrasi analat dalam contoh pada kisaran konsentrasi tertentu (ICH diacu
dalam Chan 2004). Dari kurva linearitas dapat ditetapkan kisaran konsentrasi yang terukur oleh prosedur analitis yang digunakan. Persa-maan linearitas yang digunakan adalah y = a + bx dan linearitasnya didapatkan dari harga koefisien korelasi. Syarat linearitas menurut AOAC lebih besar dari 0.9995. Koefisien korelasi adalah kemampuan suatu metode untuk menghasilkan angka analisis yang proporsional terhadap konsentrasi analat di dalam contoh pada interval konsentrasi terten-tu. Koefisien korelasi diperoleh dengan menghitung regresi dari persamaan linearnya, sedangkan perpotongannya dengan sumbu- y menyatakan ukuran biasnya. Interval linearitas adalah selang antara konsentrasi tertinggi dan terendah dari analat yang dapat ditetapkan menggunakan suatu metode dengan tingkat, ketelitian, kecermatan, dan koefisien korelasi yang telah dilakukan.
Ketelitian adalah kedekatan hasil dari se-deret pengukuran yang dilakukan pada contoh yang homogen (ICH diacu dalam Chan 2004). Analisis kimia dikatakan tinggi keteli-tian jika selisih antarhasil pengukuran tersebut kecil. ICH membagi ketelitian menjadi dua, yaitu ketertiruan (reproducibility) dan keter-ulangan (repeatibility). Ketertiruan adalah ketelitian yang dihitung dari hasil penetapan ulangan dengan menggunakan metode yang sama, namun dilakukan oleh operator, peralatan, laboratorium, dan waktu yang berbeda. Keterulangan adalah ketelitian yang diperoleh dari hasil pengulangan dengan menggunakan metode, operator, peralatan, laboratorium,dan waktu yang sama. Ketelitian dapat dinyatakan dengan berbagai cara antara lain kisaran (selisih antara hasil penetapan yang terbesar dan yang terkecil), simpangan rata-rata, dan simpangan baku relatif. Rumus simpangan baku relatif adalah
SBR (%) = 100 x SB×
Dengan SB merupakan simpangan baku dan
x
adalah rerata dari hasil pengukuran. Kriteria %SBR sesuai standar AOAC (1993) adalah sebagai berikut: (1) sangat teliti: %SBR <1, (2 ) teliti: %SBR 1-2, (3) sedang: %SBR 2-5, dan (4) tidak teliti: %SBR >5.Ketepatan merupakan kedekatan hasil percobaan yang dapat diterima dengan nilai teoretis atau nilai rujukan yang dapat diterima (ICH diacu dalam Chan 2004). Ketepatan ada-lah selisih antara rerata hasil analisis dengan nilai absolut dari contoh yang dianalisis (Hi-dayat 1989). Analisis kimia disebut tepat bila nilai yang diperoleh dekat dengan nilai
abso-lut.Secara teoretis, nilai absolut dapat didekati dengan menganalisis contoh dengan ulangan yang tidak terbatas.
Ketelitian dan ketepatan paling mudah di-tentukan dengan menetapkan contoh standar atau bahan rujukan. Namun, cara ini hanya sahih jika bahan rujukan tersedia. Bila bahan rujukan tidak tersedia, maka dapat dilakukan uji silang dengan laboratorium lain (uji profi-siensi). Berdasarkan uji ketepatan diperoleh konsentrasi contoh, konsentrasi contoh yang ditambah standar, dan konsentrasi standar yang ditambahkan sehingga dapat dihitung persen perolehan kembali (recovery). Persen perolehan kembali adalah angka yang me-nunjukkan besarnya penambahan standar yang mampu diidentifikasi kembali dengan suatu metode. Nilai persen perolehan kembali yang diharapkan adalah 80−110% (AOA 1993).
Keterangan :
a = konsentrasi contoh + konsentrasi standar yang sudah diketahui
b = konsentrasi contoh
c = konsentrasi standar teoretis yang ditambahkan
Limit deteksi adalah konsentrasi terendah dari analat dalam contoh yang dapat ditentu-kan dan berbeda nyata secara statistika dari blangko (Miller & Miller 2000). Apabila nilai konsentrasi analat berada di bawah limit deteksi suatu metode, maka keberadaan analat dapat menjadi tidak terdeteksi atau data konsentrasi yang diperoleh dapat menjadi tidak sesuai dengan kenyataan. Limit deteksi (LD) diperoleh menggunakan rumus.
LD = a + Sy/x
Sy/x adalah simpangan baku dari residu y, sedangkan a adalah perpotongan dari persa-maan garis.
Limit kuantisasi adalah jumlah terendah analat dalam contoh yang secara kuantitatif dapat ditetapkan dengan ketelitian dan ke-tepatan yang sesuai (Miller & Miller 2000). Limit kuantisasi dapat dihitung dengan terle-bih dahulu menentukan limit ketelitian dan ketepatan yang dapat diterima. Rumus limit kuantisasi (LK). LK = a + 10 Sy/x 100% × −b a kembali perolehan Persen = c
5
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah tablet obat Serpasil® sebagai sediaan farmasi yang
dianalisis, standar reserpin, etanol, H2SO4
0.25 M, larutan natrium nitrit 0.3% (b/v), dan larutan asam sulfamat 5% (b/v).
Alat-alat yang digunakan adalah neraca analitik, spektrofotometer UV-Vis 2800 Hita-chi yang dilengkapi dengan kuvet 1 cm, kom-puter Pentium IV 2.26 GHz, piranti lunak UV solutions versi 2.0 produksi Hitachi untuk membuat spektrum derivatif, pelat pemanas, dan alat-alat kaca.
Metode
Penentuan konsentrasi reserpin dalam obat dan ekstrak kering akar R. serpentina meng- gunakan metode cepat spektrofotometri derivatif UV. Metode tersebut dimulai dengan mencari nilai kecepatan penyapuan, orde turunan, penghalusan, dan jendela yang optimum agar diperoleh spektrum standar dan contoh yang berimpit. Nilai optimum tersebut digunakan untuk mengukur deret larutan standar dan dibuat kurva standar dari amplitudo DL, DS, dan DZ yang terbaik. Selanjutnya, reserpin dalam contoh diukur dan konsentrasinya dihitung dari persamaan kurva standar. Konsentrasi reserpin yang diperoleh dari metode spektrofotometri derivatif diban-dingkan dengan metode rujukan British Phar-macopiea (1993). Bila kedua nilai tersebut memberikan hasil yang tidak berbeda nyata, maka dilakukan validasi metode spektrofoto-metri derivatif UV (Lampiran 1).
Pengukuran Reserpin dengan Metode Spektrofotometri Derivatif UV
Preparasi larutan standar dan contoh.
Sebanyak 10 mg serbuk reserpin yang di-masukkan ke dalam gelas piala dan ditambah-kan 20 ml etanol absolut hangat kemudian dipanaskan pada suhu 50°C dan diaduk meng-gunakan pengaduk magnetik selama 20 menit. Larutan ini dimasukkan ke dalam labu takar 100 ml dan ditepatkan menggunakan etanol. Larutan stok dengan konsentrasi 100 mg/l ini diencerkan untuk membuat larutan 10, 20, 30, 40, dan 50 mg/l.
Satu gram tablet obat yang mengandung 1.25 mg reserpin yang dihaluskan dimasukkan ke dalam gelas piala. Kemudian ditambahkan 20 ml etanol absolut hangat dan dipanaskan
pada suhu 50 °C sambil diaduk dengan penga-duk magnetik selama 20 menit. Larutan ini dimasukkan ke dalam labu takar 50 ml dan ditepatkan menggunakan etanol.
Serbuk akar R. serpentina diekstraksi dengan 20 ml etanol kemudian dipanaskan dan diaduk dengan pengaduk magnetik selama 20 menit. Larutan ini dimasukkan ke dalam labu takar 100 ml.
Sebanyak 2.5 gram serbuk akar R. serpentina yang telah dihaluskan, diekstraksi menggunakan soxhlet dengan 100 ml pelarut etanol selama empat jam. Ekstrak ini ditam-pung dalam labu takar 100 ml dan ditepatkan menggunakan etanol. Sebanyak 20 ml larutan ekstrak dimasukkan ke dalam corong pisah yang telah berisi 200 ml asam sulfat 0.5 M kemudian dikocok. Campuran tersebut lalu diekstraksi dengan 85 ml kloroform secara bertahap yaitu 25, 15, 15, 10, 10, dan 10 ml. Ekstrak kloroform yang diperoleh ditambah-kan 10 ml natrium bikarbonat 2% dan dima-sukkan ke dalam corong pisah yang berbeda yang telah berisi 10 ml natrium bikarbonat 2%. Ekstrak kloroform yang didapat dimasuk-kan ke dalam labu takar 50 ml dan ditepatdimasuk-kan menggunakan kloroform kemudian dikering-kan menggunadikering-kan penguap putar. Ekstrak ke-ring diberi 40 ml etanol kemudian dipanaskan pada suhu 50 °C dan diaduk selama 20 menit menggunakan pengaduk magnetik. Larutan ini dimasukkan ke dalam labu takar 100 ml dan ditepatkan menggunakan etanol.
Penentuan kondisi optimum. Parameter
kondisi optimum yang dikerjakan meliputi or-de turunan (derivative order), penghalusan (smoothing), kecepatan penyapuan (scan speed), dan jumlah jendela (number of point). Parameter inilah yang digunakan untuk penentuan validasi.
Larutan standar dan contoh 25 mg/l diukur serapannya pada panjang gelombang 200–350 nm menggunakan spektrofotometer UV-Vis Hitachi 2800. Spektrum standar dan contoh obat yang diperoleh digabungkan ke dalam satu tampilan (overlay), demikian pula dengan spektrum standar dan contoh ekstrak.
Kecepatan penyapuan terbaik diperoleh dengan memasukkan beragam nilai kecepatan penyapuan, yaitu 100, 200, 400, 800,dan 1200 nm/menit pada saat pengukuran. Pemasukan setiap nilai kecepatan penyapuan diikuti pemasukan peubah orde turunan 1, 2, atau 3, peubah penghalusan 2, 3, atau 4, dan jendela 7, 9, 11,...,75 pada spektrum gabungan. Proses ini bertujuan mendapatkan puncak spektrum standar dan contoh yangberimpit pada peubah
kecepatan penyapuan, orde turunan, jumlah jendela, dan penghalusan yang optimum.
Penentuan kurva standar dari DL, DS, dan
DZ yang terbaik. Pengukuran serapan larutan standar 10, 20, 30,40, dan 50 mg/l dilakukan dengan menggunakan nilai peubah kecepatan penyapuan, orde turunan, penghalusan, dan jendela yang optimum. Masing-masing amplitudo DL, DS, dan DZ dari spektrum
standar diukur. Amplitudo yang memberikan koefisien korelasi dan sensitivitas yang tinggi ditetapkan sebagai kurva standar dan diguna-kan untuk penetuan kadar reserpin selanjut- nya.
Penentuan konsentrasi reserpin dalam
contoh. Larutan contoh diukur serapannya
pada panjang gelombang 200–350 nm. Konsentrasi reserpin dalam contoh ditentukan dengan memasukkan nilai amplitudo contoh ke dalam persamaan garis kurva standar.
Evaluasi Validasi Metode Spektrofotometri Derivatif UV
Linearitas. Pengukuran serapan larutan
standar 10, 20, 30, 40, dan 50 mg/l dilakukan menggunakan nilai kecepatan penyapuan, jumlah jendela, orde turunan, dan penghalusan yang optimum. Linearitas ditentukan menggu-nakan metode regresi kuadrat terkecil sebanyak tiga kali ulangan untuk setiap konsentrasi. Persamaan linearitas yang digunakan adalah y = a + bx dengan a dan b merupakan konstanta yang diperoleh dari grafik (a= titik potong sumbu y dan b= kemiringan).
Ketelitian. Prosedur untuk ketelitian sama
dengan prosedur untuk preparasi contoh di atas yang dilakukan sebanyak sembilan kali pada hari yang sama. Serapan larutan contoh diukur menggunakan kecepatan penyapuan, orde turunan, jumlah jendela, dan penghalusan yang optimum.
Ketepatan.Ketepatan dinyatakan dengan
per-sen perolehan kembali, yaitu nisbah antara konsentrasi standar yang diperoleh dan kon-sentrasi standar yang ditambahkan dikali 100 %. Konsentrasi larutan stok contoh dibuat 50 mg/l dan larutan stok standar dibuat 100 mg/l. Larutan stok sampel sebanyak 10 ml dima-sukkan ke dalam labu takar 50 ml yang berisi 2.5, 10, dan 17.5 ml larutan stok standar kemudian ditera menggunakan etanol sehing-ga memberikan konsentrasi akhir 15, 30, dan
45 mg/l. Masing-masing konsentrasi dibuat 3 ulangan.
Limit deteksi dan Limit Kuantisasi.
Limit deteksi dan limit kuantisasi ditentukan dari simpangan baku dari residual y dan intersep persamaan garis.
Pengukuran Reserpin dengan Metode Spektrofotometri UV-VIS
(British Pharmacopeia 1993)
Satu gram serbuk obat dan dua gram ser-buk akar, dimasukkan ke dalam gelas piala kemudian ditambahkan 2 ml etanol, 2 ml H2S
O4 0.25 M, dan diberikan 10 ml etanol.
Laru-tan ini dihangatkan agar contoh obat mudah larut. Larutan tersebut didinginkan kemudian dimasukkan kedalam labu takar 100 ml dan ditera menggunakan etanol. Larutan ini dise-but larutan A.
Larutan A sebanyak 10 ml dimasukkan ke dalam gelas piala kemudian ditambahkan 2 ml H2SO4 0.25 M dan 2 ml larutan natrium nitrit
0.3% (b/v) segar. Larutan ini dicampur dan dipanaskan pada suhu 55ºC selama 35 menit pada penangas air kemudian didinginkan. Larutan asam sulfamat 5% (b/v) sebanyak 1 ml ditambahkan kemudian dimasukkan ke dalam labu takar 25 ml dan ditera menggu-nakan etanol. Absorbans diukur pada λ = 388 nm menggunakan sel rujukan yang berisi 10 ml larutan A tanpa penambahan natrium nitrit.
HASIL DAN PEMBAHASAN Penentuan kondisi optimum
Penentuan kondisi optimum dalam analisis reserpin menggunakan metode SDUV perlu dilakukan untuk mendapatkan resolusi spek-trum yang akurat. Parameter kondisi optimum yang dilakukan meliputi kecepatan penyapu-an (scan speed), jumlah jendela (number of point), orde turunan (derivative order), dan penghalusan (smoothing). Penentuan kecepat-an penyapukecepat-an dilakukkecepat-an pada tahap awal.
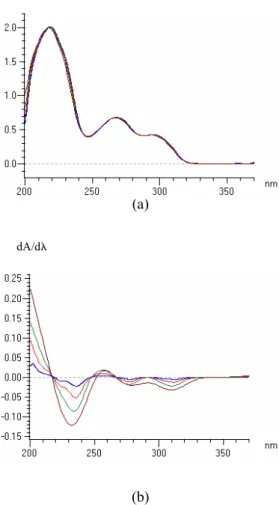
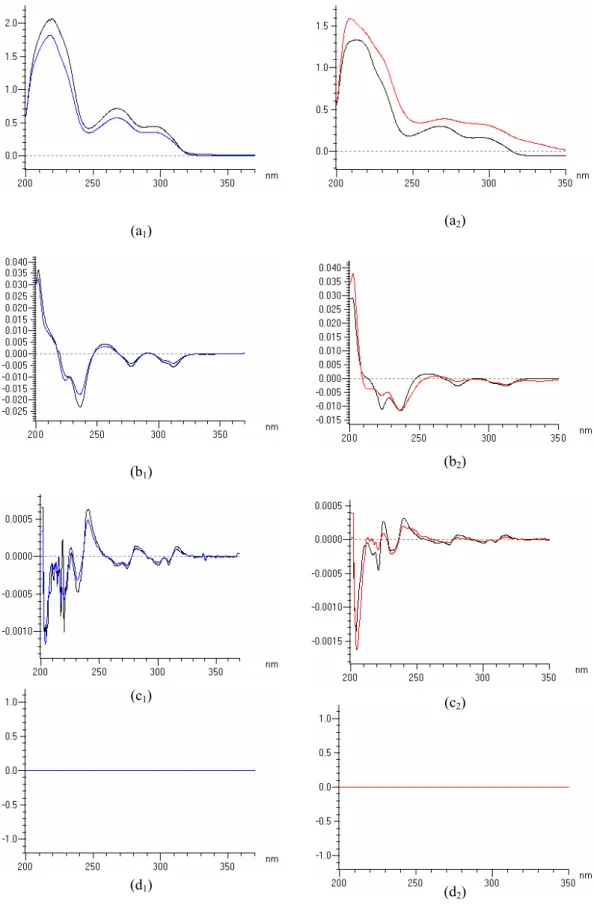
Kecepatan penyapuan terbaik diperoleh dengan menguji beragam nilai kecepatan penyapuan, yaitu 100, 200, 400, 800, dan 1200 nm/menit pada konsentrasi larutan yang sama. Bentuk spektrum dengan kecepatan penyapuan yang beragam pada turunan ke nol tidak terlihat berbeda satu sama lain (Gambar 5 a), tetapi ketika diturunkan terlihat adanya perbedaan bentuk spektrum satu sama lain (Gambar 5 b). Hal ini terjadi karena jumlah data yang diolah pada tiap peubah kecepatan
7
penyapuan berbeda. Semakin tinggi kecepatan penyapuan maka kisaran jumlah data yang diolah semakin lebar sehingga bentuk spek-trum setelah diturunkan menjadi lebih panjang dan melebar. Perubahan bentuk spektrum ini menyebabkan nilai yang diperoleh menjadi tidak akurat. Kecepatan penyapuan yang dipi-lih ialah 200 nm/menit, karena bentuk spek-trumnya setelah mengalami proses penurunan masih mengandung nilai yang akurat bila dibandingkan dengan peubah 400, 800, dan 1200 nm/menit. Tidak dipilihnya kecepatan penyapuan 100 nm/menit karena waktu yang dibutuhkan untuk analisis spektrum lebih lama sedangkan bentuk spektrum yang diperoleh sama dengan peubah 200 nm/menit.
(a)
(b)
Gambar 5 Spektrum standar reserpin pada turunan ke nol (a) dan turunan pertama (b).
Keterangan:
Jingga = kecepatan penyapuan 100 nm/menit
Biru = kecepatan penyapuan 200 nm/menit
Merah = kecepatan penyapuan 400 nm/menit
Hijau = kecepatan penyapuan 800 nm/menit
Cokelat = kecepatan penyapuan 1200 nm/menit
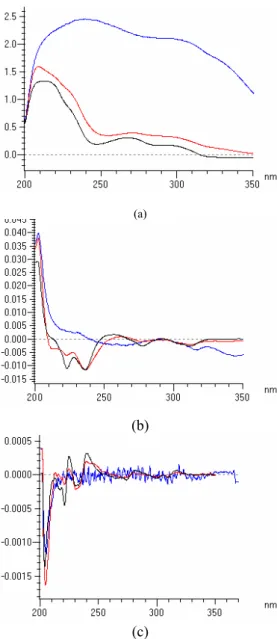
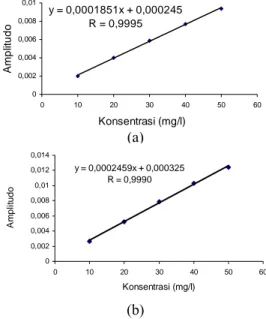
Analisis kadar reserpin menggunakan metode SDUV menunjukkan bahwa matriks yang terkandung di dalam akar tanaman R. serpentina sangat kompleks. Hal ini meyebab-kan bentuk spektrum akar yang hanya dilarut-kan dengan etanol terlihat lebih lebar dan tinggi bila dibandingkan dengan akar yang te-lah diekstraksi bertahap menggunakan kloro-form, asam sulfat, dan natrium bikarbonat (Gambar 6a). Selain itu, bentuk spektrumnya juga tidak menyerupai standar reserpin. Proses penurunan fungsi matematika yang dilakukan pada kedua macam spektrum akar menunjuk-kan hasil yang berbeda. Adanya menunjuk-kandungan matriks yang sangat kompleks di dalam akar menyebabkan bentuk spektrum akar yang hanya dilarutkan dengan etanol tidak menye-rupai bentuk spektrum standar dan tidak ditemukannya daerah yang berhimpit dengan spektrum standar walaupun telah mengalami proses penurunan. Pada spektrum akar yang mengalami ekstraksi terlihat adanya persama-an bentuk spektrum dengpersama-an stpersama-andar dpersama-an ada-nya daerah yang berhimpit dengan standar setelah diturunkan (Gambar 6b dan 6c). Sehingga, dalam penelitian ini dilakukan ekstraksi bertahap untuk analisis reserpin di dalam akar R. serpentina menggunakan metode SDUV.
Absorban
dA/dλ
Parameter kondisi optimum untuk penen-tuan kadar reserpin dalam obat dan akar tidak sama, karena kandungan matriks dalam obat dan akar berbeda. Pada analisis reserpin dalam obat dan akar, spektrum turunan pertama me-miliki sensitivitas dan linearitas yang tinggi, sehingga turunan pertama yang dipilih untuk analisis kuantitatif,walaupun spektrum dengan orde turunan yang tinggi mempunyai lineari-tas yang tinggi pula, spektrum tersebut tidak dipilih untuk analisis karena semakin tinggi orde turunan, sensitivitas akan semakin me-nurun (Lampiran 7). Hal ini terjadi karena nis-bah sinyal terhadap noise (S/N) semakin kecil (Owen 1996; Popovic et al. 1999).
Spektrum turunan pertama, kedua, dan ketiga contoh obat Serpasil® dan ekstrak akar
R. serpentina pada kisaran panjang gelom-bang 200-370 nm dapat dilihat pada Gambar 7. PadaGambar 7 terlihat pola spektrum yang berhimpit antara standar dan contoh di pan-jang gelombang 277.4 nm untuk obat dan 312 nm untuk akar. Hal ini menunjukkan hanya serapan reserpin yang terjadi pada panjang gelombang tersebut. Perbedaan panjang ge-lombang pada contoh obat dan akar disebab-kan akar oleh perbedaan matriks yang terdisebab-kan- terkan-dung di dalam contoh tersebut.
(a)
(b)
(c)
Gambar 6 Spektrum standar reserpin dan akar R. serpentina pada turunan ke nol
(a), pertama (b), dan kedua (c).
Keterangan:
Hitam = standar reserpin
Merah = akar dengan ekstraksi bertahap
Biru = akar yang dilarutkan dengan etanol
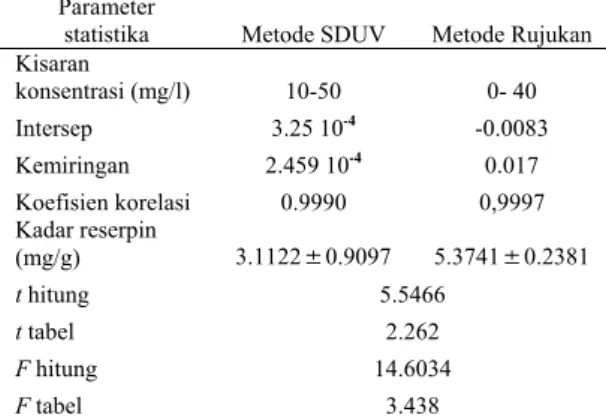
Spektrum turunan kedua pada Gambar 7c1
dan 7c2 terlihat bertumpang tindih antara
spektrum contoh dan standar, tetapi tidak di-pilih sebagai kondisi optimum untuk penen-tuan kadar reserpin. Hal ini disebabkan sema-kin tinggi orde turunan maka akan semasema-kin tinggi pula noise yang dihasilkan sehingga nisbah antara sinyal dan noise menurun. Spektrum turunan ketiga pada Gambar 7d1
dan 7d2 menujukkan garis lurus, artinya pada
turunan ketiga spek-trum mengalami distorsi
sempurna sehingga informasi yang dibutuhkan hilang.
Tumpang tindih spektrum yang terjadi an- tara standar dan contoh pada spektrum turun-an pertama dipilih untuk pengukurturun-an amplitu-do. Amplitudo merupakan respon yang ter-ukur dari analat. Jenis amplitudo yang digu- nakan di dalam penelitian ini untuk men-dapatkan persamaan regresi linear adalah Dz, yaitu amplitudo yang diukur dari garis dasar. Konsentrasi larutan standar 10–50 mg/l me-nunjukkan linearitas yang tinggi pada pan-jang gelombang 277.4 nm untuk obat dan 312 nm untuk akar.
Proses penurunan spektrum menyebabkan nisbah sinyal terhadap noise (S/N) menurun, sehingga diperlukan proses penghalusan spek-trum yang bertujuan untuk mengurangi noise dan mempertahankan nisbah sinyal terhadap noise (S/N) sesuai dengan spektrum pada orde turunan ke nol (Lampiran 2 dan 3). Teknik penghalusan spektrum yang digunakan yaitu Savitzky-Golay. Parameter penghalusan meli-puti orde penghalusan dan jumlah jendela. Orde penghalusan dan jumlah jendela yang digunakan mempengaruhi intensitas dan resolusi spektrum. Oleh sebab itu, bentuk dan besarnya amplitudo yang terukur dipengaruhi oleh kedua faktor tersebut. Semakin tinggi orde penghalusan maka nilai amplitudo akan semakin besar. Akan tetapi, semakin tinggi jumlah jendela yang digunakan, maka akan semakin banyak pula sinyal yang diolah untuk menghaluskan spektrum sehingga bentuk dan nilai amplitudo semakin kecil (Lampiran 4) (Brereton 2003). Di dalam analisis kuantitatif, proses penghalusan yang terlalu tinggi menyebabkan sinyal yang terukur dalam spektrum menjadi tereduksi, sedangkan bila terlalu rendah, sulit untuk membedakan sinyal sebenarnya yang terukur dari reserpin dengan noise. Oleh sebab itu, diperlukan penetapan orde penghalusan dan jumlah jendela yang optimum supaya nilai yang diperoleh akurat. Kondisi optimum untuk menganalisis resepin dalam obat dan akar disajikan pada Tabel 1. Tabel 1 Kondisi optimum pada analisis reser- pin dengan metode SDUV
Kondisi optimum Parameter Obat Akar Panjang gelombang (nm) 277.4 312 Kecepatan penyapuan (nm/menit) 200 200 Orde turunan 1 1 Orde penghalusan 2 2 Jumlah jendela 17 21
9
Gambar 7 Spektrum turunan standar reserpin (−), contoh obat Serpasil® (−), dan contoh
ekstrak akar Rauwolfia serpentina (−). (a1) (b1) (c1) (d1) (a2) (b2) (c2) (d2)
Keterangan: 1= Contoh obat Serpasil® 2= Contoh ekstrak akar
(a) Spektrum turunan nol (b) Spektrum turunan pertama (c) Spektrum turunan kedua (d) Spektrum turunan ketiga
y = 0.0161x + 0.0313 R2 = 0.9999 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 Kondisi optimum tersebut menunjukkan
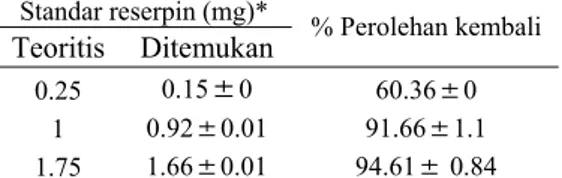
kadar reserpin rata-rata dalam obat sebesar 0.2202 mg ± 0.0028 per tablet (Lampiran 8). Nilai ini relatif jauh apabila dibandingkan dengan kadar yang tertera dalam bungkus obat, yaitu sebesar 0.25 mg per tablet, tetapi relatif lebih dekat dengan kadar reserpin yang diperoleh menggunakan metode rujukan. Spektrum serapan standar reserpin dan contoh obat Serpasil® pada kondisi optimum untuk setiap ulangan dapat dilihat pada Lampiran 5. Persamaan garis yang diperoleh y = 0.000245 + 0.0001851 x dan koefisien korelasi sebesar 0.9995 (Gambar 8 a). Selan-jutnya kadar reserpin rata-rata yang diperoleh dalam akar pada kondisi optimum sebesar 3.1122 mg ± 0.9097 per satu gram akar (Lampiran 9). Spektrum serapan standar reser-pin dan contoh akar pada kondisi optimum untuk setiap ulangan dapat dilihat pada Lam-piran 6. Persamaan garis yang diperoleh y = 0.000325 + 0.0002459 x dan koefisien
kore-lasi 0.9990 (Gambar8 b). 0,8 0 10 20 30 40 50 konsentrasi (ppm) ab sor b an
(a) (b)
Gambar 8 Kurva standar reserpin untuk obat (a) dan akar (b).
Metode spektrofotometri derivatif UV merupakan metode yang murah, mudah, dan cepat untuk analisis kuantitatif reserpin dalam obat. Biaya yang diperlukan dalam metode SDUV lebih murah dibandingkan dengan metode spektrofotometri konvensional karena tidak menggunakan pereaksi pembentuk warna dan pereaksi yang banyak. Di samping itu analisisnya menjadi lebih mudah dan murah karena standar dan contoh hanya dilarutkan dengan pelarut untuk kemudian diukur.
Pengukuran Reserpin dengan Metode Spektrofotometri UV-VIS (British Pharmacopeia 1993)
Spektrofotometri UV-VIS konvensional digunakan sebagai metode rujukan untuk analisis reserpin dalam obat dan akar. Linea-ritas standar reserpin dengan metode British Pharmacopiea untuk analisis obat diperoleh dari deret standar reserpin yang mempunyai kisaran konsentrasi 0 –40 mg/l menggunakan metode regresi kuadrat terkecil. Persamaan garis yang diperoleh adalah y = 0.0313 + 0.0161 x dengan koefisien korelasi sebesar 0.9999 (Gambar 9). Kadar reserpin rata-rata dalam satu tablet obat diperoleh sebesar 0.2289 mg ± 0.0044 (Lampiran 10). Hasil ini relatif dekat dengan kadar reserpin menggunakan metode SDUV, tetapi relatif jauh dengan kadar reserpin dalam bungkus obat.
y = 0,0001851x + 0,000245 R = 0,9995
Gambar 9 Kurva standar reserpin dalam analisis tablet obat.
Linearitas standar reserpin untuk analisis akar R. serpentina diperoleh dari kisaran kon-sentrasi 0–40 mg/l. Persamaan garis yang diperoleh adalah y = 0.0170 x - 0.0083 dengan koefisien korelasi sebesar 0.9997 (Gambar 10). Kadar reserpin rata-rata dalam satu gram akar diperoleh sebesar 5.3741 mg ± 0.2381 (Lampiran 11).
Gambar 10 Kurva standar reserpin dalam analisis akar R. serpentina.
y = 0,0002459x + 0,000325 R = 0,9990 0 0,002 0,004 0,006 0,008 0, d o 0 0,002 0,004 006 0,008 0,01 0 10 20 30 40 50 60 nsentrasi (mg/l) 0, pl it Ko A m udo 01 0,012 0,014 0 10 20 30 40 50 60 Konsentrasi (mg/l) Am p li tu y = 0.0170x - 0.0083 R = 0.9997 -0,1 0 0,1 0,2 0, 0, so rb 3 4 0,5 0,6 0,7 0,8 0 10 20 30 40 50 konsentrasi (ppm) ab an
11
Perbandingan Metode SDUV dan Spektrofotometri UV-VIS
Hasil analisis kadar reserpin dalam obat dan akar menggunakan metode Spektrofoto-metri UV-VIS dan SDUV dibandingkan seca-ra statistika menggunakan paseca-rameter uji t dan uji F (Tabel 2 dan Tabel 3). Uji t untuk kadar reserpin di dalam obat menggunakan metode spektrofotometri UV-VIS dan SDUV tidak berbeda nyata pada tingkat kepercayaan 95% dengan nilai t hitung lebih kecil dari t tabel. Uji F nilai ragam hasil analisis menggunakan metode spektrofotometer UV-Vis dan SDUV tidak berbeda nyata pada tingkat kepercayaan 95% (Lampiran 12).
Tabel 2 Hasil uji statistik metode SDUV dan metode Rujukan dalam obat
Parameter
statistika Metode SDUV
Metode Rujukan Kisaran konsentrasi (mg/l) 10-50 0- 40 Intersep 2.13 10-4 0.0313 Kemiringan 1.981 10-4 0.0161 Koefisien korelasi 0.9998 0.9999 Kadar reserpin (mg/tablet) 0.2201±0.0028 0.2289±0.0044 t hitung 0.8839 t tabel 2.306 F hitung 2.3733 F tabel 3.438
Uji t antara metode spektrofotometri UV-Vis dan SDUV untuk menganalisis kadar re-serpin dalam akar berbeda nyata pada tingkat kepercayaan 95% dengan nilai t hitung lebih besar dari t tabel. Uji F hasil analisis meng-gunakan metode spektrofotometri UV-VIS dan SDUV berbeda nyata pada tingkat keper-cayaan 95% (Lampiran 12).
Tabel 3 Hasil uji statistik metode SDUV dan metode Rujukan dalam akar
Parameter
statistika Metode SDUV Metode Rujukan
Kisaran konsentrasi (mg/l) 10-50 0- 40 Intersep 3.25 10-4 -0.0083 Kemiringan 2.459 10-4 0.017 Koefisien korelasi 0.9990 0,9997 Kadar reserpin (mg/g) 3.1122±0.9097 5.3741±0.2381 t hitung 5.5466 t tabel 2.262 F hitung 14.6034 F tabel 3.438
Validasi metode SDUV untuk penentuan kadar reserpin hanya dilakukan pada analisis obat, sedangkan dalam akar tidak dilakukan karena prosedur yang dibutuhkan relatif lama dan uji statistika menunjukkan bahwa metode rujukan dan SDUV berbeda nyata. Prosedur yang relatif lama dilakukan karena reserpin dipisahkan terlebih dahulu dari senyawa metabolit sekunder yang lain pada ekstrak akar agar matriks dari senyawa metabolit sekunder yang lain tidak terlalu menganggu spektrum.
Validasi Metode Spektrofotometri Derivatif
Validasi metode SDUV perlu dilakukan karena metode SDUV pada analisis reserpin dalam obat merupakan metode baru yang dikembangkan untuk analisis kuantitatif. Para-meter validasi yang diuji antara lain linearitas, limit deteksi, limit kuantisasi, ketelitian, dan perolehan kembali. Nilai dari parameter terse-but dibandingkan dengan batas penerimaan parameter validasi yang ditetapkan oleh organisasi internasional seperti AOAC.
Hasil penetapan parameter persamaan kurva standar menunjukkan bahwa koefisien korelasi secara keseluruhan dari tiga ulangan seri standar (Tabel 4) berkisar antara 0.9995 dan 0.9998 pada kisaran konsentrasi 10 – 50 mg/l, dengan rataan 0.9998 (Tabel 5). Angka ini menunjukkan adanya hubungan yang linear antara konsentrasi dan sinyal yang ter-ukur, sehingga untuk mengetahui konsentrasi analat dalam suatu contoh dapat langsung diketahui dengan memasukkan nilai serapan pada persamaan kurva standar yang membe-rikan linearitas yang baik. AOAC menyaran-kan bahwa koefisien korelasi yang diperoleh sekurang-kurangnya 0.9995. Metode SDUV untuk analisis reserpin dalam obat memenuhi syarat linearitas yang diterima oleh AOAC. Persamaan kurva standar yang diperoleh adalah y=2.12.10-4 + 1.976.10-4x (Gambar 11).
Tabel 4 Persamaan kurva standar sebanyak tiga kali ulangan
y = a + bx ulangan Intersep Kemiringan Koefisien korelasi 1 2.79 x 10-4 1.985 x 10-4 0.9995 2 1.84 x 10-4 2.036 x 10-4 0.9998 3 1.79 x 10-4 1.921 x 10-4 0.9997
Nilai kemiringan memberi informasi ten-tang kepekaan suatu metode. Metode SDUV
mempunyai kemiringan yang kecil, artinya perubahan konsentrasi menyebabkan perbeda-an pembacaperbeda-an yperbeda-ang tidak terlalu besar. Titik potong terhadap sumbu-y (intersep) menun-jukkan adanya pengaruh matriks pada larutan blanko. Pengaruh matriks akan mempengaruhi kemampuan metode untuk mengukur konsen-trasi yang terkecil (limit deteksi).
Tabel 5 Parameter statistika kurva standar rata-rata*
Parameter statistika Reserpin (λ= 277.4 nm)
Kisaran konsentrasi (mg/l) 10-50 Persamaan regresi y= 2.12 x 10-4+1.976 x 10-4x Simpangan baku intersep 8.2138 x 10-6 Simpangan baku kemiringan 2.476 x 10-6 Koefisien korelasi (r) 0.9998 Limit deteksi (mg/l) 1.1890 Limit kuantisasi (mg/l) 3.9634 y = 0,000213x + 0,0001981 R = 0,9998 0 0,002 0,004 0,006 0,008 0,01 0,012 0 10 20 30 40 50 60 Konsentrasi (ppm) A m p lit u d o
Keterangan: *sebanyak tiga kali ulangan
Gambar 11 Kurva standar reserpin 10 – 50 mg/l.
Limit deteksi metode SDUV diperoleh dari persamaan kurva standar rata-rata. Limit deteksi metode SDUV untuk reserpin adalah 1.1890 mg/l yang berarti metode SDUV mampu membedakan sinyal noise dengan reserpin walaupun dalam jumlah reserpin yang sedikit. Limit kuantisasi metode SDUV adalah 3.9634 mg/l, artinya dalam jumlah reserpin yang relatif sedikit, metode SDUV memberikan ketelitian dan ketepatan yang baik. Perhitungan limit deteksi dan limit kuantisasi dapat dilihat pada Lampiran 13. Hal penting yang perlu diperhatikan dalam se-buah metode adalah menghindari analisis yang menyatakan bahwa suatu analat ada padahal sebetulnya tidak ada, begitu pula sebaliknya (Miller & Miller 2000).
Ketelitian dapat diketahui dengan melihat nilai %SBR. Kadar reserpin rata-rata dalam satu tablet adalah 0.2202 mg ± 0.0028 (Tabel 6). Ketelitian dilakukan sebanyak sembilan kali ulangan, setiap ulangan mempunyai bobot
±1 gram.Perhitungan kadar reserpin dapat di-lihat pada Lampiran 14. Metode spektrofoto-metri derivatif mempunyai ketelitian 1.68%. Menurut AOAC (1993) ketelitian suatu meto-de analisis dianggap teliti jika hasil dari pe-netapan ulangan mempunyai perbedaan yang kecil satu sama lain (1-2%).
Tabel 6 Data ketelitian reserpin dalam tablet obat menggunakan metode SDUV
Ulangan Kadar reserpin (mg)* 1 0.2194 2 0.2167 3 0.2245 4 0.2200 5 0.2216 6 0.2139 7 0.2178 8 0.2245 9 0.2234 Rata-rata = 0.2202 Batas galat= 0.0028 SD = 0.0037 %SBR = 1.68
Keterangan: * kadar reserpin dalam satu tablet
Perolehan kembali (recovery) adalah ang-ka yang menunjukang-kan besarnya penambahan standar yang mampu diidentifikasi kembali dengan suatu metode. Nilai perolehan kembali menunjukkan besarnya pengaruh matriks ter-hadap analat di dalam contoh. Metode SDUV mempunyai nilai pemulihan yang beragam. Standar reserpin sebanyak 0.25 mg ditambah-kan ke dalam larutan yang telah mengandung 0.5 mg reserpin. Konsentrasi akhir 15 mg/l. Ternyata, standar reserpin yang terukur 0.15 09 mg ± 0, sehingga nilai perolehan kembalihanya 60.36%±0. Perolehan kembali untuk konsentrasi 30 mg/l dan 45 mg/l ada-lah 91.66% ± 0.0143 dan 94.61%± 0.0113. Nilai dari tiap perolehan kembali untuk tiap konsentrasi dapat dilihat pada Tabel 7, se-dangkan perhitungannya dapat dilihat pada Lampiran 15.
Tabel 7 Data perolehan kembali reserpin dalam tablet obat dengan metode SDUV
Standar reserpin (mg)*
Teoritis Ditemukan % Perolehan kembali
0.25 0.15±0 60.36±0
1 0.92±0.01 91.66±1.1 1.75 1.66±0.01 94.61± 0.84
13
Perolehan kembali yang rendah menggam-barkan adanya interaksi antara analat dan ma-triks, dan komponen pengganggu lainnya yang kompleks, sehingga menyebabkan hi-langnya analat yang terukur. Perolehan kem-bali menjadi rendah, juga dapat disebabkan pembilasan dan penyaringan yang kurang sempurna.
Perolehan kembali yang rendah pada kon-sentrasi 15 mg/l menunjukkan analisis memer- lukan pengulangan agar hasil yang diperoleh lebih baik. Menurut AOAC (1993), perolehan kembali seharusnya berkisar antara 80 –110%.
SIMPULAN DAN SARAN
Simpulan
Metode SDUV dapat digunakan untuk menganalisis kadar reserpin dalam tablet obat dengan ketelitian dan keakuratan yang baik. Analisis kadar rata-rata reserpin dalam tablet obat dengan metode SDUV adalah 0.2202 mg ± 0.0028, sedangkan dengan metode spektro-fotometri UV-VIS diperoleh sebesar 0.2289 mg ±0.0044, uji statistika yang dilakukan menunjukkan bahwa kedua metode tersebut tidak berbeda nyata. Pengukuran parameter validasi metode SDUV pada obat memberikan hasil linearitas sebesar 0.9998, ketelitian 1.68%, perolehan kembali 60.36–94.61%, limit deteksi 1.1890 mg/l, dan limit kuantisasi 3.9634 mg/l. Pengaruh matriks dalam akar belum dapat diatasi oleh metode SDUV yang ditunjukkan oleh uji statistika kedua metode tersebut berbeda nyata.
Saran
Perlu dilakukan pencarian ekstraksi akar yang sederhana yang dapat menurunkan pengaruh matriks pada metode SDUV sehingga pengaruh matriks dapat dihilangkan pada spektrum turunan tanpa mereduksi spektrum serapan reserpin. Selain itu, perlu dilakukan validasi metode SDUV yang lebih menyeluruh untuk analisis kadar reserpin dalam obat.
DAFTAR PUSTAKA
Alexander L et al. 1998. Determination of reserpine and Rescinnamine in Rauwolfia serpentine Powders and Tablets: Collabo-rative Study. J AOAC 81:373-380.
Alpdogan G, Karabina K, Sungur S. 2002. Derivative spectrophotometric determina-tion of caffeine in some beverages. Turk J Chem 26:295-302.
Ansel HC. 1989. Pengantar Bentuk Sediaan Farmasi. Ed ke-4. Farida Ibrahim; pener- jemah. Jakarta: Universitas Indonesia Press. Terjemahan dari Introduction to Pharmaceutical Dosage Forms.
Ansari M, Kazemipour M, Baradaran M, Jalalizadeh H. 2004. Derivative spectro-photometric method for determination of losartan in pharmaceutical formulations. J Pharm Biomed Anal 30:1183-1189.
[AOAC] Association Official of Analytical Chemistry. 1993. AOAC Peer - Verified Methods Program. USA: AOAC Internati-onal.
Aydogmus Z, Cetin SM, Ozgur MU. 2002. Determination of ascorbic acid in vegeta-bles by derivative spectrophotometry. Turk J Chem 26:697-704.
British Pharmacopiea.1993. British Pharmaco-piea Department of Health & Social Ser-vices for Northern Ireland. London: British Pharmacopiea.
Brereton RG. 2003. Data Analysis for the La-boratory and Chemical Plant. Chichester: J Wiley.
Chan CC. 2004. Potency Method Validation. Di dalam: Chan CC, Lee YC, Lam H, Zhang XM, editor. Analytical method Validation and Instrument Performance Verification. New Jersey: J Wiley. hlm 11-25.
Eskandiari H. 2004. Highly selective deri-vative spectrophotometry for determina-tion of nickel using 1-(2-Pyridylazo)-2-naphtol in tween 80 micellar solutions. Bull Korean Chem Soc 25(8):1137-1142. Fell AF, Jarvie DR, Stewart MJ. 1981.
Analysis for paraquat by second and fourth derivative spectroscopy. Clin Chem 27: 286-292.
Garcia PL, Santoro MIRM, Hackman ERMK, Singh AK. 2005. Development and validation of a HPLC and a UV derivative spectrophotometric methods for
determi-nation of hydroquinone in gel and cream preparations. J Pharm Biomed Anal. 39: 764-768.
Hidayat A. 1989. Pengendalian dan Evaluasi Unjuk Kerja Metode Analisis Kimia. Warta Akab 1:58-61.
Jones KG, Sweeney GD. 1979. Quantitation of urinary porphyrins by use of second derivative spectroscopy. Clin chem. 25(1): 71-74.
Karpinska J, Mikoluc B, Piotrowska J. 1998. Apllication of derivative spectrophoto-metry for determination of coenzyme Q10 in pharmaceutical and plasma. J Pharm Biomed Anal 17:1345-1350.
Liska K. 2004. Drugs and The Human Body. Edisi ke-7. New Jersey: Prentice Hall. Miller JN, Miller JM. 2000. Statistics and
Chemometrics for Analytical Chemistry. Ed ke-4. Harlow: Pearson.
Owen T. 1996. Fundamentals of UV-visible Spectroscopy. Waldbronn: Hewlett-Packard.
Popovic GV, Pfendt LB, Stefanovic VM. 1999. Analytical application of derivative spectrophotometry. J Serb Chem Soc 65 (7): 457-472.
Rolim A et al. 2005. Total flavonoids quan- tification from O/W emulsion with extract of Brazilian plants. Int J Pharmaceutics, siap terbit.
Saunders L. 1974. The Absorption and Distribution of Drugs. London: Bailliere Tindal.
Singh DK, Srivastava B, dan Sahu A. 2004. Spectrophotometry determination of Rauwolfia Alkaloids: Estimation of reserpine in pharmaceuticals. Anal Sci 20:571-573.
Siswandono .1995. Kimia Medisinal. Suraba-ya: Universitas Airlangga Press.
Skujins S. 1986. Application of UV-Visible Derivatif Spectrophotometry. Steinhauser-tasse: Varian AG.
Sudjadi. 1985. Penentuan Struktur Senyawa Organik. Jakarta: Ghalia Indonesia. Tauller A, Levillain P, Lemonnier A. 1987.
Determining methemoglobin in blood by zero-crossing-point first- derivative spec- trophotometry. Clin Chem 33(10):
1767-1770.
[USP] United State Pharmacopiea. 1995. USP/NF. Rockville:USP Convention.
Lampiran 1 Diagram alir penelitian
Standar Reserpin
Contoh obat dan ekstrak
Metode spektrofotometri
derivatif UV
Metode Rujukan
British Pharmacopiea
Preparasi standar dan contoh
Penentuan kecepatan
penyapuan, orde
turunan, penghalusan,
dan jendela optimum.
Penentuan kurva standar
dari
D
L, D
S, dan D
ZPenentuan kadar
reserpin dalam contoh
Uji statistika
17
Lampiran 2 Spektrum serapan standar reserpin dan contoh obat turunan ke nol pada ulangan (a) 1, (b) 2, (c) 3, (d) 4, (e) 5, (f) 6, (g) 7, (h) 8, (i) 9
(a)
(b) (c)
(d) (e)
(f) (g)
Keterangan:Biru = standar reserpin 10 mg/l Hitam = standar reserpin 20 mg/l Hijau = standar reserpin 30 mg/l Jingga = standar reserpin 40 mg/l Merah muda = standar reserpin 50 mg/l Merah = contoh obat
Lanjutan Lampiran 2
(h) (i)
Lampiran 3 Spektrum serapan standar reserp
ulangan (a) 1, (b) 2, (c) 3, (d) 4, (e) 5, (f)
(b)
(d)
(e)
in dan contoh akar turunan ke nol pada 6, (g) 7, (h) 8, (i) 9
(a
Keterangan:
Biru = standar reserpin 10 mg/l Hitam = standar reserpin 20 mg/l ijau = standar reserpin 30 mg/l pin 40 mg/l serpin 50 mg/l Merah = contoh akar
H
)
(c)
Jingga = standar reser Merah muda = standar re
19
Lanjutan lampiran 3
(f) (g)
(i)
ampiran 4 Spektrum serapan standar reserpin pada kecepatan penyapuan 200 nm/menit lusan kedua
(h)
L
dan pengha
Orde turunan ke-1 Jumlah jendela 7
Keterangan:
Biru = standar reserpin 10 mg/l Hitam = standar reserpin 20 mg/l Hijau = standar reserpin 30 mg/l Jingga = standar reserpin 40 mg/l Merah muda = standar reserpin 50 mg/l
Orde turunan ke-1 Jumlah jendela 65 Orde turunan ke-1
Orde turunan ke-2 Jumlah jendela 17 Orde turunan ke-2
Jumlah jendela 7
(e Orde turunan ke-2
Jumlah jendela 65 Orde turunan ke-3
Jumlah jendela 7
Orde turunan ke-3 Jumlah jendela 65 Orde turunan ke-3
Jumlah jendela 17
Lampiran 5 Spektrum serapan standar reserpin dan contoh obat pada kondisi optimum ulangan (a) 1, (b) 2, (c) 3, (d) 4, ) 5, (f) 6, (g) 7, (h) 8, (i) 9
(a)
Keterangan:
Biru = standar reserpin 10 mg/l Hitam = standar reserpin 20 mg/l Hijau = standar reserpin 30 mg/l Jingga = standar reserpin 40 mg/l Merah muda = standar reserpin 50 mg/l Merah = contoh obat
21
(b)
(f) (g)
(i)
(c)
(d)
(e)
(h)
Lampiran 6 Spektrum serapan standar reserpin dan contoh akar pada kondisi optimum ulangan (a) 1, (b) 2, (c) 3, (d) 4, (e) 5, (f) 6, (g) 7, (h) 8, (i) 9
(d)
(e)
(g)
Keterangan:
Biru = standar reserpin 10 mg/l Hitam = standar reserpin 20 mg/l Hijau = standar reserpin 30 mg/l Jingga = standar reserpin 40 mg/l Merah muda = standar reserpin 50 mg/l Merah = contoh obat
(a)
(b)
(c)
23
Lanjutan lampiran 6
(i)
(h)
Lampiran 7 Persamaan kurva standar dan kadar reserpin dalam obat untuk penentuan kondisi optimum
No. Kondisi λ (nm) Persamaan garis Regresi Kadar reserpin (mg) 1 1.2.7 277.2 0.000259+0.0001887x 0.9991 0.2190 2 312 0.0002078x-0.00011 1 0.2119 4 1.2.9 277.2 0.000241+0.0001889x 0.9994 0.2190 0.2115 7 1.2.11 277.4 0.000247+0.0001873x 0.9995 0.2194 8 312 0.0002065x-0.000065 1 0.2119 9 1.2.13 277.4 0.000247+0.0001865x 0.9994 0.2200 10 312 0.0002057x-0.000051 1 0.2118 11 1.2.15 277.4 0.000239+0.0001861x 0.9995 0.2201 12 312 0.000205x-0.00004 1 0.2119 13 1.2.17 277.4 0.000245+0.0001851x 0.9995 0.2202 14 312 0.0002044x-0.00003 1 0.2117 15 1.2.19 277.4 0.000251+0.0001841x 0.9994 0.2200 16 312 0.0002036x-0.00002 1 0.2117 17 1.2.21 277.6 0.000249+0.0001831x 0.9995 0.2174 18 312 0.0002028x-0.000016 1 0.2120 19 1.2.23 277.4 0.000266+0.0001816x 0.9994 0.2201 20 312 0.0002018x-0.000006 1 0.2147 21 1,2,25 277,6 0,000261+0,0001807x 0,9994 0,2202 22 312 0,0002008x 1 0,2120 23 1,2,27 277,6 0,000265+0,0001795x 0,9994 0,2201 24 312 0,0001998x 1 0,2122 25 1,2,29 277,6 0,000268+0,0001782x 0,9994 0,2201 26 312 0,00024+0,0001868x 0,9978 0,2127 27 1,2,31 277.6 0.00025+0.0001876x 0.9994 0.2202 28 312 0.0002066x-0.000024 1 0.2124 29 1.2.33 277.6 0.000262+0.0001758x 0.9994 0.2204 30 312 0.0001969x-0.000001 1 0.2125 31 1.2.35 277.6 0.000262+0.0001744x 0.9994 0.2204 32 312 0.0001959x-0.000001 1 0.2126 0.000003+0.0001947x 1 0.2123 5 312.2 0.0002057x-0.000039 1 33 1.2.37 277.6 0.000253+0.0001733x 0.9994 0.2206 34 312
25
Lanjutan lampiran 7
No. Kondisi λ (nm) Persamaan garis Regresi Kadar reserpin (mg) 33 1.2.37 277.6 0.000253+0.0001733x 0.9 4 99 0.2206 34 312 0.000003+0.0001947x 0.2 23 9 0.9 4 36 312 0.000006+0.0001934x 0.2 24 1 2 0.9 4 38 312 0.000007+0.0001923x 0.2 23 1.2 3 2 0.9 4 40 312 0.000001+0.0002051x 0.2 25 1.2 5 2 0 0.9 3 42 312 0.000003+0.0001899x 0.2 25 1.2 7 2 0 0.9 3 44 312 0.000001+0.0001887x 0.2 26 1.2 9 2 0 0.9 4 46 312 0.000006+0.0001874x 0.2 26 1.2 1 2 0.9 4 48 311.8 0.000004+0.0001862x 0.2 29 1. 9 2 0. 50 311.6 0.0002108x-0.000174 0.9 0.2 34 1.3 3 2 0.000 03x 0.9 3 52 311.8 0.0002097x-0.000163 0.9 0.2 28 1.3 5 2 0.000 01x 0.9 4 54 312 0.000208x-0.0001 0.9 0.212 1.3 7 2 56 312 0.0002077x-0.000085 0.9 0.2 19 1.3 9 2 0.9 5 58 312 0.0002077x-0.000081 0.9 0.2 19 1.3 1 2 0.9 5 60 312 0.0002077x-0.000071 0.2 16 1.3 3 2 0.9 5 62 311.8 0.0002072x-0.000046 0.2 13 1.3 5 2 0.9 5 312 0.0002073x-0.000047 1 0.2113 1 1 35 1.2.3 277.6 0.000253+0.0001719x 99 0.2127 1 1 37 1.2.4 77.6 0.00025+0.0001704x 99 0.2207 1 1 39 .4 77.4 0.000269+0.0001863x 99 0.2205 1 1 41 .4 77.6 .000255+0.0001671x 99 0.2206 1 1 43 .4 77.6 .000247+0.0001657x 99 0.2209 1 1 45 .4 77.6 .000251+0.0001639x 99 0.2208 1 1 47 .5 77.6 0.000243+0.0001625x 99 0.221 1 1 49 3. 77.4 0.000206+0.0001932x 999 0.219 995 1 51 .1 77.2 247+0.00019 99 0.2187 999 1 53 .1 77.2 235+0.00019 99 0.2188 999 55 .1 77.2 0.000221+0.0001901x 0.9994 0.2195 999 1 57 .1 77.4 0.000236+0.000189x 99 0.22 999 1 59 .2 77.4 0.000234+0.000189x 99 0.2199 1 1 61 .2 77.4 0.000224+0.0001892x 99 0.219 1 1 63 .2 77.4 0.000238+0.0001886x 99 0.2196 64
Lanjutan lampiran 7
Kadar reserpin No. Kon isi d λ (nm) Persamaan garis Regresi
(mg) 65 1.3.27 277.4 0.000241+0.0001883x 0.9995 0.2 99 1 66 312 0.000207x-0.000034 1 0.2114 67 1.3.29 277.4 0.000243+0.0001881x 0.9 0.22 69 1.3.31 277.6 0.00025+0 01876x 0.9 0.2 98 71 1.3.33 277.4 0.00026+0 01874x 0.9 0.2 99 73 1.3.35 277.6 0.000273+0.0001841x 0.9 0.2 26 75 1.3.37 277.6 0.000266+0.0001868x 0.9 0.2 98 77 1.3.39 277.4 0.000269+0.0001867x 0.9 0.2 99 79 1.3.41 277.4 0.000272+0.0001864x 0.9 0.2 01 81 1.3.43 277.4 0.000269+0.0001863x 0.9 0.2 01 83 1.3.45 277.4 0.000274+0.000186x 0.9 0.2 99 85 1.3.47 277.4 0.000277+0.0001855x 0.9 0.2 01 87 1.3.49 277.4 0.000272+0.0001854x 0.9 0.2 01 0 89 1.3.51 277.6 0.000272+0.000185x 0.9 0.2 01 91 1.3.59 277.6 0.000268+0.0001834x 0.9 0.2 02 93 2.2.17 240 0.000067+0.000211x 0.9 3 0.2 51 2.2 1 2 0.9 3 95 274.2 0.000015+0.0000051x 0.9948 0.2058 282.2 0.000004+0.0000048x 0.9991 0.2208 97 300.2 0.0000046x 1 0.1845 995 68 312 0.0002069x-0.000027 1 0.2115 .00 994 1 70 312 0.0002066x-0.000024 1 0.2117 .00 994 1 72 312 0.0002061x-0.000013 1 0.2118 994 2 74 312 0.0002036x-0.000008 1 0.214 994 1 76 312 0.0002057x-0.000005 1 0.2117 994 1 78 312 0.000205x-0.000001 1 0.2124 994 2 80 312 0.000003+0.0002053x 1 0.2119 994 2 82 312 0.000001+0.0002051x 1 0.2121 994 1 84 312 0.000205x-0.000004 1 0.2123 994 2 86 312 0.0002048x 1 0.2121 994 2 88 312 0.0002045x-0.000005 1 .2145 994 2 90 312.2 0.000002+0.000304x 1 0.2118 994 2 92 312 0.000003+0.0002025x 1 0.209 97 1 94 .2 40.4 0.000056+0.0000221x 97 0.2064 96