26 IV HASIL DAN PEMBAHASAN
4.1. Ekstraksi Xilan Dedak Gandum
Proses ekstraksi diawali dengan perlakuan pendahuluan pada dedak gandum, yaitu penggilingan (grinding) sampai diperoleh ukuran bubuk pollard 40 mesh. Proses berikutnya adalah delignifikasi untuk memisahkan bagian lignin dari hemiselulosa dan selulosa dengan menggunakan pelarut natrium perklorat. Proses perendaman dengan NaOH adalah upaya untuk memisahkan hemiselulosa dan selulosa. Bagian yang larut dalam NaOH merupakan hemiselulosa dan bagian yang tidak larut (ampas) adalah selulosa. Filtrat yang diperoleh kemudian diendapkan dengan etanol 90% dan dikeringkan untuk mendapatkan bubuk fraksi xilan. Hasil neraca massa ekstraksi xilan dedak gandum ini dapat dilihat pada Tabel 5 dibawah ini.
Tabel 5. Hasil ekstraksi xilan dari dedak gandum
Perlakuan Berat Bubuk dedak gandum ukuran 40 mesh 1000 gram
Perendaman dalam NaOCl 1% sebanyak 1000 ml selama 5 jam pada suhu ruang
1800 gram
Bubuk dedak gandum terdelignifikasi 1500 gram Bubuk dedak gandum terdelignifikasi kering 590 gram
Filtrat (bubuk fraksi xilan) 160 gram
Hasil ekstraksi menghasilkan rendemen xilan dedak gandum sebesar 160 gram kering per 1000 gram dedak gandum atau sebesar 16%. Hasil ekstraksi ini lebih kecil daripada hasil prosentase xilan asal dedak gandum yang dilaporkan oleh Parajo et al. (2004) sebesar 26,8% namun lebih tinggi jika dibandingkan kadar xilan dari tongkol jagung yang dilaporkan oleh Richana (2006) sebesar 12,4%. Beberapa foto proses ekstraksi xilan dari dedak gandum dapat dilihat pada Gambar 7. Ekstraksi xilan dengan metode seperti dicantumkan pada Gambar 6 ini juga dilakukan oleh Richana (2006) pada ekstraksi xilan tongkol jagung dan menghasilkan xilan dengan tingkat kemurnian 97,47%.
27 Xilan hasil ekstraksi dedak gandum digunakan sebagai sumber karbon dalam produksi xilanase. Pada produksi skala laboratorium substrat yang digunakan adalah oat spelt xylan dari Sigma, namun pada skala yang lebih besar penggunaan xilan tersebut terlalu mahal. Ekstraksi xilan dedak gandum dimaksudkan agar xilan dedak gandum ini dapat menggantikan oat spelt xylan sebagai substrat pada produksi xilanase skala yang lebih besar.
A B C
D E F
Gambar 7. Proses ekstraksi xilan dedak gandum. A: perendaman dedak gandum dalam NaOCl 1%; B: penyaringan; C: endapan dedak gandum terdelignifikasi; D: perendaman dalam NaOH; E: endapan fraksi xilan; F: bubuk xilan kering siap digiling.
4.2. Produksi Enzim Xilanase
Produksi enzim xilanase dari isolat S. aureus MBXi-K4 dilakukan pada bioreaktor dengan volume 2 liter. Proses kultivasi tersebut dilakukan untuk mendapatkan nilai-nilai parameter kinetika kultivasinya. Kinetika kultivasi dikaji berdasarkan empat hal utama yaitu laju pertumbuhan spesifik (µ), laju pembentukan biomassa (Dx/dt), laju penggunaan substrat (Ds/dt), dan laju pembentukan produk (Dp/dt) yang kesemuanya mengikuti persamaan Monod. Efisiensi pertumbuhan mikroba, pembentukan produk dan penggunaan substrat dapat dinyatakan dalam nilai rendemen biomassa (Yx/s) dan rendemen produk
28 (Yp/s). Produk yang dimaksud dalam penelitian ini diukur berdasarkan aktifitas xilanasenya.
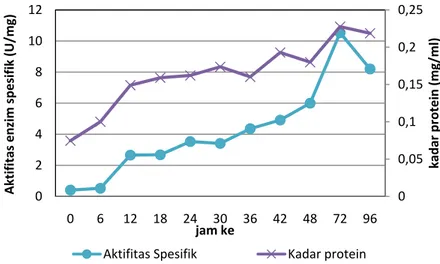
Substrat yang digunakan adalah 0.7% xilan dedak gandum dengan komposisi media mengacu pada Nakamura et al. (1993) dan Dung et al. (1993). Kultivasi dilakukan selama 96 jam pada suhu 37oC, laju aerasi 1 vvm, laju agitasi 160 rpm dan pH awal 7. Inokulum yang ditambahkan sebanyak 10% dari volume media kerja. Kultur hasil kultivasi disentrifugasi pada 4550 x g selama 10 menit pada suhu 4oC untuk mendapatkan ekstrak kasar enzim. Larutan ekstrak kasar enzim memiliki aktifitas paling tinggi pada jam ke 72 sebesar 2,26 U/ml dan aktifitas spesifiknya sebesar 10,5 U/mg.
Berdasarkan pengamatan terhadap data-data yang diperoleh pada proses produksi xilanase dari S. aureus MBXi-K4, terdapat beberapa perbedaan nilai keaktifan enzim yang diperoleh dibandingkan dengan hasil penelitian serupa menggunakan isolat yang sama oleh Setyawati (2006), dimana aktifitas xilanase pada kondisi optimal sebesar 11,37 U/ml. Hal ini dapat disebabkan karena terjadinya penurunan kualitas isolat dan perubahan fisiologis pada bakteri setelah mengalami penyimpanan yang cukup lama dan peremajaan ulang. Pada saat awal digunakan, isolat ini bahkan tidak menghasilkan zona bening ketika ditumbuhkan pada media padat yang mengandung oat spelt xylan. Untuk dapat mengembalikan produktifitas isolat telah dilakukan upaya untuk meremajakan isolat pada media cair yang diperkaya dengan oat spelt xilan pada konsentrasi rendah (0,2%) kemudian secara bertahap ditingkatkan konsentrasinya hingga mencapai 1%. Kultur sebanyak 100 µl disebar pada media padat yang mengandung xilan, dengan komposisi mengacu pada Dung et al.(1993), sampai terbentuk zona bening disekitar koloninya.
Perubahan nilai pH, berat kering sel (biomassa), aktifitas enzim dan kadar protein diamati tiap 6 jam sekali sampai 48 jam dan tiap 24 jam sampai jam ke 96. Pada Gambar 8 - 11 dapat dilihat kurva yang menggambarkan parameter-parameter yang diamati dalam proses produksi enzim xilanase.
4.2.1. Pertumbuhan Biomassa. Pertumbuhan sel pada S.aureus MBXi-K4 mengikuti pola pertumbuhan mikroorganisme pada umumnya, yaitu terbagi menjadi tiga fase pertumbuhan. Fase-fase tersebut adalah fase awal (lag phase),
29 diikuti oleh fase eksponensial atau fase pertumbuhan cepat, fase stationer dan fase menurun (fase kematian).
Laju pertumbuhan biomassa dan pembentukan xilanase terlihat memiliki kecenderungan yang sama. Pada 6 jam pertama adalah periode adaptasi mikroorganisme terhadap lingkungannya. Pada fase ini terjadi sintesa enzim yang diperlukan dalam proses metabolisme mikroba. Selama periode ini tidak terjadi perbanyakan sel. Pada periode ini laju pertumbuhan sel (dx/dt) = 0, demikian pula laju pertumbuhan spesifik (µ) = 0. Pembentukan produk (xilanase) juga belum begitu tinggi. Pada jam ke-12 terlihat mulai menunjukkan peningkatan yang cukup tinggi hingga mencapai puncaknya pada jam ke 72. Produksi enzim dan biomassa ini menurun pada jam ke-96 dimana kurva pertumbuhan telah memasuki fase pertumbuhan lambat dan memasuki fase kematian sel. Hal ini menunjukkan bahwa pembentukan xilanase ini berasosiasi dengan pertumbuhan sel.
Gambar 8. Grafik laju pertumbuhan biomassa dan aktifitas xilanase.
Berat kering sel maksimum diperoleh sebesar 4,6 (g/l) pada jam ke-72 dengan aktifitas xilanase 2,26 U/ml. Waktu optimum kultivasi xilanase pada penelitian ini sama dengan hasil penelitian Haq et al. (2002) yang menunjukkan bahwa xilanase yang diproduksi dari Aspergillus niger GCBMX-45 memiliki aktifitas xilanase tertinggi sebesar 1850 (U/g) pada jam ke-72 dan semakin menurun seiring dengan lamanya waktu kultivasi. Waktu kultivasi optimum ini sama dengan waktu kultivasi optimum produksi xilanase dari Chaetomium
0 0,5 1 1,5 2 2,5 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 0 6 12 18 24 30 36 42 48 72 96 ak tifi ta s xi la na se (U/ml) bioma ssa (g /l ) jam ke biomassa Aktifitas xilanase
30 thermophile yang dilaporkan oleh Hayat et al. (2001) dicapai pada jam ke-72 dengan aktifitas spesifik xilanase yang lebih kecil yaitu 20,68 U/mg. Richana (2006) memproduksi xilanase dari Bacillus pumillus RXAIII-5 dengan hasil biomassa tertinggi sebesar 2,8 g/l pada jam ke-42 pada perlakuan laju aerasi 1 vvm dan kecepatan agitasi 200 rpm, sedangkan aktifitas tertinggi xilanase sebesar 92,5 U/ml pada jam ke-24 dengan kondisi proses yang sama. Xilanase dari Staphylococcus sp SG13 diperoleh pada jam ke-48 dengan aktifitas enzim sebesar 0,28 U/ml (Gupta et al. 2000).
4.2.2. Perubahan Nilai pH. Perubahan nilai pH dan hubungannya dengan pertumbuhan biomassa selama proses kultivasi xilanase oleh S.aureus MBXi-K4 diperlihatkan pada Gambar 9. Penentuan nilai pH awal sebesar 7.0 adalah berdasarkan studi literatur (Dung et al. 1993).
Gambar 9. Grafik perubahan nilai pH dan laju pertumbuhan biomassa.
Penurunan nilai pH dimulai pada jam ke-0 (t=0) yaitu menjadi 6,9. Hal ini diduga berasal dari inokulum yang telah ditumbuhkan selama 24 – 30 jam. Selama pertumbuhan tersebut diduga telah terjadi pembentukan asam sebagai hasil samping dari proses metabolismenya. Nilai pH ini mempunyai kecenderungan untuk menurun seiring dengan peningkatan biomassa dan kembali meningkat pada jam ke-96 pada saat pembentukan biomassa mulai menurun. 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 6,1 6,2 6,3 6,4 6,5 6,6 6,7 6,8 6,9 7 7,1 0 6 12 18 24 30 36 42 48 72 96 bi oma ssa (g/l) pH jam ke pH biomassa
31 Perubahan nilai pH dapat disebabkan oleh penggunaan amonium dalam media tumbuh sebagai sumber nitrogen. Amonium dalam keadaan terdisosiasi (NH3+), akan bergabung dengan mikroorganisme membentuk sel dalam bentuk R-NH3+ dan meninggalkan ion H+ didalam kultur (Wang et al. 1978). Nilai pH yang kembali meningkat menunjukkan bahwa produksi biomassa sudah mulai menurun sehingga proses metabolismenya juga menurun dan asam yang merupakan produk sampingnya tidak dihasilkan lagi.
4.2.3. Pembentukan Produk. Produk yang dimaksudkan dalam penelitian ini adalah enzim xilanase yang terbentuk, yang dinyatakan dalam pengukuran aktifitas spesifik enzim (U/mg protein). Hasil pengamatan terhadap pembentukan produk dan laju penggunaan substrat disajikan pada Gambar 10 dan 11 di bawah ini.
Gambar 10. Grafik perubahan kadar protein dan aktifitas spesifik enzim.
Kadar protein terlihat pada 6 jam awal proses kultivasi cenderung mengalami peningkatan yang sedikit, namun peningkatan itu semakin tinggi sampai mencapai puncaknya pada jam ke-72 sebesar 0,23 mg/ml dimana pada jam tersebut keaktifan xilanase yang diamati telah mencapai nilai tertinggi pula yaitu sebesar 10,5 U/mg. Pada pengamatan jam ke-96 terlihat bahwa baik kadar protein maupun aktifitas enzim xilanase telah mengalami penurunan. Dapat diamati pula dari kurva produksi xilanase ini bahwa produksi enzim tertinggi justru terjadi pada akhir fase eksponensial. Pola pembentukan produk ini sesuai
0 0,05 0,1 0,15 0,2 0,25 0 2 4 6 8 10 12 0 6 12 18 24 30 36 42 48 72 96 kad ar pro tei n (mg/ml) Aktifitas enzim spesifi k (U/mg) jam ke Aktifitas Spesifik Kadar protein
32 dengan pola pertumbuhan biomassa dan kadar protein total. Fenomena ini semakin memperkuat dugaan bahwa xilanase merupakan produk metabolit primer yang berasosiasi dengan pertumbuhan sel. Hal ini disebabkan karena produk metabolit diantaranya xilanase digunakan untuk kelangsungan hidup sel dengan cara mendegradasi xilan sebagai sumber karbon.
Gambar 11. Grafik laju konsumsi substrat, pertumbuhan biomassa dan pembentukan produk.
Faktor-faktor dasar yang penting dalam produksi xilanase ini adalah pemilihan substrat penginduksi xilanase dan komposisi media yang optimal (Kulkarni et al. 1999). Xilosa merupakan induser yang efektif dan menjadi sumber karbon bagi produksi xilanase pada beberapa mikroorganisme seperti Aerobasidium pullulans, Fusarium oxysporum (Christakopoulos et al . 1999 diacu dalam Gupta et al. 2009) dan Thermomyces lanuginosus.
Pemilihan mikroorganisme sebagai penghasil xilanase juga perlu diperhatikan. Beberapa kajian mengenai produksi xilanase, menunjukkan bahwa kapang berfilamen merupakan pilihan yang lebih menarik karena kapang tersebut mengeluarkan enzim kedalam media (ekstraseluler) dan memproduksi xilanase dengan keaktifan yang jauh lebih tinggi dibandingkan dengan ragi (yeast) maupun bakteri. Kapang Trichoderma reesei dilaporkan mampu
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 0 6 12 18 24 30 36 42 48 72 96 kad ar gu la per e duk si (mg/ml) bio m as sa (g/l) jam ke
biomassa Aktifitas xilanase gula pereduksi (mg/ml)
ak ti fi tas xi lan a se ( U/ m l)
33 memproduksi xilanase sebesar 3350 IU/ml, sedangkan Schizophyllum commune menghasilkan 22700 IU/g xilanase dan Trichoderma hamatum dilaporkan memproduksi xilanase 7000 IU/g pada fermentasi media padat menggunakan jerami gandum sebagai substrat (Kulkarni et al. 1999).
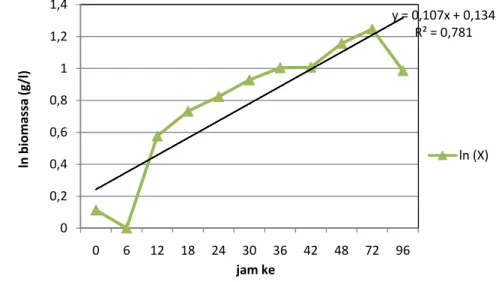
4.2.4. Kinetika Kultivasi Staphylococcus aureus MBXi-K4. Berdasarkan data pengamatan diatas, pertumbuhan sel S.aureus MBXi-K4 pada substrat xilan pollard dengan konsentrasi 0,7% diperoleh nilai Xmaks = 4,6 g/l. Data pertumbuhan sel ini dipetakan berdasarkan persamaan logistik dX/dt = µX . Penurunan persamaan dasar tersebut diperoleh dengan cara mengintegralkan persamaan itu sehingga diperoleh nilai ln (Xt/Xo) = µΔt. Hasil pemetaan data diperoleh persamaan linier ln (X) = 0,107x + 0,134. Kemiringan garis (slope) adalah nilai laju pertumbuhan spesifik biomassanya (µ) yaitu sebesar 0,107 (jam-1). Laju pertumbuhan spesifik (µ) besarnya tidak konstan tergantung kondisi lingkungan fisik dan kimia. Nilai maksimumnya dicapai pada saat fase eksponensial.
Gambar 12. Penentuan laju pertumbuhan biomassa spesifik (µ).
Laju pertumbuhan spesifik (µ) yang diperoleh (Gambar 12) lebih besar jika dibandingkan dengan hasil penelitian Richana (2006), yang menunjukkan laju pertumbuhan spesifik biomassa dari Bacillus pumillus RXAIII-5 untuk produksi xilanase sebesar 0,081 (jam-1) pada aerasi 1 vvm dan agitasi 200 rpm.
y = 0,107x + 0,134 R² = 0,781 0 0,2 0,4 0,6 0,8 1 1,2 1,4 0 6 12 18 24 30 36 42 48 72 96 ln bioma ssa (g/l) jam ke ln (X)
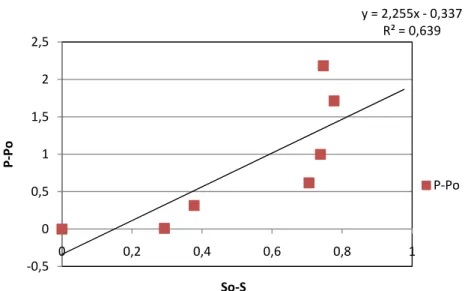
34 Rendemen produk (Yp/s) diperoleh dengan cara memetakan nilai - nilai (P-Po) yang merupakan data dari aktifitas enzim xilanase (U/ml) terhadap penggunaan substrat (So-S). Kemiringan garis yang diperoleh (slope) adalah nilai Yp/s-nya, yaitu sebesar 2,255 (U produk /mg substrat). Hal ini menunjukkan bahwa selama proses kultivasi berlangsung diperoleh nilai efisiensi penggunaan substrat dimana setiap miligram xilosa yang dikonsumsi akan dihasilkan 2,255 Unit xilanase. Kurva perhitungan rendemen produk ini dapat dilihat pada Gambar 13.
Rendemen xilanase yang dihasilkan dalam proses kultivasi dipengaruhi oleh berbagai macam kombinasi faktor. Faktor tersebut termasuk aksesibilitas substrat, laju dan banyaknya xilooligosakarida dan xilosa yang dilepaskan. Peran penting xilosa, xilobiosa, xilooligosakarida dan heterodisakarida dari xilosa dan glukosa adalah sebagai induser bagi regulasi biosintesa xilanase. Parameter bioproses lain yang mempengaruhi aktifitas dan produktifitas xilanase dalam proses kultivasi adalah pH, temperatur dan agitasi (Kulkarni et al. 1999).
Gambar 13. Perhitungan nilai rendemen produk (Yp/s)
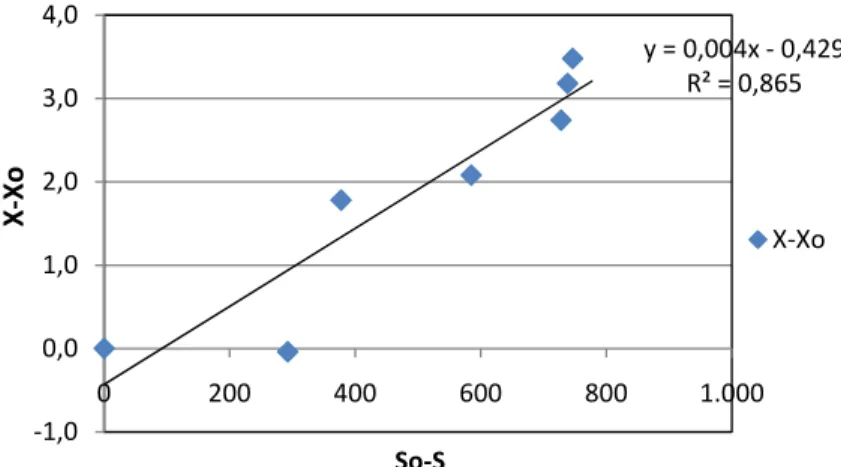
Rendemen biomassa diperoleh dengan cara memetakan nilai (X-Xo) terhadap penggunaan substrat (So-S). Kemiringan garis (slope) adalah nilai Yx/s, yaitu sebesar 0,004 (g biomassa / g substrat) dengan kata lain efisiensi substrat untuk pembentukan sel adalah sebesar 0,004 atau dapat dikatakan dalam
y = 2,255x ‐ 0,337 R² = 0,639 ‐0,5 0 0,5 1 1,5 2 2,5 0 0,2 0,4 0,6 0,8 1 P ‐Po So‐S P‐Po
35 setiap gram substrat yang dikonsumsi akan diperoleh 4 mg biomassa. Hasil pemetaan tersebut dapat dilihat pada Gambar 14.
Gambar 14. Perhitungan nilai rendemen biomassa (Yx/s)
Kajian kinetika fermentasi ini penting dilakukan untuk dapat mempelajari kondisi fermentasi yang terbaik. Untuk dapat memproduksi xilanase dalam skala yang lebih besar diperlukan optimasi proses produksi berdasarkan nilai-nilai kinetika proses yang diperoleh dalam penelitian awal ini agar dapat menentukan kelayakan secara teknik dan ekonomi.
Pendekatan model logistik dan Luedecking-Piret ini merupakan model yang telah digunakan oleh Muthuvelayudham dan Viruthagiri (2007) dalam proses fermentasi selulosa untuk menghasilkan enzim selulase.
4.3. Karakteristik Enzim Xilanase
4.3.1 Pengaruh Suhu. Karakteristik xilanase yang diamati adalah ketahanan enzim terhadap suhu dan terhadap pH. Hal ini penting dilakukan mengingat laju reaksi katalisis enzim sangat dipengaruhi baik oleh suhu maupun pH. Respon enzim xilanase terhadap suhu dan aktifitas relatifnya dapat dilihat pada Gambar 15 dan 16 dibawah ini.
Pada suhu 70oC, aktifitas awal enzim adalah sebesar 1,7 U/ml . Keaktifan relatif xilanase menurun pada menit ke-15 yaitu menjadi sebesar 1,1 U/ml yang berarti aktifitasnya tersisa sebesar 66,2% dari aktifitas awal. Keaktifan relatif xilanase sedikit mengalami peningkatan pada menit ke -30, yaitu sebesar 71,5%
y = 0,004x ‐ 0,429 R² = 0,865 ‐1,0 0,0 1,0 2,0 3,0 4,0 0 200 400 600 800 1.000 X ‐Xo So‐S X‐Xo
36 dan kembali menurun pada menit ke-45 namun secara keseluruhan masih dapat mempertahankan keaktifannya sampai menit ke 120 sebesar 0,3 U/ml, dengan keaktifan relatif sebesar 17,9%. Pada suhu 80oC , aktifitas enzim xilanase sebesar 0,86 U/ml. Keaktifan xilanase ini sedikit menurun pada menit ke-15 menjadi 92,5% dari aktifitas awalnya. Penurunan ini jauh lebih kecil daripada penurunan keaktifan enzim pada suhu 70oC, meskipun jika dilihat dari nilai aktifitas enzimnya justru lebih rendah. Pada menit ke-30 aktifitas xilanase tersisa menjadi sebesar 0.689 U/ml atau jika dinyatakan dalam keaktifan relatifnya sebesar 79,7% dari keaktifan awal.
Gambar 15. Kurva ketahanan xilanase terhadap suhu
Xilanase tahan pada suhu 90oC selama 15 menit dengan aktifitas awal sebesar 0,57 U/ml. Nilai aktifitasnya menurun tajam sejak menit ke-15 yaitu menjadi sebesar 0.233 U/ml atau sebesar 41% dari keaktifan awal. Karakter xilanase yang tahan terhadap suhu 70oC – 80oC selama 30 menit ini memiliki peluang untuk dapat diaplikasikan dalam pembuatan pakan jadi dalam bentuk pellet. Proses pelleting merupakan proses pengolahan pakan dengan penambahan panas melalui uap panas (steam) berkisar selama 20 – 255 detik tergantung dari jumlah bahan pakan yang diolah. Penambahan uap panas ini akan meningkatkan temperatur bahan pakan sekitar 5% dengan temperatur akhir 70oC – 90oC (Moran, 1989). Diperkirakan xilanase yang dihasilkan masih dapat
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 2 0' 15' 30' 45' 60' 90' 120' ak ti fit as enzim (U/ml) waktu (menit)
37 mempertahankan aktifitasnya mengingat perlakuan panas ini berlangsung cukup singkat.
Pada Gambar 16 terlihat bahwa enzim pada suhu 80oC menunjukkan tingkat penurunan keaktifan yang lebih kecil jika dibandingkan pada suhu 70oC dan 90oC, meskipun dari aktifitas enzimnya lebih rendah daripada aktifitas pada suhu 70oC. Hal ini diduga karena pada ekstrak kasar enzim ini tidak hanya terdapat satu jenis xilanase saja. Hasil zimogram menunjukkan adanya tiga zona bening pada gel dengan bobot molekul yang berbeda. Perbedaan jenis xilanase yang dihasilkan dapat memberikan karakter yang berbeda pula. Pada suhu 80oC diduga terdapat xilanase dengan aktifitas yang lebih kecil namun memiliki konformasi dan susunan asam amino yang lebih tahan terhadap suhu tinggi. Berbagai penelitian menunjukkan bahwa berbagai mikroorganisme dapat menghasilkan lebih dari satu jenis xilanase. Roy et al. (2000) melaporkan bahwa Aeromonas caviae W-61 menghasilkan 5 jenis xilanase ekstraseluler, yaitu xilanase 1,2,3,4 dan 5. Masing-masing memiliki bobot molekul 22 kDa, 41kDa, 58 kDa, 120 kDa dan 140 kDa dengan aktifitas spesifik enzim berturut-turut 23, 0,21, 1,7, 65 dan 25 U/mg protein. Streptomyces sp. S38 menghasilkan 3 xilanase dengan bobot molekul masing-masing sebesar 24,5 kDa, 37,5 kDa dan 38 kDa dengan pI 9,8, 5,2 dan 4,7 (Georis et al. 2000). Subramaniyan dan Prema (2002) dalam ulasannya tentang bioteknologi mikrobial xilanase mengatakan bahwa Phanerochaete chrysosporium yang ditumbuhkan pada substrat avicel mampu menghasilkan 30 jenis xilanase yang berbeda. Hal tersebut dapat dilihat dari pita-pita protein yang dapat dipisahkan dengan analisis elektrofokus.
38 Gambar 16. Keaktifan relatif enzim terhadap suhu pada berbagai waktu
inkubasi.
Enzim xilanase memiliki aktifitas maksimum pada suhu tertentu. Xilanase yang dihasilkan S.aureus MBXi-K4 adalah enzim yang cukup tahan panas dengan suhu optimum 70oC. Setelah mencapai aktifitas maksimum pada suhu optimumnya, aktifitas enzim akan kembali menurun seiring dengan meningkatnya suhu.
Fenomena tersebut menunjukkan bahwa suhu sangat mempengaruhi laju reaksi katalisis enzim. Kenaikan suhu akan meningkatkan laju reaksi enzim sampai mencapai suhu optimumnya. Terjadinya peningkatan kecepatan reaksi enzim tersebut karena bertambahnya energi kinetik yang mempercepat gerak vibrasi, translasi dan rotasi enzim dan substrat, sehingga memperbesar peluang keduanya untuk bereaksi (Suhartono 1989). Peningkatan suhu diatas suhu optimum akan menyebabkan peningkatan energi termal molekul yang membentuk struktur protein enzim, sehingga akan menyebabkan rusaknya interaksi non kovalen (ikatan hidrogen, ikatan van der waals, dan interaksi elektrostatik) yang menjaga struktur tiga dimensi enzim secara bersama-sama. Hal ini akan menyebabkan enzim mengalami denaturasi. Denaturasi menyebabkan struktur lipatan enzim membuka pada bagian permukaannya sehingga sisi aktif enzim berubah dan sebagai akibatnya akan terjadi penurunan aktifitas enzim (Hames dan Hoper 2000). Pada suhu tinggi substrat juga dapat mengalami perubahan konformasi sehingga gugus reaktifnya tidak dapat lagi atau mengalami hambatan dalam memasuki sisi aktif enzim (Suhartono 1989).
0 20 40 60 80 100 120 0' 15' 30' 45' 60' 90' 120' % relatif kea kti fa n xilan ase waktu (menit)
39 Enzim xilanase dari Bacillus thermoleovorans K-3d dan Bacillus flavothermus LB3A dilaporkan tetap stabil setelah diinkubasi pada suhu 70oC selama 2 jam. Pada suhu 80oC xilanase dari isolat K-3d dan LB3A menunjukkan waktu paruh 18 dan 10 menit (Sunna et al. 1997). Xilanase yang diperoleh dari pengklonan gen XynB dari Thermotoga maritima MSB8 pada vektor E. coli dan Pichia pastoris mempunyai temperatur optimum pada 90oC dan setelah inkubasi pada suhu 100oC selama 30 menit masih mempertahankan 70% dari keaktifan enzimnya (Yang et al. 2005). Penelitian Damaso et al . (2002) terhadap xilanase yang dihasilkan oleh Thermomyces lanuginosus IOC-4145 menunjukkan bahwa enzim tersebut stabil pada suhu 50ºC dengan waktu paruh 24 jam. Pada suhu 60ºC enzim dapat mempertahankan aktifitasnya sebesar 50% dari aktifitas awal, setelah 4 jam inkubasi. Pada saat suhu ditingkatkan menjadi 70ºC, lebih dari 80% aktifitas xilanasenya hilang setelah diinkubasi selama 1 jam.
4.3.2 Pengaruh pH. Semua reaksi enzimatis sangat dipengaruhi oleh pH, sehingga diperlukan bufer dengan pH tepat supaya reaksi dapat berjalan secara optimum. Xilanase yang merupakan enzim dan tentu saja mengikuti sifat-sifat protein pada umumnya, dimana protein mempunyai konstanta disosiasi pada gugus asam maupun basa terutama pada gugus residu terminal karboksil dan terminal aminonya. Diperkirakan terjadinya perubahan keaktifan enzim xilanase akibat adanya perubahan ionisasi pada gugus ionik enzim baik pada sisi aktifnya maupun sisi lain yang secara tidak langsung mempengaruhi sisi aktif. Gugus ionik berperan dalam menjaga konformasi sisi aktif dalam mengikat substrat.
Gugus fungsionil pada sisi aktif yang dapat terionisasi memegang peranan kunci pada suatu reaksi katalisa enzim. Reaksi pengikatan dan pelepasan ion hidrogen pada gugus fungsionil tersebut, dapat dianggap sebagai reaksi antara enzim dengan suatu ligan secara umum (logam, asam atau molekul lain) (Suhartono, 1989). Ketahanan enzim terhadap pH dan keaktifan relatifnya dapat dilihat pada Gambar 17 dan 18.
40 Gambar 17. Ketahanan enzim xilanase terhadap pH
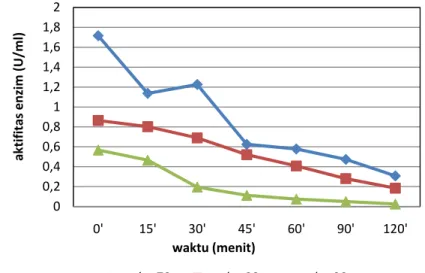
Pada grafik tersebut terlihat bahwa enzim xilanase yang diuji tahan pada kisaran pH 4 – 8, dengan aktifitas enzim tertinggi pada pH 6. Pengujian ketahanan enzim xilanase pada pH 6 menunjukkan bahwa aktifitas enzim mencapai 5,8 U/ml pada inkubasi selama 15 menit. Enzim masih dapat mempertahankan keaktifan relatifnya sebesar lebih dari 90% selama 15 menit awal kemudian menurun menjadi 44% pada menit ke-30 dan semakin menurun seiring meningkatnya waktu inkubasi hingga tersisa 13% pada menit ke-120.
Gambar 18. Persentase keaktifan relatif xilanase terhadap pH 0 1 2 3 4 5 6 7 0' 15' 30' 45' 60' 90' 120' ak ti fit as xilan ase (U/ml) waktu (menit) pH 4 pH 6 pH 8 pH 7.5 0 20 40 60 80 100 120 0' 15' 30' 45' 60' 90' 120' ak ti fi ta s re latif xi lan as e (% ) waktu (menit) pH 4 pH 6 pH 8 pH 7.5
41 Pada pH 4 aktifitas awal xilanase sebesar 3,3 U/ml dan keaktifan relatifnya sangat menurun sejak 15 menit awal inkubasi menjadi sebesar 0,66 U/ml atau sebesar 20% dari aktifitas awal. Pada pH 7,5 aktifitas awal xilanase adalah 1,22 U/ml. Xilanase masih dapat mempertahankan keaktifan relatif pada menit ke-45 sebesar 51% dan semakin menurun pada menit ke-120 menjadi 0,31 U/ml atau sebesar 25% dari aktifitas awal. Pada pH 8 aktifitas awal xilanase adalah 2,1 U/ml. Keaktifan xilanase menurun pada menit ke-30 yaitu menjadi 1,23 U/ml atau sebesar 58% dari aktifitas awalnya dan pada akhir pengamatan diperoleh keaktifan relatif tersisa sebesar 18%. Berdasarkan data tersebut diatas terlihat bahwa xilanase yang dihasilkan lebih stabil pada pH 7,5 dibandingkan pada pH 6 meskipun aktifitasnya jauh lebih kecil.
Menurunnya aktifitas enzim karena perubahan pH larutan disebabkan oleh berubahnya keadaan ion enzim dan seringkali juga ion substrat. Perubahan ini dapat terjadi pada residu asam amino yang berfungsi katalitik pengikat substrat maupun pada residu asam amino yang berfungsi untuk mempertahankan struktur tersier dan kuartener enzim yang aktif. Aktifitas enzim yang mengalami penurunan itu dapat dipulihkan kembali dengan merubah kondisi reaksi enzimatis pada pH optimumnya. Pada pH tertentu perubahan muatan ion pada rantai samping yang yang dapat terionisasi dari residu asam amino enzim menjadi terlalu besar sehingga mengakibatkan denaturasi enzim yang disertai dengan hilangnya aktifitas katalitik enzim. Perubahan struktur tersier dapat menyebabkan kelompok hidrofobik kontak langsung dengan air sehingga solubilitas enzim berkurang. Berkurangnya solubilitas ini mengakibatkan turunnya aktifitas enzim secara bertahap (Meryandini et al. 2008; Palmer 1981).
Protein dalam kondisi terlarut cenderung mudah berinteraksi dengan pelarutnya, sehingga bila terjadi perubahan pH larutan diatas atau dibawah pH optimumnya, maka akan langsung bersentuhan dengan sisi aktifnya. Akibatnya akan terjadi penurunan aktifitas enzim dengan cepat (Scopes 1987).
Nilai pH optimum enzim xilanase dari Bacillus sp strain K-1 adalah 5,5 dan aktifitasnya masih stabil pada pH 5,0 – 9,0. Pada pH 12 xilanase ini masih mempunyai keaktifan relatif tersisa 88% (Ratanakhanokchai et al. 1999). Xilanase yang dihasilkan oleh Bacillus stearothermophillus T-6 mempunyai
42 keaktifan tinggi pada rentang pH 5 – 11 dengan pH optimum 65 dan 7,0 dan masih mempertahankan keaktifannya sebesar 60% pada pH 10. Pada pH 9 dan suhu 65oC waktu paruh (half-life time) enzim sekitar 6 jam (Khasin et al. 1993). Xilanase dari Staphylococcus sp SG-13 mempunyai pH optimum 7,5 dan 9,2 (Gupta et al. 2000). Penelitian Wu et al . (2006) menunjukkan bahwa Geobacillus sp.MT-1 menghasilkan xilanase dengan karakteristik aktif pada rentang pH 5,5 – 10 dengan pH optimal 7 dan suhu optimumnya 70oC.
Aktifitas dan stabilitas xilanase sangat dipengaruhi selain oleh pH juga jenis bufernya. Penelitian Widhyastuti (2007) menunjukkan bahwa aktifitas xilanase dari Streptomyces sp. SKK1-8 pada pH 6,0 dalam bufer asetat lebih tinggi dibandingkan pada bufer fosfat, sedangkan pada pH 7,0 aktifitas dalam bufer fosfat dua kali lipat lebih tinggi jika dibandingkan dalam bufer tris-HCl. Data lain menunjukkan bahwa aktifitas xilanase dari Cellulomonas flavigena pada pH 6,5 dalam bufer sitrat-fosfat lebih tinggi 45% dibandingkan dalam bufer tris-HCl (Martinez-Trujilo et al. 2003). Aktifitas xilanase dari Fibrobacter succinogenes S85 dalam bufer format lebih tinggi daripada dalam bufer asetat, dan dalam bufer asetat juga lebih tinggi daripada bufer MES,MOPS dan tris-HCl (Marrone et al. 2000).
Perbedaan aktifitas dalam jenis bufer yang berbeda dikarenakan perbedaan pK bufer, jenis dan jumlah muatan ion komponen bufer. Setiap jenis bufer memiliki rentang pH tertentu dan kapasitas bufernya dipengaruhi oleh pKnya. Bufer bekerja dengan baik pada daerah pH yang dekat dengan pKnya, semakin jauh dari pK maka kapasitas bufernya semakin menurun. Muatan ion berpengaruh pada konstanta dielektrik larutan dan jumlah ion berpengaruh terhadap besarnya kekuatan ion larutan. Konstanta dielektrik dan kekuatan ion berpengaruh terhadap kecepatan reaksi enzimatis (Suhartono 1989).
4.3.3 Parameter Kinetika Reaksi Enzimatis. Pengamatan kinetika enzimatis dilakukan melalui pengukuran nilai Km dan Vmaks. Perhitungan kinetika reaksi enzimatis dilakukan dengan mengukur konsentrasi xilosa sebagai hasil hidrolisis substrat oatspelt xilan pada berbagai konsentrasi. Perhitungan nilai Km dan Vmaks dilakukan pada konsentrasi substrat dari 0,05% – 0,2%. Untuk
43 menghitung parameter Km dan Vmaks ini digunakan transformasi linier dari persamaan Michaelis-Menten, yaitu dengan membuat grafik Lineweaver-Burk dengan memetakan nilai 1/V dan 1/S. Penentuan nilai Vmaks dan Km dilakukan melalui double reciprocal dari persamaan Michaelis-Menten.
V = Vmaks S S + Km
bila diambil kebalikannya, maka rumus tersebut menjadi 1 = 1 + Km 1
S Vmaks Vmaks S
sehingga rumus diatas dapat ditulis dengan persamaan regresi Y = a + bx, dimana a = 1/Vmaks dan b = Km/Vmaks.
Data hasil hidrolisis substrat oat spelt xylan pada konsentrasi 0,5% - 2% dipetakan terhadap waktu dan dapat dilihat pada Gambar 19 sedangkan nilai Km dan Vmaks yang diperoleh disajikan pada Gambar 20.
Gambar 19. Kurva hidrolisis xilan pada berbagai konsentrasi substrat (oat spelt xylan). y = 0,310x + 1,422 R² = 0,987 y = 0,341x + 1,864 R² = 0,982 y = 0,465x + 2,345 R² = 0,987 y = 0,135x + 0,983 R² = 0,986 0,0 1,0 2,0 3,0 4,0 5,0 6,0 0' 5' 10' 15' 20' 25' kad ar xi losa (µmol/menit) waktu (menit) 1% 1,5% 2% 0,5%
44 Tabel 6. Nilai 1/[S] dan 1/[V] dari berbagai konsentrasi substrat
konsentrasi
substrat [S] 1/S kecepatan reaksi (V ) 1/v
0,50% 200 0,135 7,40 1% 100 0,31 3,22 1,50% 66,67 0,341 2,93
2% 50 0,465 2,15
Nilai- nilai 1/[S] yang diperoleh dari kurva hidrolisis xilan dari beberapa konsentrasi substrat dipetakan terhadap nilai-nilai 1/[V] seperti yang tertera pada Tabel 6 diatas diperoleh persamaan regresi y = 0.034x + 0.313. Berdasarkan persamaan regresi tersebut diperoleh nilai 1/Vmaks = 0.313 dan nilai Km/Vmaks = 0.034. Nilai Vmaks dari persamaan tersebut = 3,195 (µmol xilosa/menit.ml) dan nilai Km = 1,086 (mg/ml). Dapat dikatakan bahwa pada kecepatan reaksi maksimalnya xilanase dari S. aureus MBXi-K4 ini dapat menghasilkan xilosa sebesar 3,195 µmol/ menit. ml.
Gambar 20. Kurva double reciprocal Lineweaver-Burk.
Nilai Km (konstanta Michaelis-Menten) merupakan nilai konstanta yang tidak terpengaruh oleh konsentrasi enzim, sedangkan nilai Vmaks besarnya dipengaruhi oleh konsentrasi enzim. Semakin kecil nilai Km maka semakin tinggi aktifitas enzim dan afinitas enzim terhadap substrat semakin besar. Nilai Vmaks diartikan sebagai kecepatan reaksi saat enzim telah jenuh oleh substrat (Suhartono, 1989). y = 0,034x + 0,313 R² = 0,973 ‐2 0 2 4 6 8 10 12 ‐50 0 50 100 150 200 250 300 1/V 1/S
45 Nilai Km dan Vmaks xilanase dari Staphylococcus sp SG-13 pada substrat oat spelt xilan adalah 7 mg/ml dan 55 µmol xilosa/menit/mg (Gupta et al. 2000). Xilanase yang dihasilkan dari bakteri rekombinan Geobacillus sp.MT-1 mempunyai nilai Km sp.MT-1,579 mg/ml dan Vmaks sebesar 289 µmol/menit.mg (Wu et al. 2006).
4.4. Pemurnian Enzim Xilanase
4.4.1 Pengendapan Xilanase Menggunakan Amonium Sulfat. Teknik pengendapan enzim dan protein dilakukan dengan menggunakan beberapa senyawa yang bersifat mengikat air, antara lain amonium sulfat, pelarut organik, maupun polimer non ionik seperti polietilen glikol (PEG). Teknik pengendapan menggunakan amonium sulfat ini dipilih selain mudah dilakukan, juga cukup murah serta mendapatkan hasil pengendapan yang cukup baik. Penambahan amonium sulfat kedalam larutan protein akan menyebabkan pengikatan molekul air oleh molekul amonium sulfat, sehingga interaksi protein-protein menjadi lebih dominan daripada interaksi protein-air. Hal ini akan menyebabkan agregasi protein sehingga akan mengendapkan protein. Suhu lingkungan yang dijaga supaya tetap rendah (sekitar 4oC) tidak akan menyebabkan protein yang mengendap terdenaturasi, tetapi masih dapat dilarutkan kembali dalam bufernya.
Pengendapan ekstrak kasar enzim xilanase dari S.aureus MBXi-K4 dengan menggunakan amonium sulfat telah dilakukan pada konsentrasi amonium sulfat 40% - 60%. Semakin banyak kandungan asam amino yang bersifat hidrofilik pada molekul enzim atau protein, maka semakin tinggi konsentrasi amonium sulfat yang diperlukan untuk dapat mengendapkannya. Pengendapan enzim xilanase dengan menggunakan amonium sulfat dalam penelitian ini, dilakukan pada konsentrasi 40 % dan diperoleh nilai aktifitas enzim sebesar 1,8 U/ml. Hasil pengendapan enzim dengan menggunakan amonium sulfat diperlihatkan pada Gambar 21 di bawah ini.
46 Gambar 21. Aktifitas xilanase yang diendapkan dengan amonium sulfat
pada konsentrasi 40% - 60%.
4.4.2. Dialisis. Untuk dapat melanjutkan proses pemurnian enzim xilanase pada tahap berikutnya, dilakukan pencucian senyawa amonium sulfat yang terikat pada molekul enzim dengan cara dialisis. Dialisis merupakan proses difusi selektif yang melewati membran selofan. Proses ini bertujuan untuk menghilangkan garam amonium sulfat dan zat-zat terlarut yang lain. Selama dialisis air masuk ke dalam kantung dialisis akibat tekanan osmosis. Proses dialisis dilakukan pada suhu dingin untuk mencegah kerusakan protein yang dimurnikan. Molekul-molekul yang berukuran lebih kecil dari 12 kDa akan keluar dari kantung dialisis.
Larutan protein setelah melalui proses pengendapan oleh amonium sulfat kemudian disentrifugasi pada putaran 4550 x g selama 15 menit, endapan yang diperoleh didialisis menggunakan membran dengan ukuran Molecular Weight Cut-Off (MWCO) 12kDa dalam 0,05 M bufer Tris-HCl pH 7.5 dengan volume 100 kali volume enzim yang dipekatkan. Aktifitas enzim xilanase hasil dialisis sebesar 1,76 U/ml. Penurunan aktifitas xilanase setelah dialisis diduga akibat terjadinya elusi sebagian protein - protein berukuran kecil yang dapat berperan dalam keaktifan enzim xilanase. Hal ini dapat terjadi karena pada beberapa mikroorganisme penghasil xilanase dilaporkan memiliki xilanosome yang merupakan komplek multienzim dan multifungsi yang terdapat pada permukaan sel dan memegang peranan penting dalam hidrolisis hemiselulosa (Sunna dan Antranikian 1997 diacu dalam Beg et al. 2001).
40% 50% 60% Aktifitas enzim (U/ml) 1,101 0,161 0,058 0 0,2 0,4 0,6 0,8 1 1,2 ak tifi ta s enzim (U/ml)
47 4.4.3 Pemurnian Xilanase dengan Kromatografi Gel. Prinsip pemurnian dengan filtrasi gel adalah pemisahan berdasarkan ukuran partikelnya, dimana sampel yang berupa campuran molekul dilewatkan pada kolom berisi gel berpori. Filtrasi gel ini digunakan untuk memisahkan protein yang mempunyai berat molekul tinggi dari protein atau molekul lain dengan berat molekul rendah, jadi bekerja sebagai suatu penyaring molekul. Hal ini menyebabkan molekul dengan ukuran besar akan terelusi lebih dulu diikuti molekul dengan ukuran lebih kecil (Suhartono 1989). Hasil pemurnian xilanase menggunakan matrik Sephadex G-100 memperlihatkan adanya tiga puncak protein dan yang paling tinggi adalah pada fraksi no 4 – 10. Puncak lain yang lebih kecil adalah pada fraksi nomer 54-55, dan fraksi nomer 68-69 (Gambar 22).
Gambar 22. Profil elusi filtrasi gel dengan matrik Sephadex G-100 dari enzim xilanase.
Aktifitas xilanase tertinggi diperoleh dari fraksi nomer 6 yaitu sebesar 1,56 U/ml dengan aktifitas spesifik sebesar 383,9 U/mg. Profil elusi filtrasi gel ini memperlihatkan grafik kadar protein dan aktifitas enzim mempunyai kecenderungan yang sama. Eluen dengan kadar protein yang tinggi mempunyai keaktifan enzim yang tinggi pula. Hal itu menunjukkan bahwa protein yang diperoleh sebagian besar merupakan enzim target yang diinginkan. Hal tersebut diperkuat dengan hasil elektroforesis SDS PAGE dan zimogram.
1 2 3 0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4 1 5 9 13 17 21 25 29 33 37 41 45 49 53 57 61 65 69 73 77 81 85 89 93 ak ti fit as enzim (U/ml) ab so rb ans i 280 nm nomor fraksi absorbansi aktifitas enzim (U/ml)
48 Keseluruhan tahapan proses pemurnian yang dilakukan dirangkum dalam tabel pemurnian seperti yang terlihat pada Tabel 7 dibawah ini. Hasil tersebut dapat menunjukkan tingkat kemurnian enzim xilanase yang diperoleh dibandingkan dengan ekstrak kasar xilanase. Berdasarkan hasil yang diperoleh dapat dilihat bahwa teknik kromatografi gel telah meningkatkan kemurnian xilanase sebesar 11,69 kali pada fraksi nomer 6 dengan nilai aktifitas spesifik sebesar 383,9 U/mg protein.
Tabel 7. Ringkasan hasil pemurnian xilanase dari S. aureus MBXi-K4. Tahap pemurnian Vol (ml) Akti- fitas (U/ml) Total Protein (mg) Total aktifitas (U) Aktifitas Spesifik (U/mg) Yield (%) Tingkat Kemur-nian Ekstrak kasar 81 1.34 3,32 109,01 32,82 100 1 Pengendapan dengan amonium sulfat (40%) 10 1,80 0,48 18,06 37,39 16,57 1,14 Dialisis 5 1,76 0,27 8,81 32,59 8,08 0,87 Kromatografi filtrasi gel Fraksi no.5 Fraksi no.6 3 3 1,25 1,56 0,014 0,012 3,75 4,69 258.17 383.90 3,44 4,31 7.86 11.69
Pemurnian xilanase pada penelitian ini hanya menggunakan satu tahap kromatografi kolom yaitu gel filtrasi. Proses ini lebih singkat dengan tingkat kemurnian yang tidak jauh berbeda jika dibandingkan dengan xilanase dari Staphylococcus sp SG13 yang dimurnikan dalam dua tahap kolom kromatografi dengan hasil tingkat kemurnian 12 kali dari ekstrak kasarnya, namun nilai aktifitas spesifik enzim jauh lebih rendah yaitu 2,74 U/mg (Gupta et al. 2000). Tingkat kemurnian xilanase yang diperoleh lebih tinggi dibandingkan dengan kemurnian β-xilanase II dari Aspergillus fumigatus Fresenius (Silva et al. 1999), Aspergillus tereus UL 4209 (Chidi et al. 2008) dan Thermomyces lanuginosus SSBP (Lin et al. 1999) yaitu berturut-turut sebesar 0,74, 1,2 dan 4,6 kali dari ekstrak kasar dan aktifitas spesifik berturut turut sebesar 4,67 U/mg, 12 U/mg dan 3209 U/mg. Hasil ini lebih rendah jika dibandingkan dengan pemurnian
49 xilanase dari Streptomyces sp (Meryandini et al. 2008), Bacillus pumillus PS 213 (Degrassi et al. 1998), Cellulomonas flavigena (Martinez-Trujillo et al. 2003) dengan peningkatan berturut-turut sebesar 12,97 , 179,2 dan 30,6 kali.
4.5. Hasil SDS PAGE dan Zimogram
Hasil dari tiap tahapan pemurnian dilihat profil SDS-PAGE dan zimogramnya agar dapat memperkirakan bobot molekul dan melihat tingkat kemurnian enzim. Hasil visualisasi enzim xilanase pada SDS-PAGE dengan pewarnaan Coomasie Brilliant Blue menunjukkan adanya pita tunggal pada sumur nomer 2, 3 dan 4 yaitu hasil pemurnian dengan Sephadex G-100 fraksi nomer 4 – 6, dengan perkiraan ukuran bobot molekul 47,9 kDa. Hal ini menunjukkan bahwa enzim xilanase telah dapat dimurnikan (dipisahkan) secara efektif dengan teknik kromatografi filtrasi gel. Ukuran bobot molekul ini diperkirakan dengan pembanding penanda LMW (Low Molecular Weight) dari Pharmacia yang terdiri atas fosforilase (97 kDa), albumin (66 kDa), ovalbumin (45 kDa), karbonik anhidrase (30 kDa), tripsin inhibitor (20,1 kDa) dan lisozim (14,4 kDa).
Pada profil zimogram dapat dilihat adanya tiga pita zona bening pada sumur no 2-6, masing-masing adalah ekstrak kasar xilanase, pengendapan dengan amonium sulfat dan hasil dialisis, dengan perkiraan ukuran bobot molekul 45,6 kDa, 28,1 kDa dan 21,6 kDa. Pada sumur nomer 7 dan 8 yang merupakan hasil pemurnian dengan Sephadex G-100 diperoleh satu pita zona bening dengan aktifitas xilanase yang cukup tinggi pada molekul yang berukuran sekitar 21,63 kDa. Penanda yang digunakan adalah LMW Fermentas yang terdiri atas ß-galaktosidase (116 kDa), BSA (66,2 kDa), ovalbumin (45 kDa), laktat dehidrogenase (35 kDa), RE-ase Bsp981 (25 kDa), ß-laktoglobulin (18,4 kDa) dan lisozim (14,4 kDa). Profil SDS-PAGE dan zimogram disajikan pada Gambar 23 dan 24 dibawah ini.
Kemampuan satu jenis mikroba dalam menghasilkan lebih dari satu jenis xilanase telah banyak dilaporkan. Hal tersebut dikarenakan kompleksitas struktur molekul xilan yang terdapat di alam sehingga diperlukan kerja dari
50 beberapa jenis xilanase secara sinergis untuk mendegradasi secara lengkap substrat yang mengandung xilan menjadi komponen gulanya (Beg et al. 2001).
1 2 3 4 5 6 7 8
Gambar 23. Hasil SDS-PAGE, 1 : penanda LMW Pharmacia, 2: hasil filtrasi gel fraksi no 6; 3: fraksi no 5; 4: fraksi no 4; 5: hasil diálisis; 6: hasil pengendapan dengan amonium sulfat1; 7: hasil pengendapan dengan amonium sulfat2; 8: enzim ekstrak kasar.
1 2 3 4 5 6 7 8
Gambar 24. Profil zimogram hasil pemurnian xilanase. Sumur 1: penanda LMW Fermentas, 2: ekstrak kasar xilanase, 3: hasil pengendapan dengan amonium sulfat, 4:ekstrak kasar xilanase, 5: hasil pengendapan dengan amonium sulfat, 6: hasil diálisis, 7: hasil gel filtrasi (fraksi 4 – 6), 8: fraksi no 6.
45,6 kDa 28,1 kDa 21,6 kDa 45 kDa 35 kDa 25 kDa 47,9 kDa 66 kDa 45 kDa
51 Ukuran bobot molekul xilanase murni pada profil SDS-PAGE lebih besar daripada yang terlihat pada zimogram. Struktur tiga dimensi xilanase merupakan multi subunit enzim yang membentuk tiga lipatan menyerupai genggaman tangan kanan (Tőrrőnen et al. 1994 diacu dalam Georis et al. 2001) dan tampaknya telah terjadi proses pemutusan subunit pada molekul enzim atau terlepasnya kofaktor selama proses pemurnian yang disebabkan adanya interaksi antara protein dengan polisakarida pada matrik gel (Lin et al. 1999)..
Kemungkinan lain adalah pada profil SDS-PAGE pita protein enzim xilanase dengan bobot molekul kecil tidak muncul. Hal ini diduga karena konsentrasi protein pada hasil elusi filtrasi gel terlalu rendah, namun memiliki keaktifan yang tinggi sehingga tidak muncul pada gel elektoforesis, akan tetapi mampu membentuk zona bening pada profil zimogram.
Komponen penyusun xilan pada Birchwood xilan adalah 94,1% xilosa, 1,4% glukosa dan 4,5% galaktosa, sedangkan oat spelt xilan mengandung 52,5% xilosa, 22,3% arabinosa, 15,7% glukosa dan 9,5% galaktosa (Li et al. 2000). Hal ini dapat menyebabkan bakteri mampu memproduksi lebih dari satu jenis xilanase jika ditumbuhkan pada media yang mengandung oat spelt xilan. Streptomyces sp.B-12-2 memproduksi lima jenis endoxilanase ketika ditumbuhkan pada media oatspelt xilan, sedangkan Aspergillus niger dapat memproduksi 15 jenis xilanase. Modifikasi pasca translasi seperti glikosilasi, proteolisis atau bahkan keduanya dapat pula mengakibatkan pembentukan beberapa jenis xilanase pada satu jenis mikroorganisme (Subramaniyan dan Prema 2002).
Sebagian xilanase dari Streptomyces viridosporus T7A yang hilang pada proses pemurnian dengan menggunakan kromatografi filtrasi gel dengan matrik Sephadex G-75 menurut Magnuson dan Crawford (1997) disebabkan oleh adanya interaksi xilanase dengan tulang punggung polisakarida pada matrik Sephadex. Hal tersebut tidak dapat dihindari meskipun dilakukan penambahan 0,5 M NaCl pada buffer elusi. Kemungkinan interaksi antara xilanase dengan tulang punggung polisakarida matrik filtrasi gel ini juga dinyatakan oleh Subramaniyan dan Prema (2002) karena xilanase memiliki carbohydrate binding domains (CBD). Xilanase dari Thermomonospora fusca, Cellulomonas fimi, dan
52 Streptomyces thermoviolaceus memiliki baik CBD maupun XBD (Xylan Binding Domains) dan memiliki afinitas baik terhadap selulosa maupun xilan. Fungsi dari domain tersebut adalah untuk mengikat substrat selulosa maupun xilan yang akan dihidrolisis (Ratanakhanokchai et al. 1999).
Perbandingan karakteristik xilanase dari S.aureus MBXiK-4 terhadap xilanase yang diproduksi oleh bakteri lain disajikan pada Tabel 8.
Tabel 8. Karakteristik beberapa xilanase yang dihasilkan oleh berbagai jenis bakteri Mikro-organisme Pemurnian enzim Sumber karbon (%b/v) pH opt Suhu Opt (oC) Bobot Mol (kDa) Km mg/ml Vmaks µmol/ min. mg Referensi Tingkat kemur-nian Akt. enzim spec U/mg Fusarium oxysporum f.sp.ciceris - - 1% Birchwood xilan 5,5 55 21,6 2,24 72 Jorge et al. 2005 Bacillus pumillus PS213 179, 2 118,8 0,5% tongkol jagung 8 55 190 1,54 360 Degrassi et al. 1998 Aureo-basidium pullulans (NRRL Y-12974) 215 8,58 1% oatspelt xilan 4 – 4,5 75 210 0,26 6,99 Saha dan Bothast 1998 Penicillium capsulatum 17,9 761,1 2% birchwood xilan 3,8 48 22 25,13 204,5 7 Ryan et al. 2003 T.lanu- ginosus SSBP 4,6 3209 1% birchwood xilan 6,5 60 20 - 30 3,26 6300 Lin 1999 et al. Cellulo-monas flavigena 30,6 1600 1% bagas
tebu 6,5 55 56 1,27 322 Martinez-Trujillo
et al. 2003 Aspergillus terreus UL 4209 1,2 12 1% oat
spelt xilan 6 35 22 3,57 55,5 Chidi al. 2008 et Staphylo-coccus sp. SG-13 12 2,74 1% dedak gandum 7,5dan 9,2 50 - 7 (pd media oat spelt xilan) 55 (pd media oat spelt xilan) Gupta et al. 2000 Staphylo- coccus aureus MBXIK-4 11,7 383,9 0,7% oat spelt xilan 6 70 47,9 dan 21,6 1,08 3,19 Penelitian ini
*)Pengujian aktifitas xilanase berbeda untuk masing-masing peneliti dan pada dasarnya hasil penelitian ini
53 Pemaparan ini tidak berarti xilanase yang dihasilkan dalam penelitian ini dapat diperbandingkan langsung dengan xilanase hasil penelitian dari beberapa peneliti lain karena perbedaan baik dalam kondisi percobaan, strain mikroorganisme yang digunakan dan metode analisis yang dilakukan. Informasi ini berguna untuk dapat melihat karakteristik enzim xilanase yang dihasilkan diantara berbagai xilanase yang telah dihasilkan peneliti lain dan mencoba menentukan pada bidang apa aplikasi yang tepat dari xilanase yang dihasilkan.
Berdasarkan karakteristik xilanase ini tampaknya aplikasi pada industri pakan jadi masih kurang begitu menguntungkan. Hal ini dilihat dari ketahanan enzim terhadap panas hanya sekitar 30 menit pada suhu 70oC. Aplikasi xilanase dari S.aureus MBXi-K4 ini dapat diarahkan pada proses produksi yang menggunakan temperatur moderat (sekitar 40 – 70oC) seperti produksi xilooligosakarida maupun xilosa untuk kepentingan baik pangan, pakan maupun pharmaceutikal. Xilosa hasil kultivasi dapat digunakan sebagai bahan baku produksi xilitol, yaitu golongan gula alkohol yang digunakan sebagai pemanis rendah kalori sebagai gula diabetes atau pada permen rendah kalori untuk mengurangi karies gigi. Kultivasi xilosa menjadi xilitol dapat dilakukan secara enzimatis oleh xilitol dehidrogenase dari beberapa jenis khamir seperti Candida boidini, Candida guillermondii, Candida tropicalis, Candida parapsilosis, dan Debaryomyces hansenii (Saha 2003).