PENGARUH WAKTU ALIR TERHADAP EFEKTIFITAS DAN SELEKTIFITAS ADSORBEN HIBRID SILIKA KITOSAN PADA SIMULTAN ION
LOGAM Ni (II) DAN Cd(II) DENGAN METODE EKSTRAKSI FASE PADAT (EFP)
Oleh:
Sri Rezeki Samosir NIM 4103210036 Program Studi Kimia
SKRIPSI
Diajukan Untuk Memenuhi Syarat Memperoleh Gelar Sarjana Sains
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI MEDAN
RIWAYAT HIDUP
PENGARUH WAKTU ALIR TERHADAP EFEKTIFITASDANSELEKTIFITAS ADSORBEN HIBRID SILIKA KITOSANPADA SIMULTAN ION
LOGAMNi(II) DAN Cd(II) DENGAN METODE menggunakan Ekstraksi Fase Padat (EFP). Silika yang digunakan berbahan dasar abu sekam padi, sedangkan kitosan yang digunakan berbahan dasar kulit udang. Pada penelitian sebelumnya telah dilakukan bahwa perbandingan silika kitosan yang optimum yaitu 20:4% (20 mL larutan natrium silikat : 0,4 gram kitosan dalam asetat 2%) dengan luas permukaan 189,405 m2/g. Untuk mengetahui
tingkat keefektifan dan keselektifitasan adsorben tersebut dilakukan pada variasi waktu alir 20 menit, 40 menit, 60 menit, 80 menit, dan 100 menit. Dari hasil penelitian, menunjukkan bahwa waktu alir yang optimum terletak pada waktu 60 menit, dengan logam Ni(II) yang memiliki kapasitas adsorpsi yang paling besar dibandingkan dengan logam Cd(II). Jumlah logam yang teradsorp pada waktu 60 menit untuk logam Ni(II) adalah 9,9106 µmol/L, sedangkan untuk logam Cd(II)
adalah 4,4252 µmol/L. Metode Ekstraksi Fase Padat (EFP) dengan menggunakan
adsorben hibrid silika kitosan lebih efektif dalam menyerap ion logam Ni(II), dengan urutan kekuatan adsorpsi Ni(II) Cd(II). Semakin lama waktu alir yang˃ digunakan semakin jenuh adsorben untuk menyerap ion logam sehingga jumlah logam yang teradsorpsi semakin kecil.Optimum penyerapan pada waktu alir 60 menit.
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa dan Bunda Maria atas segala berkat dan karunia-Nya, penulis telah menyelesaikan penelitian dan sekaligus menyusun skripsi yang berjudul “Pengaruh Waktu Alir Terhadap Efektifitas dan Selektifitas Adsorben Hibrid Silika Kitosan Pada Simultan Ion Logam Ni(II) dan Cd(II) dengan Metode Ekstraksi Fase Padat (EFP)”.
Dengan selesainya skripsi ini, perkenankanlah penulis mengucapkan terimakasih kepada; Rektor Universitas Negeri Medan, Prof. Dr. Ibnu Hajar, M.Si; Dekan FMIPA, Prof. Drs. Motlan, M.Sc, Ph.D; dan Ketua Jurusan Kimia, Agus Kembaren, M.Si atas kesempatan dan fasilitas yang diberikan kepada penulis untuk mengikuti dan menyelesaikan studi Sarjana Sains pada program studi Kimia.
Terimakasih dan penghargaan yang setinggi-tingginya penulis ucapkan kepada Ibu Lisnawaty Simatupang,S.Si.,M.Si, selaku dosen pembimbing skripsi yang telah memberikan dorongan, bimbingan dan saran mulai dari pengajuan proposal penelitian, pelaksanaan sampai penyusunan skripsi ini serta Prof. Dr. Ramlan Silaban, M.S, Dr. Ajat Sudrajat, M.Si, dan Junifa L.Sihombing, S.Si,. M.Scyang telah memberikan masukan dan saran dalam kesempurnaan skripsi ini. Penghargaan juga diberikan kepada Ketua Program Studi Kimia, Dr. Marham Sitorus, M.Si, Kepala Laboratorium Kimia, Drs. Marudut Sinaga, M.Si, dan segenap Instansi yang telah memberikan bantuan fasilitas laboratorium selama penulis melakukan penelitian untuk penyelesaian skripsi ini.
dan mendidik saya dengan penuh cinta kasih sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Dan untuk yang Tersayang saudara-saudari kandung saya, kakak saya Dewi Purnamasari SE, adik laki-laki saya Suanro.MTR Samosir dan adik kembar saya Nova Elisabeth Samosir dan Novi Elisabeth Samosir yang telah memberikan motivasi serta kasih sayang kepada penulis. Dan kepada seluruh teman Seperjuangan jurusan Kimia Nondik 2010 untuk semua keakraban didalam diperkuliahan. Terkhusus buat sahabat saya (Parsmiler)yaitu Desi Indicayana situmorang,Dwika syahputra purba , Janriadi Sinaga, Jetro Simbolon dan Yeni Sirait atas rasa persaudaraan yang terjalin dengan baik. Kepada Christ Esra Saragih dan Boston Sidabutar Teman Seperjuangan saya saat melakukan penelitian , Dan buat seluruh mahasiswa/I jurusan kimia nondik 2011-2013 terima kasih yang sebesar-besarnya semoga kita semua diberikan berkat yang melimpah oleh Tuhan Yang Maha Esa.
Akhirnya dengan segala kerendahan hati, penulis mengharapkan saran dan kritik yang dapat membangun untuk menyempurnakan skripsi ini. Semoga hasil penelitian ini bermanfaat bagi pembaca dan dapat menjadi referensi bagi peneliti yang penelitiannya relevan dengan judul ini.
Medan, Januari 2015
2.1.3 Standard Penggunaan Kitosan 11
2.1.4Bentuk-Bentuk Kitosan 11
2.2. Silika Gel 12
2.3. Hibrid Silika Kitosan (HSK) 14
2.4 Limbah Logam 17
2.4.1. Cadmium (Cd) 18
2.4.1.1Efek Toksik 19
2.4.2Nikel (Ni) 19
2.5. Adsorpsi 20
2.5.1. Defenisi Adsorpsi 20
2.5.2. Jenis Adsorpsi 21
2.5.3. Faktor-Faktor yang Mempengaruhi Adsorpsi 22 2.5.4.Faktor-faktor yang mempengaruhi interaksi logam dengan adsorben 23
2.6. Model Isoterm, Langmuir 25
2.7. Metode Ekstraksi Fase Padat (EFP) 25
2.8. Spektroskopi Serapan Atom (SSA) 28
2.9 Hipotesis 30
BAB III METODE PENELITIAN 31
3.1. Tempat dan Waktu Penelitian 31
3.2. Alat dan Bahan 31
3.3. Prosedur Penelitian 31
3.3.4. Preparasi Kolom EFP dan Loading Sampel 33
BAB IV HASIL DAN PEMBAHASAN 36
4.1. Pembuatan Hibrid Silika Kitosan Secara Sol-Gel 36 4.2. Penentuan Daya Serap Adsorben Hibrid Silika Kitosan 36
Terhadap Logam Simultan Ni(II) dan Cd(II) Dengan Metode EFP
4.3. Kurva Kalibrasi 37
4.4. Pengukuran Sampel Ni(II) Secara SSA 38 4.5. Pengukuran Sampel Cd(II) Secara SSA 40
BAB V KESIMPULAN DAN SARAN 44
5.1. Kesimpulan 44
5.2. Saran 44
DAFTAR TABEL
Halaman
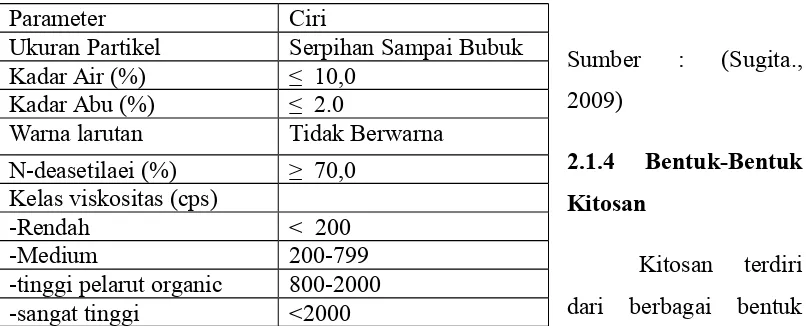
Tabel2.1. Standard Kitosan 11
Tabel 2.2 Bentuk-bentuk kitosan 11
Tabel 4.1. Hasil Pengukuran Logam Ni(II) Secara SSA 39 Tabel4.2. Hasil Kajian Adsorpsi Menggunakan Teknik 39
Kolom EFP Terhadap Logam Ni(II)
Tabel 4.3. Hasil pengukuran logam Cd(II) secara SSA 40 Tabel 4.4. Hasil Kajian Adsorpsi Menggunakan Teknik 40
DAFTAR GAMBAR
Halaman
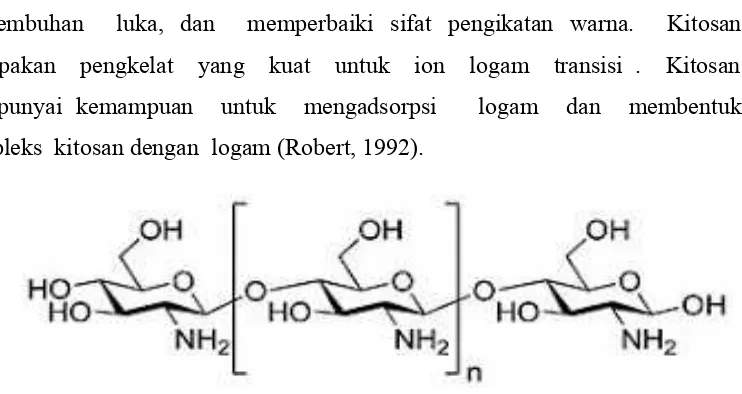
Gambar2.1. Struktur Kitosan 8
Gambar 2.2. Hibrid Silika Kitosan 16
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Perhitungan Pembuatan Larutan 49 Lampiran 2. Perhitungan Persentase Daya Adsorpsi Adsorben 52
Hibrid Silika Kitosan
Lampiran 3. Kurva Kalibrasi 53
BAB I dihasilkan dari hasil limbah industri.Keberadaan zat – zat pencemar tersebut akan menyebabkan pembaharuan yang buruk untuk ekosistem yang ada, termasuk juga manusia.Oleh sebab itu kelestarian lingkungan dari zat pencemar harus dijaga dan terus mendapatkan perhatian dari masyarakat sekitar, yang merupakan elemen dari lingkungan hidup itu sendiri.Salah satu cara yang dapat digunakan untuk mengurangi zat pencemaran pada lingkungan adalah dengan menggunakan kitosan sebagai adsorben (Purwantiningsih, S., 2009).
Logam berat adalah senyawa kimia yang berupa logam dengan berat molekul yang tinggi dan memiliki sifat beracun.Upaya penangan limbah yang mengandung logam berat terus dilakukan, salah satunya adalah dengan metoda adsorpsi. Keberadaannya di air atau air limbah dengan konsentrasi melebihi ambang batas dapat memberikan dampak negatif bagi siklus biologi yang normal di lingkungan dampak negatif yang langsung dirasakan oleh manusia antara lain gangguan kesehatan dan keracunan seperti gangguan fungsi syaraf, perubahan komposisi darah, kelainan pada jantung, paru-paru dan sebagainya. Logam berbeda dengan polutan berbahaya lainnya karena logam bersifat tidak terdegradasi, dapat terakumulasi pada jaringan hidup, dan terkonsentrasi pada rantai makanan
Menyadari ancaman yang begitu besar dari pencemaran logam berat pada perairan, maka berbagai metode alternatif telah banyak digunakan untuk mengurangi konsentrasi logam berat, Salah satunya dengan memanfatkan mikroorganisme, adapula dengan menggunakan bahan alam yang ramah lingkungan.Penggunaan Biomaterial dari limbah pertanian atau industri dapat digunakan sebagai alternatif adsorben dengan biaya rendah diantaranya seperti ; tongkol jagung, gabah padi, ampas kedelai, kulit udang, dan jerami.(Mashall dan Mitchell,1996).Dari penelitian yang telah dilakukan memperlihatkan bahwa biomaterial mengandung gugus fungsi antara lain karboksil,amino sulfat, polisakarida, lignin dan sulfihidril mempunyai kemampuan penyerapan yang baik.Kitosan memiliki dua gugus aktif yaitu –NH2dan –OH sehingga kitosan
dapat menjadi penyangga aktif yang dapat meningkatkan kemampuan adsorpsi, pada pH tertentu kedua gugus aktif ini dapat saja mengalami protonasi ataupun deprotonasi yang mestinya akan menghasilkan muatan permukaan yang berbeda gugus NH2dalam kitosan dan gugus OH merupakan basa keras . Gugus –NH2
mempunyai sepasang elektron bebas, itu berarti mempunyai sifat basa, atau dalam larutan (air) akan meningkatkan pH sistem.
Peningkatan pH sistem tentu saja dapat mengubah sifat asam basa permukaan yang berarti juga akan mempengaruhi kekuatan ikatan atau selektifitas pengikatan ion logam (Endang Widjajanti, 2003: 51).Kitosan memiliki ketahanan fisik terhadap asam masih kurang baik, oleh karena itu dilakukan modifikasi kitosan dengan penambahan silika agar ketahanan fisik terhadap asam menjadi lebih baik dan kemampuan adsorpsi terhadap logam berat tetap besar.
ada hanya berupa gugus silanol (Si-OH) dan siloksan (Si-O-Si). Akan tetapi kekurangan ini dapat diatasi dengan memodifikasi permukaan dengan menggunakan situs aktif yang sesuai untuk mengadsorpsi ion logam berat yang dikehendaki.
Pemilihan silika sebagai bahan tambahan untuk modifikasi kitosan karena silika memiliki gugus aktif silanol (Si-OH) dan siloksan (Si-O-Si).Selain itu juga memiliki kekuatan mekanik dan stabilitas termal yang tinggi dan tidak mengembang dalam pelarut organik (Bhatia, 2000).Modifikasi kitosan dengan permukaan silika gel merupakan modifikasi secara kimia melalui reaksi homogen (proses sol-gel).
Proses ekstraksi pelarut merupakan metode yang sangat baik untuk pemisahan secara selektif dan konsentrasi ion logam dari larutan kompleks. Hal ini disebabkan adanya ligan dalam jumlah yang besar, yang dapat digunakan sebagai bahan pengekstrak. Proses ini memerlukan campuran fasa pada permukaan yang sesuai untuk memperoleh ekstraksi yang baik. Oleh sebab itu diperlukan bahan alternatif yang ramah lingkungan sebagai bahan pengekstrak fasa padat yang selektif.
Hibrid Kitosan Silika yang sudah disintesis akan diuji daya adsorpsinya pada larutan logam yang telah diatur kadar logamnya. Efektifitas hibrid kitosan silika dalam mengikat logam berat dipengaruhi oleh ukuran partikel, pH larutan, konsentrasi ion logam dalam larutan, reaksi, temperature dan waktu kontak yang digunakan.
Pemisahan dengan metode ekstraksi pelarut merupakan metode yang murah dengan konsentrasi ion logam 0,01 hingga 1,0 mg/L(Akita dan Taekuchi., 1990). Penelitian Simatupang (2008) telah berhasil melakukan adsorpsi simultan ion logam divalent antara Mg(II), Zn(II), Ni(II), Cd(II) dengan sistem batch dengan kapasitas adsorpsi Mg(II) 107,52 µmol/g, Zn(II) 142,85 µmol/g, Ni(II) 120,48 µmol/g, dan Cd(II) 86,20 µmol/g. Dari data terlihat bahwa kapasitas adsorpsi Zn(II) lebih besar dibandingkan Ni(II) dan Mg(II).Pada proses pembuatan, karakterisasi dan mekanisme reaksi hibrida silika kitosan merujuk pada penelitian yang telah dilakukan sebelumnya oleh Simatupang(2007). Pembuatan hibrida silika kitosan (HSK) dari campuran Na2SiO3 dan kitosan dengan variasi (20:1%) ,
(20:2%), (20:3%), dan (20:4%) dilakukan secara sol gel pada variasi (20:4%) memiliki daya adsorpsi yang paling baik.
kitosan terhadap simultan ion logam Ni(II) dan Cd(II) dengan metode
1. Ion logam yang digunakan sebagai adsorbat terhadapadsorben hibrid silika kitosan adalah ion logam Ni(II) dan Cd(II) berdasarkan waktu alir .
2. Metode adsorpsi ion logam Ni(II) dan Cd(II) menggunakan metode
2. Berapakah jumlah logam Ni(II) dan Cd(II) yang terserap pada waktu alir optimum?
3. Apakah adsorben hibrid silika kitosanefektif digunakan untuk menyerap logam Ni(II) dan Cd(II)?
1.4 Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mendapatkan waktu alir optimum dengan penggunaan adsorben hibrid silika kitosan untuk menyerap logam Ni(II) dan Cd(II).
2. Mengetahui jumlah logamNi(II) dan Cd(II) yang terserap oleh adsorben hibrid silika kitosan pada waktu alir optimum.
4. Mengetahui penggunaan kolom yang efektif pada adsorben hibrid silika kitosan dengan metode ekstraksi fase padat.
1.5 Manfaat Penelitian
Penelitian ini diharapkan dapat bermanfaat dalam hal:
1. Memberikan informasi tentang Efektifitas dan Selektifitas optimal dari adsorben Hibrid Kitosan Silika dari variasi waktu kontak .
2. Sebagai bahan referensi untuk penelitian yang terkait yang menggunakan metode ekstraksi fase padat untuk adsorben.
BAB II
TINJAUAN PUSTAKA 2.1. Kitosan
Kitosan merupakan biopolimer yang merupakan turunan kitin dengan rumus molekul (C6H11NO4)n dengan densitas yang sangat tinggi dalam larutan
dan membawa muatan positif pada rentang pH di bawah 6,5. Kitosan mengandung gugus amina bebas yang memberikan karaktersistik sebagai penukar ion. Keuntungan lain penggunaan kitosan sebagai bahan antibakteri adalah jumlah kitosan yang sangat melimpah di alam, yang salah satunya dapat diperoleh dari limbah cangkang udang dan kepiting (crustacean) yang banyak dihasilkan dari sektor industri.
Keberadaan gugus amina pada kitosan menyebabkan kitosan dapat larut dalam pelarut asam. Pelarutan kitosan dalam pelarut asam membentuk larutan kental yang dapat digunakan sebagai pembuatan gel dalam berbagai variasi seperti butiran, membran, dan serat. Kitosan dalam bentuk terprotonasi menunjukkan kerapatan muatan yang tinggi dan bersifat sebagai polielektrolit kationik dan sangat efektif berinteraksi dengan biomolekul bermuatan negatif molekul permukaan (Sugita dkk., 2009). Akan tetapi membran dengan berbahan dasar kitosan saja tidak dapat langsung digunakan karena strukturnya yangsangat rapuh dan memiliki ketahanan sobek rendah sehingga dibutuhkan penguat. Oleh karena itu, diperlukan adanya modifikasi terhadap bahan dasar membran dengan menggunakan campuran polimer sintetis dan diharapkan dapat menghasilkan membran dengan karakteristik yang lebih baik.
dapat mengikat logam dimana gugus amino yang terdapat pada kitosan berikatan dengan logam dapat membentuk ikatan kovalen. Gaya yang bekerja yaitu gaya Van der Walls, gaya elektrostatik, ikatan hidrogen dan ikatan kovalen. Standarisasi penyerapan limbah logam dengan kitosan sebesar ≥ 70 %. Kitosan yang tidak dapat larut dalam air akan menggumpalkan logam menjadi flok – flok yang akan bersatu dan dapat dipisahkan dari air limbah. ( Marganof., 2003 ; Widodo et al , 2005 ).
Kitosan memiliki sifat unik yang dapat di gunakan dalam berbagai cara serta memiliki kegunaan yang beragam , antara lain sebagai perekat , aditif untuk kertas dan tekstil , penjernihan air minum, serta untuk mempercepat penyembuhan luka, dan memperbaiki sifat pengikatan warna. Kitosan merupakan pengkelat yang kuat untuk ion logam transisi . Kitosan mempunyai kemampuan untuk mengadsorpsi logam dan membentuk kompleks kitosan dengan logam (Robert, 1992).
Gambar 2.1. Struktur Kitosan. (Kristbergsson, 2003)
Karena adanya gugus amino, kitosan merupakan polielektrolit kationik (pKa ≈6,5) hal yangsangat jarang terjadi secara alami. Sifat yang basa ini menjadikan kitosan :
b. Membentuk kompleks yang tidak larut dengan air dengan polianion yang dapat juga digunakan untuk pembuatan butiran gel, kapsul, dan membran. c. Dapat digunakan sebagai pengkhelat ion logam berat dimana gelnya
menyediakan sistem produksi terhadap efek dekstruksi dari ion (Meriaty,2002)
2.1.1. Sifat – Sifat Fisika dan Kimia 2.1.1.1. Sifat Fisika
Kitosan adalah padatan amorf putih yang tidak larut dalam alkali dan asam mineral kecuali pada keadaan tertentu. Kitosan merupakan molekul polimer yang mempunyai berat molekul tinggi.Kitosan dengan berat molekul yang tinggi didapati dengan mempunyai viskositas yang baik dalam suasana asam.Kitosan hasil deasetilasi kitin larut dalam asam encer seperti asam asetat, asam formiat, dll.Kitosan dapat membentuk gel dalam n – metilmorpin n – oksida yang dapat digunakan dalam formulasi pelepasan obat terkendali. Kandungan nitrogen dalam kitin berkisar 5 – 8% tergantung pada tingkat deasetilasi sedangkan nitrogen pada kitosan kebanyakan dalam bentuk gugus amino. Maka kitosan bereaksi melalui gugus amino dalam pembentukan N – asilasi dan reaksi Schiff yang merupakan reaksi yang penting.(Kumar, 2000)
2.1.1.2 Sifat Kimia
Adanya gugus amino dan hidroksil dari kitosan juga menyebabkan kitosan mudah dimodifikasi secara kimia dalam reaksi pembentukan. Kitosan dalam bentuk terprotonasi menunjukkan kerapatan muatan yang tinggi dan bersifat sebagai polielektrolit kationik dan sangat efektif berinteraksi dengan biomolekul bermuatan negatif molekul permukaan (Sugitadkk., 2009).
2.1.2. Modifikasi Kitosan
pada luas permukaannya. Semakin kecil ukuran kitosan, maka luas permukaan kitosan akan semakin besar.
a. Kitosan berbentuk serpihan
Afinitas kitosan bentuk serpihan telah diuji coba terhadap ion Pb+2, Ni+2, danCr+2
dan persentase pengikatan adalah 84 – 98, 40 – 92, dan 17 – 46% berturut– turut. b. Hidrogel kitosan
Pelarutan kitosan dalam asam asetat merupakan cara sederhana untuk membentuk hidrogel kitosan.Hidrogel kitosan yang dibentuk oleh penambahan bahan senyawa penaut silang disebut hidrogel kitosan kovalenatau ionik. Penaut silang yang digunakan merupakan molekul berbobot molekul lebih rendah daripada bobot molekul kedua rantai polimer yang akan ditautkan.
c. Kitosan berbentuk membran
Membran dapat disiapkan dengan menggunakan beberapa metode antara lain pelelehan, pengepresan, track – etching, dan pembalikan fase. Pembalikan fase adalah proses yang mengubah polimer dari bentuk larutan menjadi bentuk padatan secara terkontrol. Asnel (2008) membuat membran gel kitosan – alginat dengan penaut silang glutaraldehida.
d. Kitosan berbentuk butiran
Kitosan dapat dibuat menjadi bentuk butiran dengan pelarutan 3 gram kitosan dalam 100 ml larutan asam asetat 1% yang diteteskan pada larutan NaOH 4% maka diperoleh butiran berbentuk bola. Kitosan berbentuk butiran yang terbentuk dikumpulkan dan dicuci dengan akuades.
Sumber : (Sugita., dan kegunaan seperti yang ditunjukkan pada tabel di bawah ini :
Tabel 2.2. Bentuk-bentuk Kitosan
N O
Bentuk Kitosan Sifat Kitosan
1 Serbuk - Dapat diubah kasar menjadi halus - Mudah dilarutkan 4 Gel - Kekuatan gel yang tinggi
- Mudah dibentuk dengan polianion
5 Manik - Mudah dibuat
- Dapat menyerap logam - Dapat dilakukan ikatan silang - Dapat memadatkan enzim 6 Larutan - Sifat kejernihan yang tinggi
7 Pasta - Mudah untuk diformulasikan - Daya pelembab yang baik
Sumber : Hirano,dkk (1984) 2.2 Silika Gel
terjadi melalui pengikatan langsung agen silan dengan gugus silanol pada silika gel kemudian diikuti dengan immobilisasi gugus aktif.
Silika memiliki sifat nontoksik dan biokompatibel sehingga banyak dimanfaatkan dalam berbagai aplikasi. Matrik silika secara kimia stabil, bersifat hidrofilik, mudah disintesis dan memiliki kekuatan mekanik (Antovska, 2006). Silika memiliki keuntungan dari segi kemampuan adhesi yang lebih baik pada banyak subtrat, ketahanan korosi yang tinggi, ketahanan terhadap keretakan dan sebagainya serta menunjukkan performa yang baik untuk pelapisan, perekatan, dan lain-lain. Kelemahan penggunaan silika gel adalah rendahnya efektivitas dan selektivitas permukaan dalam berinteraksi dengan ion logam berat sehingga silika gel tidak mampu berfungsi sebagai adsorben yang efektif untuk ion logam berat. Hal ini terjadi karena situs aktif yang ada hanya berupa gugus okso (O-Si-O) atau hidoksi (-Si-OH). Namun bahan ini belum efektif untuk mengadsorpsi ion logam. Hal ini dikarenakan atom O yang merupakan situs aktif pada silika gel berukuran kecil dan memiliki polarisabilitas yang rendah, sehingga interaksi dengan logam berat yang pada umumnya berukuran besar dan memiliki polarisabilitas yang tinggi secara teoritis relatif kurang kuat. Oleh karena itu, perlu adanya modifikasi permukaan silika gel modifikasi dapat dilakukan secara fisik (impregnasi) dan kimia.
Modifikasi secara kimia itu sendiri terbagi atas dua metode,yakni: imobilisasi reagen silan dan imobilisasi melalui reaksi homogen (proses sol-gel). Secara umum, untuk mendapatkan SiO2 dalam suatu raw material yaitu
110 °C, konsentrasi pelarut NaOH 5 M waktu ekstraksi 60 menit dan pengadukan 600 rpm pada kondisi batch. (Soeswanto,2011)
2.3 Hibrid Silika Kitosan (HSK)
Pembuatan (HSK) dari larutan Na2SiO3 diawali dengan pengolahan abu
sekam padi menjadi larutan natrium silikat yang selanjutnya digunakan sebagai bahan dasar dalam pembuatan hibrida silika kitosan tersebut.Proses pembuatan dan mekanisme reaksi hibrida silika kitosan merujuk pada penelitian yang telah dilakukan sebelumnya oleh Simatupang(2007). Pembuatan hibrida silika kitosan (HSK) dari campuran Na2SiO3 dan kitosan dengan variasi (20:1%) , (20:2%),
(20:3%), dan (20:4%) dilakukan secara sol gel. Hal yang perlu diperhatikan dalam pembuatan hibrida silika kitosan adalah proses pencucian dilakukan tidak sempurna maka akan mempengaruhi kristalinitas dari gel yang dihasilkan.
Proses sol-gel adalah pelarutan pada temperature rendah yang merupakan dasar pada sintesis gelas.Pembentukan matriks silika dicapai dengan hidrolisis pada suatu alkoksi (biasanya tetrametil orto silikat/ TMOS) diikuti kondensasi untuk menghasilkan suatu polimer jaringan SiO2 dengan jembatan okso. Hidrolisis menghasilkan konversi ikatan Si-OR ke Si-OH yang memadat membentuk suatu polimer berjembatan okso Si-OSi.Reaksi ini terjadi dalam suatu daerah terlokalisasi menuju pembentukan partikel sol.Derajat pertautan silang sebagai hasil polikondensasi meningkat dan viskositas sol juga meningkat. Kekentalan material kemudian mengeras menuju pembentukan suatu gel yang porous (Brinker dan Scherer, 1990). Proses sol gel dimulai dengan mengasamkan larutan natrium silikat sampai terbentuk gel karena silika mempunyai kelarutan yang tinggi pada pH > 10 ( Scott, 1993).
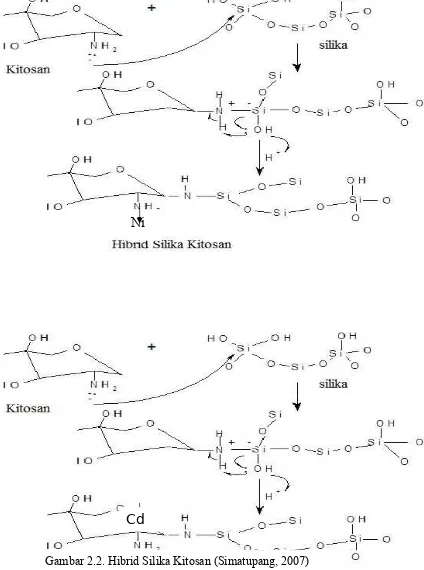
banyak berdasarkan laporan penelitian.Adsorben hybrid amino silica yang dibuat kemudian dinamakan menjadi HSK (20 ; 1), (20 ; 2), (20 ; 3), (20 ; 4) dikarakterisasi dengan menggunakan FTIR dan XRD.
Gambar 2.2. Hibrid Silika Kitosan (Simatupang, 2007)
Cd
Secara struktur, HSK memiliki gugus fungsi hidroksil dan amin yang akan mengikat logam berat untuk membentuk ikatan kompleks koordinasi.
Hal yang perlu diperhatikan dalam pembuatan hibrida silika kitosan adalah proses pencucian gel dengan aquades. Proses ini bertujuan untuk melarutkan kotoran terutama garam NaCl yang juga terdapat pada pembentukan gel dan terperangkap pada gel tersebut. Apabila proses pencucian tidak sempurna maka akan mempengaruhi kristalinitas dari gel yang dihasilkan.
Karakteristik hibrid silika kitosan yaitu : pada bilangan 1658.78 cm-1
menunjukkan adanya gugus (C=O amida), gugus (C-H SP3 stretching), pita
serapan pada panjang gelombang 3479.58 cm-1 menunjukkan adanya gugus (N-H
bending, O-H stretching). 2.4 Limbah Logam.
maka organisme yang terpengaruh akibat penambahan polutan logam ke perairan adalah organisme dan tumbuhan yang tumbuh di perairan atau habitat tersebut.
Dalam tubuh makhuk hidup logam mengalami biokonsentrasi dan bioakumulasi sehingga kadar logam di dalam tubuh mahkuk hidup lebih besar daripada di lingkungan perairan logam juga mengalami biomagnifikasi kadarnya semakin meningkat dengan peningkatan posisi organism pada rantai makanana karena interaksi antar organism dalam suatu ekosistem maka dampak dari limbah logam tersebut pada akhirnya akan sampai pada hierarki rantai makanan tingkat tertinggi yaitu manusia. Efek logam berat dapat berpengaruh langsung hingga terakumulasi pada rantai makanan walaupun pada konsentrasi yang sangat rendah (Fahmiati, 2004).Logam berat tersebut dapat ditransfer dalam jangkauan yang sangat jauh sehingga akhirnya berpengaruh terhadap kesehatan manusia walaupun dalam jangka waktu yang cukup lama dan jauh dari sumber pencemar. Karakteristik dari kelompok logam – logam berat adalah sebagai berikut: Memiliki spesifikasi grafitasi yang sangat besar (lebih dari 4),Mempunyai nomor atom 22 - 23 dan 40 - 50 serta unsur laktanida dan aktinida,juga Mempunyai respon biokimia yang khas (spesifik) pada organisme hidup. Beberapa logam berat yang dapat mencemari lingkungan dan bersifat toksik adalah kadmium (Cd), nikel(Ni), Magnesium (Mg), seng (Zn). (Sudarwin, 2008).
2.4.1 Kadmium (Cd)
Kadmium (Cd) adalah logam putih keperakan, yang dapat ditempa, lunak dan tahan korosi. Kadmium bersifat tahan panas sehingga sangat baik untuk campuran pembuatan keramik. Kadmium merupakan logam yang sering digunakan dalam lempengan elektroda, pengecatan, stabilizer dalam pabrik plastik dan baterai dan sebagai campuran logam (alloy). Kadmium melebur pada 3210C dan melarut dengan lambat dalam asam encer dengan melepaskan
(Vogel,1984). Kadmium merupakan logam transisi. Oleh karena sifat-sifatnya kadmium banyak dipakai sebagai stabilizer dalam pembuatan polyvinilclorida. Dimasa silam kadmium malah digunakan dalam pengobatan syphilis dan malaria. Kadmium didapat pada limbah berbagai jenis pertambangan logam yang tercampur kadmium seperti timah hitam, dan seng. Dengan demikian, kadmium dapat ditemukan di dalam perairan baik di dalam sedimen maupun di dalam penyediaan air minum (Cooke, 1977).Massa atom logam kadmium 112,411 g/mol, deret kimia logam Cd merupakan logam transisi, rapatan pada suhu kamar 8,65 g/cm3,massa jenis cair padat titik lebur 7,996 g/cm, titik didih
767 0C, jari-jari ion divalen 0,92Å, panas penguapan 99,87 kj/mol,
elektronegativitas 1.69(Pauling scale).
2.4.1.1 Efek toksik
Bagi manusia, kadmium sebenarnya merupakan logam asing. Tubuh sama sekali tidak memerlukannya dalam proses metabolisme. Karena Cd sangat beracun bagi manusia dan dapat diabsorpsi tubuh dalam jumlah yang tidak terbatas, karena tidak adanya mekanisme tubuh yang dapat membatasinya. Apabila Cd masuk ke dalam tubuh maka sebagian besar akan terkumpul di dalam ginjal, hati, dan sebagian yang dikeluarkan lewat saluran pencernaan. Kadmium dapat mempengaruhi otot polos pembuluh darah secara langsung maupun tidak langsung lewat ginjal. Sebagai akibatnya terjadi kenaikan tekanan darah.
2.4.2. NikeL ( Ni )
paduan nikel memiliki karakteristik kuat, tahan panas, serta tahan karat Kebanyakan nikel di bumi tidak dapat diakses karena berada dalam inti bumi cairr. Nikel diketahui menyumbang 10% komposisi inti bumi.Jumlah total nikel yang terlarut dalam laut berada pada kisaran 8 miliar ton. (Eksiklopedi nasional Indonesia, 1991). Garam-garam Ni(II) yang stabil berasal dari Ni(II) oksida, dan berwarna hijau yang disebabkan oleh warna dari kompleks heksakuonikelat(II) [Ni(H2O)6]2+. Nikel(III) oksida, Ni2O3yang hitam kecoklatan juga ada, tetapi zat ini melarut dalam asam dengan membentuk ion nikel (II).
2.5 Adsorpsi
2.5.1. Defenisi Adsorpsi
Adsorpsi adalah peristiwa penyerapan suatu zat, ion atau molekul yang melekat pada permukaan, dimana molekul dari suatu materi terkumpul pada bahan pengadsorpsi atau adsorben. Sifat adsorpsi partikel koloid banyak dimanfaatkan dalam proses penjernihan air atau pemurnian suatu bahan yang masih mengandung pengotor, partikel koloid mempunyai permukaan luas sehingga mempunyai daya serap adsorpsi yang besar. Terjadinya adsorpsi pada permukaan larutan disebabkan karena adanya kekuatan atau gaya tarik – menarik antara atom atau molekul pada permukaan larutan. Peristiwa penyerapan suatu zat padapermukaan zat lain disebut adsorpsi, zat yang diserap disebut fase terserap sedangkan zat yang menyerap disebut adsorben. Peristiwa adsorpsi disebabkan oleh gaya tarik molekul dipermukaan adsorben.
kimia yang melibatkan pembentukan senyawa kimia melalui ikatan kimia yang lebih kuat dan dikenal sebagai kemisorpsi.
Adsorpsi kimia melibatkan ikatan koordinasi sebagai hasil penggunaan bersama pasangan elektron oleh padatan (adsorben) dan adsorbat. Oscik (1982) mengemukakan bahwa pada adsorpsi fisika ikatan pada permukaan adsorben lemah dan bersifat reversibel, sehingga molekul-molekul yang telah teradsorp mudah lepas dengan cara menurunkan tekanan gas atau konsentrasi zat terlarut.
2.5.2. Jenis Adsorpsi
Berdasarkan daya tarik molekul adsorben dengan adsorbat, adsorpsi dibedakan menjadi dua, yaitu:
a. Adsorpsi fisika
Adsorpsi yang disebabkan oleh gaya Van Der Wall yang ada pada permukaan adsorben, panas adsorpsinya rendah dan lapisan yang terjadi pada permukaan adsorben biasanya lebih kecil dari satu molekul.
b. Adsorpsi kimia
terlarut oleh adsorben padat cenderung membentuk ikatan hidrogen jika salah satu mempunyai kelompok ikatan hidrogen sebagai donor dan yang lainnya sebagai akseptor (Yun dkk., 2001 dan Alberty dkk, 1992).
2.5.3. Faktor – Faktor yang Mempengaruhi Adsorpsi
Secara umum, faktor-faktor yang mempengaruhi dari proses adsorpsi adalah sebagai berikut:
a. Luas permukaan ,
Semakin luas permukaan adsorben, maka makin banyak zat yang teradsorpsi. Luas permukaan adsorben ditentukan oleh ukuran partikel dan jumlah dari adsorben.
b. Jenis adsorbat
Peningkatan polarisabilitas adsorbat akan meningkatkan kemampuan adsorpsi molekul yang mempunyai polarisabilitas yang tinggi (polar) memiliki kemampuan tarik-menarik terhadap molekul lain dibandingkan molekul yang tidak dapat membentuk dipol (nonpolar). Peningkatan berat molekul adsorbat dapat meningkatkan kemampuan adsorpsi. Adsorbat dengan rantai yang bercabang biasanya lebih mudah diadsorp dibandingkan rantai yang lurus.
c. Konsentrasi adsorbat
Semakin besar konsentrasi adsorbat dalam larutan maka semakin banyak jumlah substansi yang terkumpul pada permukaan adsorben.
d. Temperatur
Pemanasan yang terlalu tinggi menyebabkan rusaknya adsorben sehingga kemampuan penyerapannya menurun.
Hal yang juga harus diperhatikan antara lain :
1. pH, pH larutan mempengaruhi kelarutan ion logam, aktivitas gugus fungsi pada biosorben dan kompetisi ion logam dalam proses adsorpsi.
2. Kecepatan pengadukan, menentukan kecepatan waktu kontak adsorben dan adsorbat. Bila pengadukan terlalu lambat maka proses adsorpsi berlangsung lambat pula, tetapi bila pengadukan terlalu cepat kemungkinan struktur adsorben cepat rusak, sehingga proses adsorpsi kurang optimal.
3.Waktu alir,
penentuan waktu kontak yang menghasilkan kapasitas adsorpsi maksimum terjadi pada waktu kesetimbangan.Waktu kesetimbangan dipengaruhi oleh tipe biomassa (aktif atau tidak aktif), ion yang terlibat dalam system biosorpsi,konsentrasi ion logam. Waktu kontak diperlukan untuk mencapai kesetimbangan adsorpsi dijadikan sebagai penentu kecepatan laju reaksi.
2.5.4 Faktor-faktor yang mempengaruhi interaksi logam dengan adsorben Lyman dkk. (1995) dalam Sujandi (2002) mengemukakan bahwa gaya dorong adsorpsi permukaan merupakan kombinasi dua faktor, yaitu afinitas adsorbat terhadap pelarut dan afinitas adsorbat pada adsorben. Kedua faktor ini dipengaruhi oleh :
a. Sifat logam dan ligan
pengklasifikasian HSAB (hard soft acid and base) dapat diterapkan pada proses adsorpsi.
Secara umum, asam keras cenderung lebih stabil berikatan dengan basa keras, sedangkan asam lunak berikatan stabil dengan basa lunak. Fenomena ini berhubungan dengan energi orbital dari spesies-spesies tersebut.
b. Sifat Pelarut
Pada adsorpsi padat-cair, mekanisme adsorpsi bergantung pada faktor-faktor seperti gaya interaksi antara molekul adsorbat dengan permukaan, gaya interaksi antara molekul pelarut dengan permukaan adsorben, dan gaya interaksi antara molekul dari komponen larutan dengan lapisan permukaan adsorben dan pori-porinya (Oscik, 1982). Pelarut dapat ikut teradsorpj atau sebaliknya dapat mendorong proses adsorpsi.
c. pH sistem
Pengikatan kation logam pada ligan permukaan, seperti halnya pengikatan kation logam oleh ligan terlarut sangat dipengaruhi oleh pH. Pada pH rendah, ligan permukaan cenderung terprotonasi, sehingga kation logam juga berkompetisi dengan H+ untuk terikat pada ligan permukaan. Sebaliknya pada pH
tinggi dimana jumlah ion OH- besar, menyebabkan ligan permukaan cenderung
terdeprotonasi, sehingga pada saat yang sama terjadi kompetisi antara ligan permukaan dengan ion OH- untuk berikatan dengan kation logam.
2.6. Model Isoterm Langmuir
adsorben dan Tiap bagian permukaan hanya dapat menampung satu molekul atau
a.b = tetapan empiris yang tergantung pada sifat dari jenis adsorben serta suhu.
c = jumlah zat terlarut yang teradsorpsi per satuan massa adsorben x/m = jumlah zat terlarut yang teradsorpsi persatuan massa adsorben
c
Dan apabila dialurkan c (x/m) terhadap c akan dihasilkan kurva berupa garis lurus dengan kemiringan 1/a dan titik perpotongan dengan ordinat 1/ab. 2.7 Metode Ekstraksi Fase Padat
Ekstraksi fasa padat atau Solid Phase Extraction merupakan metode ekstraksi yang berkembang saat ini dengan menggunakan kolom yang berbasis kromatografi. Jika dibandingkan dengan ekstraksi cair-cair, ekstraksi fase padat yang biasa disebut Solid Phase Extraction merupakan teknik yang relatif baru akan tetapi SPE cepat berkembang sebagai alat yang utama untuk pra-perlakuan sampel atau untuk clean-up sampel-sampel yang kotor, misal sampel sampel yang mempunyai kandungan matriks yang tinggi seperti garam-garam, protein, polimer, resin, dll.
1. Proses ekstraksi lebih sempurna.
2. Pemisahan analit dari penganggu yang mungkin ada menjadi lebih efisien. 3. Mengurangi pelarut organik yang digunakan.
4. Fraksi analit yang diperoleh lebih mudah dikumpulkan. 5. Mampu menghilangkan partikulat.
6. Lebih mudah diotomatisasi.
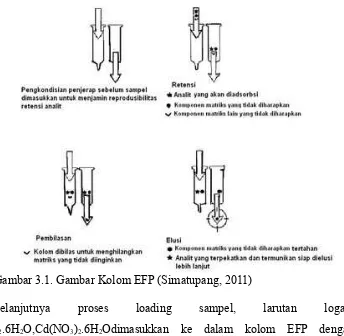
Proses ekstraksi fase padat terbagi menjadi empat tahap, yaitu : 1.Preparasi/pemilihan kolom EFP.
Kolom EFP terbagi beberapa jenis baik itu kolom secara manual atau kolom yang menggunakan siste vakum, yang dapat diaplikasikan untuk diatur laju aliran sampel yang dianalisa.
2. Kondisioning Kolom EFP
Dalam proses ini, terdapat berbagai kondisioning kolom EFP. Hal ini berakaitan dengan tipe-tipe fase yang terjadi. Fase terbalik (reserved phase)
biasanya menggunakan pelarut organic yang larut air seperti methanol dan dilanjutkan dengan air (aquades) atau larutan buffer. Fase normal dikondisioning dengan pelrut sampel atau non polar. Sedangkan kondisioning fase pertukaran ion menggunakan air bebas ion atau buffer.
1. Larutan sampel dimasukkan ke kolom EFP
Laju aliran (loading) larutan sampel ke dalam EFP dapat secara akurat dilakukan seacra perlahan-lahan sesuai volume cartridge dengan menggunakan pipet atau mikropipet sampai dengan volume sampel yang diinginkan untuk dianalisa.
2. Pencucian kolom EFP
ekstraksi cair-cair. Dengan ekstraksi cair-cair diperlukan ekstraksi beberapa kali untuk memperoleh recovery yang tinggi, sedangkan dengan SPE hanya dibutuhkan satu tahap saja untuk memperolehnya. Sementara itu kerugian SPE adalah banyaknya jenis cartridge (berisi penyerap tertentu) yang beredar di pasaran sehingga reproduksibilitas hasil bervariasi jika menggunakan cartridge yang berbeda dan juga adanya adsorpsi yang bolak-balik pada cartridge SPE.
Ada dua strategi untuk melakukan penyiapan sampel menggunakan SPE ini. Strategi pertama adalah dengan memilih pelarut yang mampu menahan secara total analit yang dituju pada penyerap yang digunakan, sementara senyawa senyawa yang mengganggu akan terelusi. Analit yang dituju yang tertahan pada penyerap ini selanjutnya dielusi dengan sejumlah kecil pelarut organik yang akan mengambil analit yang tertahan ini dan bermanfaat jika analit yang dituju berkadar rendah. strategi kedua adalah dengan mengusahakan supaya analit yang tertuju keluar (terelusi), sementara senyawa pengganggu tertahan pada penyerap yang dipakai .
2.8. Spektroskopi Serapan Atom (SSA)
Gambar 2.3. Spektrokopi Serapan Atom (SSA)
SSA juga merupakan teknik analisa yang banyak digunakan untuk menentukan kadar unsur-unsur logam dalam sampel penelitian. Teknik ini sangat tepat untuk menganalisis unsur-unsur pada logam dalam sampel penelitian pada konsentrasi yang rendah dan tidak banyak memerlukan perlakuan pendahuluan. Prinsip penentuan metode ini didasarkan pada penyerapan energi radiasi oleh atom-atom netral pada keadaan dasar, dengan panjang gelombang tertentu yang menyebabkan tereksitasinya dalam berbagai tingkat energi. Keuntungan penggunaan SSA adalah analisanya peka, teliti, cepat dan pengerjaannya relatif sederhana, dengan tidak diperlakukannya proses-proses pemisahan dan logam yang dianalisa terhadap logam lain yang ada dalam larutan.Pemilihan panjang gelombang maksimum (λ maksimum) yang tepat, pengaturan nyala yang optimum, serta penggunaannya sumber radiasi dari unsur tertentu akan diperoleh hasil dengan selektivitas yang tinggi. Dengan membandingkan absorban larutan sampel dengan absorban larutan standart pada kurva kalibrasi dari larutan standart yang berada garis lurus (Suharta, 2005). Persamaan dari regresi linier yaitu :
y = bx + a dimana :
y = absorban x = konsentrasi
tertentu. Hubungan antara absorban dan konsentrasi dikemukakan oleh Lambert Beer dengan rumus sebagai berikut:
A = log I0/It = log I/T = a.b.c
dimana: A = absorban
I0 = intensitas cahaya yang masuk
It = intensitas cahaya yang keluar a = absortivitas
b = tebal medium pengadsorpsi
2.9. Hipotesis Hipotesis Penelitian
Berdasarkan latar belakang masalah dan tujuan penelitian yang dikemukakan dalam penelitian ini maka hipotesis dalam penelitian ini adalah : H0 =Tidak ada pengaruh waktu alir terhadap efektifitas dan selektifitas adsorben
hibrid silika kitosan pada simultan ion logam Ni(II) dan Cd(II) dengan metode ekstraksi fase padat.
Ha = Ada pengaruh waktu alir terhadap efektifitas dan selektifitas adsorben hibrid
BAB III
METODOLOGI PENELITIAN
3.1. Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Jurusan Kimia FMIPA Universitas Negeri Medan, Jln. Williem Iskandar Pasar V Medan Estate.Lokasi penelitian ini telah ditetapkan karena telah menggunakan alat-alat dan bahan-bahan yang telah di sediakan di dalam laboratorium. Pengukuran secara SSA dilakukan di Balai Riset dan Standarisasi Nasional, Jalan Sisingamangaraja, Medan.Penelitian inidilakukan selama 4 (empat) bulan yang di mulai dari bulan April 2014 hingga Agustus 2014.
3.2.Alat dan Bahan
Peralatan-peralatan yang digunakan dalam penelitian ini adalah oven,furnace, ayakan ukuran 200 mesh, hotplate dan stirer,alat penggerus (lumpang dan mortar), desikator, Kolom EFP, peralatan gelas, sudip, peralatan plastik, peralatan analisis yaitu SSA.
Bahan-bahan kimia yang dilakukan dalam penelitian ini adalah adsorben hibrid silika kitosan, HCl 6M, HCl 3M,NaOH 3,5%, NaOH 60%, akuabides, akuades, metanol 70%, larutan multilogam Ni(NO3)2.6H2O, Cd(NO3)2.6H2O.
3.4 Prosedur Penelitian
3.3.1. Preparasi Natrium Silika Dari Sekam Padi
Proses pembuatan larutan natrium silika diawali dengan penyiapan bahan dasar yaitu sekam padi. Sekam padi dibersihkan dan dikeringkan, kemudian difurnace pada suhu 7000C selama 3 jam. Sekam padi yang sudah menjadi abu
sekam padi kemudian digerus, dan diayak pada ayakan 200 mesh. Selanjutnya abu sekam padi sebanyak 20,003 gram direaksikan dengan HCl 6M sebanyak 120 mL, dan disaring hingga pH netral. Endapan yang diperoleh dioven pada suhu 1200Cselama 2 jam. Endapan ditimbang, dilebur dengan NaOH dan diuapkan
hingga mengental. Selanjutnya difurnace selama 30 menit pada suhu 5000C, dan
ditambahkan dengan aquades sebanyak 200 mL, kemudian didiamkan semalaman. Larutan yang terbentuk disaring. Larutan ini dinamakan larutan natrium silika. (Simatupang,2011)
3.3.2. Preparasi Kitosan dari Kulit Udang
Pada tahap persiapan, limbah kulit udang dicuci dengan air lalu dikeringkan di dalam oven dengan temperatur 65oC selama 4 jam. Setelah kering,
kulit udang dihancurkan di dalam blender hingga halus. Selanjutnya adalah tahap demineralisasi. Serbuk hasil blender kulit udang bersih yang diperoleh diperlakukan dengan HCl 1 N; 1: 5 (w/v), lalu diaduk selama 3-4 jam pada suhu 65oC untuk menghilangkan mineral-mineral. Kemudian dilakukan penyaringan
dan pencucian sampai netral lalu dikeringkan dalam oven pada suhu 65oC.
Selanjutnya dilakukan tahapan deproteinasi dengan 3,5 % NaOH; 1 : 10 (w/v) selama 4–5 jam pada suhu 65oC sambil diaduk. Lalu disaring dan dicuci
dengan air sampai netral. Kemudian dilakukan tahapan deasetilase. Kitin yang diperoleh dari hasil isolasi tersebut direfluks (deasetilasi) dengan 50 % NaOH; 1 : 10 (w/v) sambil diaduk pada suhu 100oC selama 4 jam. Lalu didinginkan dan
dicuci dengan air sampai netral.Lalu dikeringkan dalam oven pada suhu 65-70oC.
Produk akhir dari tahapan di atas disebut kitosan.(Simatupang,2011)
Proses sintesis hibrid silika kitosan (HSK) diawali dengan penyiapan bahan larutan natrium silikat sebanyak 20 mL dan kitosan sebanyak 0,4 gram (4%). Berdasarkan penelitan Simatupang (2013), menunjukkan bahwa hasil karakterisasi optimum adsorbsi kitosan adalah 4% didasarkan padaluas area 163,171m2/g secara SAA (Surface Area Analyser) yang dimiliki paling besar
sehingga kemampuan untuk menyerap lebih baik.
Kitosan 4 % dilarutkan dalam asetat 2% sebanyak 10 mL (Sri, 2013). Pada pembuatan hibrid silika kitosan natrium silikat dicampurkan secara perlahan ke dalam kitosan dalam asetat 2% sambil ditetesi HCl 3M secara perlahan, hal ini bertujuan untuk pembentukan gel hingga pH larutan netral. Larutan yang terbentuk didiamkan semalaman, kemudian dicuci dengan aquades, dioven hingga kering pada suhu700C. Hibrid silika kitosan yang telah kering digerus kemudian
diayak 200 mesh.
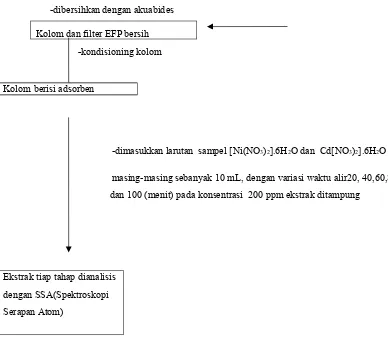
3.3.4. Preparasi Kolom EFP dan Loading Sampel
Kolom dan filter dibersihkan terlebih dahulu dengan menggunakan akuabides sehingga bersih dan kering.Setelah itu dilakukan proses kondisioning kolom yaitu sebanyak 0,5 gram hibrid silika kitosan ditempatkan ke dalam botol plastik dan ditambahkan 5 mL metanol 70% kemudian dihomogenkan. Setelah homogen adsorben dimasukkan ke dalam kolom EFP sampai kondisi yang sesuai menempati kolom dan homogen.
Gambar 3.1. Gambar Kolom EFP (Simatupang, 2011)
Selanjutnya proses loading sampel, larutan logam Ni(NO3)2.6H2O,Cd(NO3)2.6H2Odimasukkan ke dalam kolom EFP dengan
melakukan variasi waktu alir (20menit, 40menit, 60menit, 80menit, 100menit). Larutan multilogam dialirkan.Hasil larutan yang mengalir dari tiap-tiap perlakuan ditampunguntuk dianalisis dengan metode Spektroskopi Serapan Atom (SSA).
Bagan Prosedur Kerja Pengaruh Waktu Alir Terhadap Efektifitas dan Selektifitas Adsorben Hibrid Silika Kitosan Pada Simultan Ion Logam Ni(II) dan Cd(II) dengan Metode Ekstraksi Fase Padat (EFP).
-ditambah 5 mL metanol -dihomogenkan
-dimasukkan dalam
Kolom (homogen) Kolom dan filter EFP (ukuran panjang 30cm
dan diameter 1,5inchi)
-dibersihkan dengan akuabides
Kolom dan filter EFP bersih
-kondisioning kolom
-dimasukkan larutan sampel [Ni(NO3)2].6H2O dan Cd[NO3)2].6H2O
masing-masing sebanyak 10 mL, dengan variasi waktu alir20, 40,60,80,
dan 100 (menit) pada konsentrasi 200 ppm ekstrak ditampung
Gambar 3.2.Bagan Prosedur Kerja Pengaruh Waktu Alir Terhadap Efektifitas dan Selektifitas Adsorben Hibrid Silika Kitosan Pada Simultan Ion Logam Ni(II) dan Cd(II) dengan Metode Ekstraksi Fase Padat (EFP). Kolom berisi adsorben
Ekstrak tiap tahap dianalisis
dengan SSA(Spektroskopi
BAB IV
HASIL DAN PEMBAHASAN
Dalam bab ini disajikan hasil penelitian yang telah dilakukan dan pembahasannya tentang pembuatan adsorben hibrid silika kitosan serta bagaimana efektifitas dan selektifitas adsorben hibrid silika kitosan untuk menyerap logam Ni(II) dan Cd(II) secara simultan dengan menggunakan metode Ekstraksi Fase Padat (EFP) dan Spektroskopi Serapan Atom (SSA).
4.1. Hibrid Silika Kitosan Melalui Proses Sol - Gel
Proses sintesis hibrid silika kitosan (HSK) diawali dengan penyiapan bahan larutan natrium silikat sebanyak 20 mL dan kitosan sebanyak 0,4 gram (4%). Berdasarkan penelitan Simatupang(2013), menunjukkan bahwa hasil karakterisasi optimum adsorbsi kitosan adalah 4% didasarkan pada luas area 163,171m2/g secara SAA (Surface Area Analyser) yang dimiliki paling besar
sehingga kemampuan untuk menyerap lebih baik.
Kitosan 4 % dilarutkan dalam asetat 2% sebanyak 10 mL (Sri, 2013). Pada pembuatan hibrid silika kitosan natrium silikat dicampurkan secara perlahan ke dalam kitosan dalam asetat 2% sambil ditetesi HCl 3M secara perlahan, hal ini bertujuan untuk pembentukan gel hingga pH larutan netral. Larutan yang terbentuk didiamkan semalaman, kemudian dicuci dengan aquades, dioven hingga kering pada suhu700C. Hibrid silika kitosan yang telah kering digerus kemudian
diayak 200 mesh.
menyerap dengan baik. Sedangkan jika berat adsorben melebihi 0,25-0,75 gram maka daya adsorpsi adsorben akan mengalami penurunan (Sihombing, 2011). Sampel yang merupakan campuran logam Ni(II) dan Cd(II) masing-masing sebanyak 10 mL pertahapan dimasukkan ke dalam kolom dengan variasi waktu alir 20 menit, 40 menit, 60 menit, 80 menit, 100 menit. Berdasarkan faktor-faktor yang mempengaruhi proses adsorpsi, waktu alir merupakan faktor yang sangat mempengaruhi dimana kesetimbangan adsorpsi ion logam tercapai setelah lebih kurang 1 jam sehingga situs aktif adsorben sudah jenuh dengan molekul adsorbat dan kenaikan konsentrasi adsorbat relatif tidak meningkatkan jumlah logam yang teradsorpsi (Emma, 2010). Ekstrak yang telah diperoleh ditampung, kemudian dianalisis dengan SSA.
4.3. Kurva Kalibrasi
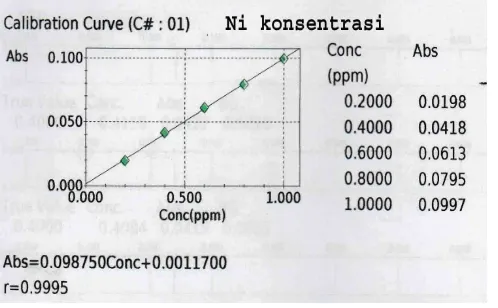
Kurva kalibrasi diperoleh dari hasil pengukuran larutan standar yang mengandung ion logam Ni(II) dan Cd(II) dengan mengukur absorbansinya pada panjang gelombang 232,0 nm untuk logam Ni(II) dan 228,8 nm untuk logam Cd(II) dan pada konsentrasi 0.2000 ppm, 0,4000 ppm, 0,6000 ppm, 0,8000 ppm, dan 1,0000 ppmdengan menggunakan spektrofotometer serapan atom.
Kurva kalibrasi untuk logam Ni(II) ditunjukkan pada gambar 4.1 berikut :
Gambar 4.1. Kurva Kalibrasi Logam Ni(II)
absorbansinya.Kurva kalibrasi menunjukkan hubungan antara absorbansi dan konsentrasi baku sehingga diperoleh persamaan regresi linier. Persamaan regresi ini dipakai untuk menghitung kadar dalam sampel (Rohman, 2007). Nilai absorbansi maksimum yaitu 0,0997 pada konsentrasi 1.0000 ppm.
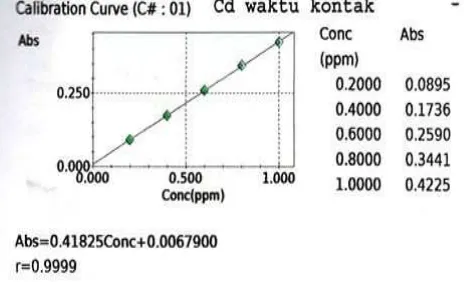
Kurva kalibrasi untuk logam Cd(II) ditunjukkan pada gambar 4.2 berikut :
Gambar 4.2. Kurva Kalibrasi Logam Cd(II)
Persamaan regresi Cd(II) yaitu absorbansi = 0.41825Conc + 0.00679 dengan nilai r = 0.9999 merupakan garis linear, maka persamaan tersebut dapat digunakan untuk menentukan konsentrasi sampel Cd(II) berdasarkan harga absorbansinya.Berdasarkan kurva kalibrasi diperoleh harga absorbansi maksimum yaitu 0,4225 pada konsetrasi 1.0000 ppm.
4.4. Pengukuran Sampel Ni(II) Secara SSA
Untuk menentukan dan mengetahui daya adsorpsi hibrid silika kitosan dalam mengatasi logam berat Ni(II), terlebih dahulu harus mengetahui hasil pengukuran pada SSA yaitu:
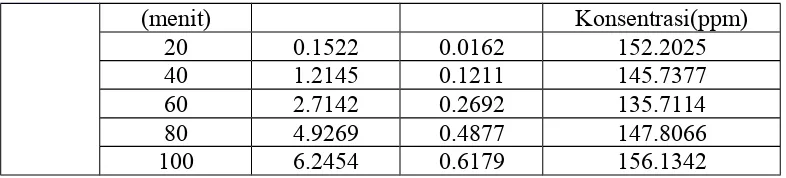
Tabel 4.1. Hasil Pengukuran Logam Ni(II) Secara SSA
(menit) Konsentrasi(ppm)
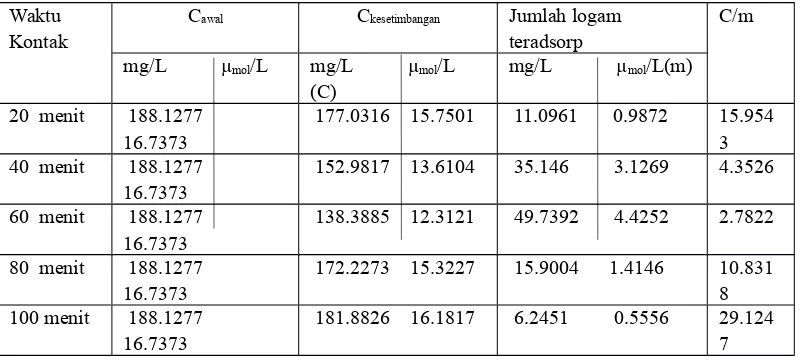
Tabel 4.1 di atas menjelaskan bahwa konsentrasi, absorbansi, dan aktual konsentrasi pada waktu 60 menit berada pada nilai yang terkecil untuk actual konsentrasi dibandingkan pada waktu alir pada 20, 40, 80, dan 100 menit. Aktual konsentrasi pada waktu 60 menit akan mempengaruhi jumlah logam yang teradsorp, nilai aktual konsentrasi merupakan nilai yang terkecil, sedangkan jumlah logam yang teradsorp menempati jumlah tertinggi. Data selengkapnya tentang hasil kajian adsorpsi menggunakan teknik kolom EFP dapat terlihat pada Tabel 4.2 berikut ini:
Tabel 4.2. Hasil Kajian Adsorpsi Menggunakan Teknik Kolom EFP Terhadap Logam Ni(II).
Dari Tabel 4.2 menunjukkan bahwa waktu alir sebanding dengan jumlah logam yang teradsorp, yaitu seiring bertambahnya waktu alir semakin banyak jumlah logam yang teardsorp, tetapi mengalami titik yang maksimal pada waktu 60 menit. Pada waktu alir 20 menit dan 100 menit jumlah logam Ni yang teradsorp semakin kecil, dan jumlah logam Ni yang paling sedikit teradsorp berada pada waktu alir 100 menit.
Hasil pengukuran yang menunjukkan nilai absorbansi dan aktual konsentrasi pada logam Cd(II) dengan variasi waktu alir 20, 40, 60, 80, dan 100 menit dapat terlihat pada Tabel 4.3 di bawah ini :
Tabel 4.3. Hasil pengukuran logam Cd(II) secara SSA WaktuKontak
Dari Tabel 4.3 di atas menjelaskan bahwa nilai konsentrasi dan absorbansi serta aktual konsentrasi berbanding lurus, semakin tinggi konsentrasi semakin tinggi nilai absorbansi demikian juga nilai aktual konsentrasi.
Berdasarkan nilai aktual konsentrasi yang diperoleh dari hasil pengukuran SSA dapat dikaji jumlah logam Cd yang teradsorp pada masing-masing waktu alir. Data hasil kajian adsorpsi disajikan pada Tabel 4.4 berikut ini :
Berdasarkan tabel di atas dapat dilihat bahwa penambahan waktu alir berpengaruh terhadap jumlah logam Cd yang teradsorp. Jumlah logam yang teardsorp pada alir 20 menit adalah 11,0961 mg/L, sedangkan dengan penambahan waktu alir 20 menit atau pada waktu alir 40 menit hasil jumlah logam yang teradsorp meningkat hingga lebih dari 100% yaitu 35,146 mg/L. Jumlah logam yang teradsorp pada waktu 60 menit merupakan jumlah yang paling besar dibandingkan dari semua waktu alir, penambahan waktu alir berikutnya pada menit ke 80 jumlah logam yang teradsorp semakin kecil, dan pada waktu 100 menit jumlah logam Cd yang teradsorp semakin sedikit. Dari data di atas dapat dilihat bahwa pada waktu 60 menit merupakan waktu alir yang optimum untuk menyerap logam Cd, semakin tinggi waktu alir yang digunakan tidak meningkatkan jumlah logam yang teradsorp.
Pada waktu alir 60 menit merupakan waktu dimana kesetimbangan adsorpsi ion logam tercapai. Hal ini disebabkan situs aktif sudah jenuh dengan molekul adsorbat dan kenaikan konsentrasi adsorbat relatif tidak meningkatkan jumlah logam yang teardsorpsi (Lisnawaty, 2007).
0 20 40 60 80 100 120 0
2 4 6 8 10 12
0.99 3.13
4.45
1.41
0.56 7
8 10
8
6
Ni(II) Cd(II)
Gambar 4.3. Grafik Waktu Alir versus Ion logam yang Teradsorp (µmol/L).
Grafik di atas menjelaskan bahwa dengan metode ekstraksi fase padat dan pengukuran secara SSA logam Ni lebih banyak teradsorp dibandingkan dengan logam Cd. Proses adsorpsi yang dilakukan merupakan sistem simultan logam, sehingga pada saat interaksi akan terjadi kompetisi diantara ion logam divalen tersebut untuk menempati situs aktif pada adsorben (Simatupang, 2007).
Berdasarkan hasil perhitungan kajian adsorpsi menggunakan teknik kolom EFP terhadap logam Ni(II) terlihat bahwa pada waktu 20 menit (7,1012µmol/L) dan
40 menit (8,2025µmol/L), jumlah logam yang teradsorp semakin kecil, halnya
pada waktu 80 menit (7,8501µmol/L) dan 100 menit (6,4314mol/). Sedangkan
jumlah logam teradsorp yang paling banyak berada pada waktu 60 menit yaitu (9,9106 µmol/L) pada waktu alir 60 menit merupakan waktu penyerapan logam
yang optimum. Hasil perhitungan kajian adsorpsi menggunakan teknik kolom EFP terhadap logam Cd(II) terlihat bahwa pada waktu 20 menit (0,9872µmol/L)
dan 40 menit (3,1269µmol/L) jumlah logam yang teradsorp semakin kecil, sama
halnya pada waktu 80 menit (1,4146µmol/L) dan pada 100 menit (0,556µmol/L).
Jumlah logam teradsorp yang paling banyak berada pada waktu 60 menit yaitu (4,4252µmol/L) pada waktu alir 60 menit merupakan waktu penyerapan logam
yang optimum. Dari hasil pengukuran pada waktu optimum yaitu 60 menit logam Ni lebih banyak teradsorp dibandingkan dengan logam Cd dan memiliki selisih 5,4854 µmol/L. Waktu optimum tercapai bilamana peningkatan logam yang
teradsorpsi mencapai titik maksimalnya, sehingga penambahan waktu alir tidak akan memberikan perubahan yang signifikan terhadap logam yang teradsorp (Sri, 2010)
(Simatupang,2007). Merujuk dari penelitian (Boston,2014) tentang “Optimalisasi pH Untuk Meningkatkan Efektivitas dan Selektivitas Adsorben Hibrid Silika Kitosan Pada Simultan Ion Logam Divalent Zn(II) dan Cd(II) Dengan Metode Ekstraksi Fase Padat” adalah memproleh pH Optimum dari Hibrid Silika Kitosan adalah pada pH 6 dengan konsentrasi adsorbat 200ppm.
Berdasarkan prinsip Hard Soft Acid and Bases (HSAB) yang dikembangkan Pearson bahwa kelompok asam-asam keras akan menyenangi kelompok basa-basa keras, sedangkan kelompok asam-asam lunak akan menyenangi basa-basa lunak. Gugus yang paling berperan dalam proses adsorpsi adalah gugus silanol (Si-OH) yang merupakan situs basa keras. Menurut Martell dan Hancock (1996) ukuran jari-jari kompleks [Ni(H2O)6]2+ yaitu 2,06 Å,
sedangkan [Cd(H2O)6]2+ yaitu 2,30 Å (Scott, 1993). Dengan demikian jelaslah
bahwa jari-jari kompleks akua oktahedral [Ni(H2O)6]2+ < [Cd(H2O)6]2+, dimana
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Setelah melakukan pengumpulan data dan pembahasan dari hasil penelitian ini maka dapat dikemukakan kesimpulan sebagai berikut :
1. Berdasarkan variasi waktu alir diperoleh penyerapan adsorben hibrid silika kitosan yang optimum berada pada waktu alir 60 menit, dengan pH Optimum adalah pH 6 (Boston,2014) dan jumlah adsorben hibrid silika kitosan yang digunakan adalah 0,5 gram.
2. Pada waktu alir 60 menit, jumlah ion logam Ni(II) teradsorp adalah sebesar 9,9106 µmol/L dan jumlah ion logam Cd(II) adalah sebesar 4,4252
µmol/L.
3. Adsorben hibrid silika kitosan dengan menggunakan metode ekstraksi fase padat efektif untuk menyerap ion logam seperti Ni(II) dengan tingkat persentase 30% dan Cd(II) 26,4%.
4. Adsorben hibrid silika kitosan efektif digunakan pada kolom berdiameter 1,5 inchi dan panjang 30cm dengan metode ekstraksi fase padat
5.2 SARAN
1. Pada saat pembuatan adsorben hibrid silika kitosan larutan yang terbentuk tidak boleh terlalu gel.
2. Kolom yang digunakan pada saat ekstraksi sebaiknya merupakan kolom yang khusus untuk ekstraksi, agar hasil yang diperoleh maksimal.
DAFTAR PUSTAKA
Agustina, Sri., (2013). Pembuatan Kitosan Dari Cangkang Udang Dan Aplikasinya Sebagai Adsorben Untuk Menurunkan Kadar Logam Cu. Seminar Nasional FMIPA 2013, IKIP Mataram.
Airoldi, C., dan Arakaki, L.N.N., 2001, Immobilization of Ethylenesulfide on Silica Surface Through Sol-Gel Process and Some Thermodynamic Data of Divalent Cation Interaction, Polyhedron, 20, 929-936.
Atkins, PW., (1990), Kimia Fisika edisi ke IV, Erlangga, Jakarta
Bhatia, R.B., and C.J. Brinker, 2000,Chem.Mater., 12, 2434 – 2441. Boston, (2014). Optimalisasi pH Untuk Meningkatkan Efektivitas dan Selektivitas
Adsorben Hibrid Silika Kitosan Pada Simultan Ion Logam Divalent Zn(II) dan Cd(II) Dengan Metode Ekstraksi Fase Padat, Skripsi UNIMED,Medan.
Brinker, C.J., dan Scherer, W.J., Sol-Gel Science:The Physics and Chemistry of Sol-Gel Processing, Academic Press, San Diego.
Cooke, M, Jackson, A., Nickless, G. And Robert (1997), Distribution Spesiation of Cadmium intheTerestial, Helix Asperse, Bull, Environ, Conton, Toxicol. Endang Widjajanti Laksono, dkk.2008, Jurnal Penelitian Saintek,Koadsorpsi
Cr-Fe oleh Kitosan Vol. 13, No. 1, April 2008: 95-109. Staf Pengajar FMIPA UNY.
Eksiklopedia Nasional Indonesia, (1991), Zink, PT.Cipta Adi Pustaka, Jakarta.Fatha, A., (2007).
Fahmawati,dkk Kajian Kinetika Adsorpsi Cd (II), Ni(II), dan Mg(II) pada Silika Gel Termodifikasi 3-mercapto-1,2,4-triazol, Alchemy Volume 3 No.2: 22-28 Surakarta:UNS 2004.
Fahmiati, Nuryono dan Narsito, 2006, Thermodinamics adsorpstion of Cd(II), Ni(II) and Mg(II) on 3-Mercapto-1,2,4-Triazole Immobilized Silica Gel, Indo. J. Chem., 6(1), 52-55
Jal, P.K., Patel, S., dan Misrha, B.K., 2004, Chemical Modification of Silica by immobilization of Fungsional Groups for Extractive Concentration of Metal Ions, Talanta, 62, 1005-1028.
Kristbergsson, (2003), Application Adsorption For Heavy MetalSolid phases And Extraction, Thesis, 65: 637-643.
Lestari, Sri., (2010), Pengaruh Berat dan Waktu Kontak Untuk Adsorpsi Timbal(II) Oleh Adsorben Dari Kulit Batang Jambu Biji.Jurnal Kimia Mulawarman Volume 8 No 1 Tahun 2010, ISSN 1693-5616. Kimia FMIPA UnMul, Samarinda.
Journal Chemistry Technology Biotechol 66: 92-198.
Nuryono, E.S. Kunarti, dan Narsito, 2000, Jurnal Kimia Sains dan Aplikasi, III(2), 41 –51
Ościk, J., 1982, “Adsorption”, John Wiley & Sons, New York.
Santos, E.A. Pagono, R.L., Simoni, J.A., Airoldi, C., Cestari, A.R., and Viera, E.F.S., 2001, The Influence of the Counter Ion Competition and Nature of Solvent on the Adsorption of Mercury Halides on SHmodified
Silica Gel, Colloid and Surface, 201: 25-282
Sembodo, S.T.B., (2006), Model Kinetika Langmuir untuk Adsorpsi Timbal pada Abu Sekam Padi, FT, UNS, Ekuilibrium Vol.5, No.1., 28-33
Sihombing, (2011), Penentuan Massa Adsorben Dalam Penyerapan Logam Berat, Skripsi UNIMED, Medan.
Simatupang,Lisnawaty, (2007), Interaksi Simultan Antara Mg(II), Zn(II), Ni(II), Cd(II),dan 3-Aminopropiltrimetoksisilan yang Dimobilisasikan pada
Simatupang Lisnawaty, Dewi S.R.,Susanti N., (2011), Pengembangan Metode Alir Menggunakan Silika Gel Dari Sekam Padi Untuk Mengatasi Limbah Cair Industri Logam, Laporan Akhir Research Grant Unimed, Medan Simatupang,Lisnawaty,(2013), Imobilisasi kitosan pada silika gel dan
karakterisasinya meliputi struktur, gugus fungsi dan luas pori, Laporan Akhir Research Grant Unimed, Medan
Sriyanti, Taslimah, Nuryono dan Narsito,2004, Selektivitas Silika Gel Termodifikas Gugus Tiol Untuk Adsorpsi Kadmium(II) dan Tembaga(II), Proceeding Seminar Nasional Hasil Penelitian MIPA 2004, FMIPA Undip,Semarang.
Sudarwin, (2008), Analisis Spasial Pencemaran Logam Berat (Pb dan Cd) pada Sedimen Aliran Sungai dari Tempat Pembuangan Akhir (TPA) Sampah Jati barang Semarang, Tesis, Program Pasca Sarjana, Universitas Diponegoro, Semarang.
Sugiyarto, KH, 2000, Kimia Anorganik I, Jurdik Kimia, FMIPA UNY Yogyakarta.
Sugita, P., (2009), Kitosan : Sumber Biomaterial MasaDepan, IPB Press, Bogor.
Vogel, (1985), Buku Teks Analitik Anorganik Kualitatif Makro dan Semimikro, PT.Kalman Media Pusaka, Jakarta.
Lampiran 1. Perhitungan Pembuatan Larutan
1. Larutan NaOH 3,5% 3,5
100 x 500 = 17,5 gram
2. Larutan HCl 3 M Dik : HCl = 37% Bj = 1,19 Dit : M...???
M =
BM xBjx10
M =
36,5 37x1,19x10
= 12,06M
VI.MI = V2.M2 VI.12,06 = 500.3
VI =
12,06 500X3
= 124,378 mL = 124,4 mL (dibulatkan) 3. Larutan NaOH 60%
100
4. Pembuatan Larutan Induk Ni2+
0,495 gram Ni(NO3)2.6H2O dan dilarutkan dengan aquades dan dimasukkan ke
dalam labu ukur 100 mL lalu ditambahkan aquades sampai tanda batas lalu
larutan induk Ni2+ 1000 ppm kemudian dimasukkan ke dalam labu ukur 100 mL
lalu ditambahkan aquades sampai tanda batas lalu dihomogenkan. 6. Pembuatan Larutan Induk Cd2+
1000 ppm Perhitungan :
mg Cd(NO3)2.4H2O = Mr Cd(NO3)2.4H2O x mg Cd
= 308,47 x 100mg
dimasukkan ke dalam labu ukur 100 mL lalu ditambahkan aquades sampai tanda batas lalu dihomogenkan.
Larutan standar Cd2+200 ppm dibuat dengan memipet sebanyak 20
mL larutaninduk Cd2+ 1000 ppm kemudian dimasukkan ke dalam labu
ukur 100 mL lalu ditambahkan aquades sampai tanda batas lalu dihomogenkan.
% Cd(II) = Cawal - Cakhir x 100%
Cawal
= 188,1277ppm – 138,3885 ppm x 100% 188,1277 ppm
= 26,4%
Dimana : Cawal = konsentrasi awal logam (ppm)
Cakhir = konsentrasi kesetimbangan logam pada waktu alir 60 menit
(ppm)
Lampiran 3. Kurva Kalibrasi A. Kurva Kalibrasi Untuk Ni
Gambar 1. Alat – alat yang Digunakan Selama Penelitian
Gambar 2. Bahan – bahan yang Digunakan Selama Penelitian
Kertas Saring Whatman Ayakan 200 mesh
Botol Semprot
Cawan Porselin Mortar
dan Alu
Gelas Ukur 250 mL
Kristal NaOH Abu Sekam
Instrumen Spektroskopi Serapan Atom (AAS)
Lampiran 4. (Lanjutan) Dokumentasi Penelitian
Gambar 1. Hibrid silika kitosan yang telah kering
,
(c)