I
PENDAHULUAN
1.1 Latar Belakang
Cendana (Santalum album L.) merupakan tanaman tahunan yang banyak tumbuh di Indonesia bagian timur dan Negara Timor Leste. Tanaman ini berpotensi serta memiliki nilai ekonomi tinggi dikarenakan memiliki kandungan minyak atsiri yang tinggi serta produksi kayu teras yang tinggi (Baskin et al. 2004). Keadaan tanaman cendana dapat dikatakan hampir punah sehingga digolongkan sebagai salah satu tanaman yang dilindungi (Wawo 2008). International Union for Conservation of Nature (Vié et al. 2008) pun menyatakan bahwa tanaman cendana merupakan tanaman dengan kategori rawan mengalami kepunahan di alam akibat kebakaran hutan, penebangan liar, dan budidayanya yang tergolong sulit.
Menurut Subasinghe (2013) benih cendana membutuhkan waktu perkecambahan yang lama yaitu berkisar 2-3 bulan untuk siap ditanam. Annapurna et al. (2004) menyatakan bahwa perkecambahan dan pertumbuhan tanaman cendana sangat lambat sehingga sering kali menjadi kendala bagi keberhasilan program persemaian dan pembibitan. Fenomena tersebut disebabkan oleh sifat dormansi benih cendana. Sifat dormansi benih cendana menurut Baskin et al. (2006) digolongkan sebagai dormansi morfofisiologi, yaitu embrio perlu mengalami pemanjangan terlebih dahulu sebelum akhirnya benih berkecambah atau patah dormansi. Selain itu Batabyal et al. (2014) menduga bahwa benih cendana memiliki tipe dormansi fisik akibat kulit benihnya yang keras.
Upaya mematahkan dormansi benih cendana telah banyak dilakukan, namun hasil yang diperoleh relatif belum memuaskan. Hasil penelitian Sutheesh et al. (2016) menunjukkan bahwa perlakuan perendaman benih cendana dengan menggunakan GA3 1000 ppm untuk mematahkan dormansi fisik menghasilkan perkecambahan 44.7% pada hari ke 128 setelah tanam dan perlakuan dengan H2SO4 selama 10 menit menghasilkan perkecambahan sebesar 18.3% selama 153 hari setelah tanam. (Dileepa et al. 2015) menyatakan bahwa perlakuan GA3 500 ppm menghasilkan perkecambahan dengan persentase 100% pada minggu ke 7 setelah tanam. Berdasarkan literatur tersebut, metode pematahan dormansi yang digunakan belum mampu mematahkan dormansi benih cendana dengan waktu yang lebih singkat, sehingga perlu adanya pengkajian metode baru yang lebih efektif dan cepat sebagai upaya dalam mematahkan dormansi benih cendana.
Ultrafine bubble water (air UFB) merupakan air yang mengunakan bubbles dengan diameter <10-6 nm (micro and nano bubble) dikarenakan memiliki ukuran yang kecil antara 100-400 nm UFB bersifat invisible (Liu et al. 2016).Hasil dari proses UFB ini disebut sebagai Air UFB (micro and nano bubbles). Gelembung halus yang terdapat di dalam air UFB dapat menyebabkan terbentuknya reactive oxygen species (ROS) lebih banyak (Liu et al., 2016). Peranan teknologi air UFB di bidang pertanian yaitu menggunakan air UFB yang berukuran 100-400 nm untuk mempercepat proses pertumbuhan tanaman dan khususnya pada benih dormansi fisik dan dormansi fisiologis dapat mempercepat proses perombakan cadangan makanan hingga proses munculnya radikula dan plumula lebih cepat (Liu et al. 2019).
2
Teknologi UFB dilaporkan cukup efektif untuk mematahkan domansi fisik pada benih saga, benih jati putih, benih padi, benih kedelai, dan dan benih sayur-sayuran (Iswara et al. 2018); (Siregar et al. 2020); mematahkan dormansi benih saga dengan nilai perkecambahan di atas 80% (Iswara et al. 2018). Benih jati putih dengan lama penyimpanan benih diatas satu tahun invigorasi dengan air UFB dapat meningkatkan viabilitas dan vigor dengan nilai perkecambahan >80 % (Siregar et al. 2020).
Media tanam sebagai salah satu penentu keberhasilan pembibitan cendana. Media yang baik merupakan media yang mampu menyediakan air dan unsur hara dalam jumlah yang cukup bagi pertumbuhan tanaman. Keberhasilan pembibitan harus diupayakan agar benih yang telah berkecambah dapat tumbuh normal menjadi tanaman dewasa. Hal ini sangat dipengaruhi oleh aerasi tanah, agregat tanah, kemampuan menahan air yang baik, dan ruang untuk perakaran yang cukup (Lunt et al. 2003).
Noor et al. (2019) menyatakan bahwa pembibitan benih nyamplung dapat dilakukan dengan menggunakan berbagai jenis media tanam seperti pasir, serbuk gergaji, arang sekam (biochar), cocopeat, zeolit, vermikulit, dan perlit. Salah satu bahan yang banyak digunakan untuk pembibitan tanaman adalah cocopeat. (Irawan et al. 2014) menyatakan bahwa cocopeat memiliki kandungan unsur hara makro dan mikro yang dibutuhkan oleh tanaman, seperti Kalium (K), Fosfor (P), Kalsium (Ca), Magnesium (Mg), dan Natrium (Na). Cocopeat dapat menahan kandungan air dan unsur kimia pupuk, serta menetralkan kemasaman tanah. Sifat tersebut menyebabkan cocopeat dapat digunakan sebagai media yang baik untuk pertumbuhan tanaman dan media tanam bibit di rumah kaca dan persemaian (Prasetyawan 2009).
Arang sekam sangat baik diaplikasikan pada lahan pertanian untuk membantu menyuburkan tanah. Menurut (Heriyanto dan Siregar, 2004) Arang sekam berfungsi sebagai penyimpan sementara unsur hara dalam tanah, sehingga tidak mudah tercuci oleh air dan akan sangat mudah dilepaskan ketika dibutuhkan atau diambil oleh akar tanaman. Arang sekam bersifat porous, ringan, tidak kotor, dan cukup dapat menahan air. Penggunaan arang sekam cukup meluas dalam budidaya tanaman hias maupun sayuran terutama budidaya secara hidroponik (Lehmann et al. 2006) Arang sekam berfungsi sebagai kondisioner tanah yang dapat ditambahkan ke dalam tanah dengan tujuan untuk meningkatkan fungsi tanah, merombak unsur hara agar dapat diserap oleh tanaman, serta menahan air dan nutrisi menjadi lebih tersedia bagi tanaman (Glaser et al. 2002).
Beberapa penelitian melaporkan bahwa pertumbuhan bibit cendana pada fase pembibitan sangat lambat. Oleh karena itu, berbagai upaya untuk meningkatkan pertumbuhan bibit cendana di pembibitan masih terus dilakukan. Berdasarkan manfaat arang sekam dan cocopeat yang telah dijelaskan diatas, maka dalam penelitian ini diuji penggunaan arang sekam dan cocopeat untuk meningkatkan mutu bibit cendana.
3
1.2 Rumusan Masalah
Adapun perumusan masalah dari tanaman cendana yaitu mempunyai kulit benih yang keras juga dilapisi dengan lilin menyebabkan air susah untuk menembus kulit benih dengan menggunakan air ultrafine bubbles cepat mematahkan dormansi morfofisiologi benih cendana. Selain kulit yang keras bibit cendana juga pertumbuhannya lambat sehingga aplikasi dengan media arang sekam dan cocopeat dengan konsentrasi yang sesuai dapat meningkatkan vigor bibit cendana.
1.3 Tujuan
Tujuan penelitian ini adalah :
1. Menguji metode pematahan dormansi benih cendana yang efektif dengan teknologi Ultrafine Bubbles (UFB).
2. Menguji kombinasi media tanam dasar (pasir+tanah+kompos) dengan konsentrasi cocopeat dan arang sekam yang terbaik untuk meningkatkan vigor bibit tanaman cendana.
1.4 Manfaat
Penelitian ini diharapkan dapat bermanfaat dalam pengembangan ilmu pengetahuan dan teknologi perbenihan tanaman khususnya tanaman tahunan yang memiliki sifat dormansi morfofisiologis dan dormansi fisik.Informasi tentang teknologi air UFB dan potensi pengunaan generator untuk memproduksi air UFB diharapkan dapat bermanfaat di ilmu dan teknologi benih khususnya pada benih-benih yang bersifat dorman dan berkulit keras dan dormansi fisiologis. Penggunaan beberapa jenis media yaitu arang sekam dan cocopeat dan konsentrasi yang tepat untuk meningkatkan mutu benih cendana.
4
1.5 Ruang Lingkup
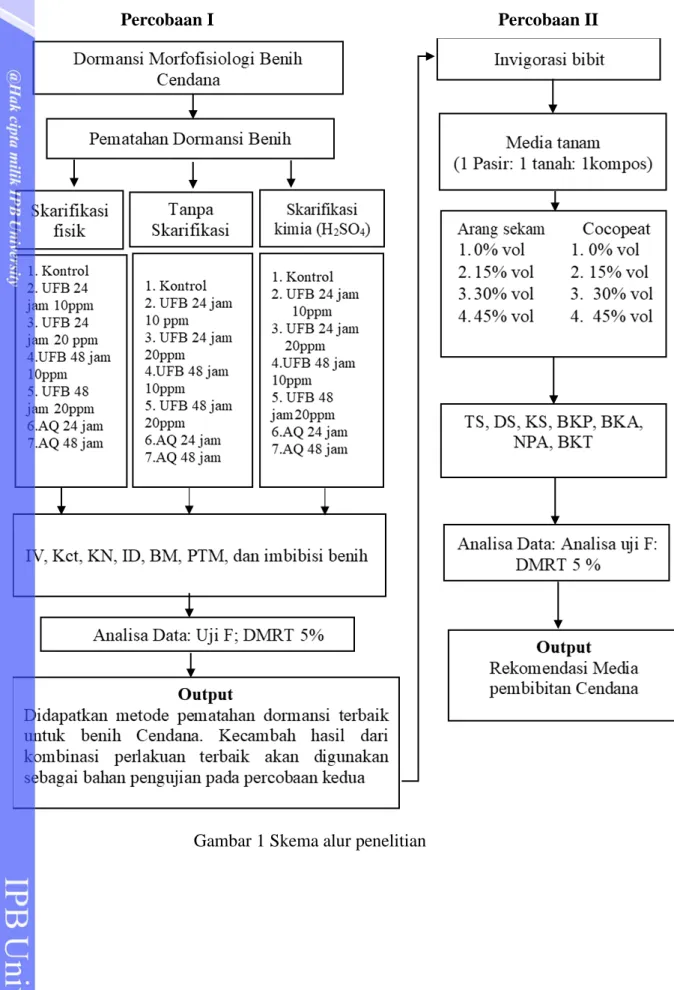
Percobaan I Percobaan II
5
II
TINJAUAN PUSTAKA
2.1 Tanaman Cendana
Tanaman cendana (Santalum album L) yang tumbuh di Negara Timor Leste dikenal sebagai pohon asli negara setempat yang dikenal dengan nama Ai kameli dan sendana dalam bahasa Melayu. Dalam dunia perdagangan cendana dikenal dengan nama sandalwood. Spesies cendana di Indonesia hanya satu yaitu Santalum album L, Menurut Rudjiman (1987) yang di acu dalam (Ridla et al. 2017) mengklasifikasikan cendana (Santalum album L.) sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Dicotyledonae Ordo : Santales Family : Santalaceae Genus : Santalum
Spesies : Santalum album Linn
2.2 Morfologi Tanaman Cendana
Cendana (Santalum album L) merupakan pohon berukuran sedang yang selalu hijau, tinggi rata-rata mencapai 12-15 m. Rahayu et al. (2003) menyebutkan diameter batang cendana sekitar 20-35 cm batangnya bercanbang banyak dan menghasilkan ranting-ranting yang banyak pula. Kulit batang berwarna putih keabu-abuan setelah dewasa kulitnya berubah warna menjadi cokelat. Pohon cendana mempunyai daun tunggal berbentuk elips sampai lanset dengan ujung yang runcing. Panjang daun 4-8 cm, lebar 2-4 cm dan panjang tangkai daun 1-1.5 cm. Kedudukan daun berhadapan kadang-kadang berseling dan tidak mempunyai daun penumpu. Tanaman cendana memiliki bunga majemuk dan jenis bunga monocious dimana dalam satu pohon dapat dijumpai jenis bunga jantan dan betina yang tersusun dalam bentuk malai dan terdapat di ujung tangkai atau ketiak daun (Gerson et al. 2014). Perkawinan bunga cendana dibantu dengan perantara angin dan serangga. Perkawinan antar bunga jantan dan betina bisa terjadi antar pohon dan terbentuk buah apabila ditinjau dari segi genetik kurang menguntungkan. Cendana pada umumnya berbunga pada umur 5 tahun dan berbuah setiap tahun. Tetapi ada beberapa pohon cendana yang tidak berbuah setiap tahun karena pengaruh biennial bearing. Musim berbunga di beberapa daerah di Indonesia pada umumnya terjadi pada bulan November sampai Desember, namun di Timor Leste musim berbunga pada bulan Desember sampai Januari dan musim berbungga selanjunya pada bulan Mei-Juli (Juliao dan Wijayanto 2011). Kebanyakan bunga cendana berukuran kecil, berwarna putih kehijau-hijauan sampai coklat kotor dan baunya sedap serta berkelamin dua.
6
2.3 Dormansi Morfofisiologi Pada Benih Cendana
Benih cendana memiliki komponen morfologi untuk dormansi dan dapat diklasifikasikan memiliki dormansi morfofisiologi sederhana yang tidak dalam yaitu selain mempunyai dormansi fisik kulitnya yang keras juga dormansi fisiologis yaitu embrionya yang kurang matang dan Panjang (Dileepa et al. 2015). Pematahan dormansi dengan skarifikasi mekanis memungkinkan kulit benih terluka sehingga dapat dilewati air dan terjadi proses imbibisi. Air masuk ke dalam benih menyebabkan aktivasi enzim, perombakan cadangan makanan, transpor molekul, peningkatan respirasi dan asimilasi, inisiasi pembelahan dan pembesaran sel, dan pemanjangan sel radikula diikuti munculnya radikula dari kulit benih dapat terjadi (Annisa1 et al. 2016). Nurmiaty et al. (2014) melaporkan bahwa skarifikasi mekanik dengan pelukaan gunting kuku menunjukkan viabilitas benih saga tertinggi, daya berkecambah sebesar 100%, dan kecepatan perkecambahan sebesar 23.22%. Hasil penelitian Juhanda et al. (2013) menyatakan skarifikasi mekanik dengan mengunting benih saga dan direndam ke dalam H2SO4 selama 10 dan 30 detik menghasilkan daya berkecambah 100%, hingga perlu ditindak lanjuti pada kasus benih cendana dengan mengamplas karena kulit bijinya juga keras.
Pematahan dormansi pada benih cendana dengan metode skarifikasi kimia dan stratifikasi menggunakan asam sulfat (H2SO4) dengan metode yaitu benih direndam terlebih dahulu kedalam asam sulfat selama 30 menit lalu dikecambahkan ke ruang suhu yang telah atur agar cepat memicuh untuk perkecambahan dapat menjadi alternatif untuk penelitian benih cendana karena benih cendana diduga dormansi morfofisiologi. Konsentrasi asam sulfat pekat dengan perendaman selama 40 menit menunjukkan bahwa benih saga mampu berkecambah dengan persentase kecambah sebesar 100%. Hal ini dikarenakan asam sulfat bekerja mempengaruhi impermeabilitas kulit benih sehingga kulit benih cendana menjadi permeable terhadap air (Junita Saila et al. 2016)
2.4 Ultrafine Bubbles Water
Air UFB mengacu pada semua gelembung dengan diameter di bawah 100 μm, dan dibagi menjadi 2, ada yang di atas 1 µm (gelembung mikro atau MB) dan UFB di bawah 1 µm. Air UFB lebih sulit diamati secara langsung karena ukurannya di bawah resolusi spasial mikroskop optik. Misalnya, dengan panjang gelombang λ = 600 nm, cahaya yang tersebar dari Air UFB lebih kecil dari sekitar λ / π yaitu, diameter <190 nm sehingga menjadi sangat lemah (Ushida et al. 2016). Beberapa penelitian sebelumnya berfokus pada campuran ultra-halus gelembung (UFB water yang mengandung gelembung berukuran submikrometer. Pada penelitian ini campuran air UFB dari air dan larutan gliserol dilewatkan melalui celah dan kapiler berukuran mikro dan penurunan tekanan yang dihasilkan dievaluasi dan dibandingkan dengan celah yang hanya untuk air dan gliserol berair saja. Pengamatan dilakukan pada sifat-sifat aliran dari aliran campuran gelembung halus. Penurunan tekanan yang diukur secara eksperimental untuk celah (≤51 μm) dan kapiler (≤81 μm) lebih sedikit untuk campuran pada air UFB dari pada untuk air dan gliserol berair saja. Fenomena ini dipertimbangkan dalam hal padaPerilaku antar muka dan dikaitkan dengan interaksi listrik antara lapisan ganda listrik dan air UF. Selanjutnya, pengamatan numerik untuk kondisi
7 dinding selip dilakukan dan hasil untuk campuran UFB sesuai dengan nilai prediksi untuk kondisi dinding selip (Ushida et al. 2016).
2.5 Reactive Oxygen Species
Reactive Oksygen Species (ROS) adalah produk alami dari metabolisme oksidatif seluler dan memainkan peran penting dalam modulasi kelangsungan hidup sel, kematian sel, diferensiasi dan pensinyalan sel. Elemen ROS yang signifikan secara biologis meliputi radikal bebas, seperti oksigen tunggal (1O2), superoksida (O2), hidroksil (HO), hidroperoksil (HO2), karbonat (CO3), peroksil (RO2), alkoksil peroxy nitrate (O2NOO), peroxy nitrous acid (ONOOH), peroxo monocarbonate (HOOCO2), nitric oxide (NO), dan hypochlorite (OCl) (Dayem et al. 2017).
ROS merupakan kelanjutan fenomena yang dimulai pada saat pasca panen dan memberikan efek dormansi pada benih. ROS itu sendiri berhubungan erat dengan hormon ABA dan GA (Bouteau et al. 2007). Semua ROS mampu bereaksi dengan membran, asam nukleat, protein dan enzim dan molekul kecil lainnya yang mengakibatkan kerusakan sel. ROS diproduksi terus menerus dalam tubuh manusia sebagai konsekuensi dari proses metabolisme normal. Jika radikal bebas tidak dinonaktifkan, tingkat kimianya dapat merusak semua jenis makromolekul seluler, termasuk protein, karbohidrat, lipid dan asam nukleat.
2.6 Aplikasi Beberapa Jenis Media Tanam
Media tanam yang baik adalah media yang mampu menyediakan air dan unsur hara dalam jumlah cukup bagi pertumbuhan tanaman. Hal ini dapat ditemukan pada tanah dengan tata udara yang baik, mempunyai agregat mantap, kemampuan menahan air yang baik dan ruang untuk perakaran yang cukup. Proses penanaman dapat dilakukan dengan menggunakan berbagai jenis media tanam seperti pasir, serbuk gergaji, arang sekam, cocopeat, zeolit, vermikulit dan (Farida et al. 2014). Serbuk sabut kelapa (cocopeat) adalah hasil sampingan dari proses pengambilan serat sabut kelapa. (Irawan dan Hidayah 2014) menyatakan bahwa kandungan hara yang terkandung dalam cocopeat yaitu unsur hara makro dan mikro yang dibutuhkan tanaman diantaranya adalah kalium, fosfor, kalsium, magnesium dan natrium. Cocopeat dapat menahan kandungan air dan unsur kimia pupuk serta menetralkan kemasaman tanah. Sifat tersebut menyebabkan cocopeat dapat digunakan sebagai media yang baik untuk pertumbuhan tanaman dan media tanam bibit di rumah kaca dan persemaian. Arang sekam dapat ditambahkan ke dalam tanah dengan maksud meningkatkan fungsi tanah, perombakan unsur hara dapat diserap oleh tanaman, menahan, dan menjadikan air dan nutrisi lebih tersedia bagi tanaman.
2.7 Tanaman Cendana Semi Parasit
Cendana merupakan jenis tanaman yang bersifat setengah parasit (semi parasit), sehingga membutuhkan tanaman inang seperti tanaman cabai inang primer dan tanaman Akasia inang sekunder untuk memasok beberapa unsur hara yang digunakan untuk pertumbuhan. Lebih lanjut menyebutkan bahwa unsur hara yang diambil dari inang adalah Nitrogen (N), Pospor (P), Kalium (K) dan asam amino, sedangkan unsur Kalsium (Ca) diambil sendiri dari dalam tanah. Sistem perakaran cendana adalah akar tungang yang jelas dengan banyak akar-akar cabang yang kuat. Akar yang muda mempunyai sedikit rambut akar. Akar cabang
8
bentuknya panjang dan ramping, mempunyai kemampuan menjelajah tanah sejauh 30-40 m dan mencapai inangnya (Rahayu et al. 2002).
Tanaman inang berfungsi sebagai peneduh ketika cendana masih dalam tingkat semai yakni mengunakan tanaman merambat. Parasitisme cendana dengan inangnya terjadi melalui kontak akar. Setelah kontak akar terjadi, maka nutrisi dari akar inang mengalir ke akar cendana. Parasitisme ini secara morfologi dapat dilihat dari adanya titik sambung akar. Kontak tersebut diawali dengan terbentuknya houstorium yang tumbuh pada bulu bulu akar cendana. Houstorium adalah modifikasi akar cendana yang menempel pada akar tanaman inang yang digunakan sebagai alat untuk menyerap unsur hara dari tanaman inangnya (Gerson et al. 2014).
9
III
METODE
3.1 Waktu dan Tempat Penelitian
Percobaan pertama yaitu pematahan dormansi benih cendana dilaksanakan pada bulan Februari-Maret 2020 dilaboratorium Teknik lingkungan Biosistem, Laboratorium penyimpana benih, dan Rumah Kaca Kebun Percobaan Leuwikopo IPB. Percobaan ke-2 dilakukan di Kebun Percobaan Leuwikopo di rumah kaca, Laboratorium Pengujian Mutu Benih dan Laboratorium Biologi Reproduksi Benih, Departemen Agronomi dan Hortikultura, Fakultas Pertanian Institut Pertanian Bogor. Penelitian dimulai dari bulan Maret hingga Juli 2020.
3.2 Alat dan Bahan
Benih cendana aksesi lokal Timor Leste (TL) yang dipanen pada bulan Agustus 2019 dan disimpan selama 4 bulan di ruang simpan benih dengan suhu 16-18oC. Bahan yang digunakan untuk perendaman benih yaitu air UFB, Aquades, dan H2SO4. Bahan untuk media tanam yaitu pasir yang di steril. Peralatan yang digunakan adalah air UFB generator (FZIN-10, IDEC), moisture tester, chamber, bak perkecambahan, timbangan analitik, gelas ukur, botol winkler, labu erlenmeyer, dan cawan petri.
Bahan media yang digunakan dalam percobaan kedua adalah cocopeat, arang sekam, kompos, tanah, dan pasir. Kecambah cendana dari hasil percobaan pertama dari metode pematahan dormansi yang tercepat dan hasil kecambah normal yang terbaik yang digunakan untuk percobaan kedua. Tanaman Cabai (Capsicum sp) digunakan sebagai tanaman inang. Alat yang digunakan meliputi timbangan biasa (kg), oven, pisau steril, mistar, hygrometer dan polybag ukuran 7 cm x 20 cm.
3.3 Prosedur Kerja
Percobaan I: Teknologi Ultrafine Bubbles untuk Pematahan Dormansi Benih Cendana
Percobaan ini bertujuan untuk mengetahui efektifitas air UFB dalam mempercepat pematahan dormansi. Percobaan ini terdiri atas dua faktor perlakuan yang diterapkan pada Rancangan Kelompok Teracak Lengkap (RKLT). Faktor pertama adalah jenis skarifikasi yaitu tanpa skarifikasi (kontrol), skarifikasi fisik dengan metode diamplas, dan skarifikasi kimia dengan menggunakan H2SO4 10% selama 30 menit. Faktor kedua adalah perlakuan perendaman benih yaitu tanpa perendaman (kontrol), perendaman dengan UFB oksigen 20 ppm, dan tanpa oksigen selama 24 dan 48 jam, serta perendaman dengan aquades selama 24 dan 48 jam. Pemilihan taraf konsentrasi H2SO4 10% dalam perendaman selama 30 menit mengikuti metode yang telah digunakan pada penelitian sebelumnya pada benih saga (Iswara et al. 2018). Percobaan terdiri atas 21 kombinasi perlakuan dengan tiap kombinasi perlakuan diulang sebanyak tiga kali, sehingga terdapat 63 unit percobaan. Satu satuan percobaan merupakan satu box perkecambahan yang berisi 25 butir benih. Model rancangan yang digunakan adalah model aditif linier sebagai berikut (Mattjik dan Sumertajaya 2002):
10
Keterangan:
Yijk : Nilai pengamatan skarifikasi benih ke-i, pada perlakuan perendaman benih ke-j, dan kelompok ke-k
µ : Nilai rataan umum
αi : Nilai tambah pengaruh faktor jenis skarifikasi benihcendana ke-i βj : Nilai tambah pengaruh faktor perlakuan perendaman benih ke-j ρk : Nilai tambah dari kelompok ke-k
(αβ)ij : Komponen interaksi skarifikasi benih ke-i dan perlakuan perendaman benih ke-j
Εijk : Pengaruh acak pada jenis skarifikasi benih ke-i, lama perendaman benih ke-j, dan kelompok ke-k yang menyebar normal
Pengamatan yang dilakukan pada pematahan dormansi benih cendana setelah di tanam terdiri atas:
1. Indeks vigor (IV)
Persentase kecambah normal (KN) pada hitungan I uji daya berkecambah (DB) yaitu 21 HSP
2. Kecepatan tumbuh (Kct)
Persentase kecambah normal (KN) yang dihitung dan diambil setiap etmal (24 jam) mulai dari 1 hari hingga 41 hari setelah tanam (HST).
3 Persentase kecambah normal (KN) diamati pada 41 hari setelah tanam (HST), kecambah dikategorikan normal apabila ujung tunas berkembang sempurna dan sehat dengan minimal sepasang daun.
4 Persentase Benih Mati (BM)
Kriteria benih mati ditunjukan untuk benih – benih yang busuk sebelum berkecambah atau tidak tumbuh setelah jangka waktu pengujian yang ditentukan, tetapi bukan dalam keadaan dorman.
5 Intensitas dormansi (ID) merupakan persentase benih Segar yang tidak Tumbuh diakhir pengamatan (41 HST). Benih yang terserang cendawan sebelum akhir pengamatan dan belum berkecambah tidak termasuk kedalam perhitungan intensitas dormansi. Perhitungan intensitas dormansi menggunakan rumus:
11 6 Potensi tumbuh maksimum (PTM) dihitung berdasarkan persentase jumlah benih yang berkecambah dengan kriteria minimal tumbuh radikula pada akhir pengamatan yaitu 41 hari setelah tanam (HST).
7 Uji imbibisi
Benih cendana yang akan di uji dibagi menjadi tiga kelompok, yaitu benih yang diskarifikasi fisik, benih tanpa skarifikasi dan skarifikasi kimia, masing-masing perlakuan terdapat 25 benih diulang sebanyak 3 kali. Benih masing-masing direndam sesuai dengan perlakuan selama 24 jam dan 48. Benih yang direndam dengan air UFB dan aquades setiap 4 jam sekali benih ditimbang bobotnya. Setelah deringkan dengan tissue lalu lalu direndam kembali. Rumus yang digunakan untuk menghitung absorbsi adalah:
Percobaan II: Aplikasi Jenis Media Tanam untuk Meningkatkan Vigor Bibit Cendana
Hasil pematahan dormansi benih dari percobaan pertama digunakan dalam percobaan kedua sebagai bahan untuk meningkatkan vigor bibit. Media yang digunakan pada percobaan ke dua yaitu campuran tanah, pasir dan kompos yang dikombinasikan dengan biochar atau cocopeat. Perbandingan kombinasi dengan konsentrasi sebagai berikut:
- 1 Tanah : 1 pasir : 1 kompos : Arang sekam : 0% : 15% : 30% : 45% - 1 Tanah : 1 pasir : 1 kompos : Cocopeat : 0 % : 15% : 30% : 45%
Pasir dan tanah disterilkan dengan cara dipanaskan selama 4 jam kemudian dicampur dengan kompos dikombinasi dengan 2 jenis media tanam. Hasil kombinasi dari media tanam dimasukkan ke dalam polybag yang berukuran (7 x 20) cm. Masing-masing polybag diisi media tanam sesuai perlakuan yang telah dirancangkan. Kecambah cendana dari hasil percobaan 1 dipilih hasil kecambah yang sesuai kriteria kecambah normalnya yaitu plumula dan akar sudah tumbuh dan telah mempunyai sepasang daun ditanam bersamaan dengan kecambah tanaman inang yang kriteria kecambahnya sama atau dua minggu kemudian baru ditanam kecambah inangnya. Bibit kecambah cendana ditanam secara langsung bersamaan kecambah tanaman inang ke dalam kantung polybag yang telah diisi media tanam dengan kedalaman 0.3 cm.
Percobaan kedua untuk mengetahui sejauh mana pengaruh persentase media cocopeat dan biochar untuk meningkatkan vigor bibit tanaman cendana. Percobaan kedua menggunakan RAK faktorial, dengan dua faktor. Faktor pertama media tanam yang terdiri dari 2 taraf yaitu biochar dan cocopeat. Faktor kedua adalah persentase arang sekam dan cocopeat yang terdiri dari 4 taraf yakni 0 %
12
(kontrol), 15%, 30% dan 45 % sehingga diperoleh 8 kombinasi perlakuan. Setiap perlakuan diulang sebanyak 3 kali sehingga terdapat 24 unit percobaan, dengan tiap satuan percobaan terdiri atas 6 tanaman sampel, sehingga secara keseluruhan terdapat 144 polybag. . Setiap polybag ditanam satu kecambah tanaman inang yang berumur 1 bulan dengan kecambah kecambah cendana yang telah ditanam 2 minggu terlebih dahulu. Model statistik yang digunakan adalah:
Yijk = µ + αi + βj + (αβ)ij + ρk + εijk Keterangan :
Yijk : Nilai pengamatan skarifikasi benih ke-i, pada perlakuan perendaman benih ke-j, dan kelompok ke-k
µ : Nilai rataan umum
αi : Nilai tambah pengaruh faktor jenis skarifikasi benih cendana ke-i βj: : Nilai tambah pengaruh faktor perlakuan perendaman benih ke-j ρk : Nilai tambah dari kelompok ke-k
(αβ)ij : Komponen interaksi skarifikasi benih ke-i dan perlakuan perendaman benih ke-j
εijk : Pengaruh acak pada jenis skarifikasi benih ke-i, lama perendaman benih ke-j, dan kelompok ke-k yang menyebar normal
Pemeliharaan dengan penyiraman dilakukan setiap 1 hari sekali, moister tester digunakan untuk mengukur kadar air tanah dan volume penyiraman yang diberikan merupakan volume air yang ditambahkan agar mencapai kapasitas lapang. Penentuan kadar air kapasitas lapang media tanam dilakukan dengan menimbang setiap perlakuan polibag yang belum disirami air dan ditimbang lagi setelah disirami air sampai kapsitas lapang minimal yaitu 80%. Penyiangan dengan mencabut langsung gulma yang dapat mengganggu pertumbuhan semai cendana, dan melakukan pemangkasan pada cabang inang atau mengurangi jumlah daunnya supaya tidak mengganggu pertumbuhan bibit cendana (Kuswanto 2005).
Pengamatan dilakukan meliputi:
Persentasi semai tumbuh: dihitung dari jumlah bibit tumbuh setelah 2 minggu. 1. Tinggi semai: pertumbuhan tinggi merupakan nilai selisih dari tinggi akhir
dengan tinggi awal.Diamati 2 minggu setelah tanam
2. Diameter semai: pertumbuhan diameter semai adalah selisih dari nilai diameter akhir dengan nilai diameter awal. Diamati 2 minggu setelah ditanam 3. Kekokohan semai (KS): merupakan nilai perbandingan antara tinggi dengan
diameter semai. Diamati 2 minggu setelah tanam dari hasil pengamatan tinggi semai dibagi diameter semai
4. Berat kering pucuk (BKP): Peningkatan rata-rata berat kering pucuk semai yang sudah dioven dengan suhu 600C selama 4 hari, setelah pengamatan terakhir di panen pada waktu bibit berumur 3 bulan, diamati setelah bibit dipanen yaitu 3 bulan,
5. Pengamatan akar: pengamatan akar pada semai cendana meliputi pengukuran panjang akar, jumlah akar sekunder, dan berat kering akar (BKA).
6. Nisbah pucuk akar (NPA) untuk melihat hubungan perbandingan pertumbuhan ujung dan pertumbuhan akar, biasanya dinyatakan sebagai rasio pucuk-akar.
13 7. Berat kering total (BKT): Berat kering total atau biomassa semai merupakan
nilai kumulatif dari berat kering pucuk dan berat kering akar. 8. Indeks kualitas bibit (S)
(S) = (Ql) = (h/d) + (t/r) keterangan :
s = Q1 = bobot kering bibit (g) h = tinggi semai (cm) d = diameter semai (mm) t/r = nisbah pucuk akar
Indeks mutu bibit diamati pada waktu waktu 3 bulan.
3.4 Analisis data
Data yang diperoleh dianalisis ragam menggunakan program SAS versi 9.1. Apabila analisis ragam taraf menunjukkan bahwa perlakuan yang diberikan berpengaruh nyata, maka analisis data dilanjutkan dengan uji DMRT (Duncan Multiple Range Test) pada taraf 5%.
14
IV
HASIL DAN PEMBAHASAN
4.1 Percobaan I : Teknologi Ultrafine Bubbles untuk Pematahan Dormansi Benih Cendana
Laju imbibisi pada benih cendana
Benih cendana memiliki dormansi morfofisiologi. Benih dihasilkan dari buah berbentuk bulat berwarna ungu kehitaman dengan benih keras yang dibalut daging buah. Buah cendana berdiameter sekitar satu cm bila telah masak dari berwarna ungu hingga menjadi hitam dan berbenih tunggal. Cendana memiliki buah batu dan bulat, waktu masak daging kulit buah berwarna hitam dan mempunyai lapisan eksokarp, mesokarp berdaging, endokarp keras dengan garis dari ujung ke pangkal
Imbibisi adalah air yang masuk ke dalam benih menyebabkan proses metabolisme dalam benih berjalan lebih cepat akibatnya perkecambahan yang dihasilkan semakin baik. Sedangkan menurut (Matthews et al. 2012) imbibisi merupakan proses meningkatnya kandungan air benih yang diperlukan untuk memicu proses biokimiawi perkecambahan. Laju imbibisi benih sangat erat kaitannya dengan sifat permeabilitas kulit benih (testa) terhadap air dan gas. Testa yang agak keras dilapisi lilin sebagai lapisan pelindung dan penutup embrio mempengaruhi karakter morfologi benih terkait proses fisiologi embrio.
Gambar 2 Proses Imbibisi benih cendana pada perlakuan jenis skarifikasi (A=Skarifikasi fisik B=Tanpa skarifikasi C= Skarifikasi kimia) dan lama perendaman benih pada air UFB dan aquades yang berbeda.
15 Hasil proses imbibisi yang tertera pada gambar 2 menunjukkan adanya perbedaan antar perlakuan jenis skarifikasi dan lama perendaman dengan air UFB, H2SO4, dan aquades. Skarifikasi adalah salah satu upaya pretreatment atau perlakuan awal pada benih yang ditujukan untuk mematahkan dormansi dan mempercepat terjadinya perkecambahan benih yang seragam (Schmidt 2000). Grafik yang ada menunjukan bahwa proses imbibisi benih pada skarifikasi fisik imbibisinya lebih tinggi daripada tanpa perlakaun. Hal ini disebabkan karena kulit benih telah tipis muda menyerap air hingga pembengkakan lebih cepat menyebakan bobot benih bertambah besar 23 gram. Proses penyerapaan air oleh benih pada fase pertama air diserap sedikit demi sedikit hingga terjadi pembengkakan dengan bertambahnya bobot benih dan fase kedua terjadi pemecahan kulit benih karena terjadi perombakan cadangan makanan, pemanjangan sel yang dibantu oleh air hingga munculnya radikula dan plumula dari testa membentuk kecambah hingga menjadi bibit.
Skarifikasi kimia dengan H2SO4 awalnya pada perlakuan kontrol (0 jam) bobot benih lebih berat dengan perlakuan tanpa skarifikasi dan skarifikasi fisik ini dikarenakan benih skarifikasi kimia direndam terlebih dahulu selama 30 menit terlebih dahulu, dimana benih sudah berimbibisi pada perlakuan perendaman yang diberikan sehingga bobot berat benih lebih tinggi. Perlakuan direndam terlebih dahulu dengan H2SO4 selama 30 menit telah terjadi penyerapan air oleh benih sebelum dilanjut dengan perendaman air UFB oksigen 20 ppm, Air UFB tanpa oksigen dan aquades.
Tabel 1 Perlakuan faktor tunggal terhadap pengamatan parameter Kct, indeks vigor, kecambah normal, potensi tumbuh maksimum, benih mati, dan intensitas dormansi Perlakuan Kct (%KN /etmal) Indeks Vigor (%) Kecambah Normal (%) PTM (%) BM (%) Intensitas Dormansi (%) Jenis Skarifikasi ** ** ** ** ** ** SF 4.67 2.8 4.54 54.28 3.21 35.04 TS 2.06 0.71 2.59 35.81 4.02 49.52 SK 2.31 0.71 2.89 38.48 3.9 46.85 Konst.UFB ** ** ** ** ** **
Kontrol 0.67d 0.71b 1.71c 14.22d 4.11ab 68.00a
UFB24 Jam 3.52b 1.83a 4.14b 46.22b 3.67abc 43.55b
UFB20 24Jam 4.64a 1.93a 4.55ab 56.00a 3.07c 34.22c
UFB 48 Jam 4.50a 1.76a 4.74a 52.88a 3.38c 34.66c
UFB20 48 Jam 4.66a 1.82a 4.70a 57.33a 3.22c 34.66c
Aqu.24 Jam 1.50c 0.71b 1.76c 36.00c 4.39a 45.32b
Aqu.48 Jam 1.59c 1.08b 1.78c 37.33c 4.12ab 46.22b
Keterangan: SF=Skarifikasi fisik, TS=Tanpa skarifikasi, SK=Skarifikasi Kimia UFB 24=UFB selama 24 jam, UFB 48=UFB selama 48 jam, UFB20 - 24= UFB + oksigen ≥ 20 ppm selama 24 jam, UFB20 - 48= UFB + oksigen ≥ 20 selama 48 jam, AQ 24=Aquades selama 24 jam, AQ 48=Aquades selama 48 jam.
16
Data yang tertera pada tabel 1 di atas menunjukkan pengaruh perlakuan faktor tunggal pengamatan pada semua parameter yang diamati signifikan berbeda terhadap perlakuan jenis skarifikasi dan konsentrasi lama perendaman air. Jenis skarifikasi yang terbaik pada semua peubah yaitu SF. Benih yang telah diamplas sampai kulitnya tipis mudah menyerap air hingga mempercepat proses perombakan metabolisme dalam benih untuk memunculkan radikula dan plumula. Pengaruh perlakuan faktor tunggal perendaman benih dalam air UFB dan aquades terhadapa semua peubah yang diamati yaitu perndaman dengan air UFB 20 ppm selama 48 dan 24 jam menunjukan hasil yg berpengaruh nyata dibandingkan dengan perlakuan yang lain. Air UFB yang berfungsi untuk melunakan kulit benih mudah menembus dinding sel hingga cepat menyerap air dan terjadi perombakan cadangan makanan untuk perkecambahannya ( Liu et al. 2016).
Menurut (Ilyas 2012) secara umum uji vigor atau uji kekuatan tumbuh diartikan sebagai kemampuan benih untuk tumbuh normal pada keadaan lingkungan yang suboptimal, ada kemungkinan benih memiliki kemampuan untuk tumbuh menjadi semai normal meskipun keadaan biofisik lapangan produksi suboptimum. Kekuatan tumbuh atau vigor benih dapat diungkapkan oleh tiga parameter yakni indeks vigor, daya berkecambah dan kecepatan tumbuh benih (Rusmin et al. 2016). Tertera Pada tabel 1 ketiga peubah respon terhadap perlakuan jenis skarifikasi dan lama perendaman dengan air UFB dari data yang ada menunjukkan hasil yang lebih tinggi yaitu pada jenis skarifikasi fisik dan perendaman air UFB oksigen 20 ppm selama 24 dan 48 jam.
Benih yang viable dapat ditandai dengan aktifnya aktivitas metabolisme benih yang dapat diukur melalui laju imbibisi dimana benih hidup memiliki laju imbibisi relatif tinggi selama proses perkecambahan (Costa et al. 2019). Selain itu, tingginya benih mati pada perlakuan skarifikasi fisik + kontrol, tanpa skarifikasi + Aquades 24 dan 48 jam, serta skarifikasi kimia + Aquades 24 dan 48 jam dikarenakan proses perendaman selama 24 dan 48 jam menyebabkan kondisi benih yang lembab dan memfasilitasi serangan cendawan selama di lapangan. Serangan cendawan tersebut menyebabkan benih mati meningkat yaitu 5.21%. Benih cendana dengan perlakuan skarifikasi fisik memiliki serangan cendawan banyak dibandingkan dengan tanpa skarifikasi fisik dan skarifikasi kimia.
Tujuan dari pada pematahan dormansi untuk mendapatkan viabilitas dan vigor optimal benih (Dharma et al. 2015). Benih dengan viabilitas dan vigor yang tinggi dapat menyebabkan tanaman tumbuh dengan baik dan memiliki produksi bibit yang tinggi. Perendaman dengan air UFB yang dikombinasikan dengan tanpa skarifikasi dan skarifikasi kimia pada 21 HSP persentase indeks vigornya menurun ini kemungkinan karena benih cendana yang karakter dorman morfofisiologis embrio dalam benih belum matang sehingga indeks vigor benih menurun.
17 Tabel 2 Indeks vigor (%) benih cendana dengan berbagai perlakuan pematahan
dormansi
Perlakuan Jenis Skarifikasi (%)
SF TS SK
Kontrol 0.71c 0.71c 0.71c
UFB 24 jam 4.06a 0.71c 0.71c
UFB20 24 jam 4.37a 0.71c 0.71c
UFB 48 jam 3.88a 0.71c 0.71c
UFB20 48 jam 4.04a 0.71c 0.71c
Aqu. 24 jam 0.71c 0.71c 0.71c
Aqu. 48 jam 1.82b 0.71c 0.71c
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf α=5%. SF=Skarifikasi fisik; UFB 24 jam = perendaman UFB selama 24 jam; UFB 48 jam = perendaman UFB selama 48 jam; UFB20 24 jam = perendaman UFB + oksigen ≥20 ppm selama 24 jam; UFB20 48 jam = UFB + oksigen ≥20 ppm selama 48 jam; Aqu. 24 jam = perendaman aquadest selama 24 jam; Aqu. 48 jam = perendaman aquadest selama 48 jam.
Perendaman pada air UFB oksigen 20 ppm 24 + 48 jam dan air UFB tanpa oksigen 24 + 48 jam yang tertera pada tabel 2 menunjukkan kombinasi perlakuan dengan skarifikasi fisik mampu meningkatkan indeks vigor tertinggi 4.37% dibandingkan perlakuan lain yaitu 0.71%. Hal ini karena aktivitas Reactive oxygen Species (ROS) mampu memfasilitasi pelemahan dinding membran sel untuk proses pertumbuhan dan pemanjangan sel radikula menembus kulit benih (Gomes dan Garcia 2013). Penurunan integritas dinding membran sel tersebut dapat meningkatkan absorpsi air dan merangsang pembelahan dan pemanjangan sel batang, mempercepat pertumbuhan sel akar, serta mengaktifkan enzim metabolisme perkecambahan dan pertumbuhan. Hubungan ROS pada germinasi benih yakni air UFB yang memproduksi ROS menghasilkan lebih banyak gelumbung-gelumbung air yang dapat menbangunkan benih yang istirahat untuk cepat berkecambah, (Liu et al. 2014) melalui perendaman benih kedalam air UFB sesuai perlakuan yang ditentukan.
Data yang tertera di tabel 2 menunjukkan kombinasi perendaman dengan air UFB oksigen 20 ppm selama 24 dan 48 jam serta air UFB 24 dan 48 jam tanpa oksigen dengan skarifikasi fisik menunjukkan mampu meningkatkan indeks vigor yaitu 4.37%, 4.06%, 4.04% dan 3.88% dibandingkan perlakuan lainnya. Hal ini karena aktivitas Reactive Oxcygen Species (ROS) yang dihasilkan oleh air UFB yang berkaitan dengan proses perkecambahan mampu memfasilitasi pelemahan dinding membran sel untuk proses mempercepat pertumbuhan dan pemanjangan sel radikula (Muller et al. 2009).
Kecepatan tumbuh (Kct) dari data yang tertera di tabel 3 benih setiap hari mengalami peningkatan yang menggambarkan tingginya indeks vigor dan daya berkecambah yang tertera di tabel 3. Benih yang mempunyai kecepatan tumbuh dan keserempakan tumbuh tinggi menurut (Ilyas 2012) memiliki vigor yang tinggi. Kct tertinggi diperoleh pada pengamatan 13 HSP dengan perlakuan air UFB 48 jam (6.75 % KN/etmal) dan air UFB Oksigen ≥ 20 ppm selama 48 jam (6.72.0% KN/etmal).
18
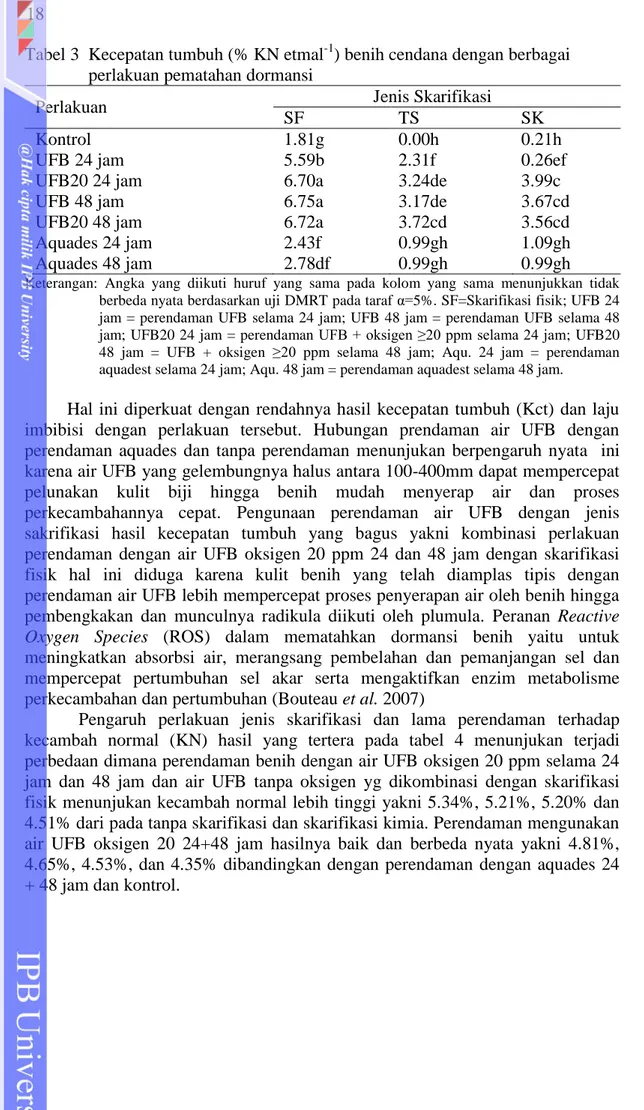
Tabel 3 Kecepatan tumbuh (% KN etmal-1) benih cendana dengan berbagai perlakuan pematahan dormansi
Perlakuan Jenis Skarifikasi
SF TS SK
Kontrol 1.81g 0.00h 0.21h
UFB 24 jam 5.59b 2.31f 0.26ef
UFB20 24 jam 6.70a 3.24de 3.99c
UFB 48 jam 6.75a 3.17de 3.67cd
UFB20 48 jam 6.72a 3.72cd 3.56cd
Aquades 24 jam 2.43f 0.99gh 1.09gh
Aquades 48 jam 2.78df 0.99gh 0.99gh
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf α=5%. SF=Skarifikasi fisik; UFB 24 jam = perendaman UFB selama 24 jam; UFB 48 jam = perendaman UFB selama 48 jam; UFB20 24 jam = perendaman UFB + oksigen ≥20 ppm selama 24 jam; UFB20 48 jam = UFB + oksigen ≥20 ppm selama 48 jam; Aqu. 24 jam = perendaman aquadest selama 24 jam; Aqu. 48 jam = perendaman aquadest selama 48 jam.
Hal ini diperkuat dengan rendahnya hasil kecepatan tumbuh (Kct) dan laju imbibisi dengan perlakuan tersebut. Hubungan prendaman air UFB dengan perendaman aquades dan tanpa perendaman menunjukan berpengaruh nyata ini karena air UFB yang gelembungnya halus antara 100-400mm dapat mempercepat pelunakan kulit biji hingga benih mudah menyerap air dan proses perkecambahannya cepat. Pengunaan perendaman air UFB dengan jenis sakrifikasi hasil kecepatan tumbuh yang bagus yakni kombinasi perlakuan perendaman dengan air UFB oksigen 20 ppm 24 dan 48 jam dengan skarifikasi fisik hal ini diduga karena kulit benih yang telah diamplas tipis dengan perendaman air UFB lebih mempercepat proses penyerapan air oleh benih hingga pembengkakan dan munculnya radikula diikuti oleh plumula. Peranan Reactive Oxygen Species (ROS) dalam mematahkan dormansi benih yaitu untuk meningkatkan absorbsi air, merangsang pembelahan dan pemanjangan sel dan mempercepat pertumbuhan sel akar serta mengaktifkan enzim metabolisme perkecambahan dan pertumbuhan (Bouteau et al. 2007)
Pengaruh perlakuan jenis skarifikasi dan lama perendaman terhadap kecambah normal (KN) hasil yang tertera pada tabel 4 menunjukan terjadi perbedaan dimana perendaman benih dengan air UFB oksigen 20 ppm selama 24 jam dan 48 jam dan air UFB tanpa oksigen yg dikombinasi dengan skarifikasi fisik menunjukan kecambah normal lebih tinggi yakni 5.34%, 5.21%, 5.20% dan 4.51% dari pada tanpa skarifikasi dan skarifikasi kimia. Perendaman mengunakan air UFB oksigen 20 24+48 jam hasilnya baik dan berbeda nyata yakni 4.81%, 4.65%, 4.53%, dan 4.35% dibandingkan dengan perendaman dengan aquades 24 + 48 jam dan kontrol.
19 Tabel 4 Kecambah normal (%) benih cendana dengan berbagai perlakuan
pematahan dormansi
Perlakuan Jenis Skarifikasi
SF TS SK
Kontrol 3.71de 0.71f 0.71f
UFB 24 jam 4.51bc 3.10e 4.81ab
UFB20 24 jam 5.20ab 4.37ab 4.08cd
UFB 48 jam 5.34a 4.21bc 4.65ab
UFB20 48 jam 5.21ab 4.37ab 4.53ab
Aqu. 24 jam 3.88cde 0.71f 0.71f
Aqu. 48 jam 3.92cde 0.71f 0.71f
Keterangan: Angka yang diikuti huruf yang sama pada kolom dan baris yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf α=5%. SF=Skarifikasi fisik; UFB 24 jam = perendaman UFB selama 24 jam; UFB 48 jam = perendaman UFB selama 48 jam; UFB20 24 jam = perendaman UFB + oksigen ≥20 ppm selama 24 jam; UFB20 48 jam = UFB + oksigen ≥20 ppm selama 48 jam; Aqu. 24 jam = perendaman aquades selama 24 jam; Aquades 48 jam = perendaman aquadest selama 48 jam.
Aktivitas Reactive Oxygen Species (ROS) mampu memfasilitasi pelemahan dinding membran sel untuk proses pertumbuhan dan pemanjangan sel radikula lebih cepat menembus kulit benih ( Liu et al. 2014). Penurunan integritas pada dinding membran sel tersebut dapat meningkatkan absorpsi air, merangsang pembelahan serta pemanjangan sel batang, mempercepat pertumbuhan sel akar, dan mengaktifkan enzim metabolisme perkecambahan dan pertumbuhan (Bradford et al. 2016).
Jenis skarifikasi yang terbaik pada semua peubah yaitu skarifikasi fisik benih yang diamplas sampai tipis yang dikombinasi dengan perendaman menggunakan UFB oksigen 20 ppm dan UFB tanpa oksigen selama 48 jam hasilnya lebih tinggi dibandingkan dengan kontrol dan perlakuan perendaman yang lain, membuat benih mudah menyerap air hingga mempercepat proses perombakan metabolisme dalam benih dan akan mendorong pemanjangan radikula dan plumula untuk menembus kulit benih. Air UFB yang berfungsi untuk melunakan kulit benih, mudah menembus dinding sel hingga benih cepat menyerap air dan terjadi perombakan cadangan makanan untuk perkecambahannya (Song et al. 2017).
Intensitas dormansi pada perlakuan kombinasi perendaman dengan air UFB dan skarifikasi fisik menunjukkan hasil benih segar tidak tumbuh terendah dibandingkan perlakuan tanpa air UFB (kontrol) yang dikombinasikan dengan tanpa skarifikasi terbanyak yaitu 90%. Benih segar tidak tumbuh pada skarifikasi kimia tanpa air UFB dan perendaman dengan aquades 48 jam lebih sedikit yaitu 76 %. Intensitas dormansi yang rendah diduga karena benih masih dalam keadaan dorman dan perendaman hanya selama 30 menit dengan H2SO4 dan dilanjutkan dengan perendaman aquades 48 jam belum dapat mamatahkan dormansi benih cendana dalam waktu cepat.
20
Tabel 5 Intensitas dormansi (%) benih cendana dengan berbagai perlakuan pematahan dormansi
Perlakuan Jenis Skarifikasi
SF TS SK
Kontrol 37.33cd 90.66a 76.00b
UFB 24 jam 37.33cd 49.33c 44.00cd
UFB20 24 jam 25.33f 37.33cd 40.00cd
UFB 48 jam 28.00ef 41.33cd 34.66de
UFB20 48 jam 28.00ef 36.66cd 37.33cd
Aqu. 24 jam 46.00cd 90.66a 76.00b
Aqu. 48 jam 37.33cd 42.66cd 45.33cd
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf α=5%. SF=Skarifikasi fisik; UFB 24 jam = perendaman UFB selama 24 jam; UFB 48 jam = perendaman UFB selama 48 jam; UFB20 24 jam = perendaman UFB + oksigen ≥20 ppm selama 24 jam; UFB20 48 jam = UFB + oksigen ≥20 ppm selama 48 jam; Aqu. 24 jam = perendaman aquadest selama 24 jam; Aqu. 48 jam = perendaman aquadest selama 48 jam.
Hasil yang tertera pada tabel 5 perlakuan yang memberikan hasil terbaik yaitu jenis skarifikasi fisik+air UFB oksigen 20 ppm selama 24+48 jam dan skarifikasi fisik + air UFB selama 24+48 jam berpengaruh nyata terhadap intensitas dormansi yang terendah dibandingkan perlakuan tanpa air UFB (kontrol) yang dikombinasi dengan tanpa skarifikasi yaitu 90% dan perendaman aquades selama 24 jam % dan skarifikasi kimia dengan tanpa perendaman dan perndaman dengan aquades 24 jam hasilnya yakni 76 % menunjukan hasil yang jelek ini diduga karena benih masih dalam keadaan dorman sehingga perendaman selama 30 menit dengan H2SO4 belum dapat mamatahkan dormansinya.
Benih segar tidak tumbuh pada kombinasi perlakuan skarifikasi fisik dengan perendaman air UFB oksigen 20 ppm maupun tanpa oksigen selama 48 jam yakni 28%, sedangkan perendaman air UFB oksigen 20 ppm selama 24 jam 25% dan perendaman air UFB tanpa oksigen 37 % intensitas dormansinya rendah berpengaruh nyata dengan perlakuan kontrol dan perendemana dengan aquades baik 24 maupun 48 jam. Penggunaan air UFB menyebabkan kecambah yang dihasilkan juga sangat baik yang dibuktikan dengan nilai BSTT yang juga relatif lebih rendah dibandingkan perlakuan lainnya.
Pematahan dormansi benih cendana dengan skarifikasi fisik yaitu diamplas dengan kertas amplas dari salah satu bagian sisi sampai tipis dari hasil yang tertera pada tabel 6 memberikan dampak buruk dengan meningkatnya jumlah benih mati yaitu 5.21%. Diduga waktu mengamplasnya yang terlalu dalam menyebabkan benih terluka pada endospermanya sehingga benih terkena cendawa hingga membusuk atau benih yg telah busuk mengganggu proses metabolisme dan merusak jaringan kotiledon dan embrio sehinga tidak dapat berkembang menjadi sebuah kecambah yang seutuhnya (Yuniarti 2015). Pada skarifikasi fisik dan skarifikasi kimia dengan perendaman aquades 48 jam juga meningkatakan benih mati ini diduga karena benih terlalu lembab hingga diserang cendawan menyebabkan kerusakan pada 2 jaringan tersebut akan berujung pada kematian benih.
21 Tabel 6 Persentase Benih mati (%) pada benih cendana dengan berbagai
perlakuan pematahan dormansi
Perlakuan Jenis Skarifikasi
SF TS SK
Kontrol 5.21a 3.12def 4.01abc
UFB 24 jam 2.18h 4.65abc 4.20abc
UFB20 24 jam 2.56gh 3.80bcd 2.86efg
UFB 48 jam 2.65fgh 4.20abc 3.30cde
UFB20 48 jam 2.65fgh 3.50cde 3.50cde
Aqu. 24 jam 3.71bcd 4.53abc 4.94ab
Aqu. 48 jam 3.50cde 4.34abc 4.51abc
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf α=5%. SF=Skarifikasi fisik; UFB 24 jam = perendaman UFB selama 24 jam; UFB 48 jam = perendaman UFB selama 48 jam; UFB20 24 jam = perendaman UFB + oksigen ≥20 ppm selama 24 jam; UFB20 48 jam = UFB + oksigen ≥20 ppm selama 48 jam; Aqu. 24 jam = perendaman aquadest selama 24 jam; Aqu. 48 jam = perendaman aquadest selama 48 jam.
Pengamatan benih pada peubah potensi tumbuh maksimum (PTM) yang tertera pada tabel 7 menunjukkan dari kedua perlakuan jenis skarifikasi dan perlakuan perendaman benih terjadi interaksi. PTM merupakan jumlah keseluruhan benih yang berkecambah, kriteria minimal tumbuh radikula pada hitungan pengamatan akhir 41 hari. Perlakuan kombinasi menunjukkan PTM yang tertinggi yaitu dengan perendaman air UFB oksigen 20 ppm dan kombinasi perlakuan yang terendah yakni tanpa skarifikasi dengan kontrol. PTM >60% diperoleh dari perendaman dengan air UFB oksigen 20 ppm 48 jam dan tanpa oksigen (66.66%). Perendaman dengan air UFB oksigen 20 ppm dan tanpa oksigen selama 24 jam yaitu 66.76%, lebih tinggi dibandingkan kontrol dan perendaman dengan aquades selama 48 dan 24 jam.
Tabel 7 Potensi tumbuh maksimum (%) benih cendana dengan berbagai perlakuan pematahan dormansi
Perlakuan Jenis Skarifikasi
SF TS SK
Kontrol 34.66hg 0.00i 8.00i
UFB 24 jam 58.66ab 37.33fg 42.66cd
UFB20 24 jam 66.67a 48.00cd 53.33bc
UFB 48 jam 66.66a 41.33de 50.66bc
UFB20 48 jam 66.66a 52.00bcd 53.33bc
Aqu. 24 jam 40.00ef 37.33fg 30.66h
Aqu. 48 jam 46.66cd 34.66gh 30.66h
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf α=5%. SF=Skarifikasi fisik; UFB 24 jam = perendaman UFB selama 24 jam; UFB 48 jam = perendaman UFB selama 48 jam; UFB20 24 jam = perendaman UFB + oksigen ≥20 ppm selama 24 jam; UFB20 48 jam = UFB + oksigen ≥20 ppm selama 48 jam; Aqu. 24 jam = perendaman aquadest selama 24 jam; Aqu. 48 jam = perendaman aquadest selama 48 jam.
22
Pada tanpa skarifikasi potensi tumbuh maksimum sebesar 41.0% dan pada skarifikasi fisik sebesar 53.33%. Secara keseluruhan terjadi interaksi perlakuan jenis skarifikasi dan perendaman dengan setiap lama perendaman dimana penggunaan air UFB dan skarifikasi fisik menunjukkan signifikan dibandingkan dengan tanpa sakrifikasi dan skarifikasi kimia namun dari ketiga skarifikasi kombinasi dengan perendaman air UFB oksigen 20 ppm selama 24 dan 48 jam dan air UFB tanpa oksigen sangat beda nyata dibandingkan dengan perlakuan kontrol dan perendaman dengan aquades 24 dan 48 jam.
Berdasarkan nilai daya berkecambah benih telah dapat dipatahkan dormansinya pada 13 HSP telah dapat dipatahkan dengan perlakuan perendaman air UFB. Perlakuan dengan skarifikasi kimia H2SO4 10% direndam selama 30 menit lalu perendaman dengan air UFB 24 dan 48 jam dan air UFB oksigen 20 24+48 jam mampu mematahkan dormansi benih dalam jangka waktu cepat dengan hasil PTM > 50% pada 41 HSP, sedangkan perendaman dengan aquades 24 dan 48 jam nilai PTM >30% 41 HSP begitu juga TS + dengan air UFB oksigen 20 selama 24 dan 48 jam juga air UFB tanpa oksigen nilai PTM >30 % pada 41 HSP. Hal ini menunjukkan bahwa perlakuan skarifikasi fisik + air UFB oksigen ppm 20, UFB tanpa oksigen selama 24 dan 48 jam efektif untuk mendapatkan PTM maksimal (Iswara et al. 2018).
4.2 Evaluasi Daya Berkecambah Benih Cendana
Kulit benih cendana memiliki tingkat ketebalan yang mempengaruh daya tumbuh benih. Memiliki dormansi fisik juga dormansi fisiologis dimana embrio benihnya kurang Panjang dan belum matang sempurna. Berdasarkan mengukur benih cendana yang dilakukan di Laboratorium Bioteknologi yaitu memiliki ketebalan kulit dari endosperma 0.6 mm dan terdiri dari 3 lapisan yaitu terluar (32.2 µm), palisade (44.6 µm), dan sub epidermal (219.8 µm). Perkecambahan benih menurut (Schmidt 2000) salah satunya didukung oleh proses imbibisi, yaitu penyerapan air oleh embrio dan endosperma sehingga menyebabkan pembengkakan, mendesak kulit benih yang sudah lunak sampai pecah dan memberikan ruang untuk keluarnya akar. Karakteristik kulit benih sangat mempengaruhi laju kemunculan kecambah selama pengujian mutu benih. Pengujian mutu benih perlu dilakukan untuk menentukan mutu benih terkait dengan nilai viabilitas dan vigor. Viabilitas dan vigor benih ditentukan dengan mengamati jumlah kecambah normal yang muncul setiap hari selama pengujian hingga akhir masa pengujian. Data tersebut dianalisis untuk melihat dan menentukan hitungan pertama (H1), hitungan kedua (H2), dan daya berkecambah.
Benih cendana pada perlakuan kontrol menunjukkan pemunculan kecambah yang sangat lamban dengan daya berkecambah hingga akhir pengamatan sebesar 0%, dengan hitungan pertama dapat diamati pada hari ke-21 dan hitungan kedua diamati pada hari ke-41. Kulit benih yang keras dengan lapisan lilin pada permukaan kulit benih menyebabkan imbibisi benih yang rendah sehingga menyebabkan lamban dan rendahnya perkecambahan yang terjadi. Perlakuan air UFB, Air UFB oksigen 20 ppm, aquades, dengan lama perendaman selama 24 maupun 48 jam tanpa terlebih dahulu diberikan skarifikasi fisik menunjukkan perkecambahan yang lamban pada hari 20-30 dan pada hari ke 30-41, serta PTM yang rendah berkisar antara 17-35%. Perlakuan-perlakuan tersebut
23 tanpa adanya skarifikasi tidak begitu efektif untuk meningkatkan daya berkecambah dan mempercepat pemunculan kecambah benih cendana.
Pematahan dormansi morfofisiologi pada benih cendana dilakukan skarifikasi fisik di amplas dengan mengamplas salah satu bagian sisi benih sampai kulit nampak dalam berwarna putih kecoklatan. Skarifikasi kimia mengunakan perendaman dengan H2SO4. Skarifikasi adalah salah satu upaya pretreatment atau perlakuan awal pada benih yang ditujuhkan untukmematahkan dormansi dan mempercepat terjadinya perkecambahan benih yang seragam. Karakter benih cendana yang memiliki kulit keras, lapisan lilin dipermukaan testa dan dormansi fisiologis yaitu embrio yang lama matang bertujuan agar dapat melunakkan kulit benih yang keras, menghilangkan lapisan lilin agar benih permeable terhadap air dan gas yang menjadi elemen penting dalam proses metabolisme yakni perombakan cadangan makanan untuk ditranslokasi ke titik tumbuh yaitu embrio agar mendorong pemanjangan tumbuh radikula dan plumula.
Skarifikasi fisik benih cendana tanpa dilanjutkan dengan perendaman menunjukkan laju perkecambahan tetap rendah, yaitu 30% dengan diamati pada hari ke-21 dan pada hari ke-41. Skarifikasi fisik yang dilanjutkan dengan perendaman dalam UFB, UFB20, dan aquades selama 24 jam menunjukkan daya pemunculan kecambah lebih cepat dan daya berkecambah yang tinggi. Perlakuan skarifikasi dilanjutkan perendaman dalam air UFB selama 24 menghasilkan PTM sebesar 66,67%, skarifikasi dilanjutkan perendaman dalam air UFB + oksigen selama 24 dan 48 jam menghasilkan PTM sebesar 66% dengan, dan skarifikasi dilanjutkan perendaman dalam aquadest selama 24 jam menghasilkan PTM sebesar 40%.
Skarifikasi fisik yang diberikan mampu meningkatkan efektivitas UFB dalam meningkatkan imbibisi benih dan mempercepat laju kemunculan kecambah dan meningkatkan daya berkecambah. Ketiga perlakuan tersebut menunjukkan daya berkecambah yang rendah (kurang dari 50%) ketika dilakukan perendaman selama 48 jam. Perlakuan skarifikasi dilanjutkan perendaman dalam air UFB selama 48 jam menghasilkan PTM sebesar 30% dan skarifikasi dilanjutkan perendaman dalam air UFB + oksigen selama 48 jam menghasilkan PTM sebesar 35% dan skarifikasi dilanjutkan perendaman dalam aquadest selama 48 jam menghasilkan PTM sebesar 40% dengan ketiga perlakuan dapat mempercepat laju kemunculan kecambah dibandingkan kontrol, dan waktu perendaman dengan aquades yang cukup lama menyebabkan rendahnya daya berkecambah. Diduga perendaman selama 48 menyebabkan benih mengalami lisis dan terjadi kebocoran metabolit sehingga benih berkecambah rendah. Benih cendana yang diberi perlakuan skarifikasi fisik dengan mengamplas salah satu bagian sisi benih sampai kulitnya tipis dalam evaluasi waktu daya berkecambahnya rentang dan relative lebih singkat.
Evaluasi daya berkecambah dapat dilakukan pada hari ke-41, Benih cendana tanpa perlakuan skarifikasi (kontrol) menunjukkan waktu perkecambahan awal sangat tertunda dan sampai akhir pengamatan 41 hari tidak berkecambah. Evaluasi pada benih cendana dapat dilakukan dengan mengamati pertama pada 50 hari dan ke dua 60 hari. Uji daya berkecambah cendana sebaiknya terlebih dahulu diberikan perlakuan skarifikasi. Skarifikasi yang dapat dilakukan adalah skarifikasi fisik dan skarifikasi kimia diikuti perendaman dengan air UFB oksigen 20 ppm selama 24 dan 48 jam hal ini karena pada hari ke-13 telah terjadi
24
perkecambahan pada perlakuan skarifikasi fisik dengan perendaman air UFB, Skrifikasi kimia diikuti dengan perendaman air UFB pengamatan pada hari ke 17 telah terjadi perkecambahan sedangkan tanpa skarifikasi yang diikuti dengan perendaman air UFB pengamatan pada hari 21 telah terjadi perkecambahan dimana radikula telah muncul.
4.3 Percobaan II : Aplikasi Jenis Media Tanam untuk Meningkatkan Pertumbuhan Vigor Bibit Cendana
Pertumbuhan merupakan hasil perkembangan setiap tanaman dari siklus kehidupan berubah dalam bentuk volume dan massa (Alain et al. 2000) dalam (Omon 2006). Bahwa pertumbuhan setiap tanaman merupakan hasil dua faktor yang berlawanan, yaitu faktor pertama merupakan hasil dari naiknya potensial biotik yang tidak terbatas dan kedua pertumbuhan merupakan hasil penyesuaian terhadap lingkungan dan umur (ekofisiologis). Pertumbuhan diawali dari pembelahan dan perbanyakan sel yang diikuti dengan pembentukan jaringan dan organ tanaman. Perubahan fungsi struktural menyebabkan setiap organ tanaman mewakili fungsi yang diadaptasikan dengan lingkungannya, misal perakaran akan berubah, arsitektur dan jumlahnya ketika berhadapan dengan media yang porous atau padat. Pertumbuhan dibagian atas tanah akan mengikuti arsitektur bibit yang disatukan oleh faktor genetik yaitu genetik dari setiap pohon.
Parameter pertumbuhan dan hasil bibit cendana yang diuji dalam penelitian ini yaitu tinggi semai, diameter semai, kekokohan semai, berat basah pucuk, berat kering pucuk, berat segar total dan berat kering total, pengamatan akar (panjang akar, jumlah akar sekunder dan berat kering akar, nisbah pucuk akar, dan indeks mutu bibit.
Tabel 8 Faktor tunggal perlakuan jenis media dan dosis media terhadap pertumbuhan tinggi semai
Faktor perlakuan Tinggi semai (cm)
2MST 4MST 6MST 8MST 10MST 12MST Media Biochar 8.08 10.37 11.60 13.00 14.56 16.26 Cocopeat 7.95 10.26 11.11 12.00 13.62 14.18 Konsentrasi 0 7.33 b 9.57 c 10.2b 11.63b 12.81 b 13.38c 15 8.50 a 11.03 a 12.12a 13.08a 14.18ab 15.51b 30 8.23ab 9.98 bc 11.13ab 11.82b 12.83 b 15.50b 45 7.98 b 10.67ab 11.90 a 13.50a 15.03a 16.85a
Keterangan: Angka diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf uji 5%; A: Arang sekam, B: Cocopeat
Pengaruh pemberian media arang sekam yang dikombinasikan dengan media dasar (tanah+pasir+kompos) terhadap tinggi semai, diameter semai dan kekokohan semai sangat berbeda nyata dibandingkan dengan aplikasi media cocopeat dan kontrol. Hal ini diduga karena arang sekam yang berfungsi untuk menjaga kelembaban tanah dan mempercepat sifat fisik tanah agar hara tersedia untuk tanaman. Respon tertinggi yaitu terhadap tinggi semai, diameter semai, dan kekokohan semai dengan pemberian konsentrasi 45%.
25 Tinggi semai merupakan ukuran semai yang sering diamati baik sebagai indikator pertumbuhan maupun sebagai parameter yang digunakan untuk mengukur pengaruh lingkungan atau perlakuan yang diterapkan (Wawo 2008). Pertumbuhan tinggi merupakan nilai selisih dari tinggi akhir dengan tinggi awal. Hasil uji Anova yang tertera pada tabel 8 menunjukkan bahwa penambahan arang sekam meningkatkan pertumbuhan tinggi semai secara nyata. Perlakuan arang sekam terbaik terdapat pada 45% diikuti 30 % dan 15 %. Tinggi 16-18 cm pada pengamatan terakhir 12 MST atau meningkat 11.80%. Sifat biochar yang slow release dan akar inang membantu semai cendana dalam penyerapan unsur hara. Arang sekam mampu memperbaiki sifat fisik, biologi, dan kimia tanah sehingga tanah menjadi subur (Supriyanto dan Fiona 2010). Tanaman akan tumbuh dengan baik pada tanah yang subur. Perlakuan konsentrasi arang sekam yang memiliki rata-rata tinggi terbaik konsisten terdapat pada konsentrasi 45% dengan tinggi 16.85 cm atau meningkat 11.80%. Menurut (Sudrajat et al. 2009) lokasi produksi hormon auksin salah satunya terdapat di meristem tunas apikal. Fungsi utama hormon auksin di antaranya membantu merangsang terjadinya perpanjangan batang, dominansi apikal, dan fototropisme. Hal ini menunjukkan penambahan atau pengunaan arang sekam bermanfaat bagi pertumbuhan tinggi semai cendana. Tabel 9 Faktor tunggal perlakuan jenis media dan dosis media terhadap
pertumbuhan diameter semai
Faktor perlakuan Diameter semai (mm)
2MST 4MST 6MST 8MST 10MST 12MST Media Biochar 0.93 1.23 1.40 1.71 1.88 2.00 Cocopeat 0.88 1.13 1.35 1.58 1.75 1.84 Konsentrasi 0 0.82a 1.06 c 1.21c 1.40 c 1.57 c 1.67 c 15 1.00a 1.28 a 1.59a 1.80a 1.95 a 2.05a 30 0.91 a 1.15 b 1.36 b 1.58b 1.77 b 1.88 b 45 0.87a 1.21 a 1.45ab 1.80a 1.97 a 2.15 a
Keterangan: Angka diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf uji 5%; A: Arang sekam, B: Cocopeat
Pertumbuhan diameter semai adalah selisih dari nilai diameter akhir dengan nilai diameter awal yang tertera pada tabel 9 menunjukkan bahwa pemberian arang sekam dapat meningkatkan diameter semai 2.15 dan 2.15 mm pada konsentrasi media 15% dan 45% berpengaruh nyata terhadap penambahan arang sekam. Persentase konsentrasi 45% ke dalam media tanam merupakan perlakuan terbaik dengan pertumbuhan diameter semai yaitu 2.15 mm dengan selisih 0.48 mm atau meningkat 14.17% dibandingkan dengan kontrol pertumbuhannya diameter peningkatannya hanya 10.65% dibandingkan dengan control pertumbuhan diameter hanya 0.82 mm. Hal ini menunjukkan bahwa pemberian arang sekam dapat meningkatkan diameter semai 14–28.74% walaupun tidak berpengaruh nyata. Penambahan biochar persentase 45% ke dalam media tanam merupakan perlakuan terbaik dengan pertumbuhan diameter 2.15 mm atau meningkat 28.74% dibandingkan dengan kontrol dengan pertambahan diameter 1.67 mm, hal ini sesuai Pernyataan (Nurhasybi et al.
26
2008). Pertumbuhan tinggi semai dan batang semai bibit dapat meningkat dengan cepat jika diberi unsur hara yang tepat dan sesui kebutuhannya. Pengamatan perlakuan pada media cocopeat menunjukan bahwa pemberian konsentrasi 15% justru meningkatkan hasil yang lebih baik dari pada perlakuan yang lain. Hal ini dapat menjadi keuntungan ataupun kerugian bagi tanamn karena media atau konsentrasi yang terlalu banyak menyimpan air dapat menghambat pertumbuhan beberapa tanaman.
Rata-rata diameter cendana mengalami penurunan pada umur 0-4 MST. Hal ini dikarenakan batang semai saat disapih berwarna hijau kekuningan, banyak mengandung air, dan mengkilat. Batang mengalami proses pengerasan batang yang menyebabkan batang berwarna hijau tua hingga kecoklatan sehingga diameter batang pada empat minggu pertama pengamatan mengalami penurunan (Ram and Pandey 2012). Hal ini menunjukkan bahwa bibit cendana sedang mengalami pertumbuhan primer (batang dan akar bertambah tinggi atau panjang). Rata-rata diameter mulai tumbuh normal dan meningkat mulai umur 6 MST-12 MST yang menunjukkan semai cendana mengalami pertumbuhan sekunder (batang dan akar bertambah lebar)
Tabel 10 Faktor tunggal perlakuan jenis media dan dosis media terhadap pertumbuhan kekokohan semai
Faktor perlakuan Kekokohan semai (cm)
2MST 4MST 6MST 8MST 10MST 12MST Media Biochar 7.81 7.81 7.92 8.35 8.62 9.49 Cocopeat 7.65 7.48 7.65 8.2 9.13 9.03 Konsentrasi 0 8.89 a 9.03 a 8.46 a 8.30 a 8.23a 8.12 a 15 8.88 a 8.66 a 8.18 a 7.41 a 7.27a 7.55 a 30 9.45 a 8.65 a 8.10 a 7.53 a 7.33a 8.07 a 45 9.7i a 9.16 a 8.37 a 7.66 a 7.77a 7.83 a
Keterangan: Angka diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf uji 5%; A: Biochar, B: Cocopeat
Kekokohan semai (KS) merupakan nilai perbandingan antara tinggi dengan diameter semai yang tertera pada tabel 10 menunjukkan bahwa perlakuan konsentrasi arang sekam dan cocopeat keduanyanya berpengaruh nyata terhadap variabel kekokohan semai dikarenakan tidak berpengaruh nyata pada variabel diameter semai dengan tinggi semai cendana. Kekokohan semai (KS) merupakan nilai perbandingan antara tinggi dengan diameter semai (Fanggidae et al. 2020). menunjukkan bahwa perlakuan konsentrasi arang sekam dan cocopeat terhadap kedua variable diameter dan tinggi semai cendana tidak berpengaruh nyata terhadap peubah kekokohan semai dikarenakan kedua peubah tersebut tidak berpengaruh nyata.
27 Tabel 11 Faktor tunggal perlakuan jenis media dan dosis media terhadap pertumbuhan parameter hasil berat segar tanaman, berat kering tanaman, panjang pucuk, berat basah pucuk, dan berat kering pucuk. Faktor perlakuan Berat Segar Tanaman Berat Kering Tanaman Panjang Pucuk Berat Basah Pucuk Berat Kering Pucuk Media Biochar 0.97 0.3 10.97 1.10 0.17 Cocopeat 0.76 0.21 9.46 1.01 0.10 Konsentrasi 0 0.61 b 0.17 c 8.80 c 0.95 b 0.09c 15 0.87a 0.27 b 10.36 b 1.05 a 0.15 ab 30 0.95 a 0.25 b 9.65 bc 1.08 a 0.14 b 45 1.03 a 0.34 a 12.06 a 1.11 a 0.18 a
Keterangan: Angka diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf uji 5%; A: Arang sekam, B: Cocopeat
Rekapitulasi pada tabel 11 menunjukkan penambahan arang sekam memberikan pengaruh nyata terhadap variabel berat segar tanaman, berat kering tanaman, panjang pucuk, berat basah pucuk dan berat kering pucuk. Penambahan arang sekam memberikan pengaruh nyata dari pada pemberian cocopeat terhadap variabel lain. Perlakuan konsentrasi arang sekam pada konsentrasi 45% dan 15% memiliki interaksi dan nilai rata-rata pada berat segar tanaman 1.03 g, berat kering tanaman 0.34 g, panjang pucuk 12.06 cm, berat basah pucuk 1.11 g dan berat kering pucuk tertinggi sebesar 0.18 g atau rata-rata meningkat pada setiap variabel yaitu 30%-50% dibandingkan dengan kontrol 0%. Pemberian arang sekam dengan konsentrasi minimal 30% sampai dengan 45% mampu meningkatkan nilai rata-rata berat kering pucuk sebesar 40-50 % lebih baik jika dibandingkan dengan pemberian cocopeat yang rata-rata peningkatan hanya 10 %. Rata-rata berat segar tanaman (BST), berat kering tanaman (BKT), panjang pucuk (PP), berat basah pucuk (BBP) dan berat kering pucuk (BKP) pada bibit cendana meningkat apabila konsentrasi arang sekam yang diberikan semakin tinggi dari 15%. Hal ini sesuai dengan pendapat (Supriyanto dan Fiona 2010) yang mengaplikasi arang sekam bibit tanaman Jabon.
Hasil yang tertera pada tabel 11 juga menunjukkan, faktor perlakuan arang sekam memberikan berpengaruh nyata namun penambahan mampu meningkatkan rata-rata dari variabel hasil semai cendana sebesar 40-50%. Hal ini sesuai dengan pendapat Lehmann et al. (2006) yang menyatakan bahwa aplikasi pemberian arang sekam ke tanah akan memberikan manfaat langsung terhadap peningkatan kesuburan tanah dan pertumbuhan tanaman.
28
Tabel 12 Faktor tunggal perlakuan jenis media dan dosis media terhadap pertumbuhan parameter hasil panjang akar, jumlah akar sekunder, berat basah akar, berat kering akar, nisbah pucuk akar dan indeks kualiatas bibit Faktor Perlakuan Panjang akar Jumlah akar sekunder Berat basah akar Berat kering akar Nisbah pucuk akar Index kualitas bibit Media tn tn * ** tn tn Biochar 10.97 4.50 0.25 0.88 0.89 8.90 Cocopeat 9.46 4.00 0.21 0.56 0.85 8.62 Konsentrasi * tn ** ** tn tn 0 8.80 a 3.78 b 0.14 c 0.04 c 0.85 a 8.66 a 15 10.36 b 4.18 ab 0.24 ab 0.07 b 0.94 a 8.51 a 30 9.65 bc 4.28 ab 0.23 b 0.06b 0.83 a 8.88 a 45 12.06 a 4.78 a 0.29 a 0.09 a 0.83 a 8.98 a
Keterangan: Angka diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf uji 5%; A: Arang sekam, B: Cocopeat
Hubungan perbandingan pertumbuhan ujung dan pertumbuhan akar, biasanya dinyatakan sebagai rasio pucuk-akar (rasio S-R atau shot-root ratio) yang mempunyai kepentingan fisiologis, karena dapat menggambarkan salah satu tipe toleransi terhadap kekeringan (Gardner et al. 2008). Hasil yang tertera pada tabel 12 menunjukkan bahwa pemberian arang sekam sebagai pupuk padat pada berbagai konsentrasi ternyata mampu meningkatkan nisbah pucuk akar (NPA), berat kering akar (BKA), berat basah akar (BBA), panjang akar (PA), jumlah akar sekunder (JAS), dan indeks mutu benih (IMB) semai cendana rata-rata sebesar 3-5%, walaupun tidak berpengaruh nyata. Semakin meningkat konsentrasi biochar yang diberikan dapat memberikan pengaruh yang semakin baik pula pada setiap variabel hasil bibit tanaman cendana. Sedangkan menurut (Annapura dan Rayhore 2004) bibit yang baik adalah pada umur 6 bulan dapat mencapai tinggi > 20 cm, diameter batang > 0,3 cm dan indeks kualitas bibit > 0,3. Nisbah pucuk akar menentukan kualitas bibit cendana. Kualitas bibit cendana yang baik adalah bibit yang mempunyai pertumbuhan seimbang antara bagian atas dengan bagian akar tanaman (rasio pucuk akar) dan untuk setiap jenis tanaman mempunyai rasio pucuk akar yang berbeda-beda (Sudrajat dan Nurhasybi 2009).