VARIASI GEN lrRNA LEBAH MADU Apis cerana
DI LOMBOK, SUMBAWA, DAN FLORES
INDRA ANGGRIAWAN
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
ABSTRAK
INDRA ANGGRIAWAN. Variasi Gen Large Ribosomal RNA (lrRNA) Lebah Madu Apis cerana di Lombok, Sumbawa, dan Flores. Dibimbing oleh RIKA RAFFIUDIN dan M. CHANDRA WIDJAJA.
Lebah madu Apis cerana merupakan lebah lokal Asia dengan persebaran yang sangat luas. Belum lengkapnya data genetika A. cerana menjadi dasar utama penelitian ini. Tujuan penelitian ini untuk mempelajari variasi genetika A. cerana berdasarkan lrRNA/DraI dan analisis filogenetik antara A. cerana di Indonesia dan Thailand. Koleksi A. c. indica dilakukan di Lombok, Sumbawa, dan Flores. Analisis homologi dilakukan dengan A. cerana dari Thailand (AF140508; AF140509; dan AF140511), serta haplotipe A. cerana dari Pati dan Lombok (AcPt1 dan AcLb4). Jumlah koloni yang diperoleh masing-masing 22, 3, dan 4 koloni untuk Lombok, Sumbawa, dan Flores. Ukuran nukleotida gen lrRNA yang diamplifikasi berkisar antara 625-629 pb dengan basa AT sekitar 88.90%. Berdasarkan analisis lrRNA/DraI, ditemukan dua haplotipe yaitu haplotipe A dan C. Persentase haplotipe A sebesar 72.72, 100, dan 50%, berturut-turut untuk populasi A. c. indica di Lombok, Sumbawa, dan Flores. Persentase haplotipe C sebesar 27.28 dan 50% untuk A. c.
indica di Lombok dan Flores. Analisis filogenetik berdasarkan gen lrRNA menggunakan Maximum Parsimony menunjukkan bahwa populasi lebah di Thailand membentuk kelompok yang
terpisah dengan A. cerana di Indonesia. Jarak genetik terbesar (3.53%) terjadi antara AF140508 dan AcLb4. Sedangkan nilai jarak genetik terkecil (0.00%) terjadi antara AcPt1 dan AcSbw5. Nilai transisi/transversi (ts/tv) >1 adalah 66.67% dan ts/tv <1 adalah 26.67%.
ABSTRACT
INDRA ANGGRIAWAN. Variation of large ribosomal RNA (lrRNA) gene of Honey Bee Apis
cerana from Lombok, Sumbawa, and Flores. Supervised by RIKA RAFFIUDIN and M.
CHANDRA WIDJAJA.
Apis cerana is a native, wide distribution honey bee in Asia and lack of its genetic data in
Indonesia. Hence, the purposes of this research were to explore the genetic variations of A. cerana based on lrRNA digested by DraI (lrRNA/DraI) and performed a phylogenetic analysis with A.
cerana from Thailand. Apis cerana were collected from Lombok, Sumbawa, and Flores. DNA
homology analysis were carried out with A. cerana from Thailand (AF140508, AF140509, and AF140511), and from Pati and Lombok (AcPt1 and AcLb4). A total of 22, 3, and 4 collonies of A.
cerana were collected from Lombok, Sumbawa, and Flores, respectively. The nucleotide sequence
of lrRNA were AT-rich (88.90%), ranged from 625 up to 629 bp. There were two haplotypes, haplotype A and C, based on lrRNA/DraI analysis. The A haplotype were 72.72, 100, and 50 %, respectively for A. c. indica from Lombok, Sumbawa, and Flores. The C haplotype were 27.28 and 50%, respectively from Lombok and Flores. Phylogenetic analysis by using maximum parsimony method, showed that A. cerana from Thailand clustered separately with those of Indonesian A.
cerana. The highest genetic distance (3.53%) occured between AF140508 and AcLb4. The
shortest genetic distance (0.00%) was between AcPt1 and AcSbw5. Transition/transvertion (ts/tv) value >1 were 66.67% and ts/tv <1 were 26.67%.
VARIASI GEN lrRNA LEBAH MADU Apis cerana
DI LOMBOK, SUMBAWA, DAN FLORES
INDRA ANGGRIAWAN
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Variasi Gen lrRNA Lebah Madu Apis cerana di Lombok, Sumbawa, dan
Flores
Nama : Indra Anggriawan
NIM : G34103075
Menyetujui :
Pembimbing I, Pembimbing II,
Dr. Ir. Rika Raffiudin, M.Si Drs. M. Chandra Widjaja, MM
NIP. 131999583 NIP. 080057508
Mengetahui :
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Drh. Hasim, DEA
NIP. 131578806
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 19 Desember 1984 sebagai putra kedua dari pasangan Sudiono dan Titin. Pendidikan yang telah ditempuh oleh penulis yaitu pendidikan dasar di SDN 04 Lubang Buaya pada tahun 1997, pendidikan menengah pertama di SLTPN 81 Lubang Buaya pada tahun 2000, dan pendidikan menengah atas di SMUN 48 Pinang Ranti pada tahun 2003. Penulis kemudian melanjutkan pendidikannya di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Institut Pertanian Bogor (IPB) melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB).
Selama berkuliah di Departemen Biologi, penulis menjadi asisten untuk mata kuliah Biologi Tingkat Persiapan Bersama (Bio-TPB), Perkembangan Hewan, Biologi Sel dan Molekuler, dan Avertebrata pada tahun ajaran 2006-2007. Penulis juga menjadi asisten untuk mata kuliah Bio-TPB, Studi Lapang, dan Vertebrata pada tahun ajaran 2007-2008. Selain itu penulis juga aktif di organisasi kemahasiswaan Biologi (HIMABIO). Pada tahun 2004-2005, penulis menjadi ketua bagian Nata Bioworld dan ketua bidang eksplorasi alam. Pada tahun 2005, penulis melakukan studi lapang di Taman Wisata Alam (TWA) Situ Gunung mengenai keragaman semut di TWA Situ Gunung. Pada tahun berikutnya, penulis melakukan praktek lapang mengenai perawatan dan pemeliharaan Macaca fascicularis di Pusat Penyelamatan Satwa Cikananga (PPSC) Sukabumi. Pada tahun 2007 penulis melakukan ekspedisi lebah Apis cerana dan A. dorsata di Lombok dan Sumbawa. Ekspedisi tersebut bekerja sama dengan Universitas Mataram (Program Studi Biologi), Dinas Kehutanan (Dishut) Nusa Tenggara Barat (NTB), Rajawali Citra Televisi Indonesia (RCTI) Lombok, dan kelompok tani madu di Lombok dan Sumbawa. Ekspedisi dibiayai oleh Direktorat Jenderal Pendidikan, Departemen Pendidikan Nasional, atas nama Rika Raffiudin dengan judul Diferensiasi DNA Mitokondria Lebah Madu Apis cerana di Jawa, Lombok, Sumbawa, dan Flores. Pada tahun yang sama, penulis juga mengikuti seminar Biologi Internasional di Universitas Gadjah Mada Jogjakarta (Advance in Biological Sciences: Contribution Toward a Better Human
Prosperity, Jogjakarta, 7-8 September 2007) sebagai peserta poster, dengan judul poster Nest Characteristics of Honey Bee in Sumbawa Island.
PRAKATA
Alhamdulillah, puji syukur penulis panjatkan kepada Allah SWT atas segala nikmat Nya sehingga karya ilmiah ini berhasil diselesaikan.
Terima kasih penulis ucapkan kepada Dr. Ir. Rika Raffiudin, M.Si dan Drs. M. Chandra Widjaja, MM atas bimbingan dan dukungannya, serta kritik dan sarannya sehingga karya ilmiah ini menjadi lebih baik lagi, dan kepada Nina Ratna Djuita, M.Si, selaku penguji atas kritik dan saran terhadap karya ilmiah ini. Ucapan terima kasih penulis ucapkan kepada Direktorat Jenderal Pendidikan Tinggi (DIKTI) atas dana penelitian tahun 2007 (dibiayai oleh Direktorat Jenderal Pendidikan, Departemen Pendidikan Nasional, Surat Perjanjian No.: 317/SP3/PP/DP2M/II/2006 tanggal: 1 Februari 2006 DIREKTORAT JENDERAL PENDIDIKAN TINGGI DEPARTEMEN PENDIDIKAN NASIONAL) atas nama Rika Raffiudin dengan judul Diferensiasi DNA Mitokondria Lebah Madu Apis Cerana di Jawa, Lombok, Sumbawa, dan Flores.
Penulis juga mengucapkan terima kasih kepada Bapak Bambang Suryobroto, Bapak Achmad Farajallah, Bapak Tri Heru W, Bapak Tri Atmowidi, Ibu Taruni Sri P, dan Ibu Dyah Perwitasari atas segala saran, ilmu, dan nasihat yang telah diberikan. Terima kasih kepada Pak Adi, Mba Tini, Pak Wandia, Mba Zul, dan Ani atas bantuannya selama di Laboratorium. Terima kasih kepada Sinyo dan keluarga, team eksplorasi lebah Lombok (Adi dan Dedi (mahasiswa Biologi Universitas Mataram), Sumbawa (Dinas Kehutanan (Dishut) Nusa Tenggara Barat (NTB), Rajawali Citra Televisi Indonesia (RCTI) Lombok, Asrul (mahasiswa Biologi Universitas Mataram), dan kelompok tani madu Abadi), Dompu-Bima (Pak Syam, Pak Azis, dan Mas Bambang), dan Flores (Taman Nasional Kelimutu). Kepada Nico, Lusi, Wildan, Citra, Rut, Gita, Oci, Wafa, Carwan, Dian, Muley, Rini, Femi, dan Sri Maria U, serta seluruh teman-teman Biologi atas dukungan dan motivasi yang telah diberikan. Terima kasih penulis haturkan kepada keluarga tercinta atas semua dukungan dan doa yang telah diberikan.
Bogor, Januari 2008
DAFTAR ISI
Halaman
DAFTAR TABEL ...VI DAFTAR GAMBAR ...VI DAFTAR LAMPIRAN ...VI
PENDAHULUAN ... 1 METODE ... 1 OBJEKPENELITIAN ... 1 KOLEKSI LEBAH ... 1 EKSTRAKSI DNA ... 2 AMPLIFIKASI DNA ... 2 ELEKTROFORESIS DNA ... 2 VISUALISASI DNA ... 2 ANALISIS PCR-RFLP ... 3
PENGURUTAN (SEQUENCING) DAN ANALISIS HOMOLOGI (ALIGNMENT)DNA ... 3
ANALISIS POHON FILOGENI ... 3
HASIL ... 4
KOLEKSI LEBAH ... 4
EKSTRAKSI DAN AMPLIFIKASI DNA... 4
ANALISIS PCR-RFLP ... 5
PENGURUTAN (SEQUENCE)DNA ... 6
ANALISIS HOMOLOGI (ALIGNMENT)DNA ... 7
ANALISIS FILOGENI A. CERANA ... 7
PEMBAHASAN ... 10
DISTRIBUSI A. CERANA ... 10
ANALISIS KERAGAMAN GENETIK LRRNA DAN COX 1-2 A. C. INDICA ... 10
PERSENTASE HAPLOTIPE A. C. INDICA ... 10
VARIASI NUKLEOTIDA LRRNAA. C. INDICA ... 10
ANALISIS POHON FILOGENI ... 11
SIMPULAN ... 11 SARAN ... 11 DAFTAR PUSTAKA ... 11 LAMPIRAN ... 13 vi vi vi Objek Penelitian .…… Koleksi Lebah .. Ekstraksi DNA … Amplifikasi DNA … Elektroforesis DNA …. Visualisasi DNA …. Analisis PCR-RFLP ..
Pengurutan (Sequence) dan Analisis Homologi (Alignment) DNA ………... Analisis Filogenetik ..……
Koleksi Lebah ..
Ekstraksi dan Amplifikasi DNA …. Analisis PCR-RFLP ..
Pengurutan (Sequence) DNA … Analisis Homologi (Alignment) DNA …. Analisis Filogenetik A. cerana
Distribusi A. cerana ….
Analisis Keragaman Genetik lrRNA dan cox 1-2 A. c. indica ………. Persentase Haplotipe A. c. indica ……
Variasi Nukleotida A. c. indica ………. Analisis Pohon Filogeni ..
DAFTAR TABEL
Halaman
1 Nukleotida primer yang digunakan untuk amplifikasi lrRNA A. cerana berdasarkan
nukleotida primer Sittipraneed (2001) ... 14
2 Lebah madu Apis cerana dan A. mellifera yang digunakan pada penelitian ini ... 15
3 Data lokasi koleksi lebah A. cerana ... 16
4 Data haplotipe gen lrRNA A. cerana Lombok, Sumbawa, dan Flores ... 20
5 Persentase haplotipe A. cerana Lombok, Sumbawa, dan Flores ... 18
6 Persentase nukleotida A. cerana lrRNA/DraI ... 19
7 Jarak genetik antar koloni A. cerana lrRNA/DraI ... 20
DAFTAR GAMBAR
Halaman 1 Lebah Madu A. cerana ... 14
2 Peta lokasi pengambilan sampel di (a) Lombok, (b) Sumbawa, dan (c) Flores ... 15
3 Pita DNA A. cerana gen lrRNA. M: penanda DNA 100 pb Promega, 1-2: Ac21Lb, 3-4: Ac22Lb, 5-6: Ac4Sb, 7-8: Ac5Sb, 9-10: Ac6Sb ... 19
4 Pita DNA A. cerana hasil pemotongan dengan DraI. M: penanda DNA 100 pb Promega, 1-2: Ac21Lb, 3-4: Ac22Lb, 5-6: Ac4Sb, 7-8: Ac5Sb, 9-10: Ac6Sb ... 20
5 Peta restriksi hasil pemotongan gen lrRNA/DraI A. cerana. AcLb21, AcSbw5, AcFlr3, dan AcFlr4: hasil penelitian ini. AF140508, AF140509, dan AF140511: Sittipraneed (2001), AcPt1 dan AcLb4: Apriani (2006). ... 21
6 Homologi urutan nukleotida gen lrRNA A. cerana. AcLb21, AcSbw5, AcFlr3, dan AcFlr4: hasil penelitian ini. AF140508, AF140509, dan AF140511: Sittipraneed (2001), AcPt1 dan AcLb4: Apriani (2006), Amel_lrRNA: urutan nukleotida lrRNA Apis mellifera (Acc number: L06178). TTT/AAA: situs restriksi DraI, *: homologi nukleotida. ... 7 Konstruksi pohon filogeni A. cerana gen lrRNA berdasarkan Maximum Parsimony (Gambar a-c) dan Neighbour Joining (Gambar d), angka di atas nodus menyatakan nilai bootstrap 100x. AcLb21, AcSbw5, AcFlr3, dan AcFlr4: hasil penelitian ini. AF140508, AF140509, dan AF140511: Sittipraneed (2001), AcPt1 dan AcLb4: Apriani (2006), L06178: urutan nukleotida lrRNA Apis mellifera ...
DAFTAR LAMPIRAN
Halaman 1 Daerah koleksi A. c. indica Lombok dan Sumbawa (Apriani 2006) ... 14
2 Peta persebaran A. cerana di Indonesia berdasarkan lrRNA/DraI (2006-2007) ... 15
3 Rasio substitusi transisi dengan transversi ... 16
4 Kromatogram hasil pengurutan DNA A. c. indica (AcSbw5) menggunakan primer For lrRNA ... 18
5 Kromatogram hasil pengurutan DNA A. c. indica (AcSbw5) menggunakan primer Rev lrRNA ... 19
6 Kromatogram hasil pengurutan DNA A. c. indica (AcLb21) menggunakan primer For lrRNA ... 20
7 Kromatogram hasil pengurutan DNA A. c. indica (AcLb21) menggunakan primer Rev lrRNA ... 21 3 3 4 6 8 8 1 5 6 7 6 6 8 9
PENDAHULUAN
Latar Belakang
Lebah madu merupakan salah satu serangga sosial yang hidup dalam suatu koloni dan terdiri atas ribuan individu. Dalam koloni tersebut, terdapat tiga kasta yang dibedakan berdasarkan kemampuan repro-duktif, yaitu ratu, jantan, dan pekerja (Winston 1987). Berdasarkan Michener (2000), lebah madu termasuk ke dalam ordo Hymenoptera, subordo Apocrita, infraordo Acuelata, superfamili Apoidea, famili Apidae, subfamili Apinae, tribe Apini, dan genus Apis. Lebah madu Apis cerana merupakan lebah lokal yang banyak diternakan di Indonesia. Hal itu dikarenakan A. cerana memiliki daya tahan terhadap tungau parasit Varrhoa dan daya adaptasi yang tinggi terhadap lingkungan (Morse 1997). Selain itu juga didukung dengan persebaran yang sangat luas dari lebah ini. Menurut Ruttner (1988), lebah madu A.
cerana memiliki empat sub spesies yang
tersebar di seluruh dunia, yaitu A. c. cerana (Asia bagian barat dan timur laut), A. c. indica (Asia selatan dan tenggara), A. c. himalaya (pegunungan Himalaya), dan A. c. japonica (Jepang).
Gambar 1 Lebah madu A. cerana. DNA mitokondria (mtDNA) merupakan informasi genetik yang hanya diturunkan secara maternal, sehingga analisis mtDNA dapat digunakan untuk mempelajari evolusi hewan, keragaman populasi, dan aliran gen. Gen large ribosomal RNA (lrRNA) merupakan salah satu gen pada mtDNA yang tidak menyandi protein. Gen ini memiliki persentase A-T yang tinggi yaitu 83.33% (Crozier & Crozier 1993).
Analisis Restriction Fragment Length
Polymorphism (RFLP) yang dilakukan pada
populasi lebah di Jepang, Thailand, Vietnam,
Taiwan, Koera, Nepal, dan Filipina menunjuk-kan adanya variasi DNA mitokondria pada daerah tRNAleu dan daerah Cytochrome Oxidase I-II (CO I-II) (Deowanish et al. 1996).
Pada tahun 1999, dilakukan analisis dengan menggunakan enzim restriksi DraI pada daerah gen srRNA, lrRNA, dan daerah intergenik CO I-II. Dari 170 koloni yang digunakan, ditemukan variasi dari ketiga gen tersebut yaitu masing-masing dengan dua, empat, dan tujuh haplotipe (Sihanuntavong et al. 1999). Sedangkan dari hasil analisis RFLP dengan menggunakan gen
lrRNA/DraI pada 225 koloni di Thailand,
menghasilkan empat haplotipe (Sittipraneed et
al. 2001).
Penelitian mengenai keragaman genetik mtDNA dari A. cerana di Indonesia telah dilakukan sebelumnya oleh Raffiudin pada tahun 2006. Penelitian tersebut menggunakan analisis gen lrRNA/DraI, dengan jumlah koloni yang digunakan 97 koloni, yang masing-masing berasal dari pulau Jawa (81 koloni), Kalimantan (enam koloni), Lombok (tujuh koloni), dan Sumbawa (tiga koloni). Dari hasil analisis tersebut diperoleh dua haplotipe untuk pulau Jawa, satu haplotipe untuk pulau Kalimantan, dan dua haplotipe untuk pulau Lombok dan Sumbawa.
Tujuan
Penelitian ini bertujuan untuk mengeks-plorasi lebih lanjut variasi genetika A. cerana
indica berdasarkan gen lrRNA di pulau Lombok,
Sumbawa, dan Flores. Selain itu, penelitian ini mempelajari filogeni A. cerana hasil penelitian ini dengan A. cerana asal Thailand. Dari hasil penelitian ini diharapkan dapat melengkapi
database mengenai haplotipe dan urutan
nukleotida gen lrRNA A. c. indica di Indonesia.
METODE
Objek Penelitian
Objek penelitian yang digunakan adalah lebah madu A. c. indica yang berasal dari Lombok, Sumbawa, dan Flores (hasil koleksi dari penelitian ini) dan koleksi Rika Raffiudin di Lab. Zoologi Departemen Biologi FMIPA IPB. Koleksi di Flores dilakukan oleh Islamul Hadi (Staf pengajar Program Studi Biologi, Universitas Mataram).
Koleksi Lebah
Koleksi lebah dilakukan di pulau Lombok (tujuh daerah), Sumbawa (tiga daerah), dan Flores (tiga daerah). Dari masing-masing
2
koloni diambil 10-15 individu lebah pekerja dan kemudian disimpan di dalam tabung yang berisi etanol absolut.
Ekstraksi DNA
Ekstraksi DNA dilakukan dengan menggunakan metode cetyl trimethyl ammonium bromide (CTAB) 20% dan
presipitasi etanol (Sambrook et al. 1989). Ekstraksi dilakukan terhadap dua individu lebah pekerja dari tiap koloni. Sebelum diekstraksi, lebah dimasukkan ke dalam 10 mM Tris HCl pH 8; 1 mM EDTA (TE) sebanyak tiga kali. Pencucian tersebut bertujuan untuk mengganti etanol dalam jaringan dengan TE.
Toraks lebah kemudian dipotong dengan menggunakan pisau scalpel steril dan dimasukkan ke dalam tabung 1.5 ml. Setelah itu tabung yang berisi toraks lebah direndam dalam nitrogen selama 20 menit. Toraks kemudian digerus hingga hancur dengan menggunakan grinder. Sebanyak 500 μl bufer CTAB (10 ml 1 M Tris-HCl pH 8; 4 ml 0.5 M NaEDTA pH 8; 8.18 g NaCl; 2 g CTAB dan air hingga 100 ml) dan 14 μl Proteinase K (5 mg/ml) ditambahkan ke dalam tabung yang berisi hancuran jaringan toraks. Tabung kemudian diinkubasi pada suhu 55°C selama dua jam dan disentrifugasi dengan kecepatan 13.000 rpm (10 menit). Supernatan yang terbentuk kemudian dipindahkan ke tabung 1.5 ml baru dan ditambahkan 250 μl fenol dan 250 μl CIAA (kloroform isoamil alkohol). Tabung lalu dikocok perlahan selama satu menit dan disentrifugasi dengan kecepatan 13.000 rpm selama lima menit. Sentrifugasi akan membentuk dua lapisan yaitu lapisan atas yang mengandung DNA dan lapisan bawah yang merupakan campuran antara fenol dan isoamil alkohol. Lapisan bawah tersebut kemudian dibuang dan tabung disentrifugasi kembali selama satu menit. Lapisan atas yang mengandung DNA kemudian dipindahkan ke tabung baru dan ditambahkan larutan CIAA sebanyak 400 μl. Tabung kemudian dikocok perlahan selama satu menit dan disentrifugasi selama tiga menit pada kecepatan 13.000 rpm. Kemudian lapisan bawah hasil sentrifugasi dibuang dan tabung disentrifugasi kembali dengan kece-patan 13.000 rpm selama satu menit. Lapisan atas yang mengandung DNA dipindahkan ke tabung baru dan ditambahkan 600 μl iso-propanol kemudian dipresipitasi selama sema-lam pada suhu 4°C.
Tabung yang berisi campuran DNA dan isopropanol kemudian disentrifugasi dengan
kecepatan 13.000 rpm (30 menit) pada suhu 4°C. Larutan isopropanol kemudian dibuang dan ke dalam tabung ditambahkan 500 μl etanol 70%, selanjutnya tabung disentrifugasi kembali 13.000 rpm (10 menit) pada suhu 4°C. Super-natan lalu dibuang dan endapan (pelet) DNA dikeringkan dengan cara divakum selama 30 menit. Pelet DNA hasil ekstraksi kemudian dilarutkan dalam TE 0.5 M dan disimpan pada suhu 4°C.
Amplifikasi DNA
DNA hasil ekstraksi kemudian diamplifikasi (diperbanyak) secara in vitro dengan menggu-nakan metode PCR (mesin PCR Takara
Thermal Cycle). Komposisi pereaksi yang
digunakan pada proses PCR terdiri atas 6.4 μl
destilata water (DW) steril, 1 μl dNTP 2.5 mM,
1.25 μl Mg2+
free buffer, 1.5 μl MgCl2 25 mM, 0.1 μl Taq polymerase 5 μM, 1 μl DNA hasil ekstraksi, 0.625 μl primer For lrRNA 10 μM, dan 0.625 μl primer Rev lrRNA 10 μM (Tabel 1). Total volume pereaksi yang digunakan sebanyak 12.5 μl.
Amplifikasi dilakukan dalam tiga tahap, yaitu tahap predenaturasi dengan suhu 940C selama satu menit. Kemudian dilakukan perbanyakan sebanyak 30 siklus dengan suhu denaturasi (pemisahan utas ganda DNA) 940C,
annealing (penempelan primer) 610C, dan
elongation (pemanjangan segmen DNA) 720C, masing-masing selama 1 menit. Tahap terakhir yaitu sintesis DNA dengan suhu 720C selama tujuh menit.
Elektroforesis DNA
DNA yang telah diamplifikasi kemudian dipisahkan dengan menggunakan polyacri-
lamide gel electrophoresis (PAGE) 5% dengan
bufer 1xTBE (Tris 0.5 M, Asam borat 0.65 M, EDTA 0.02 M). Gel akrilamid 5% terdiri atas 4 ml akrilamid 30%, 4 ml bufer 5xTBE, 12.5 ml
destilata water (DW) steril, 15 μl TEMED, dan
150 μl APS 10%. Fragmen DNA kemudian dimigrasikan dengan menggunakan arus listrik sebesar 145 Volt selama 100 menit. Proses ini menggunakan DNA ladder 100 bp (Promega) sebagai penanda DNA.
Visualisasi DNA
Pita DNA pada gel akrilamid divisualisasi dengan menggunakan metode pewarnaan silver
nitrate (Tegelstrom 1986). Tahapan visualisasi
DNA ini meliputi pencucian dengan larutan CTAB (0.2 g/200 ml akuades) selama 10 menit, dilanjutkan dengan akuades (200 ml) selama 2x2 menit. Kemudian gel direndam dalam
3
NH4OH (2 ml/200 ml akuades) selama 8 menit. Setelah itu gel direndam dalam campuran AgNO3 (0.32 g AgNO3, 0.8 ml NH4OH, 80 μl, dan 200 ml akuades) selama 20 menit. Gel lalu dicuci kembali dengan akuades selama 2x2 menit. Selanjutnya gel direndam dalam campuran NaCO3 (4 g NaCO3, 100 μl formaldehida, dan 200 ml akuades) sampai muncul pita DNA. Tahap terakhir yaitu gel direndam dalam larutan asam asetat 1% (200 μl asam asetat 1% dan 200 ml akuades).
Analisis PCR-RFLP
PCR produk kemudian dipotong dengan menggunakan enzim restriksi DraI. Enzim restriksi ini memiliki situs pemotongan TTT/AAA. Komposisi pereaksi yang digu- nakan pada proses PCR-RFLP terdiri atas 1.1 μl DW steril, 0.4 μl bufer B, 0.5 μl enzim restriksi DraI (10 U/μl), dan 2 μl PCR produk. Total volume pereaksi yang digunakan sebanyak 4 μl. Campuran tersebut kemudian diinkubasi selama semalam pada suhu 37°C.
Hasil pemotongan kemudian dimigrasikan dengan menggunakan gel akrilamid 5% pada 145 Volt selama 100 menit. Pita DNA kemudian divisualisasi dengan menggunakan
metode pewarnaan silver nitrate (Tegelstrom 1986).
Pengurutan (Sequencing) dan Analisis Homologi (Alignment) DNA
Nukleotida lrRNA hasil PCR diurutkan dengan menggunakan jasa Lembaga Biologi Molekuler Charoen Pockphan Jakarta. Selanjutnya hasil pengurutan dianalisis dengan menggunakan program Genetyx Win 4.0 dan Clustal X (Thompson et al. 1997). Analisis homologi nukleotida lrRNA dilakukan antara haplotipe yang ditemukan pada penelitian ini dengan haplotipe Sittipraneed et al. (2001) dari GenBank (www.ncbi.nlm.nih.gov) dengan
Accession number (Acc number): AF140508;
AF140509; dan AF1405011, haplotipe dari hasil Apriani (2006): AcPt1 dan AcLb4, dan sebagai
outgroup digunakan urutan nukleotida A. mellifera (Acc number: L06178) (Tabel 2). Analisis Filogenetik
Analisis filogenetik dilakukan dengan menggunakan program PAUP 4.10 (PPC) versi Macintosh. Rekonstruksi yang digunakan pada analisis ini yaitu Maximum Parsimony (MP) dan Neighbour Joining (NJ), dengan menggu-nakan bootstrap 100x.
Tabel 1 Nukleotida primer yang digunakan untuk amplifikasi lrRNA A. cerana berdasarkan nukleotida primer Sittipraneed (2001)
No Primer Urutan Nukleotida Primer (5`-3`) 1 Forward lrRNA GGG ACG ATA AGA CCC TAT AG
2 Reverse lrRNA CAA CCC TGA TAC AAA GGT ACA AAA
Tabel 2 Lebah madu A. cerana dan A. mellifera yang digunakan pada penelitian ini
Kelompok Lebah Kode Sampel Lokasi Acc Number Kolektor
Ingroup A. cerana AcLb21 Lombok - Anggriawan I
A. cerana AcSbw5 Sumbawa - Anggriawan I A. cerana AcFlr3 Flores - Hadi I A. cerana AcFlr4 Flores - Hadi I A. cerana AcPt1 Pati - Apriani A. cerana AcLb4 Lombok - Hadi I
A. cerana AF140508 Thailand AF140508 Sittipraneed S A. cerana AF140509 Thailand AF140509 Sittipraneed S A. cerana AF140511 Thailand AF140511 Sittipraneed S
Outgroup A. mellifera L06178 - L06178 Crozier RH
4
Tabel 3 Data lokasi koleksi lebah A. cerana
Pulau Kode
Sampel
Lokasi Koordinat Ketinggian
(m dpl)
Jumlah Koloni Lombok AcLb11 Kampus lama Univ.
Mataram, Kec. Selaparang, Mataram
80 34’ 57’’ 1160 05’ 35”
10 1
AcLb12 Kelayu, Lombok Timur 80 39’ 19’’ 1160 32’ 46” 12 1 AcLb13-16 Santong 80 18’ 30’’ 1160 17’ 01” 8 4 AcLb17 Santong 80 18’ 14’’ 1160 16’ 32” 10 1
AcLb18-19 Desa Bentek, Kec. Pame-nang, Lombok Barat
80 43’ 1160 10’
105 2
AcLb20-22 Desa Kuta, Kec. Pujut, Lombok Tengah
80 53’ 53’’ 116018’ 01’’
3 3
AcLb23-27 Desa Sire, Kec. Tanjung, Lombok Barat
80 21’49’’ 1160 18’ 01”
4 5
AcLb28-32 Desa Lendang Nangka, Kec. Masbagik
80 36’ 01’’ 1160 27’ 00”
206 5
Sumbawa AcSbw4 Gili Ngara, Kec. Moyo Utara, Sumbawa
80 30’18’’ 117035’45”
15 1
AcSbw5 Desa Pelat, Sumbawa - - 1
AcSbw6 Desa Pungka, Sumbawa - - 1
Flores AcFlr1 Desa Walogai, Flores 80 42’ 08’’ 121048’13.2”
837 1
AcFlr2-3 Desa Walogai Atas, Flores 80 42’ 25’’ 1210 48’ 30.9”
1.084 2
AcFlr4 Desa Moni, Flores 80 46’ 12’’ 1210 49’ 59.2”
1.212 1
Total 29
HASIL
Koleksi Lebah
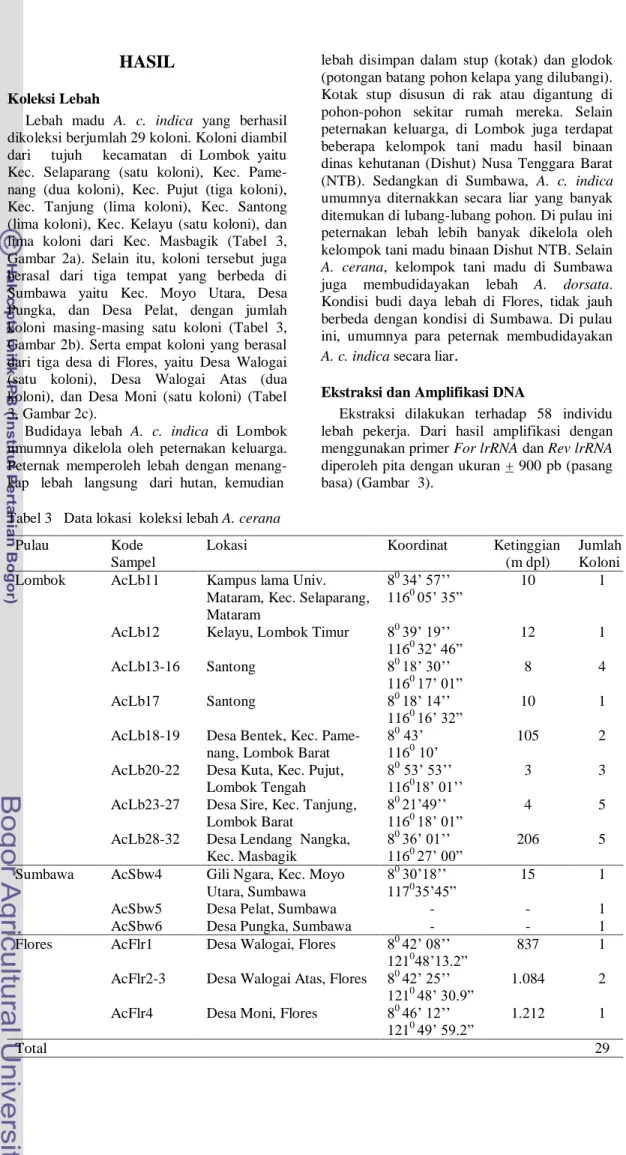
Lebah madu A. c. indica yang berhasil dikoleksi berjumlah 29 koloni. Koloni diambil dari tujuh kecamatan di Lombok yaitu Kec. Selaparang (satu koloni), Kec. Pame-nang (dua koloni), Kec. Pujut (tiga koloni), Kec. Tanjung (lima koloni), Kec. Santong (lima koloni), Kec. Kelayu (satu koloni), dan lima koloni dari Kec. Masbagik (Tabel 3, Gambar 2a). Selain itu, koloni tersebut juga berasal dari tiga tempat yang berbeda di Sumbawa yaitu Kec. Moyo Utara, Desa Pungka, dan Desa Pelat, dengan jumlah koloni masing-masing satu koloni (Tabel 3, Gambar 2b). Serta empat koloni yang berasal dari tiga desa di Flores, yaitu Desa Walogai (satu koloni), Desa Walogai Atas (dua koloni), dan Desa Moni (satu koloni) (Tabel 3, Gambar 2c).
Budidaya lebah A. c. indica di Lombok umumnya dikelola oleh peternakan keluarga. Peternak memperoleh lebah dengan menang-kap lebah langsung dari hutan, kemudian
lebah disimpan dalam stup (kotak) dan glodok (potongan batang pohon kelapa yang dilubangi). Kotak stup disusun di rak atau digantung di pohon-pohon sekitar rumah mereka. Selain peternakan keluarga, di Lombok juga terdapat beberapa kelompok tani madu hasil binaan dinas kehutanan (Dishut) Nusa Tenggara Barat (NTB). Sedangkan di Sumbawa, A. c. indica umumnya diternakkan secara liar yang banyak ditemukan di lubang-lubang pohon. Di pulau ini peternakan lebah lebih banyak dikelola oleh kelompok tani madu binaan Dishut NTB. Selain
A. cerana, kelompok tani madu di Sumbawa
juga membudidayakan lebah A. dorsata. Kondisi budi daya lebah di Flores, tidak jauh berbeda dengan kondisi di Sumbawa. Di pulau ini, umumnya para peternak membudidayakan
A. c. indica secara liar
.
Ekstraksi dan Amplifikasi DNA
Ekstraksi dilakukan terhadap 58 individu lebah pekerja. Dari hasil amplifikasi dengan menggunakan primer For lrRNA dan Rev lrRNA diperoleh pita dengan ukuran + 900 pb (pasang basa) (Gambar 3).
5
Analisis PCR-RFLP
Analisis PCR-RFLP yang dilakukan pada 29 koloni lebah A. c. indica dengan menggunakan enzim restriksi DraI menunjuk-kan adanya variasi genetika, yaitu dengan ditemukan dua haplotipe (A dan C) (Gambar 4). Haplotipe A ditemukan pada koloni yang berasal dari Kec. Selaparang, Kec. Santong, Kec. Pamenang, Kec. Tanjung, dan Kec. Masbagik (Lombok), Kec. Moyo
Utara, Desa Pelat, dan Desa Pungka (Sumbawa), serta Desa Walogai dan Desa Walogai Atas (Flores), sedangkan haplotipe C ditemukan pada koloni yang berasal dari Kec. Santong, Kec. Pujut, dan Kec. Masbagik (Lombok), serta Desa Walogai Atas dan Desa Moni (Flores) (Tabel 3, Tabel 4). Perbedaan posisi pemotongan dapat dilihat pada setiap urutan nukleotida (Gambar 5).
Ac 6 Sbw Ac 4 Sbw Ac 5 Sbw
Ac 3 Sbw Ac 2 Sbw
(b)
Gambar 2 Peta lokasi pengambilan sampel di (a) Lombok, (b) Sumbawa, dan (c) Flores. Ac 1 Flr Ac 2-3 Flr Ac 4 Flr (c) (a) Ac 23-27 Lb Ac 18-19 Lb Ac 4, 11 Lb Ac 28-32 Lb Ac 20-22 Lb Ac 5 Lb Ac 6 Lb Ac 7 Lb Ac 9 Lb Ac 10 Lb Ac 12 Lb Ac 13-16 Lb Ac 17 Lb Ac4Sbw Ac5Sbw Ac3Sbw Ac6Sbw Ac2Sbw Lokasi A. cerana Sungai di Lombok Gunung di Lombok Lokasi A. cerana Gunung di Sumbawa Sungai di Sumbawa Lokasi A. cerana Sungai di Flores Gunung di Flores
6
Gambar 4 Pita DNA A. cerana hasil pemotongan dengan DraI. M: penanda DNA 100 pb Promega, 1-2: Ac21Lb, 3-4: Ac22Lb, 5-6: Ac4Sb, 7-8 : Ac5Sb, 9-10: Ac6Sb. M 1 2 3 4 5 6 7 8 9 10 400 300 100
Berdasarkan perhitungan persentase haplo-tipe, haplotipe A merupakan haplotipe umum yang ditemukan pada koloni lebah Lombok, Sumbawa, dan Flores, dengan persentase sebesar 72.72% (Lombok), 100% (Sumbawa), dan 50% (Flores), sedangkan haplotipe C memiliki persentase sebesar 27.28% (Lombok) dan 50% (Flores) (Tabel 5).
Pengurutan (Sequence) DNA
Pengurutan DNA dilakukan dengan menggunakan primer For dan Rev lrRNA pada masing-masing haplotipe yang berbeda (haplotipe A dan C). Masing-masing haplo-tipe tersebut mewakili individu asal Lombok, Sumbawa, dan Flores yaitu AcSbw5, AcLb21, dan AcFlr4 dengan panjang DNA hasil pengurutan + 599 pb, + 595 pb, dan + 598 pb. Panjang DNA tersebut ditambah dengan panjang urutan nukleotida primer (For + Rev) sebesar + 30 pb, sehingga panjang DNA yang sebenarnya adalah + 629 pb, + 625 pb, dan + 628 pb. Hasil pengurutan ditampilkan dalam bentuk kromatogram (Lampiran 4-9).
Tabel 4 Data haplotipe gen lrRNA A. cerana Lombok, Sumbawa, dan Flores
No Asal Haplotipe Lombok 1 Ac Lb 11 A 2 Ac Lb 12 C 3 Ac Lb 13 A 4 Ac Lb 14 A 5 Ac Lb 15 C 6 Ac Lb 16 A 7 Ac Lb 17 A 8 Ac Lb 18 A 9 Ac Lb 19 A 10 Ac Lb 20 A 11 Ac Lb 21 C 12 Ac Lb 22 C 13 Ac Lb 23 A 14 Ac Lb 24 A 15 Ac Lb 25 A 16 Ac Lb 26 A 17 Ac Lb 27 A 18 Ac Lb 28 A 19 Ac Lb 29 A 20 Ac Lb 30 C 21 Ac Lb 31 A 22 Ac Lb 32 A Sumbawa 23 Ac Sbw 4 A 24 Ac Sbw 5 A 25 Ac Sbw 6 A Flores 26 Ac Flr 1 A 27 Ac Flr 2 C 28 Ac Flr 3 A 29 Ac Flr 4 C M 1 2 3 4 5 6 7 8 9 10
Gambar 3 Pita DNA A. cerana gen
lrRNA. M: penanda DNA
100 pb Promega, 1-2: Ac21Lb, 3-4: Ac22Lb, 5-6: Ac4Sb, 7-8: Ac5Sb, 9-10: Ac6Sb. 900 AF 140508 AF 140509 AF 140511 AcPt1 AcSbw5 AcFlr3 AcLb4 AcLb21 AcFlr4
Gambar 5 Peta restriksi hasil pemotongan gen lrRNA/DraI A. cerana. AcLb21, AcSbw5, AcFlr3, dan AcFlr4: hasil penelitian ini. AF140508, AF140509, dan AF140511: Sittipraneed (2001), AcPt1 dan AcLb4: Apriani (2006).
7
Analisis Homologi (alignment) DNA
Analisis kesamaan (homologi) dilakukan pada masing-masing haplotipe yang ditemu-kan pada penelitian ini dengan haplotipe hasil penelitian Sittipraneed et al. (2001) yang diambil dari GenBank dengan Acc Number: AF140508, AF140509, dan AF140511, haplotipe hasil penelitian Apriani (2006), dan urutan nukleotida A. mellifera dengan Acc
number L06178. Hasil alignment DNA
dengan haplotipe Sittipraneed (2001) ditemukan adanya tiga situs pemotongan yang berbeda. Posisi situs pemotongan yang berbeda disebabkan karena adanya perubahan nukleotida. (Gambar 6).
Analisis Filogenetik A. cerana
Analisis filogenetik dilakukan dengan menggunakan program PAUP 4.10 (PPC) versi Macintosh. Dari hasil analisis didapat bahwa urutan nukleotida dari koloni A. cerana yang dianalisis lebih didominasi oleh nukleo-
tida A (43.834%) dan T (42.103%) (Tabel 6). Jarak genetik terbesar terjadi antara AF140508 dan AcLb4 dengan nilai 3.53%, sedangkan nilai genetik terkecil terjadi antara AcPt1 dan AcSbw5 dengan nilai 0.00% (Tabel 7).
Rasio substitusi transisi terhadap tranversi antar pasangan koloni menunjukkan nilai tertinggi yaitu 2.20%, antara AF140508 dan AcFlr3. Sedangkan nilai terendah yaitu 0.00%, antara AcLb4 dan ACLb21. Total rasio transisi terhadap transversi yaitu 66.67% untuk ts/tv >1 dan 26.67% untuk ts/tv <1 (Lampiran 3). Konstruksi pohon filogenetik dilakukan berdasarkan urutan nukleotida gen
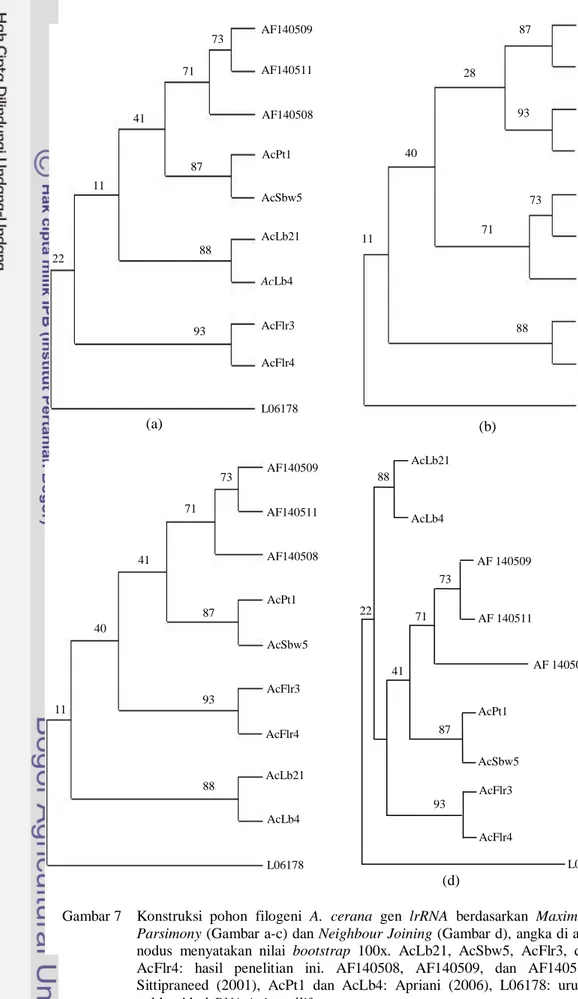
lrRNA A. cerana dengan metode Maximum Parsimony (MP) (Gambar 7a-c) dan
Neighbour Joining (NJ) (Gambar 7d). Dari
hasil analisis dengan menggunakan MP, terdapat 512 karakter yang konstan, 69 karakter yang parsimony uninformative, dan hanya 21 karakter yang parsimony informative.
Tabel 5 Persentase haplotipe A. cerana Lombok, Sumbawa, dan Flores Jumlah koloni (a) Jumlah koloni (b) Persentase haplotipe (%) Persentase haplotipe (a-b) (%) Lokasi A C Sumbawa Lombok A C A C A C Flores
Ket : (a) data hasil penelitian tahun 2007; (b): data hasil penelitian Apriani (2006)
17 5 3 2 - 2 72.72 27.28 100 50 50 - 6 1 2 1 - - 75.86 24.14 83.33 16.67 50 50
AcLb4 AATTTAATCATTATCACTATATTTTTTAAATTAAAATATATATTTTTATAGAATTAATAA 297 AcLb21 AATTTAATCATTATCACTATATTTTAAAAATTAAAATATATATTTTTATAGAATTAATAA 297 AF140509 AATTTAATCATTATCACTATATTTCAAAAATTAAAATATATATTTTTATAGAATAAATAA 297 AF140511 AATTTAATCATTATCACTATATTTTAAAAATTAAAATATATATTTTTATAGAATAAATAA 297 AF140508 AATTTAATCATTATCACTATATCTTAAAAATTAAAATATATGTTTTTATAGAATAAATAA 297 AcPt1 AATTTAATCATTATCACTATATTTTAAAAATTAAAATATATATTTTTATAGAATAAATAA 300 AcSbw5 AATTTAATCATTATCACTATATTTTAAAAATTAAAATATATATTTTTATAGAATAAATAA 300 AcFlr3 AATTTAATCATTATCACTATATTTTAAAAATTAAAATATATATTTTTATAGAATAAATAA 297 AcFlr4 AATTTAATCATTATCACTATATTTTAAAAATTAAAATATATATTTTTATAGAATAAATAA 299 L06178 AATCTAATCACTATTTCTATATTTTATTAATTAAAATATAAATTTTTATAGAA-AAATAA 288 *** ****** *** ****** * ************ *********** ***** AcLb4 AATTTAAAATTTAAATTTTTAAAAA-TTAATAAC--TAAATTATTAAATTTTTTATATTA 354 AcLb21 AATTTAAAATTTAAATTTTTAAAAA-TTAATAAC--TAAATTATTAAATTTTTTATATTA 354 AF140509 AATTTAAAATTTAAATTTTTTAAA--TTAATAAC--TAAATTATTAAATTTTTTATATTA 353 AF140511 AATTTAAAATTTAAATTTTTTAAA--TTAATAAC--TAAATTATTAAATTTTTTATATTA 353 AF140508 AATTCAAAATTTAAATTTTTAAAAA-TTAATAAC--TAAATTATTAAATTTTTTATATTA 354 AcPt1 AACTTAAAATTTAAATTTTTTAAAAATTAATAAC--TAAATTATTAAATTTTTTATATTA 358 AcSbw5 AACTTAAAATTTAAATTTTTTAAAAATTAATAAC--TAAATTATTAAATTTTTTATATTA 358 AcFlr3 AACTTAAAATTTAAATTTTTTTAAAATTAATAAC--TAAATTATTAAATTTTTTATATTA 355 AcFlr4 AACTTAAAATTTAAATTTTTTTAAAATTAATAAC--TAAATTATTAAATTTTTTATATTA 357 L06178 AATATAAA-TTTAAATCATTATTAATTTATAAATATTAAATTATTAAATTATTAAAATTA 347 ** *** ******* ** * *** ** ************** ** * ****
8
Tabel 6 Persentase nukleotida A. cerana lrRNA/DraI
Taxon A C G T 0.43834 0.09005 0.05057 0.42103
Tabel 7 Jarak genetik antar koloni A. cerana lrRNA/DraI
1 2 3 4 5 6 7 8 9 10 1 AcLb4 - 2 AcLb21 0.34 - 3 AF140509 2.69 2.36 - 4 AF140511 2.52 2.19 0.19 - 5 AF140508 3.53 3.19 1.51 1.35 - 6 AcPt1 2.35 2.01 1.34 1.17 1.85 - 7 AcSbw5 2.35 2.01 1.34 1.17 1.85 0.00 - 8 AcFlr3 2.18 1.85 1.85 1.68 2.69 1.17 1.17 - 9 AcFlr4 2.18 1.85 1.85 1.68 2.69 1.17 1.17 0.00 - 10 L06178 12.69 12.69 13.04 12.87 13.34 13.16 13.16 12.83 12.83 - AcLb4 ATAAAAAATATTAATTTCATAATATTATAAATAAAATTAAAAATTTTTATAAATAAATTT 414 AcLb21 ATAAAAAATATTAATTTCATAATATTATAAATAAAATTAAAAATTTTTATAAATAAATTT 414 AF140509 ATAAAAAATATTAACTTCATAATATTATAAATAAAATCAAAAATTTTTATAAATAAATTT 413 AF140511 ATAAAAAATATTAACTTCATAATATTATAAATAAAATCAAAAATTTTTATAAATAAATTT 413 AF140508 ATAAAAAATATTAACTTCATAATATTATAAATAAAATCAAAAATTTTTATAAATAAATTT 414 AcPt1 ATAAAAAATATTAACTTCATAATATTATAAATAAAATCAAAAATTTTTATAAATAAATTT 418 AcSbw5 ATAAAAAATATTAACTTCATAATATTATAAATAAAATCAAAAATTTTTATAAATAAATTT 418 AcFlr3 ATAAAAAATATTAATTTCATAATATTATAAATAAAATCAAAAATTTTTATAAATAAATTT 415 AcFlr4 ATAAAAAATATTAATTTCATAATATTATAAATAAAATCAAAAATTTTTATAAATAAATTT 417 L06178 AAGAAAAATATTATCTCTATAACATTAAAAATTAAAATTAAA-TTTTTATCT-TAAATTT 405 * ********** * **** **** **** *** *** ******* ******* AcLb4 ATAGTTTATCCCATAAATTTTTAATATAAAAATTAATATCATAAA-TAAATTTTAATGTA 473 AcLb21 ATAGTTTATCCCATAAATTTTTAATATAAAAATTAATATCATAAA-TAAATTTTAATGTA 473 AF140509 ATAGTTTATCCCATAAATTTTTAATATAAAAATTAATACTATAAA-TAAATTTTAATGTA 472 AF140511 ATAGTTTATCCCATAAATTTTTAATATAAAAATTAATACTATAAA-TAAATTTTAATGTA 472 AF140508 ATAGTTTATCCCATAAATTTTTAATATAAAAATTAATACTATAAA-TAAATTTTAAGGTA 473 AcPt1 ATAGTTTATCCCATAAATTTTTAATATAAAAATTAATACTATAAA-TAAATTTTAATGTA 477 AcSbw5 ATAGTTTATCCCATAAATTTTTAATATAAAAATTAATACTATAAA-TAAATTTTAATGTA 477 AcFlr3 ATAGTTTATCCCATAAATTTTTAATATAAAAATTAATACTATAAA-TAAATTTTAATGTA 474 AcFlr4 ATAGTTTATCCCATAAATTTTTAATATAAAAATTAATACTATAAA-TAAATTTTAATGTA 476 L06178 ATAGATTATCCCATAAATTTTTAATATAAAAATTAATAAATTAAAATAAAATTTAATTTA 465 **** ********************************* **** **** ***** ** AcLb4 TTAAAAATTTTATATCTAAATTAAATTTATTTCTAAAAAAACTAGATATCAATAAGTTCG 533 AcLb21 TTAAAAATTTTATATCTAAATTAAATTTATTTCTAAAAAAACTAGATATCAATAAGTTCG 533 AF140509 TTAAAAATTTTATATCTAAATTAAATTTATTTCTAAAAAAACTAGATATCAATAACTTCG 532 AF140511 TTAAAAATTTTATATCTAAATTAAATTTATTTCTAAAAAAACTAGATATCAATAACTTCG 532 AF140508 TTAAAAATTTTATATCTAAATTAAATTTATTTCTAAAAAAACTAGATATCAATAACTTCG 533 AcPt1 TTAAAAATTTTATATCTAAATTAAATTTATTTCTAAAAAAACTAGATATCAATAAGTTCG 537 AcSbw5 TTAAAAATTTTATATCTAAATTAAATTTATTTCTAAAAAAACTAGATATCAATAAGTTCG 537 AcFlr3 TTAAAAATTTTATATCTAAATTAAATTTATTTCTAAAAAAACTAGATATTAATAAGTTCG 534 AcFlr4 TTAAAAATTTTATATCTAAATTAAATTTATTTCTAAAAAAACTAGATATTAATAAGTTCG 536 L06178 CTAAAATAATTATATCTAAATTAAATTTATTTCTAAAAAAACTAGATATTAATAAGTTCG 525 ***** **************************************** ***** **** Gambar 6 Homologi urutan nukleotida gen lrRNA A. cerana. AcLb21, AcSbw5, AcFlr3, dan
AcFlr4: hasil penelitian ini. AF140508, AF140509, dan AF140511: Sittipraneed (2001), AcPt1 dan AcLb4: Apriani (2006), Amel_lrRNA: urutan nukleotida
lrRNA Apis mellifera (Acc number: L06178). TTT/AAA: situs restriksi DraI, *: homologi nukleotida.
9
(c) AF140509 AcPt1 AcSbw5 AcFlr3 AcFlr4 AF140511 AF140508 AcLb21 AcLb4 L06178 87 93 73 71 41 88 40 11 (d) AcLb21 AcLb4 AF 140509 AF 140511 AF 140508 AcPt1 AcSbw5 AcFlr3 AcFlr4 L06178 (b) AF140509 AF140511 AF140508 AcPt1 AcFlr3 AcLb21 AcLb4 AcSbw5 AcFlr4 L06178 87 93 73 71 88 28 40 11 AF140509 AF140511 AF140508 AcPt1 AcSbw5 AcLb21 AcLb4 AcFlr3 AcFlr4 L06178 93 88 87 73 71 41 22 11 (a)Gambar 7 Konstruksi pohon filogeni A. cerana gen lrRNA berdasarkan Maximum
Parsimony (Gambar a-c) dan Neighbour Joining (Gambar d), angka di atas
nodus menyatakan nilai bootstrap 100x. AcLb21, AcSbw5, AcFlr3, dan AcFlr4: hasil penelitian ini. AF140508, AF140509, dan AF140511: Sittipraneed (2001), AcPt1 dan AcLb4: Apriani (2006), L06178: urutan nukleotida lrRNA Apis mellifera.
88 73 71 41 87 93 22
10
PEMBAHASAN
Distribusi A. cerana
Lebah madu A. cerana merupakan lebah lokal Asia dengan persebaran yang sangat luas. Berdasarkan Smith (2000), persebaran A.
cerana di Indonesia mencapai kepulauan
Timor. Hal itu sesuai dengan hasil koleksi pada penelitian ini, yaitu dengan ditemukan-nya A. c. indica di Flores
Lebah ini merupakan lebah terbanyak kedua yang dibudidayakan oleh masyarakat Indonesia setelah A. mellifera, sehingga data mengenai distribusi dan keragaman genetik A.
cerana perlu dieksplorasi, untuk memberikan
gambaran mengenai keragaman dari A. cerana di Indonesia.
Analisis Keragaman Genetik lrRNA dan
cox 1-2 A. c. indica
DNA mitokondria (mtDNA) merupakan informasi genetik yang hanya diturunkan secara maternal. DNA ini banyak digunakan untuk mempelajari tentang aliran gen dan keragaman populasi. Berdasarkan Crozier & Crozier (1993), persentase AT pada mtDNA sangat tinggi yaitu 83.33%. Persentase yang tinggi juga diperoleh pada penelitian ini yaitu 88.90%.
Salah satu gen yang digunakan pada analisis mtDNA adalah gen large ribosomal RNA (lrRNA). Gen ini umum digunakan karena tidak menyandikan protein dan memiliki laju mutasi yang tinggi. Analisis keragaman genetik dengan menggunakan analisis gen lrRNA telah banyak dilakukan di antaranya di Thailand oleh Sihanuntavong et
al. (1999) dan Sittipraneed et al. (2001). Di
Indonesia, penelitian mengenai keragaman genetik A. cerana dengan menggunakan analisis gen lrRNA/DraI telah dilakukan oleh Raffiudin & Hadi (2006) terhadap 97 koloni asal Jawa, Kalimantan, Lombok, dan Sumbawa (penelitian pendahuluan untuk tahun 2007).
Keragaman genetik A. c. indica asal Lombok, Sumbawa, dan Flores dengan analisis gen lrRNA/DraI ditemukan dua haplotipe yaitu haplotipe A dan C (penamaan berdasarkan Raffiudin & Hadi (2006)). Berdasarkan peta restriksi, diperoleh enam pita DNA untuk haplotipe A dengan ukuran 9, 47, 79, 91, 95, dan 278 pb, sedangkan pada haplotipe C terdapat tujuh pita dengan ukuran 7, 8, 38, 79, 91, 94, dan 278 pb. Haplotipe A pada penelitian ini hampir sama dengan
haplotipe C pada penelitian Sihanuntavong et
al. (1999). Hal itu dapat dilihat dari ukuran
pita DNA hasil pemotongan lrRNA/DraI yaitu 8, 91, 94, 124, dan 278 pb.
Untuk mendapatkan data yang lebih informatif mengenai keragaman genetika A. c.
indica asal Lombok, Sumbawa dan Flores,
dilakukan analisis pada daerah intergenik cox
1-2. Dari hasil analisis dengan menggunakan
enzim restriksi DraI, diperoleh lima haplotipe. Keragaman genetik yang diperoleh dari analisis pada daerah intergenik cox 1-2 lebih banyak dibandingkan analisis gen lrRNA. Hal itu karena daerah intergenik cox 1-2 memiliki laju mutasi yang lebih tinggi daripada gen
lrRNA.
Persentase Haplotipe A. c. indica
Haplotipe A merupakan haplotipe umum yang ditemukan pada koloni asal Lombok, Sumbawa, dan Flores. Hal itu dibuktikan melalui perhitungan persentase terhadap kedua haplotipe. Berdasarkan perhitungan persentase, haplotipe A memiliki persentase sebesar 72.72% (Lombok), 100% (Sumbawa), dan 50% (Flores), sedangkan haplotipe C memiliki persentase sebesar 27.28% (Lombok) dan 50% (Flores). Perhitungan tersebut mempengaruhi persentase haplotipe
A. c. indica Lombok, dan Sumbawa pada
penelitian sebelumnya (Apriani 2006). Dengan adanya penambahan jumlah koloni yaitu tujuh koloni untuk Lombok dan tiga koloni untuk Sumbawa, terjadi perubahan persentase kedua haplotipe. Pada koloni asal Lombok, terjadi peningkatan persentase pada haplotipe A menjadi 75.86%, sedangkan haplotipe C mengalami penurunan menjadi 24.14%. Begitu juga dengan koloni asal Sumbawa, pada haplotipe A terjadi penurunan sebesar 16.67% menjadi 83.33%, sedangkan haplotipe C meningkat menjadi 16.67% (Lampiran 2).
Terdapat kesamaan haplotipe antara koloni asal Jawa dengan koloni asal Lombok, Sumbawa, dan Flores (haplotipe A). Hal itu terjadi karena pada awalnya pulau Jawa, Lombok, Sumbawa, dan Flores bersatu dengan Asia membentuk suatu daratan (Hall 1997). Karena itulah terjadi aliran gen dari pulau Jawa sampai Flores.
Variasi Nukleotida lrRNA A. c. indica
Hasil alignment DNA dengan haplotipe hasil Sittipraneed et al. (2001), haplotipe Apriani (2006), dan urutan nukleotida
11
A. mellifera (Acc number: L06178)
menunjuk-kan persamaan dan perbedaan situs pemo-tongan enzim restriksi. Terdapat tiga situs pemotongan enzim restriksi yang berbeda, yaitu pada posisi 260, 300, dan 315 pada AcLb21.
Perbedaan situs pemotongan enzim restriksi terjadi karena adanya perubahan nukleotida. Perubahan tersebut dapat terjadi karena adanya mutasi, seperti transversi (purin↔pirimidin), transisi (purin↔purin atau pirimidin↔pirimidin), delesi, dan insersi.
Analisis Pohon Filogeni
Hasil analisis karakterisasi gen lrRNA menunjukkan nukleotida A dan T lebih mendominasi urutan nukleotida pada setiap koloni dengan nilai 43.834% dan 42.103%. Berdasarkan Saccone et al. (1999), komposisi A+T sangat tinggi pada genom serangga dan nematoda.
Perbedaan nukleotida yang terjadi pada semua koloni lebih didominasi oleh transisi. Hal itu dapat dilihat dari nilai rasio subtitusi transisi terhadap transversi. Dari hasil perhitungan, nilai rasio transisi terhadap transversi (ts/tv) terbesar terjadi antara AF140508 dan AcFlr4 sebesar 2.20%, sedangkan nilai ts/tv terkecil terjadi antara AcLb4 dan AcLb21 sebesar 0.00%. Total rasio yang diperoleh untuk ts/tv >1 sebesar 66.67% dan untuk ts/tv <1 sebesar 26.67%. Jarak genetik terbesar terjadi antara AF140508 dan AcLb4 dengan nilai 3.53%, sedangkan nilai genetik terkecil terjadi antara AcPt1 dan AcSbw5 dengan nilai 0.00%.
Konstruksi yang dilakukan dengan menggunakan Maximum Parsimony mengha-silkan tiga pohon dengan topologi yang berbeda. Perbedaan tersebut dapat dilihat dari koloni yang menempati bagian basal di dalam
ingroup. Pada pohon (a), posisi basal di dalam ingroup ditempati oleh AcFlr3 dan AcFlr4,
sedangkan pada pohon (b) dan (c) ditempati oleh AcLb4 dan AcLb21. Adanya perbedaan tersebut dikarenakan analisis ini hanya berdasarkan satu gen saja. Berdasarkan Cao et
al. (1994), analisis dengan menggunakan set
data yang besar dapat memberikan hasil yang lebih kuat dibandingkan dengan analisis berdasarkan gen tunggal. Akan tetapi, dari ketiga pohon tersebut terdapat kesamaan bahwa koloni A. cerana asal Thailand (AF140508, AF140509, dan AF140511) membentuk cluster tersendiri yang terpisah dengan koloni asal Indonesia.
SIMPULAN
Koleksi A. c. indica dilakukan di tujuh kecamatan di Lombok, tiga desa di Sumbawa, dan tiga desa di Flores. Budidaya lebah A. c.
indica di Lombok umumnya dikelola oleh
peternakan keluarga, sedangkan A. c. indica diternakkan secara liar di Sumbawa dan Flo-res. Ukuran nukleotida gen lrRNA yang diamplifikasi berkisar antara 625-629 pb dengan basa AT sekitar 88.90%. Berdasarkan analisis lrRNA/DraI, ditemukan dua haplotipe yaitu haplotipe A dan C. Persentase haplotipe A sebesar 72.72, 100, dan 50%, berturut turut untuk populasi A. c. indica di Lombok, Sumbawa, dan Flores. Persentase haplotipe C sebesar 27.28 dan 50% untuk A. c. indica di Lombok dan Flores. Analisis filogeni berda-sarkan gen lrRNA menggunakan Maximum
Parsimony menunjukkan bahwa populasi
lebah di Thailand membentuk kelompok yang terpisah dengan A. cerana di Indonesia. Jarak genetik terbesar (3.53%) terjadi antara AF140508 (A. cerana asal Thailand) dan AcLb4 (asal Lombok), sedangkan nilai jarak genetik terkecil (0.00%) terjadi antara AcPt1 (Pati) dan AcSbw5 (Sumbawa). Nilai rasio transisi terhadap tranversi (ts/tv), untuk ts/tv >1 sebesar 66.67% dan untuk ts/tv <1 sebesar 26.67%.
SARAN
Perlu adanya penelitian selanjutnya dengan memperluas daerah pengambilan sampel terutama pada daerah-daerah yang belum dieksplorasi, seperti Sumatra, Kalimantan, Bali, Sulawesi, dan Timor. Sehingga data mengenai distribusi dan variasi genetika dari lebah madu A. c. indica di Indonesia lebih lengkap.
DAFTAR PUSTAKA
Apriani. 2006. Keragaman genetik lebah madu A. cerana di Indonesia berdasarkan DNA mitokondria gen ribosoma besar (lrRNA) [Skripsi]. Departemen Biologi. Institut Pertanian Bogor: Bogor.
Cao Y, Adachi A, Janke A, Paabo S, Hasegawa M. 1994. Phylogenetic relationship among eutherian orders estimated from inferred protein sequences of mitochondrial proteins: instability of a tree based on a single gene. J Mol Evol 39: 519-527.
12
Crozier RH, Crozier YC. 1993. The mitochondrial genome of the honeybee
Apis mellifera L: complete sequence
and genome organization. Genetics 133: 97-117
Deowanish S, Nakamura J, Matsuka M, Kimura K. 1996. MtDNA variation among subspesies of Apis cerana using restriction fragment length polymorphism. Apidologie 27: 407-413.
Hall R. 1997. Reconstructing cenozoic South East Asia. Geological Soc London
Spec Publ 106: 153-184.
Michener CD. 2000. The Bees of The World. London: The Johns Hopkins Univ Pr. Morse RA, Flottum K, editor. 1997. Honey
bee Pests, Predators, and Diseases. 3rd Ed. Root Company.
Raffiudin R, Hadi I. 2006. Diferensiasi DNA mitokondria lebah madu Apis cerana di Jawa, Lombok, Sumbawa, dan Flores. Laporan Penelitian Funda- mental Tahun I. Ditjen Pendidikan Tinggi.
Ruttner F. 1988. Biogeography and
Taxo-nomy of Honeybees. Springer-Verlag:
Berlin.
Saccone C, De Giorgi C, Gissi C, Pesole G, Reyes A. 1999. Evolutionary genomics in Metazoa: the mitochondrial DNA as a model system. Gene 238: 195-209.
Sambrooks J, Fritsch EF, Maniatis T. 1989.
Molecular Cloning a Laboratory Manual. Ed ke 2. New York: Cold
Spring Harbor Lab Pr.
Sihanuntavong D, Sittipraneed S, Klinbunga S. 1999. Mitochondrial DNA diversity and population structure of the honey bee, Apis cerana in Thailand. J Apic
Res 38: 211-219.
Sittipraneed S. Sihanuntavong D, Klinbunga S. 2001. Genetic differentiation of honeybee (Apis cerana) in Thailand revealed by polymorphism of a large subunit of mitochondrial ribosomal DNA. J Insect Soc 48: 266-272. Smith D.R, Villafuerte L, Otis G, Palmer
M.R. 2000. Biogeography of Apis
cerana F and A. nigrocincta Smith:
insight from mtDNA studies.
Apidologie 21: 265-279.
Tegelstrom H. 1986. Mitochondrial DNA in natural population: an improved routine for screening of genetic variation based on sensitive silver staining. Electrophoresis 7: 226-229. Winston LM. 1987. The Biology of the
Honeybee. Cambridge: Harvard Univ
14
Lampiran 1 Daerah koleksi A. c. indica Lombok dan Sumbawa (Apriani 2006) a. Lombok
No Kode
Sampel Lokasi Koordinat
Ketinggian (meter)
Jumlah Koloni 1 Ac Lb 4 Mataram, Kec. Selaparang,
Mataram
80 34’ 57’’
1160 05’ 35” - 1
2 Ac Lb 5 Trunojoyo, Kec. Ampenan, kodya Mataram
80 34’ 46.4’’
1160 05’ 09” - 1
3 Ac Lb 6 Gomong, Kec. Mataram Barat, Kodya Mataram
80 35’ 36.4’’
1160 10’ 56” - 1
4 Ac Lb 7 Bertais, Kec. Cakranegara, Kodya Mataram
80 35’ 10’’
1160 05’ 53” - 1
5 Ac Lb 8 Jorong, Kelayu, Kec. Mataram Barat, Kodya Mataram
- - 1
6 Ac Lb 9 Gomong, Kec. Mataram Barat, Kodya Mataram
80 35’05’’
1160 06’ 20” -
1 7 Ac Lb 10 Kec. Selong, Kab. Lombok
Timur 80 39’ 27’’ 1160 08’ 39” - 1 b. Sumbawa No Kode
Sampel Lokasi Koordinat
Ketinggian (meter)
Jumlah Koloni 1 Ac Sb 1 Desa Jorok, Kec.
Unteriwes, Kab. Sumbawa - - 1
2 Ac Sb 2 Kec. Moyo Utara, Olat Rawa, Kab. Sumbawa
80 31’ 05’’
1170 33’ 55” - 1
3 Ac Sb 3 Dusun Rapit Doya, Kec. Unteriwes, Kab. Sumbawa
80 32’ 14’’
Lampiran 2 Peta persebaran A. cerana di Indonesia berdasarkan lrRNA/DraI (2006-2007) A B D A C A C A C 94.46% 1.53% 100% 75.86% 24.14% 83.33% 16.67% 50% 50%
Lampiran 3 Rasio substitusi transisi dengan transversi
---ti-- ---tv--- ---ident--- prop ti/tv Taxa AG CT AC AT CG GT AA CC GG TT diff ratio total --- AcLb4 vs. AcLb21 0 0 0 2 0 0 259 50 30 254 0.00 0.00 595 AcLb4 vs. AF140509 1 8 0 6 1 0 254 48 29 246 0.03 1.29 593 AcLb4 vs. AF140511 1 7 0 6 1 0 254 48 29 247 0.03 1.14 593 AcLb4 vs. AF140508 2 11 0 6 1 1 255 48 29 242 0.04 1.62 595 AcLb4 vs. AcPt1 1 7 0 6 0 0 256 49 30 246 0.02 1.33 595 AcLb4 vs. AcSbw5 1 7 0 6 0 0 256 49 30 246 0.02 1.33 595 AcLb4 vs. AcFlr3 0 6 0 7 0 0 257 48 30 247 0.02 0.86 595 AcLb4 vs. AcFlr4 0 6 0 7 0 0 257 48 30 247 0.02 0.86 595 AcLb4 vs. L06178 3 20 3 46 0 2 233 41 26 209 0.13 0.45 583 AcLb21 vs. AF140509 1 8 0 4 1 0 256 48 29 246 0.02 1.80 593 AcLb21 vs. AF140511 1 7 0 4 1 0 256 48 29 247 0.02 1.60 593 AcLb21 vs. AF140508 2 11 0 4 1 1 257 48 29 242 0.03 2.17 595 AcLb21 vs. AcPt1 1 7 0 4 0 0 258 49 30 246 0.02 2.00 595 AcLb21 vs. AcSbw5 1 7 0 4 0 0 258 49 30 246 0.02 2.00 595 AcLb21 vs. AcFlr3 0 6 0 5 0 0 259 48 30 247 0.02 1.20 595 AcLb21 vs. AcFlr4 0 6 0 5 0 0 259 48 30 247 0.02 1.20 595 AcLb21 vs. L06178 3 20 3 46 0 2 234 41 26 208 0.13 0.45 583 AF140509 vs. AF140511 0 1 0 0 0 0 258 54 30 251 0.00 --- 594 AF140509 vs. AF140508 1 5 0 2 0 1 256 54 30 244 0.02 2.00 593 AF140509 vs. AcPt1 0 5 0 2 1 0 257 52 30 247 0.01 1.67 594 AF140509 vs. AcSbw5 0 5 0 2 1 0 257 52 30 247 0.01 1.67 594 AF140509 vs. AcFlr3 1 6 0 3 1 0 257 50 29 247 0.02 1.75 594 AF140509 vs. AcFlr4 1 6 0 3 1 0 257 50 29 247 0.02 1.75 594 AF140509 vs. L06178 4 20 5 44 1 2 232 42 25 207 0.13 0.46 582 AF140511 vs. AF140508 1 4 0 2 0 1 256 54 30 245 0.01 1.67 593 AF140511 vs. AcPt1 0 4 0 2 1 0 257 52 30 248 0.01 1.33 594 AF140511 vs. AcSbw5 0 4 0 2 1 0 257 52 30 248 0.01 1.33 594 AF140511 vs. AcFlr3 1 5 0 3 1 0 257 50 29 248 0.02 1.50 594 AF140511 vs. AcFlr4 1 5 0 3 1 0 257 50 29 248 0.02 1.50 594 AF140511 vs. L06178 4 19 5 44 1 2 232 42 25 208 0.13 0.44 582 AF140508 vs. AcPt1 1 6 0 2 1 1 258 53 30 243 0.02 1.75 595 AF140508 vs.