ISOLASI DAN IDENTIFIKASI JENIS SENYAWA FLAVONOID DALAM FASE n-BUTANOL DARI EKSTRAK METANOL DAUN DARUJU
(Acanthus ilicifolius Linn.), Acanthaceae. Ratna Djamil, Lissa Desfonda
Fakultas Farmasi Universitas Pancasila
Abstract
Ilicifolius Acanthus Linn. is one derived from medicinal plants familia Acanthaceae are known to contain flavonoids, but not yet known about the classes and types of flavonoid compounds contained in these plants. Based on this, then do research about ilicifolius Acanthus Linn., With the aim to know the classes and types of flavonoid compounds contained in these plants. Our research methods include the collection and provision of materials, phytochemical screening, the preliminary investigation of flavonoid, flavonoid isolation and identification of isolates using the method of ultraviolet-visible light. Results of phytochemical screening of crude drugs and known in the powder in n-butanol phase of methanol extracts of leaves contained daruju flavonoids, saponins, tannins, steroids and coumarins. The results of identification of flavonoid compounds suspected of classes and types are as follows flavonoidnya NB-III isolates suspected of flavonol compounds with hydroxyl group on the 3,5,7,8 positions and clusters prenil oxygenation in position 6. IV isolates suspected of flavonol compounds with hydroxyl group at positions 3, 5, 7, prenil group at position 6 and O-ring diOH B. NB-VI isolates suspected of flavanone compounds with hydroxyl group at position O-diOH in ring A and 6.7 or 7.8-in OH.
Keywords : Ilicifolius Acanthus Linn., Acanthaceae, flavonoid phytochemical screening, n-butanol phase,
ultraviolet-visible light, sliding reagent.
PENDAHULUAN
Kekayaan jenis tanaman yang tumbuh di Indonesia sangat berlimpah, termasuk di dalamnya adalah tanaman daruju (Acanthus ilicifolius Linn.) yang dapat dimanfaatkan untuk tujuan pengobatan. Namun, informasi tentang nama maupun kandungannya belum banyak dipublikasikan, sehingga pemanfaatan tanaman untuk tujuan pengobatan didasarkan pada pengalaman secara turun-temurun. Informasi mengenai manfaat tanaman daruju terbatas pada pengalaman setiap daerah dan membuka kemungkinan manfaat satu jenis tanaman dapat beragam antara satu daerah dengan daerah lain.
Perkembangan pemanfaatan sumber-sumber biofarmaka dengan berbagai tingkatnya dari mulai bahan alam dasar sampai senyawa murni telah menandai pesatnya perkembangan penggunaan bahan yang diperkuat dengan keinginan untuk “back to nature”. Hal ini merupakan tantangan bagi para ilmuwan khususnya yang menekuni bahan alam untuk terus melakukan pencarian senyawa obat dari tanaman, termasuk diantaranya senyawa aktif antikanker.
Salah satu contoh tanaman yang digunakan sebagai obat tradisional adalah tanaman daruju. Daruju tumbuh liar di daerah pantai, tepi sungai, serta tempat-tempat lain yang tanahnya berlumpur dan berair payau.
Daun, biji dan akar daruju berkhasiat sebagai obat cacing, obat sakit perut, anti radang, pembersih darah, obat hepatitis, obat pembesaran hati dan limpa, obat TBC kelenjar, obat gondongan, obat asma bronkial, obat
kanker terutama kanker hati, obat luka terkena racun anak panah, ekspektoran, antiflogistik, anti parotitis, dan anti kanker.
Daun daruju mengandung senyawa flavonoid, asam fenolat, asam p-kumarat, asam p-hidroksi benzoat dan saponin disamping itu akarnya mengandung asam amino.
Flavonoid merupakan salah satu golongan fenol alam yang terbesar. Sebenarnya, flavonoid terdapat dalam semua tanaman hijau. Dalam tanaman, aglikon flavonoid (yaitu flavonoid tanpa gula terikat) terdapat dalam berbagai bentuk struktur. Semuanya mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi C6-C3-C6, yaitu dua cincin aromatik yang dihubungkan oleh satuan tiga karbon. Dari literatur, tidak disebutkan jenis flavonoid dari tanaman daruju.
Berdasarkan hal tersebut, maka dilakukan penelitian untuk mengetahui dan mengidentifikasi jenis senyawa flavonoid dari daun daruju. Penelitian ini meliputi penapisan fitokimia, pembuatan ekstrak, partisi ekstrak, pemeriksaan pendahuluan ekstrak, isolasi golongan senyawa flavonoid dan identifikasi senyawa isolat dengan menggunakan spektrofotometer ultraviolet-cahaya tampak. BAHAN DAN METODE
BAHAN
Bahan penelitian
Serbuk simplisia dari daun daruju (Acanthus ilicifolius L.), metanol, heksan, etil asetat, n-butanol, amonia 25%, kloroform, pereaksi
Dragendorff, asam klorida (1:10 v/v), pereaksi Mayer, air panas, serbuk magnesium, asam klorida pekat, amil alkohol, asam klorida 2N, aquadest, besi (III) klorida 1%, pereaksi Stiassny (formaldehid 30%-asam klorida pekat 2:1), natrium asetat, natrium hidroksida 1N, eter, asam asetat anhidrat, asam sulfat pekat, kloroform, amonia 10%, petroleum eter, etanol 95%, serbuk zink, aseton, asam borat, asam oksalat, asam asetat glasial, asam asetat 15%.Peralatan yang digunakan Timbangan analitik, alat-alat gelas, corong, rotavapor, kertas saring, kertas Whatman No.3, camber, lumpang dan alu, corong pisah, lampu ultraviolet dan spektrofotometer ultraviolet-cahaya tampak.
METODE
Penapisan fitokimia. Penapisan fitokimia terhadap ekstrak.
Identifikasi Golongan Alkaloid.
Sejumlah 1 g serbuk simplisia atau 19 mg untuk ekstrak ditambahkan dengan 5 ml amonia 25% dalam mortir. Setelah itu ditambahkan 20 ml kloroform gerus dan saring. Filtrat berupa larutan organik (larutan A) digunakan untuk percobaan selanjutnya. Sebagian larutan A diteteskan pada kertas saring yang telah ditetesi pereaksi Dragendorff. Terbentuknya warna merah atau jingga menunjukan adanya alkaloid. Sisa larutan organik (larutan A) diekstraksi dua kali dengan asam klorida (1 : 10 v/v) diambil fase asam (larutan B). kedalam kedua tabung reaksi yang masing-masing berisi 5 ml larutan B ditambahkan beberapa tetes pereaksi Dragendorff dan pereaksi Mayer. Terbentuknya endapan merah bata dengan pereaksi Dragendorff atau endapan putih dengan pereaksi Mayer membuktikan adanya alkaloid.
Identifikasi Golongan Flavonoid.
Sejumlah 1 g serbuk simplisia atau 19 mg untuk ekstrak ditambahkan 100 ml air panas selama 5 menit dan saring. Terhadap 5 ml filtrat ditambahkan serbuk magnesium, 1 ml asam klorida pekat dan 2 ml amil alkohol kemudian kocok kuat, biarkan memisah. Adanya flavonoid ditunjukan dengan terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol.
Identifikasi Golongan Saponin.
Sebanyak 10 ml larutan percobaan pada identifikasi flavonoid dimasukan kedalam tabung reaksi, kocok kuat secara vertikal selama 10 detik. Terbentuknya busa setinggi 1-10 cm yang stabil dalam waktu kurang lebih 10 menit
dan tidak hilang pada penambahan setetes asam klorida 2 N menunjukan adanya saponin.
Identifikasi Golongan Tanin.
Sejumlah 1 g serbuk simplisia atau 19 mg untuk ekstrak ditambahkan 100 ml air, didihkan selama 15 menit, didinginkan dan disaring dengan kertas saring, kemudian filtrat dibagi menjadi dua bagian. Kedalam filtrat pertama ditambahkan larutan besi (III) klorida 1% terbentuk warna hijau biru atau kehitam-hitaman menunjukan adanya senyawa golongan tanin. Kedalam filtrat yang kedua ditambahkan 15 ml pereaksi Stiassny (formaldehid 30% - asam klorida pekat 2:1),dipanaskan diatas penangas air, terbentuk endapan warna merah muda menunjukan adanya tannin katekuat. Selanjutnya endapan disaring, filtrat dijenuhkan dengan natrium asetat, ditambahkan beberapa tetes larutan besi (III) klorida 1% terbentuk warna biru tinta menunjukan adanya tanin galat.
Identifikasi Golongan Kuinon.
Sejumlah 1 g serbuk atau 19 mg untuk ekstrak ditanbahkan 10 ml air, didihkan selama 5 menit kemudian disaring. Filtratnya sebanyak 5 ml ditambahkan natrium hidroksida 1 N. Terbentuk warna merah intensif menunjukkan adanya senyawa golongan kuinon.
Identifikasi Golongan Steroid atau Triterpenoid.
Sejumlah 1 g serbuk simplisia atau 19 mg untuk ekstrak dimaserasi dengan 20 ml eter selama 2 jam (dalam wadah tertutup rapat), kemudian disaring dan diambil filtratnya. Dari filtrat tersebut diambil sebanyak 5 ml, diuapkan dalam cawan penguap hingga diperoleh residu. Selanjutnya kedalam residu tersebut ditambahkan 2 tetes larutan asam asetat anhidrat dan 1 tetes asam sulfat pekat. Terbentuknya warna merah menunjukan adanya senyawa triterpenoid sedangkan terbentuknya warna hijau menunjukkan adanya senyawa steroid.
Identifikasi Golongan Kumarin.
Sejumlah 2 g serbuk simplisia atau 39 mg untuk ekstrak dimasukkan ke dalam tabung reaksi (volume 20 ml) ditambahkan 10 ml pelarut kloroform dan dipasang corong (yang diberi lapisan kapas yang telah dibasahi dengan air) pada mulut tabung kemudian dipanaskan selama 10 menit diatas penangas air kemudian didinginkan, selanjutnya disaring dengan kertas saring, filtrat diuapkan pada cawan penguap sampai mengering, sisa ditambahkan air panas sebanyak 10 ml kemudian didinginkan. Larutan dimasukkan kedalam tabung reaksi dan ditambahkan 0,5 ml larutan amonia 10% kemudian diamati dibawah sinar lampu ultraviolet pada panjang gelombang 366 nm
Disampaikan dalam Kongres Ilmiah XVIII IAI Makasar, 10-12 Desember 2010
maka terjadi fluorosensi warna biru atau hijau menunjukan adanya golongan senyawa kumarin.
Identifikasi Golongan Minyak Atsiri. Sejumlah 2 g serbuk simplisia dan 39 mg untuk ekstrak, dimasukkan ke dalam tabung reaksi ditambahkan 10 ml pelarut petroleum eter dan pasang corong (yang diberi lapisan kapas yang telah dibasahi air) pada mulut tabung. Panaskan selama 30 menit diatas penangas air dan didinginkan, saring dengan kertas saring. Filtrat diuapkan pada cawan penguap sampai kering, residu yang diperoleh dilarutkan dalam 5 ml pelarut alkohol, saring dengan kertas saring, filtratnya diuapkan pada cawan penguap residu berbau aromatik/menyenangkan menunjukan adanya senyawa golongan minyak atsiri.
Pembuatan ekstrak metanol daun daruju. Pembuatan ekstrak dibuat dengan mengekstraksi 500 g serbuk simplisia secara maserasi dengan pelarut metanol hingga terekstraksi sempurna, filtrat yang diperoleh kemudian dipekatkan dengan rotavapor sehingga diperoleh ekstrak kental metanol. Partisi ekstrak metanol.
Ekstrak kental metanol dipartisi dalam corong pisah berturut-turut dengan pelarut n-heksan, etil asetat, n-butanol. Fase n-butanol dipekatkan dengan rotavapor sampai diperoleh ekstrak kental n-butanol.
Pemeriksaan pendahuluan fase. Dengan Reaksi Warna.
Reaksi Pew.
Satu ml larutan percobaan diuapkan sampai kering. Sisa ditambahkan 1-2 ml etanol 95%, 500 mg serbuk zink dan 2 ml asam klorida 2N, lalu didiamkan 1 menit, kemudian ditambahkan 0,5 ml asam klorida P. Adanya flavonoid ditunjukkan dengan terbentuknya warna merah intensif 2-5 menit, menunjukkan adanya flavonoid (glikosida-3-flavonol).
Reaksi Shinoda.
Satu ml larutan percobaan diuapkan sampai kering. Sisa ditambahkan 1 ml etanol 95%, 100 mg serbuk magnesium dan 0,5 ml asam klorida. Bila terbentuk warna merah jingga sampai merah ungu menunjukkan adanya senyawa flavonoida golongan flavon, khalkon, auron.
Reaksi Wilson Taubock.
Satu ml larutan percobaan diuapkan sampai kering, lalu ditambahkan aseton, asam borat dan asam oksalat. Uapkan hati-hati diatas tangas air. Sisa ditambahkan 10 ml eter, kemudian diamati dibawah sinar UV dengan panjang gelombang 366 nm. Jika terlihat
pendaran warna kuning intensif menunjukkan adanya senyawa flavonoid.
Dengan Kromatografi kertas.
Pemeriksaan senyawa flavonoid dari ekstrak kental n-butanol dilakukan secara kromatografi kertas menggunakan kertas Whatman no.3 dengan fase gerak yaitu n-butanol─asam asetat glasial─air dengan perbandingan 4 : 1 : 5. Diamati perubahan warna kromatogram sebelum dan sesudah diuapi dengan amonia.
Isolasi Senyawa Flavonoid.
Isolasi senyawa flavonoid dilakukan secara kromatografi kertas preparatif. Mula-mula fase n-butanol yang berupa ekstrak kental ditambahkan dengan metanol secukupnya. Kemudian ekstrak tersebut ditotolkan dengan arah memanjang seperti pita pada batas awal eluasi pada kertas Whatman No.3 sampai jenuh. Selanjutnya kertas preparatif dieluasi menggunakan fase gerak pertama yaitu BAA (n-butanol-asam asetat glasial-air dengan perbandingan 4:1:5), setelah mencapai batas eluasi kertas preparatif diangkat dan dikeringkan. Kemudian masing-masing pita yang terbentuk digunting menjadi potongan-potongan kecil dan diekstraksi dengan metanol. Sebelum diidentifikasi dengan spektrofotometer ultraviolet-cahaya tampak senyawa yang diidentifikasi harus senyawa murni, senyawa murni ditandai dengan terbentuknya pita tunggal, maka pita-pita yang sudah dilarutkan dalam metanol ditotolkan kembali pada kertas Whatman No.3 dan dieluasi menggunakan fase gerak kedua yaitu asam asetat 15%.
Identifikasi Senyawa Flavonoid Dengan Spektrofotometer Ultraviolet-Cahaya Tampak.
Identifikasi golongan dan jenis senyawa flavonoid dilakukan menggunakan spektrofotometer ultraviolet-cahaya tampak. Mula-mula isolat murni yang mengandung senyawa flavonoid dilarutkan dalam metanol pa kemudian dilihat spektrumnya menggunakan spektrofotometer-ultraviolet cahaya tampak. Jika spektrum terlihat pada rentang 240-285 nm (pita II) dan 300-550 nm (pita I) maka isolat merupakan senyawa flavonoid dan selanjutnya dilakukan penambahan pereaksi geser seperti natrium hidroksida, aluminium klorida, asam klorida, natrium asetat dan asam borat lalu amati pergeseran panjang gelombang maksimum sesudah dilakukan penambahan pereaksi geser.
HASIL DAN PEMBAHASAN Penapisan fitokimia.
Penapisan fitokimia dilakukan untuk mengetahui kandungan senyawa kimia dalam serbuk simplisia dan dalam fase n-butanol dari ekstrak metanol daun daruju (Acanthus ilicifolius Linn.). dari hasil penapisan tersebut dapat diketahui bahwa dalam serbuk simplisia dan dalam fase n-butanol mengandung senyawa flavonoid, saponin, tanin, steroid dan kumarin.
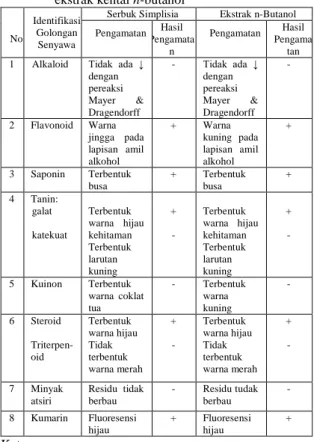
Tabel 1. Hasil penapisan fitokimia dari serbuk dan ekstrak kental n-butanol
No
Identifikasi Golongan
Senyawa
Serbuk Simplisia Ekstrak n-Butanol Pengamatan Hasil Pengamata n Pengamatan Hasil Pengama tan 1 Alkaloid Tidak ada ↓
dengan pereaksi Mayer & Dragendorff - Tidak ada ↓ dengan pereaksi Mayer & Dragendorff - 2 Flavonoid Warna jingga pada lapisan amil alkohol + Warna kuning pada lapisan amil alkohol + 3 Saponin Terbentuk busa + Terbentuk busa + 4 Tanin: galat katekuat Terbentuk warna hijau kehitaman Terbentuk larutan kuning + - Terbentuk warna hijau kehitaman Terbentuk larutan kuning + - 5 Kuinon Terbentuk warna coklat tua - Terbentuk warna kuning - 6 Steroid Triterpen-oid Terbentuk warna hijau Tidak terbentuk warna merah + - Terbentuk warna hijau Tidak terbentuk warna merah + - 7 Minyak atsiri Residu tidak berbau - Residu tudak berbau - 8 Kumarin Fluoresensi hijau + Fluoresensi hijau + Keterangan :
+ = Memberikan reaksi positif - = Memberikan reaksi negatif
Ekstraksi dan Isolasi. Pembuatan ekstrak. Pembuatan ekstrak dilakukan dengan cara maserasi terhadap 500,04 g serbuk simplisia daun daruju menggunakan pelarut metanol dan menghasilkan ekstrak kental sebanyak 50,8548 g. Rendemen ekstrak sebesar 10,17%.
Partisi ekstrak.
Ekstrak kental metanol dipartisi dengan menggunakan pelarut n-heksan, etil asetat dan n-butanol, hasil partisi n-butanol dipekatkan dengan rotavapor hingga diperoleh ekstrak kental sebesar 9, 7023 g.
Pemeriksaan Pendahuluan Senyawa Flavonoid. Reaksi warna
Tabel 2. Hasil reaksi warna terhadap fase n-butanol
Reaksi Warna Pengamatan Hasil
Percobaan
Pew Merah +
Shinoda Kuning jingga +
Wilson Taubock Fluoresensi
kuning
+
Dari hasil reaksi warna diatas dapat diketahui dalam fase n-butanol terdapat senyawa flavonoid yang ditunjukkan dengan hasil yang positif pada ketiga reaksi yaitu reaksi Pew yang berwarna merah, reaksi Shinoda yang berwarna kuning jingga dan reaksi Wilson-taubock yang berfluoresensi kuning. Dari ketiga reaksi dapat disimpulkan bahwa dalam fase n-butanol dari ekstrak metanol daun daruju (Acanthus ilicifolius Linn.) terdapat senyawa flavonoid dengan golongan antara lain flavon, auron atau khalkon
Pemeriksaan pendahuluan secara kromatografi kertas.
Ekstrak kental n-butanol yang diperoleh dari hasil partisi dilarutkan dengan metanol secukupnya, kemudian dilakukan pemeriksaan pendahuluan secara kromatografi kertas untuk memperoleh fase gerak yang sesuai guna proses pemisahan selanjutnya. Fase diam yang digunakan adalah air yang terikat pada kertas Whatman No. 3. Fase gerak yang memberikan hasil terbaik yaitu fase gerak n-butanol−asam asetat glasial−air (BAA) dengan perbandingan 4:1:5. Selanjutnya kromatogram diberi uap amonia dan diamati warna yang timbul sebelum dan sesudah diberi uap amonia dapat dilihat pada Gambar 1 dan 2.
Gambar 1. Profil kromatogram dalam bentuk pita kertas dari fase n-butanol sebelum diuapi amonia
Disampaikan dalam Kongres Ilmiah XVIII IAI Makasar, 10-12 Desember 2010
Keterangan :Fase gerak : BAA (n-butanol-asam asetat glasial-air 4:1:5)
Fase diam : Kertas Whatman No.3 Deteksi : dibawah sinar UV 366 nm
Gambar 2. Profil kromatogram dalam bentuk pita kertas dari fase n-butanol sesudah diuapi amonia
Keterangan :
Fase gerak : BAA (n-butanol-asam asetat glasial-air 4:1:5)
Fase diam : Kertas Whatman No.3
Deteksi : dibawah sinar UV 366 nm
Isolasi Senyawa Flavonoid.
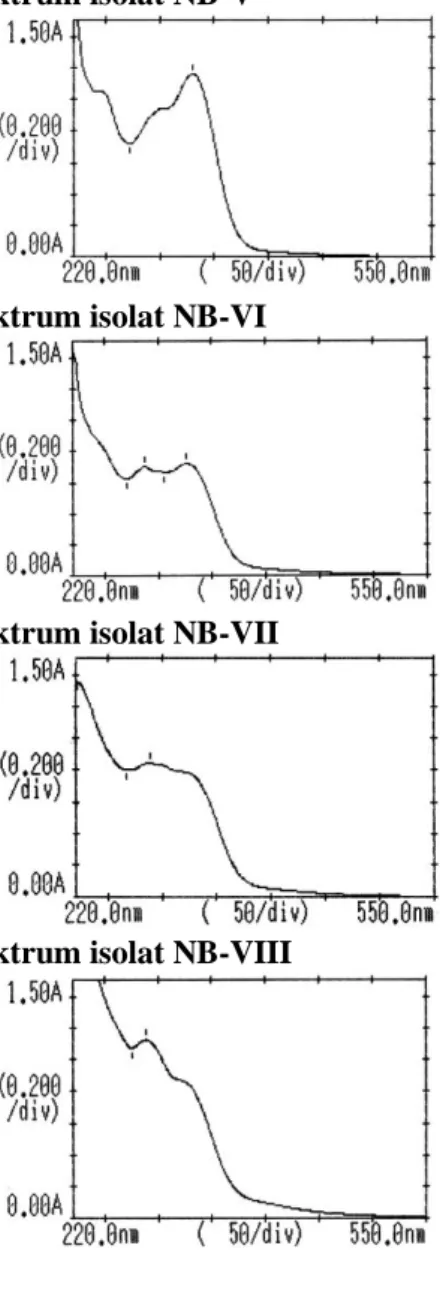
Isolasi senyawa flavonoid dilakukan dengan cara kromatografi kertas preparatif, ekstrak kental n-butanol yang telah dilarutkan dengan metanol ditotolkan dalam bentuk garis pada kertas Whatman No.3 dan dieluasi dengan cairan eluen BAA (n-butanol−asam asetat glasial−air) dengan perbandingan 4:1:5 yang menghasilkan sembilan pita yang dapat dilihat pada Gambar 1. Kesembilan pita tersebut diidentifikasi secara spektrofotometri ultraviolet-cahaya tampak, spektrum dan panjang gelombang dapat dilihat pada Gambar 4, ternyata yang memberikan panjang gelombang serapan maksimum untuk flavonoid hanya tiga pita yaitu NB-III, NB-IV dan NB-VI. Masing-masing pita tersebut digunting kecil-kecil dan diekstraksi dengan metanol. Selanjutnya isolat yang diperoleh dieluasi kembali dengan asam asetat 15% untuk mengetahui apakah pita tersebut sudah merupakan pita tunggal. Dari hasil eluasi dengan asan asetat 15% ternyata ketiga pita tersebut sudah merupakan pita tunggal yang dapat dilihat pada Gambar 3. Selanjutnya masing-masing pita tunggal tersebut
diidentifikasi dengan spektrofotometer ultraviolet-cahaya tampak.
Gambar 3. Kromatogram bentuk pita tunggal setelah dipisahkan dengan fase gerak kedua(asam asetat 15%)
Spektrum isolat NB-I
Spektrum isolat NB-II
Spektrum isolat NB-III
Spektrum isolat NB-IV
NB-VI NB-IV
Spektrum isolat NB-V
Spektrum isolat NB-VI
Spektrum isolat NB-VII
Spektrum isolat NB-VIII
Spektrum isolat-IX
Gambar 4. Spektrum isolat yang diidentifikasi secara spektrofotometer ultraviolet-cahaya tampak Tabel 3. Panjang gelombang dan serapan setiap isolat
Isolat
Panjang gelombang
(λ)
Serapan
Pita I Pita II Pita I Pita II Isolat NB-I - 265,5 - 1,095 Isolat NB-II - 265,0 - 1,089 Isolat NB-III 324,5 263,0 0,612 1,077 Isolat NB-IV 331,5 250,5 1,156 1,238 Isolat NB-V 330,5 - 1,161 - Isolat NB-VI 326,5 288,0 0,724 0,706 Isolat NB-VII - 288,5 - 0,846 Isolat NB-VIII - 289,0 - 1,125 Isolat NB-IX - 255,5 - 1,211
Identifikasi Isolat. Isolat NB-III.
Identifikasi isolat NB-III dilakukan dengan mengamati pergeseran panjang gelombang serapan maksimum sebelumdan sesudah penambahan pereaksi geser seperti natrium hidroksida, aluminium klorida, aluminium klorida dan asam klorida, natrium asetat dan natrium asetat dan asam borat.
Gambar 5. Spektrum Isolat NB-III fasen-butanol dengan pereaksi geser
Keterangan: : metanol :NaOH :AlCl3 :AlCl3/HCl :Na Asetat : Na Asetat + H3BO3
Tabel 4. Pergeseran panjang gelombang maksimum isolat NB-III
No. Pereaksi Geser
Panjang gelombang maksimum Pergeseran Pita I (nm) Pita II (nm) Pita I (nm) Pita II (nm) 1 2 3 4 5 6 7 8 Metanol Metanol + NaOH Metanol + NaOH 5’ Metanol + AlCl3 Metanol + AlCl3 + HCl Metanol + NaOAc Metanol + NaOAc 5’ Metanol + NaOAc +H3BO3 330,0 380,0 379,0 341,5 329,0 328,5 328,5 335,5 255,0 264,5 264,0 259,0 258,0 253,0 253,0 252,5 - 50 49 11,5 1 1,5 1,5 5,5 - 9,5 9 4 3 2 2 2,5
Hasil pemeriksaan pendahuluan terhadap ekstrak n-butanol dengan pereaksi Pew menunjukkan adanya senyawa flavonoida (glikosida 3-flavonol), dengan pereaksi Shinoda menunjukkan adanya senyawa flavon, khalkon, dan auron dan dengan pereaksi Wilson Taubock menunjukkan adanya senyawa 5-hidroksi flavonol, 5-hidroksi flavon.
Dari pemeriksaan pendahuluan secara kromatografi kertas isolat NB-III mengarah dugaan pada auron yang tak mengandung 4’-OH bebas atau flavonol yang mengandung 3-OH bebas dan disertai atau tanpa 5-3-OH bebas. Hal ini didasarkan pada warna bercak kromatogram hijau sebelum diberi uap amonia
550,0 nm 220,0 nm (50/div) Panjang gelombang () 0,00 A 2.00 A (0,500 /div) Abs or b an ( A)
Disampaikan dalam Kongres Ilmiah XVIII IAI Makasar, 10-12 Desember 2010
dan berubah menjadi warna hijau tua setelah diberi uap amonia.
Pada identifikasi secara spektrofotometri menggunakan spektrofotometer ultraviolet-cahaya tampak dalam pelarut metanol, isolat memberikan serapan maksimum pada panjang gelombang 330,0 nm untuk pita I dan 255,0 nm untuk pita II. Dari data tersebut menunjukkan bahwa isolat adalah golongan flavon, flavonol (3-OH tersubstitusi) atau isoflavon.
Pada penambahan natrium hidroksida serapan maksimum pita I menjadi 380,0 nm berarti terjadi pergeseran batokromik sebesar 50 nm dan dengan penurunan kekuatan selama 5 menit. Dari data ini menunjukkan adanya gugus OH pada posisi 3 dan tidak ada 4’-OH bebas.
Pada penambahan aluminium (III) klorida dan asam klorida serapan maksimum pita I menjadi 329,0 nm berarti terjadi pergeseran hipsokromik pada pita I sebesar 1 nm. Dari data ini menunjukkan adanya gugus OH pada posisi 5 dengan gugus prenil pada posisi 6.
Pada penambahan natrium asetat serapan maksimum pita II menjadi 253,0 nm berarti terjadi pergeseran hipsokromik pada pita II sebesar 2 nm. Dari data ini menunjukkan adanya gugus OH pada posisi 7 dengan oksigenasi pada 6 atau 8.
Pada penambahan natrium asetat dan asam borat serapan maksimum pita I menjadi 335,5 nm berarti terjadi pergeseran batokromik pada pita I sebesar 5,5 nm. Dari data ini menunjukkan adanya gugus OH pada posisi O-diOH pada cincin A (6,7 atau 7,8).
Dari semua data diatas dapat disimpulkan bahwa isolat NB-III diduga senyawa flavonol dengan gugus OH pada posisi 3,5,7,8 oksigenasi dan gugus prenil pada posisi 6.
Gambar 6. Senyawa flavonol dengan gugus OH pada posisi 3,5,7,8 oksigenasi dan gugus prenil pada posisi 6
Isolat NB-IV.
Identifikasi isolat NB-IV dilakukan dengan mengamati pergeseran panjang gelombang serapan maksimum sebelum dan sesudah penambahan pereaksi geser seperti natrium hidroksida, aluminium klorida, aluminium klorida dan asam klorida, natrium asetat dan natrium asetat dan asam borat.
Gambar 7. Spektrum Isolat NB-IV fase n-butanol dengan pereaksi geser Keterangan: : metanol :NaOH :AlCl3 :AlCl3/HCl :Na Asetat : Na Asetat + H3BO3
Tabel 5. Pergeseran panjang gelombang maksimum isolat NB-IV No. Pereaksi Geser Panjang gelombang maksimum Pergeseran Pita I (nm) Pita II (nm) Pita I (nm) Pita II (nm) 1. 2. 3. 4. 5. 6. 7. 8. Metanol Metanol + NaOH Metanol + NaOH 5’ Metanol + AlCl3 Metanol + AlCl3 + HCl Metanol + NaOAc Metanol + NaOAc 5’ Metanol + NaOAc +H3BO3
330,5 381,0 377,0 342,0 330,0 334,5 339,5 352,5 251,0 263,5 253,0 259,5 253,5 257,5 259,5 259,5 - 50,5 46,5 11,5 0,5 4 9,5 22 - 12,5 2 8,5 2 6,5 8,5 8,5
Hasil pemeriksaan pendahuluan terhadap ekstrak n-butanol dengan pereaksi Pew menunjukkan adanya senyawa flavonoida (glikosida 3-flavonol), dengan pereaksi Shinoda menunjukkan adanya senyawa flavon, khalkon, dan auron dan dengan pereaksi Wilson Taubock menunjukkan adanya senyawa 5-hidroksi flavonol, 5-hidroksi flavon.
Dari pemeriksaan pendahuluan secara kromatografi kertas isolat NB-IV mengarah dugaan pada flavon atau flavonol tersulih pada 3-O mempunyai 5-OH tetapi tanpa 4’-OH bebas atau beberapa 6-/8-OH flavon dan flavonol tersulih pada 3-O serta mengandung 5-OH atau khalkon yang mengandung 2’-/6’-OH tetapi tidak mengandung 2-/4-OH bebas. Hal ini didasarkan pada warna bercak kromatogram ungu sebelum diberi uap amonia dan berubah menjadi warna ungu sedikit lebih tua setelah diberi uap amonia.
Pada identifikasi secara spektrofotometri menggunakan spektrofotometer ultraviolet-cahaya tampak dalam pelarut metanol, isolat memberikan serapan maksimum pada panjang
220,0 nm (50/div) 550,0 nm Panjang gelombang () 0,00 A 2.00 A (0,500 /div) Abs or b an ( A)
gelombang 330,5 nm untuk pita I dan 251,0 nm untuk pita II. Dari data tersebut menunjukkan bahwa isolat adalah golongan flavon, flavonol (3-OH tersubstitusi).
Pada penambahan natrium hidroksida serapan maksimum pita I menjadi 381,0 nm berarti terjadi pergeseran batokromik sebesar 50,5 nm dan dengan penurunan kekuatan selama 5 menit. Dari data ini menunjukkan adanya gugus OH pada posisi 3 dan tidak ada 4’-OH bebas.
Pada penambahan aluminium (III) klorida dan asam klorida serapan maksimum pita I menjadi 330,0 nm berarti terjadi pergeseran hipsokromik pada pita I sebesar 0,5 nm. Dari data ini menunjukkan adanya gugus OH pada posisi 5 dengan gugus prenil pada posisi 6.
Pada penambahan natrium asetat serapan maksimum pita II menjadi 257,5 nm berarti terjadi pergeseran batokromik pada pita II sebesar 6,5 nm. Dari data ini menunjukkan adanya gugus OH pada posisi 7.
Pada penambahan natrium asetat dan asam borat serapan maksimum pita I menjadi 352,5 nm berarti terjadi pergeseran batokromikpada pita I sebesar 22 nm. Dari data ini menunjukkan adanya gugus OH pada posisi orto-diOH pada cincin B.
Dari semua data diatas dapat disimpulkan bahwa isolat IV diduga senyawa flavonol dengan gugus OH pada posisi 3, 5, 7, gugus prenil pada posisi 6 dan O-diOH pada cincin B.
Gambar 10. Senyawa flavonol dengan gugus OH pada posisi 3, 5, 7, gugus prenil pada posisi 6 dan O-diOH pada cincin
Isolat NB-VI
Identifikasi isolat NB-VI dilakukan dengan mengamati pergeseran panjang gelombang serapan maksimum sebelum dan sesudah penambahan pereaksi geser seperti natrium hidroksida, aluminium klorida, aluminium klorida dan asam klorida, natrium asetat dan natrium asetat dan asam borat.
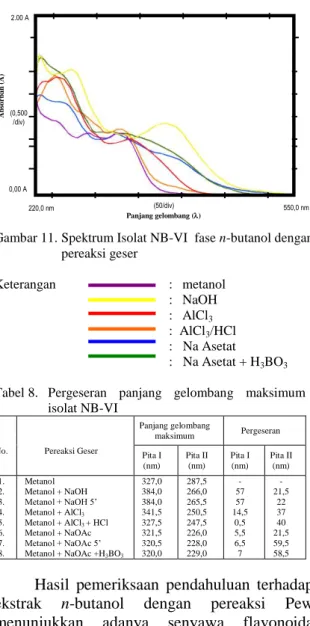
Gambar 11. Spektrum Isolat NB-VI fase n-butanol dengan pereaksi geser Keterangan : metanol : NaOH : AlCl3 : AlCl3/HCl : Na Asetat : Na Asetat + H3BO3
Tabel 8. Pergeseran panjang gelombang maksimum isolat NB-VI
No. Pereaksi Geser
Panjang gelombang maksimum Pergeseran Pita I (nm) Pita II (nm) Pita I (nm) Pita II (nm) 1. 2. 3. 4. 5. 6. 7. 8. Metanol Metanol + NaOH Metanol + NaOH 5’ Metanol + AlCl3 Metanol + AlCl3 + HCl Metanol + NaOAc Metanol + NaOAc 5’ Metanol + NaOAc +H3BO3
327,0 384,0 384,0 341,5 327,5 321,5 320,5 320,0 287,5 266,0 265,5 250,5 247,5 226,0 228,0 229,0 - 57 57 14,5 0,5 5,5 6,5 7 - 21,5 22 37 40 21,5 59,5 58,5
Hasil pemeriksaan pendahuluan terhadap ekstrak n-butanol dengan pereaksi Pew menunjukkan adanya senyawa flavonoida (glikosida 3-flavonol), dengan pereaksi Shinoda menunjukkan adanya senyawa flavon, khalkon, dan auron dan dengan pereaksi Wilson Taubock menunjukkan adanya senyawa 5-hidroksi flavonol, 5-hidroksi flavon.
Dari pemeriksaan pendahuluan secara kromatografi kertas isolat NB-VI mengarah dugaan pada flavon atau flavonol tersulih pada 3-O mempunyai 5-OH tetapi tanpa 4’-OH bebas atau 6-/8-OH flavon dan flavonol tersulih pada 3-O serta mengandung 5-OH atau dihidroflavonol dan flavanon yang mengandung 5-OH atau khalkon yang mengandung 2’-/6’-OH tetapi tidak mengandung 2-/4-2’-/6’-OH bebas. Hal ini didasarkan pada warna bercak kromatogram ungu tua sebelum diberi uap amonia dan tetap berwarna ungu tua setelah diberi uap amonia.
Pada identifikasi secara spektrofotometri menggunakan spektrofotometer ultraviolet-cahaya tampak dalam pelarut metanol, isolat memberikan serapan maksimum pada panjang
220,0 nm (50/div) 550,0 nm Panjang gelombang () 0,00 A 2.00 A (0,500 /div) A b sor b an (A )
Disampaikan dalam Kongres Ilmiah XVIII IAI Makasar, 10-12 Desember 2010
gelombang 327,0 nm untuk pita I dan 287,5 nm untuk pita II. Dari data tersebut menunjukkan bahwa isolat adalah golongan flavanon dan dihidroflavonol.
Pada penambahan natrium hidroksida serapan maksimum pita II menjadi 266,0 nm berarti terjadi pergeseran hipsokromik sebesar 21,5 nm dan dengan penurunan kekuatan selama 5 menit. Dari data ini menunjukkan adanya gugus O-diOH pada cincin A.
Pada penambahan aluminium (III) klorida dan asam klorida serapan maksimum pita II menjadi 250,5 nm berarti terjadi pergeseran hipsokromik pada pita II sebesar 40 nm. Dari data ini tidak ada yang dapat disimpulkan.
Pada penambahan natrium asetat serapan maksimum pita I menjadi 321,5 nm berarti terjadi pergeseran hipsokromik pada pita I sebesar 5,5 nm. Dari data ini menunjukkan adanya gugus yang peka terhadap basa, misalnya 6,7 atau 7,8 -diOH.
Pada penambahan natrium asetat dan asam borat serapan maksimum pita II menjadi 229,0 nm berarti terjadi pergeseran hipsokromik pada pita II sebesar 58,5 nm. Dari data ini tidak ada yang dapat disimpulkan.
Dari semua data diatas dapat disimpulkan bahwa isolat NB-VI diduga senyawa flavanon dengan gugus OH pada posisi O-diOH pada cincin A dan 6,7 atau 7,8 –di OH.
Gambar 12. Senyawa flavanon dengan gugus OH pada posisi 6,7.
KESIMPULAN
Berdasarkan hasil penelitian yang telah dilakukan terhadap daun daruju (Acanthus ilicifolius Linn.), maka dapat disimpulkan sebagai berikut :
1. Pada pemeriksaan penapisan fitokimia daun daruju menunjukkan adanya senyawa flavonoid, saponin, tanin, steroid dan kumarin.
2. Berdasarkan hasil identifikasi spektrofotometer ultraviolet-cahaya tampak dalam fase n-butanol dari ekstrak metanol daun daruju bahwa isolat NB-III diduga senyawa flavonol dengan gugus OH pada
posisi 3,5,7,8 oksigenasi dan gugus prenil pada posisi 6. Isolat IV diduga senyawa flavonol dengan gugus OH pada posisi 3, 5, 7, gugus prenil pada posisi 6 dan O-diOH pada cincin B. Isolat NB-VI diduga senyawa flavanon dengan gugus OH pada posisi O-diOH pada cincin A dan 6,7 atau 7,8 –di OH. DAFTAR PUSTAKA
1. Mursito, B. Ramuan tradisional untuk kesehatan anak. Jakarta: Penebar Swadaya; 2001. Hal. v.
2. Kelompok Kerja Nasional Tumbuhan Obat Indonesia. Prosiding Seminar Nasional Tumbuhan Obat Indonesia XXIII Jakarta 25-26 Maret 2003. Fakultas Farmasi Universitas Pancasila; 2003. Hal. 21. 3. Dalimartha, S. Atlas Tumbuhan Obat
Indonesia. Jilid II. Jakarta: Trubus Agriwidya; 2001. Hal. 58-61.
4. Syamsuhidayat, SS., Hutapea, JR. Inventaris Tanaman Obat Indonesia. Jilid I. Jakarta: Departemen Kesehatan Republik Indonesia; 1991. Hal.8-9.
5. Kebun Tanaman Obat Karyasari. Materi pelatihan profesional tanaman obat. Jilid II. Jakarta: Yayasan Pengembangan Tanaman Obat Karyasari; 2004. Hal. 21. 6. Soedibyo, M. Alam Sumber Kesehatan.
Jakarta: Balai Pustaka; 1998. Hal. 121-2.
7. Hariana, A. Tumbuhan Obat dan Khasiatnya. Edisi I. Jakarta: Penebar Swadaya; 2004. Hal. 91-2.
8. Dalimartha, S. Ramuan Tradisional Untuk Pengobatan Kanker. Jakarta: Penebar Swadaya;1998. Hal.50-1.
9. Markham, K.R. Cara mengidentifikasi flavonoid. Diterjemahkan oleh Padmawinata K. Bandung: ITB; 1988. Hal. 1, 10, 15, 17, 20-1, 38-9, 41-8.
10. Departemen Kesehatan Republik Indonesia. Daftar tanaman obat. Jilid I. Jakarta: Balai Penelitian dan Pengembangan Kesehatan; 1981. Hal. 5. 11. De Padua LS, Bunyapraphatsara N,
Lemmens R.H M. J. Plant resources of south-east asia, Bogor: Prosea Foundation; 1999. Hal. 36-9.
12. Harborne, JB. Metode fitokimia penuntun cara modern menganalisis tumbuhan obat. Terjemahan Padmawinata K, Soediro I. Edisi II. Bandung: ITB; 1987. Hal. 9-10, 21, 71.
13. Departemen Kesehatan Republik Indonesia. Parameter standar umum
ekstrak tumbuhan. Jakarta: Direktorat Jendral Pengawasan Obat dan Makanan; 2002. Hal. 1, 9-11.
14. Departemen Kesehatan Republik Indonesia. Buku panduan teknologi ekstrak. Jakarta: Direktorat Jendral Pengawasan Obat dan Makanan; 2000. Hal. 11, 13-4.
15. Departemen Kesehatan Republik Indonesia. Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan Republik Indonesia; 1995. Hal. 1002.
16. Gritter, RJ., Bobbit, JM., Schwarting, AE. Pengantar kromatografi. Diterjemahkan oleh Padmawinata. Edisi II. Bandung: ITB; 1991. Hal. 1, 157.
17. Farnsworth NR. Biological and Phytochemical Screening of Plant. Journal of Pharmaceutical, No. 3. Vol. 55. 1966. 18. Departemen Kesehatan Republik Indonesia.
Materia Medika Indonesia. Jilid IV. Jakarta: Direktorat Jenderal Pengawasan Obat dan Makanan; 1995. Hal. 337