Bab IV Hasil dan Pembahasan
IV.1. Umum
Pada bab ini akan dijabarkan hasil penelitian dan pembahasan tentang hasil penelitian yang akan dibagi menjadi beberapa bagian, yaitu :
a. Karakteristik air limbah laundry b. Laju pelepasan ion aluminium
c. Distribusi spesies senyawa aluminium
d. Proses elektrokoagulasi pada percobaan batch e. Proses elektrokoagulasi pada percobaan kontinyu f. Kinetika reaktor elektrokoagulasi
IV.2. Karakteristik Air Limbah Laundry
Air limbah yang digunakan pada penelitian ini berupa limbah cair asli yang berasal dari jasa laundry yang ada di daerah perumahan Antapani Bandung. Hasil analisa yang dilakukan diperoleh karakteristik dari air limbahnya adalah sebagai berikut :
Tabel IV.1 Karakteristik air limbah laundry
No Parameter Konsentrasi Baku Mutu Satuan
1. Surfaktan (MBAS) 256.87 – 363.72 5* mg/L 2. COD 599.44 – 754.35 100* mg/L 3. Fosfat 7.357 – 7.843 5** mg/L 4. Kekeruhan 144 – 759 NTU 5. pH 8.67 – 10.53 6 - 9* 6. Konduktivitas 1073 – 1678 µS/cm 7. Suhu 23.6 – 26.0 oC *KEP-51/MENLH/10/1995 ** PP No 82 Tahun 2001
Konsentrasi air limbah laundry yang digunakan pada penelitian ini berfluktuasi tergantung pada air limbah yang dihasilkan oleh jasa laundry tersebut. Konsentrasi surfaktan, COD dan fosfat tergantung pada jenis deterjen yang digunakan. Selain itu juga tergantung pada jenis kotoran yang melekat pada pakaian yang dicuci. Jenis kotoran yang biasa melekat pada pakaian adalah debu dari udara, kotoran yang dihasilkan badan (misalnya keringat), pengotor yang berasal dari aktifitas domestik, komersial dan industri (Smulders, 2002).
Hasil pemeriksaan tersebut menunjukkan bahwa konsentrasi kandungan polutan dalam air limbah laundry telah melebihi baku mutu yang ditetapkan. Parameter yang konsentrasinya sangat tinggi adalah surfaktan dan COD sedangkan untuk fosfat tidak terlalu tinggi. Dengan tingginya kandungan surfaktan dan COD akan menimbulkan dampak yang negatif bagi biota jika air limbah tersebut dibuang ke lingkungan perairan.
IV.3. Laju Pelepasan Ion Aluminium
Elektroda yang digunakan sebagai kutub anoda dan katoda pada penelitian ini menggunakan aluminium dengan kemurnian sebesar 99.7% (Laboratorium Pengujian tekMIRA). Penggunaan aluminium untuk kedua kutub tersebut didasarkan atas beberapa penelitian yang telah ada dimana dinyatakan bahwa reaktor yang mempergunakan aluminium pada kedua elektroda yaitu anoda dan katoda dilaporkan proses pelarutan aluminium melebihi 100% (Przhegorlinskii et al., 1987 ; Donini et al., 1994 ; Mameri et al., 1998 ; Bozin and Mikhailov, 1990 dalam Holt, 2002).
Selama proses elektrokoagulasi, kondisi permukaan elektroda mengalami perubahan (Gambar IV.1). Kondisi ini disebabkan terlepasnya ion aluminium ke dalam air, sehingga terjadilah fenomena korosi ini.
Gambar IV.1. Kondisi permukaan elektroda selama proses elektrokoagulasi (a) sebelum digunakan (b) pertama kali pemakaian
(c) pemakaian berulang kali
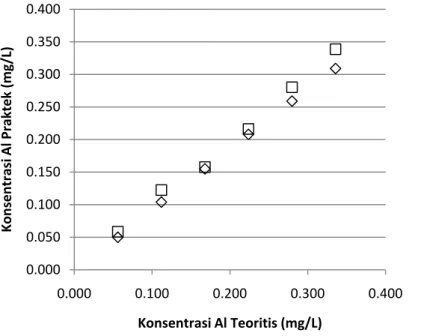
Secara teoritis pelepasan ion aluminium selama elektrokoagulasi dihitung dengan menggunakan hukum Faraday. Pada penelitian ini dilakukan penimbangan terhadap elektroda setiap kali dilakukan percobaan. Untuk memastikan bahwa hasil tersebut sesuai maka dilakukan percobaan sejenis dengan melakukan pengukuran terhadap jumlah ion aluminium di dalam air dengan mempergunakan AAS. Dari hasil tersebut akan dibandingkan jumlah ion aluminium yang terlepas secara teoritis. Perbandingan tersebut dapat dilihat pada Gambar IV.2.
Gambar IV.2. Perbandingan konsentrasi aluminium yang terlepas selama proses Elektrokoagulasi untuk konfigurasi bipolar
Gambar IV.3. Perbandingan massa aluminium yang terlepas
Dari hasil percobaan yang dilakukan ini diperoleh bahwa nilai konsentrasi ion aluminium yang terlepas dengan pengujian AAS dan penimbangan memberikan hasil yang tidak berbeda jauh dari perhitungan teoritis. Berdasarkan hasil kedua pengukuran tersebut akan diperoleh konsentrasi aluminium total (AlT) yang akan dipergunakan dalam perhitungan distribusi spesies senyawa aluminium.
0.000 0.050 0.100 0.150 0.200 0.250 0.300 0.350 0.400 0.000 0.100 0.200 0.300 0.400 Konsentrasi Al Praktek (mg/L) Konsentrasi Al Teoritis (mg/L) AAS Penimbangan y = 0.0028x R² = 0.9948 y = 0.0029x R² = 0.9783 0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 0.16 0.18 0.2 0 10 20 30 40 50 60 Massa Aluminium (mg) Waktu (menit) Bipolar Monopolar
Sedangkan nilai laju pelepasan ion aluminium diperoleh dari kemiringan kurva pada Gambar IV.3, yaitu 0,0029 mg/menit untuk monopolar dan 0,0028 mg/menit untuk bipolar. Dari hasil perhitungan diperoleh laju pelepasan ion aluminium untuk konfigurasi monopolar dan bipolar pada variasi kerapatan arus.
Tabel IV.2. Perbandingan laju pelepasan ion aluminium
Kerapatan arus (A/m2)
Laju pelepasan (g/menit) monopolar bipolar
50 0.0015 0.0016
75 0.0020 0.0020
100 0.0029 0.0028
Berdasarkan tabel diatas terlihat bahwa konfigurasi monopolar mempunyai laju pelepasan ion aluminium yang lebih tinggi daripada bipolar. Untuk kerapatan arus 100 A/m2 nilai laju pelepasan ion aluminium pada konfigurasi monopolar adalah 0.0029 g/menit. Dengan nilai tersebut dapat digunakan untuk memperkirakan waktu penggantian elektroda, yaitu untuk berat elektroda rata-rata sebesar 75 g diperkirakan akan habis setelah penggunaan selama 431 jam pengoperasian peralatan elektrokoagulasi.
IV.4. Distribusi Spesies Senyawa Aluminium
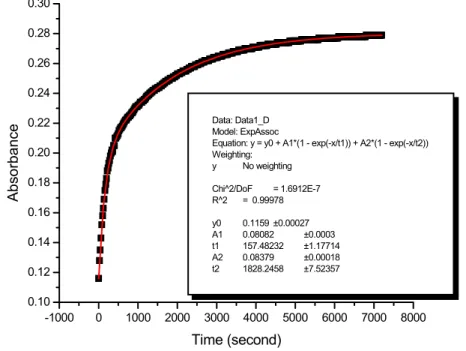
Untuk melihat distribusi spesies senyawa aluminium yang terbentuk pada proses elektrokoagulasi maka dilakukan percobaan dengan menggunakan metode Ferron. Dari pembacaan Spektrofotometer UV-Vis diperoleh data absorbansi yang dibaca setiap interval waktu 20 detik selama 2 jam atau 7200 detik. Nilai absorbansi yang terbaca oleh peralatan merupakan nilai konsentrasi aluminium yang bereaksi dengan reagen Ferron. Hasil pembacaan untuk percobaan dengan variasi pH dapat dilihat pada gambar di bawah ini :
-1000 0 1000 2000 3000 4000 5000 6000 7000 8000 0.06 0.08 0.10 0.12 0.14 0.16 0.18 0.20 0.22 0.24 0.26 0.28 0.30 Absorbance Time (seconds) pH 2 pH 4 pH 6 pH 8 pH 10 pH 12 -1000 0 1000 2000 3000 4000 5000 6000 7000 8000 0.10 0.12 0.14 0.16 0.18 0.20 0.22 0.24 0.26 0.28 0.30 Data: Data1_D Model: ExpAssoc
Equation: y = y0 + A1*(1 - exp(-x/t1)) + A2*(1 - exp(-x/t2)) Weighting: y No weighting Chi^2/DoF = 1.6912E-7 R^2 = 0.99978 y0 0.1159 ±0.00027 A1 0.08082 ±0.0003 t1 157.48232 ±1.17714 A2 0.08379 ±0.00018 t2 1828.2458 ±7.52357 Ab so rba nce Time (second)
Gambar IV.4. Hasil pembacaan absorbansi pada metode Ferron untuk variasi pH Hasil pembacaan absorbansi tersebut dianalisa dengan mempergunakan software Origin Pro 7.0 untuk mendapatkan persamaan garis yang sesuai dengan pola kurva tersebut.
Menurut Feng et.al (2007) reaksi antara ion aluminium dengan reagen Ferron mengikuti persamaan reaksi pseudo orde 1, yaitu :
A = A0 + Ab1(1 − e−t/t1 ) + Ab2(1 − e−t/t2) (IV.1) dimana A adalah nilai absorbansi, t adalah waktu reaksi, A0 adalah nilai absorbansi reaksi Ala-Ferron, Ab1 adalah absorbansi Alb1-Ferron, Ab2 adalah absorbansi Alb2-Ferron, t1 dan t2 merupakan waktu reaksi dari Alb1 dan Alb2. Alb1 adalah bagian dari Alb yang relatif cepat bereaksi dengan Ferron yang terdiri dari senyawa oligomer dan Alb2 adalah bagian dari Alb yang relatif lambat bereaksi dengan Ferron yang terdiri dari senyawa polimer dengan berat medium.
Dengan memasukkan nilai k1 =1/t1, k2 =1/t2 persamaan di atas menjadi :
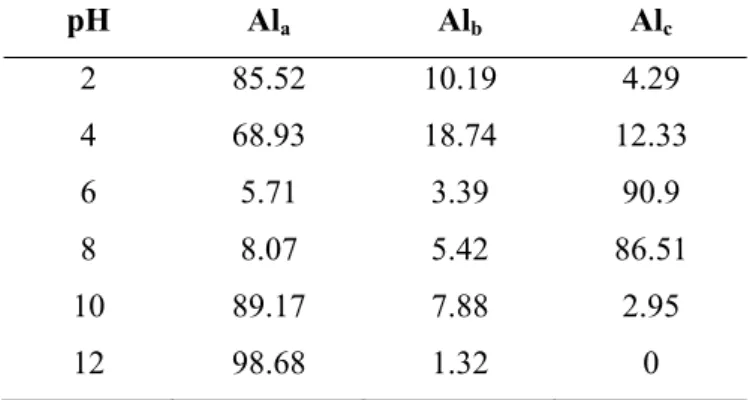
A = A0 + Ab1(1 − e−k1t ) + Ab2(1 − e−k2t) (IV.2) Hasil analisa software tersebut digunakan untuk menghitung distribusi spesies senyawa aluminium (Ala, Alb dan Alc) dengan metode kalkulasi kinetik Al-Ferron. Hasil perhitungannya adalah sebagai berikut :
Tabel IV. 3. Hasil perhitungan distribusi senyawa aluminium (%)
pH Ala Alb Alc 2 85.52 10.19 4.29 4 68.93 18.74 12.33 6 5.71 3.39 90.9 8 8.07 5.42 86.51 10 89.17 7.88 2.95 12 98.68 1.32 0
Dari perhitungan tersebut terlihat bahwa untuk pH air limbah laundry yaitu antara 8 – 10, spesies senyawa aluminium yang terbanyak adalah golongan monomer.
IV.5. Proses Elektrokoagulasi Pada Percobaan Batch
Pada penelitian ini digunakan kuat arus yang berasal dari DC Power Supply dengan kapasitas 0 – 10 A dan tegangan 0 – 50 Volt. Kuat arus yang dialirkan ke elektroda aluminium sebesar 0.25 – 1 A untuk memperoleh kerapatan arus yang diinginkan yaitu 50, 75 dan 100 A/m2.
Untuk percobaan secara batch, reaktor yang digunakan berupa beker glass dengan kapasitas 600 mL. Untuk mendapatkan kondisi yang homogen, magnetic stirrer diatur pada skala 5 untuk semua percobaan pada penelitian ini. Selama proses elektrokoagulasi selama 60 menit, dilakukan pengambilan sampel pada interval waktu 10 menit. Pengukuran secara langsung dilakukan untuk parameter kekeruhan, konduktivitas, pH dan suhu. Sampel yang diambil dimasukkan dalam botol sampel yang kemudian dianalisa kandungan surfaktan, COD dan fosfat. Data yang diperoleh untuk semua percobaan elektrokoagulasi akan dijelaskan pada bagian di bawah ini.
IV.5.1. Kekeruhan
Kekeruhan yang terukur pada air limbah laundry menunjukkan nilai yang cukup tinggi, yaitu diatas 100 NTU. Melalui proses elektrokoagulasi diharapkan terjadinya penurunan kekeruhan dari air limbah tersebut. Hasil pemeriksaan kekeruhan pada percobaan ini dapat dilihat pada gambar berikut ini.
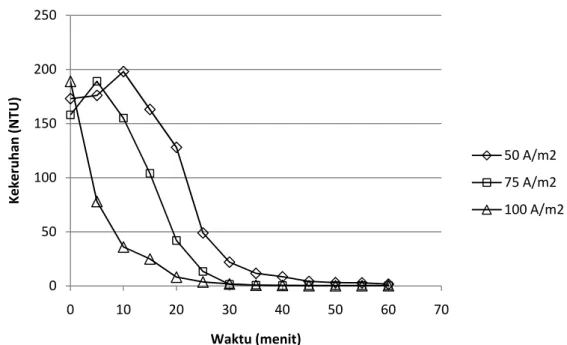
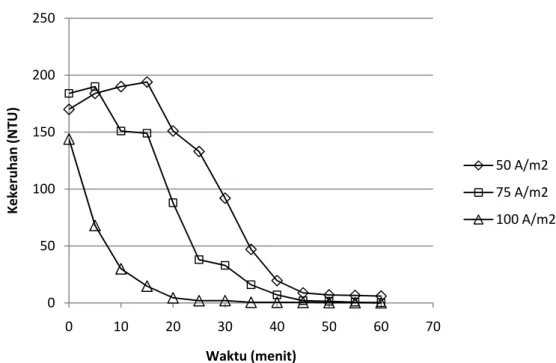
Gambar IV.6. Profil penurunan kekeruhan pada konfigurasi monopolar dengan variasi kerapatan arus
Dari gambar di atas dapat terlihat bahwa pada menit awal percobaan yaitu 0 – 10 menit untuk kerapatan arus 50 A/m2 dan 75 A/m2 terjadi kenaikan nilai kekeruhan. Hal ini disebabkan mulai terlepasnya ion aluminium dari anoda yang berfungsi sebagai agen koagulan. Koagulan ini akan berikatan dengan senyawa yang ada di dalam air limbah sehingga mulai terbentuk flok. Di awal percobaan flok yang terbentuk masih berukuran kecil sehingga menimbulkan terjadinya kekeruhan, namun pada menit berikutnya flok ini mulai membesar dan mengalami flotasi sehingga kekeruhannya mulai menurun.
Untuk kerapatan arus 100 A/m2 kenaikan kekeruhan tidak terdeteksi karena pengambilan sampel baru pada menit ke-5 sehingga tidak diketahui perubahan yang terjadi diantara 0-5 menit. Selain itu karena arus yang mengalir cukup tinggi menyebabkan jumlah ion aluminium yang terlepas juga banyak sehingga proses koagulasi berlangsung lebih cepat.
0 50 100 150 200 0 10 20 30 40 50 60 70 Kekeruhan (NTU) Waktu (menit) 50 A/m2 75 A/m2 100 A/m2
Gambar IV.7. Profil penurunan kekeruhan pada konfigurasi bipolar dengan variasi kerapatan arus
Untuk konfigurasi bipolar dengan kerapatan arus 50 A/m2, kenaikan kekeruhan terjadi pada 0 – 15 menit sedangkan untuk kerapatan arus 75 A/m2 kenaikannya pada menit 0 – 5 menit. Namun pada kerapatan arus 75 A/m2 penurunan kekeruhan secara tajam baru terjadi setelah menit ke-15. Seperti pada konfigurasi monopolar untuk kerapatan arus 100 A/m2 kenaikan kekeruhan tidak terdeteksi di menit awal. Tingkat kekeruhan mulai stabil pada menit ke-20 untuk kerapatan arus 100 A/m2, dan pada menit ke-45 untuk kerapatan arus 50 dan 75 A/m2.
IV.5.2. pH
Nilai pH dari air limbah yang diolah melalui proses elektrokoagulasi sangat menentukan dalam proses pengolahannya. Untuk melihat pengaruh pH terhadap efisiensi pengolahan, pada penelitian ini air limbah laundry diubah nilai pH dengan menambahkan NaOH untuk mendapatkan kondisi basa dan penambahan H2SO4 untuk mendapatkan kondisi asam. Dari hasil percobaan yang dilakukan didapatkan terjadinya perubahan nilai pH sebagaimana gambar di bawah ini.
0 50 100 150 200 250 0 10 20 30 40 50 60 70 Kekeruhan (NTU) Waktu (menit) 50 A/m2 75 A/m2 100 A/m2
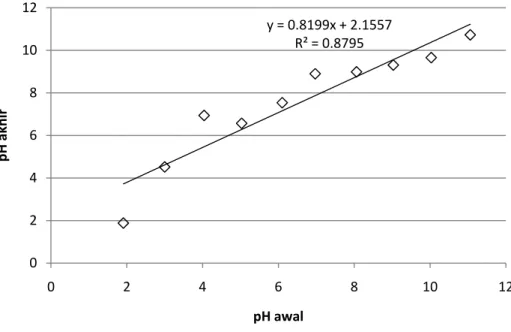
Gambar IV.8. Perubahan pH pada proses elektrokoagulasi
Dari gambar diatas dapat terlihat bahwa pH air limbah yang diolah dengan elektrokoagulasi mengalami kenaikan. Hal ini disebabkan oleh terbentuknya ion OH- pada kutub katoda sesuai dengan persamaan berikut.
2 H2O + 2e → 2 OH- + H2 E0C = - 0.83 V (IV.1) Dengan bertambahnya jumlah ion OH- di dalam air limbah menyebabkan terjadinya kenaikan pH. Selain itu nilai pH dari air limbah akan menyebabkan terbentuknya berbagai spesies senyawa aluminium, seperti monomer dan polimer (Mollah, 2004). Dari analisa spesies senyawa aluminium dengan metode Ferron diperoleh distribusi sebagai berikut :
y = 0.8199x + 2.1557 R² = 0.8795 0 2 4 6 8 10 0 2 4 6 8 10 12 pH akhir pH awal
Gambar IV.9. Distribusi spesies senyawa aluminium pada variasi pH Sedangkan tingkat penyisihan yang terjadi pada percobaan variasi pH ini adalah sebagai berikut :
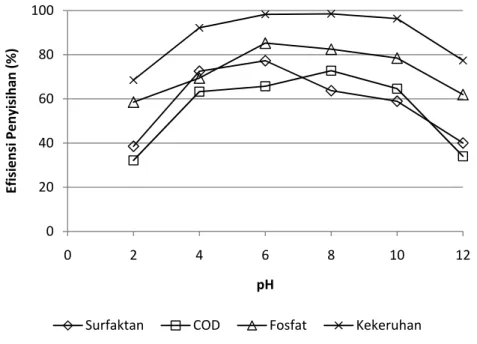
Gambar IV.10. Tingkat penyisihan pada variasi pH untuk konfigurasi monopolar (kerapatan arus 100 A/m2, td=30 menit)
‐20 0 20 40 60 80 100 0 2 4 6 8 10 12 14 Distribusi spesies Al (%) pH Ala Alb Alc 0 20 40 60 80 100 0 2 4 6 8 10 12 Efisiensi Penyisihan (%) pH
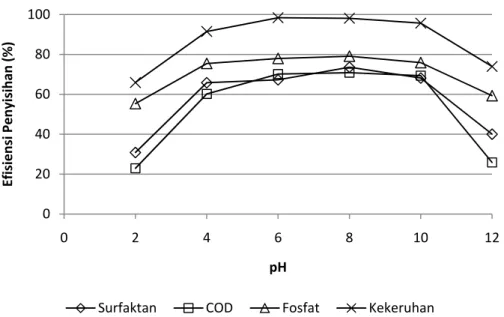
Gambar IV.11. Tingkat penyisihan pada variasi pH untuk konfigurasi bipolar (kerapatan arus 100 A/m2, td=30 menit)
Dari gambar diatas terlihat bahwa tingkat penyisihan yang paling baik terjadi pada rentang pH 4 – 10. Hal ini disebabkan pada rentang pH tersebut terjadi proses hidrolisis ion Al yang menghasilkan senyawa Al(OH)2+, Al2(OH)24+, Al(OH)3 dan senyawa polimer Al13(OH)327+ yang efektif dalam proses koagulasi (Ge, 2004). Sedangkan pada pH dibawah 4 senyawa yang terbentuk adalah ion AL3+ dan pada pH diatas 10 senyawa yang terbentuk adalah Al(OH)4- . Keduanya memiliki sifat kurang efektif dalam proses koagulasi.
IV.5.3. Konduktivitas
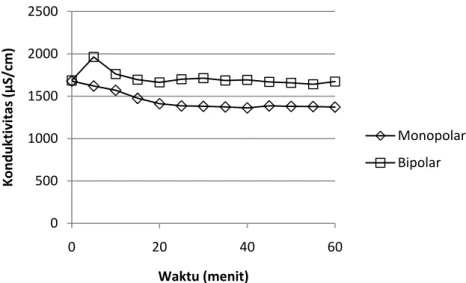
Nilai konduktivitas dari air limbah yang diolah dengan menggunakan elektrokoagulasi sangat menentukan tingkat efisiensi pengolahan. Proses elektrokoagulasi dapat berjalan dengan baik apabila konduktivitasnya cukup tinggi. Hal ini disebabkan elektron yang mudah mengalir pada air dengan konduktivitas tinggi. Hasil pembacaan konduktivitas pada percobaan ini adalah sebagai berikut : 0 20 40 60 80 0 2 4 6 8 10 12 Efisiensi Penyisihan (%) pH
Gambar IV.12. Perubahan konduktivitas pada percobaan elektrokoagulasi dengan kerapatan arus 100 A/m2
Dari gambar diatas dapat terlihat bahwa di awal proses elektrokoagulasi, nilai konduktivitas cenderung mengalami penurunan. Perubahan tersebut terjadi karena proses elektrokoagulasi akan mengikat ion-ion yang ada pada polutan untuk membentuk flok yang dapat dipisahkan. Namun pada menit berikutnya, nilai konduktivitas cenderung konstan karena ion aluminium yang terlepas akan menambah konduktivita larutan.
IV.5.4. Penyisihan Surfaktan
Pemeriksaan surfaktan pada penelitian ini mempergunakan metode MBAS, yaitu metode pemeriksaan surfaktan berjenis anionik. Pada penelitian ini, kandungan LAS dari deterjen yang digunakan oleh jasa laundry sebesar 25 %.
Pada percobaan elektrokoagulasi dengan konfigurasi monopolar dan bipolar diperoleh data dari sampel yang diambil pada interval waktu 10 menit yang dapat dilihat pada Gambar IV.11 dan Gambar IV.12. Selain pengambilan pada interval waktu tersebut, pada menit ke-5 sampel juga diambil untuk melihat kecenderungan penurunan konsentrasi surfaktan di awal percobaan. Percobaan ini dilakukan dengan menggunakan variasi kerapatan arus 50, 75 dan 100 A/m2.
0 500 1000 1500 2000 2500 0 20 40 60 Konduktivitas (µS/cm) Waktu (menit) Monopolar Bipolar
0 50 100 150 200 250 300 350 400 0 20 40 60 Surfaktan (mg/L) Waktu (menit)
50 A/m2 75 A/m2 100 A/m2
0 50 100 150 200 250 300 350 400 0.000 0.200 0.400 0.600 Surfaktan (mg/L) Massa aluminium (g/m2)
50 A/m2 75 A/m2 100 A/m2
0 50 100 150 200 250 300 350 400 0 20 40 60 Surfaktan (mg/L) Waktu (menit)
50 A/m2 75 A/m2 100 A/m2
0 50 100 150 200 250 300 350 400 0.000 0.200 0.400 0.600 Surfaktan (mg/L) Massa Aluminium (g/m2)
50 A/m2 75 A/m2 100 A/m2
Gambar IV.13 Profil penurunan konsentrasi surfaktan pada konfigurasi monopolar dengan variasi kerapatan arus
Pada kurva di atas terlihat bahwa penurunan konsentrasi surfaktan yang tajam terjadi pada kerapatan arus 100 A/m2 terutama pada menit awal. Sedangkan untuk kerapatan arus 50 dan 75 A/m2 cenderung landai. Sedangkan massa aluminium yang dibutuhkan untuk mendapatkan konsentrasi surfaktan yang paling rendah yaitu 9,04 mg/L diperoleh pada 0,560 g/m2.
Gambar IV.14. Profil penurunan konsentrasi surfaktan pada konfigurasi bipolar dengan variasi kerapatan arus
Penurunan konsentrasi surfaktan yang terjadi pada konfigurasi bipolar menunjukkan pola yang sama dengan konfigurasi monopolar. Dimana kerapatan arus 100 A/m2 yang memiliki penurunan paling tinggi. Untuk konfigurasi bipolar konsentrasi surfaktan yang paling rendah yaitu 16,79 mg/L diperoleh pada massa aluminium sebesar 0,560 g/m2.
Dari kedua konfigurasi diperoleh bahwa kerapatan arus 100 A/m2 memberikan hasil yang paling baik. Hal ini disebabkan jumlah ion aluminium yang terbentuk berbanding lurus dengan kuat arus yang mengalir sesuai dengan hukum Faraday. Dan kerapatan arus 100 A/m2 menggunakan kuat arus yang lebih tinggi dibandingkan kerapatan arus yang lain. Sehingga proses koagulasi yang terjadi menghasilkan efisiensi yang paling baik.
Terjadinya penyisihan surfaktan pada percobaan ini disebabkan beberapa proses. Menurut Ge (2004) penyisihan surfaktan dalam proses elektrokoagulasi disebabkan karena terjadi adsorbsi surfaktan pada permukaan partikel sehingga terbentuk permukaan yang hydropobic yang menyebabkan partikel dalam air limbah akan naik ke permukaan dengan bantuan gelembung gas yang terbentuk.
Sedangkan menurut Aboulhassan (2006) penurunan kandungan surfaktan pada penelitian ini disebabkan terjadinya suatu proses yang disebut Adsortive Micelle Flocculation (AMF). Proses ini terjadi ketika struktur surfaktan yang berbentuk micelle beradsorbsi dengan ion Al yang akan mengikat bahan organik dari air limbah dan membentuk flok yang dapat dipisahkan dengan mudah (Talens-Alesson, 2004).
Gambar IV.16. Proses Adsortive Micelle Flocculation (Talens-Alesson, 2004) Untuk mengetahui terbentuknya proses ini maka dilakukan percobaan untuk mendapatkan nilai Critical Micelle Concentration (CMC). Nilai dari CMC sangat diperlukan untuk mengetahui apakah konsentrasi surfaktan yang terdapat dalam larutan telah membentuk sebuah struktur berupa micelle.
Nilai CMC dapat diperoleh dengan beberapa metode pengukuran. Pada penelitian ini metode yang dipilih adalah pengukuran konduktivitas dari konsentrasi surfaktan. Nilai CMC dapat dilihat dari kurva antara konsentrasi surfaktan dengan nilai konduktivitas, dimana nilai CMC merupakan titik belok dari kurva tersebut (Holmberg, 2002). Dari hasil penelitian dengan kisaran konsentrasi surfaktan SDS (atau surfaktan LAS) antara 0.005 – 0.02 mol/L didapatkan titik belok kurva yang terjadi pada konsentrasi surfaktan sebesar 0.008 mol/L (Gambar IV.15.)
Gambar IV.17. Hasil penentuan nilai CMC pada surfaktan LAS
Pada konsentrasi surfaktan sebesar 0.008 mol/L atau jika dikonversikan dengan mengalikan dengan berat molekul SDS yaitu 288.38 akan diperoleh konsentrasi surfaktan sebesar 2,307 mg/L. Air limbah laundry yang digunakan pada penelitian ini memiliki konsentrasi surfaktan antara 256,87 – 363,72 mg/L yang berarti bahwa struktur micelle sudah terbentuk. Sehingga dapat disimpulkan bahwa proses AMF terjadi pada pengolahan air limbah laundry ini. Kondisi ini dapat dimanfaatkan sebagai alternatif pengolahan berbasis surfaktan. Karena selama ini proses pengolahan limbah seperti pestisida, fenol, asam benzoic menggunakan surfaktan murni pada proses pengolahannya (Talens-Alesson, 2002)
IV.5.5. Penyisihan COD
Pemeriksaan COD diperlukan untuk mengetahui kandungan bahan organik yang terdapat di dalam air limbah laundry. Nilai COD yang diperiksa pada penelitian ini adalah konsentrasi COD total, sehingga sampel yang akan diperiksa tidak di saring terlebih dahulu.
Hasil pemeriksaan COD untuk konfigurasi monopolar dan bipolar dapat dilihat pada gambar di bawah ini :
y = 99030x + 517.67 R² = 0.9995 y = 141767x + 169.74 R² = 0.9993 y = 71404x + 428.48 R² = 0.9993 y = 107398x + 124.17 R² = 0.9992 0 500 1000 1500 2000 2500 3000 0 0.005 0.01 0.015 0.02 0.025 Konduktivitas (µS/cm) Konsentrasi SDS (mol/L)
0.00 200.00 400.00 600.00 0.000 0.200 0.400 0.600 COD (mg/L) Massa aluminium (g/m2)
50 A/m2 75 A/m2 100 A/m2
0.00 200.00 400.00 600.00 0 20 40 60 80 COD (mg/L) Waktu (menit)
50 A/m2 75 A/m2 100 A/m2
0 200 400 600 800 0 20 40 60 COD (mg/L) Waktu (menit)
50 A/m2 75 A/m2 100 A/m2
0 200 400 600 800 0.000 0.200 0.400 0.600 COD (mg/L) Massa aluminium (g/m2)
50 A/m2 75 A/m2 100 A/m2
Gambar IV.18. Profil penurunan COD pada konfigurasi monopolar dengan variasi kerapatan arus
Dari Gambar IV.16 terlihat bahwa untuk kerapatan arus 100 A/m2 terjadi penurunan yang sangat tajam pada menit ke-0 sampai menit ke-20. Kemudian dilanjutkan dengan penurunan yang lebih landai pada menit berikutnya. Sedangkan untuk kerapatan arus 75 A/m2 tingkat penurunannya cenderung konstan. Hal ini berbeda dengan kerapatan arus 50 A/m2 yang memiliki tingkat penurunan yang tidak konstan. Konsentrasi surfaktan yang paling rendah yaitu 76.09 mg/L diperoleh pada massa aluminium sebesar 0.560 g/m2.
Pada konfigurasi bipolar, tingkat penurunan untuk kerapatan arus 100 A/m2 cenderung tajam sampai menit ke-20. Sedangkan untuk kerapatan arus 50 dan 75 A/m2 memiliki pola yang hampir sama yaitu cenderung landai.
Dari kedua konfigurasi diperoleh bahwa kerapatan arus 100 A/m2 memberikan hasil yang paling baik. Hal ini disebabkan jumlah ion aluminium yang terbentuk berbanding lurus dengan kuat arus yang mengalir sesuai dengan hukum Faraday. Dan kerapatan arus 100 A/m2 menggunakan kuat arus yang lebih tinggi dibandingkan kerapatan arus yang lain. Massa aluminium yang dihasilkan sebesar 0.560 g/m2 mampu menurunkan konsentrasi COD sampai 104.2 mg/L.
Penyisihan COD yang terjadi pada proses elektrokoagulasi disebabkan oleh oksidasi langsung di anoda yang dilanjutkan dengan koagulasi dan elektroflotasi, (Ge, 2004). Menurut Mollah (2004) mekanisme penyisihan yang umum terjadi di dalam elektrokoagulasi terbagi dalam tiga faktor utama, yaitu : (a) terbentuknya koagulan akibat proses oksidasi elektrolisis pada elektroda, (b) destabilisasi kontaminan, partikel tersuspensi dan pemecahan emulsi, dan (c) agregatisasi dari hasil destabilisasi untuk membentuk flok. Sedangkan proses destabilisasi kontaminan, partikel tersuspensi dan pemecahan emulsi terjadi dalam tahapan sebagai berikut :
- Kompresi dari lapisan ganda (double layer) difusi yang terjadi disekeliling spesies bermuatan yang disebabkan interaksi dengan ion yang terbentuk dari oksidasi di elektroda.
- Netralisasi ion kontaminan dalam air limbah dengan menggunakan ion berlawanan yang dihasilkan dari elektroda. Dengan adanya ion tesebut menyebabkan berkurangnya daya tolak menolak antar partikel dalam air limbah sehingga gaya van der Waals sehingga proses koagulasi bisa berlangsung.
- Terbentuknya flok, dimana flok ini terbentuk akibat proses koagulasi sehingga terbentuk sludge blanket yang mampu menjebak dan menjembatani partikel koloid yang masih ada di air limbah.
Sedangkan menurut Aboulhassan (2006) penurunan COD juga disebabkan proses yang sama dengan surfaktan yaitu terjadi proses Adsortive Micelle Flocculation.
0.000 2.000 4.000 6.000 8.000 10.000 0 20 40 60 Fosfat (mg/L) Waktu (menit)
50 A/m2 75 A/m2 100 A/m2
0.000 2.000 4.000 6.000 8.000 10.000 0.000 0.200 0.400 0.600 Fosfat (mg/L) Massa aluminium (g/m2)
50 A/m2 75 A/m2 100 A/m2
Selain itu sebagian besar bahan organik yang terbaca sebagai COD merupakan senyawa surfaktan. Sehingga bila konsentrasi surfaktan mengalami penurunan, maka nilai COD juga menurun.
IV.5.6. Penyisihan Fosfat
Sebagai salah satu bahan penyusun deterjen, pemeriksaan fosfat bertujuan untuk mengetahui kemampuan elektrokoagulasi menurunkan kandungan bahan deterjen. Adapun hasil yang diperoleh dari percobaan untuk konfigurasi monopolar dan bipolar ditunjukkan pada gambar di bawah ini.
Gambar IV.20. Profil penurunan fosfat pada konfigurasi monopolar dengan variasi kerapatan arus
Tingkat penurunan kandungan fosfat dalam air limbah yang diolah menunjukkan bahwa untuk kerapatan arus 100 A/m2 terjadi penurunan yang relatif tinggi sampai pada menit ke-30. Sedangkan untuk kerapatan arus 75 A/m2 proses tersebut terjadi sampai pada menit ke-20. Massa aluminium yang mampu menurunkan kandungan fosfat sampai 0.750 mg/L diperoleh pada 0.560 g/m2.
0 2 4 6 8 10 0 20 40 60 Fosfat (mg/L) Waktu (menit)
50 A/m2 75 A/m2 100 A/m2
0 2 4 6 8 10 0.000 0.200 0.400 0.600 Fosfat (mg/L) Massa aluminium (g/m2)
50 A/m2 75 A/m2 100 A/m2
Gambar IV.21. Profil penurunan fosfat pada konfigurasi bipolar dengan variasi kerapatan arus
Untuk konfigurasi bipolar, penurunan yang tajam terjadi pada menit ke-20 untuk kerapatan arus 100 A/m2. Sedangkan untuk kedua kerapatan arus yang lain, pola penurunannya tidak stabil. Penurunan kandungan fosfat yang paling besar diperoleh pada massa aluminium sebesar 0.560 g/m2.
Penyisihan fosfat pada proses elektrokoagulasi disebabkan oleh terbentuknya ion aluminium yang lebih efektif dalam menyisihkan fosfat dari pada aluminium sulfat pada jumlah ion yang sama (Ge, 2004). Sedangkan menurut Bektas (2004) dan İrdemez (2006) penyisihan fosfat terjadi karena ion Al3+ bereaksi dengan PO43- membentuk AlPO4 yang sukar larut sehingga mudah dipisahkan.
ܣ݈ଷା ܱܲ
ସଷି՜ ܣ݈ܱܲସ (IV.2)
Selain reaksi tersebut, ion fosfat juga mengalami adsorpsi secara langsung dengan senyawa hasil hidrolisa aluminium, kemudian dilanjutkan dengan proses sweep coagulation (Georgantas, 2007).
0.00 50.00 100.00 150.00 200.00 250.00 300.00 0 20 40 60 Surfaktan (mg/L) Waktu (menit)
inlet monopolar bipolar
0.00 50.00 100.00 150.00 200.00 250.00 300.00 0 20 40 60 Surfaktan (mg/L) Waktu (menit)
inlet monopolar bipolar
0.00 100.00 200.00 300.00 400.00 500.00 600.00 700.00 800.00 0 20 40 60 COD (mg/L) Waktu (menit)
inlet monopolar bipolar
0.00 100.00 200.00 300.00 400.00 500.00 600.00 700.00 800.00 0 20 40 60 COD (mg/L) Waktu (menit)
inlet monopolar bipolar
IV.6. Proses Elektrokoagulasi Pada Percobaan Kontinyu
Reaktor yang digunakan pada percobaan kontinyu dijalankan pada dua waktu detensi yang berbeda, yaitu 10 dan 30 menit. Hasil pengujian yang didapat adalah
(a) (b)
Gambar IV. 22. Penurunan surfaktan pada percobaan kontinyu (a) td= 10 menit (b) td= 30 menit pada kerapatan arus 100 A/m2
Kondisi steady state untuk waktu detensi 10 menit mulai tercapai pada menit ke-40, sedangkan untuk waktu detensi 30 menit mulai tercapai pada menit ke-30. Konfigurasi monopolar dan bipolar tidak menunjukkan adanya perbedaan pada percobaan kontinyu ini terutama pada waktu detensi 30 menit. Penyisihan COD yang terjadi pada percobaan kontinyu dapat dilihat pada gambar berikut :
(a) (b)
Gambar IV. 23. Penurunan COD pada percobaan kontinyu (a) td= 10 menit (b) td= 30 menit pada kerapatan arus 100 A/m2
0.000 1.000 2.000 3.000 4.000 5.000 6.000 7.000 8.000 0 20 40 60 Fosfat (mg/L) Waktu (menit)
inlet monopolar bipolar
0.000 1.000 2.000 3.000 4.000 5.000 6.000 7.000 8.000 0 20 40 60 Fosfat (mg/L) Waktu (menit)
inlet monopolar bipolar
Kondisi steady state pada penyisihan COD untuk waktu detensi 10 menit mulai terjadi pada menit ke-50, sedangkan untuk waktu detensi 30 menit mulai terjadi pada menit ke-40. Konfigurasi monopolar menunjukkan tingkat penyisihan yang lebih baik dari pada bipolar pada waktu detensi 10 menit, tetapi pada waktu detensi 30 menit tidak menunjukkan perbedaan.
Penyisihan fosfat yang terjadi pada percobaan kontinyu adalah sebagai berikut :
(a) (b)
Gambar IV. 24. Penurunan fosfat pada percobaan kontinyu (a) td= 10 menit (b) td= 30 menit pada kerapatan arus 100 A/m2
Kondisi steady state pada penyisihan fosfat untuk waktu detensi 10 menit mulai terjadi pada menit ke-40, sedangkan untuk waktu detensi 30 menit mulai terjadi pada menit ke-30. Konfigurasi monopolar dan bipolar tidak menunjukkan perbedaan pada penyisihan fosfat untuk waktu detensi yang berbeda.
Selain pengukuran terhadap parameter surfaktan, COD dan fosfat juga dilakukan pengukuran terhadap parameter fisik, yaitu kekeruhan. Sampel yang diambil didiamkan terlebih dahulu supaya terjadi pemisahan antara flok dengan air yang diolah. Pengukuran yang dilakukan menunjukkan hasil sebagai berikut :
0 20 40 60 80 100 120 140 160 180 0 20 40 60 Kekeruhan (NTU) Waktu (menit)
inlet monopolar bipolar
0 20 40 60 80 100 120 140 160 180 0 20 40 60 80 Kekeruhan (NTU) Waktu (menit)
inlet monopolar bipolar
(a) (b)
Gambar IV. 25. Penurunan kekeruhan pada percobaan kontinyu (a) td= 10 menit (b) td= 30 menit pada kerapatan arus 100 A/m2
Kondisi steady state pada penurunan kekeruhan untuk waktu detensi 10 dan 30 menit mulai terjadi pada menit ke-40. Konfigurasi monopolar tidak menunjukkan perbedaan dengan bipolar untuk waktu detensi 10 menit, tetapi untuk waktu detensi 30 menit terjadi perbedaan pada menit awal saja.
Secara keseluruhan tingkat penyisihan yang terjadi pada percobaan kontinyu adalah sebagai berikut :
Gambar IV.26. Tingkat penyisihan pada percobaan kontinyu
Dari gambar tersebut terlihat bahwa tingkat penyisihan pada konfigurasi monopolar dan bipolar hampir sama, terutama pada penyisihan fosfat dan kekeruhan. Sedangkan untuk surfaktan dan COD, konfigurasi monopolar
0.00 20.00 40.00 60.00 80.00 100.00
Surfaktan COD Fosfat Kekeruhan
Tingkat Penyisihan (%) Monopolar, td=10 menit Bipolar, td=10 menit Monopolar, td=30 menit Bipolar, td=30 menit
0.00 50.00 100.00 150.00 200.00 250.00 300.00 350.00 400.00 0 20 40 60 Konsentrasi Surfaktan (mg/L) Waktu (menit) data model 0.00 50.00 100.00 150.00 200.00 250.00 300.00 350.00 400.00 0 20 40 60 Konsentrasi Surfaktan (mg/L) Waktu (menit) data model
IV.7. Kinetika Reaktor Elektrokoagulasi IV.7.1. Kinetika Penyisihan Surfaktan
Untuk mengetahui laju penyisihan surfaktan pada proses elektrokoagulasi baik pada konfigurasi monopolar maupun bipolar digunakan persamaan reaksi orde pertama (Pers. III.1). Dengan persamaan tersebut dibuat grafik hubungan antara – Ln (Ct/Co) terhadap waktu untuk memperoleh nilai kinetikanya (k). Adapun nilai k yang diperoleh untuk percobaan elektrokoagulasi konfigurasi monopolar dan bipolar adalah sebagai berikut :
Tabel IV.4. Perbandingan nilai k pada penyisihan surfaktan
Kerapatan Arus (A/m2) Monopolar Bipolar k R2 k R2 50 0.0292 0.9795 0.0280 0.9714 75 0.0482 0.9579 0.0319 0.9841 100 0.0584 0.9713 0.0480 0.9878 Pada kerapatan arus 50 A/m2 diperoleh nilai k yang hampir sama antara konfigurasi monopolar dan bipolar. Sedangkan untuk kerapatan arus 75 dan 100 A/m2 didapatkan bahwa konfigurasi monopolar menunjukkan nilai k yang lebih tinggi. Untuk melihat kesesuaian nilai k yang diperoleh dengan data hasil percobaan, maka nilai k tersebut di plot kembali pada data percobaan.
(a) (b)
Gambar IV.27. Ploting nilai k pada konfigurasi (a) monopolar (b) bipolar untuk kerapatan arus 100 A/m2
Dari hasil ploting diatas terlihat bahwa penyisihan surfaktan mengikuti reaksi orde satu. Sedangkan hubungan antara kerapatan arus dengan kinetika penyisihan ditunjukkan oleh gambar berikut ini :
Gambar IV.28. Perbandingan nilai k penyisihan surfaktan pada konfigurasi monopolar dan bipolar
Dari perbandingan nilai k tersebut terlihat bahwa konfigurasi monopolar pada penyisihan surfaktan lebih baik dari konfigurasi bipolar. Walaupun pada kerapatan arus 50 A/m2 nilai kinetikanya hampir sama.
IV.7.2. Kinetika Penyisihan COD
Dari grafik penyisihan COD dapat dicari nilai kinetika penyisihannya (k) dengan cara ploting antara antara –Ln (Ct/Co) terhadap waktu. Dari hasil ploting didapatkan nilai k konfigurasi monopolar dan bipolar, yaitu sebagai berikut ini :
Tabel IV.5. Perbandingan nilai k pada penyisihan COD
Kerapatan Arus (A/m2) Monopolar Bipolar k R2 k R2 50 0.0218 0.9680 0.0158 0.9511 75 0.0277 0.9879 0.0196 0.9663 100 0.0356 0.8248 0.0339 0.9574 Untuk melihat kesesuaian nilai k yang diperoleh dengan data hasil percobaan,
0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0 20 40 60 80 100 120 k (1/menit) Kerapatan arus (A/m2) Monopolar Bipolar
0 0.005 0.01 0.015 0.02 0.025 0.03 0.035 0.04 0 50 100 150 k (1/menit) Kerapatan arus (A/m2) Monopolar Bipolar 0 100 200 300 400 500 600 700 800 0 20 40 60 Konsentrasi COD (mg/L) Waktu (menit) data model 0 100 200 300 400 500 600 700 800 0 20 40 60 Konsentrasi COD (mg/L) Waktu (menit) data model (a) (b)
Gambar IV.29. Ploting nilai k pada konfigurasi (a) monopolar (b) bipolar untuk kerapatan arus 100 A/m2
Dari hasil ploting diatas terlihat bahwa penyisihan COD mengikuti reaksi orde satu. Sedangkan hubungan antara kerapatan arus dengan kinetika penyisihan ditunjukkan oleh gambar berikut ini :
Gambar IV.30. Perbandingan nilai k penyisihan COD pada konfigurasi monopolar dan bipolar
Nilai k yang diperoleh antara konfigurasi monopolar dan bipolar untuk kerapatan arus 100 A/m2 menunjukkan hasil yang tidak jauh berbeda. Namun untuk kerapatan arus yang lain, konfigurasi monopolar jauh melebihi konfigurasi bipolar. Secara keseluruhan nilai k untuk konfigurasi monopolar lebih tinggi dibandingkan dengan bipolar yang berarti bahwa konfigurasi monopolar mempunyai tingkat penyisihan yang lebih baik dibandingkan bipolar.
0.000 1.000 2.000 3.000 4.000 5.000 6.000 7.000 8.000 9.000 0 20 40 60 Konsentrasi Fosfat (mg/L) Waktu (menit) data model 0.000 1.000 2.000 3.000 4.000 5.000 6.000 7.000 8.000 0 20 40 60 Konsentrasi Fosfat (mg/L) Waktu (menit) data model
IV.7.3. Kinetika Penyisihan Fosfat
Untuk mengetahui tingkat penyisihan yang paling baik diantara kerapatan arus maka dilakukan ploting antara –Ln (Ct/Co) terhadap waktu untuk memperoleh nilai kinetikanya (k). Nilai k yang paling besar menunjukkan bahwa kerapatan arus tersebut menghasilkan tingkat penyisihan yang paling baik.
Untuk membandingkan nilai k antara konfigurasi monopolar dan bipolar sehingga dapat diketahui di antara kedua konfigurasi tersebut yang menghasilkan tingkat penyisihan yang paling baik, maka dibuatlah tabel perbandingan dibawah ini
Tabel IV.6. Perbandingan nilai k pada penyisihan fosfat
Kerapatan Arus (A/m2) Monopolar Bipolar k R2 k R2 50 0.0239 0.9871 0.0243 0.9369 75 0.0296 0.9741 0.0290 0.9917 100 0.0419 0.9415 0.0438 0.9624 Untuk melihat kesesuaian nilai k yang diperoleh dengan data hasil percobaan, maka nilai k tersebut di plot kembali pada data percobaan.
(a) (b)
Gambar IV.31. Ploting nilai k pada konfigurasi (a) monopolar (b) bipolar untuk kerapatan arus 100 A/m2
Dari hasil ploting diatas terlihat bahwa penyisihan fosfat mengikuti reaksi orde satu. Sedangkan hubungan antara kerapatan arus dengan kinetika penyisihan ditunjukkan oleh gambar berikut ini :
Gambar IV.32. Perbandingan nilai k penyisihan fosfat pada konfigurasi monopolar dan bipolar
Dari tabel dan gambar diatas dapat dilihat bahwa nilai k untuk kedua konfigurasi memiliki nilai yang hampir sama. Hal ini berarti bahwa kedua konfigurasi menghasilkan tingkat penyisihan terhadap fosfat yang hampir sama.
IV.6.4. Resume Kinetika
Dari perhitungan nilai kinetika diatas dapat dibandingkan nilainya untuk kerapatan arus 100 A/m2 antara konfigurasi monopolar dan bipolar, yaitu :
Tabel IV.7. Perbandingan nilai k antara konfigurasi monopolar dan bipolar
Monopolar Bipolar k R2 k R2 Surfaktan 0.0584 0.9713 0.0480 0.9878 COD 0.0356 0.8248 0.0339 0.9574 Fosfat 0.0419 0.9415 0.0438 0.9624 0 0.01 0.02 0.03 0.04 0.05 0 20 40 60 80 100 120 k (1/menit) Kerapatan arus (A/m2) Monopolar Bipolar
Secara umum dapat dilihat nilai kinetika laju reaksi untuk konfigurasi monopolar dan bipolar tidak memberikan perbedaan yang signifikan. Tidak adanya perbedaan hasil antara konfigurasi monopolar dan bipolar disebabkan arus listrik yang dialirkan jumlahnya sama sehingga menghasilkan agen koagulan yang sama. Walaupun pada konfigurasi bipolar terdapat elektroda yang tidak dialiri arus secara langsung, namun akibat arus yang melalui larutan membuat elektroda tersebut menjadi bermuatan positif dan negatif sekaligus. Hal ini terlihat pada terbentuknya lapisan film pada satu sisi dan sisi lainnya tidak ada (Gambar IV.33).
(a) (b)
Gambar IV. 33. Kondisi elektroda pada saat proses elektrokoagulasi (a) monopolar, (b) bipolar
Hal ini bisa dijelaskan dengan skema pengaliran arus listrik berikut ini :
(a) (b)
Gambar IV.34. Skema aliran arus listrik pada konfigurasi (a) monopolar
Jadi dari luasan anoda dan katoda, konfigurasi monopolar dan bipolar menghasilkan luasan yang sama. Sehingga dengan demikian ion aluminium yang terlepas juga hampir sama. Kondisi ini didukung dari hasil pengujian laju pelepasan ion aluminium dan distribusi spesies senyawanya yang tidak menunjukkan perbedaan yang signifikan
Tabel IV.8. Perbandingan distribusi senyawa alumninium
Ala (%) Alb (%) Alc (%) AlT (mg/L)
bipolar 72.14 7.36 20.49 0.158
monopolar 77.82 7.53 14.65 0.17
Walaupun perbedaan tersebut tidak signifikan, konfigurasi monopolar masih lebih baik dibandingkan bipolar dari segi penyisihan dan jumlah ion aluminium yang terlepas. Hal ini kemungkinan disebabkan jumlah arus yang mengalir pada elektroda netral yang menjadi bipolar tidak bisa 100% disebabkan hambatan pada larutan. Kondisi ini berlainan dengan aliran arus listrik pada konfigurasi monopolar yang hanya terhambat oleh hambatan dari logam dan kabel penghubung.