PENCEMARAN AIR
&
Undang-Undang Republik Indonesia Nomor 19 Tahun 2002 Tentang Hak Cipta Lingkup Hak Cipta
Pasal 2
1. Hak Cipta merupakan hak eksklusif bagi Pencipta atau Pemegang Hak Cipta untuk mengumumkan atau memperbanyak Ciptaannya, yang timbul secara otomatis setelah suatu ciptaan dilahirkan tanpa mengurangi pembatasan menurut peraturan perundang-undangan yang berlaku.
Ketentuan Pidana Pasal 72
1. Barang siapa dengan sengaja melanggar dan tanpa hak melakukan perbuatan sebagaimana dimaksud dalam Pasal 2 Ayat (1) atau Pasal 49 Ayat (1) dan Ayat (2) dipidana dengan penjara masing-masing paling singkat 1 (satu) bulan dan/atau denda paling sedikit Rp 1.000.000,00 (satu juta rupiah), atau pidana penjara paling lama 7 (tujuh) tahun dan/atau denda paling banyak Rp 5.000.000.000,00 (lima miliar rupiah).
Wayan Budiarsa Suyasa
UdAyAnA UniveRSity PReSS 2015
PENCEMARAN AIR
&
v
Hak Cipta pada Penulis. Hak Cipta Dilindungi Undang-Undang :
dilarang mengutip atau memperbanyak sebagian atau seluruh isi buku ini tanpa izin tertulis dari penerbit.
Penulis:
Wayan Budiarsa Suyasa
Penyunting:
Jiwa Atmaja
Cover & Ilustrasi:
Repro
Design & Lay Out:
i Wayan Madita
Diterbitkan oleh:
Udayana University Press Kampus Universitas Udayana denpasar Jl. P.B. Sudirman, denpasar - Bali telp. (0361) 255128
unudpress@gmail.com htp://penerbit.unud.ac.id
Cetakan Pertama:
2015, x + 142 hlm, 15 x 23 cm
ISBN:
PENCEMARAN AIR
&
v
PRAKATA
P
ertumbuhan Penduduk dan pembangunan diikuti oleh peningkatan berbagai aktivitas dan kegiatan usaha untuk memenuhi kebutuhan manusia. tidak dapat dihindari, dampak ikutan dari peningkatan pembangunan tersebut adalah timbulnya limbah yang berdampak pada terjadinya peningkatan pencemaran. Aktivitas produksi yang akan menghasilkan produk yang diinginkan dan hasil samping yang tidak dapat dihindari sebagai beban pengelolaan.Limbah adalah buangan yang dihasilkan dari suatu proses produksi baik industri maupun domestik (rumah tangga) yang keberadaannya pada suatu saat dan tempat tertentu tidak dikehendaki lingkungan karena tidak memiliki nilai ekonomis.Air limbah yang tidak dikelola akan menimbulkan dampak yang luar biasa pada perairan, khususnya sumber daya air. Kelangkaan sumber daya air pada masa mendatang dan bencana alam semisal erosi, banjir, dan kepunahan ekosistem perairan tidak pelak lagi dapat terjadi apabila kaum akademisi tidak peduli terhadap permasalahan tersebut.
v
baik untuk memenuhi kebutuhan dasar manusia seperti untuk air minum, air bersih dan sanitasi maupun sebagai sumber daya yang diperlukan bagi pembangunan ekonomi seperti untuk pertanian, industri, pembangkit tenaga listrik dan pariwisata. Air yang digunakan untuk berbagai kebutuhan dan keperluan hingga saat ini dan untuk kurun waktu mendatang masih mengandalkan pada sumber air permukaan, khususnya air sungai. Ketersediaan sumber daya air sungai cenderung menurun karena penurunan kualitas dan kuantitas yang tersedia juga karena kualitas yang ada menjadi tidak dapat dimanfaatkan karena adanya pencemaran.Pengelolaan air limbah merupakan salah satu prioritas dalam pengelolaan lingkungan di indonesia. Air
mempunyai karakteristik isik dan kimiawi yang sangat
mempengaruhi kehidupan organisme di dalamnya. Apabila terjadi perubahan kualitas perairan, terutama oleh bahan pencemaran lingkungan, maka daya dukung air tersebut terhadap kehidupan akan teracam.
dalam buku ini akan dibahas tentang air itu sendiri dari sifat alamiahnya hingga berubah menjadi air limbah yang mengandung berbagai bahan pencemar akibat pemakaian dari berbagai aktivitas manusia. Selanjutnya, akan dikupas indikatornya, bagaimana upaya dan teknik pengelolaannya dalam upaya mengembalikan kualitas air. Buku ini lebih diperuntukan bagi pelajar, mahasiswa untuk dipahami dan menjadikan landasan berinovasi dalam pengelolaan air limbah.
denpasar, 03 november 2014
v
DAFTAR ISI
Prakata ... v
Datar Isi ... vii
Datar Tabel ... ix
Datar Gambar ... x
Bab i. Kimia Lingkungan Air 1.1 Sifat-sifat Air ... 1
1.2 Komposisi Air Alami ... 5
1.3 Siklus Hidrolisa ... 6
1.4 Molekol Air dan ikatan Hidrogen ... 7
1.5 Gas-gas dalam Air ... 13
Bab ii. Pencemaran Air 2.1 timbulnya Pencemaran Air ... 24
2.2 Sumber dan Jenis Pencemar Air ... 25
2.3 indikator pencemaran Air ... 30
2.4 Parameter isik Pencemaran Air ... 32
2.5 Parameter Kimia Pencemaran Air ... 37
v
Bab iii. Air Limbah
3.1 Sifat-sifat Air Limbah ... 48
3.2 Karakter Fisik Air Limbah ... 50
3.3 Karakter Kimia Air Limbah ... 53
3.4 Baku Mutu Air ... 56
3.5 Karakteristik Limbah domestik ... 57
3.6 Pengolahan Air Limbah ... 59
3.7 Komponen Pengolahan Air Limbah ... 71
3.8 Mikroorganisme Pengurai Air Limbah ... 75
3.9 Pengolahan Biologis dengan Lumpur Aktif ... 81
3.10 Kurva Pertumbuhan Mikroba ... 82
3.11 Cara Pengolahan Air Limbah ... 88
3.12 tahap Pengolahan Air Limbah ... 96
3.13 Kolam Oksidasi ... 104
Bab iv. eksplorasi Konsorsium Mikroorganisme dalam Suspensi Aktif 4.1 Teknik Pembibitan (seeding) Mikroorganisme (active sludge) ... 110
4.2 Biodegradasi Rhodamin b dengan Biosistem ... 120
Bab V Penutup ... 136
x
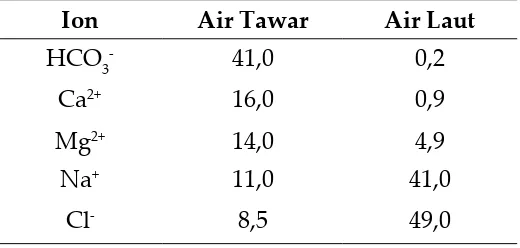
tabel 1.1 Perbandingan konsentrasi ion ion utama pada air tawar dan air laut (% dari konsentrasi total ion) ~ 5
Tabel 1.2. Harga Konstanta Gas dari Beberapa Macam Gas
dalam Air pada 25oC ~ 14
tabel 1.3. Konsentrasi jenuh kelarutan Oksigen dalam Air dalam berbagai temperatur ~ 20
tabel 2. 1. Jenis Pencemar dan Sumbernya ~ 26
Tabel 2.2. Klasiikasi Padatan di Perairan Brdasarkan
Ukuran diameter ~ 35
tabel 2.3. ion-ion yang biasa ditemukan di perairan ~ 37 tabel 2.4. Kadar Oksigen dan Kaitannya dengan
Organisme akuatik ~ 39
tabel. 2.5. Jenis Penyakit Air Beserta Pembawanya ~ 46 tabel 3.1 Sifat-Sifat Air Limbah dan Sumbernya ~ 49 tabel 3.2. Perkiraan volume aliran limbah cair dan
beban BOd yang dihasilkan dari berbagai jenis bangunan dan pelayanan ~ 59
tabel 3.3. Mikroba yang Berperan dalam Proses Biodegradasi ~ 76
Tabel 4.1. Komposisi Air Limbah dan Gula Pasir pada
x
Gambar 1.1. Siklus Hidrologi ~ 7 Gambar 1.2. Ikatan H2O Cair ~ 8
Gambar 1.3. Diagram titik didih senyawa hidrogen ~ 10 Gambar.3.1. Komposisi dan Persentase Komponen Bahan
Organik dalam limbah ~ 58
Gambar 3.2 Aerasi dengan memasukkan udara ke dalam air limbah ~ 61
Gambar 3.3. Aerasi dengan Menggunakan Baling-Baling ~ 62
Gambar 3.4. Struktur ABS ~ 79
Gambar 3.5. Struktur LAS ( Dodecyl Benzena
Sulfonat) ~ 79
Gambar 3.6. Kurva Pertumbuhan Bakteri ~ 85 Gambar 3.7. Skema Diagram Pengolahan Fisik ~ 90 Gambar 3.8. Skema Diagram pengolahan Kimiawi ~ 91 Gambar 3.9. Skema Diagram pengolahan Biologi ~ 95 Gambar 4.1. Diagram Alir Proses Kontak Stabilisasi ~ 120 Gambar 4.2. Biosistem ~ 133
BAB I
KIMIA LINGKUNGAN AIR
1.1 Sifat-Sifat Air
A
ir memiliki struktur molekul yang sangat sederhana, hanya terdiri atas unsur H dan O namun memiliki peran yang sangat vital bagi kehidupandan keberlangsungannya di bumi ini. Kehidupan sangat tergantung pada keberadaan air, tidak ada kehidupan di bumi tanpa adanya air. Fungsi utama air bagi kehidupan yang tidak dapat digantikan adalah multak diperlukan dalam proses fotosintesis, pendistribusian nutrien dan pengontrol suhu tubuh. Keberadaan air bagi kehidupan di bumi ditentukan oleh siklus air. didalam siklus air volume total air di bumi sesungguhnya tetap, namun distribusinya mengalami perubahan-perubahan seiring dengan gangguan terhadap siklus air. Pendistribusian air ini tidak merata di seluruh bagian dari bumi. Hal ini disebabkan karena distribusi curah hujan yang tidak merata di berbagai daerah. Ada daerah yang curah hujannya tinggi dan berkembang menjadi daerah yang subur, sebaliknya daerah yang curah hujannya sangat rendah menjadi gersang dan tandus.
cair dan gas (uap air) yang ternyata menunjukkan sifat-sifat yang istimewa dan unik bila dibandingkan dengan sifat yang ditunjukkan oleh senyawa-senyawa lainnya. Sebagai
contoh : es mengapung di air; sifat ini berbeda dengan sifat bentuk padat pada umumnya yang kerapatannya lebih besar dari bentuk cairnya. Ternyata penyimpangan sifat dari es ini memungkinkan bagi biota akuatik untuk dapat mempertahankan hidupnya di musin dingin.
Air merupakan pelarut yang sangat baik karena dapat melarutkan berbagai macam senyawa ionik dan polar. dengan demikian, air bertindak sebagai media untuk transportasi senyawa-senyawa nutrisi bagi tanaman, hewan dan senyawa-senyawa yang berasal dari limbah yang bersifat toksik ataupun polutan.
Air merupakan komponen utama penyusun makhluk hidup, hampir 98% tubuh suatu makhluk hidup, tersusun oleh air. Bumi merupakan planet air, yang menutupi sekitar 71% permukaan bumi dalam bentuk lautan. Air terdapat dalam berbagai bentuk misalnya uap air, es, cairan dan salju. Air tawar terutama terdapat di badan air di daratan dihubungkan dengan laut dan atmosfer melalui siklus hidrologi yang berlangsung secara kontinyu.
senyawa air mudah bersenyawa sehingga air tergolong pelarut yang universal. Air di alam ini tidak terdapat dalam bentuk yang murni, namun bukan berarti bahwa air tersebut dalam keadaan tercemar. Karakteristik dan sifat yang khas
dari air adalah sebagai berikut (Miller, 1992) :
o Pada kisaran suhu yang sesuai bagi kehidupan,
yaitu 00C (320F)- 1000C, air berwujud cair. Suhu
00C merupakan titik beku (freezing point) dan
suhu 1000 C merupakan titik didih (boiling point).
tanpa sifat tersebut air yang terdapat pada jaringan tubuh makhluk hidup maupun air yang terdapat di laut, sungai danau dan badan air akan terdapat sebagai bentuk padatan atau gas, sehingga tidak akan terdapat kehidupan di muka bumi ini, karena sekitar 60%-90% sel mahluk hidup adalah air.
o Perubahan suhu air berlangsung lambat
sehingga air memiliki sifat sebagai penyimpan panas yang sangat baik. Sifat ini memungkinkan air tidak menjadi panas atau dingin dalam seketika. Perubahan air yang lambat mencegah terjadinya tekanan pada mahluk hidup karena adanya perubahan suhu yang mendadak dan menyebabkan air baik digunakan sebagai pendingin mesin.
o Air memerlukan panas yang tinggi dalam proses
Proses ini memerlukan energi panas dalam jumlah yang besar.
o Air merupakan pelarut yang baik. Air mampu
melarutkan berbagai jenis senyawa kimia. Air dapat mencuci racun/toksik/pencemar yang terdapat di dalam tubuh atau badan air.
o Air memiliki tegangan permukaan yang tinggi.
Suatu cairan dikatakan memiliki tegangan permukaan yang tinggi jika tekanan antarmolekul cairan tersebut tinggi. tegangan permukaan air menyebabkan air memiliki sifat membasahi suatu bahan secara baik (Higher weting ability). tegangan permukaan yang tinggi menyebabkan terjadinya sistem kapiler, yaitu kemampuan untuk bergerak dalam pipa kapiler. Sifat kapiler ini menunjang sistem transportasi unsur hara dari dan ke tanaman.
o Air merupakan satu-satunya senyawa
yang meregang ketika membeku. Pada saat membeku, air meregang sehingga air memiliki Kandungan densitas (massa/volume) yang lebih rendah daripada air. dengan demikian es akan mengapung di air. Sifat ini mengakibatkan danau-danau beriklim dingin hanya membeku pada bagian permukaan sehingga kehidupan organisme akuatik tetap berlangsung.
yang memiliki sifat-sifat istimewa dan unik yang berpangkal dari adanya ikatan hidrogen. Walaupun ikatan hidrogen ini lebih lemah dari ikatan ionik ataupun ikatan kovalen
akan tetapi pengaruhnya terhadap sifat-sifat isika dari air,
menjadikan air sebagai suatu senyawa yang berperanan penting bagi kehidupan.
1.2 Komposisi Air Alami
Air alami sesungguhnya merupakan suatu larutan yang mengandung zat terlarut dalam berbagai konsentrasi. Air yang mengandung sekitar 1000 ppm padatan yang terlarut umumnya digolongkan sebagai air tawar. Air laut rata-rata mengandung sekitar 35.000 ppm padatan yang terlarut. Sedangkan air payau konsentrasi padatan yang terlarut berada di antara batas-batas antara air tawar dan air laut. Konsentrasi ion-ion pada air tawar jauh lebih rendah dari konsentrasi ion-ion dalam air laut; begitupun distribusi ionionnya sangat berbeda.
Ion Air Tawar Air Laut
HCO3- 41,0 0,2
Ca2+ 16,0 0,9
Mg2+ 14,0 4,9
na+ 11,0 41,0
Cl- 8,5 49,0
Pada air laut kation utamanya adalah na+ dan
anion utamanya adalah Cl. Pada air tawar, Ca2+ dan Mg2+
merupakan kation utama, sedangkan anionnya adalah HC03
-. ion-ion pada air tawar berasal dari pelapukan batu-batuan dan tanah.
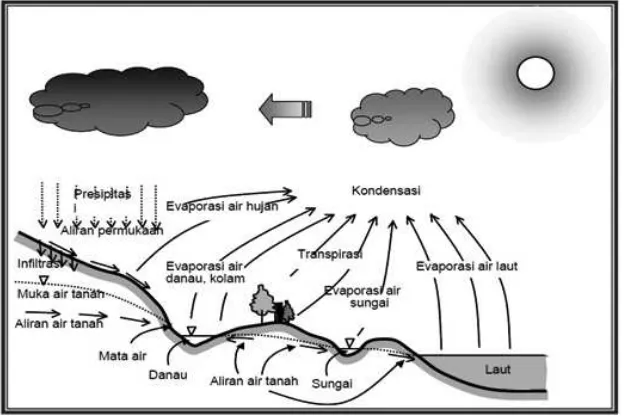
1.3 Siklus Hidrologi
Siklus hidrologi adalah proses perputaran air termasuk perubahan wujud air di bumi yang berlangsung terus menerus membentuk siklus. Air di bumi secara terus-menerus mengalami siklus melalui proses penguapan, transpirasi, kondensasi dan presipitasi, peresapan kedalam tanah (pengisian air tanah), pengaliran permukaan, pemakaian oleh kehidupan dan aktivitas manusia, pelepasan kembali ke badan air. Pendistribusian air melalui siklus yang tidak henti ini dimotori oleh peran energi matahari dan gaya gravitasi bumi. Panas matahari menghangatkan permukaan bumi dan menyebabkan air dari danau, sungai lautan
dan bagian-bagian hidrosir lain mengalami penguapan
(evaporasi).
demikian pula tanaman-tanaman mengalami
transpirasi. Uap air yang terjadi masuk ke dalam atmosir
mengalami pendinginan sehingga terjadi kondensasi dan membentuk awan. Awan ini terbawa oleh angin ke bagian lain dari bumi. Molekul-molekul air yang terdispersi
menempel pada partikel-partikel debu yang ada di atmosir
permukaan bumi sebagai hujan. Presipitasi ini dapat berupa hujan, salju, embun tergantung pada kondisi lingkungannya.
Sebagian dari hujan ini jatuh langsung ke daerah hidrosir,
yang lainnya jatuh di atas tanah atau batu-batuan. Sebagian dari air ini mengalir melalui permukaan menuju sungai atau danau dan sebagian lainnya meresap ke dalam tanah. Air yang meresap ke dalam tanah ini mencapai lapisan yang kedap air dan disebut air tanah (ground water). Selanjutnya
secara perlahan air tanah ini meresap menuju hidrosir
untuk melengkapi siklusnya.
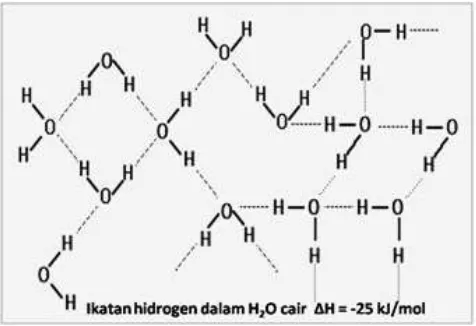
1.4 Molekul Air dan Ikatan Hidrogen
Air mempunyai rumus molekul H2O. Antara atom O dan kedua atom H terbentuk ikatan kovalen; namun karena atom oksigen bersifat lebih elektronegatif dibanding atom
hidrogen maka molekul air bersifat polar. Sudut ikatan
antara H dan O dalam molekul H2O adalah 104,5o. Sifat polar
yang kuat dari air sangat berperan dalam pembentukan ikatan hidrogen. Jenis ikatan ini umumnya terjadi antara molekul-molekul yang bersifat polar yang mengandung H dengan senyawa-senyawa yang mengandung O, F dan N. Dalam hal ini H atom yang bermuatan positif akan tertarik oleh atom yang bersifat elektronegatif.
Satu molekul air dapat membentuk empat ikatan hidrogen. Atom O dapat membentuk dua ikatan hidrogen karena mempunyai dua pasang elektron bebas sedangkan masing-masing atom H membentuk satu ikatan hidrogen dengan atom O pada molekul lain yang berdekatan. dalam keadaan cair, molekul-molekul air senantiasa bergerak dan ikatan hidrogen secara terus-menerus terbentuk dan terputus. Susunan molekul-molekulnya bersifat acak.
dalam keadaan padat (es) gerakan molekul-molekulnya minimal dan molekul-molekulnya terorientasi sedemikian rupa sehingga terbentuk ikatan hidrogen yang maksimal. Molekul-molekulnya tersusun dalam heksagonal beraturan membentuk struktur tiga dimensi yang teratur dan kuat. Rongga yang terjadi pada susunan ini besarnya ditentukan oleh sudut ikatan dari molekul-molekul air. Akibat terjadinya rongga ini maka volume es lebih besar dari bentuk cairnya. Akibatnya jarak molekul molekul air pada keadaan cair lebih rapat daripada dalam keadaan padat (es).
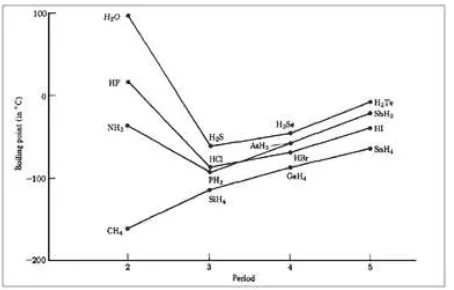
1.4.1 Titik Didih dan Titik Leleh
titik didih senyawa hidrogen dan unsur-unsur golongan vi A pada umumnya meningkat secara teratur
sesuai dengan kenaikan berat molekulnya : H2S, H2Se dan H2te. di luar dugaan H2O yang berat molekulnya paling kecil ternyata mempunyai titik didih paling tinggi jauh di atas titik didih senyawa-senyawa lainnya.
tingginya titik didih air ini adalah akibat adanya ikatan hidrogen di antara molekul-molekul H2O ini; sedangkan pada senyawa-senyawa lainnya keberadaan
ikatan hidrogen ini tidak signiikan.Pada penguapan air
dari cair menjadi uap, diperlukan energi tambahan dalam bentuk panas untuk memutuskan ikatan hidrogen ini; sehingga titik didih air menjadi jauh lebih tinggi dari yang diprediksikan.Seandainya air memiliki titik didih seperti yang diprediksikan (sekitar –80oC) maka pada temperatur
0
bentuk uap sehingga kehidupan di bumi tidak mungkin berlangsung.Air juga mempunyai titik lebur yang tinggi karena diperlukan sejumlah energi dalam bentuk panas untuk memutuskan ikatan hidrogen agar terjadi perubahan dari bentuk padat (es) menjadi bentuk cair.
1.4.2 Kapasitas Panas
Kapasitas panas adalah panas yang diperlukan untuk menaikkan temperatur 1 gram senyawa sebesar 1oC. Ternyata air
mempunyai kapasitas panas paling tinggi yaitu 1 kalori untuk menaikkan temperatur 1 gram air sebesar 1oC.dari batasan di
atas, makin tinggi kapasitas panas suatu senyawa makin kecil kenaikan temperaturnya bila menyerap sejumlah panas tertentu dari makin kecil penurunan temperaturnya bila melepaskan sejumlah panas yang sama.Sifat ini besar sekali implikasinya terhadap iklim di bumi; sebab dengan adanya sifat ini lautan mampu menyerap panas dalam jumlah yang sangat besar tanpa mengalami kenaikan temperatur yang
berarti. dengan kata lain, air mampu meredam terjadinya perubahan temperatur yang drastis di muka bumi.
1.4.3 Panas Peleburan dan Panas Penguapan
Panas peleburan, yaitu panas yang diperlukan oleh 1 gram zat padat untuk berubah menjadi cair pada titik lelehnya. Sebaliknya, sejumlah panas yang sama akan dilepaskan pada perubahan 1 gram zat zair menjadi zat pada pada titik bekunya.Panas peleburan, yaitu panas yang diperlukan oleh 1 gram zat cair untuk berubah menjadi uap pada titik didihnya. Sejumlah panas yang sama dilepaskan pada pengembunan 1 gram uap menjadi cair pada titik didihnya.Pada proses peleburan, terjadi penyerapan panas tetapi temperatur tidak meningkat sampai seluruhnya meleleh. Sebaliknya pada proses pembekuan, panas dilepaskan ke lingkungan tetapi temperatur tidak turun sampai seluruhnya membeku. demikian pula halnya pada proses penguapan dan pengembunan, tidak terjadi perubahan temperatur sampai prosesnya selesai.
penting bagi manusia karena dengan adanya penguapan sedikit air dari kulit (berkeringat) dapat menurunkan
suhu tubuh secara eisien. Dengan demikian, tubuh hanya
kehilangan air relatif kecil sehingga tidak menimbulkan goncangan kesetimbangan cairan tubuh.
Panas penguapan yang tinggi dari air ini juga mempengaruhi iklim dari bumi. Pada musim panas air menguap dari permukaan badan air seperti lautan, danau, dan sebagainya. Panas yang diperlukan untuk penguapan ini diambil dari lingkungan di sekelilingnya, sehingga daerah di sekitamya terasa sejuk. Pada musim dingin, pada waktu air membeku terjadi pelepasan panas sehingga daerah sekitarnya terasa lebih hangat.
1.4.4 Hubungan Temperatur dengan Kerapatan
Kerapatan dideinisikan sebagai berat per satuan
volume. Kerapatan zat cair umumnya meningkat dengan turunnya temperatur dan mencapai maksimum pada titik bekunya. Tidak demikian halnya dengan air. Bila temperatur air menurun, kerapatannya mencapai maksimum pada 4oC (empat
derajat di atas titik bekunya), dan selanjutnya menurun sampai titik bekunya tercapai pada 0oC. Dengan demikian kerapatan es
lebih kecil dari air sehingga es akan mengapung di permukaan air.
mulai membeku membentuk lapisan es yang mengapung menutupi permukaan air dan bertindak sebagai dinding penyekat yang mencegah air yang ada dibawahnya kehilangan panas. dengan demikian, proses pembekuan tidak sampai mencapai dasar danau dan hanya terbatas setebal beberapa kaki saja. Akibatnya, ikan-ikan dan organisme-organisme akuatik lainnya dapat hidup dalam air yang ada di bawah lapisan es tersebut.
Akibat lain yang dapat terjadi dari fenomena di atas adalah kerusakan pada karang-karang dan lingkungan. Air yang terperangkap masuk ke celah-celah karang bila membeku maka tenaga ekspansi yang timbul begitu besarnya sehingga mengakibatkan karang-karang tersebut retak; dan hal ini merupakan faktor penting dari pelapukan batu karang.
1.5 Gas-gas dalam Air
Gas yang terlarut dalam air mempunyai arti yang
amat penting terutama bagi ekosistem air. Biota akuatik sangat membutuhkan oksigen dan tanaman-tanaman air memerlukan CO2 untuk proses fotosintesa. Kelarutan gas-gas di dalam air menuruti Hukum Henry yang menyatakan bahwakelarutan suatu gas dalam zat cair sebanding dengan tekanan parsialnya.
Berdasarkan pernyataan di atas, bila kelarutan gas di dalam air adalah X, maka dapat dinyatakan dalam
bentuk-persamaan berikut :
Dimana k adalah konstanta gas tersebut pada suhu tertentu dan Px adalah tekanan parsial dan gas tersebut.
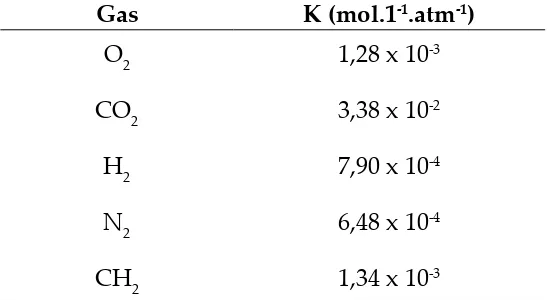
Perlu dicatat bahwa hukum Henry ini tidak berlaku bagi gas‑gas yang bereaksi dengan pelarutnya; seperti misalnya gas CO2 atau gas SO2.Tabel berikut menyatakan nilai k dari beberapa macam gas dalam air pada 25oC.
Tabel 1.2.Harga Konstanta Gas dari Beberapa Macam Gas dalam Air pada 25oC
Gas K (mol.1-1.atm-1)
O2
CO2
H2
n2
CH2
1,28 x 10-3
3,38 x 10-2
7,90 x 10-4
6,48 x 10-4
1,34 x 10-3
Kelarutan jenuh oksigen pada 25oC dalam air dapat
diperhitungkan secara sederhana dengan berpegang pada tekanan udara 1 atm dan tekanan uap air pada 25oC 0,0313
atm dan udara kering mengandung 20,95% volume oksigen. dari ketentuan ini, tekanan parsial oksigen didapatkan dari
perhitungan :
PO2= 20,95 x 10-2 x (1,0000 - 0,0313 atm) = 0,2029 atm.
Seanjutnya berdasarkan hukum Henry konsentrasi
(O2(aq)) = k. P O2
= 1,28 x 10-3 mol 1-1 atm-1 x 0,2029 atm
= 2,60 x 10-4 mol 1-1
Karena massa molekul O2 = 32 maka kelarutannya menjadi: (2,60 x 10-4 mol 1-1 ) x 32 g/mol = 8,32 mg/L atau 8,32 ppm.
1.5.1 Oksigen dalam Air
di samping untuk kelangsungan kehidupan biota akuatik, oksigen terlarut juga digunakan untuk menguraikan bahan‑bahan organik dalam air. Bila bahan-bahan jenis ini cukup banyak mencemari badan air maka jumlah oksigen yang dikonsumsi untuk menguraikan bahan-bahan tersebut semakin banyak. Konsekuensinya kandungan oksigen terlarut dalam air turun sampai sedemikian rendah sehingga tidak cukup untuk memenuhi kebutuhan biota akuatik yang ada dalam perairan tersebut. Banyak ikan-ikan akan mati, bukan karena keracunan zat-zat pencemar tetapi akibat dari kekurangan oksigen.
Hampir seluruh oksigen yang ada dalam air berasal dari atmosfer. Kemampuan suatu badan air untuk mengisi oksigen kembali dengan cara kontak dengan atmosfer merupakan faktor penting dalam mempertahankan kandungan oksigen dalam air.
Oksigen yang dihasilkan oleh tumbuh-tumbuhan
air yang berwarna hjau melalui proses fotosintesis pada
Kelarutan oksigen dalam air tergantung pada
temperatur air, tekanan parsial oksigen dalam atmosir dan
kandungan garam dalam air. dari perhitungan yang telah dilakukan pada pembicaraan terdahulu terlihat bahwa konsentrasi oksigen dalam air pada 25oC yang berada dalam
keadaan setimbang dengan udara pada tekanan 1 atmosfer hanyalah 8,32 mg/L atau 8,32 ppm. Jadi bila dalam air ini terjadi proses yang memerlukan oksigen, maka kandungan oksigen terlarut akan dengan cepat menurun mendekati nol seandainya tidak dilakukan tindakan-tindakan untuk mengatasinya seperti pengoperasian mekanisme reaerasi
yang eisien dalam air.
Penggunaan oksigen untuk menghancurkan senyawa- senyawa organik dapat dinyatakan dengan persamaan
reaksi berikut :
{CH2O} + O2 CO2 + H2O (4.2) ternyata dari persaman stoikiometri di atas, untuk mengkonsumsi kandungan oksigen sebesar 8,32 mg per liter pada 25oC ini hanya 7,8 mg per liter bahan organik
{CH2O} sudah cukup.
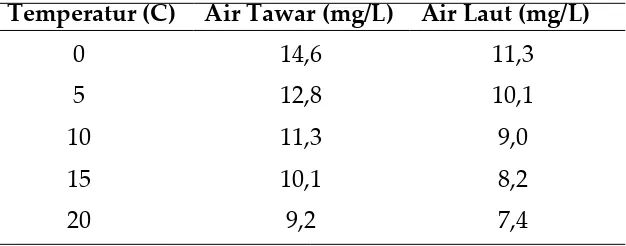
Pengaruh suhu terhadap kelarutan gas-gas dalam air terutama pada kelarutan oksigen dalam air sangatlah penting artinya. Kenaikan temperatur akan menurunkan kelarutan gas-gas dalam air seperti terlihat pada data berikut. Pada 0oC kelarutan oksigen dalam air adalah
14,74 mg/L, sedangkan pada 35oC kelarutannya 7,03 mg/L.
kecepatan metabolisme (pernafasan) dari organisme perairan sehingga menyebabkan adanya suatu keadaan di mana naiknya kebutuhan oksigen diikuti oleh penurunan kelarutan gas tersebut dalam air.
1.5.2 Oksigen Terlarutdalam Air
Gas yang terlarut dalam air sangat penting artinya bagi
kehidupan di air. Hal ini karena gas-gas diperlukan dalam proses fotosintesis dan respirasi. Oksigen di dalam air yang digunakan oleh organisme hidup adalah oksigen terlarut, bukan atom O dalam molekul H2O. Untuk tersedianya air yang sehat, jumlah oksigen dan gas-gas yang lainnya
haruslah djaga setinggi mungkin. Kelarutan oksigen dalam
air tergantung pada suhu dan kadar garam. Jika dalam air terjadi proses pemakaian oksigen maka kadar oksigen terlarut menjadi makin kecil dan bahkan dapat mencapai nol yang tentu saja hal ini sangat merugikan bagi ekosistem dalam badan air tersebut. Untuk mengatasi hal tersebut maka dalam badan air harus ada suatu proses reoksigenasi.
Proses ini tergantung dari kinetika yang dapat menghambat masuknya udara ke dalam air seperti suhu, turbulensi, dan adanya partikel dalam badan air.
Pengaruh suhu terhadap kelarutan gas dalam air
ditunjukan dengan persamaan Clausius Clapeyron:
log C2/C1 = ∆ H/2,303 R ( 1/t1- 1/t2(4.3)
dimana:
dH = kalor larutan dalam kal/mol; R = konstanta gas (1,987 kal/K.mol).
Kelarutan oksigen dalam air pada suhu 25oC dalam keseimbangan dengan udara pada tekanan 1 atmosfer sebesar 8,32 mg/L. Dalam keadaan setimbang dengan udara, air tidak dapat mengandung kadar oksigen terlarut yang terlampau tinggi dibandingkan dengan banyak jenis zat terlarut yang lainnya. Bila terjadi proses penggunaan oksigen dalam air, kadar oksigen terlarut dapat dengan cepat mencapai nol tanpa adanya proses mekanisme reaerasi yang eisien dalam air, seperti aliran turbulensi pada sungai‑sungai yang dangkal atau aerasi dengan pemompaan
udara ke dalam tangki yang merupakan fasilitas pengolahan pada
suatu perlakuan sekunder terhadap limbah dengan lumpur aktif.
Selain untuk kelangsungan kehidupan ekosistem air, oksigen dalam air digunakan untuk menguraikan senyawa‑senyawa organik dengan reaksi sbb:
CH2O + O2--- CO2 + H20
Berat bahan organik-organik yang diperlukan untuk mengkonsumsi 8,3 mg O2 dalam satu liter air yang seimbang dengan atmosfer pada suhu 25oC adalah 7,8 mg
CH2O. Jadi mikroorganisme yang sedang menghancurkan bahan organik hanya mampu merubah 7 sampai 8 mg bahan organik saja, bila mikroorganisme itu mengkonsumsi oksigen jenuh dalam satu liter air pada suhu 25oC.
Winkler & Altenberg dan cara elektrokimia. Metode Winkler dan Altenberg berdasarkan pada sifat-sifat gas oksigen yang terlarut dalam air dengan prinsip kerja sebagai
berikut: Segera setelah pengambilan cuplikan dalam air,
ditambahkan dengan larutan MnSO4 (350 g/L) dan 1 mL, larutan alkali yodium (terdiri dari 15 g i2, 3 g naOH dan 1 g nan3), dalam 100 ml aquadest. Botol ditutup dan dikocok kuat-kuat, kemudian dibiarkan selama 5 menit. dilakukan pengocokan lagi, kemudian secara perlahan ditambahkan 2 ml H2SO4 pekat dan dititrasi dengan natriumtiosulfat.
Reaksi penetapan oksigen terlarut adalah sebagai
berikut:
0 gangguan akan terjadi oleh adanya garam-garam besi, kromat, hipoklorit, klor bebas, tanin, lignin dan asam humat.
Metode pengukuran oksigen terlarut dengan metode elektrokimia memiliki prinsip reduksi gas oksigen pada katoda akan menyebabkan timbulnya arus yang besarnya proporsional dengan tekanan parsial dari oksigen dalam larutan. Prinsip kerjanya dengan membuat arus baku dengan mengukur air yang jenuh dengan udara, kemudian dilakukan penetapan dengan pembanding yang memberikan ekspresi hasilnya dengan kadar oksigen dalam % konsentrasi jenuh. Jika menghendaki kadar dalam mg/L maka digunakan tabel transformasi.
Temperatur (C) Air Tawar (mg/L) Air Laut (mg/L)
0
Banyaknya gas oksigen (mg/ml) yang dapat digunakan untuk mengoksidasi senyawa organik dan anorganik yang bisa teroksidasi dalam air disebut kebutuhan oksigen kimiawi atau chemical oxygen demand= COd. Angka COd dapat digunakan untuk mengevaluasi O2 yang dapat digunakan untuk mengoksidasi garam anorganik dan organik dalam cuplikan, baik yang mengalami biodegradesi maupun yang tidak.
Prinsip kerja penentuan COd adalah dengan oksidasi cuplikan dengan K2Cr2O7 yang berlebihan pada suasana asam dan suhu didih. dilakukan penambahan katalisator Ag2SO4 dan zat pengkompleks HgSO4. Kelebihan bikromat dititrasi dengan larutan ferri ammoniumsulfat. Lima puluh ml cuplikan air yang sebelumnya disaring atau didekantasi ditambah dengan 1 gram HgSO4 dan 5 ml H2SO4 dan ditunggu sampai larut dan tidak ada endapan AgCl yang terjadi kemudian ditambahkan 25 ml larutan K2Cr2O7 0,25 n dan 70 ml H2SO4. Setelah itu dipanaskan dengan sistem pendingin balik selama 2 jam kemudian diencerkan dengan air. Selanjutnya ditambahkan indikator (Ferroine) dan dititrasi dengan larutan baku Ferri ammoniumsulfat.
Jumlah oksigen total dalam mg/L yang dapat digunakan
untuk reaksi kimia sebagai berikut : Sumber: Greg Laidler(1991)
Temperatur (C) Air Tawar (mg/L) Air Laut (mg/L)
Pengerjaannya adalah dengan prinsip kerja isis
yaitu dengan melewatkan air ke dalam tanur pemanas bertemperatur tinggi (900oC). Zat yang dapat dioksidasi
akan teroksidasi secara sempurna pada suhu tersebut. Jumlah oksigen dalam mg/L yang dibutuhkan oleh bakteri aerobik untuk menguraikan dan menstabilkan sejumlah senyawa organik dalam air melalui proses oksidasi biologis aerobik dikenal dengan istilah BOd.Setelah diinkubasi selama 5 hari maka hasil penetapan tersebut disebut BOd 5. Jadi jumlah oksigen dalam mg/L yang diperlukan dalam kondisi penetapan inkubasi selama 5 hari dalam suhu 20oC dalam kegelapan menyatakan degradasi
zat organik terhadap oksigen melalui cara biologis.
Sebenarnya oksidasi senyawa organik secara biologis yang sempurna dapat terjadi dalam waktu 21-28 hari, namun biasanya penetapan dilakukan dengan BOd5. Hal ini dilakukan karena sudah dapat diketahui bahwa tahap oksidasi yang berlangsung sebesar 70%, dan menunggu sampai 21-28 hari untuk suatu analisa yang memerlukan waktu cepat, terlalu lama dalam waktu 5 hari bakteri-bakteri nitrogen hampir secara sempurna telah menggunakan
Cara penetapan BOd5 mengikuti prosedur seperti berikut. Sejumlah volume tertentu dari cuplikan dimasukan ke dalam labu takar dengan diencerkan dengan air yang telah jenuh dengan oksigen. derajat keasaman dibuat netral, kemudian cuplikan dibagi menjadi dua bagian dan dimasukan ke dalam tabung inkubasi tanpa ada gelembung udara yang tersisa salah satu cuplikan ditetapkan nilai oksigen terlarutnya (dO) sedangkan tabung yang lainnya diinkubasi dalam almari inkubasi dalam kondisi gelap dan suhu inkubasi 20oC selama 5 hari. Setelah itu cuplikan
yang diinkubasi ditetapkan kandungan oksigennya (dO). Perbedaan harga dO dari yang diinkubasi dengan cuplikan yang tidak diinkubasi adalah nilai BOd5 cuplikan tersebut.
Pada proses penetapan BOd5 ada beberapa hal yang
dapat mempengaruhi yakni: gangguan cahaya yang dapat
menyebabkan proses fotosintesa sehingga kadar oksigen bertambah, perubahan suhu, pH, elemen-elemen toksis, dan timbulnya gelembung udara pada proses pengerjaan pengukuran.
Untuk lebih memastikan nilai BOd5 suatu cuplikan perlu dilakukan perbandingan dengan larutan standar glukosa 300 mg/L (nilai BOd = 224 mg) atau dengan larutan standar asam glutamat 300 mg/L (nilai BOd 217 mg). Jika nilai COd<BOd 21, maka cuplikan yang diperiksa berisi zat-zat organik yang bisa terbiodegradasi. Perbandingan
2.1 Timbulnya Pencemaran Air
e
kosistem adalah suatu sistem ekologi yang terbentuk dari komponen abiotik dan biotik dengan interaksi diantaranya yang membentuk identitas dan kapasistas ekosistem.Manusia adalah bagian penting dalam suatu ekosistem yang dapat berperan secara internal maupun eksternal dari suatu ekosistem. Keterlibatan manusia menjadi bagian dari ekosistem memiliki dampakyang signiikan terhadap perubahan ekosistem. Untuk
pertumbuhan dan memenuhi keperluan hidupnya manusia menjadikan lingkungan sebagai sumberdaya dalam memenuhi berbagai aktivitas produksinya. dalam melakukan aktivitas, manusia maupun makhluk hidup lain menghasilkan bahan buangan yang biasa disebut limbah. namun, yang menjadi persoalan adalah limbah dalam jumlah yang besar dan dapat berbahaya dari suatu aktivitas yang intensif, yaitu industri. industri dalam skala kecil hingga besar telah merupakan sumber pencemar bagi lingkungan tanah, air dan udara dari berbagai limbah yangg dapat berbentuk padat, cair dan gas.
BAB II
Sumber pencemar merupakan sumber zat/bahan asing yang masuk ke lingkungan dan menimbulkan perubahan pada lingkungan. Perubahan pada lingkungan dapat terjadi tergantung pada besarnya jumlah maupun tingkat toksik dari limbah yang dimasukan ke lingkungan serta faktor kapasitas media lingkungan dalam menampung limbah untuk tidak terjadi pencemaran ataupun kerusakan media lingkungan itu sendiri. Beban pencemar yang masuk melampaui daya dukung lingkungan akan terjadi pencemaran dan kerusakan dan demikian sebaliknya. Jika beban lingkungan terlalu besar, lingkungan membutuhkan waktu untuk memperbaiki diri dan jika perbaikan sulit dilakukan, maka terjadi pencemaran lingkungan.
2.2 Sumber dan Jenis Pencemar Air
Sumber pencemar yang berasal dari aktivitas manusia
dapat diidentiikasi kedalam suatu lokasi tertentu (point source) atau tak tentu/tersebar (non point/difuse source). Kedua jenis sumber pencemar itu harus diperhitungkan dan dianalisis dalam menentukan beban pencemaran yang masuk ke suatu media lingkungan. Sumber tertentu lebih
mudah diidentiikasi karena kejelasan hubungan antara
ditimbulkan dapat ditentukan berdasarkan karakteristik limbah yang dihasilkan. Sumber pencemar non point source
dapat berupa campuran sumber tertentu dalam jumlah yang banyak, misalnya limpasan dari daerah pertanian yang mengandung pupuk dan pestisida, limpasan dari daerah pemukiman (domestik) dan limpasan dari daerah perkotaan.
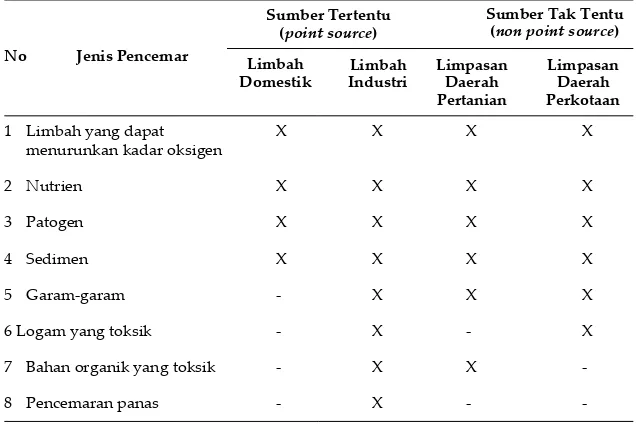
Sumber pencemar dari berbagai aktivitas manusia baik berasal dari lokasi tertentu maupun tidak tertentu dapat menghasilkan bahan pencemar berupa padatan, cairan maupun gas. Bahan pencemar yang masuk ke media air dapat terlarut, tersuspensi, tersedimentasi dan lepas sebagai gas. Pengelompokan bahan pencemar berkaitan dengan janis aktivitas ditunjukan dalam tabel 2.1.
Tabel 2. 1. Jenis Pencemar dan Sumbernya
Sumber Tertentu (point source)
Sumber Tak Tentu (non point source)
No Jenis Pencemar Limbah
Domestik
Sumber pencemar juga dapat dikelompokan menjadi sumber pencemar langsung dan sumber pencemar tidak langsung. Sumber pencemar langsung adalah sumber pencemar yang langsung keluar dari sumbernya masuk ke media sebagai sumber dampak. Sumber pencemar langsung antara lain dari kegiatan industri, rumah tangga, pertanian, peternakan dan sebagainya. Sumber tidak langsung adalah kontaminan yang memasuki lingkungan melalui media perantara, misalnya tanah, air tanah dan hujan sebelum ke target penerima dampak. Jenis bahan buangan dari sumber pencemar langsung maupun tidak langsung dapat berbagai
bentuk sebagai berikut :
a. Bahan Buangan Padat
Bahan buangan padat adalah bahan buangan yang berbentuk padat, baik yang kasar maupun yang halus. Bentuk bahan buangan ini di perairan dapat tersuspensi, terlarut atau bahkan mengendap. Hal ini akan mempengaruhi kekeruhan dan berat jenis perairan. Bahan buangan ini
kadangkala menimbulkan warna dan bau spesiik di
perairan. Jika warna perairan gelap, akan mempengaruhi penetrasi sinar matahari ke dalam air. Sinar matahari sangat berguna untuk fotosintesis.
b. Bahan Buangan Organik
karena akan menyuburkan perairan, sehingga timbul bakteri pathogen. Bahan buangan organik sebaiknya dibuat kompos atau untuk diproses menghasilkan gas metan.
c. Bahan Buangan Anorganik
Bahan buangan anorganik berupa bahan buangan/ limbah yang sulit terurai/didegradasi oleh mikroorganisme. Apabila masuk ke dalam perairan, maka akan terjadi peningkatan ion logam di perairan. yang berasal dari industri misalnya timbal (Pb), Cadmium (Cd), Air Raksa (Hg), Kroom (Cr), nikel (ni).
d. Bahan Buangan Olahan Bahan Makanan
Merupakan bahan buangan organik yang memiliki kekhasan, yaitu bau yang sangat menyengat hidung. Apabila bahan makanan mengandung protein dan gugus Amin, maka akan menjadi senyawa amonia yang mudah menguap dan berbau busuk. Mikroorganisme yang terdapat di dalamnya, juga terdapat bakteri pahtogen yang membahayakan kesehatan manusia.
e. Bahan Buangan Cairan Berminyak
f. Bahan Buangan Zat Kimia
Bahan buangan zat kimia terdiri dari bahan sabun/ detergent, bahan pemberantas kimia (insektisida), Zat warna kimia. Bahan buangan sabun di perairan ditandai dengan adanya buih-buih sabun di permukaan perairan. Sabun berasal dari asam lemak (Stearat, Palmitat atau Oleat) yang direaksikan dengan na(OH) atau K(OH). Beberapa sifat sabun adalah larutan sabun akan menaikkan pH dan mengganggu kehidupan organisme di dalam air. Bahan antiseptik yang ditambahkan dalam sabun akan menggangu organisme di dalam air dan terdapat sebagian bahan sabun yang tidak dapat dipecah oleh mikroorganisme. Pemakaian basa natrium (na) atau Kalium (K) dapat meningkatkan kesadahan air. Pemakaian bahan pemberantas hama (insektisida) pada lahan pertanian menimbulkan sisa bahan insektisida yang cukup banyak. insektisida sulit dipecah atau diurai oleh mikroorganisme dan membutuhkan waktu yang lama. Akibat yang ditimbulkan oleh insektisida akan menurunkan kadar oksigen terlarut di dalam air.
g. Zat Warna Kimia
Banyak digunakan dalam industri, untuk membuat produk menjadi menarik. Zat warna merupakan racun dan bersifat carcinogenic bagi tubuh karena tersusun dari zat kimia yaitu chromogen dan Auxochrome
0
(perkotaan), maupun kegiatan industri. Berdasarkan sifat toksiknya, polutan/pencemar dibedakan menjadi dua, yaitu polutan tak toksik (non toxic polutans) dan polutan toksik (toxic pollutans).Polutan tak toksik biasanya berada pada ekosistem secara alami, bersifat mencemari jika terdapat dalam jumlah yang berlebihan, sehingga dapat mengganggu kesetimbangan ekosistem melalui proses
isika dan kimia perairan. Polutan tak toksik terdiri dari
bahan-bahan tersuspensi dan nutrient. Bahan-bahan
tersuspensi mempengaruhi sifat isika perairan, misalnya
meningkatkan kekeruhan dan menghambat penetrasi sinar matahari. Keberadaan nutrient dan unsur hara yang berlebihan dapat menimbulkan pengayaan perairan, yang mengganggu kesetimbangan ekosistem akuatik secara keseluruhan.Sementara polutan toksik dapat menyebabkan kematian (lethal) dan tidak menyebabkan kematian (sub lethal), misalnya terganggunya pertumbuhan, tingkah laku, dan morfologi organisme akuatik. Polutan toksik biasanya berupa bahan-bahan yang bukan alami, misalnya pestisida dan detergent.
2.3 Indikator Pencemaran Air
Air yang tercemar, memiliki karakteristik khusus
yang dapat dibedakan dari air bersih, baik secara isik, kimia
maupun biologi. Semakin banyaknya jumlah manusia/ penduduk maka makin banyak bahan buangan di alam. Kondisi ini akan menyebabkan kualitas air mengalami
kimia dan biologi lingkungan perairan dapat ditunjukan dengan berbagai indikator/tanda bahwa air dalam keadaan tercemar. indikator tersebut (1) Suhu sangat penting dalam suatu perairan, karena menentukan jenis organisme yang dapat hidup. Kegiatan industri seringkali menggunakan mesin reaktor dalam proses produksi. Apabila hal ini dibuang ke perairan maka akan mengakibatkan perubahan suhu perairan. Perubahan suhu perairan juga dapat terjadi karena peristiwa alam, yang mengakibatkan peningkatan kesuburan perairan sehingga akan timbul jenis tanaman air yang menimbulkan pencemaran (Red Tide). (2)
derajat Keasaman (pH) bagi kehidupan normal berkisar antara 6,5-7,5. Air dapat bersifat asam atau basa tergantung dari jumlah ion Hidrogen yang didonorkan. Limbah yang dibuang ke perairan dapat mengurangi pH menjadi <7(Asam) maupun >7(Basa). (3) indikator Fisik yang mudah terdeteksi oleh panca indera manusia adalah Warna, Rasa dan Bau. Perubahan itu disebabkan oleh jenis dan jumlah bahan buangan/limbah di perairan. Warna, Rasa dan Bau dapat mengurangi estetika bagi penggunaan air untuk keperluan air minum. (4) timbulnya endapan, Koloidal dan Bahan terlarut.
Koloidal ini akan menghalangi masuknya cahaya matahari ke perairan. Jika cahaya matahari kurang di perairan, maka mikroorganisme tidak dapat melakukan fotosintesa dengan sempurna. Fotosintesa dibutuhkan untuk menghasilkan oksigen yang cukup bagi organisme perairan. Semakin banyak endapan, koloidal maupun Bahan terlarut akan meningkatkan BOd (Biological Oxygen Demand) di perairan. (5) Mikroorganisme berperan dalam mendegradasi bahan buangan. Semakin banyak bahan buangan di perairan maka akan semakin banyak mikroorganisme yang akan mendegradasinya. Seiring perkembangan mikroorganisme, kemungkingan akan timbul juga mikroba patogen. Mikroba Pathogen akan menimbulkan berbagai macam penyakit. (5) Radioaktif telah banyak dipergunakan di segala bidang, antara lain pertanian, kedokteran, industri dan lain sebagainya. Sejak awal terbentuknya bumi, radioaktivitas telah ada dalam pembentukan Bumi melalui Reaksi Fusi yang memerlukan energi yang sangat tinggi. namun manusia dilarang untuk mebuang secara sengaja bahan-bahan radioaktif ke perairan.
2.4 Parameter Fisik Pencemaran Perairan
Penentuan parameter pencemaran perairan secara
isik ditentukan berdasarkan sifat-sifat isika. Sifat isika
perairan dapat berupa bahan organik maupun organik yang memiliki sifat daya hantar panas yang bervariasi. Berbagai kandungan bahan tersebutlah yang berpengaruh pada suhu alami perairan disamping tentunya besarnya panas yang diterimanya. Partikel-partikel yang terkandung didalam perairan juga menentukan kecerahan perairanm, warna dan ukuran padatan terlarut dan tersuspensi
didalamnya. Berikut ini Parameter Fisika spesiik yang dapat dipergunakan untuk mengetahui kualitas Air :
2.4.1 Suhu
Badan air memiliki suhu, yang dipengaruhi oleh musim, lintang (latitude), ketinggian dari permukaan air (altitude), waktu hujan dalam sehari, sirkulasi udara, penutupan awan, aliran air serta kedalaman badan air. Perubahan suhu berperan penting terhadap proses
isika, kimia dan biologi badan air, yang juga berperan
mengendalikan kondisi ekosistem perairan. Organisme akuatik memiliki kisaran tertentu yang paling baik bagi pertumbuhannnya.
mikroorganisme seiring dengan itu terjadi peningkatan dekomposisi bahan organik oleh mikroorganisme. Hal ini dapat berdampak pada penyerapan oksigen terlarut yang dapat menjadi pembatas bagi pertumbuhan dan aktivitas mikroorganisme. namun demikian kandungan oksigen terlarut dapat kembali meningkat jika ada penurunan suhu perairan alami.
2.4.2 Kecerahan dan Kekeruhan
Kecerahan merupakan ukuran transparansi perairan, yang ditentukan secara visual dengan menggunakan alat
2.4.3 Warna
terdapat dua warna di perairan, yaitu warna tampak (Apparent Color) dan warna sesungguhnya (true color). Warna sesungguhnya disebabkan oleh partikel terlarut di perairan dan warna tampak disebabkan oleh partikel terlarut dan tersuspensi. Warna perairan ditimbulkan oleh bahan organik dan bahan anorganik. Oksida Besi menyebabkan air berwarna kemerahan, sedangkan oksida Mangan menyebabkan air berwarna kecoklatan dan kehitaman. intensitas warna cenderung meningkat dengan meningkatnya pH. Untuk segi estetis sebaiknya warna air tidak melebihi 15 PtCo. (skala Platinum Cobalt). Untuk kepentigan air minum sebaiknya warna tidak melebihi 50PtCo. Warna juga dapat disebabkan olah alga di perairan contoh oleh Blooming alga (Red Tide). Warna dapat menghambat penetrasi cahaya untuk masuk ke perairan.
2.4.4 Padatan Total, Terlarut dan Tersuspensi
Padatan total (residu) adalah padatan yang tersisa setelah sampel mengalami pengeringan pada suhu tertentu.
Padatan yang terdapat di perairan diklasiikasikan menurut
ukuran diameter, dapat dilihat pada tabel 2.2.
Tabel 2.2.Klasiikasi Padatan di Perairan Brdasarkan Ukuran Diameter
No Klasiikasi Padatan Ukuran Diameter (μm) Ukuran Diameter
1 Padatan terlarut < 10-3 <10-6
2 Koloid 10-3-1 10-6-10-3
Padatan tersuspensi total ( Total Suspended Solid atau TSS) adalah bahan-bahan tersuspensi (diameter > 1 μm) yang tertahan di saringan millipore berdiameter 0,45 μm. tSS terdiri dari Lumpur dan pasir halus serta jasad-jasad renik yang terdiri dari kikisan tanah dan erosi tanah yang terbawa ke badan air.
Padatan yang menetap (Setleable solid) adalah padatan tersuspensi yang dapat diendapkan selama periode tertentu dalam wadah yang berbentuk kerucut terbalik (imhof cone). Padatan terlarut total (Total Dissolved Solid atau tdS) adalah bahan-bahan terlarut (diameter < 10-6 mm) dan
koloid (diameter 10-6mm – diameter 10-3mm) yang berupa
senyawa-senyawa kimia dan bahan-bahan lain, yang tidak tersaring pada kertas saring yang berdiameter 0,45 μm. tdS biasanya disebabkan oleh bahan anorganik yang berupa ion-ion yang biasanya ditemukan di perairan. Jenis ion-ion anorganik yang biasanya ditemukan di perairan antara lain dapat dilihat pada tabel 2.3
Tabel 2.3. ion-ion yang biasa ditemukan di perairan
Major Ion (Ion Utama) (1-1000 mg/liter)
Secondary Ion (Ion Sekunder) (0,01 mg-10 mg/liter)
1. Besi (Fe)
2. Strontium (Sr)
3. Kalium (K)
4. Karbonat (CO3)
5. nitrat (nO3)
6. Flourida (F)
7. Boron (B)
8. Silika (SiO2) 1. Sodium (na)
2. Kalsium (Ca)
3. Magnesium (Mg)
4. Bikarbonat (HCO3)
5. Sulfat ( SO4)
6. Klorida (Cl)
2.5 Parameter Kimia Pencemaran Perairan
Penentuan parameter pencemaran perairan secara kimia ditentukan berdasarkan sifat-sifat kimia. Sifat kimia adalah sifat yang ditentukan dengan terjadinya reaksi yang melibatkan ionik, masuknya unsur maupun senyawa kimia kedalam air dan terjadi reaksi yanng dapat merubah bentuk hasil semula. dengan demikian sifat kimia adalah keberadaan unsur/senyawa dalam perairan sebagai hasil dari reaksi kimia. Bebrapa parameter kimia perairan adalah
2.5.1 Derajat Keasaman (pH)
nilai pH ditentukan oleh konsentrasi ion hidrogen dalam air, semakin besar konsentrasi ion hidrogen dalam air semakin rendah nilai pH dan perairan semakin bersifat toksik. Sebagian besar biota akuatik sensitif terhadap perubahan pH, dan menyukai kondisi pH yang berkisar antara 7,0 -8,5. Kondisi pH sangat mempengaruhi dinamika kimiawi unsur/senyawa dan proses biokimiawi perairan, misalnya
proses nitriikasi akan terhambat dengan menurunnya pH
perairan. namun demikian,logam berat dalam kondisi ionnya dan meningkatkan tinkat toksisitasnya pada pH yang rendah. Penurunan pH perairan mulai dari pH 6 akan mempengaruhi kelimpahan keanekaragaman plankton dan bentos, sementara pH 5 kebawah akan mempengaruhi
penurunan yang signiikan pada biomassa zooplankton dan peningkatan ilamen algae hjau, dan pada pH 4 sebagian besar tumbuhan hjau akan mati.
2.5.2 Oksigen Terlarut/Disolved Oksygen (DO)
Oksigen merupakan salah satu gas yang terlarut pada perairan. Kadar oksigen yang terlarut di perairan alami bervariasi tergantung pada suhu, salinitas, turbulensi air
dan tekanan atmosfer (Efendi, 2003). Ikan dan organisme
Tabel 2.4.Kadar Oksigen dan Kaitannya dengan Organisme akuatik
Pemaparan lama akan dapat mengakibatkan kematian ikan
ikan dapat bertahan hidup tetapi pertumbuhannya terganggu
ideal bagi sebagian besar organisme akuatik dan kadar logam berat tinggi akan dapat menyengsarakan organisme akuatik.
2.5.3 Kebutuhan Oksigen Biokimiawi/Biochemical Oxygen
Demand (BOD)
dekomposisi bahan organik umumnya terjadi dalam dua tahap, pertama yaitu oksidasi bahan organik menjadi bahan anorganik. selanjutnya yaitu oksidasi bahan anorganik yang tidak stabil menjadi bahan organik yang lebih stabil. BOd5 merupakan gambaran kadar bahan organik, yaitu jumlah oksigen yang dibutuhkan oleh mikroba aerob untuk mengoksidasi bahan organik menjadi karbondioksida dan air.
0
sangat mendukung proses oksidasi tersebut. Keberadaan bahan-bahan toksik akan dapat mengganggu kemampuan mikroba dalam mengoksidasi bahan organic. Perairan yang telah memiliki Kandungan BOd5 5,0-7,0 mg/liter dianggap masih alami, sedangkan perairan yang memiliki Kandungan BOd5> 10 mg/liter dianggap telah mengalami pencemaran. Kandungan BOd5 industri pangan antara 500-4000 mg/liter (Rao, 1991)
2.5.4 Kebutuhan Oksigen Kimiawi/Chemical Oksygen
Demand (COD)
COd menggambarkan jumlah total oksigen yang dibutuhkan untuk mengoksidasi bahan-bahan kimiawi secara kimiawi, baik yang dapat didegradasi secara biologi maupun yang sukar didegradasi secara biologi. Pengukuran COd didasarkan pada kenyataan bahwa hampir semua bahan organik dapat dioksidasi menjadi karbon dioksida dan air dengan bantuan oksidator kuat (Kalium dikromat/ K2Cr2O7) dalam suasana asam.
Perairan yang memiliki kadar COd tinggi tidak ideal bagi kepentingan perikanan dan pertanian. Kandungan COd pada perairan yang tidak tecemar biasanya berkisar kurang dari 20 mg/liter. Sedangkan pada perairan yang tercemar lebih dari 200 mg/liter dan pada limbah industri
2.5.5 Nitrit (NO2-)
nitrit bersifat toksik dalam perairan, kandungan nitrit di perairan ditentukan oleh pencemarn oleh senyawaan n dan terhambatnya proses pembentukan nitrat oleh mikroorganisme hal ini berkaitan juga dengan ketersediaan oksigen terlarut. Umumnya, perairan alami memiliki kadar nitrit dalam jumlah sedikit, dan segera teroksidasi menjadi nitrat yang menyebabkan kandungan nitrat lebih tinggi dari nitrit. Sumber nitrit berkaitan dengan sumber yang menghasilkan senyawaan nitrogen, sumber tersebut umumnya berasal dari limbah industri dan limbah domestik. Perairan alami mengandung nitrit sekitar 0,01 mg/liter dan sebaiknya tidak melebihi 0,06 mg/ liter karena dapat bersifat toksik. Pada manusia konsumsi nitrit yang berlebihan dapat mengakibatkan terganggunya
proses pengikatan oksigen oleh hemoglobin darah. (Efendi,
2003).
2.5.6 Nitrat (NO3)
2.5.7 Besi (Fe)
Keberadaan besi pada perairan permukaan di pada kerak bumi menempati posisi keempat terbesar. Besi ditemukan dalam kation Ferro (Fe2+) dan Ferri (Fe3+). Pada
perairan alami dengan pH sekitar 7 dan kadar oksigen terlarut yang cukup, ion ferro yang yang bersifat mudah larut dioksidasi menjadi ion ferri. Proses redoks besi melibatkan bakteri sebagai mediator Kadar Besi pada perairan alami berkisar antara 0,05-0,2 mg/liter (Boyd, 1988), kadar besi > 1,0 mg/liter dapat membahayakan kehidupan organisme akuatik.
2.5.8 Kadmium (Cd)
Kadmium banyak digunakan dalam industri metalurgi, pelapisan logam, pigmen, baterai, peralatan
elektronik, pelumas, peralatan fotograi, gelas, keramik,
tekstil dan plastik. Kadar Kadmium pada perairan alami sekitar 0,0001-0,001 mg/liter. Untuk melindungi kehidupan ekosistem akuatik sebaiknya perairan memiliki kadar
kadmium sekitar 0,0002 mg/liter (Efendi, 2003).
2.5.9 Timbal (Pb)
dan kemunduran mental pada anak-anak yang sedang berkembang. Pada Perairan yang diperuntukkan bagi air minum sebaiknya kadarnya tidak melebihi 0,1 mg/liter
(Efendi, 2003)
2.5.10 Fosfat (PO4)
Fosfat banyak digunakan sebagai pupuk, sabun atau detergen, bahan industri keramik dan minyak pelumas. Kadar Fosfor yang diperkenankan bagi kepentingan air minum adalah 0,2 mg/liter. Kadar fosfor pada perairan
alami berkisar antara 0,005-0,02 mg/liter (Efendi, 2003).
Fosfat terdapat dalam air alam atau air limbah sebagai senyawa Ortofosfat, Polifosfat dan Fosfat-organis. Ortofosfat adalah senyawa monomer seperti H2PO4-, HPO
4
2-dan PO43-. Sedangkan Polifosfat (juga disebut “Condensed
Phosphates”) merupakan senyawa polimer seperti (PO3)6
3-(heksametafosfat), P3O105- (tripolifosfat). Setiap senyawa
ortofosfat yang terlarut melalui proses biologis oleh bakteri maupun tanaman.
Jika kadar fosfat pada air alami sangat rendah (<0,01 mg P/l), pertumbuhan tanaman dan ganggang akan terhalang, keadaan ini dinamakan oligotrop. Bila kadar lain atau nutrient sangat tinggi, pertumbuhan ganggang dan tanaman tidak terbatas (keadaan eutrop) (Allaerts, 1984).
2.6 Dampak Pencemaran Air
Jenis dampak yang ditimbulkan oleh pencemaran air banyak sekali ragamnya. dampak ini dapat terbagi dan dikategorikan ke dalam empat kelas antara lain dampak terhadap kehidupan biota air, kualitas air tanah, kesehatan dan estetika lingkungan.
2.6.1 Dampak terhadap Kehidupan Biota Air
2.6.2 Dampak terhadap Kualitas Air Tanah
Polutan akan meresap ke dalam tanah melalui pori-pori tanah. Pada proses peresapan ini, tanah akan menjadi jenuh. Hal ini akan menimbulkan gangguan terhadap air tanah, sebagai salah satu sumber air minum yang paling banyak digunakan.
2.6.3 Dampak terhadap Kesehatan
dampak terhadap kesehatan tergantung dari kualitas air, karena air merupakan media bagi penyebaran penyakit.
Penularan penyakit dapat bermacam-macam yaitu : Air
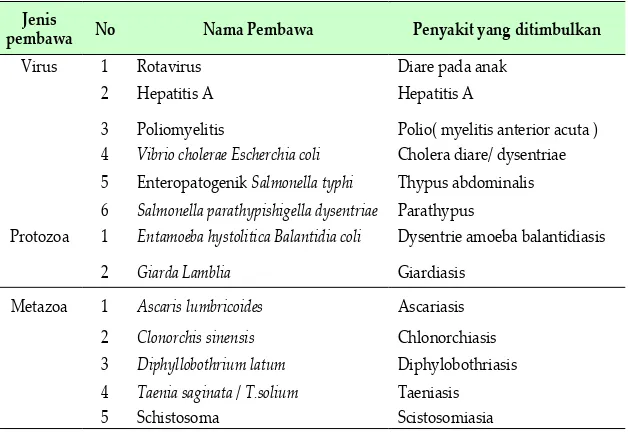
sebagai media hidup bagi mahluk hidup termasuk mikroba, air sebagai sarang penyebar penyaki dan jumlah air yang berkurang menyebabkan tidak tercukupinya kebutuhan manusia untuk membersihkan dirinya. di indonesia terdapat beberapa penyakit yang dikategorikan sebagai
Tabel. 2.5. Jenis Penyakit Air Beserta Pembawanya
Jenis
pembawa No Nama Pembawa Penyakit yang ditimbulkan
virus 1 Rotavirus diare pada anak 2 Hepatitis A Hepatitis A
3 Poliomyelitis Polio( myelitis anterior acuta ) 4 Vibrio cholerae Escherchia coli Cholera diare/ dysentriae 5 enteropatogenik Salmonella typhi thypus abdominalis 6 Salmonella parathypishigella dysentriae Parathypus
Protozoa 1 Entamoeba hystolitica Balantidia coli dysentrie amoeba balantidiasis
2 Giarda Lamblia Giardiasis
Metazoa 1 Ascaris lumbricoides Ascariasis 2 Clonorchis sinensis Chlonorchiasis 3 Diphyllobothrium latum diphylobothriasis 4 Taenia saginata / T.solium taeniasis 5 Schistosoma Scistosomiasia Sumber : Gunadharma, 1997
2.6.4 Dampak terhadap Estetika Lingkungan
Pada tempat pembuangan dan pengolahan limbah, masalah
bau umumnya timbul dari beberapa kegiatan antara lain :
tangki pembuang limbah industri, tangki pembusuk limbah
3.1 Sifat-Sifat Air Limbah
A
ir limbah mempunyai sifat-sifat yang dapatdibedakan menjadi tiga bagian yaitu: sifat isik,
sifat kimiawi dan sifat biologis. Adapun cara pengukuran yang dilakukan pada setiap jenis dari sifat-sifat tersebut dilakukan dengan cara yang berbeda-beda sesuai dengan keadaannya. Analisis jumlah dan satuan biasanya diterapkan untuk menelaah bahan kimianya, sedangkan analisis menggunakan penggolongan, banyak diterapkan untuk kandungan biologinya.
Adapun gambaran lengkap tentang sifat isik, sifat
kimiawi, serta kandungan biologis dari air limbah serta sumber utama munculnya sifat itu dapat dilihat pada tabel 2.1 di bawah (Matcalf dan eddy, 1979).
BAB III
Tabel 3.1 Sifat-Sifat Air Limbah dan Sumbernya
Sifat-sifat Air Limbah Sumber asal air limbah
Sifat isik :
Sifat kimia : - Organik
1 Warna Air buangan rumah tangga dan industri serta bangkai
benda organis
2 Bau Pembusukan air limbah dan limbah industry
3 endapan Penyediaan air minum, air limbah rumahtangga dan
industri, erosi tanah, aliran air rembesan
4 temperatur Air limbah rumahtangga dan industri
1 Karbohidrat Air limbah rumahtangga, perdagangan serta limbah industri
2 Minyak, lemak, Air limbah rumahtangga, perdagangan serta limbah industri
gemuk
3 Pestisida Air limbah pertanian
4 Fenol Air limbah industri
5 Protein Air limbah rumahtangga, perdagangan
6 deterjen Air limbah rumahtangga, industri
7 Lain-lain Bangkai bahan organik alamiah
1 Kesadahan Air limbah dan air minum rumahtangga serta rembesan air tanah
2 Klorida Air limbah dan air minum rumahtangga, rembesan air
tanah dan pelunak air
3 Logam berat Air limbah industri
4 nitrogen Air limbah rumahtangga dan pertanian
5 Ph Air limbah industri
6 Fosfor Air limbah rumahtangga dan industri serta limpahan air
hujan
7 Belerang Air limbah dan air minum rumahtangga serta limbah
industry
1 Hidrogen sulida Pembusukan limbah rumahtangga
2 Metan Pembusukan limbah rumahtangga
3 Oksigen Penyediaan air minum rumahtangga serta perembesan air
permukaan
1 Binatang Saluran terbuka dan bangunan pengolah
2 tumbuh-tumbuhan Saluran terbuka dan bangunan pengolah
3 Protista Air limbah rumahtangga dan bangunan pengolah
4 virus Air limbah rumahtangga
Anorganik :
Bahan-bahan beracun :
- Gas-gas
0
3.2 Karakteristik Fisik Air Limbah
Karakter isik air limbah ditentukan oleh polutan yang
masuk kedalam air limbah dan memberikan perubahan
isik pada air limbah tersebut. Karakteristik isik tersebut
adalah suhu, kekeruhan, warna dan bau yang disebabkan oleh adanya bahan tersuspesi dan terlarut didalamnya. Penentuan derajat kekotoran air limbah sangat dipengaruhi
oleh adanya sifat isik yang mudah terlihat. Adapun sifat isik yang penting adalah kandungan zat padat sebagai
efek estetika dan kejernihan serta bau dan warna dan juga temperatur.
3.2.1 Suhu
Fluktuasi suhu dalam air akan
berpengaruh terhadap kehidupan di dalamn.
Peningkatan dan penurunan suhu dalam air dipengaruhi oleh derajat ketinggian tempat, komposisi substrat, kekeruhan, curah hujan, angin, suhu limbah dan reaksi-reaksi kimia yang terjadi dalam air. Kenaikan suhu sebesar 10 oC dapat mengakibatkan ikan tertekan
dan laju metabolisme meningkat dua kali lipat. Suhu optimal beberapa jenis moluska adalah 20 oC, dan
apabila melampaui batas tersebut akan mengakibatkan berkurangnya aktivitas kehidupannya (Haslam, 1995).
3.2.2 Padatan Terlarut dan Tersuspensi
Besarnya padatan tersuspensi dalam suatu perairan akan menurunkan penetrasi cahaya, sehingga akan dapat
Pada dasar perairan, padatan tersuspensi secara perlahan akan menutupi organisme bentos dan dapat mempengaruhi jaring-jaring pangan. Padatan tersuspensi dalam suatu perairan disebabkan oleh banyak faktor seperti lumpur, bahan organik, detritus, plankton, dan limbah domestik, sehingga menimbulkan kekeruhan yang tinggi dalam suatu perairan.
Padatan total (residu) adalah bahan yang tersisa setelah air sampel mengalami evaporasi dan pengeringan pada suhu tertentu. Residu dianggap sebagai kandungan total bahan terlarut dan tersuspensi dalam air. Selama penentuan residu ini, sebagian besar bikarbonat yang merupakan anion utama di perairan telah mengalami transformasi menjadi karbondioksida, sehingga karbondioksida dan gas – gas lain yang menghilang pada saat pemanasan tidak tercakup dalam nilai padatan total (Boyd, 1988). Padatan yang
terdapat di perairan diklasiikasikan berdasarkan ukuran
diameter partikel.
Padatan tersuspensi total (total suspended solid atau tSS) adalah bahan dasar tersuspensi yang tertahan pada saringan milipore dengan diameter pori 0,45 mikrometer. tSS terdiri atas lumpur dan pasir halus serta jasad-jasad renik, yang terutama disebabkan oleh kikisan tanah erosi
tanah yang terbawa ke dalam air (Efendi, 2003).
Solid atau tdS) adalah bahan – bahan terlarut (diameter <10-6mm) dan koloid (diameter 10-6 – 10-3) yang berupa
senyawa-senyawa kimia bahan lain, yang tidak tersaring pada kertas saring berdiameter 0,45mikrometer (Rao, 1992). tdS biasanya disebabkan oleh bahan organik yang berupa ion – ion yang biasa ditemukan di perairan.
Berdasarkan sifat volatilitas (penguapan) pada suhu 6000C, padatan tersuspensi dan terlarut dibedakan menjadi
volatile solids dan non volatile atau ixed solids. Volatile solid
adalah bahan organik yang teroksidasi pada pemanasan dengan suhu 6000C, sedangkan non volatile solid adalah
fraksi bahan organik yang tertinggal sebagai abu pada suhu tersebut (Rao, 1992).
nilai tdS perairan sangat dipengaruhi oleh pelapukan batuan, limpasan dari tanah, dan pengaruh antropogenik (berupa limbah domistik dan industri). Bahan – bahan tersuspensi yang terlarut dalam perairan alami tidak bersifat toksik, akan tetapi jika berlebihan, terutama tSS dapat meningkatkan nilai kekeruhan, yang selanjutnya akan menghambat penetrasi cahaya matahari ke kolam air dan akhirnya berpengaruh terhadap fotosintesis di perairan
(Efendi, 2003).
3.3 Karakteristik Kimia
Karakteristik kimia air limbah ditentukan dengan adanya polutan dari bahan bahan kimia (chemical). Chemical tersebut terdapat dalam bentuk terlarut dalam bentuk ion-ion dan tersuspensi dalam bentuk senyawanya. Kandungan bahan kimia yang ada di dalam air limbah sebagai polutan akan menimbulkan dampak negatif bagi lingkungan melalui berbagai kemungkinan reaksi biokimia. Bahan organik terlarut dapat menghabiskan oksigen dalam limbah serta akan menimbulkan rasa dan bau yang tidak sedap pada penyediaan air bersih. Selain itu, akan lebih berbahaya apabila bahan tersebut merupakan bahan yang beracun. Adapun bahan kimia yang penting yang ada di
dalam air limbah pada umumnya dapat diklasiikasikan sebagai berikut (Sugiharto, 1987) :
1. Bahan organik 7. Protein 12. Logam berat
2. pH 8. Karbohidrat 13. Metan
3. Klorida 9. Minyak& Lemak 14. nitrogen
4. Kebasaan 10. Fenol 15. Fosfor
5. Sulfur 11. Bahan anorganik 16. Gas
6. Zat beracun
3.3.1 Oksigen Terlarut
Kandungan oksigen (O2) terlarut merupakan hal yang paling penting bagi kelangsungan hidup organisme perairan, sehingga penentuan kadar O2 terlarut dalam
air dapat djadikan ukuran untuk menentukan mutu