VIABILITAS SPERMATOZOA BABI DALAM PENGENCER BELTSVILLE THAWING SOLUTION (BTS) PADA TIGA
TEMPAT PENYIMPANAN BERBEDA
(Viability of Boar Spermatozoa in Bts Extender (Beltsville Thawing Solution) Stored in Three Different Places)
N.L.G. S UMARDANI
1, L.Y. T UTY
2dan H.S. P OLLUNG
31
Fakultas Peternakan Universitas Udayana, Denpasar, Jl. PB Sudirman, Denpasar, Bali
2
Fakultas Kedokteran Hewan Institut Pertanian Bogor, Jl. Agatis Kampus IPB Darmaga, IPB Bogor 16680
3
Fakultas Peternakan Institut Pertanian Bogor, Jl. Agatis Kampus IPB Darmaga, IPB Bogor 16680
ABSTRACT
The optimal storage temperature to preserve boar semen is 17 – 18°C. The temperature fluctuations can decrease sperm viability. The observation was based on the sperm viability in Beltsville Thawing Solution (BTS) extender in different storages i.e.: room temperature (22°C), refigerator (20°C) and styrofoam box (18°C). The research was done in a completely randomized design (CRD) with three treatments. Semen from three years old Yorkshire boars (n=3) were collected twice a week by hand method. Semen characteristics and their quality were evaluated macro and microscopically. These semen were added with BTS extender up to fourfold volume (ratio 1:3). This is based on the assumption of AI dose of 2 - 3 x 10
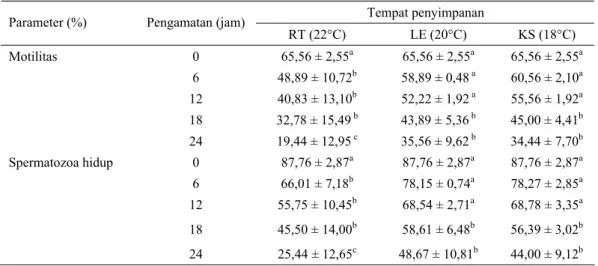
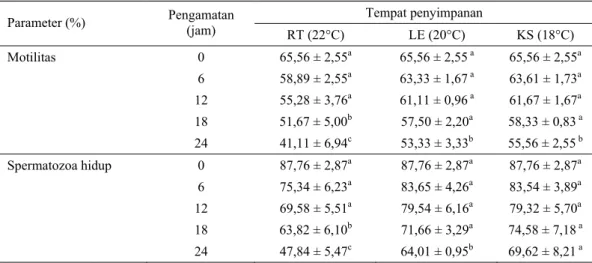
9cells/80ml and the sperm motility and viability were evaluated every six hours for 24 hours observation. The results showed that fresh semen characteristics were good, with the persentage of sperm motility of 65.56 ± 2.55% and sperm viability of 87.76 ± 2.87%. The best storage system found in this experiment of 24 hours observation was BTS extender with sperm motility of 55.56 ± 2.55% and sperm viability of 69,62 ± 8,21% in styrofoam box.
In conclusion, BTS extender can maintain the quality of spermatozoa stored in styrofoam box for about 24 hours with sperm motility 50 - 60%, and the styrofoam box can be used as an alternative container for insemination program in the field.
Key Words: Sperm Viability, Semen Extender, Storage, Boar Sperm
ABSTRAK
Semen cair babi dapat disimpan dalam temperatur optimum 17 – 18°C. Perubahan temperatur dapat menurunkan viabilitas spermatozoa selama penyimpanan. Penelitian ini bertujuan untuk mengetahui viabilitas spermatozoa dalam pengencer Beltsville Thawing Solution (BTS) pada penyimpanan berbeda yaitu pada ruang terbuka (22°C), lemari es (20°C) dan kotak styrofoam (18°C). Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan tiga perlakuan. Semen dikoleksi dengan metode manual (hand method) dua kali dalam seminggu, dari tiga ekor babi pejantan Yorkshire berumur tiga tahun. Karakteristik dan kualitas semen dievaluasi secara makroskopis dan mikrokospis. Semen yang telah ditampung ditambahkan pengencer BTS dengan perbandingan 1:3 dengan asumsi menggunakan dosis IB yakni konsentrasi spermatozoa motil mencapai 2 – 3 x 10
9sel dalam 80 ml. Pengamatan terhadap motilitas dan spermatozoa hidup dilakukan setiap enam jam sampai jam ke - 24. Hasil penelitian menunjukkan, karakteristik semen segar adalah baik dengan motilitas 65,56 ± 2,55% dan spermatozoa hidup 87,76 ± 2,87%. Sistem penyimpanan yang lebih baik selama 24 jam pengamatan adalah pada kotak styrofoam dengan persentase motilitas spermatozoa 55,56 ± 2,55% dan spermatozoa hidup 69,62 ± 8,21%. Kesimpulan dari penelitian ini adalah pengencer BTS dapat mempertahankan viabilitas spermatozoa semen cair babi yang disimpan pada kotak styrofoam dengan persentase motilitas mencapai 50 – 60% dan penggunaan kotak styrofoam dapat dilakukan sebagai alternatif tempat penyimpanan semen untuk kegiatan inseminasi di lapangan.
Kata Kunci: Viabilitas Spermatozoa, Pengencer Semen, Penyimpanan, Spermatozoa Babi
PENDAHULUAN
Produksi semen cair babi sering dihadapkan pada kendala penyimpanan semen, khususnya saat pendistribusian semen cair kepada konsumen. Hal ini mengingat semen babi memiliki sifat voluminous yakni volume tinggi (150 – 200 ml), konsentrasi spermatozoa rendah yaitu 200 – 300 X 10
6sel/ml (G ARNER
dan H AFEZ , 2000), dan semen babi dapat disimpan dengan tetap mempertahankan viabilitasnya hanya pada kisaran temperatur 15 – 20°C (P AULENZ et al., 2000). Terjadinya perubahan temperatur akan berpengaruh terhadap struktur phospholipid membran plasma spermatozoa (W ATSON , 1996; C HUN - X IA et al., 2000). Persentase phosphatidy- lethanolamine dan sphingomyelin pada membran spermatozoa babi sangat tinggi, masing-masing adalah 24 dan 14% (W HITE , 1993). Hal ini menyebabkan membran plasma spermatozoa babi sangat sulit stabil pada temperatur rendah.
Penggunaan semen cair untuk periode waktu yang lama memerlukan pengawetan dengan penambahan bahan pengencer yang mengandung sumber nutrisi, buffer, bahan anti cold shock, dan antibiotik, serta dapat melindungi spermatozoa selama proses pengolahan dan penyimpanan. Karbohidrat paling banyak digunakan sebagai sumber nutrisi karena lebih mudah dimanfaatkan oleh spermatozoa, dan sebagai pelindung spermatozoa terhadap cekaman perubahan temperatur (cold shock). Pengencer Beltsville Thawing Solution (BTS) mengandung glukosa sebagai unsur utama karbohidrat (D UBE et al., 2004). Berkaitan dengan hal tersebut, penelitian ini bertujuan untuk mengkaji penggunaan pengencer BTS pada penyimpanan berbeda terhadap viabilitas spermatozoa babi selama proses pendistribusian semen cair kepada konsumen.
MATERI DAN METODE
Sumber semen berasal dari tiga ekor babi jantan bangsa Yorkshire, umur tiga tahun, dalam kondisi sehat, dan mempunyai mutu semen baik, yaitu konsentrasi spermatozoa lebih dari 150 X 10
6sel/ml dan motilitas spermatozoa lebih dari 60%. Penampungan
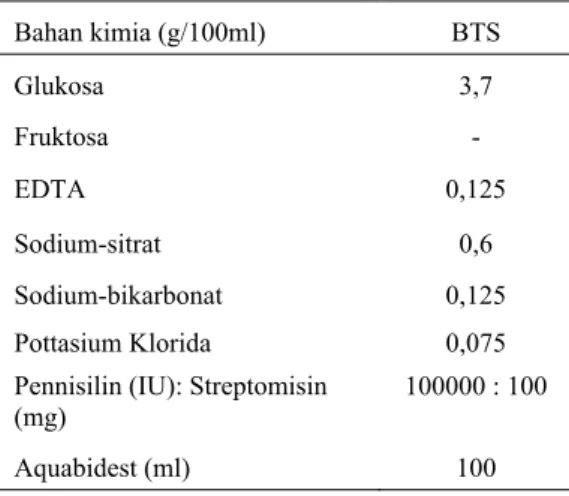
semen dua kali seminggu, dengan metode manual (glove hand method). Pakan yang diberikan untuk pejantan mengandung protein 18% dan energi 16 MJ (3824.16 kkal/kg), yang terdiri dari dedak padi, dedak jagung, polar, gandum, konsentrat 152, mineral, lisin, dan starbio, dengan total pemberian pakan sebanyak 2,5 kg/ekor/hari. Bahan pengencer semen yang digunakan adalah BTS dengan kandungan bahan kimia seperti dijabarkan dalam Tabel 1.
Tabel 1. Komposisi bahan pengencer semen babi
Bahan kimia (g/100ml) BTS
Glukosa 3,7 Fruktosa - EDTA 0,125 Sodium-sitrat 0,6 Sodium-bikarbonat 0,125
Pottasium Klorida 0,075
Pennisilin (IU): Streptomisin
(mg) 100000 : 100
Aquabidest (ml) 100
BTS (Beltsville Thawing Solution), EDTA (Ethylenediamine-tetra-acetic acid)
Semen yang diperoleh dievaluasi secara makroskopis dan mikroskopis, meliputi pemeriksaan volume (ml), warna, pH dan pemeriksaan konsistensi atau kekentalan, konsentrasi spermatozoa (10
6sel/ml), persentase sperma motil (M%) dan sperma hidup (SH%) serta persentase normalitas dan abnormalitas spermatozoa. Semen yang telah dievaluasi dan memenuhi syarat, selanjutnya diencerkan dengan perbandingan satu bagian semen dan tiga bagian pengencer. Asumsi berdasarkan dosis IB yakni konsentrasi spermatozoa motil mencapai 2000 – 3000 X 10
6sel dalam 80 ml.
Rancangan yang digunakan adalah
Rancangan Acak Lengkap dengan tiga
perlakuan yaitu semen cair pada ruang terbuka
(22°C) perlakuan A, lemari es (20°C) perlakuan
B, dan kotak styrofoam (18°C) perlakuan C,
yang masing-masing perlakuan diulang tiga
kali. Waktu pengamatan dilakukan setiap enam
jam, mulai dari pengamatan jam ke-0 hingga
jam ke - 24 penyimpanan. Pejantan yang digunakan sebanyak tiga ekor. Parameter yang diamati meliputi karakteristik semen segar, viabilitas spermatozoa setelah pengenceran dan penyimpanan. Semua data dianalisis dengan analisis of variance (ANOVA) menggunakan program SAS dan bila terdapat perbedaan yang nyata (P < 0,05) atau sangat nyata (P < 0,01) dilanjutkan dengan uji Duncan (S TEEL dan T ORRIE , 1993).
HASIL DAN PEMBAHASAN Karakteristik semen segar
Hasil evaluasi semen segar merupakan pemeriksaan awal semen yang dijadikan dasar untuk menentukan kelayakan semen yang akan diproses lebih lanjut. Pemeriksaan semen dilakukan di laboratorium dengan temperatur ruang 20 – 22°C dan kelembaban 80 – 90%.
Semen yang diperoleh dari 9 kali penampungan mempunyai mutu yang cukup baik, bersifat voluminous dengan motilitas spermatozoa lebih dari 60% dan konsentrasi spermatozoa lebih dari 150 x 10
6sel/ml (Tabel 2).
Secara umum, karakteristik semen segar yang dihasilkan tidak berbeda jauh dengan hasil penelitian dari peneliti lainnya. R OBERT (2006) dan A X et al. (2000) menyatakan volume semen babi tanpa gelatin berkisar 200- 250 ml, dengan warna putih susu dan konsistensi encer, serta dengan pH rata-rata 7,40 ± 0,2 (G ADEA 2003). Beberapa faktor yang mempengaruhi volume, warna, konsistensi dan pH semen adalah variasi umur, tingkat
rangsangan, frekuensi ejakulasi, kualitas pakan, serta perbedaan buffer (J OHNSON et al., 2000), fraksi semen yang ditampung pra- spermatozoa atau kaya-spermatozoa (R OBERT , 2006).
Motilitas, konsentrasi, volume dan persentase abnormalitas spermatozoa berkaitan erat dengan kemampuan spermatozoa dalam fertilisasi, serta dapat menggambarkan tingkat pengenceran dan banyaknya betina yang dapat diinseminasi. Menurut B ONET et al. (1993);
G ARNER dan H AFEZ (2000); J OHNSON et al.
(2000); H IRAI et al. (2001); B ASSOL et al.
(2005) persentase abnormalitas spermatozoa babi per ejakulat tidak boleh lebih dari 20%.
Adapun faktor-faktor yang dapat mempengaruhi motilitas, konsentrasi dan abnormalitas spermatozoa yakni genetik, umur, cahaya dan temperatur, manajemen pemeliharaan, frekuensi penampungan dan pengenceran serta lingkungan (E VERETT dan B EANS 1982;
S HUKLA et al. 1992).
Viabilitas semen segar dalam penyimpanan 22°, 20° dan 18°C
Rataan persentase motilitas dan spermatozoa hidup semen segar masing- masing mencapai 65,56 ± 2,55%, dan 87,76 ± 2,87%. Viabilitas semen segar dalam penyimpanan ruang terbuka (22°C), lemari es (20°C) dan kotak styrofoam (18°C) dalam penelitian ini menunjukkan hasil yang berbeda nyata (P < 0,05) antar perlakuan (Tabel 3).
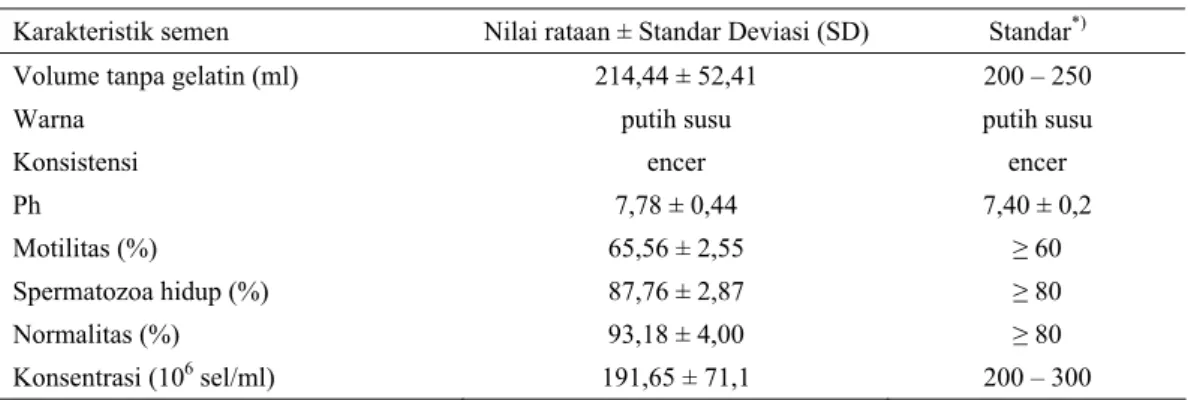
Tabel 2. Nilai karakteristik semen segar babi
Karakteristik semen Nilai rataan ± Standar Deviasi (SD) Standar
*)Volume tanpa gelatin (ml) 214,44 ± 52,41 200 – 250
Warna putih susu putih susu
Konsistensi encer encer
Ph 7,78 ± 0,44 7,40 ± 0,2
Motilitas (%) 65,56 ± 2,55 ≥ 60
Spermatozoa hidup (%) 87,76 ± 2,87 ≥ 80
Normalitas (%) 93,18 ± 4,00 ≥ 80
Konsentrasi (10
6sel/ml) 191,65 ± 71,1 200 – 300
*)