KALUS
Phaleria macrocarpa
(Scheff.) Boerl.
)
Effect of the conbonation of plant growth regulator (2,4d and kinetine) on the
growth and secondary metabolite content of Phaleria macrocarpa
(Scheff.)
Boerl.
callus
Dewi Sartika dan Djoko Santosa Fakultas Farmasi Universitas Gadjah Mada
Jl. Sekip Utara Yogyakarta 55281 e-mail:santosadjoko5346@yahoo.co.id
ABSTRAK
Mahkota dewa (Phaleria macrocarpa (Scheff.) Boerl.) merupakan tumbuhan anggota Thymelaeaceae, berasal dari Papua yang digunakan sebagai tanaman obat. Penelitian ini bertujuan untuk mengetahui pengaruh
kombinasi 2,4 D dan kinetin terhadap pertumbuhan kalus daun dan profil metabolit sekundernya berdasarkan metode kromatografi lapis tipis (KLT). Sterilisasi eksplan daun mahkota dewa menggunakan larutan NaOCl 10 % v/v. Eksplan diinokulasi dalam media Murashige-Skoog (MS) padat yang ditambahkan 2,4D 2ppm
untuk menghasilkan kalus. Selanjutnya kalus disubkultur pada media MS padat yang telah ditambahkan 2,4 D-kinetin dengan perbandingan 1:1, 1:2 dan 2:1. Panen kalus dilakukan pada usia 5 minggu. Kalus dimaserasi dengan metanol p.a dan kloroform p.a, kemudian dianalisis dengan KLT menggunakan fase diam silika gel GF254 dan fase gerak berupa campuran n-heksan:etil asetat (3:1v/v). Sebagai pembanding digunakan ekstrak metanolik dan kloroformik daun mahkota dewa. Bercak pada pelat KLT dideteksi dengan lampu UV 254 dan 366 nm serta pereaksi anisaldehid asam sulfat. Hasil penelitian menunjukkan rata-rata bobot kalus basah tertinggi pada perlakuan D3, yaitu 1,2163 gram dan rata-rata bobot kalus kering tertinggi pada perlakuan D2,
yaitu 0,04686 gram, sedangkan profil kromatogram pada ekstrak kloroformik dan metanolik untuk semua perlakuan menghasilkan fluoresensi biru di bawah sinar UV 366 pada hRf 60.
Kata kunci: mahkota dewa, 2,4 D dan kinetin, kalus daun, KLT
ABSTRACT
leaf callus growth and secondary metabolite profiles by thin-layer chromatography (TLC) method. Sterilization of leaf explants using 10% v / v NaOCl solution. Explants were inoculated in Murashige-Skoog medium (MS)
added 2.4 D solid 2 ppm to produce callus. Furthermore callus will subcultured on solid MS medium added 2.4 D:kinetin with the ratio of 1:1, 1:2 and 2:1 . Callus were harvested at 5 weeks since subculture. Callus macerated with methanol and chloroform pa, and then analyzed by TLC using silica gel GF254 as stationary phase and mobile
phase a mixture of n-hexane: ethyl acetate (3:1 v / v). For comparison used methanol and cloroform extracts
of mahkota dewa. Spot detection using uv light of 254 and 366 nm as well as sulfuric acid reagent anisaldehid. The results showed an average wet weight of callus was highest in D3 treatment, ie 1.2163 gram and average
dry weight of callus was highest in treatments D2, ie 0.04686 gram. while the extract chromatogram profile kloroformik and metanolik for all treatments produce fluorescence blue under UV light at 366 HRF 60.
Key words: mahkota dewa, 2,4 D and kinetin, callus leaves, TLC
PENDAHULUAN
Salah satu tanaman obat tradisional di Indonesia yaitu mahkota dewa atau yang lebih dikenal dengan nama ilmiah Phaleria macrocarpa
(Scheff.) Boerl. dibudidayakan sebagai tanaman hias dan juga sebagai tanaman peneduh, tetapi belakangan ini dimanfaatkan sebagai tanaman obat tradisional yang dikenal merupakan obat asli Indonesia. Beberapa hasil penelitian yang telah dilakukan terhadap mahkota dewa menunjukkan kandungan kimia pada bagian buah dan kulit daging buah mengandung alkaloid, terpenoid,
saponin dan flavonoid, sedangkan pada daunnya
ditemukan senyawa polifenol (Gangga dkk., 2007).
Mahkota dewa mengandung
senyawa-senyawa alkaloid, saponin, flavonoid, resin,
tannin dan sebagainya yang berkhasiat sebagai
antihistamin, antioksidan, obat asam urat, liver,
rematik, kencing manis, ginjal, tekanan darah tinggi sampai kanker. Saponin merupakan fitonutrien yang bersifat antibakteri dan
antivirus. Hasil penelitian praklinis menunjukkan
bahwa mahkota dewa dapat digunakan untuk pengobatan tumor dan penyakit kulit
(Simanjuntak, 2008).
Berdasarkan kandungan kimia diatas terjadi permintaan yang semakin tinggi maka dikhawatirkan kelestarian dari tanaman ini akan terancam. Diperlukan budidaya kultur jaringan (in vitro) untuk mengatasi permintaan yang semakin tinggi agar kelestarian tanaman ini tetap terjaga. Kultur jaringan tanaman merupakan teknik menumbuhkembangkan bagian tanaman, baik berupa sel, jaringan, atau organ dalam kondisi kultur yang aseptik secara
in vitro (Yusnita, 2004). Salah satu keunggulan kultur jaringan tanaman adalah menghasilkan jumlah bibit yang banyak dalam waktu relatif singkat. Selain itu kultur jaringan juga dapat mempertahankan sifat induk yang unggul dan dapat menghasilkan bibit yang bebas cendawan,
bakteri, virus dan hama penyakit (Prihandana &
Hendroko, 2006).
sebagai bahan tanam, penggunaan medium yang cocok, keadaan yang aseptik, dan pengaturan udara yang baik (Hendaryono & Wijayani, 1994). Salah satu faktor keberhasilan kultur jaringan tanaman adalah penggunaan media. Media untuk jenis teknik in vitro ini pada umumnya terdiri
atas komponen makro, mikro, zat besi, vitamin
dan zat pengatur tumbuh dengan komposisi yang telah disesuaikan dengan kebutuhan tanaman (Santosa & Nursandi, 2002).
Salah satu jenis media yang sering digunakan adalah media Murashige Skoog (MS), karena mudah dan relatif murah. Zat pengaruh tumbuh (ZPT) pada tanaman adalah senyawa organik yang dalam jumlah sedikit dapat mendukung, menghambat dan dapat merubah proses fisiologi tanaman. Jenis ZPT
yang biasa digunakan dalam kultur jaringan tanaman adalah sitokinin dan auksin. Fungsi auksin yaitu dapat menginduksi terjadinya kalus, sementara sitokinin berfungsi untuk memacu pembentangan sel, pembesaran dan pembelahan sel. Golongan auksin yang sering digunakan antara lain 2,4 D sedangkan golongan sitokinin yang sering digunakan adalah kinetin. Jika kombinasi ke dua ZPT ini digunakan bersamaan, diharapkan dapat memberikan hasil pertumbuhnan kalus yang cepat dan jumlah yang besar (Dodds & Robert, 1982). Dari penelitian
ini diharapkan dapat diketahui pengaruh variasi
2,4 D-kinetin terhadap pertumbuhan kalus dan membandingkan profil metabolit sekunder kalus daun dengan tanaman induknya.
Tabel I. Penelitian mengenai kultur in vitro mahkota dewa.
No Jenis Hasil penelitian Pustaka
1. Kalus Phaleria macrocarpa
Kombinasi konsentrasi ZPT 2,4-D dan BA mampu menginduksi
terbentuknya kalus. Pada eksplan daun yaitu 2.5 mg/l 2,4-D + 0.5 mg/l BA dan 5.0 mg/l 2,4-D + 0.5 mg/l BA sedangkan pada eksplan biji yaitu 10.0 mg/l 2,4-D + 5.0 mg/l BA.
Kombinasi konsentrasi NAA dan BA dapat juga menginduksi terbentuknya kalus. Pada eksplandaun yaitu 20.0 mg/l NAA tanpa
BA dan 20.0 mg/l NAA + 0.5 mg/l BA sedangkan pada eksplan biji yaitu 20.0 mg/l NAA + 0.5 mg/l BA dan 20.0 mg/l NAA + 1.0 mg/l
BA.
M e n t a r y, 2006
METODE PENELITIAN Bahan
Bahan utama yang dipakai adalah tanaman mahkota dewa diambil dari Kebun TOGA Bagian Biologi Fakultas Farmasi UGM. Bagian tanaman yang digunakan adalah daun pada urutan ke 2-3 dari ujung tanaman daun mahkota dewa. Sampel tanaman telah diidentifikasi dan
disimpan sebagai voucher sample penelitian
No. 089/2011 di Laboratorium Farmakognosi
Fakultas Farmasi UGM. Bahan-bahan lain adalah untuk pembuatan media MS padat, bahan kimia berderajat pro analysis untuk ekstraksi kalus daun dan kromatografi lapis tipis (KLT).
Alat
ini antara lain peralatan yang terbuat dari gelas untuk pengerjaan kultur kalus, peralatan untuk ekstraksi kalus daun dan seperangkat alat untuk analisis metabolit sekunder dengan metode KLT.
Cara Kerja
Kultur Kalus Daun Mahkota Dewa
Daun mahkota dewa dipotong-potong menjadi bagian yang lebih kecil. Selanjutnya dicuci dengan air mengalir selama 15 menit. Eksplan kemudian disterilkan dalam larutan natrium hipoklorit (Bayclin®) selama 25 menit. Dibilas sebanyak 3 kali dengan akuades steril 3, 5 dan 7 menit untuk menghilangkan sisa sterilan. Potongan eksplan yang telah steril ditanam di dalam botol kultur yang berisi media MS padat dengan zat pengatur tumbuh 2,4 D 2 ppm. Hasil kultur diinkubasi pada suhu 25 °C tanpa disinari lampu. Selanjutnya kalus disubkultur pada media MS padat dengan 3 kombinasi perlakuan 2,4 D-kinetin, yaitu (1:1, 1:2 dan 2:1). Pemanenan dilakukan hingga kalus berumur 5 minggu. Masing-masing kalus basah daun mahkota dewa
dikeringkan menggunakan oven 50oC sampai kalus kering mencapai bobot tetap, yaitu selisih penimbangan bobot tidak lebih dari 0,25%. Kemudian kalus kering digerus dalam mortir hingga diperoleh serbuk kalus yang cukup halus.
Analisis Kualitatif dengan Kromatografi Lapis Tipis
Kalus dimaserasi dengan metanol p.a dan kloroform p.a, kemudian dianalisis dengan KLT menggunakan fase diam silika gel GF254 dan fase gerak berupa campuran n-heksan:etil asetat (3:1
v/v). Sebagai pembanding digunakan ekstrak
metanolik dan kloroformik daun mahkota dewa. Bercak pada pelat KLT dideteksi dengan lampu UV 254 dan 366 nm serta pereaksi penampak bercak anisaldehid asam sulfat.
Analisis Data
Data yang diharapkan berupa bobot basah dan bobot kering serta profil kromatogram kultur kalus daun dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Keberhasilan Sterilisasi Eksplan
Persentase keberhasilan sterilisasi eksplan ditentukan oleh jenis sterilan dan waktu sterilisasi serta perlakuan prasterilisasi. Tahap prasterilisasi dilakukan dengan mencuci bersih eksplan daun, perendaman dalam sabun cair dan pembilasan dengan air suling. Sterilisasi eksplan daun dilakukan dengan menggunakan natrium hipoklorit (Bayclin).
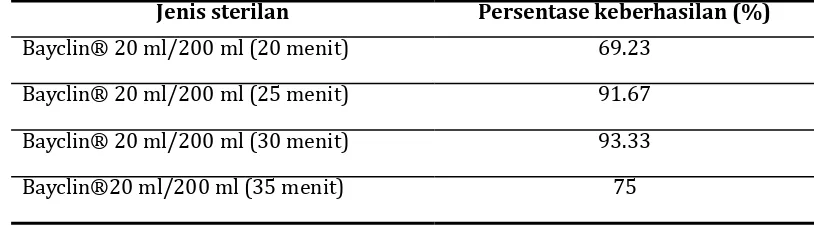
Tabel 2. Persentase keberhasilan sterilisasi eksplan daun mahkota dewa
Jenis sterilan Persentase keberhasilan (%) Bayclin® 20 ml/200 ml (20 menit) 69.23
Bayclin® 20 ml/200 ml (25 menit) 91.67
Bayclin® 20 ml/200 ml (30 menit) 93.33
Berdasarkan tabel di atas dapat dilihat bahwa sterilisasi yang digunakan dari empat kali penanaman menggunakan Bayclin® 20 ml dalam 200 ml, yang membedakan adalah waktu sterilisasi tiap penanaman. Dari empat kali penanaman terlihat bahwa waktu 30 menit adalah waktu yang efektif dalam menanam eksplan (tingkat keberhasilan 93,33%). Dalam penelitian ini, waktu sterilisasi eksplan lebih cepat menunjukkan persentase keberhasilan terkecil sedangkan jika waktunya lebih di perpanjang hasilnya pun tidak jauh berbeda dengan waktu yang lebih cepat. Hal ini menunjukkan bahwa lama tidaknya waktu sterilisasi tidak menjamin keberhasilan dalam steriliasasi eksplan. Faktor dari kondisi eksplan (seperti kemampuan melindungi diri, ukuran eksplan, umur, fase
fisiologis jaringan yang digunakan) juga berpengaruh dalam proses sterilisasi eksplan (Nugrahani dkk., 2011).
Inisiasi kalus
Keberhasilan inokulasi eksplan adalah ditunjukkan dengan respon positif (Gambar 1) eksplan terhadap media sampai mulai munculnya benjolan-benjolan kecil di sekitar eksplan atau yang dikenal dengan inisiasi kalus (Gambar 2). Parameter inisiasi kalus adalah jumlah hari mulai munculnya benjolan di sekitar eksplan yang dihitung sejak inokulasi eksplan. Kecepatan inisiasi kalus tiap eksplan berbeda-beda karena kecepatan pembelahan sel tiap eksplan pun berbeda. Munculnya kalus merupakan reaksi penutupan jaringan akibat adanya luka pada jaringan tersebut
Gambar 1. Respon positif eksplan daun makota dewa terhadap media MS
Gambar 2. Inisiasi kalus daun mahkota
dewa
Respon positif eksplan terlihat dengan menggulungnya bagian-bagian tertentu dari eksplan daun. Adanya respon positif eksplan terhadap media merupakan titik awal keberhasilan pembentukan kalus. Sedangkan inisiasi pembentukan kalus ditandai dengan timbulnya tonjolan berupa titik putih pada irisan eksplan yang diamati dari hari pertama
penanaman eksplan. Dari hasil penelitian ini diperoleh waktu inisiasi kalus adalah 14 hari.
zat pengatur tumbuh sintetik untuk kedua golongan hormon tersebut, berupa 2,4 D dan kinetin dapat memacu pertumbuhan, yaitu dengan munculnya kalus. Pada kadar yang rendah, kalus daun mahkota dewa muncul pada umur 14-17 hari. Jika penambahan 2,4 D dan kinetin berlebihan justru akan menghambat kecepatan pembentukan kalus.
Kuantifikasi kalus
Suatu pertumbuhan dapat diamati
dengan mengukur perbesaran volume (ukuran
sel) dan mengukur pertambahan bobot.
Perbesaran volume (ukuran sel) kalus dapat
diamati berdasarkan pengamatan ukuran kalus yang bertambah besar sedangkan pertambahan bobot kalus tersebut dapat diketahui dengan mengukur bobot kering dan bobot basahnya (Salisbury & Ross, 1992).
Bobot basah kalus diperoleh dengan cara menimbang kalus awal perlakuan dan akhir perlakuan. Bobot basah digunakan untuk mengukur pertumbuhan kalus namun kurang bisa dijadikan standar karena bobot basah dipengaruhi oleh status air yang berada dalam sel, metabolisme tanaman dan kondisi kelembaban tanaman (Sitompul & Guritno, 1995).
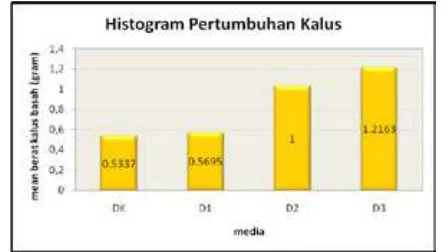
Gambar 3. Pertumbuhan kalus berdasarkan mean
berat basah kalus daun mahkota dewa
Keterangan :
DK : tanpa zat pengatur tumbuh 2,4 D dan kinetin,
D1 : 2,4 D dan kinetin (1:1)
D2 : 2,4 D dan kinetin (1:2)
D3 : 2,4 D dan kinetin (2:1)
Pertumbuhan dicirikan dengan bertambahnya berat yang irreversible, sehingga pengukuran bobot basah kalus dapat mewakili parameter pertumbuhan kalus yang berasal dari eksplan daun mahkota dewa. Gambar 3 menunjukkan bobot basah yang terendah pada perlakuan media DK. Hal ini menunjukkan bahwa tanpa penambahan zat pengatur tumbuh eksplan mampu membentuk kalus meskipun lambat pertumbuhannya. Di dalam jaringan yang dikulturkan masih tersimpan auksin endogen yang cukup untuk membentuk kalus.
Bobot basah yang tertinggi pada perlakuan D3 (2:1). Dari hasil penelitian ini, terlihat bahwa semakin tinggi konsentrasi 2,4 D yang digunakan maka semakin meningkat bobot basah kalus. Hal ini disebabkan karena kandungan airnya yang tinggi.Pengaruh auksin terhadap pertumbuhan
jaringan diduga menginduksi sekresi ion H+
keluar melalui dinding sel. Pengasaman dinding sel menyebabkan K+ diambil, pengambilan ini mengurangi potensial air dalam sel, akibatnya air mudah masuk ke dalam sel dan sel akan membesar (Harjoko, 1999; Maftuchah dkk., 1998). Penambahan auksin (2,4D) yang efektif dapat memacu pembentukan kalus karena
efektivitasnya yang kuat untuk memacu proses
penambahan sitokinin (kinetin) pada media akan menaikkan proliferasi kalus. Perbedaaan tinggi rendahnya bobot basah kalus pada tiap perlakuan diduga disebabkan oleh kemampuan jaringan dalam menyimpan air dan unsur hara yang berbeda-beda. Menurut Sriyanti (2000), berat basah kalus juga dipengaruhi oleh kemampuan sel dalam mengadakan proses difusi, osmosis dan tekanan turgor sel.
Bobot kering merupakan parameter pertumbuhan yang dapat digunakan sebagai ukuran pertumbuhan tanaman dengan segala peristiwa yang dialaminya. Menurut Sitompul dan Guritno (1995) bahan kering merupakan manifestasi dari semua proses dan peristiwa yang terjadi dalam pertumbuhan tanaman. Bobot kering kalus didapatkan dengan proses
pengurangan kadar air dan penghentian aktivitas
metabolisme hingga mencapai berat konstan.
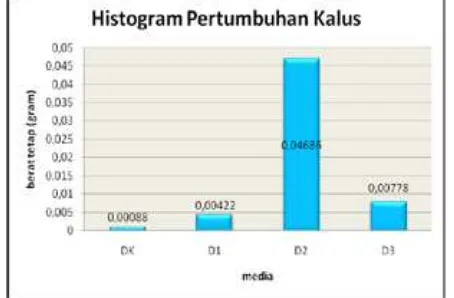
Gambar 4. Pertumbuhan kalus berdasarkan berat
kering kalus daun mahkota dewa
Berdasarkan Gambar 4 terlihat bahwa pemberian 2,4 D dan kinetin secara kombinasi memberikan pengaruh terhadap bobot yang berbeda jika dibandingkan pada media DK. Bobot tetap terendah pada media DK sedangkan
bobot kering tertinggi pada media D2. 2,4-D merupakan salah satu auksin yang berperan dalam pertumbuhan kalus dari eksplan dan menghambat regenerasi pucuk tanaman. Sedangkan kinetin adalah salah satu sitokinin yang berperan untuk pembelahan sel dalam kultur jaringan tanaman. Perbandingan auksin dan sitokinin yang seimbang pada eksplan dapat menghasilkan pertumbuhan kalus. Menurut Gustian (2009), pembentukan kalus dapat distimulasi oleh penambahan auksin pada konsentrasi rendah. Sedangkan jika penambahan auksin pada konsentrasi tinggi maka cenderung menghambat daripada merangsang pertumbuhan (Hendaryono & Wijayani, 1994).
Profil Metabolit Sekunder
Analisis kandungan kimia kalus daun
mahkota dewa dilakukan dengan metode kromatografi lapis tipis (KLT). Analisis
kandungan kimia di dalam kalus daun mahkota dewa dilakukan secara kualitatif. Kromatogram
ekstrak kloroform dan ekstrak metanol sel-sel kalus daun mahkota dewa dibandingkan dengan
ekstrak kloroform dan metanol daun mahkota dewa.
Fase diam yang digunakan dalam analisis kandungan kimia dengan KLT adalah silika
gel GF254. Fase gerak yang digunakan adalah campuran n-heksan-etilasetat (3:1) dengan jarak
pengembangan 8 cm. Deteksi untuk hasil elusi dilakukan melalui sinar UV 254 nm dan 366 nm
serta pereaksi penampak bercak anisaldehid. Keragaman metabolit pada kalus daun
mahkota dewa merupakan hasil ekspresi genetik dari sel-sel kalus, demikian pula
keragaman metabolit di dalam daun mahkota dewa juga merupakan ekspresi genetik sel-sel
di dalam daun mahkota dewa. Perbandingan profil kromatogram pada kedua jenis ekstrak
baik kalus maupun daun mahkota dewa akan dapat mengetahui besarnya kesamaan
metabolit yang dikandungnya. Kesamaan metabolit yang dikandung ataupun kesamaan profil kromatogram menunjukkan sifat lestari
perlakuan terhadap sel-sel kalus daun mahkota dewa terhadap sifat asli tumbuhan mahkota
dewa.
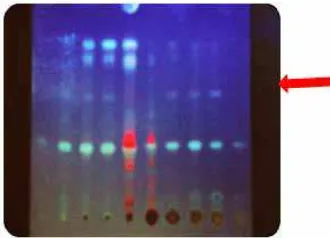
Gambar 5. Kromatogram kalus 5 minggu setelah disemprot dengan pereaksi anisaldehid asam sulfat
Gambar 6. Kromatogram kalus 5 minggu pada uv 366
nm setelah disemprot dengan pereaksi anisaldehid asam sulfa
Profil kromatogram kalus daun mahkota dewa umur 5 minggu terlihat bahwa perlakuan kombinasi zat pengatur tumbuh 2,4 D dan kinetin berbagai kombinasi menghasilkan bercak berwarna ungu setelah disemprot anisaldehid pada hRf 60. Hal ini tidak dijumpai pada ekstrak kloroformik dan metanolik daun mahkota dewa sebagai pembanding. Bercak tersebut pada UV 366 nm memberikan fluorosensi biru.
Menurut Wagner (1984), pereaksi vanilin asam
nm. Bercak pada hRf 60 menunjukkan ciri-ciri golongan senyawa terpenoid karena setelah disemprot dengan anisaldehid bercak berwarna kebiruan.
Bercak lain yang terlihat adalah pada
hRf 33,75 dari ekstrak kloroformik kalus daun pada semua perlakuan dan ekstrak kloroformik
daun mahkota dewa. Sedangkan pada hRf 35
dari ekstrak metanolik kalus daun pada semua perlakuan dan ekstrak metanolik daun mahkota dewa. Warna bercak pada hRf 33,75 dan hRf 35 adalah fluoresensi hijau. Perbedaan jarak hRf pada ekstrak kloroformik dan metanolik merupakan tingkat kepolaran yang berbeda tetapi dengan warna bercak yang sama menunjukkan bahwa ekstrak kloroformik dan ekstrak metanolik kalus daun merupakan golongan senyawa yang sama.
Ekstrak kloroformik kalus daun menghasilkan bercak pada pada hRf 83,75 dan 87,5. Sedangkan pada ekstrak metanolik kalus daun juga dijumpai bercak yang sama pada hRf
83,75 dan 87,5 meskipun tidak begitu jelas yang diduga masih merupakan hasil antara metabolit sekunder, karena diferensiasi kalus yang belum sempurna.
KESIMPULAN
1. Kombinasi 2,4 D-kinetin berpengaruh pada bobot basah dan bobot kering dalam kultur kalus daun mahkota dewa. Bobot basah tertingi pada perlakuan D3, sedangkan bobot kering tertinggi pada perlakuan media D2. 2. Terdapat bercak dengan hRf 60 pada kalus
daun mahkota dewa yang tidak terdapat pada ekstrak daun mahkota dewa. Diduga bercak tersebut adalah golongan senyawa terpenoid.
UCAPAN TERIMA KASIH
Penelitian ini didanai oleh Fakultas Farmasi UGM melalui Hibah Kompetitif Penelitian Berkualitas Prima Kategori Madya Tahun 2011. Oleh sebab itu kami mengucapkan terima kasih atas bantuan dana tersebut.
DAFTAR PUSTAKA
Dodds JH. & Roberts LW. 1982. Experiments in Plant Tissue Culture, 1st Ed., 23-30
Cambridge University Press, USA
Gangga E., Hernika A., & Linda N. 2007. Analisis Pendahuluan Metabolit Sekunder dari Kalus Mahkota Dewa (Phaleria macrocarpa
(Scheff.) Boerl.), Jurnal Ilmu Kefarmasian Indonesia, Vol.5 (1), 7-22.
Gardner FP., Pearce RB., dan Mitchell RI.
1991. Fisiologi Tanaman Budidaya.
(diterjemahkan oleh Herawati Susilo). UI Press. Jakarta.
Gati E. & Mariska I. 1992. Pengaruh Auksin dan Sitokinin Terhadap Kalus Mentha piperita Linn. Buletin Littri 3 : 1-4
George, EF. 2008. Plant Propagation by Tissue Culture, 3rd Ed., Exegetics Limitied.
Gustian. 2009. Upaya Perbanyakan Tanaman Penghasil Gaharu (Aquilaria malaccensis
Lamk.) secara In Vitro. Working Paper.
Universitas Andalas. Padang.
Harjadi, SS. 1993. Pengantar Agronomi. P.T. Gramedia. Jakarta.
Harjoko, D. 1999. Pengaruh Macam-Macam Auksin terhapad Poliploidisasi kalusTanaman Semangka pada kultur in Vitro, Fakultas Pertanian UNS.
Kultur Jaringan. Edisi II, Kanisius. Yogyakarta. 17-20, 90-94.
Hopkins, WG. 1999. Introduction to Plant
Physiology. John Wiley and Sonc, Inc. New York.
Maftuchah, Ardiana HK. & Joko BS. 1998. Induksi kalus Artemisia (Artemisia vulgaris L.) melalui kultur in vitro. Tropika, 6(2): 135-141.
Mentary M. 2006. Induksi Kalus dan Tunas secara in vitro Tanaman Mahkota Dewa dengan Manipulasi Zat Pengatur Tumbuh dan Eksplan. Tesis. Institut Pertanian Bogor Nugrahani P., Sukendah & Makziah. 2011.
Teknik Propagasi Secara In Vitro. Fakultas
Pertanian, Universitas Pembangunan
Nasional Veteran, Jawa Timur.
Prihandana R. & Hendroko P. 2006. Petunjuk Budidaya Jarak Pagar. Agromedia Pustaka. Jakarta.
Salisbury FB., & Ross CW. 1992. Plant Physiology,
4th Ed., California. Wadsworth Publ.Co. Santosa, U. & Nursandi, F. 2002. Kultur Jaringan
Tanaman, Universitas Muhammadiyah
Malang, Malang
Simanjuntak, Partomuan. 2008. Identifikasi Senyawa Kimia dalam Buah Mahkota Dewa (Phaleria macrocarpa (Scheff.) Boerl.),
Jurnal Ilmu Kefarmasian Indonesia, 6(1), 23-28.
Sitompul, S.M. dan Guritno B. 1995. Analisisis
Pertumbuhan Tanaman. Gadjah Mada
University Press. Yogyakarta.
Sriyanti, D.P. 2000. Pelestarian tanaman Nilam
(Pogostemon heyneanus Benth.) Melalui
Kultur Mikrorestek, Biosmart 2 (2): 19-22
Wagner, H., Bladt S., & Zganski E.M. 1984. Plant Drud Analysis, A Thin LayerChromatography Atlas, Translated by Th. A. Scott, Springer, Verlag Heidelberg, New York.
Yusnita. 2004. Kultur Jaringan. Cara
Memperbanyak Tanaman Secara Efisisen.