Pembuatan dan Reaksi
Senyawa Kompleks
Di susun oleh :
Rengganis Ayu
4311410004
Ahmad Sanusi
4311410006
Zukhrufa Isna
4311410026
Fannny Monica H.B
4311410022
Ana Yustika
43114100
Senyawa Kompleks
Jenis-Jenis Senyawa Kompleks
●
Kompleks Werner
Kompleks yang tidak berisi ikatan
logam-karbon dan kompleks siania
●
Kompleks Logam Karbonil
Isolasi Kompleks
Teknik isolasi Senyawa Kompleks
●
Penguapan pelarut dan pendinginan
●
Penambahan pelarut yang bercampur
dengan larutan semula
1. Kompleks Werner
a.
Reaksi Subtitusi dalam Larutan Air
Reaksi terjadi antara larutan garam laogam di
dalam air dengan pereaksi koordinasi
[Cu(OH
2)
4]SO
4+ NH
3→ [Cu(NH
3)
4]SO
4+ 4H
2O
Biru Tua
+ C
2H
5OH
Kompleks Werner
Kompleks Werner
b.
Reaksi Subtitusi dalam Larutan Bukan
Air
Penggunaan pelarut bukan air hanya
dilakukan bila:
●
Ion logam yang mempunyai afnitas
besar terhadap air
Kompleks Werner
Ion-on Al
3+, Fe
3+, dan Cr
3+mempunyai afnitas
tinggi terhadap air dan membentuk ikatan
logam-oksigen yang kuat.
c. Reaksi Substitusi Tanpa
Pelarut
•
Merupakan reaksi antara garam
anhidrous dan suatu ligan cair.
•
Biasanya dipakai untuk membuat
kompleks logam.
•
Jika ligan cair yang ditambahkan
d. Disosiasi Kompleks Thermal
Padat
•
Merupakan reaksi substitusi dalam
kondisi atau keadaan padat.
•
Contoh :
Pada pemanasan [Rh(NH
3)
5OH
2]I
3H
2O akan digantikan oleh I
[Rh(NH
3)
5OH
2]I
3 100o[Rh(NH
3)
5I]I
2+H
2O
(g)e. REAKSI OKSIDASI -
REDUKSI
•
Senyawa – senyawa kobal (III) kompleks
selalu dibuat dari garam kobal (II). Reaksi
kobal (II) dengan ligand cepat dan
kemudian dapat dibuat kobal (III) kompleks
dengan oksidasi. Pembentukan kompleks
[Co(NH
3)
6]Cl
3terjadi secara bertahap.
•
[Co(OH
2)
6]Cl
2+ 6NH
3[Co(NH
3)
6]Cl
2+
H
2O
•
Pembuatan kompleks dengan reduksi
ion pusat jarang dilakukan karena hasil
oksidasinya tidak stabil.
•
K
2[Ni(CN)
4] + 2K NH
3K
4[Ni(CN)
4]
kuning cair
•
Fe(CO)
5+ 4KOH
K
2[Fe(CO)
4] +
K
2CO
3+ 2H
2O
f. Reaksi Katalitis
•
Reaksi – reaksi yang berjalan lambat
dapat dipercepat dengan menaikkan
temperatur. Reaksi ini dapat dipercepat
dengan penambahan katalisator.
•
Ada 2 jenis katalisator yaitu katalisator
homogen dan heterogen
•
Katalisator homogen yaitu bila katalisator
itu membentuk satu fase dengan
pereaksi. Katalisator heterogen bila
Penggunaan katalisator
heterogen
•
Pembuatan kompleks heksaaquokobal (III)
klorida
[Co (OH
2)
6] Cl
2NH
3, H
2O, O
2, HCl [Co
(NH
3)
5Cl]Cl
2pink
NH
4Cl
ungu
[Co (OH
2)
6] Cl
2NH
3, H
2O, O
2, HCl [Co
(NH
3)
6]Cl
3Penggunaan katalis
homogen
•
Pembentukan kompleks-kompleks Pt (IV)
dengan katalisator Pt (II)
Trans- [Pt (NH
3)
4Cl
2]
2++ 2 Br
-[Pt (NH
3)
4]
2+Trans - [Pt (NH
3)
4(Br)
2]
2++ 2Cl
-Trans- [Pt (NH
3)
4Cl
2]
2++ 2 SCN
-[Pt (NH
3)
4]
2+-g. Reaksi substitusi tanpa
pemecahan ikatan logam
ligand
•
Pembentukan beberapa kompleks dapat terjadi
tanpa pemutusan ikatan logam-ligand, misalnya :
[(NH
3)
5Co – O – CO
2]
++2H
+[(NH
3)
5Co – OH
2]
3++CO
2Hal ini dapat dibuktikan dengan memakai air berisi
H
2O
18. Ternyata kompleks tsb tidak berisi O
18,
Reaksi tanpa pemutusan
ikatan Co – O
[(NH
3)
5Co-OH] + N
2O
3[(NH
3)
5Co-ONO]
2++
HNO
2Hal ini dibuktikan apabila kompleks di tabel
dengan O
18maka kompleks yang terjadi berisi
99,4% O
18[(NH
3)
5Co-O
18H] + N
2O
3[(NH
3)
5Co-O
18NO]
2++
h. EFEK TRANS
Ligan –ligan yang menyebabkan gugus yang letaknya trans
terhadapnya bersifat labil, dikatakan mempunyai efek trans yang kuat
Contoh :
Urutan efek trans berdasarkan hasil penyelidikan :
CN- ~ CO ~ C2H4 > PH3 ~ SH2 > NO2- > I- > Br- > Cl- >
NH3 ~ py > OH- > H2O
Selain efek trans, stabilitas ikatan logam-ligan juga
megang peran penting dalam reaksi
i. PEMBUATAN ISOMER CIS-TRANS
Pada pembuatan senyawa-senyawa cis-trans, dapat
bentuk :
- Campuran isomer cis dan trans. Contoh : kompleks kobalt (III)
- Hanya satu hasil isomer. Contoh : kompleks platina (II)
Pemisahan isomer-isomer cis dan trans dalam campuran :
- Kristalisasi bertingkat - Kromatografi penukar ion
Menetapkan suatu isomer berbentuk cis atau trans :
- Reaksi kimia
- Menentukan sifat optis aktif dari isomer [M(AA)2X2]
- Difraksi sinar X, spektroskopi, pengukuran momen dipole
j.
Pembuatan Senyawa-Senyawa
Optis Aktif
• Banyak molekul-molekul optis aktif terdapat pada
tanam-tanaman dan hewan. Pada pembuatan
senyawa kompleks yang optis aktif, selalu terjadi campuran rasemis, hingga diperoleh zat yang
tidak optis aktif. Untuk mendapatkan zat yang optis aktif, langkah utama ialah memisahkan isomernya dari campuran rasemis yang terjadi.
• Pemisahan atau resolusi campuran rasemis
biasanya dilakukan dengan menambah zat lain yang optis aktif, hingga terbentuk zat baru yang mempunyai sifat-sifat berbeda, yang dapat
dipisahkan dengan cara tertentu, misalnya dengan jalan kristalisasi. Campuran rasemis,
2. Kompleks Metal Karbonil dan
Organometalik
• Senyawa golongan ini yang pertama dikenal adalah biru
prusia: Fe[Fe2(CN)6]3. Senyawa karbonil NI(CO)4 dan
Fe(CO)5 dibuat oleh Mond (Prancis)pada tahun 1890.
• Yang trmasuk senyawa-senyawa golongan ini adalah:
a. Senyawa-senyawa berisi alkil seperti: [(CO)5MnCH3]
b. Senyawa-senyawa berisi aril seperti: [P{(C2H5)3}2Pt(C6H5)2]
c. Senyawa-senyawa berisi ikatan antara logam karbon d. Senyawa-senyawa olefn
• Logam dalam senyawa ini biasanya mempunyai bilangan
a. Pembuatan Metal Karbonil
•
Mond mula-mula membuat zat ini
• Dari nomor atom efektif dapat dijelaskan bahwa: a. Atom- atom dengan nomor atom genap
membentuk karbonil-karbonil monomer seperti : Cr(CO)6; Fe(CO)5 dan Ni(CO)4.
b.Atom- atom dengan nomor atom ganjil
membentuk karbonil-karbonil dimer, seperti: Mn2(CO)10 dan
Co2(CO)8
• V(CO)6 adalah satu
-satunya kompleks karbonil monomer
yang tidak memenuhi nomor atom efektif. zat ini dibuat pada tahun 1959, berupa zat hitam,
paramagnetik dan terurai pada 700C.
Pada reduksi dengan Na terbentuk V(CO)6
•
Logam karbomil biasanya dibuat dengan
reduksi garamnya dengan adanya CO
pada tekanan tinggi. Beberapa reduktor
telah didapatkan untuk maksud ini.
•
Reduktor lain yang aktif, misalnya Al dan
garam-garam organik dari logam aktif,
seperti C
2H
5MgBr dan C
5H
5αiFe(CO)
5b. Pembuatan senyawa Logam
olefn
Pada tahun 1827 W.C Zeise, ahli farmasi dari Spanyol mendapatkan bahwa reaksi C2H4 dengan [PtCl4]2 dalam Cl menghasilkan senyawa yang berisi platina dan etilen dengan rumus :
•
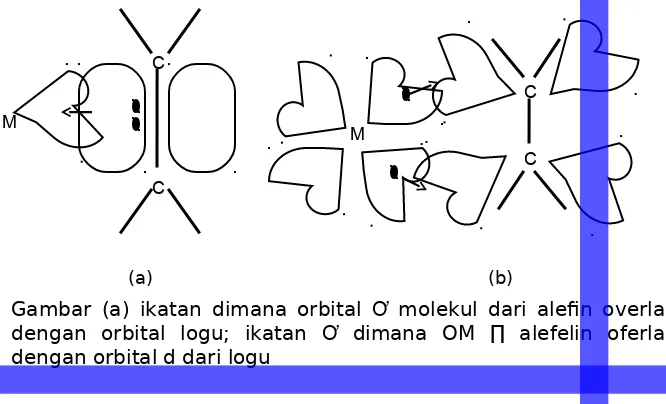
(a) (b)• Gambar (a) ikatan dimana orbital Ơ molekul dari alefn overlap
dengan orbital logu; ikatan Ơ dimana OM ∏ alefelin oferlap
dengan orbital d dari logu
M
C C
M
C
c. Pembuatan Senyawa
Senwich
Sejak tahun 1950 telah banyak di buat senyawa-senyawa logam transisi dimana atom logam terdapat sebagai daging diantara dua senyawa organik yang datar seakan-akan berupa roti slice dalam molekul yang berbentuk senwich. Senyawa yang paling stabil berisi
anion siklopentadine. Contohnya Fe(C5H5)2
Reaksi anion siklopentadine yang terjadi dalam Ferrosene
d. Pembuatan Senyawa-senyawa
berikatan
Ơ
logam-karbon
Adanya ligand-ligan seperti CO, C5 H5, dan fosfne pada
senyawa-senyawa logam transisi menunjukan kemungkinan adanya senyawa-senyawa organometalik’
Ikatan Ơ logam-logam sering dibuat dengan reaksi metatesa dengan
salah satu hasilnya berupa senyawa organometalik dan lainnya garam sederhana.
(CO) 5 Mn Na+ CH3 I (CO) 5 Mn CH3 + Na I
Tidak berwarna Tidak berwarna
Cis [ { P(C 2 H 5 ) 3 } 2 PtBr 2 ] + 2CH 3 MgBr
cis [ { P(C 2 H 5 ) 3 } 2 Pt(CH3 )2 ] + 2 MgBr 2
H Mn CO
5+ C
2F
4HCF
2CF
2Mn (CO)
5Tidak berwarna Tidak berwarna
Fe(CO)
5+ F
3C CF
F
3CCF Fe (CO)
4kuning ungu
pentan
25°
benzen