BAB 2
TINJAUAN PUSTAKA 2.1 Tumbuhan Mawar Putih
2.1.1. Morfologi Tumbuhan Mawar
Bunga Mawar yang termasuk famili Rosaceae berbentuk semak kadang-kadang
memanjat (Nuraini, 2014). Daunnya merupakan daun majemuk menyirip yang
memiliki daun penumpu. Struktur daun mawar (Rosa sp.) ini terdiri dari anak
daun (foliolum) yang terdiri dari lebih dari satu helai yang didukung oleh tangkai
anak daun; tangkai anak daun (petiololus) yang merupakan tempat melekatnya
anak daun ; ibu tangkai daun (petiolus communis) merupakan tempat melekatnya
anak daun dan tangkainya ; serta daun penumpu.
Rosa alba L atau Rosa indica Lindl berbunga besar berwarna putih atau
putih pucat, memiliki perhiasan bunga ganda , berbau harum ( Suryowinoto,
1997).
2.1.2. Sistematika Tumbuhan Bunga Mawar Putih Kingdom : Plantae
Divisi : Spermatophyta
Kelas : Dycotyledoneae
Ordo : Rosidales
Famili : Rosaceae
Genus : Rosa
Spesies : Rosa alba L
2.1.3. Jenis-Jenis Tumbuhan Bunga Mawar
Mawar beragam warna yaitu merah, merah jambu, kuning, ungu, putih, dan
lain-lain. Jumlah varietas mawar saat ini diperkirakan mencapai 5000 macam, namun
hanya sekitar 300-400 varietas saja yang dikenal secara umum dan sering
dibudidayakan. Luqman (1992), Tim Direktorat Bina Produksi Hortikultura
(1988) mencatat bahwa diantara varietas tersebut penggolongan mawar menjadi
Sembilan kelompok utama, yaitu:
a. Hybrid tea
Jenis bunga mawar yang bertangkai panjang dengan bunga tunggal
diujungnya sehingga tampak megah dan cantik
b. Floribunda
Jenis bunga potong dan tanaman taman yang bunganya cukup besar dengan
warna bervariasi dab tangkai tegak panjang
c. Grandiflora
Bunganya berukuran raksasa dengan diameter dapat mencapai 7,5-12,5 cm.
d. Climbing rose
Diameter bunga berkisar antara 5-15 cm dan tumbuh merunduk karena
beratnya cabang serta tersusun dalam tandan yang jarang. Kelompok mawar
ini pertumbuhannya sangat lamban dibandingkan kelompok lain dan rata-rata
baru dapat berbunga setelah umurnya lebih dua tahun.
e. Polyantha
Jenis mawar taman dengan warna bunga yang sangat beraneka ragam, bunga
kecil dengan garis tengah sekitar 5 cm dan didekat pucuk cabangnya terdapat
banyak ranting yang masing-masing memiliki sekuntum bunga
Jenis mawar yang diameter bunganya sangat lebar (15 cm) dan juga
merupakan kelompok mawar yang sudah sulit ditemukan dalam literature
g. Mawar tea
Merupakan nenek moyang mawar di Asia dengan ukuran bunga kecil
h. Mawar tua
disebut juga mawar kuno, dan aromanya sangat wangi
i. Special purpose
mawar yang dibedakan atas tiga golongan, yaitu mawar pohon, mawar perdu,
mawar mini.
Luqman (1992), Rukmana (1992) dan Subiyanto (1991) menguraikan
pengelompokkan bunga mawar berdasarkan bentuk bunga menjadi tiga kelompok,
yaitu:
a. Mawar berbunga tunggal
Mawar yang mahkota bunganya tersusun dari satu lapis daun bunga sebanyak
5-7 helai
b. Mawar berbunga semidobel
daun bunganya berjumlah antara 10-20 helai yang tersusun dalam beberapa
lapis, biasanya mahkota bunga semidobel ini agak terbuka bagian atasnya
c. Mawar berganda
Mahkotanya tersusun dari beberapa lapis daun bunga sehingga membentuk
O1
Flavonoid merupakan salah satu golongan fenol alam yang terbesar (Markham,
1988). Flavonoida umumnya terdapat dalam tumbuhan tingkat tinggi tetapi
terdapat juga dalam alga. Golongan flavonoid dapat digambarkan sebagai deretan
senyawa C6-C3-C6. Artinya, kerangka karbonnya terdiri atas dua gugus C6 (cincin
benzene tersubtitusi) disambungkan oleh rantai alifatik tiga karbon. Golongan
terbesar flavonoid berciri mempunyai cincin piran yang menghubungkan rantai
tiga-karbon dengan salah satu dari cincin benzene. Adapun sistem penomoran
untuk turunan flavonoid sebagai berikut pada gambar 2.1 (Robinson, 1995).
Gambar 2.1 flavonoid
2.2.1 Klasifikasi Senyawa Flavonoida 1 . Flavonoida O-glikosida
Flavonoida biasanya terdapat sebagai flavonoid O-Glikosida. Pada
senyawa tersebut satu gugus hidroksil flavonoid atau lebih yang terikat
pada satu gula atau lebih dengan ikatan hemiasetal yang tak tahan asam
Pengaruh glikosilasi menyebabkan flavonoid menjadi kurang reaktif dan
lebih mudah larut dalam air. Sifat terakhir ini memungkinkan
penyimpanan flavonoid di vakuola sel. Salah satu contohnya yaiu
Apigenin 7-O-β-D-glukopiranosida pada gambar 2.2 (Markham, 1988).
O
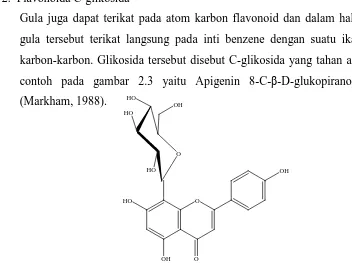
2. Flavonoida C-glikosida
Gula juga dapat terikat pada atom karbon flavonoid dan dalam hal ini
gula tersebut terikat langsung pada inti benzene dengan suatu ikatan
karbon-karbon. Glikosida tersebut disebut C-glikosida yang tahan asam
contoh pada gambar 2.3 yaitu Apigenin 8-C-β-D-glukopiranosida
(Markham, 1988).
3. Flavonoida Sulfat
Flavonoid flavonoid lain yang mudah larut dalam air yang mungkin
ditemukan hanya flavonoida sulfat. Senyawa ini mengandung satu ion
sulfat atau lebih yang terikat pada hidroksil fenol atau gula. Secara
teknis senyawa ini sebenarnya bisulfat karena terdapat sebagai garam,
yaitu flavon-O-SO3-K (Markham, 1988).
4. Biflavonoid
Biflavonoid adalah flavonoid dimer flavonoid yang biasa terlibat yaitu
biasanya flavon dan flavanon secara biosintesis mempunyai pola
oksigenasi yang sederhana dan ikatan antar flavonoid yaitu ikatan
karbon-karbon atau ikatan eter contoh pada gambar 2.4 Amentoflavon (
Markham, 1988). Biflavonoid terdapat hampir khusus dalam
gimnospermae tetapi kadang-kadang dapat juga ditemukan dalam
angiospermae (Harbone, 1987).
O OH
HO O
OH O
HO HO
HO OH
5. Aglikon Flavonoida
Anglikon flavonoid mempunyai atom karbon atom asimetrik dan dengan
demikian menunjukkan sifat keaktifan optik (yaitu memutar bidang
polarisasi-datar). Yang termasuk dalam golongan ini adalah flavanon,
dihidroflavonol, katekin, pterokarpan, rotenoid, dan beberapa
biflavonoid (Markham, 1988).
flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu
1. Flavonol
Flavonol dapat dikatakan sebagai flavonoid yang paling tersebar luas
dan tersebar di seluruh kingdom tumbuhan kecuali alga dan fungi
(Gambar 2.5) . Flavonol seperti myricetin, quercetin, isorhamnetin dan
kaemperol pada umumnya ditemukan dalam bentuk o-glikosida
(Robinson, 1995)
O
O
OH
Gambar 2.5 Flavonol O OH
HO O
OH
O OH
HO O
OH
Gambar 2.4 Amentoflavon
2. Flavon
Flavon (Gambar 2.6) memiliki struktur yang sangat mirip dengan
flavonol (Crozier, 2006). Hanya ada 2 flavon umum yaitu apigenin dan
luteolin. Flavon juga terdapat dalam bentuk glikosida tetapi jenis
glikosidanya lebih sedikit daripada jenis gikosida pada flavonol
(Harbone, 1987).
3. Isoflavon
Isoflavon yang telah dikenal lebih dari 200 senyawa, merupakan isomer
flavon, tetapi jauh lebih langkah. Hampir semuanya terdapat dalam suku
leguminosae (Harbone, 1988). Isoflavon berlainan dengan flavonoid,
pada kedudukan dari cincin aromatik B pada rantai propana sentral,
struktur isoflavon dapat dilihat pada gambar 2.7 (Manitto, 1980).
4. Flavanon
Flavanon dapat dikarakterisasi karena tidak adanya terdapat ikatan
rangkap pada atom karbon no 2 dan 3 (gambar 2.8) dan dengan adanya
pusat atom karbon kiral pada pada C2. Struktur flavanon memiliki
kereaktifan yang tinggi. Flavanon dalam konsentrasi tinggi terdapat
dalam buah jeruk (Citrus) (Crozier, 2006).
O O
Gambar 2.6 flavon
O O
Gambar 2.7 Isoflavon
O O
5. Flavanonol
Flavanonol atau dihidroflavonol (gambar 2.9) merupakan flavonoid yang
paling kurang dikenal dan tidak diketahui apakah senyawa ini terdapat
dalam bentuk glikosida. Tidak seperti leukoantosianidin, senyawa ini
stabil dalam asam klorida panas tetapi terurai oleh basa hangat menjadi
kalkon (Robinson 1995).
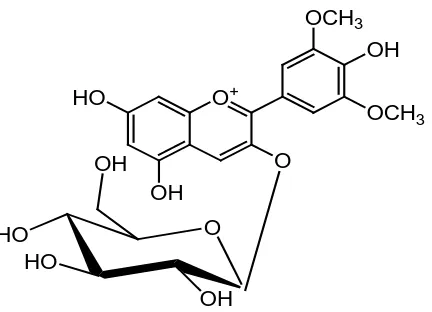
6. Antosianin
Antosianin merupakan pewarna paling penting dan paling tersebar luas
dalam tumbuhan (Harbone, 1988). Antosianin ialah pigmen daun bunga
merah sampai biru yang biasa ( meskipun apigeninidin kuning),
banyaknya sampai 30% bobot kering dalam beberapa bunga. Tidak
seperti golongan flavonoid lainnya antosianin selalu terdapat sebagai
glikosida. Salah satu contoh antosianin Malvidin-3-O-glikosida dapat
dilihat pada gambar 2.10 (Robinson, 1995).
O O
OH
Gambar 2.9 Flavononol
O+
OCH3
OCH3
OH
HO
OH
O
O HO
HO
OH OH
7. Antosianidin
Antosianidin ialah aglikon antosianin yang terbentuk bila antosianin
dihidrolisis dengan asam (Harbone, 1988) dimana secara luas tersebar
dalam kingdom plantae dan jelas terdapat dalam jaringan bunga dan
buah. Antosianidin (gambar 2.11) ini bertanggung jawab dalam
meberikan warna merah,biru, dan ungu. Antosianidin juga ditemukan
dalam di daun, batang, biji dan jaringan akar dan memiliki peran penting
dalam menarik serangga dalam penyerbukan. Adapun contoh
antosianidin yang paling umum yaitu pelargonidin, cyaniding,
delphinidin, peonodin, petunidin, dan malvidin ( Crozier, 2006 ).
8. Auron
Auron berupa pigmen kuning emas terdapat dalam bunga tertentu dan
bryofita (gambar 2.12). Dikenal hanya lima aglikon , tetapi pola
hidroksilasi senyawa ini umumnya serupa dengan pola pada flavonoid
lain dalam larutan basa senyawa ini menjadi merah rose. Beberapa
contoh auron yaitu leptosin, aureusidin, sulfuretin, dan sulfuretin (
Crozier, 2006 ).
O+
OH
OH HO
OH
Gambar 2.11 antosianidin
O
9. Kalkon
Kalkon merupakan zat warna kuning pada bunga, kadang terdapat pada
jaringan lain. Sifat khas kalkon memberikan warna merah dengan
ammonia (Sirait, 2000). Kalkon tidak terdapat cincin benzo γ-piron
sehingga merupakan flavonoid cincin terbuka.Struktur dari kalkon dapat
dilihat pada gambar 2.13 (Bhat, 2005).
2.2.2 Sifat Kelarutan Senyawa Flavonoida
Flavonoida dalam bentuk glikosida kelarutannya bertambah dalam air dan
alkohol. Flavanon dan glikosida kalkon sulit larut dalam metanol, etanol, dan
campuran alkohol-air. Flavan-3-ol ( katekin, proantosianidin, dan tanin
terkondensasi) dapat diekstrak secara langsung menggunakan air sedangkan
metanol merupakan pelarut yang baik untuk katekin dan aseton 70 % untuk
prosianidin. Antoasianin dapat diekstrak menggunakan metanol asam. Metanol
asam ini mengandung asam asetat 7% dan asam trifluoroasetat 3% (Andersen,
2006).
2.3 Teknik Pemisahan
2.3.1 Ekstraksi
Ekstraksi adalah suatu metode pemisahan substansi atau zat dari campurannya
dengan menggunakan pelarut yang sesuai. Ekstraksi dapat digolongkan
berdasarkan bentuk campuran yang diekstraksi dan proses pelaksanaannya.
Berdasarkan bentuk campurannya yaitu ekstraksi padat-cair ; zat yang diekstraksi
terdapat di dalam campuran yang berbentuk padatan.
O
Ekstraksi jenis ini banyak dilakukan didalam usaha mengisolasi zat
berkhasiat yang terkandung didalam bahan alam seperti steroid, hormon,
antibiotika, dan lipida pada biji-bijian. Kemudian ekstraksi cair-cair ; zat yang
diekstraksi terdapat didalam campuran yang berbentuk cair. Ekstraksi cair-cair
sering juga disebut ekstraksi pelarut banyak dilakukan untuk memisahkan zat
seperti iod, atau logam-logam tertentu dalam larutan air.
Berdasarkan proses pelaksanaanya yaitu ekstraksi Kontinyu (Continues
Extraction) pada ekstraksi kontinyu, pelarut yang sama digunakan secara
berulang-ulang sampai proses ekstraksi selesai. Tersedia berbagai alat dari jenis
ekstraksi ini seperti alat soxhlet atau Craig Countercurent. Dan yang kedua
Ekstraksi Bertahap (Batch) pada ekstraksi bertahap, setiap kali ekstraksi selalu
digunakan pelarut yang baru sampai proses ekstraksi selesai. Alat yang digunakan
adalah berupa corong pisah (Yazid, 2005).
Flavonoid biasanya (glikosida) dapat terdegradasi oleh aktivitas enzim saat
tumbuhan dalam bentuk segar dan dalam bentuk tidak kering. Oleh karena itu
disarankan sampel yang digunakan dalam bentuk kering, lipofilik, atau sampel
beku. Ketika sampel atau material dalam bentuk kering digunakan pada umumnya
diubah dalam bentuk serbuk halus. Untuk ekstraksi pelarut yang dipilih
disesuaikan dengan sifat flavonoidnya. Polaritas merupakan dasar pertimbangan
dalam hal pemilihan pelarut (Andersen, 2006). Aglikon flavonoid kepolaran
rendah (flavon, dihidroflavonol, flavanon, isoflavon) dapat diekstraksi
menggunakan kloroform, diklorometan, dietil eter atau etil asetat sedangkan
aglikon flavonoid yang lebih polar seperti hidroksi flavon, flavonol, biflavon,
auron, khalkon dapat diekstraksi dengan aseton, metanol, etanol dan air atau
kombinasi dari pelarut tersebut. Metanol dan air dalam campuran yang bervariasi
merupakan salah satu sistem pelarut yang sesuai untuk senyawa yang
kepolarannya tinggi (Bhat, 2005).
Sampel dalam bentuk serbuk dapat diekstraksi dengan menggunakan alat
sokletasi awalnya diekstrak menggunakan n-heksana, hal ini bertujuan untuk
membuang lemak dan kemudian diekstraksi dengan etanol atau etil asetat untuk
2.3.2 Kromatografi
Kromatografi didefinisikan sebagai prosedur pemisahan zat terlarut oleh suatu
proses migrasi diferensial dinamis dalam sistem yang terdiri atas dua fase atau
lebih. Salah satu fase bergerak secara bersinambungan dalam arah tertentu dan
didalamnya, zat-zat terlarut menunjukkan perbedaan mobilitas yang disebabkan
oleh perbedaan adsorpsi, partisi, kelarutan, tekanan uap, ukuran molekul, atau
kerapatan muatan ion (Harmita, 2014).
2.3.2.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis merupakan kromatografi adsorbsi dan adsorben bertindak
sebagai fase stasioner. Kromatografi lapis tipis (thin layer chromatography atau
TLC) dapat digunakan untuk memisahkan berbagai senyawa seperti ion-ion
anorganik, kompleks senyawa-senyawa organik baik yang terdapat di alam dan
senyawa-senyawa sintetik.Metode pemisahan ini merupakan metode fisikokimia
yang didasarkan atas penyerapan, partisi (pembagian), atau gabungannya (
Harmita, 2009).
Ada empat jenis adsorben yang biasa digunakan yaitu silika gel, alumina,
kieselguhr, dan selulosa. Dari keempat adsorben tersebut yang paling banyak
dipakai adalah silika gel. Kelebihan penggunaan kromatografi lapis tipis
dibandingkan dengan kromatografi kertas ialah karena dapat dihasilkannya
pemisahan yang sempurna, kepekaan yang lebih tinggi, dan dapat dilaksanakan
dengan lebih cepat ( Adnan, 2010 ).
Sebelumnya kromatografi lapis tipis, kromatografi poliamida, dan
elektroforesis kertas merupakan merupakan kelompok teknik pemisahan untuk
senyawa fenolik. Kromatografi lapis tipis merupakan analisis yang bagus untuk
flavonoida hal ini dikarenakan adanya cincin fenil yang merupakan gugus
kromofor yang aktif akan UV serta menyebabkan flavonoid sangat mudah
2.3.2.2 Kromatografi Kolom
Kromatografi kolom merupakan peralatan yang sangat penting dalam pemisahan
flavonoida. Adapun fase diam yang pada umumnya digunakan dalam
kromatografi kolom yaitu silika gel, sephadex, polyamida dan selulosa dimana
fase gerak yang biasa digunakan yaitu campuran antara pelarut organik polar dan
pelarut organik nonpolar dengan menggunakan metode elusi gradient (Bhat,
2005).
Mekanisme pemisahan pada kromatografi kolom didasarkan pada adsorbsi
komponen-komponen campuran yang memiliki afinitas yang berbeda-beda pada
permukaan fase diam. Interaksi antara adsorben dan komponen-komponen
campuran harus bersifat reversible. Aliran fase gerak akan membawa
komponen-komponen campuran dengan kecepatan yang berbeda-beda sesuai dengan afinitas
komponen tersebut terhadap adsorben. Komponen yang memiliki afinitas paling
kecil akan bergerak lebih cepat.
Pemisahan yang terjadi bergantung pada jenis fase gerak yang digunakan.
Bila fase gerak yang digunakan sekaligus merupakan larutan campuran yang
dipisahkan, kecuali eluat pertama, eluat sebelumnya selalu mengandung
komponen dari eluat sebelumnya. Jadi komponen yang dipisahkan tidak murni.
Bila eluen berupa larutan dari zat yang lebih kuat terikat pada adsorben,
komponen-komponen yang dipisahkan lebih murni dan keluar secara beruntun
dari kolom. Adapun prosedur yang dilakukan dalam kromatografi kolom yaitu:
Diawali tahap penyiapan kolom, kolom diisi homogen dengan adsorben
yaitu dengan mencampurkan adsorben dengan pelarut hingga membentuk bubur
(slurry), kemudian dituangkan ke dalam kolom yang berisi pelarut. Campuran
diaduk didalam kolom untuk membantu homogenitas dan menghilangkan
gelembung-gelembung udara. Sebelum dan selama proses pemisahan, permukaan
kolom harus tetap terendam dalam pelarut dan ketinggian pelarut ± 1 cm diatas
permukaan kolom. Kemudian tahap pemasukkan sampel ke permukaan kolom.
Kolom dicuci dengan eluen, kemudian sampel yang telah dilarutkan dengan
sejumlah kecil volume eluen dimasukka kemudian kran dibuka dengan hati-hati.
Dalam kromatografi kolom perbandingan berat adsorben dengan sampel yaitu
Setelah pemasukkan sampel terjadi proses elusi atau pemisahan
komponen-komponen sampel. Elusi diteruskan hingga komponen-komponen
terpisah atau hingga tiap-tiap komponen keluar dari kolom. Untuk senyawa yang
tidak berwarna, eluat dipisahkan dalam beberapa fraksi, yang masing-masing
dengan volume kecil dan penetapan tiap tiap fraksi. Dan tahap yang terakhir yaitu
deteksi atau penetapan kadar komponen. Dimana senyawa kemudian ditetapkan
dan ditimbang setelah fraksi diuapkan dengan uji bercak, KKt atau KLT atau
dengan spektrofotometri (Harmita, 2009).
2.3.2.3 Kromatografi Lapis tipis Preparatif
Pada KLT preparatif, sampel dilarutkan dalam sedikit pelarut sebelum ditotolkan
pada plat pelarut yang baik yang digunakan yaitu pelarut non polar seperti
n-heksana, diklorometana, etil asetat. Jika pelarut digunakan sedikit polar akan
terjadi pelebaran pita (Hostettman, 1995).
Sampel yang akan dipisahkan ditotolkan berupa garis pada salah satu sisi
plat lapisan dan dikembangkan secara tegak lurus pada garis sampel sehingga
campuran akan terpisah menjadi beberapa pita. Penampakan pita dilakukan
dengan cara yang tidak merusak senyawa yang tidak berwarna dan penjerap yang
mengandunng pita dikerok dari plat kaca kemudian sampel dielusi dengan
penjerap dengan pelarut polar (Gritter, 1991).
2.4 Teknik Spektroskopi
2.4.1 Spektrofotometer Ultraviolet-Visibel (UV-Vis)
Spektrum UV-Visibel merupakan hasil interaksi antara radiasi elektromagnetik
(REM) dan molekul. REM merupakan bentuk energi radiasi yang mempunyai
sifat gelombang dan partikel (foton) (Harmita,2009).
Flavonoid dapat diidentifikasi dengan mudah dengan menggunakan
metode spektroskopi salah satunya adalah spektrofotometer Ultraviolet (UV).
Spektrofotometer Ultraviolet biasanya digunakan untuk mengkarakterisasi dan
mengidentifikasi tipe-tipe flavonoid. Spektra UV-Vis dari tiap pigmen tumbuhan
akan berbeda dikarenakan kromofor yang berbeda-beda.
cincin A sedangkan pita I merupakan hasil absorpsi dari sistem sinamoil cincin B
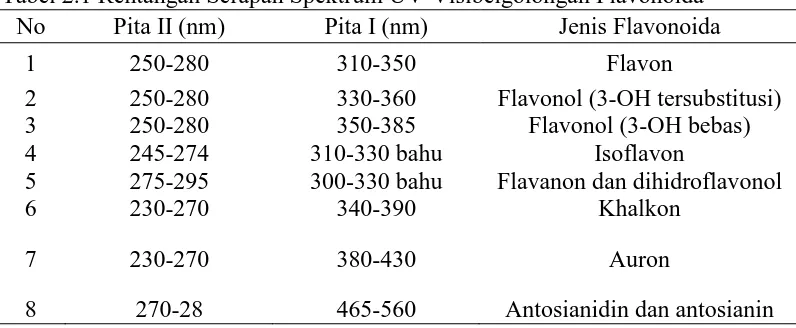
(Bhat,2005). Berikut rentangan serapan spektrum UV-Visibel golongan
flavonoida pada tabel 2.1 (Markham, 1988).
Tabel 2.1 Rentangan Serapan Spektrum UV-Visibelgolongan Flavonoida No Pita II (nm) Pita I (nm) Jenis Flavonoida
1 250-280 310-350 Flavon
2 250-280 330-360 Flavonol (3-OH tersubstitusi) 3 250-280 350-385 Flavonol (3-OH bebas) 4 245-274 310-330 bahu Isoflavon
5 275-295 300-330 bahu Flavanon dan dihidroflavonol
6 230-270 340-390 Khalkon
7 230-270 380-430 Auron
8 270-28 465-560 Antosianidin dan antosianin
2.4.2 Spektrofotometer Infra Merah (FT-IR)
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi
getaran (vibrasi) yang berlainan. Inti-inti atom yang terikat oleh ikatan kovalen
mengalami getaran (vibrasi) atau osilasi (oscillation). Bila molekul menyerap
radiasi inframerah, energi yang diserap menyebabkan kenaikan dalam amplitudo
getaran atom-atom yang terikat itu. Jadi molekul ini berada dalam keadaan vibrasi
tereksitasi (excited vibrational state); energi yang diserap akan dibuang dalam
bentuk panas bila molekul itu kembali ke keadaan dasar (Supratman, 2010 ).
Dua molekul senyawa yang memiliki struktur kimia yang berbeda akan
memiliki spektrum inframerah yang berbeda. Hal ini dapat dikarenakan kedua
molekul tersebut memiliki jenis ikatan dan dan frekuensi vibrasi yang berbeda.
Walaupun memiliki jenis ikatan yang sama, ikatan-ikatan tersebut berada dalam
dua senyawa yang berbeda sehingga mempunyai frekuensi vibrasi yang berbeda
(karena kedua ikatan yang sama tersebut berada dalam lingkungan yang berbeda).
karena itu tipe ikatan yang berlainan menyerap radiasi inframerah pada
panjang gelombang yang berlainan . Dengan demikian spektrometri inframerah
dapat digunakan untuk mengidentifikasi adanya gugus fungsi dalam suatu
molekul seperti OH, NH2, aromatik, substitusi aromatik, -NO2, -SO2, -asetilen.
Terdapat dua tipe vibrasi molekul yaitu Stretching (vibrasi regang/ulur)
ikatan dan bending (vibrasi lentur/tekuk) yaitu vibrasi yang disebabkan oleh sudut
ikatan sehingga terjadi pembesaran atau pengecilan sudut ikatan. Gerakan vibrasi
yang diamati dalam spektrum inframerah jika menghasilkan perubahan momen
dipol sedangkan jika ( µ =0) akan teramati dalam spektrum raman.
Frekuensi molekular dapat dipengaruhi oleh beberapa faktor yaitu
penggandengan vibrasi, ikatan hidrogen, efek induksi, efek resonansi (mesomeri),
sudut ikatan dan efek medan.Dalam spektrum inframerah juga perlu diperhatikan
letak (frekuensi), bentuk pita (melebar atau tajam), dan intensitas pita (kuat,
sedang, lemah) karena merupakan petunjuk sangat berharga dalam
mengidentifikasikan gugus fungsi yang terdapat dalam spektrum (Harmita, 2009).
2.4.3 Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR)
Spektroskopi NMR adalah salah satu metode spektroskopi yang paling penting
untuk menentukan struktur molekul dan stereokimia. Spektroskopi ini dapat
digunakan dalam bidang organik, anorganik, organometalik, biologi, dan kimia
obat-obatan yang memberikan informasi mendetail baik untuk senyawa-senyawa
yang memiliki berat molekul rendah tetapi juga polimer-polimer sintesis dan alam
bahkan makromolekul ( Brown, 1988). Spektroskopi NMR didasarkan pada
penerapan gelombang radio oleh inti tertentu dalam molekul organik, bila molekul
ini berada dalam magnet yang sangat kuat dan homogen. Spektroskopi resonansi
magnet proton ini dapat memberi gambaran kuat magnet dari berbagai inti yang
ada dan untuk menduga letak inti tersebut dalam suatu molekul senyawa organik.
Dari spektra resonansi magnet inti proton (1H-NMR), diperoleh informasi
tentang jenis hydrogen, jumlah atom hidrogen pada masing-masing jenis
lingkungan hidrogen, dan jumlah atom hidrogen pada atom karbon tetangga
(Supratman, 2010 ). Perlu diketahui bahwa bentuk pecahan dan geseran kimia
setiap atom hidrogen yang terikat pada karbon akan berbeda, bergantung pada
lingkungannya. Dari data pergeseran kimia, akan diketahui jenis senyawa yang
mengikat hidrogen akan memberikan informasi tentang perbandingan atau jumlah
hidrogen, yang akhirnya dapat memberikan total atom H yang terdapat dalam
Geseran kimia didefinisikan sebagai rasio antara kekuatan perisai inti
(nuclear shielding) dan medan terapan yang digunakan (applied field).Geseran
kimia merupakan fungsi dari inti dan lingkungannya, serta berkaitan dengan
jumlah molekular. Geseran kimia biasanya diukur dengan membandingkan
terhadap senyawa standar yang sesuai. Senyawa standar pembanding ditambahkan
kedalam sampel yang akan diperiksa misalnya TMS (Harmita, 2009).
TMS (tetramethylsilan) merupakan senyawa standard yang biasa
digunakan untuk sampel organik. Perbandingan antara letak resonansi suatu
proton atau karbon tertentu dengan letak resonansi proton atau karbon standard
dinamakan pergeseran kimia (chemical shift) dari proton atau karbon dan diberi
simbol delta. Senyawa ini juga dapat digunakan untuk pembanding 13C-NMR.
Tetra Metil Silan sangat cocok sebagai senyawa standard karena
a. TMS mempunyai dua belas proton sehingga memberikan satu
puncak tunggal yang tajam ( singlet )
b. TMS merupakan cairan yang volatile, dapat ditambahkan dalam
jumlah sedikit pada larutan sampel dalam pelarutnya (pelarut
berdeuterium) sampel dapat diperoleh kembali dengan
menguapkan pelarutnya
c. Proton dan karbon pada hampir semua senyawa organik
mengalami resonansi pada medan yang lebih rendah daripada
proton atau karbon TMS karena Si bersifat lebih elektropositif
terhadap karbon
d. Larut dalam sebagian besar pelarut organik
e. TMS bersifat inert
f. Tidak larut dalam air atau D2O (Supratman, 2010)
Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR) ini merupakan
alat diagnosa yang penting yang dapat mengidentifikasi jenis-jenis flavonoid
yang berbeda berdasarkan karakteristik yang berbeda dari jenis-jenis flavonoid
tersebut. Berikut merupakan karakteristik pergeseran kimia 1H-NMR dari
Tabel 2.2 Karakteristik Pergeseran kimia 1H-NMR dari flavonoid
Subtituen
H-6 (δ) ppm H-8 (δ) ppm
Flavon, Flavonol,
Isoflavon
6-6.2 (d) 6.3-6.5 (d)
7-Glikosida 6.2-6.4 (d) 6.5-6.9 (d)
Flavanon, dihidroflavonol 5.75-5.95 (d) 5.9-6.1 (d)
7-Glikosida 5.9-6.1 6.1-6.4 (d)
Subtituen 4’-oksigenasi H-2’; H-6’(δ) ppm H-3’;H-5’ (δ) ppm Flavonol 7.9-8.1 (d) 6.5-7.1 (d)
Flavonon 7.1-7.3 (d) 6.5-7.1 (d)
Dihidroflavonol 7.2-7.4 (d) 6.5-7.1 (d)
Isoflavon 7.2-7.4 (d) 6.5-7.1 (d)
Khalkon 7.4-7.6 (d) 6.5-7.1 (d)
Auron 7.6-7.8 (d) 6.5-7.1 (d)
3’,4’- dioksigenasi H-2’ (δ) ppm H-6’ (δ) ppm
Flavon 7.2 (d) 7.3-7.5 (d)
Flavonol 7.5-7.7 (d) 7.6-7.9 (d)
Flavonol- 3-OMe 7.6-7.8 (d) 7.4-7.6 (d)
Flavonol 3’,4’-O-glikosil 7.2-7.5 (d) 7.3-7.7 (d)
Subtituen H-2 (δ) ppm H-3 (δ) ppm Flavanon 5.0-5.5 (q) 2.8 (q)
Dihidroflavonol 4.8-5.0 4.1-4.3 (d)
Dihidroflavonol 3-glikosil 5.0-5.6 (d) 4.3-4.6 (d)
Flavon 6.3 (s)
Isoflavon 7.6-7.8 ; 7.8-8.1
(CDCl3)