TUGAS AKHIR – SB141510
POTENSI
Bacillus SEBAGAI BAKTERI
SIDEROFOR DAN
BIOREMOVAL LOGAM
BESI (Fe)
SEPTA TRI FARISNA 1511 100 051
Dosen Pembimbing Dr. Enny Zulaika, MP Nur Laili, S. Si., M. Si
Jurusan Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
FINAL PROJECT – SB141510
SIDEROPHORE
PRODUCTION
AND
REDUCTION OF FERRIC IRON BY
Bacillus
ISOLATED FROM KALIMAS SURABAYA
SEPTA TRI FARISNA 1511 100 051
Supervisor
Dr. Enny Zulaika, MP Nur Laili, S. Si., M. Si
Biology Department
Mathematics and Natural Science Faculty Sepuluh Nopember Institute Of Technology Surabaya 2015
LEMBAR PENGESAHAN
POTENSI Bacillas SEBAGAI BAKTERI SIIIEROFOR
IIAN BIONMOYAILOGaM
BESI (Fe)
TUGAS AKIIIR
Diajukan
Untuk Memenuhi
Salah
Satu
Sycrat
Memperoleh
Gelar Sarjana
Sains
,
pudu
Jurusan
S-1 Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
Oleh:
SEPTA TRI FARISNA h{RP. 1511 100 051
Disetujui oleh Pembim Dr. Enny Zulaika,M.P. ...
NurLaili.
sr$cA(!t
qtt{...p"-uimbing 2)
27 luli20l5Biologi
Ir. Maya Shovitri, M.Si
199803
2 001
iii
Nama : Septa Tri Farisna
NRP : 1511 100 051
Jurusan : Biologi
Dosen Pembimbing : Dr. Enny Zulaika, MP Nur Laili, S. Si., M. Si Abstrak
Beberapa strain Bacillus mampu menghasilkan siderofor. Siderofor adalah senyawa pengkelat logam besi sebagai respon kekurangan besi. Bacillus juga berpotensi sebagai bioremoval logam besi. Tujuan dari penelitian ini adalah mendapatkan Bacillus siderofor yang resisten logam besi dan mengetahui kemampuan bioremovalnya.
Isolat bakteri yang digunakan adalah Bacillus endogenik Kalimas Surabaya. Penapisan bakteri siderofor pada medium Fe-CAS Agar. Uji resistensi dilakukan pada media nutrient agar- FeCl3.6H2O dimulai dari 5 mg/L dan seterusnya. Uji bioremoval
besi dilakukan pada konsentrasi 9,496; 33,365; dan 33,594 mg/L. Uji viabilitas dilakukan dengan menumbuhkan isolat yang telah terpapar besi pada medium nutrient agar tanpa FeCl3.6H2O.
Bacillus A6, DA11, dan SS19 dapat menghasilkan siderofor dan resisten Fe3+ 33,594 mg/L. Bacillus DA11 dapat meremoval Fe3+ paling tinggi, yaitu 27,967 mg/L pada konsentrasi 33,594 mg/L dengan efisiensi bioremoval 83%. Semua Bacillus mempunyai daya hidup setelah terpapar logam Fe dengan CFU ≥ 300.
v
Student Name : Septa Tri Farisna
NRP : 1511 100 051
Department : Biology
Supervisor : Dr. Enny Zulaika, MP Nur Laili, S. Si., M. Si Abstract
Some Bacillus strains can produce siderophore. Siderophore is a chelating agent for ferric iron as a response to low iron environment. Bacillus also has potency as iron bioremoval. The aim of this research is to get siderophore Bacillus strain which can resist to iron and to know the ability of its bioremoval.
This research used Bacillus isolated from Kalimas Surabaya ie: A6, DA11, S1, S6, and SS19. The strains were screened for siderophore bacteria in Fe-CAS Agar medium. Resistance test used nutrient agar-FeCl3.6H2O in 5 mg/L and so on. Ferric
bioreduction test was applied in 9,496; 33,365; and 33,594 mg/L. The strains from Ferric bioremoval test were grown in nutrient agar medium without FeCl3.6H2O.
Bacillus A6, DA11, and SS19 could produce siderophore and also resisted to 33,594 mg/L Fe3+. Bacillus DA11 had the highest ability of Ferric bioreduction, which was 27,967 mg/L from 33,594 mg/L Ferric with efficiency 83%.
All
Bacillus
had high
viability after growing in Fe containing medium with CFU
≥
300.
vii
menyelesaikan tugas akhir yang berjudul Potensi Bacillus
Sebagai Bakteri Siderofor dan Bioremoval Logam Besi (Fe). Penyusunan tugas akhir ini merupakan suatu syarat untuk memperoleh gelar Sarjana Sains di Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Sepuluh Nopember Surabaya.
Penelitian ini didukung dengan dana penelitian PUPT melalui PNBP ITS tahun anggaran 2015 sesuai nomor kontrak 003246.IT2.11/PN.08/2015. Sebagian penelitian ini dilakukan di Laboratorium Mikrobiologi Pertanian, Bidang Mikrobiologi, Pusat Penelitian Biologi LIPI dan didanai oleh Proyek DIPA Tematik LIPI Tahun Anggaran 2015. Dalam penyusunan tugas akhir ini tidak lepas dari bimbingan dan bantuan berbagai pihak. Penulis mengucapkan terima kasih kepada Dr. Enny Zulaika, MP. selaku pemimbing I, Nur Laili, S. Si, M. Si selaku pembimbing II, serta dosen penguji, Dra. Nurlita Abdulgani M. Si., dan Nur Hidayatul Alami, S. Si., M. Si. Penulis juga mengucapkan terima kasih kepada Ibu dan kakak-kakak atas doa dan semangatnya, teman tim riset Bioremediasi dan Biofertilizer serta teman-teman angkatan 2011, dan seluruh pihak yang telah membantu.
Penulis menyadari masih banyak kekurangan dalam tugas akhir ini, namun besar harapan tugas akhir ini dapat bermanfaat untuk masyarakat luas.
Surabaya, 4 Agustus 2015 Septa Tri Farisna
ix Halaman HALAMAN PENGESAHAN... ABSTRAK... ABSTRACT... KATA PENGANTAR... DAFTAR ISI ... DAFTAR TABEL ... DAFTAR GAMBAR ... DAFTAR LAMPIRAN ... BAB I PENDAHULUAN 1.1 Latar Belakang ... 1.2 Permasalahan ... 1.3 Batasan Masalah ... 1.4 Tujuan ... 1.5 Manfaat ... BAB II TINJAUAN PUSTAKA
2.1 Genus Bacillus. ... 2.2 Logam Besi (Fe) ... 2.3 Resistensi... 2.4 Siderofor... 2.5 Bioremoval... BAB III METODOLOGI
3.1 Waktu dan Tempat Penelitian ... 3.2 Metode Penelitian... 3.2.1 Bakteri yang Digunakan... 3.2.2 Uji Rekonfirmasi Bacillus... 3.2.3 Penapisan Bakteri Siderofor…... 3.2.4 Uji Resistensi dan Range Finding Test Isolat
i iii v vii ix xi xiii xv 1 2 2 2 3 5 6 7 7 9 11 11 11 11 12
x
Terhadap FeCl3.6H2O...
3.2.5 Uji Viabilitas Isolat Terhadap Cekaman Logam Fe...…... 3.2.6 Penentuan Umur Isolat Untuk Uji Bioremoval
Fe... 3.2.7 Uji Bioremoval Fe…... 3.2.8 Viabilitas Bacillus... 3.3 Rancangan Penelitian dan Analisa Data... BAB IV HASIL DAN PEMBAHASAN
4.1 Hasil Rekonfirmasi Bacillus... 4.2 Penapisan Bakteri Siderofor... 4.3 Uji Resistensi Bacillus Terhadap Logam Besi (Fe) 4.4 Viabilitas Bacillus Pada Medium Tercekam Logam
Fe... 4.5 Penentuan Umur Isolat Untuk Perlakuan
Bioremoval... 4.6 Uji Bioremoval Fe... 4.7 Uji Viabilitas Bacillus... BAB V KESIMPULAN DAN SARAN
5.1 Kesimpulan... 5.2 Saran... DAFTAR PUSTAKA... LAMPIRAN... BIODATA PENULIS... 12 13 14 15 16 17 19 21 24 27 30 32 34 37 37 39 47 71
xiii
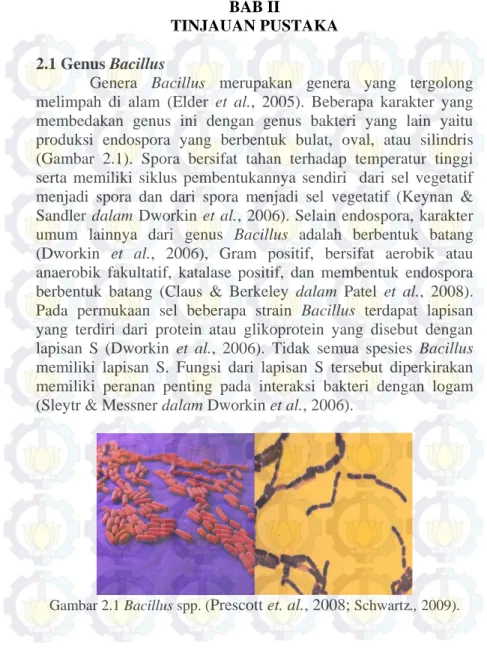
Gambar 2.1 Bacillus spp... 5 Gambar 2.2 Struktur Molekul Siderofor yang
Diproduksi oleh Spesies Bacillus... 9 Gambar 4.1 Hasil Uji Siderofor Setelah Inkubasi
48 Jam... 21 Gambar 4.2 Hasil Uji Resistensi Bacillus Pada
Konsentrasi Fe 300
mg/L... 25 Gambar 4.3 Kurva Pertumbuhan Bacillus A6 yang
Terpapar Logam Fe... 27 Gambar 4.4 Kurva Pertumbuhan Bacillus DA11
yang Terpapar Logam Fe... 28 Gambar 4.5 Kurva Pertumbuhan Bacillus S6 yang
Terpapar Logam Fe... 28 Gambar 4.6 Kurva Pertumbuhan Bacillus SS19
yang Terpapar Logam Fe... 29 Gambar 4.7 Kurva Pertumbuhan Bacillus A6,
DA11, dan SS19 Pada Medium
Nutrient Broth Tanpa Logam Fe... 31 Gambar 4.8 Persentase Efisiensi Bioremoval Fe
xiv
Gambar 4.9 Hasil Uji Viabilitas Bacillus... 35
xv
Lampiran 1 Komposisi Medium NA dan NB... 47 Lampiran 2 Pembuatan Medium Fe-CAS Agar.... 48 Lampiran 3 Uji Rekonfirmasi... 50 Lampiran 4 Skema Kerja... 52 Lampiran 5 Dokumentasi Hasil... 54 Lampiran 6 Analisa Data MANOVA dengan
Minitab... 69 Lampiran 7 Hasil Analisis AAS... 70
xvi
xi
Tabel 4.1 Hasil Uji Rekonfirmasi Bacillus
spp... 19
Tabel 4.2 Hasil Penapisan Bakteri Siderofor... 22
Tabel 4.3 Hasil Uji Resistensi FeCl3.6H2O... 25
Tabel 4.4 Kepadatan Sel Bacillus (Inkubasi 12 jam... 32
Tabel 4.5 Konsentrasi Fe Perlakuan... 33
Tabel 4.6 Hasil Uji Bioremoval Fe... 33
xii
xv
Lampiran 1 Komposisi Medium NA dan NB... 47 Lampiran 2 Pembuatan Medium Fe-CAS Agar.... 48 Lampiran 3 Uji Rekonfirmasi... 50 Lampiran 4 Skema Kerja... 52 Lampiran 5 Dokumentasi Hasil... 54 Lampiran 6 Analisa Data MANOVA dengan
Minitab... 69 Lampiran 7 Hasil Analisis AAS... 70
xvi
1 1.1 Latar Belakang
Salah satu genus prokariota yang melimpah adalah Bacillus (Elder et al., 2005). Karakter umum anggota genus Bacillus adalah berbentuk batang (Dworkin et al., 2006), Gram positif, bersifat aerobik atau anaerobik fakultatif, katalase positif, dan membentuk endospora (Claus & Berkeley dalam Patel et al., 2008). Beberapa strain anggota genus Bacillus dilaporkan memiliki potensi resisten terhadap logam berat seperti Hg, Pb, Cu, dan Cd (Zulaika et al., 2012). Resistensi bakteri terhadap logam dapat melalui mekanisme biosorbsi dan bioakumulasi. Mekanisme biosorbsi merupakan proses pasif sehingga logam tidak meracuni bakteri, sedangkan mekanisme bioakumulasi merupakan proses aktif dimana logam berat dapat meracuni sel bakteri (Chojnacka, 2010).
Siderofor merupakan senyawa pengkelat yang dihasilkan bakteri dan dilepas ke luar sel untuk mengkelat logam besi (Madigan et al., 2012) sebagai respon kekurangan besi dan untuk mendapatkan besi (Zawadzka et al., 2009). Siderofor juga dapat digunakan untuk menyembunyikan logam Fe di lingkungan rhizosfer sehingga tidak tersedia bagi perkembangan mikroba patogen (Husen, 2007). Siderofor mampu membentuk kompleks dengan Ferric (Fe3+) dan menyalurkannya ke dalam sel (Prescott et al., 2008).
Beberapa bakteri yang ditemukan sebagai penghasil siderofor di antaranya Pseudomonas fluorescens (Fgaier & Eberl, 2011), Streptococcus phocae (Retamales et al., 2012), Erwinia chrysanthemi (Riquelme dalam Varma & Chincholkar, 2007), Methylobacterium extorquens (Silva-Stenico et al, 2005), Vibrio cholerae, Vibrio vulnificus, Vibrio fluvialis (Varma & Chincholkar, 2007), dan Bacillus (Zawadzka et al., 2009) seperti Bacillus anthracis dan Bacillus cereus (Pandey et al., 2012).
2
Bacillus yang diisolasi dari Kalimas Surabaya (isolat A6, S1, S6, SS19, dan DA11) merupakan genera yang resisten logam Hg, Pb, Cd, dan Cu (Zulaika et al., 2012). Bacillus tersebut belum diteliti resistensinya terhadap logam Fe dan potensinya sebagai bakteri siderofor sekaligus sebagai agen bioremoval logam Fe. 1.2 Permasalahan
Berdasarkan latar belakang di atas, permasalahan pada penelitian ini adalah:
1. Apakah Bacillus endogenik Kalimas Surabaya dapat berpotensi sebagai bakteri siderofor?
2. Jika merupakan bakteri siderofor, bagaimanakah resistensinya terhadap logam Fe?
3. Jika resisten terhadap logam Fe, bagaimana kemampuan bioremovalnya terhadap logam Fe?
1.3 Batasan Masalah
Batasan masalah dalam penelitian ini adalah: 1. Penelitian dilakukan dalam skala laboratorium.
2. Bakteri Bacillus yang digunakan yaitu anggota genus Bacillus, isolat A6, S1, S6, SS19, DA11, dan Bacillus cereus ATCC 1178.
3. Logam besi (Fe) yang digunakan adalah senyawa FeCl3.
4. Pengukuran konsentrasi FeCl3 menggunakan AAS
(Atomic Absorption Spectrophotometry). 1.4 Tujuan
Tujuan dari penelitian yang dilakukan adalah untuk: 1. Mendapatkan isolat bakteri yang bersifat siderofor. 2. Mendapatkan isolat bakteri yang resisten logam Fe. 3. Mengetahui kemampuan bioremoval Fe pada isolat
1.5 Manfaat
Manfaat dari penelitian yang dilakukan yaitu mendapatkan isolat Bacillus resisten Fe yang berpotensi sebagai bioremoval besi dan sebagai bakteri siderofor.
4
5 BAB II
TINJAUAN PUSTAKA 2.1 Genus Bacillus
Genera Bacillus merupakan genera yang tergolong melimpah di alam (Elder et al., 2005). Beberapa karakter yang membedakan genus ini dengan genus bakteri yang lain yaitu produksi endospora yang berbentuk bulat, oval, atau silindris (Gambar 2.1). Spora bersifat tahan terhadap temperatur tinggi serta memiliki siklus pembentukannya sendiri dari sel vegetatif menjadi spora dan dari spora menjadi sel vegetatif (Keynan & Sandler dalam Dworkin et al., 2006). Selain endospora, karakter umum lainnya dari genus Bacillus adalah berbentuk batang (Dworkin et al., 2006), Gram positif, bersifat aerobik atau anaerobik fakultatif, katalase positif, dan membentuk endospora berbentuk batang (Claus & Berkeley dalam Patel et al., 2008). Pada permukaan sel beberapa strain Bacillus terdapat lapisan yang terdiri dari protein atau glikoprotein yang disebut dengan lapisan S (Dworkin et al., 2006). Tidak semua spesies Bacillus memiliki lapisan S. Fungsi dari lapisan S tersebut diperkirakan memiliki peranan penting pada interaksi bakteri dengan logam (Sleytr & Messner dalam Dworkin et al., 2006).
Bakteri genus Bacillus memiliki beberapa kemampuan seperti memproduksi enzim alginase pada B. stearothermophilus (Hansen et al., 1984), B. circulans mampu mendegradasi fenol (Dong et al., 1992). Selain itu, penelitian pada B. cereus menyatakan bahwa bakteri tersebut mampu hidup (resisten) dalam medium yang mengandung Pb dari konsentrasi 0,5-7 ppm, logam Cu (0,5-8 ppm), logam As (0,5-10 ppm), logam Fe (0,5-8 ppm), dan logam Mn (0,5-10 ppm) (Kanwal et al., 2004).
2.2 Logam Besi (Fe)
Berdasarkan sudut pandang toksikologi, logam berat dapat dibagi dalam dua jenis. Jenis pertama adalah logam berat esensial, dimana keberadaannya dalam jumlah tertentu sangat dibutuhkan oleh organisme hidup, namun dalam jumlah yang berlebihan dapat menimbulkan efek racun. Contoh logam berat ini adalah Zn, Cu, Fe, Co, Mn, Ni, dan sebagainya sedangkan jenis kedua adalah logam berat tidak esensial atau beracun seperti Hg, Cd, Pb, Cr, dan lain-lain (Yudo, 2006).
Besi atau Ferrum (Fe) adalah metal berwarna putih keperakan, liat, dan dapat dibentuk. Di alam didapat sebagai hematit (Yudo, 2006). Besi dioksidasi menjadi Fe (III) dan membentuk mineral yang tidak terlarut seperti hematit, goetit, dan ferihidrit. Sebaliknya, Fe (II) terlarut dalam air namun hanya terdapat pada kondisi anoksik. Konsentrasi Fe (II) dapat direduksi oleh keberadaan fosfat dan karbonat. Potensial reduksi dari Fe (III) menjadi Fe (II) adalah Eo = 0,77 V. Oleh karena itu besi dalam keadaan toksik berbentuk Fe3+. Namun potensial reduksinya mudah terpengaruh oleh agen pengkelat. Hal ini menyebabkan protein yang mengandung besi dapat mengontrol suatu reaksi dan mengkatalisis reaksi redoks (Wittenwiller, 2007). Besi sangat penting sebagai komponen pigmen sitokrom pada respirasi seluler (Madigan et al., 2012; Prescott et al., 2008; Talaro & Talaro, 2002) dan sebagai kofaktor enzim (Prescott et al., 2008). Dalam respirasi seluler pada organisme aerobik,
7
elektron yang dilepaskan dari substrat ditransfer ke molekul oksigen melalui perjalanan elektron dari sitokrom, enzim flavin, protein besi nonheme, dan lain-lain. Energi dilepaskan saat elektron berjalan dan energi tersebut adapat dimanfaatkan untuk kebutuhan organisme (Neilands, 1974). Menurut Pergub Bali No. 8 Tahun 2007 baku mutu logam Fe yaitu 5 mg/L (ppm).
2.3 Resistensi
Bakteri telah mengembangkan beberapa sistem yang efisien untuk detoksifikasi logam. Mekanismenya dapat digolongkan ke dalam 5 kategori, yaitu (1) penyerapan intraseluler; (2) mengekspor; (3) mereduksi permeabilitas; (4) penyerapan ekstraseluler; dan (5) detoksifikasi ekstraseluler (Rough et al. dalam Sherameti & Varma, 2010). Hampir semua mekanisme resitensi bakteri dikode pada plasmid dan transposon (Silver & Walderhaug dalam Sherameti & Varma, 2010) dan hal itu memungkinkan transfer gen atau mutasi spontan yang menyebabkan bakteri resisten terhadap logam. Resistensi bakteri terhadap logam dapat melalui mekanisme biosorbsi dan bioakumulasi. Mekanisme biosorpsi merupakan proses pasif sehingga logam tidak meracuni bakteri. Sedangkan mekanisme bioakumulasi merupakan proses aktif dimana logam berat dapat meracuni sel bakteri (Chojnacka, 2010).
2.4 Siderofor
Penyerapan besi dari lingkungan biasanya sulit bagi mikroorganisme karena bentuknya yang tidak larut (insoluble) seperti Ferric (Fe3+) (Prescott et al., 2008). Pada keadaan pH yang mendekati netral, besi seringkali berbentuk ferric hidroksida (Plowman et al., 1984). Beberapa bakteri dan jamur menghadapi kesulitan tersebut dengan mensekresikan siderofor (Prescott et al., 2008). Terdapat hampir 500 jenis siderofor yang diketahui dan diproduksi oleh bakteri, jamur, dan tumbuhan (Boukhalfa &
Crumbliss dalam Wittenwiller, 2007). Siderofor merupakan senyawa organik dengan berat molekul ringan yang mampu membentuk kompleks dengan Ferric (Fe3+) dan menyalurkannya ke dalam sel (Prescott et al., 2008) dan diubah menjadi bentuk Fe2+ (Grossman et al., 1993). Pada bakteri patogen, siderofor disintesis untuk mendapatkan besi dari inangnya (Lee et al., 2007).
Sebagian besar siderofor secara kimia dikategorikan sebagai katekolat, hidroksamat, atau α-hidroksikarboksilat berdasarkan gugus fungsinya yang membentuk ligan dengan ferric (Fe3+). Beberapa molekul tersebut adalah polipeptida yang disintesis dari NRPS (Nonribosomal Peptide Synthetases), yaitu suatu enzim yang multifungsi yang juga bertanggung jawab dalam biosintesis peptida antibiotik pada mikroba (Lee et al., 2007).
Pada bakteri Gram positif, termasuk spesies Bacillus, siderofor berikatan dengan protein membran spesifik (specific membrane-anchored substrate-binding proteins / SBPs). Siderofor kemudian ditransportasikan melalui membran sitoplasma ke komponen permease dari transporter ABC-type dengan bantuan ATP. Untuk beradaptasi pada kondisi lingkungan yang bervariasi, mikroorganisme biasanya memproduksi lebih dari satu macam siderofor (Zawadzka et al., 2009). Anggota Bacillus cereus diketahui memproduksi dua macam siderofor, bacillibactin dan petrobactin (Gambar 2.2). Keduanya berikatan dengan unit dihiroksibenzoat (DHB), sebagian pada petrobactin dan secara keseluruhan pada bacillibactin. Biosintesis dari bacilibactin sendiri diatur oleh regulasi operon Fur (Hotta et al., 2010).
9
Gambar 2.2 Struktur Molekul Siderofor yang Diproduksi oleh Spesies Bacillus (Zawadzka et. al., 2009).
Keefisienan dari siderofor dapat ditentukan dari struktur kimia dan dari jenis lingkungan tempat dihasilkannya. Siderofor yang memiliki struktur kimia siklik lebih stabil daripada yang memiliki struktur linier (Wittenwiler, 2007).
2.5 Bioremoval
Mekanisme toleransi mikroba terhadap logam berat dengan cara kompleksasi meliputi produksi polisakarida ekstraselular yang memiliki sifat-sifat anion yang berfungsi sebagai bioakumulator yang efisien, produksi metabolit organik yang memiliki sifat pengkelat dan membentuk kompleks dengan logam, presipitasi, serta kristalisasi ekstraselular (Gadd dalam Saraswati & Yuniarti, 2007). Bioremoval merupakan penggunaan sistem biologi untuk mengangkat atau menghilangkan polutan (Wilde & Benemann, 1993). Removal (pengangkatan) logam pada sistem biologi dan tipe mekanismenya bergantung pada spesies
dimana logam berat itu ada. Proses bioremoval dipengaruhi oleh pH, ion lain, suhu, spesies mikroba, potensial redoks, dan faktor lainnya (Noyes, 1994).
Mikroba yang toleran logam berat dengan mekanisme selain efflux disebut sebagai mikroba pengakumulasi logam berat (Gadd & White ; Dave dalam Saraswati & Yuniarti, 2007). Menurut Iyer et al (2005), mekanisme biosorbsi berhubungan dengan adanya eksopolisakarida (EPS) pada dinding sel bakteri yang berfungsi sebagai pengkelat logam berat di permukaan sel. Molekul kompleks pada dinding sel bakteri terdiri dari peptidoglikan yang tersusun oleh molekul-molekul yang lebih sederhana antara lain fosforil, karboksil, dan asam amino yang mempunyai muatan negatif, muatan negatif akan berinteraksi dengan ion atau molekul yang bermuatan positif di lingkungan luarnya sehingga berbentuk ikatan ligan. Ion logam bermuatan positif, sehingga secara elektrostatik akan terikat pada permukaan sel (Langley & Baveridge dalam Sholikah & Kuswytasari, 2012). Bakteri, kapang, ganggang, dan ragi mampu mengakumulasi logam berat Ag, Au, Cd, Co, Cu, Fe, Ni, U, dan Zn (Gadd & White; Dave dalam Saraswati & Yuniarti, 2007). Di dalam tanah, sel-sel mikroba baik mati maupun hidup dan produknya dapat merupakan bioakumulator logam berat yang sangat efisien (Saraswati & Yuniarti, 2007).
11 BAB III
METODOLOGI 3.1 Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Februari 2015 – Mei 2015 di Laboratorium Mikrobiologi dan Bioteknologi Jurusan Biologi FMIPA-ITS dan Laboratorium Mikrobiologi Pusat Penelitian Biologi LIPI Cibinong.
3.2 Metode Penelitian
3.2.1 Bakteri yang Digunakan
Isolat bakteri yang digunakan adalah genus Bacillus A6, S1, S6, SS19, DA11 endogenik Kalimas Surabaya, dan Bacillus cereus ATCC 1178 yang merupakan koleksi Laboratorium Mikrobiologi dan Bioteknologi Jurusan Biologi FMIPA ITS. 3.2.2 Uji Rekonfirmasi Bacillus
Uji rekonfirmasi diawali dengan purifikasi Bacillus uji pada medium nutrient agar (Lampiran 1) dengan metode gores (streak) untuk mendapatkan satu koloni murni dan mengetahui morfologi koloni Bacillus. Setelah didapatkan satu koloni murni, dilakukan subkultur.
Subkultur dilakukan untuk memperpanjang waktu hidup suatu kultur bakteri dengan memindahkannya pada medium yang baru. Sebanyak satu ose isolat diinokulasikan secara aseptis dengan metode streak ke dalam tabung reaksi berisi medium nutrient agar miring dan diinkubasi selama 24 jam pada suhu ruang. Keberhasilan subkultur ditandai dengan tumbuhnya koloni pada medium nutrient agar miring.
Profile matching karakter kunci Bacillus dilakukan dengan pengamatan bentuk sel, pewarnaan Gram, pewarnaan endospora, dan uji katalase (Lampiran 3).
3.2.3 Penapisan Bakteri Siderofor Pembuatan Medium Fe-CAS Agar
Medium Fe-CAS agar (Crome Azurol S / CAS = C23H13C12O9SNa3) merupakan medium yang digunakan untuk
penapisan bakteri siderofor. Semua peralatan gelas yang akan digunakan, dicuci dengan larutan 3M HCl atau yang lebih pekat untuk menghilangkan sisa-sisa logam Fe yang mungkin masih melekat pada peralatan gelas, kemudian dibilas dengan akuades. Medium Fe-CAS agar terdiri dari beberapa larutan (Lampiran 2) yang disterilkan secara terpisah dengan autoklaf selama 15 menit (Husen, 2007; Schwyn & Neilands, 1987).
Uji Bakteri Siderofor
Satu ose isolat Bacillus secara aseptis diinokulasikan ke medium Fe-CAS agar dengan metode streak plate, kemudian diinkubasi pada suhu ruang selama 24 jam. Bakteri sebagai penghasil siderofor adalah koloni yang berwarna kuning sampai oranye yang kontras dengan warna biru media Fe-CAS agar (Husen, 2007). Selanjutnya yang digunakan untuk uji bioremoval logam adalah isolat yang positif sebagai bakteri siderofor; jika semua isolat positif siderofor dilakukan penapisan isolat dengan cara uji resistensi terhadap logam Fe.
3.2.4 Uji Resistensi dan Range Finding Test Isolat Terhadap FeCl3.6H2O
Satu ose isolat Bacillus dari medium padat nutrient agar (hasil subkultur) diinokulasikan secara aseptis dengan metode streak pada medium nutrient agar dengan kandungan FeCl3.6H2O
0,1 mg/L (Lampiran 1), diinkubasi 24 jam pada suhu ruang. Isolat yang tumbuh adalah isolat yang resisten FeCl3.6H2O.
Range finding test digunakan untuk mendapatkan isolat yang mampu mentoleransi konsentrasi optimum logam Fe. Isolat ditumbuhkan secara aseptis pada medium nutrient agar yang mengandung FeCl3.6H2Odengan konsentrasi 5, 8, 25, 50 mg/L
13
dan seterusnya (interval 25) sampai didapatkan konsentrasi yang mampu ditoleransi isolat uji. Inkubasi dilakukan selama 24 jam pada suhu ruang. Hasil range finding test yang digunakan adalah konsentrasi FeCl3.6H2O di bawah konsentrasi maksimal yang
mampu ditoleransi isolat uji. Isolat yang akan digunakan untuk uji bioremoval adalah 3 isolat yang memiliki toleransi lebih tinggi terhadap FeCl3.6H2O dibandingkan isolat lainnya. Selanjutnya
isolat dan konsentrasi FeCl3.6H2O dari range finding test akan
digunakan untuk uji bioremoval Fe. Misal K1, K2, K3, dan
seterusnya (mewakili konsentrasi) dan I1, I2, I3, dan seterusnya
mewakili isolat.
3.2.5 Uji Viabilitas Isolat Terhadap Cekaman Logam Fe Uji viabilitas isolat terhadap cekaman logam Fe dilakukan untuk mengetahui daya hidup isolat Bacillus uji dalam medium nutrient broth yang mengandung Fe. Uji ini dilakukan dengan pembuatan kurva pertumbuhan dalam medium nutrient broth yang mengandung FeCl3.6H2O pada isolat uji yang sudah
terpilih di range finding test. Konsentrasi FeCl3.6H2O yang
digunakan adalah K1, K2, K3, dan tanpa logam Fe untuk kontrol.
Sebelum pembuatan kurva, pembuatan kultur starter dilakukan terlebih dahulu. Pembuatan kultur starter dilakukan dalam dua tahap. Tahap pertama untuk kultur starter I. Satu ose isolat Bacillus hasil subkultur diinokulasikan secara aseptis ke dalam 10 ml medium nutrient broth (Lampiran 1) dalam Erlenmeyer, diinkubasi selama 18 jam pada suhu ruang di atas rotary shaker (100 rpm). Selanjutnya tahap kedua untuk kultur starter II. Setelah diinkubasi 18 jam, 5 ml kultur starter I diinokulasikan secara aseptis ke dalam 45 ml medium nutrient broth dalam Erlenmeyer dan diinkubasi selama 18 jam pada suhu ruang di atas rotary shaker (100 rpm).
Sebanyak 10 ml kultur starter II diinokulasikan secara aseptis ke dalam Erlenmeyer berisi 90 ml medium nutrient broth
dengan penambahan FeCl3.6H2O sesuai konsentrasi yang
dibutuhkan. Untuk kontrol tidak ditambahkan FeCl3.6H2O.
Setiap jam/2 jam sebanyak 1,5 ml kultur diambil dan dimasukkan ke dalam kuvet kemudian diukur nilai Optical Density (OD) nya dengan spektrofotometer pada panjang gelombang (λ) 600 nm (Harley & Prescott, 2002). Pengukuran OD dimulai dari jam ke-0 sampai jam ke 24. Data OD yang didapatkan kemudian dibuat kurva pertumbuhan dengan sumbu x sebagai waktu (t) dan sumbu y sebagai nilai OD.
3.2.6 Penentuan Umur Isolat Untuk Uji Bioremoval Fe Penentuan umur isolat untuk uji bioremoval Fe dilakukan dengan pembuatan kurva pertumbuhan. Kurva pertumbuhan dilakukan untuk mengetahui gambaran tahap-tahap pertumbuhan bakteri (Madigan et al., 2012).
Sebelum pembuatan kurva, pembuatan kultur starter dilakukan terlebih dahulu. Pembuatan kultur starter dilakukan dalam dua tahap. Tahap pertama untuk kultur starter I. Satu ose isolat Bacillus hasil subkultur diinokulasikan secara aseptis ke dalam 10 ml medium nutrient broth (Lampiran 1) dalam Erlenmeyer, diinkubasi selama 18 jam pada suhu ruang di atas rotary shaker (100 rpm). Selanjutnya tahap kedua untuk kultur starter II. Setelah diinkubasi 18 jam, 5 ml kultur starter I diinokulasikan secara aseptis ke dalam 45 ml medium nutrient broth dalam Erlenmeyer dan diinkubasi selama 18 jam pada suhu ruang di atas rotary shaker (100 rpm).
Sebanyak 10 ml kultur starter II diinokulasikan secara aseptis ke dalam Erlenmeyer berisi 90 ml medium nutrient broth. Setiap jam/2 jam sebanyak 1,5 ml kultur diambil dan dimasukkan ke dalam kuvet kemudian diukur nilai Optical Density (OD) nya dengan spektrofotometer pada panjang gelombang (λ) 600 nm (Harley & Prescott, 2002). Pengukuran OD dimulai dari jam ke-0 sampai jam ke 24. Data OD yang didapatkan kemudian dibuat
15
kurva pertumbuhan dengan sumbu x sebagai waktu (t) dan sumbu y sebagai nilai OD.
Umur kultur (µ) untuk perlakuan bioremoval logam Fe berpedoman pada kurva pertumbuhan kultur tanpa pemaparan Fe. Umur kultur (µ) dihitung dengan formula:
µ = Umur kultur untuk perlakuan bioremoval logam Fe a = waktu (t) fase log akhir
b = waktu (t) fase log awal 3.2.7 Uji Bioremoval Fe
Pembuatan Larutan Stok Logam
Larutan stok logam FeCl3.6H2O untuk uji bioremoval
dibuat dengan konsentrasi 5000 mg/L. Sebanyak 500 mg FeCl3.6H2O dilarutkan dalam 100 ml akuades dalam Erlenmeyer.
Kultur Starter Uji Bioremoval Fe
Pembuatan kultur starter dilakukan dalam dua tahap. Tahap pertama untuk Starter I. Satu ose isolat uji diinokulasikan secara aseptis ke dalam 20 ml medium cair nutrient broth dan diinkubasi selama 20 jam pada suhu ruang di atas rotary shaker dengan kecepatan 100 rpm. Untuk starter II, starter I yang berumur 20 jam diinokulasikan secara aseptis ke 80 ml medium nutrient broth dan diinkubasi selama 20 jam pada suhu ruang di atas rotary shaker dengan kecepatan 100 rpm.
Pengukuran Konsentrasi FeCl3 yang Diremoval Isolat Uji
Kultur Bacillus uji (dari starter) sebanyak 45 ml diinokulasikan secara aseptis ke dalam 180 ml medium cair nutrient broth, diinkubasi sampai dengan µ jam sesuai kurva
pertumbuhan. Kultur uji sebelum dipapar FeCl3.6H2O dihitung
kepadatannya dengan Haemocytometer, selanjutnya diambil 50 ml dan dipapar dengan FeCl3.6H2O dengan konsentrasi sesuai
dengan range finding test (K1, K2, K3). Setelah inkubasi selama
24 jam di atas rotary shaker (100 rpm), larutan kultur ditambahkan 5 tetes HNO3 serta dipanaskan pada suhu ≤ 85
o
C selama 15 menit . Setelah itu larutan kultur disentrifugasi dengan kecepatan 4000 rpm selama 20 menit untuk memisahkan filtrat dan pelet sel Bacillus. Pengukuran konsentrasi Fe3+ di filtrat dilakukan dengan menggunakan AAS (Atomic Absorption Spectrophotometry) dengan panjang gelombang (λ) 248,3 nm (Fathurrahmi, 2012). Konsentrasi Fe3+ pada filtrat medium merupakan konsentrasi logam Fe3+ sisa (Ks) yang tidak diremoval
oleh Bacillus. Konsentrasi yang mampu diremoval oleh Bacillus dan efisien removalnya dihitung dengan formula:
R = Konsentrasi Fe3+ yang diremoval Bacillus E = Efisiensi Bioremoval Fe
K0 = Konsentrasi awal Fe 3+
dalam medium tanpa inokulum Bacillus
Ks = Konsentrasi akhir Fe 3+
pada filtrat setelah isolat difiltrasi
3.2.8 Viabilitas Bacillus
Isolat Bacillus yang telah terpapar FeCl3.6H2O diambil
sebanyak 100 µL dan diinokulasikan pada medium nutrient agar dengan menggunakan metode pour plate. Koloni yang tumbuh adalah koloni yang memiliki viabilitas terhadap pemaparan FeCl3.6H2O Jika koloni tumbuh lebih dari 300 CFU (Colony
Forming Units) maka dilakukan pengenceran. CFU yang dapat diterima adalah 30 – 300 (Ingham & Schneeberger, 2012).
R = K0 - Ks
17
3.3 Rancangan Penelitian dan Analisa Data
Penelitian dilakukan dengan metode kualitatif untuk uji siderofor dan uji resisten serta dengan metode kuantitatif untuk uji bioremoval Fe dan uji viabilitas (CFU).
Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL). Perbedaan perlakuan diuji dengan Multivariate Analysis of Varians (MANOVA) dengan taraf kepercayaan (p = 5%), uji beda nyata dilakukan dengan uji beda nyata terkecil (BNT). Pengulangan dilakukan dua kali.
19 BAB IV
HASIL DAN PEMBAHASAN 4.1 Hasil Rekonfirmasi Bacillus
Uji rekonfirmasi Bacillus dilakukan untuk menentukan bahwa isolat uji adalah dari genus Bacillus. Isolat yang digunakan adalah A6, DA11, S1, S6, SS19 yang diisolasi dari Kalimas Surabaya (Zulaika et al., 2012) dan Bacillus cereus ATCC 1178 sebagai isolat pembanding.
Secara umum koloni isolat Bacillus berbentuk irregular dengan tepi berombak (tidak rata) dan berwarna putih keruh (Lampiran 5). Hasil profile matching karakter kunci Bacillus menunjukkan bahwa isolat Bacillus uji berbentuk batang, merupakan bakteri Gram positif, membentuk endospora, motil, bersifat aerob atau anaerob fakultatif, kemoorganotrof, dan katalase positif (Tabel 4.1).
Tabel 4.1 Hasil Uji Rekonfirmasi Bacillus spp. Karakter Kunci Bacillus* Kode Isolat A6 DA11 S1 S6 SS19 B. cereus Berbentuk batang + + + + + + Gram positif + + + + + + Endospora + + + + + + Motil + + + + + + Aerob/Fakultatif Anaerob + + + + + + Kemoorganotrof + + + + + + Katalase Positif + + + + + + *Holt et al. (1994)
Morfologi koloni Bacillus yang secara umum berbentuk irregular, berwarna putih keruh, dan tepi berombak sesuai dengan pernyataan Holt et al. (1994) yang menyatakan bahwa genus Bacillus menunjukkan koloni yang berbeda-beda pada medium
nutrient agar. Warna koloni pada umumnya putih sampai kekuningan atau putih suram, tepi koloni bermacam-macam namun pada umumnya tidak rata, permukaannya kasar, koloni besar, dan tidak mengkilat. Bentuk koloni dan ukurannya sangat bervariasi tergantung dari jenisnya.
Semua Bacillus uji berbentuk batang dan merupakan bakteri Gram positif. Bakteri Gram positif berwarna ungu (Harisha, 2006) setelah pewarnaan Gram dengan crystal violet dan safranin. Bakteri Gram positif memiliki dinding sel 60-90% terdiri dari peptidoglikan (Harisha, 2006). Pada pewarnaan endospora menggunakan malachite green, semua isolat uji membentuk endospora (bagian berwarna hijau pada sel bakteri). Endospora merupakan suatu struktur khusus yang mengandung dipicolinic acid (DPA) sebagai penanda resistensi bakteri tersebut terhadap paparan panas, radiasi ultraviolet, juga radiasi gamma. Endospora dapat berbentuk bulat, oval, elips, atau silinder, yang terbentuk di dalam sel vegetatif (Prescott et al., 2008).
Semua isolat Bacillus uji bersifat motil. Secara umum genus Bacillus memiliki peritrichous flagella (Berber, 2004) yang menyebabkan Bacillus bersifat motil (Schaechter et al., 2006). Genus Bacillus bersifat aerob dan atau fakultatif anaerob, tersebar pada beberapa habitat, seperti tanah, air, hingga makanan, namun paling banyak ditemukan di tanah (Hatmanti, 2000). Bacillus merupakan mikroorganisme kemoorganotrof, yaitu organisme yang mendapatkan sumber energi dari bahan organik (Madigan et. al., 2012). Selain itu Bacillus juga memiliki enzim katalase yang ditandai dengan munculnya gelembung saat berinteraksi dengan H2O2 (Harley & Prescott, 2002).
Berdasarkan hasil profil matching sesuai karakter kunci dengan panduan Bergey’s Manual of Determinative Bacteriology, semua isolat Bacillus uji benar-benar dari genus Bacillus. Berdasarkan Holt et al., (1994), genus Bacillus mempunyai ciri spesifik yaitu berbentuk batang, merupakan
21
bakteri Gram positif, membentuk endospora, motil, bersifat aerob dan atau anaerob fakultatif, kemoorganotrof, dan katalase positif. 4.2 Penapisan Bakteri Siderofor
Penapisan bakteri siderofor dilakukan untuk menyeleksi isolat Bacillus uji yang mampu menghasilkan siderofor. Penapisan ini dilakukan dengan medium Fe-CAS, yaitu medium yang digunakan secara universal untuk mendeteksi siderofor (Schwyn & Neilands, 1987; Bholay et al., 2012).
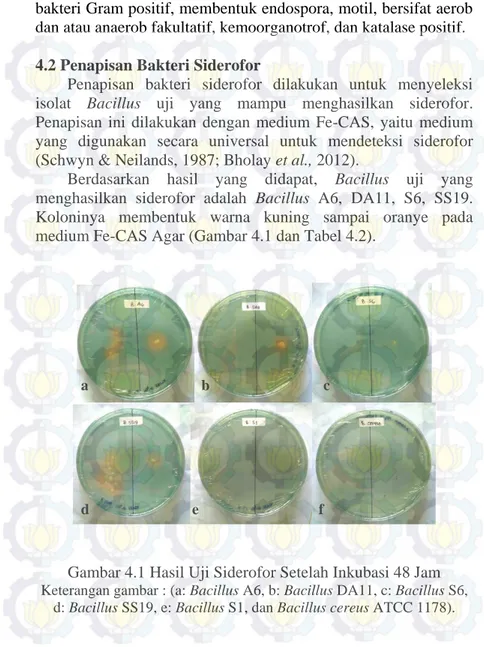
Berdasarkan hasil yang didapat, Bacillus uji yang menghasilkan siderofor adalah Bacillus A6, DA11, S6, SS19. Koloninya membentuk warna kuning sampai oranye pada medium Fe-CAS Agar (Gambar 4.1 dan Tabel 4.2).
Gambar 4.1 Hasil Uji Siderofor Setelah Inkubasi 48 Jam Keterangan gambar : (a: Bacillus A6, b: Bacillus DA11, c: Bacillus S6,
d: Bacillus SS19, e: Bacillus S1, dan Bacillus cereus ATCC 1178).
a b c
Tabel 4.2 Hasil Penapisan Bakteri Siderofor No. Isolat Bacillus Warna kuning-oranye
Ukuran Zona Siderofor Inkubasi 24 Jam Inkubasi 48 Jam 1. A6 + 0,6 cm 1,225 cm 2. B. cereus - - - 3. DA11 + 0,4 cm 0,55 cm 4. S1 - - - 5. S6 + 0,2 cm 0,25 cm 6. SS19 + 0,4 cm 0,975 cm
Keterangan : (+): Koloni tumbuh membentuk warna kuning-oranye, (-): Koloni tidak tumbuh dan tidak membentuk warna kuning-oranye.
Terbentuknya warna kuning pada medium Fe-CAS Agar disebabkan adanya siderofor yang diproduksi oleh isolat uji. Menurut Louden et al. (2011) CAS (Chrome Azurol S) dan HDTMA membentuk kompleks yang kuat dengan ferric yang menyebabkan warna biru pada medium Fe-CAS agar. Menurut Schwyn & Neilands (1987) apabila terdapat pengkelat logam besi (Fe) yang kuat seperti siderofor, maka pengkelat tersebut akan mengambil Fe dari kompleks pewarna Blue Dye sehingga medium Fe-CAS Agar yang berwarna biru akan berubah warna menjadi oranye.
FeDye + L → FeL + Dye Fe : Ferric (Fe3+)
Dye : Blue Dye
L : Ligan (Siderofor)
(Schwyn & Neilands, 1987) Genus Bacillus adalah Gram positif, senyawa siderofor akan berikatan dengan protein membran spesifik (specific membrane - anchored substrate-binding-proteins/SBPs). Senyawa siderofor kemudian ditransportasikan melalui membran sitoplasma ke
23
komponen permease dari transporter tipe ABC dengan bantuan ATP (Zawadzka et al., 2009). Beberapa anggota Bacillus diketahui memproduksi dua macam siderofor, bacillibactin dan petrobactin. Biosintesis dari bacillibactin diatur oleh regulasi operon Fur (Hotta et al., 2010). Namun dalam penelitian ini belum diketahui jenis siderofor yang diproduksi karena tidak dilakukan uji bahan aktif siderofor. Siderofor merupakan agen pengkelat Fe3+ yang diproduksi bakteri dalam keadaan cekaman kekurangan Fe (Verma et al., 2012). Komposisi medium Fe-CAS sebagai media uji siderofor, memiliki kandungan logam Fe hanya 0,0027 gr/L, supaya bakteri yang diuji mampu memproduksi siderofor. Hal tersebut juga didukung oleh pernyataan Harvie et al. (2005) dan Bhagwat et al. (2013) bahwa Bacillus tidak memproduksi siderofor dalam kondisi lingkungan yang kaya akan Fe.
Siderofor yang diproduksi bakteri telah digunakan secara efisien sebagai agen biokontrol untuk melawan patogen pada tanah yang ditanami tumbuhan. Siderofor secara signifikan akan mengurangi keberadaan ion ferric yang menyebabkan terhambatnya pertumbuhan fungi patogen. Siderofor berguna dalam agrikultur untuk manajemen penyakit tumbuhan dan juga peningkatan pertumbuhan tumbuhan (Patil et al., 2014).
Bacillus S1 dan Bacillus cereus ATCC 1178 tidak menghasilkan siderofor setelah ditumbuhkan pada medium Fe-CAS Agar (Gambar 4.2). Namun beberapa peneliti menyatakan bahwa Bacillus cereus memproduksi dua macam siderofor, bacillibactin dan petrobactin (Hotta et al., 2010). Tidak tumbuhnya kedua isolat tersebut pada medium Fe-CAS dapat disebabkan karena adanya kandungan bahan medium yang bersifat toksik bagi beberapa bakteri. Verma et al., (2012) menyatakan bahwa HDTMA (Hexadecyltrimethylammonium bromide) bersifat toksik bagi beberapa bakteri dan menyebabkan tidak tumbuhnya bakteri pada medium Fe-CAS. HDTMA merupakan surfaktan dan dapat bersifat sebagai antibakterial yang
menyebabkan perubahan permeabilitas membran sel serta keluarnya ion interseluler dan massa metabolit sel ke luar sel (Parolo et al., 2011). Selain itu bakteri Gram positif lebih peka terhadap reagen yang bersifat toksik daripada bakteri Gram negatif (Verma et al., 2012). Berdasarkan fakta di atas, isolat Bacillus uji yang bersifat sebagai bakteri siderofor adalah Bacillus A6, DA11, S6, dan SS19.
Berdasarkan ukuran zona siderofor pada tabel 4.2, isolat Bacillus yang membentuk ukuran zona siderofor paling besar adalah Bacillus A6 dan yang paling kecil adalah Bacillus S6. Hal tersebut bergantung pada kemampuan masing-masing isolat dalam memproduksi siderofor untuk pengambilan Fe. Hu & Xu (2011) menyatakan dalam deteksi siderofor, faktor yang penting adalah substrat atau mediumnya. Hasil uji siderofor menunjukkan zona siderofor terbesar sampai terkecil secara berturut-turut adalah Bacillus A6, SS19, DA11, dan S6.
4.3 Uji Resistensi Bacillus Terhadap Logam Besi (Fe)
Uji resistensi dilakukan untuk mengetahui kemampuan isolat tumbuh dalam medium yang mengandung logam Fe. Isolat yang digunakan untuk uji resistensi adalah isolat yang mampu menghasilkan siderofor, yaitu Bacillus A6, DA11, S6, dan SS19. Hasil yang didapat, semua isolat Bacillus mampu tumbuh pada media nutrient agar yang mengandung logam Fe sampai dengan 300 mg/L. Berdasarkan pengukuran AAS, konsentrasi Fe pada media mengalami penurunan cukup besar sekitar ≥ 70% (Tabel 4.5) yang menyebabkan konsentrasi Fe di media rendah (Tabel 4.3 dan Gambar 4.2). Sesuai dengan Baby et al., (2014), Bacillus mampu tumbuh dengan baik pada medium yang mengandung Fe (III) dalam konsentrasi rendah.
25
Tabel 4.3 Hasil Uji Resistensi FeCl3.6H2O
Kode Isolat Konsentrasi (mg/L) 0,1 5 8 25 50 75 100 125 150 175 200 300 A6 +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ DA11 +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ S6 +++ +++ +++ +++ +++ ++ ++ ++ ++ ++ ++ ++ SS19 +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++
Keterangan: (+++) = tumbuh baik, (++) = tumbuh sedang, (+) = tumbuh rendah, (-) = tidak tumbuh
Gambar 4.2 Hasil Uji Resistensi Bacillus Pada Konsentrasi Fe 300 mg/L
Keterangan gambar : (a: Bacillus A6, b: Bacillus DA11, c: Bacillus S6, dan d: Bacillus SS19).
Semua Bacillus uji mampu tumbuh dalam medium yang mengandung Fe karena Fe dibutuhkan dalam metabolisme sel bakteri. Hal tersebut juga dinyatakan oleh Baby et al. (2013) secara umum semua mikroorganisme, termasuk Bacillus membutuhkan Fe untuk aktivitas metabolisme dan juga sebagai komponen struktural utama pada beberapa enzim. Dalam penelitiannya Baby et al. (2014) menyatakan bahwa beberapa spesies Bacillus resisten terhadap logam Fe sampai dengan 6000 mg/L, walaupun ada beberapa spesies Bacillus yang hanya mampu resisten hingga 100 mg/L.
Menurut Chojnacka (2010), bakteri yang diisolasi dari lingkungan yang tercemar logam berat merupakan bakteri yang mempunyai resistensi tinggi terhadap logam berat di sekitarnya. Isolat Bacillus yang digunakan dalam penelitian ini diisolasi dari sungai Kalimas Surabaya yang diketahui telah tercemar merkuri antara 0,105 hingga 6,38 mg/L (Zulaika et al., 2012) dan resisten terhadap 25 mg/L HgCl2 (Zulaika et al., 2012), sehingga Bacillus
yang diuji pada penelitian ini memiliki toleransi yang baik terhadap logam, sebab Hg merupakan logam berat yang paling toksik dibandingkan logam berat lainnya. Mikroba yang hidup pada lingkungan kaya logam cenderung lebih resisten terhadap logam berat daripada yang hidup di lingkungan tidak kaya logam (Kumar et al., 2013). Resistensi tersebut melalui mekanisme adaptasi (Nithya et al., 2011), hal ini karena adanya perbedaan kromosomal, transposon, dan plasmid yang mengatur sistem resistensi pada masing-masing bakteri (Baby et al. 2013). Pada dasarnya, populasi mikroorganisme yang resisten terhadap logam melibatkan perubahan kelarutan dari logam tersebut melalui reduksi, akumulasi, dan secara in-situ immobilisasi (Roane, 1999 dalam Baby et al., 2013). Menurut Nithya et al. (2011) salah satu mekanisme penting resistensi pada bakteri terhadap logam adalah adanya protein RND (Resistence, Nodulation, Cell Division) yang mengatur transportasi logam melalui membran sel. Pada Bacillus subtilis pengambilan Fe diatur oleh protein Fur. Dalam kondisi lingkungan yang kaya akan Fe, protein Fur menekan sistem pengambilan Fe (Fuangthong et al., 2002).
Berdasarkan hasil uji resistensi, keempat isolat Bacillus yang diuji menunjukkan pertumbuhan yang baik pada medium nutrient agar yang mengandung logam Fe sampai dengan 300 mg/L sehingga range finding test untuk bioremoval ditentukan konsentrasinya 50, 100, dan 150 mg/L.
27
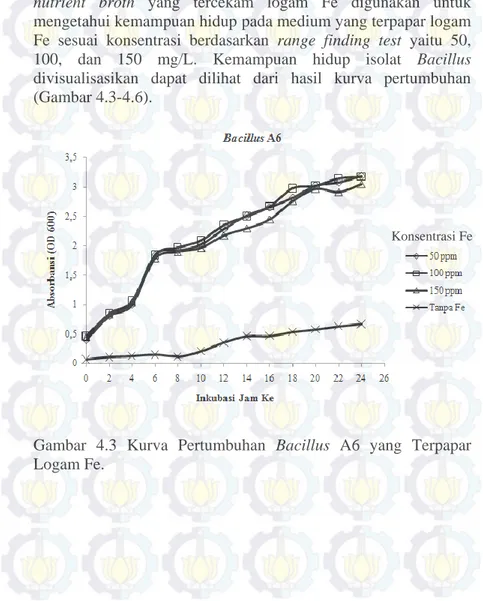
4.4 Viabilitas Bacillus Pada Medium Tercekam Logam Fe Kurva pertumbuhan isolat Bacillus uji dalam medium nutrient broth yang tercekam logam Fe digunakan untuk mengetahui kemampuan hidup pada medium yang terpapar logam Fe sesuai konsentrasi berdasarkan range finding test yaitu 50, 100, dan 150 mg/L. Kemampuan hidup isolat Bacillus divisualisasikan dapat dilihat dari hasil kurva pertumbuhan (Gambar 4.3-4.6).
Gambar 4.3 Kurva Pertumbuhan Bacillus A6 yang Terpapar Logam Fe.
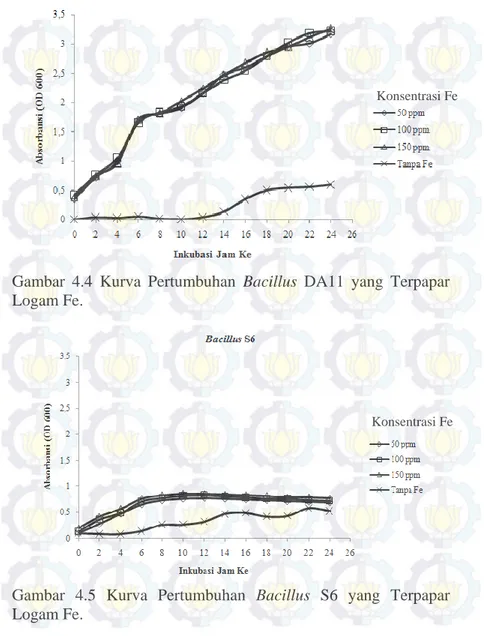
Gambar 4.4 Kurva Pertumbuhan Bacillus DA11 yang Terpapar Logam Fe.
Gambar 4.5 Kurva Pertumbuhan Bacillus S6 yang Terpapar Logam Fe.
Konsentrasi Fe
29
Gambar 4.6 Kurva Pertumbuhan Bacillus SS19 yang Terpapar Logam Fe.
Berdasarkan pola pertumbuhan pada Gambar 4.4 – 4.7, Bacillus A6, DA11, dan SS19 menunjukkan pola pertumbuhan yang hampir serupa, sedangkan Bacillus S6 memiliki pola pertumbuhan yang berbeda dengan A6, DA11, dan SS19. Nilai OD paling tinggi berkisar pada nilai 3,25 Å (pengenceran 5x) pada semua konsentrasi logam Fe dan untuk Bacillus S6 mempunyai nilai OD 0,85 Å (tanpa pengenceran). Nilai OD tersebut lebih tinggi dibandingkan dengan nilai OD isolat Bacillus uji yang ditumbuhkan pada medium NB tanpa terpapar logam yang berkisar antara 0,5 - 0,6 Å (tanpa pengenceran). Nilai OD semakin tinggi dengan semakin meningkatnya konsentrasi logam. Hal tersebut dapat terjadi karena isolat Bacillus resisten pada media nutrient broth yang mengandung logam Fe hingga konsentrasi 300 mg/L, sehingga dalam medium tercekam logam Fe, Bacillus masih mampu tumbuh dengan baik. Hal tersebut disebabkan logam besi (Fe) penting sebagai komponen pigmen Konsentrasi Fe
sitokrom pada respirasi seluler (Madigan et. al., 2012; Prescott et. al., 2008; Talaro & Talaro, 2002) dan sebagai kofaktor enzim (Prescott et. al., 2008) serta adanya protein Fur yang menekan sistem pengambilan Fe berlebih saat kondisi lingkungan bakteri kaya akan Fe (Fuangthong et al., 2002).
Pada kurva pertumbuhan Bacillus S6 menunjukkan pertumbuhan yang paling rendah jika dibandingkan dengan ketiga isolat Bacillus yang diuji. Hal ini dapat terjadi karena kondisi medium nutrient broth yang berupa cairan memungkinkan paparan logam Fe yang lebih besar terhadap sel bakteri yang tersebar bebas di dalam medium daripada di medium padat yang memungkinkan isolat hanya sebagian terpapar logam. Selain itu Bacillus S6 di medium nutrient agar-Fe pada uji resistensi menunjukkan pertumbuhan yang kurang baik dari konsentrasi 75 mg/L dan seterusnya. Hal tersebut tergantung adaptasi genetik dari masing-masing genus Bacillus yang meliputi adaptasi kromosomal, transposon dan plasmid (Baby et al. 2013). Berdasarkan hasil kurva pertumbuhan, dipilih tiga isolat Bacillus yang memiliki kemampuan viabilitas baik dalam medium terpapar Fe yaitu Bacillus A6, DA11, dan SS19 untuk uji bioremoval logam Fe.
4.5 Penentuan Umur Isolat Untuk Perlakuan Bioremoval Hasil kurva pertumbuhan Bacillus A6, DA11, dan SS19 pada medium nutrient broth tanpa logam Fe menunjukkan pola yang secara umum hampir serupa. Fase adaptasi atau fase lag terjadi dari jam ke 0 hingga jam ke 3 pada semua isolat (Gambar 4.7). Fase lag menggambarkan tidak adanya pertumbuhan populasi secara signifikan karena sel mengalami perubahan kimiawi dan bertambah ukuran serta substansi seluler sehingga siap untuk membelah diri (Sulistijowati, 2012).
31
Gambar 4.7 Kurva Pertumbuhan Bacillus A6, DA11, dan SS19 Pada Medium Nutrient Broth Tanpa Logam Fe.
Berdasarkan hasil kurva pertumbuhan, umur isolat Bacillus untuk perlakuan bioremoval (µ) yaitu jam ke 12. Pada jam ke 12 kurva pertumbuhan menunjukkan fase log atau eksponensial. Fase ini menggambarkan terjadinya pertumbuhan dan pembelahan sel bakteri secara maksimal. Pertumbuhan tersebut dipengaruhi oleh kondisi lingkungannya (suhu dan komposisi medium). Pada fase eksponensial, kondisi fisiologis dan kimiawi populasi sel bakteri seragam, sehingga kultur yang berada pada fase eksponensial biasanya digunakan untuk penelitian fisiologis dan biokimia (Madigan et. al., 2012; Prescott et. al., 2008). Secara umum prokariot tumbuh lebih cepat daripada mikroorganisme eukariot. Itu terjadi karena sel yang berukuran kecil memiliki kemampuan untuk meningkatkan kapasitas penyerapan nutrisi daripada sel yang lebih besar, dan hal tersebut dapat mempengaruhi laju pertumbuhannya (Madigan et. al., 2012).
Setelah fase eksponensial terdapat suatu fase dimana jumlah sel bakteri yang tumbuh sama dengan sel bakteri yang mati yang disebut fase stasioner. Fase ini terjadi karena nutrisi dalam medium sudah banyak digunakan sehingga tidak ada pertumbuhan dan produk samping dari metabolisme terakumulasi di medium sehingga menghambat pertumbuhan sel bakteri bahkan dapat menyebabkan kematian (Madigan et. al., 2012). Kurva pertumbuhan pada Gambar 4.8, fase stasioner dimulai jam ke 20 pada semua isolat Bacillus. Jika inkubasi dilanjutkan setelah fase stasioner, maka sel-sel bakteri akan mati karena lisis yang disebut fase kematian (Madigan et. al., 2012).
4.6 Uji Bioremoval Fe
Uji Bioremoval Fe dilakukan untuk mengetahui kemampuan isolat uji dalam meremoval logam besi (Fe) pada medium nutrient broth. Sebelum dipapar logam, kepadatan sel Bacillus dihitung menggunakan Hemacytometer pada µ jam sesuai penentuan umur perlakuan jam ke 12 (Tabel 4.4).
Tabel 4.4 Kepadatan Sel Bacillus (Inkubasi 12 jam) Isolat Bacillus Jumlah Sel/ml
A6 67,75 x 106
DA11 34,05 x 106
SS19 11,55 x 106
Hasil analisis AAS pada medium nutrient broth tanpa isolat menunjukkan penurunan yang relatif besar (Tabel 4.5). Konsentrasi Fe 50 mg/L menjadi 9,496 mg/L; 100 mg/L menjadi 33,365 mg/L; dan 150 mg/L menjadi 33,594 mg/L. Hal tersebut dapat terjadi karena adanya komposisi medium Nutrient Broth seperti senyawa-senyawa yang membentuk garam jika terionisasi mampu berikatan dengan logam (Gillespie, 1994). Semua isolat uji mampu melakukan bioremoval Fe (Tabel 4.6). Konsentrasi logam besi (Fe) yang lebih besar menunjukkan bioremoval yang
33
lebih besar pula, demikian juga dengan efisiensi bioremoval (Tabel 4.6 dan Gambar 4.9). Berdasarkan analisis MANOVA untuk isolat dan efisiensi bioremoval Fe, nilai p = 0,473 (p > 0,05) yang berarti antara ketiga isolat dan efisiensi bioremoval tidak berbeda. Sedangkan analisis MANOVA untuk konsentrasi Fe dan efisiensi bioremoval, nilai p = 0,001 (p < 0,05) yang menunjukkan bahwa konsentrasi mempengaruhi efisiensi bioremoval dengan perbedaan paling nyata terdapat pada konsentrasi 9,496 dan 33,365 mg/L (Lampiran 6).
Tabel 4.5 Konsentrasi Fe Perlakuan
Konsentrasi Perlakuan (mg/L) Konsentrasi Pengukuran AAS* (mg/L)
50 9,496
100 33,365
150 33,594
*Balai Riset dan Standardisasi Industri Surabaya Tabel 4.6 Hasil Uji Bioremoval Fe
No. Isolat Bacillus Konsentrasi Awal (mg/L) Konsentrasi Akhir (mg/L) Konsentrasi Bioremoval (mg/L)* Efisiensi Bioremoval (%)* 1. A6 9,496 33,365 33,594 4,995 6,642 6,581 4,501a 26,723b 27,013b 47,404a 80,093b 80,410b 2. DA11 9,496 33,365 33,594 4,54 6,524 5,627 4,956a 26,841b 27,967b 52,190a 80,447b 83,248b 3. SS19 9,496 33,365 33,594 4,44 7,481 9,288 5,056a 25,884b 24,306b 53,243a 77,578b 72,352b *Angka yang didampingi huruf yang berbeda pada kolom yang beda signifikan (p < 0,05).
Gambar 4.8 Efisiensi Bioremoval Fe oleh Isolat Bacillus. Bioremoval logam oleh bakteri dapat dipengaruhi oleh temperatur, pH, biomassa, kemampuan toleransi bakteri tersebut terhadap logam (Johncy et al., 2010 dan Silva et al., 2008), dan waktu paparan dengan logam (Shaaban et al., 2015). Terdapat beberapa gugus kimia yang dapat mengikat logam pada mikroba seperti gugus acetamido pada kitin, polisakarida struktural pada fungi, gugus amino dan fosfat pada asam nukleat, gugus sufhidril dan karboksil pada protein, dan gugus hidroksil pada polisakarida (Shaaban et al., 2015). Gugus-gugus kimia tersebut memiliki muatan negatif yang akan berinteraksi dengan ion atau molekul yang bermuatan positif di lingkungan luarnya sehingga berbentuk ikatan ligan (Wang et al., 2009).
4.7 Uji Viabilitas Bacillus
Uji viabilitas dilakukan untuk mengetahui kemampuan hidup isolat Bacillus pada medium nutrient agar setelah dipapar logam
35
Besi (Fe). Isolat Bacillus yang telah dipapar Fe pada uji bioremoval ditumbuhkan pada medium nutrient agar tanpa logam Fe dengan metode pour plate dan diinkubasi selama 24 jam. Semua isolat uji tumbuh lebih dari 300 CFU (Colony Forming Unit) (Tabel 4.7 dan Gambar 4.9).
Tabel 4.7 Hasil Uji Viabilitas Bacillus
Isolat Bacillus CFU Bacillus Setelah Terpapar Fe 9,496 mg/L 33,365 mg/L 33,594 mg/L A6 >300 CFU >300 CFU >300 CFU DA11 >300 CFU >300 CFU >300 CFU SS19 >300 CFU >300 CFU >300 CFU
Gambar 4.9 Hasil Uji Viabilitas Isolat Bacillus
Keterangan : (a: Bacillus A6, b: Bacillus DA11, dan c: Bacillus SS19). Hasil uji viabilitas menunjukkan bahwa logam Fe yang dipaparkan dalam medium perlakuan logam tidak mempengaruhi dan menghambat pertumbuhan isolat Bacillus. Hal ini terjadi karena Fe merupakan salah satu mikronutrien yang dibutuhkan untuk pertumbuhan bakteri (Harvie et al., 2005).
39 BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan, maka dapat disimpulkan bahwa:
1. Bakteri Bacillus A6, DA11, S6, SS19 mampu menghasilkan siderofor dan Bacillus S1, Bacillus cereus ATCC 1178 tidak menghasilkan siderofor.
2. Bacillus A6, DA11, S6, dan SS19 resisten terhadap medium nutrient agar yang mengandung logam Fe sampai dengan konsentrasi 300 mg/L.
3. Kemampuan meremoval Fe yang terbaik terdapat pada Bacillus DA11 pada perlakuan Fe 33,594 mg/L dengan bioremoval 27,967 mg/L dari pemaparan 33,594 mg/L dan efisiensi bioremovalnya 83,248%.
5.2 Saran
Isolat Bacillus yang menghasilkan siderofor dalam penelitian ini dicoba untuk diaplikasikan dalam lingkungan yang terkendali untuk mengetahui aktivitasnya sebagai biofertilizer. Selain itu isolat tersebut juga dapat diaplikasikan sebagai agen bioremediasi di tanah tercemar Fe dalam kondisi yang terkontrol.
39 DAFTAR PUSTAKA
Baby, V., Rajakumar, S., dan Ayyasamy, P. M. 2013. Reduction of Ferric Iron in Synthetic Medium Amended with Acetate As A Sole Carbon Source. International Journal of Current Microbiology and Applied Sciences Vol. 2 No. 12: 501-513. Baby, V., Rajakumar, S., dan Ayyasamy, P. M. 2014. Prevalence and Screening of Potential Fe(III) and Mn(VI) Resistant Microorganisms in Industrial Soil. International Journal of Innovative Research in Science, Engineering and Technology Vol. 3: 7.
Berber, I. 2004. Characterization of Bacillus Species By Numerical Analysis of Their SDS-PAGE protein Profiles. Journal of Cell and Molecular Biology 3: 33-37.
Bhagwat, P. K., Kasabe, P. J., Jhample, S. B., dan Dandge, P. B. 2013. Friendly Bacteria Propping Up Legumes Development In Pesticide Contaminated Soil. International Journal of Pharma and Bio Sciences 4(3): 356-364.
Bholay, A. D., Priyanka, U. J., Borkhataria B. V., dan Dhalkari, M. V. 2012. Fluorescent Pseudomonads as Plant Growth Promoting Rhizobacteria and Their Siderophoregenesis. IOSR Journal of Pharmacy and Biological Sciences Volume 3: 27-32. Cabaj, A. dan Kosakowska, A. 2009. Iron-dependent Growth of and Siderophore Production By Two Heterotrophic Bacteria Isolated from Brackish Water of The Southern Baltic Sea. Microbiological Research 164: 570-577.
Chojnacka, K. 2010. Biosorption and Bioaccumulation-The Prospects for Practical Applications. Environment International 36: 299-307.
Dong, F., Wang, L., Wang, C., Cheng, J., He, Z., Sheng, Z., dan Shen, R. 1992. Molecular Cloning and Mapping of Phenol Degradation Genes from Bacillus stearithermophilus FDTP-3 and Their Expression in Escherichia coli. Applied and Environmental Microbiology 58: No 8.
Dworkin, M., Falkow, S., Rosenberg, E., Schleifer, K. H., dan Stackebrand, E. 2006. The Prokaryotes: A Handbook on The Biology of Bacteria: Firmicutes, Cyanobacteria. Springer Science Bussiness Media.
Elder, K., Baker, D., dan Ribes, J. 2005. Infections, Infertility, and Assisted Reproduction. Cambridge: Cambridge University Press.
Fathurrahmi. 2012. Analysis of Mineral Contents Ca, Mg, Fe and Na in Natural Bentonite Clay. Jurnal Natural 12: No 1.
Fgaier, H. & Eberl, H. J. 2011. Antagonistic Control of Microbial Pathogens Under Iron Limitations By Siderophore Producing Bacteria In A Chemostat Setup. Journal of Theoritical Biology 273: 103-114.
Fuangthong, M., Herbig, A. F., Bsat, N., dan Helmann, J. D. 2002. Regulation of The Bacillus subtilis fur and perR Genes by PerR: Not All Members of The PerR Regulon Are Peroxide Inducible. Journal of Bacteriology: 3276-3286.
Gillespie, S. H., 1994. Medical Microbiology. Oxford: Butterworth-Henemann.
Grossman, T. H., Tuckman, M., Ellestad, S., dan Ousburne, M. S. 1993. Isolation and Characterization of Bacillus subtilis Genes Involved in Siderophore Biosynthesis: Relationship between B. subtilis sfp0 and Escherichia coli entD Genes. Journal of Bacteriology 175: 6203-6211.
41
Hansen, J. B., Doubet, R. S., dan Ram. 1984. Alginase Enzyme Production by Bacillus circulans. Applied and Environmental Microbiology 47: No 4.
Harisha, S. 2006. An Introduction to Practical Biotechnology. New Delhi: Laxmi Publications.
Harley dan Prescott. 2002. Laboratory Exercises in Microbiology, Fifth Edition. The McGraw-Hill Companies. Harvie, D. R., Vilchez, S., Steggles, J. R., dan Ellar, D. J. 2005. Bacillus cereus Fur Regulates Iron Metabolism and Is Required for Full Virulence. Microbiology 151: 569-577.
Hu, Q. dan Xu, J. 2011. A Simple Double-Layered Chrome Azurol S Agar (SD-CASA) Plate Assay To Optimize The Production of Siderophore By A Potential Biocontrol Agent Bacillus. African Journal of Microbiology Research Vol. 5 (25): 4321-4327.
Husen, E. 2007. Metode Analisis Biologi Tanah. Balai Besar Litbang Sumberdaya Lahan Pertanian, Badan Penelitian dan Pengembangan Pertanian, Departemen Pertanian.
Holt, J. G., Krieg, N. R., Sneath, P. H. A. Staley, J. T., dan Williams, S. T. 1994. Bergey’s Manual of Deterinative Bacteriology 9th edition. Baltimore: Williams and Wilkins. Hotta, K., Kim, C., Fox, D. T., dan Koppsisch, A. T. 2010. Siderophore-mediated Iron Acquisition in Bacillus anthracis and Related Strains. Microbiology 156.
Ingham, C. & Schneeberger, P. M. 2012. The Role of New Technologies in Medical Microbiological Research and Diagnosis. Netherlands: Bentham Books.
Iyer, A., Mody, K., dan Jha, B. 2005. Biosorption of Heavy Metals by A Marine Bacterium. Marine Pollution Bulletin 50: 340-343.
Johncy, R. M., Hemambika, B., Hemapriya, J., dan Rajeshkannan. 2010. Comparative Assessment of Heavy Metal Removal by Immobilized and Dead Bacterial Cells: A Biosorption Approach. Global Journal of Environmental Research 4 (1): 23-30.
Kanwal, R., Ahmed, T., Tahir, S. S., dan Rauf, N. 2004. Resistance of Bacillus cereus and E. coli Towards Lead, Copper, Iron, Manganese and Arsenic. Pakistan Journal of Biological Sciences 7: 6-9.
Kumar, R., Nongkhlaw, Acharya, C., dan Joshi, S. R. 2013. Growth Media Composition and Heavy Metal Tolerance Behaviour of Bacteria Characterized From The Sub-Surface Soil of Uranium Rich Ore Bearing Site of Domiasiat in Meghalaya. Indian Journal of Biotecnology Vol. 12: 115-119.
Lee, J. Y., Janes, B. K., Brian K. D. P. F., Pfleger, Bergman, N. H., Liu, H., Hakansson, K., Somu, R. V., Aldrich, C. C., Cendrowski, S., Hanna, P. C., dan Sherman, D. H. 2007. Biosynthetic Anaalysis of The Petrobactin Siderophore Pathwaay from Bacillus anthracis. Journal of Bacteriology 189: 1698-1710.
Louden, B. C., Haarman, D., dan Lynne, A. M. 2011. Use of Blue Agar CAS Assay for Siderophore Detection. Journal of Microbiology & Biology Education Vol. 12: No.1
Madigan, M. T., Martinko, J. M., Stahl, D. A., dan Clark, D. P. 2012. Brock Biology of Microorganisms. San Fransisco: Pearson Education.
43
Neilands, J. 1974. Microbial Iron Metabolism: A Comprehensive Treatise. London: Academic Press.
Nithya, C., Gnanalakshmi, B., dan Pandian, S. K. 2011. Assesment and Characterization of Heavy Metal Resistance in Palk Bay Sediment Bacteria. Marine Envioronmental Research: 283-294.
Noyes, Robert. 1994. Unit Operations in Environtmental Engineering. United Sates of America: Noyes Publications. Pandey, R. K., Jarvis, G. G., dan Low, P. S. 2012. Efficient Synthesis of The Siderophore Petrobactin Via Antimony Triethoxide Mediated Coupling. Tetrahedron Letters 53: 1627-1629.
Parolo, M. E., Fernandez, L. G., Zajonkovsky, I., Sanchez, M. P., dan Baschini, M. 2011. Antibacterial Activity of Materials Synthesized From Clay. Sciences Against Microbial Pathogens. Patel, A. K., Deshattiwar, M. K., Chaudhari, B. L., dan Chincholkar, S. B. 2008. Production, Purification, and Chemical Characterization of The Catecholate Siderophore from Potent Probiotic Strains of Bacillus sp. Bioresource Technology 100: 368-373.
Patil, S., Bheemaraddi, M. C., Shivannavar, C. T., dan Gaddad, S. M. 2014. Biocontrol Aactivity of Siderophore Producing Bacillus subtilis CTS-G24 Against Wilt and Dry Rot Causing Fungi in Chickpea. IOSR Journal of Agriculture and Veterinary Science (IOSR-JAVS) Vol. 7, Issue 9 Ver. 1: 63-68.
Plowman, J. E., Loehr, T. M., Goldman, S. J., dan Sanders-Loehr, J. 1984. Structure and Siderophore Activity of Ferric Schizokinen. Journal of Inorganic Biochemistry 20: 183-197.
Prescott, Harley, Klein. 2008. Microbiology, Seventh Edition. New York: McGraw-Hill.
Retamales, J., Gonzales-Conteras, A., Salazar, S., Toranzo, A. E., dan Avendano-Herrera, Ruben. 2012. Iron Utilization and Siderophore Production By Streptococcus phocae Isolated From Diseased Atlantic Salmon (Salmo salar). Aquaculture 364-365: 305-311.
Saraswati, R. & Yuniarti, E. 2007. Metode Analisis Biologi Tanah. Balai Besar Litbang Sumberdaya Lahan Pertanian, Badan Penelitian dan Pengembangan Pertanian, Departemen Pertanian. Schaecter, M., Ingraham, J. L., dan Neidhardt, F. C. 2006. Microbe. Washington DC: ASM Press.
Schwartz M. 2009. Bacillus anthracis.
<htttp://www.bioquell.ie/> [2 Januari 2015]
Schwyn, B dan Neilands, J. B. 1987. Universal Chemical Assay for The Detection and Determination of Siderophores. Analytical Biochemistry 160: 47-56.
Shaaban, M. T., Ibrahim, H. A. H., Abouhend, A. S., dan El-Moselhy, K. M. 2015. Removal of Heavy Metals from Aqueos Solutions Using Multi-Metals and Antibiotics Resistant Bacterium Isolated from The Red Sea, Egypt. American Journal of Microbiological Research Vol. 3 No. 3: 93-106.
Sheramati, I. & Varma, A. 2010. Soil Biology: Soil Heavy Metals. New York: Springer Heidelberg Dordrecht.
Sholikah, U. & Kuswytasari, N. D., 2012. Uji Potensi Genera Bacillus Sebagai Bioakumulator Merkuri. Skripsi. Jurusan Biologi, Institut Teknologi Sepuluh Nopember.