Laporan Praktikum Fisiologi Tumbuhan
PERKECAMBAHAN DAN DORMANSI
Ali Fachrudin dan Nariswari FidaraUniversitas Islam Negeri Syarif Hidayatullah Jakarta Fakultas Sains dan Teknologi
Program Studi Biologi April 2017 Abstrak
. Praktikum ini dilakukan untuk pengaruh faktor lingkungan terhadap perkecambahan biji, mengetahui pengaruh faktor lingkungan terhadap perkecambahan biji dengan testa yang relatif keras, dan mengetahui faktor yang menghambat perkecambahan. Metode yang dilakukan dengan cara. Hasil pada percobaan . Dapat Disimpulkan.
Kata kunci : 1. Pendahuluan
Benih dikatakan dormansi bila benih tersebut sebenarnya hidup tetapi berkecambah walaupun diletakkan pada keadaan yang secara umum dianggap telah memenuhi syarat bagi suatu perkecambahan. Dormansi merupakan terhambatnya proses metabolisme dalam biji. Dormansi dapat berlangsung dalam waktu yang sangat bervariasi (harian-tahunan) tergantung oleh jenis tanaman dan pengaruh lingkungannya. Dormansi pada benih dapat disebabkan oleh keadaan fisik dari kulit, keadaan fisiologis dari embrio, atau kombinasi dari kedua keadaan tersebut. Namun demikian, dormansi bukan berarti benih tersebut mati atau tidak dapat tumbuh kembali, disini hanya terjadi masa istirahat dari pada benih itu sendiri. Masa ini dapat dipecahkan dengan berbagai cara, seperti cara mekanis atau kimiawi. Cara mekanis dengan menggunakan sumber daya alat atau bahan mekanis yang ada seperti amplas, jarum, pisau, alat penggoncang dan sebagainya. Sedangkan cara kimiawi dengan menggunakan bahan-bahan kimia seperti asam sulfat pekat dan HNO3 pekat. Pada intinya cara-cara tersebut supaya terdapat celah agar air dan gas udara untuk perkecambahan dapat masuk kedalam benih (Sutopo, 1985).
Variasi umur benih suatu tanaman sangatlah beragam, namun juga bukan berarti bahwa benih yang telah masak akan hidup selamanya. Seperti, kondisi penyimpanan selalu mempengaruhi daya hidup benih. Meningkatnya kelembaban biasanya mempercepat hilangnya daya hidup, walaupun beberapa biji dapat hidup lebih lama dalam air. Penyimpanan
dalam botol atau di udara terbuka pada suhu sedang sampai tinggi menyebabkan biji kehilangan air dan sel akan pecah apabila biji diberi air. Pecahnya sel melukai embrio dan melepaskan hara yang merupakan bahan yang baik bagi pertumbuhan pathogen penyakit. Tingkat oksigen normal umumnya mempengaruhi dan merugikan masa hidup biji. Kehilangan daya hidup terbesar bila benih disimpan dalam udara lembab dengan suhu 35˚C atau lebih (Dwidjoseputro, 1985).
Tipe dormansi diantaranya sebgai berikut:
1. Dormansi fisik : yang menyebabkan pembatasan struktural terhadap perkecambahan. Seperti kulit biji yang keras dan kedap sehingga menjadi penghalang mekanisme terhadap masuknya air dan gas pada beberapa jenis tanaman. 2. Dormansi fisiologi : dapat disebabkan oleh beberapa mekanisme, umumnya dapat disebabkan oleh pengatur tumbuh baik penghambat atau perangsang tumbuh, dapat juga oleh faktor-faktor dalam seperti ketidaksamaan embrio dan sebab-sebab fisiologi lainnya.
Dormansi adalah masa istirahat biji sehingga proses perkecambahan tidak dapat terjadi, yang disebabkan karena adanya pengaruh dari dalam dan luar biji (Salisbury dan Ross, 1995).
Perkecambah merupakan transformasi dari bentuk embrio menjadi tanaman yang sempurna. Perkecambahan biji yang dipermudah dengan keadaan tertentu seperti penyucian, dengan keberadaan zat penghambat tumbuh larut air pada kulit biji, suhu rendah, perpecahan kulit biji dan hal lain membuat potensial bahan tanam sebagai sumber keseragaman tanaman menjadi cukup rumit. Ditambah lagi dengan kenyataan bahwa lingkungan relung tanah tidak akan sama pada kondisi lapangan seperti dalam hal kandungan air, temperatur dan organisme (Sitompul, 1995).
Perkecambahan biji adalah kulminasi dari serangkaian kompleks proses-proses metabolik yang masing-masing harus berlangsung tanpa gangguan. Tiap substansi yang menghambat salah satu proses akan berakibat pada terhambatnya seluruh rangkaian proses pekecambahan. Beberapa zat penghambat dalam biji yang telah berhasil diisolir adalah koumarin dan lacton tidak jenuh, namun lokasi penghambatnya sukar ditentukan karena daerah kerjanya berbeda dengan tempat dimana zat tersebut diisolir. Zat penghambat dapat berada dalam embrio, endosperm, kulit biji maupun daging buah (Lakitan, 2007).
Alelopati merupakan sebuah fenomena yang berupa bentuk interaksi antara makhluk hidup yang satu dengan makhluk hidup lainnya melalui senyawa kimia. Pendapat lain mengungkapkan bahwa alelopati merupakan suatu peristiwa dimana suatu individu tumbuhan yang menghasilkan zat kimia dan dapat menghambat pertumbuhan jenis yang lain yang tumbuh bersaing dengan tumbuhan tersebut. Istilah ini diartikan sebagai pengaruh negatif dari suatu jenis tumbuhan tingkat tinggi terhadap perkecambahan, pertumbuhan, dan pembuahan jenis-jenis lainnya. Kemampuan untuk menghambat pertumbuhan tumbuhan lain merupakan akibat adanya suatu senyawa kimia tertentu yang terdapat pada suatu jenis tumbuhan (Indriyanto, 1999).
Tumbuhan juga dapat bersaing antara sesamanya dengan secara interaksi biokimia, yaitu salah satu tumbuhan mengeluarkan senyawa beracun ke sekitarnya dan dapat mengakibatkan gangguan pertumbuhan tumbuhan lainnya.
Interaksi antara gulma dan pertanaman antara lain menyebabkan gangguan perkecambahan biji, kecambah jadi abnormal, pertumbuhan memanjang akar terhambat, perubahan susunan sel-sel akar dan lain sebagainya. Persaingan yang timbul akibat dikeluarkannya zat yang meracuni tumbuhan lain disebut alelopati, senyawa-senyawa kimia yang mempunyai potensi alelopati dapat ditemukan di setiap organ tumbuhan, antara lain terdapat pada: daun, batang, akar, rhizoma, buah, biji dan umbi serta bagian-bagian tumbuhan yang membusuk. Umumnya senyawa yang dikeluarkan adalah dari golongan fenol.
Tujuan praktikum ini adalah mengetahui pengaruh faktor lingkungan terhadap perkecambahan biji, mengetahui pengaruh faktor lingkungan terhadap perkecambahan biji dengan testa yang relatif keras, dan mengetahui faktor yang menghambat perkecambahan.
3. Metodologi
Praktikum ini dilakukan pada tanggal Maret 2017 hingga tanggal April 2017 berlokasikan di Pusat Laboratorium Terpadu (PLT) UIN Syarif Hidayutullah Jakarta.
Alat yang digunakan dalam praktikum perkecambahan dan dormansi antara lain cawan petri, tabung reaksi, gelas beaker, blender, gelas ukur, pipet tetes, dan lemari es.
Bahan yang digunakan dalam praktikum ini antara lain (Phaseolus radiatus), biji saga (), kapas, akuades, H2SO4 pekat, komarin 50 ppm, kertas amplas, akar alang-alang, dan kertas saring.
Praktikum kali ini dilakukan 3 percobaan yaitu, percobaan pengaruh faktor lingkungan terhadap perkecambahan, percobaan pengaruh faktor lingkungan terhadap biji dengan kulit biji yang relatif keras, dan percobaan penghambat perkecambahan. Percobaan pertama pengaruh faktor lingkungan terhadap perkecambahan, disiapkan 5 buah cawan petri beralaskan kertas saring atau kapas. Cawan 1 dibiarkan kering, cawan 2 dibasahi dengan 15 ml aquades untuk memungkinkan biji dapat berkecambah, begitu pula cawan ke 4 dan 5. Cawan ke 3 dibasahi dengan 15 ml aquades yang telah dididhkan dan sudah mencapai suhu kamar lagi. Disiapkan pula 1 tabung reaksi berisikann 10 ml air seperti pada cawan ke 3, air mendidih yang sudah didinginkan. Ke dalam cawan 1-4 dimasukkan masing-masing 10 biji, pada cawan ke 5 dimasukkan 10 biji yang telah dibuang kulit bijinya. Ke dalam tabung reaksi setelah dimasukkan 10 biji dilapisi permukaanya dengan lapisan minyak. Semua cawan dan tabung disimpan pada suhu kamar, kecuali cawan ke 4 disimpan dalam lemari es dengan suhu 5-10˚C. Selanjutnya diamati jumlah biji yang berkecambah dalam tiap cawan/tabung selama 7 hari dan dicatat persentase perkecambahannya. Percobaan kedua pengaruh faktor lingkungan terhadap biji dengan dengan kulit biji yang relatif keras, disediakan 50 biji saga (Abrus precatorius) dibagi dalam 5 kelompok. Disediakan pula 5 pasang cawan petri beralaskan kertas saring atau kapas. Cawan 1-4 dibasahi dengan aquades sebanyak 15 ml. Pada cawan pertama dimasukkan 10 biji, pada cawan ke 2 dimasukkan 10 biji yang diasah sebagian kulit bijinya sampai tampak kotiledonnya. Pada cawan ke 3 dimasukkan 10 biji yang telah direndam dalam air mendidih dan dibiarkan tetap terendam sampai air mencapai suhu kamar. Pada cawan ke 4 dimasukkan 10 biji yang sebelumnya direndam dalam H2SO4 pekat 1-2 menit lalu segera dicuci dibawah air mengalir. Cawan ke 5 dibasahai dulu secukupnya dengan
koumarin 50 ppm baru kemudian dimasukkan 10 biji. Disimpan semua cawan petri tersebut dalam ruang gelap. diamati persentase perkecambahan dalam setiap cawan petri, dijaga kelembaban samapi jangan sampai cawan petri kering. Diamati selama 7 hari dan dihitung persentase perkecambahan. Percobaan ketiga penghambatan perkecambahan, dibuat ekstrak alang-alang dengan cara sbb (dihaluskan bagian alang-alang dengan blender, dicampurkan bagian alang-alang dengan air (aquades) dengan perbandingan sebagai berikut: bagian tumbuhan dengan air (1:3, 1,6) dan direndam selama 24 jam, setelah 24 jam disaring ekstrak alang-alang yang diperoleh dengan menggunakan saringan). Diletakkan masing-masing 10 biji kacang hijau dan kacang kedelai ke dalam cawan petri yang berbeda yang sudah diberi kertas saring/kapas. Disiram 15 ml ekstrak alang-alang kedalam cawan petri yang sudah berisi biji tersebut. Diamati perkecambahan biji-biji tersebut setiap hari, selama 7-10 hari. Ditentukan persen perkecambahannya dan diukur panjang hipokotil, epikotil, dan dihitung perbandingan hipokotil/epikotil. Dibandingkan dengan perkecambahan yang hanya disiram dengan/aquadest (kontrol).
4. Hasil dan Pembahasan
Berdasarkan pengamatan yang telah dilakukan dengan melakukan 3 percobaan yaitu pengaruh faktor
lingkungan terhadap perkecambahan, pengaruh faktor lingkungan terhadap biji dengan kulit testa yang relatif keras dan penghambat perkecambahan didapatkan hasil yang disajikan dalam bentuk tabel sebagai berikut :
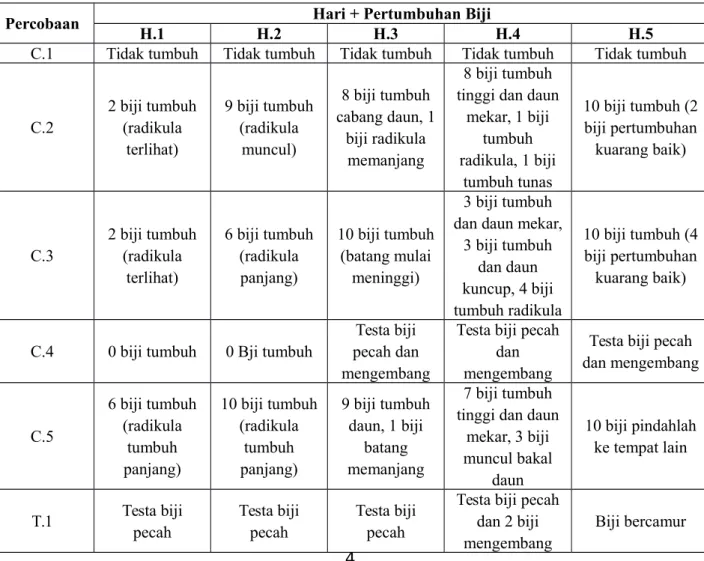
Tabel 1. Pengaruh Faktor Lingkungan Terhadap Perkecambahan
Percobaan Hari + Pertumbuhan Biji
H.1 H.2 H.3 H.4 H.5
C.1 Tidak tumbuh Tidak tumbuh Tidak tumbuh Tidak tumbuh Tidak tumbuh
C.2 2 biji tumbuh (radikula terlihat) 9 biji tumbuh (radikula muncul) 8 biji tumbuh cabang daun, 1 biji radikula memanjang 8 biji tumbuh tinggi dan daun
mekar, 1 biji tumbuh radikula, 1 biji tumbuh tunas 10 biji tumbuh (2 biji pertumbuhan kuarang baik) C.3 2 biji tumbuh (radikula terlihat) 6 biji tumbuh (radikula panjang) 10 biji tumbuh (batang mulai meninggi) 3 biji tumbuh dan daun mekar,
3 biji tumbuh dan daun kuncup, 4 biji tumbuh radikula 10 biji tumbuh (4 biji pertumbuhan kuarang baik)
C.4 0 biji tumbuh 0 Bji tumbuh
Testa biji pecah dan mengembang
Testa biji pecah dan mengembang
Testa biji pecah dan mengembang C.5 6 biji tumbuh (radikula tumbuh panjang) 10 biji tumbuh (radikula tumbuh panjang) 9 biji tumbuh daun, 1 biji batang memanjang 7 biji tumbuh tinggi dan daun
mekar, 3 biji muncul bakal daun 10 biji pindahlah ke tempat lain T.1 Testa biji pecah Testa biji pecah Testa biji pecah
Testa biji pecah dan 2 biji mengembang
Keterangan :
C.1 : 10 Biji kering tanpa aquades (suhu kamar) C.2 : 10 Biji dibasahi aquades (suhu kamar)
C.3 : 10 biji dibasahi aquades yang telah dididihkan (suhu kamar) C.4 : 10 biji dibasahi aquades (suhu lemari es)
C.5 : 10 biji dikupas kulitnya dan dibasahi aquades (suhu kamar) T.1 : 10 biji direndam aquades mendidih + minyak (suhu kamar)
Berdasarkan percobaan pengujian pengaruh faktor lingkungan terhadap perkecambahan yang telah dilakukan, didapatkan hasil pada cawan perlakuan pertama menggunakan Biji utuh, tanpa aquades dengan meletakaannya dalam suhu kamar didapatkan hasil tidak ada satupun biji yang berkecambah dimulai dari hari pertama hingga hari kelima dengan persentase keberhasilan perkecambahan sebesar 0%. Hal ini disebabkan karena biji yang disimpan dalam keadaan kering tidak dapat tumbuh karena enzim-enzim pertumbuhannya belum aktif. Perkecambahan biji tergantung pada imbibisi, penyerapan air akibat potensial air yang rendah pada biji yang kering. Air yang berimbibisi menyebabkan biji mengembang dan memecahkan kulit pembungkusnya dan juga memicu perubahan metabolik pada embrio yang menyebabkan biji tersebut melanjutkan pertumbuhan. Enzim-enzim akan mulai mencerna bahan-bahan yang disimpan pada endosperma atau kotiledon, dan nutrien-nutriennya dipindahkan ke bagian embrio yang sedang tumbuh, apabila tidak terdapat air maka biji tidak akan berimbibisi dan berkecambah (Campbell, 2002).
Perlakuan cawan kedua menggunakan Biji utuh + aquades yang disimpan di dalam suhu kamar didapatkan hasil pada hari pertama sebanyak 2 biji hingga hari kelima pertumbuhan mencapai 10 biji yang berkecambah dengan
persentase keberhasilan perkecambahan 80%. Aquades merupakan salah satu faktor yang mampu mengaktifkan enzim-enzim pertumbuhan pada biji. Biji yang ditempatkan pada suatu lingkungan yang basah maka molekul air yang ada di luar akan mulai berdifusi ke dalam biji. Ketika molekul itu sudah berhasil melalui selaput pembungkus biji sebagian diantaranya ada yang diserap sehingga menyebabkan terjadinya peristiwa imbibisi (peristiwa penyerapan air ke dalam ruangan antar dinding sel, sehingga dinding selnya akan mengembang). Sedangkan molekul air yang lainnya akan berpindah melalui membran sitoplasma yang permeabel dengan cara osmosis menuju vakuola sel-sel hidup yang ada dalam biji sehingga dari sinilah awal biji dapat berkecambah (Ferry and Ward, 1959).
Perlakuan cawan ketiga menggunakan Biji utuh + aquades yang dididihkan, dan diletakkan di dalam suhu kamar didapatkan hasil pada hari pertama sebanyak 2 biji hingga hari kelima pertumbuhan mencapai 10 biji yang berkecambah dengan persentase keberhasilan perkecambahan mencapai 60%. Tujuan direndam dalam air yang mendidih hingga mencapai suhu kamar (semula) yaitu untuk mempermudah proses imbibisi dan melunakkan permukaan biji.
Perlakuan cawan keempat menggunakan Biji utuh + aquades, dan diletakkan pada suhu 5°-10℃ didapatkan hasil tidak ada satupun biji yang berkecambah akan tetapi testa menjadi pecah dan mengembang dengan persentase keberhasilan perkecambahan 0%. Hal ini disebabkan karena pada suhu yang sangat rendah, keadaan lingkungan dianggap tidak memungkinkan untuk tumbuhan hidup. Lingkungan dianggap tidak mendukung proses perkecambahan, sehingga masa dormansi akan lebih lama.
Perlakuan cawan kelima menggunakan Biji tanpa kulit + aquades, dan diletakkan pada suhu kamar didapatkan hasil 10 biji yang berkecambah dengan presentase keberhasilan perkecambahan 100%. Kulit biji yang telah hilang membuat aquades meresap hingga kotiledon mengaktifkan enzim-enzim pertumbuhan pada biji. Suhu kamar juga mendukung kelembaban terhadap biji sehingga membuat proses dormansi lebih singkat (Elisa, 2009).
Perlakuan cawan keenam menggunakan biji utuh yang di rendam pada aquades dalam tabung reaksi dengan dilapisi lapisan minyak sayur didapatkan hasil tidak ada satupun biji yang berkecambah sejak hari pertama sampai hari kelima tetapi biji hanya mengalami pengembangan dan testa menjadi pecah dengan presentase keberhasilan perkecambahan 0%. Hal ini dikarenakan biji yang utuh membuat aquades sulit berimbibisi ke dalam biji. Lapisan minyak juga menggangu pertukaran oksigen yang dibutuhkan selama proses pertumbuhan. Kekurangan O2 dapat menyebabkan
metabolisme mengalami hambatan, karena partikel-partikel minyak sangat rapat yang menghalangi pertukaran gas. Dengan terhambatnya metabolisme, maka perkecambahan dan pertumbuhan biji ikut terhambat.
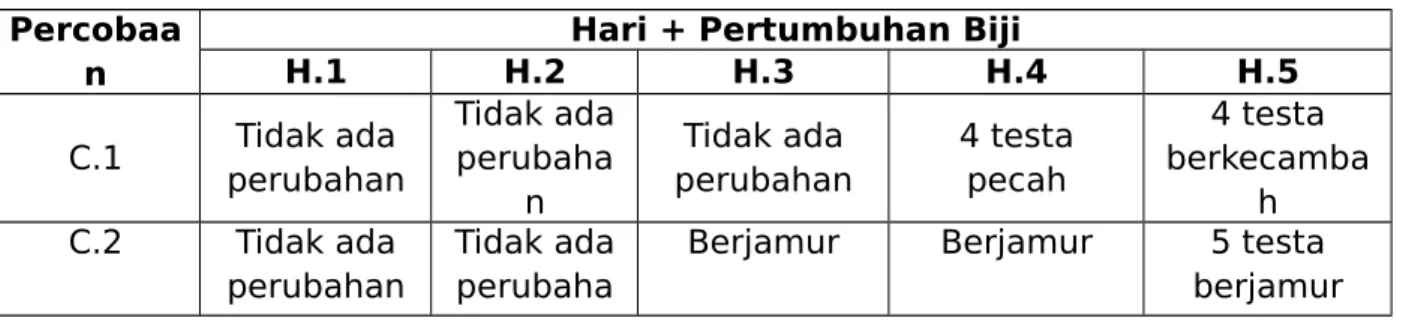
Tabel 2. Pengaruh Faktor Lingkungan Terhadap Kulit Biji Yang Relatif Keras Percobaa
n
Hari + Pertumbuhan Biji
H.1 H.2 H.3 H.4 H.5 C.1 Tidak ada perubahan Tidak ada perubaha n Tidak ada perubahan 4 testa pecah 4 testa berkecamba h C.2 Tidak ada perubahan Tidak ada perubaha
Berjamur Berjamur 5 testa
n C.3 4 testa pecah 6 testa pecah 7 testa pecah 7 testa pecah 6 testa pecah C.4 Tidak ada perubahan Tidak ada perubaha n Tidak ada perubahan 1 testa pecah 1 testa bertambah C.5 Tidak ada perubahan Tidak ada perubaha n Tidak ada perubahan 1 testa pecah testa bertambah Keterangan :
C.1 : 10 biji dibasahi aquades
C.2 : 10 biji diasah sebagian kulit biijinya dan dibasahi aquades
C.3 : 10 biji yang telah direndam air mendidih dan di biarkan terendam sampai air suhu kamar
C.4 : 10 biji yang direndam H2SO4 pekat 1-2 menit lalu dicuci dibawah air mengalir C.5 : cawan dibasahi koumarin 50 ppm kemudian dimasukkan biji
Percobaan berikutnya yaitu pengaruh faktor lingkungan terhadap kulit biji yang relatif keras yaitu menggunakan biji saga (Abrus precatorius) dengan diberikan perlakuan berbeda - beda pada tiap cawannya. Cawan pertama mendapat perlakuan biji saga yang utuh tidak diamplas. Cawan kedua mendapatkan perlakuan biji saga yang testanya diamplas dengan melakukan penggosokan menggunakan amplas yang bertujuan untuk membuat kulit yang keras dan tebal menjadi lebih tipis sehingga memudahkan imbibisi pada air. Hal ini bertujuan untuk mematahkan dormansi biji akibat kulit benih yang keras. Cawan ketiga dilakukan perendaman biji saga (Abrus precatorius) menggunakan air mendidih yang hingga air mencapai suhu kamar, tujuannya untuk memberikan suhu yang ekstrim pada biji sehingga kulit biji yang tebal dapat lebih mudah ditembus oleh kotiledon. Cawan keempat direndam dengan H2SO4 pekat selama 1-2 menit lalu dicuci menggunakan air
mengalir. Cawan kelima dibasahi dengan dengan koumarin 50 ppm. Cawan keempat dan kelima diberikan perlakuan tersebut bertujuan untuk melunakkan testa dan memudahkan perkecambahan.
Berdasarkan hasil pengamatan yang telah dilakukan, diidapatkan data bahwa tidak ada pertumbuhan maupun perkecambahan yang terjadi pada ke lima cawan yang telah diberikan perlakuan bervariasi. Cawan pertama tidak menunjukkan adanya pertumbuhan atau perkecambahan. Hal ini jelas menunjukkan kulit biji yang keras menghalangi masuknya air dan oksigen kedalam biji dan menghalangi pertumbuhan embrio meskipun biji saga di letakkan di dalam wadah yang selalu di beri air yang cukup.
Skarifikasi secara fisik yang dilakukan pada biji saga (cawan kedua) adalah dengan cara diamplas hingga sebagian kulit biji terkelupas. Hasil praktikum menunjukkan bahwa semua biji yang telah diamplas tidak mengalami perkecambahan karena pada perlakuan beberapa biji saga yang di amplas kurang maksimal, sehingga hasilnya pun tidak optimal untuk mendapatkan perkecambahan dan terdapat
pertumbuhan fungi pada biji. Hal ini tidak sesuai dengan literatur Menurut Saleh (2004), perlakuan skarifikasi dengan kertas amplas memungkinkan masuknya air ke dalam benih lebih mudah sehingga imbibisi sebagai proses awal perkecambahan benih dapat terjadi. Imbibisi dapat mengaktifkan enzim-enzim perombakan yang menjadikan karbohidrat, protein dan lemak menjadi senyawa-senyawa aktif. Cawan ketiga pengamatan biji dengan perlakuan perendaman dengan menggunakan air menididih tidak terjadi pertumbuhan. Hal ini dapat terjadi karena dormansi biji disebabkan beberapa faktor, salah satunya adalah oksigen, perkecambahan biji memerlukan O2 untuk proses pertumbuhannya (Burhan, et al 1997), sedangkan oksigen
terlarut pada air matang sudah menghilang.
Cawan keempat dan kelima, dilakukan skarifikasi fisik dan kimia yaitu dengan merendam kecambah di dalam larutan asam sulfat pekat (H2SO4) dan koumarin 50 ppm. Perendaman dengan
asam sulfat maupun koumarin efektif untuk mengurangi kandungan dalam biji keras, dengan kata lain perlakuan ini dapat menghilangkan sumbat hilum dan mengurangi kandungan kulit biji yang keras sehingga biji dapat tumbuh dengan baik. Selain itu, skarifikasi kimia juga bertujuan untuk melunakkan kulit biji sehingga biji dapat mengimbibisi air dan oksigen, juga dapat memudahkan embrio untuk tumbuh (Sutopo, 1985). Biji saga yang direndam H2SO4 dan kaumarin 50 ppm tidak ada yang tumbuh maupun retak testa. Kurangnya biji yang
mengalami perkecambahan disebabkan oleh beberapa faktor yaitu karena kulit biji belum lunak atau rusak sepenuhnya sehingga kulit biji masih bersifat impermeabilitas atau tidak dapat mengimbibisi air dan oksigen.
Tabel 3. Penghambat perkecambahaan
Keterangan :
C.1 : 10 biji + 15 ml ekstrak alang-alang 0% C.2 : 10 biji + 15 ml ekstrak alang-alang 2,5% C.3 : 10 biji + 15 ml ekstrak alang-alang 5% C.4 : 10 biji + 15 ml ekstrak alang-alang 10% C.5 : 10 biji + 15 ml ekstrak alang-alang 20%
Berdasarkan percobaan pengujian penghambatan perkecambahan dengan menambahkan ekstrak alang-alang (alelopati) dengan konsentrasi yang berbeda-beda pada setiap cawan didapatkan hasil pertumbuhan Percobaa
n
Hari + Pertumbuhan Biji
H.1 H.2 H.3 H.4 H.5 C.1 7 biji tumbuh 9 biji tumbuh 10 biji tumbuh 10 biji tumbuh 10 biji tumbuh C.2 5 biji tumbuh 5 biji
tumbuh 6 biji tumbuh
10 biji tumbuh 10 biji tumbuh C.3 1 biji tumbuh 2 biji
tumbuh 3 biji tumbuh 4 biji tumbuh 7 biji tumbuh
C.4 0 biji
tumbuh
0 biji
tumbuh 0 biji tumbuh 2 biji tumbuh 2 biji tumbuh
C.5 0 biji
tumbuh
0 biji
pada cawan yang berbeda-beda pula. Cawan pertama dengan menambahkan ekstrak alang-alang sebanyak 0% terjadi peningkatan perkecambahan biji kacang hijau pada hari pertama sebesar 7 hingga hari kelima mencapai 10 kecambah. Hal ini terjadi karena konsentrasi dari ekstrak alang-alang sebesar 0% tidak mempengaruhi sekaligus tidak menghambat pertumbuhan kecambah tersebut. Cawan kedua dengan menambahkan ekstrak alang-alang sebanyak 2,5 % didapatkan hasil perkecambahan yang hampir sama pada cawan pertama yaitu biji kacang hijau tumbuh menjadi kecambah sebanyak 10 pada hari kelima, akan tetapi terjadi perbedaan kecepatan tumbuh untuk mencapai perkecambahan maksimal, pada cawan kedua pertumbuhan maksimal baru terjadi pada hari keempat sedangkan cawan pertama pertumbuhan maksimal terjadi pada hari ketiga. Cawan ketiga dengan menambahkan ekstrak alang-alang konsentrasi sebesar 5% tetapi terjadi pertumbuhan kecambah, akan tetapi perkecambahan yang terjadi tidak sebesar pada cawan 1 dan 2, yaitu hanya 7 kecambah yang tumbuh. Cawan keempat dengan menambahkan konsentrasi ekstrak alang-alang sebesar 10% sangat mempengaruhi perkecambahan dari biji kacang hijau hal ini dapat diketahui dari jumlah kecambah yang berhasil tumbuh hanya sebanyak 2. Sedangkan pada cawan kelima dengan menambahkan konsentrasi ekstrak alang-alang sebesar 20% meneyebabkan tidak adanya pertumbuhan kecambah, hal ini disebabkan karena konsentrasi ekstrak alang-alang yang sangat besar sehingga menyebabkan
penghambatan pertumbuhan kecambah. Ekstrak
alelopati yang diberikan ke kecambah kacang hijau tidak hanya berpengaruh pada pertumbuhan tinggi tanaman, tetapi juga pada kondisi daunnya. Daun tanaman kacang hijau ada yang menjadi hitam dan mati, ada pula yang menjadi layu dan tidak segar. Menurut Odum (1998), zat alelopati yang terdapat pada tanaman alelopati memiliki mekanisme yang kompleks dalam penghambatan pertumbuhan tanaman lain, diawali kekacauan struktur pada membran plasma, penyempitan saluran membran, dan hilangnya fungsi enzim ATP-ase. Hal ini akan berpengaruh terhadap penyerapan dan konsentrasi ion dan air yang kemudian mempengaruhi pembukaan stomata dan proses fotosintesis. Hambatan lain dapat terjadi dalam proses sintesis protein, pigmen dan senyawa karbon lain, serta aktivitas beberapa fitohormon. Sebagian atau seluruh hambatan tersebut kemudian bermuara pada terganggunya pembelahan dan pembersaran sel yang akhirnya menghambat pertumbuhan dan perkembangan tanaman sasaran.
Sebagian alelopati terjadi pada tumbuhan dan dapat mengakibatkan tumbuhan disekitar penghasil alelopati tidak dapat tumbuh atau mati. Hal ini dilakukan untuk memenangkan kompetisi nutrisi dengan tanaman lain yang berbeda jenis/spesies. Oleh karena itu, alelopati dapat memiliki dampak positif bagi lingkungan, karena dapat diaplikasikan sebagai pembasmi gulma sehingga mengurangi penggunaan herbisida sintetik yang berbahaya bagi lingkungan (Alfandi et al, 2007).
Berdasarkan percobaan yang telah dilakukan dapat disimpulkan bahwa. Daftar Pustaka
Alfandi & Dukat, 2007. “Respon pertumbuhan dan produksi tiga kultivar kacang hijau (Vigna radiata L.) terhadap kompetisi dengan gulma pada dua jenis tanah”, Vol. 6, No. 1, Hal. 26-29, diakses 03 April 2017
Burhan, Walyati dkk, 1997, Buku Ajar Fisiologi Tumbuhan., Universitas Andalas. Padang
Campbell, N.A., Reece, J.B., & Mitchell, L.G. (2002). Biologi. Jilid 1. Edisi Kelima. Alih Bahasa: Wasmen. Penerbit Erlangga. Jakarta
Dwidjoseputro. 1985. Pengantar Fisiologi Lingkungan Tanaman. Gajah Mada University Press. Yogyakarta
Elisa. 2009. Dormansi. Diakses dari http://elisa.ugm.ac.id/files/yeni_wn_ratna/6L4WiASR/III-dormansi.doc. pada tanggal 04 April 2017 pukul 20.00 WIB
Ferry, J. F. dan H. S. Ward. 1959. Fundamentals of Plant Physiology. University of Wisconsin, Madison.
Indriyanto. 1999. Ekologi Hutan. Bumi Aksara. Jakarta
Lakitan, B. 2007. Dasar-Dasar Fisiologi Tumbuhan. Raja Grafindo Persada. Jakarta
Lita, Sutopo. 1985. Teknologi Benih. Rajawali. Jakarta Odum. 1998 . Ekologi Tumbuhan. Rineka Cipta. Yogyakarta
Retno, Catarina. 2012. Petunjuk Praktikum Fisiologi Tumbuhan. Universitas Sanata Dharma. Yogyakarta
Saleh, M.S., 2004. Pematahan Dormansi Benih Aren Secara Fisik Pada Berbagi Lama Ekstrasi Buah. Dalam Industri Benih di Indonesia Aspek Penunjangan Pengembangan. Jurusan Budidaya Pertanian, Fakultas Pertanian. UNTAD. Palu
Salisbury dan Ross. 1995. Fisiologi Tumbuhan Jilid 2. ITB. Bandung
Salisbury, Cleon. 1995. Fisiologi Tumbuhan Jilid 1. ITB P
Lampiran
Gambar 1. Proses Difusi menggunakan MB dan media agar (Dokumentasi Pribadi, 2017)
Gambar 2. Proses Osmosis dengan menggunakan eter Gambar 3. Proses Osmosis dengan menggunakan xilen (Dokumentasi Pribadi, 2017) (Dokumentasi Pribadi, 2017)
Gambar 4. Proses Imbibisi kacang kedelai Gambar 5. Proses Imbibisi karet gelang