PELUKAAN DAN ETILENA EKSOGEN
ARLYNY FITRI ASTUTI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
ARLYNY FITRI ASTUTI. The Expression of The Responsive Reactive
Oxygen Species Genes in Hevea Brasiliensis by Wounding and Exogenous
Ethylene Treatment. Under direction of MARIA BINTANG and TETTY
CHAIDAMSARI.
Rubber tree respons tapping and stimulation of etephon treatment as a stress
to their life. Environment stresses will occur the accumulation of reactive oxygen
species (ROS) that can result in the structural macromolecules organell cells. The
deviation of latex production due to oxidative stress which stimulated by etephon
application (exogenous ethylene) is interesting study. The etephon application
that has been used to increased the quality and quantity of latex production on
rubber tree without shattering the tree is needed to observe. The samples which
used in this research is have been tapped and stimulated by exogenous ethylene.
The aim of this research is to observe the effect of exogenous ethylene and
wounding in expression of responsive ROS genes in Clone PB260 Hevea
brasiliensis bark. Chaidamsari method used to isolating the RNA of samples, then
the qualitative and quantitative analysis needed to characterize its RNA. The
expression of responsive ROS genes observed by RT-PCR method. The
expression of responsive ROS genes is not always directly proportional to the
wounding and exogenous ethylene stimulation frequencies. The expression of
MnSOD, Cu-ZnSOD, GCLcytosolic, GCLchloroplastic, and HbAPX1 genes
increase after exogenous ethylene treatment showing that the tree is in oxidative
stress due to ROS presents. The expression of catalase gene on rubber bark
decrease, whereas HbAPX2 gene variety after exogenous ethylene treatment.
ARLYNY FITRI ASTUTI. Ekspresi Gen Responsif Terhadap Reactive
Oxygen Species pada Hevea brasiliensis Akibat Pelukaan dan Etilena Eksogen.
Dibimbing oleh MARIA BINTANG dan TETTY CHAIDAMSARI.
Penyadapan dan stimulasi etefon direspon oleh tanaman karet sebagai
cekaman bagi kehidupannya. Cekaman lingkungan akan menyebabkan akumulasi
Reactive Oxygen Species (ROS) yang dapat menghancurkan makromolekul
penyusun membran organel atau sel. Penyimpangan produksi lateks karena
cekaman oksidatif yang diakibatkan oleh stimulasi etilena eksogen menarik untuk
dikaji. Penggunaan stimulan yang telah lama dilakukan untuk peningkatan
kualitas dan kuantitas produksi lateks pada tanaman karet diharapkan dapat
sejalan tanpa merusak atau mengurangi umur produksi tanaman tanaman karet.
Sampel yang digunakan telah melalui perlakuan penyadapan dan stimulasi etilena
eksogen. Sampel diisolasi dengan metode Chaidamsari (2005) yang telah
dimodifikasi hingga didapat RNA total, kemudian dianalisis secara kuantitatif dan
kualitatif. Ekspresi gen responsif terhadap ROS diamati dengan metode RT-PCR.
Penelitian ini bertujuan mengamati ekspresi gen responsif ROS terhadap pengaruh
pemberian stimulan pelukaan dan etilena eksogen pada H. brasiliensis khususnya
klon PB260. Ekspresi gen responsif terhadap ROS tidak selalu berbanding lurus
dengan frekuensi perlakuan penyadapan dan pemberian etilena eksogen.
Ekspresi
gen MnSOD, GCLsitosolik, GCLkloroplastik, HbAPX1, dan Cu-ZnSOD
meningkat setelah diberikan etilena eksogen yang menunjukkan tanaman
mengalami cekaman oksidatif karena kehadiran ROS. Sedangkan pada gen
katalase tampak terjadi penurunan ekspresi gen setelah kulit batang distimulasi
etilena eksogen. Ekspresi gen HbAPX2 tampak bervariasi setelah aplikasi
etilena eksogen.
PELUKAAN DAN ETILENA EKSOGEN
ARLYNY FITRI ASTUTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Nama
: Arlyny Fitri Astuti
NIM
: G44104034
Disetujui
Komisi Pembimbing
Prof. Dr. drh. Maria Bintang, MS. Dr. Tetty Chaidamsari, M.Si.
Ketua Anggota
Diketahui
Dr. Drh. Hasim, DEA.
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Untaian rasa syukur penulis panjatkan kepada Alah SWT penguasa alam
semesta, karena atas segala curahan karunia-Nya penulis dapat menyelesaikan
penelitian ini. Laporan ini disusun berdasarkan hasil penelitian yang dilaksanakan
mulai Februari hingga Mei 2008 di Laboratorium Biologi Molekuler dan
Rekayasa Genetika, Balai Penelitian Bioteknologi Perkebunan Indonesia.
Terima kasih kepada semua pihak yang telah membantu dan memberikan
usulan, saran, serta kritik selama penyusunan laporan penelitian ini antara lain
kepada Prof. Dr. drh. Maria Bintang, MS. selaku pembimbing utama, Dr. Tetty
Chaidamsari, M.Si. selaku pembimbing anggota, dan seluruh staf Laboratoium
Biologi Molekuler dan Rekayasa Genetika.
Ucapan terima kasih juga penulis sampaikan kepada Bapak, Ibu, Kakak
tercinta serta sahabatku Paramitha, Firdaus PS, Miko A, dan Wiena yang
senantiasa memberikan motivasi, doa, dan kasih sayang kepada penulis. Tak lupa
penulis sampaikan terima kasih kepada rekan penelitian Alfinia, Chairunisa,
David, Fami, Resti, Yanti, dan Agustine.
Penulis berharap tulisan ini dapat bermanfaat bagi semua pihak yang
membutuhkannya demi kemajuan ilmu pengetahuan.
Bogor, September 2008
Arlyny Fitri Astuti
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Hevea brasiliensis Sebagai Komoditi Perkebunan ... 2
Klon Tanaman Karet ... 2
Biosintesis Etilena ... 3
Etefon Sebagai Pelepas Etilena Eksogen ... 4
Cekaman Oksidatif Pada Tanaman Karet ... 4
Enzim Responsif Terhadap ROS ... 5
Teknik Optimasi Suhu Annealing Dengan PCR Gradien ... 5
Reverse Transcriptase PCR... 6
BAHAN DAN METODE
Alat dan Bahan ... 6
Metode Penelitiaan ... 6
HASIL DAN PEMBAHASAN
RNA Total Kulit Batang Karet Hasil Isolasi ... 8
Konsentrasi dan Kemurnian RNA Total Kulit Batang Hasil Isolasi ... 9
Kualitas RNA Total Kulit Batang Hasil Isolasi... 10
Sintesis cDNA dan Suhu Annealing Optimal... 10
Ekspresi Gen Responsif Terhadap ROS ... 11
Pengaruh Perlakuan Terhadap Ekspresi Gen Responsif ROS pada Kulit
Batang Karet ... 11
SIMPULAN DAN SARAN ... 12
DAFTAR PUSTAKA ... 13
DAFTAR GAMBAR
Halaman
1 Tanaman karet ... 2
2 Biosintesis etilena pada tanaman... 3
3 Pembentukan etilena eksogen dari etefon ... 4
4 Degradasi membran lutoid dari tanaman karet yang mengalami KAS ... 5
5 Peran enzim GCL pada kloroplas ... 5
6 Sintesis cDNA dari poli(A) mRNA dengan RT-PCR ... 6
7 Elektroforegram contoh sampel RNA yang memiliki kontaminan DNA... 9
8 Elektroforegram contoh sampel RNA yang terdegradasi ... 9
9 Elektroforegram RNA kulit batang hasil isolasi ... 10
10 Elektroforegram PCR gradien sampel M dengan primer HbAPX1 .... ... 11
11 Elektroforegram Ekspresi gen HbAPX1 dengan visualisasi elektroforesis
gel agarosa 1% ... 12
12 Tingkat ekspresi gen katalase pada perlakuan penyadapan ... 12
13 Ekspresi gen MnSOD pada perlakuan d4 setelah aplikasi etilena eksogen .... 12
DAFTAR LAMPIRAN
Halaman
1 Tahapan penelitian ... 16
2 Pembuatan larutan sediaan ... 17
3 Elektroforegram PCR gradien gen responsif terhadap ROS ... 19
4 Hasil uji ekspresi gen responsif terhadap ROS pada kulit batang tanaman
karet klon PB 260 ... 20
5 Tingkat ekspresi gen resposif terhadap ROS pada perlakuan penyadapan ... 24
PENDAHULUAN
Karet secara keseluruhan, termasuk karet alam, merupakan kebutuhan vital yang tidak
tergantikan dalam kehidupan sehari-hari.
Walaupun jumlah produksi dan konsumsi karet alam tidak sebesar karet sintetis namun peranan karet alam tidak dapat sepenuhnya digantikan oleh bahan lain. Kelebihan yang dimiliki karet alam antara lain, memiliki daya elastis atau
daya lenting yang sempurna, memiliki
plastisitas yang baik sehingga pengolahannya mudah, mempunyai daya aus yang tinggi, tidak mudah panas, dan memiliki daya tahan yang tinggi terhadap keretakan.
Menteri Pertanian dan Ketahanan Pangan
Republik Indonesia pada tahun 2006
mengatakan bahwa pengembangan perkebunan karet termasuk salah satu agenda revitalisasi
pertanian di Indonesia. Urgensi utama
memasukkan perkebunan karet sebagai
prioritas utama nasional karena karet terbukti mempunyai peranan yang sangat penting bagi
perekonomian nasional. Perkembangan
produksi karet nasional juga akan diikuti pula oleh peningkatan penyerapan tenaga kerja yaitu sekitar 1,4 juta tenaga kerja langsung, belum lagi termasuk penyerapan tenaga kerja tidak langsung yang turut mendukung perkembangan karet Indonesia (Dirjenbun Jambi 2007).
Indonesia menargetkan peremajaan 250 ribu hektar (ha) perkebunan karet rakyat dan 50 ribu hektar pembukaan lahan karet baru mulai tahun 2007 sampai 2010 untuk menjadi produsen karet alam terbesar di dunia. Pemerintah menyediakan dana sampai 2 triliun rupiah untuk revitalisasi perkebunan karet rakyat, terutama untuk pengadaan bibit dan subsidi bunga, sehingga pembayaran bunga pinjaman petani karet nantinya hanya 10%, sedangkan sisanya ditanggung pemerintah
(Antara 2007). Optimalisasi pencapaian
perejamaan perkebunan karet rakyat seluas 250 ribu ha maupun pembukaan lahan baru seluas 50 ribu ha sampai 2010 sangat penting agar
Indonesia tidak kehilangan momentum
menguasai pasar karet alam dunia dan menjadi produsen terbesar (Antara 2007).
Pemerintah juga mengutamakan pengadaan bibit unggul untuk peremajaan karet rakyat, karena sedikitnya produsen penangkaran bibit karet (Antara 2007). Penelitian dalam bidang molekuler atau rekayasa genetika juga turut dikembangkan untuk mendapatkan tanaman karet dengan sifat-sifat yang diinginkan (Jayashree et al. 2003; Sobha et al. 2003). Usaha berbagai kalangan untuk meningkatkan
produksi lateks diantaranya adalah
pengembangan klon tanaman karet (Webster &
Baulkwill 1989; Lasminingsih et al. 1994; Sumarmadji 1999; Nurhaimi-Haris et al. 2003), aplikasi atau penggunaan stimulan seperti etefon, yaitu senyawa asam 2-kloro-etilfosfonat atau sering disingkat CEPA (Schreurs 1972; Balai Penelitian Perkebunan Sembawa 1982; Sumarmadji et al. 2004; Tistama & Siregar
2005), maupun dalam perawatan dan
pemberian nutrisi yang mendukung
pertumbuhan dan perkembangan tanaman karet (Webster & Baulkwill 1989).
Penggunaan stimulan etefon untuk
mengeksploitasi tanaman karet telah
diperkenalkan di Indonesia sejak awal tahun 1970-an. Etefon merupakan nama komersial dari stimulan etilena eksogen yang efektif untuk memacu produksi lateks dengan cara memperpanjang waktu aliran lateks. Salah satu dampak dari meningkatnya kadar etilena pada tanaman karet adalah terjadi peningkatan lama aliran lateks, aktivitas regenerasi lateks in situ, dan aktivitas metabolisme (Kuswanhadi 2005; Jetro 2007) yang akhirnya akan meningkatkan produksi lateks dari tanaman karet.
Penggunaan stimulan etilena eksogen
secara komersial berpedoman kepada dua hal, yaitu perpanjangan masa aliran lateks dan
penurunan biaya penyadapan melalui
penurunan intensitas penyadapan. Namun kenyataaannya, aplikasi stimulan disikapi oleh sejumlah perkebunan besar di Indonesia untuk
memperoleh keuntungan jangka pendek.
Hampir seluruh perkebunan karet
mengaplikasikan tanpa memperhitungkan prinsip-prinsip yang penting dalam penggunaan stimulan, akibatnya masa eksploitasi tanaman karet berkurang dari 25 tahun.
Penyadapan dan stimulasi etefon direspons oleh tanaman karet sebagai cekaman bagi kehidupannya. Cekaman lingkungan akan menyebabkan akumulasi Reactive Oxygen
Species (ROS) yang dapat menghancurkan
makromolekul penyusun membran organel atau sel. Kerusakan membran tersebut akan memicu kematian sel. Untuk mengatasi cekaman tersebut, tanaman karet meningkatkan aktivitas askorbat peroksidase (APX; EC 1.11.1.9). Enzim tersebut berperan dalam detoksifikasi ROS in vivo, dan berperan dalam ketahanan terhadap cekaman dan/atau mengatur lamanya aliran lateks (Tjoet et al. 2002). Beberapa enzim yang berperan dalam detoksifikasi ROS antara lain, Mangan Superoksida dismutase (MnSOD), Zn-Cu Superoksida dismutase (Zn-CuSOD), Glioksilatkarboligase kloroplastik
(GCLkloroplastik), Glioksilatkarboligase
sitosolik (GCLsitosolik), dan katalase.
Hevea brasiliensis (H. brasiliensis) secara
kering alur sadap (KAS) saat tingkat eksploitasi melebihi kapasitas pohon untuk meregenarasi lateks (Jacob et al. 1994). Timbulnya penyakit KAS meningkat dengan tingginya frekuensi penyayatan (Vijay Kumar
et al. 1990) dan pemberian stimulasi berlebihan
dengan menerapkan senyawa penghasil etilena seperti etefon (Brozozovska-Hanower et al. 1979; Chrestin 1989). Cekaman oksidatif telah diketahui mengubah jalur metabolisme normal di jaringan sehat dengan cara memicu rentetan proses degeneratif (Mockeries & Lashed 1994; Krishnakumar 2005). Penyimpangan produksi
lateks karena cekaman oksidatif yang
diakibatkan oleh etilena eksogen menarik untuk dikaji. Penggunaan stimulan yang telah lama dilakukan untuk peningkatan kualitas dan kuantitas produksi lateks pada H. brasiliensis diharapkan dapat sejalan tanpa merusak atau
mengurangi umur produksi tanaman.
Penelitian ini bertujuan mengamati ekspresi gen resonsif ROS terhadap pengaruh pelukaan dan pemberian etilena eksogen pada kulit batang tanaman H. brasiliensis khususnya klon PB260. Hipotesis penelitian ini, yaitu pelukaan dan aplikasi etilena eksogen akan menimbulkan cekaman pada tanaman karet yang dapat diamati melalui ekspresi gen MnSOD,
Zn-CuSOD, HbAPX1, HbAPX2,
GCLkloroplastik, GCLsitosolik, dan katalase dari kulit batang tanaman karet klon PB 260.
Hasil penelitian ini diharapkan dapat
memberikan informasi mengenai respon
tanaman karet terhadap pelukaan dan aplikasi etilena eksogen pada klon PB 260, sehingga nantinya dapat dikembangkan suatu penanda molekuler yang berguna dalam seleksi klon-klon karet berdaya hasil tinggi serta responsif terhadap aplikasi stimulan eksogen namun tahan terhadap cekaman oksidatif.
TINJAUAN PUSTAKA
Hevea brasiliensis Sebagai Komoditi
Perkebunan
Tanaman karet termasuk dalam ordo
Euphorbiales, famili Euphorbiaceae, dan
genus Hevea. Terdapat 10 spesies dalam genus
Hevea, salah satunya adalah H. brasiliensis
yang merupakan tanaman karet yang ditanam
dengan tujuan komersial (Webber &
Paardekoper 1989). Tanaman karet berasal dari bahasa latin bernama H. brasiliensis sesuai dengan daerah asalnya, yaitu Brazil (Gambar 1). Tanaman ini merupakan sumber utama bahan karet alam dunia.
Tinggi pohon H. Brasiliensis yang tumbuh liar dapat mencapai 40 meter dan tetap bertahan hidup hingga mencapai usia 100
tahun. Meskipun demikian, tinggi pohon dewasa yang terdapat di area perkebunan berkisar antara 15-25 meter dengan usia 25-35 tahun. Intensitas penyadapan lateks dan pertimbangan ekonomi merupakan faktor membedakan pertumbuhan antara tanaman karet liar dan perkebunan. Daun karet terdiri dari tangkai daun utama dan tangkai anak daun. Panjang tangkai daun utama 3-20 cm. Panjang tangkai anak daun sekitar 3-10 cm, pada ujungnya terdapat kelenjar. Biasanya ada tiga anak daun yang terdapat pada sehelai daun karet. Anak daun berbentuk eliptis, memanjang dengan ujung meruncing. Buah karet berbentuk seperti setengah bola dengan pembagian ruang yang jelas. Jumlah ruang biasanya adalah tiga dan terkadang dapat mencapai enam ruang pada satu buah. Dalam setiap ruang buah terdapat biji yang berperan penting dalam perkembangbiakan. Biji karet berukuran besar dengan berat 3.5-6.0 g, memiliki kulit keras, dan berwarna coklat kehitaman dengan bercak
berpola yang khas Ukuran biji besar dengan
kulit keras. Warnanya coklat kehitaman dengan bercak-bercak berpola yang khas.
Produk utama yang dipanen dari tanaman karet adalah lateks. Tanaman H. brasiliensis menghasilkan lateks dengan kuantitas dan kualitas yang terbaik sehingga merupakan spesies karet yang sangat menguntungkan secara komersial. Hingga saat ini tanaman karet tidak hanya digunakan sebagai penghasil lateks tetapi juga digunakan sebagai komponen perangkat rumah tangga, misalnya lemari, kursi, dan tempat tidur (Hasan 1989). Nilai tambah lain yang dimiliki tersebut menjadikan tanaman karet digunakan untuk proyek Hutan Tanaman Industri (HTI).
Gambar 1 Tanaman karet.
Klon Tanaman Karet
Tanaman yang didapat dari hasil
perbanyakan secara vegetatif atau aseksual disebut klon. Klon tanaman karet memiliki
kelebihan dibandingkan tanaman yang
dikembangkan melalui biji. Kelebihan klon antara lain, tumbuhnya tanaman lebih seragam, umur produksinya lebih cepat, dan jumlah
ACC Oksidase
lateks yang dihasilkan juga lebih banyak. Selain kelebihannya, klon tanaman karet juga memiliki kekurangan seperti perbedaan daya tahan pada setiap klon terhadap hama penyakit dan lingkungan yang dapat mempengaruhi pertumbuhan klon.
Lembaga penelitian perkebunan memiliki andil dalam seleksi dan peningkatan kualitas klon untuk perkebunan karet. Klon-klon unggul yang diharapkan memiliki sifat-sifat ideal seperti tingkat produksi lateks yang tinggi, serta keresistenan terhadap berbagai penyakit, hama, dan pengaruh angin. Selain itu, klon tanaman karet diharapkan memiliki respon yang baik terhadap stimulan dengan intensitas sadapan yang rendah, memiliki kulit murni halus serta tebal, dan memiliki kemampuan yang cepat dalam pemulihan kulit setelah
penyadapan. Pemuliaan
tanaman karet setiap tahun semakin
berkembang. Klon tanaman karet yang
memiliki keunggulan dianjurkan ditanam dalam berbagai skala. Anjuran tersebut dibuat dengan berbagai pertimbangan seperti luasnya lahan, lokasi, cara pengelolaan, ketahan klon terhadap penyakit, produksi, dan sebagainya. Klon anjuran skala besar seperti AVROS 2037, GT 1, BPM 1, dan BPM 24 dianjurkan ditanam dua jenis atau lebih klon dalan satu areal.
Perkebunan rakyat dianjurkan menanam klon AVROS 2037, BPM 1, GT 1, PR 303, dan PR 300. Klon-klon anjuran untuk skala kecil, misalnya BPM 107, PB 217, PB 260, PR 302, PR 312, dan PR 323.
Biosintesis Etilena
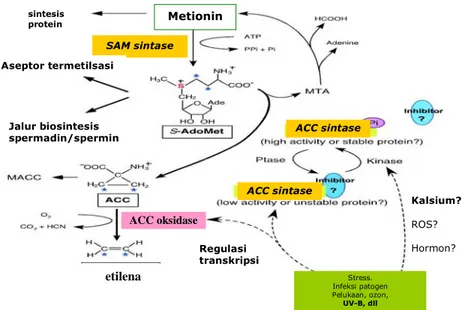
Etilena merupakan suatu hormon berwujud gas yang pada konsentrasi sangat rendah memberikan peranan besar dalam regulasi metabolisme pada tanaman. Etilena awalnya diakui sebagai hormon stres karena sintesisnya dirangsang oleh bermacam-macam tanda stres pada tanaman seperti pelukaan mekanis dan kimia, kemarau, suhu ekstrem, dan serangan patogen (Kende 1993; Johnson & Ecker 1998). Secara singkat etilena disintesis dari S-adenosilmetionin (SAM) melalui 2 tahap, yaitu
asam 1-aminosiklopropana-1-karboksilat
(ACC) sintase mengkatalisis SAM
memproduksi ACC (Gambar 2). Selanjutnya ACC dikonversi menjadi etilena melalui aksi dari ACC oksidase (Yang & Hoffman 1984). Enzim ACC sintase dan ACC oksidase secara umum dianggap sebagai enzim pembatas kecepatan di dalam biosintesis etilena (Matoo & Suttle 1991; Krishnakumar 2005). Enzim ACC sintase pada tanaman dirangsang oleh berbagai macam faktor seperti penuaan, cekaman, dan hormon tumbuhan lainnya. Pelukaan merupakan salah satu faktor umum yang merangsang produksi etilena endogenus di dalam tumbuhan (Yang & Pratt 1978) dan hampir dipastikan juga oleh rangsangan dari aktivitas ACC sintase (Watanabe et al. 2001).
Secara umum, biosintesis etilena diawali dengan pembentukan SAM dari metionin dengan bantuan SAM sintetase (EC 2.5.1.6) dengan menggunakan 1 ATP. Molekul SAM adalah suatu prekursor dalam lintasan biosintesis poliamin (spermidin atau spermin) dan donor bagi molekul-molekul selular seperti asam nukleat, protein, dan lipid.
Gambar 2 Biosintesis etilena pada tanaman (Wang et a. 2002).
sintesis protein Metionin SAM sintase Jalur biosintesis spermadin/spermin Aseptor termetilsasi Regulasi transkripsi Kalsium? ROS? Hormon? Stress. Infeksi patogen Pelukaan, ozon, UV-B, dll etilena ACC oksidase ACC sintase ACC sintase
Pengubahan SAM menjadi ACC dikatalisis
oleh ACC sintase (EC 4.4.1.14).
Metiltioadenosin (MTA) dihasilkan dalam proses pembentukan ACC dan akan digunakan kembali untuk pembentukan metionin. Hal ini menyebabkan konsentrasi metionin selular dapat tetap terjaga saat terjadi peningkatan laju biosintesis etilena (Wang et al 2002).
Tahap akhir adalah oksidasi ACC menjadi etilena yang dikatalisis oleh ACC oksidase.
Sianida akan diubah menjadi β-sianoalanin
oleh β-sianoalanin sintase (β-CAS, EC 4.4.1.9)
untuk mencegah efek toksik dari akumulasi sianida yang terbentuk pada tahap akhir. Pengaturan biosintesis etilena terjadi pada tahap pembentukan ACC oleh ACC sintase (Salisbury & Ross 1995; Jones & Woodson 1999; Wang et al 2002; Wang et al 2005). Wang et al 2002 berhipotesis, ACC sintase dapat mengalami fosforilasi secara reversible oleh suatu fosfatase atau kinase yang akan mempengaruhi derajat aktivitas dari enzim ACC sintase.
Etefon Sebagai Pelepas Etilena eksogen
Etefon merupakan nama komersial dari senyawa penghasil etilena yang efektif untuk
memacu produksi lateks dengan cara
memperpanjang waktu aliran lateks. Etefon dikenal juga dengan CEPA (asam-2-kloro-etilfosfonat). Etefon secara umum telah
terbukti dapat mendorong peningkatan
produksi lateks selama periode tertentu.
Pengaruh pemberian etefon yang
spesifik pada tanaman karet memiliki kaitan yang luas dengan reaksi-reaksi enzimatis yang kompleks (Sumarmadji et al. 2004). Etefon melepaskan gas etilena eksogen ke jaringan kulit tanaman yang berfungsi sebagai agen anti penyumbatan pembuluh lateks (Gambar 3). Etilena menstabilkan lutoid
dengan cara meningkatkan permeabilitas
membrannya. Etefon memperpanjang waktu aliran lateks dengan menunda terbentuknya sumbat pada pembuluh-pembuluh lateks dan memperluas areal drainase lateks. Berdasarkan Balai Penelitian Perkebunan Sembawa (1982) terdapat 3 cara aplikasi etefon (etilena eksogen), yaitu dioleskan etefon pada bidang sadap, dioleskan pada alur sadapan setelah kulit sisa dibuang, dan dioleskan tepat di bawah irisan sadap setelah kulit dikerok terlebih dahulu.
ClCH2-CH2-PO3H2 + H2O
pH 3.5
OCH2CH2PO3H2
OCH2CH2PO3H2 + HCl CH2=CH2 + H3PO4
Gambar 3 Pembentukan etilena eksogen dari etefon.
Cekaman Oksidatif Pada Tanaman Karet
Kerusakan yang diakibatkan oleh O2 dan
radikalnya disebut cekaman oksidatif (Erturk & Alscher 2005). Beragam cekaman baik biotik (Hammond-Kosack and Jones 1996; Snijder et
al. 1996) ataupun abiotik meningkatkan
aktivitas enzim pencarian O2. Stimulasi etilena
eksogen dan penyadapan merupakan salah satu contoh cekaman abiotik pada H. Brasiliensis. Pada H. brasiliensis cekaman yang diterima bisa disebabkan oleh pelukaan pohon karet pada saat penyadapan yang juga dapat memicu sintesis etilena. Produksi etilena di jaringan pohon karet lebih besar pada klon yang sensitif terhadap pelukaan (Sivakumaran et al. 1979).
Etilena dikenal dapat merangsang cekaman oksidatif dalam sistem biologi (Melon 1990). Beberapa ROS seperti hidrogen peroksida (H2O2), superoksida (O2-), radikal hidroksil
(OH-), dan oksigen tunggal (O2
*
) berperan sebagai molekul pembawa pesan pada berbagai macam keadaan biotik (Chamnongpol et al. 1998) dan suatu cekaman-cekaman biotik (Levine et al. 1994).
Molekul ROS turut serta dalam
perangsangan gen pertahanan patogen seperti, gen pengkode protein, akumulasi pengaturan gen dari senyawa fenil propanoat, dan gen penyandi enzim detoksifikasi ROS (Sharma & Davis 1994; Schenk et al. 2000). Tingkat cekaman oksidatif dalam suatu jaringan ditentukan oleh jumlah ROS dan keseimbangan dari enzim penghilangan toksisitas ROS seperti SOD, katalase, dan peroksidase (Apel & Hirt 2004).
Tanaman karet yang distimulasi etilena eksogen secara berlebihan akan mengalami cekaman oksidatif yang selanjutnya dapat menimbulkan penyakit KAS. Secara histologis KAS dicirikan oleh adanya koagulasi lateks dan pembentukan sel-sel tilasoid dalam pembuluh lateks (de Fay & Jacob 1989). Menurut Chrestin et al. (1989), terjadinya koagulasi dalam pembuluh lateks disebabkan oleh adanya degradasi membran lutoid oleh
senyawa ROS seperti O2-, H2O2, OH* dan QO*
selanjutnya senyawa yang terkandung dalam lutoid akan dibebaskan sehingga menyebabkan koagulasi. Faktor yang berpengaruh positif terhadap kestabilan membran lutoid adalah enzim SOD dan katalase serta senyawa tiol dan asam askorbat yang bisa menetralkan senyawa ROS tersebut (Siswanto 1994). Superoksida (O2
-) disintesis oleh NAD(P-)H oksidase pada
membran lutoid sedangkan QO* oleh
peroksidase sitosolik (Gambar 4). Superoksida secara non enzimatik membentuk OH* atau
secara enzimatik oleh SOD akan diubah
menjadi H2O2 dan selanjutnya oleh katalase
akan dinetralkan menjadi H2O dan 1/2O2 oleh
katalase (Chrestin et al. 1989; Siswanto 1994).
Gambar 4 Degradasi membran lutoid dari tanaman karet yang mengalami KAS (Siswanto 1994).
Enzim Responsif Terhadap ROS
Enzim SODs merupakan antioksidan yang penting dan jalur pertama dari pertahanan melawan cekaman oksidatif. Enzim SOD
mengkatalisis disproportionasi dari ROS
(McCord & Fridovich 1969). Berdasarkan kofaktor logam, SOD dibagi menjadi tiga kelompok utama, yaitu Cu/ZnSOD, MnSOD, dan FeSOD. Enzim Cu/ZnSOD memiliki tembaga dan seng sebagai kofaktor yang dapat ditemukan di dalam kloroplas dan sitosol. Enzim MnSOD mempunyai kofaktor mangan yang berlokasi di dalam mitokondria dan peroksisom. Sedangkan, FeSOD sebagian besar ditemukan di dalam kloroplas pada tanaman tetapi tidak ada pada hewan (Alscher et al. 2002). Enzim SOD menyebabkan dismutasi dari radikal superoksida untuk memproduksi
H2O2. Enzim ini memiliki peran yang penting
dalam menentukan konsentrasi O2
dan H2O2 pada tanaman, oleh karena itu melakukan peran kunci dalam mekanisme pertahanan melawan toksisitas radikal bebas (Bowler et al. 1992).
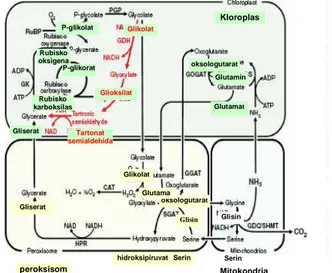
Katalase merupakan enzim tetramerik
mengandung heme yang terlibat dalam
penghilangan H2O2. Katalase pada tanaman
terlibat dalam fotorespirasi dan pembersihan
H2O2 selama β-oksidasi asam lemak pada biji
berkecambah dan juga selama cekaman abiotik lainnya (Canvin 1990; Willekens et al. 1995; Willekens et al. 1997). Katalase di dalam
peroksisom berperan dalam penetralan H2O2
yang merupakan hasil samping dari
pengubahan glikolat menjadi glioksilat yang
dikatalisis oleh glioksilat oksidase. Molekul
H2O2 akan dikatalisis menjadi molekul H2O
dan 1/2O2. Sedangkan di dalam kloroplas, 2
molekul glioksilat dikatalisis oleh GCL
menjadi tartronat semialdehida reduktase
(TSR) dan satu molekul CO2 (Gambar 5).
Pada tanaman tingkat tinggi APX dicirikan setidaknya hadir dalam 3 bentuk yang berbeda, yaitu ikatan tilakoid, stromal, dan sitosolik.
Askorbat adalah donor elektron yang
diperlukan untuk pembentukan kloroplastik dari APX. Enzim APX sangat labil jika askorbat tidak ada (Chen & Asada 1989; Miyake et al. 1991). Bentuk sitosolik dari enzim APX dikenal lebih stabil dengan adanya donor dan memiliki toleransi donor yang lebih luas.
Gambar 5 Peran enzim GCL pada kloroplas (Kebeish et al. 2007).
Teknik Optimasi Suhu Annealing dengan PCR Gradien
Metode PCR gradien merupakan salah satu jenis teknik PCR yang telah dikembangkan.
Metode ini memungkinkan perbanyakan
(amplifikasi) fragmen DNA yang diinginkan dengan mengatur program suhu annealing yang sesuai sehingga didapat suhu annealing yang optimal untuk penempelan primer. Optimasi suhu annealing tersebut bertujuan mengurangi
kesalahan penempelan primer (mismatch
primer). Proses PCR gradien dilakukan seperti
amplifikasi umumnya hanya saja kita dapat
mengaplikasikan berbagai kisaran suhu
annealing pada sekali program berjalan.
Amplifikasi DNA memerlukan dua macam oligonukleotida (primer) yang masing-masing berhibridisasi dengan salah satu utas DNA yang akan diamplifikasi pada sisi yang berbeda
dan keempat deoksinukleosida trifosfat
(dNTPs) dalam jumlah yang cukup, serta suatu
P-glikorat oksologutarat peroksisom Mitokondria Kloroplas hidroksipiruvat Gliserat Serin Serin Glisin Glisin Glikolat Glutama t Gliserat oksologutarat Glutamin Glutamat Glikolat Glioksilat Tartonat semialdehida Rubisko karboksilas Rubisko oksigena P-glikolat
DNA polimerase khusus yang tahan panas (Koolman & Rohmn 1994). Tahap-tahap dalam proses PCR meliputi tahap denaturasi pada temperatur tinggi, tahap penempelan primer pada DNA cetakan (annealing), serta tahap pemanjangan primer dengan melakukan reaksi polimerisasi nukleotida untuk membentuk rantai DNA baru (elongasi) (Saiki et al. 1988).
Reverse Transcriptase PCR
Metode RT-PCR digunakan untuk
amplifikasi sekuen yang telah diketahui dari sel atau RNA jaringan. Reaksi PCR ini dilakukan menggunakan enzim reverse transcriptase (RT) untuk mensintesis mRNA menjadi cDNA. Enzim RT yang digunakan secara komersial diisolasi dari sel yang terinfeksi oleh Moloney
murine leukimia virus (MMLV) dan Asian myleoblastosis virus (AMV). Menurut Reece
(2004), kedua enzim RT komersial tersebut memiliki fungsi yang relatif sama namun memiliki perbedaan dalam beberapa sifat, antara lain suhu dan pH optimum.
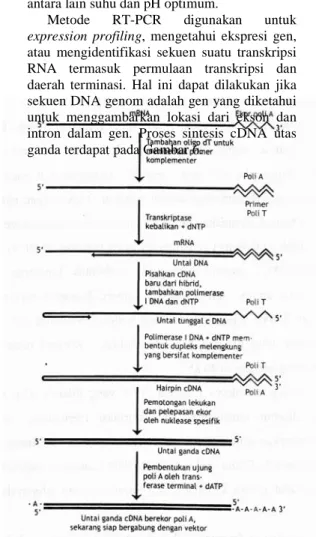
Metode RT-PCR digunakan untuk
expression profiling, mengetahui ekspresi gen,
atau mengidentifikasi sekuen suatu transkripsi RNA termasuk permulaan transkripsi dan daerah terminasi. Hal ini dapat dilakukan jika sekuen DNA genom adalah gen yang diketahui untuk menggambarkan lokasi dari ekson dan intron dalam gen. Proses sintesis cDNA utas ganda terdapat pada Gambar 6.
Gambar 6 Sintesis cDNA dari poli(A) mRNA dengan RT-PCR.
BAHAN DAN METODE Alat dan Bahan
Peralatan yang digunakan adalah sentrifus
Beckmann Allegra 64R, sentrifus Eppendorf
5417R, pipet Eppendorf, freezer Sansio -20°C, freezer Decby -40°C, spektrofotometer UV-VIS Beckmann Coulter-DU 530, mesin PCR Biometra, perangkat elektroforesis gel agarosa, autoklaf, pemanas, peralatan gelas, tabung sentrifus 15 ml, tabung mikro, pipet tip berbagai ukuran, Program ImageQuant, dan gel
doc.
Bahan-bahan yang akan digunakan yaitu,
sampel kulit batang tanaman karet, N2 cair,
PVP (polivinil pirrolidon), bufer ekstrak
(lampiran 2), dietil pirokarbonat (DEPC), β
-Merkaptoetanol, fenol, LiCl, Na-asetat,
kloroform:isoamilalkohol 24:1 (Chl:IAA),
fenol:kloroform:isoamilalkohol 25:24:1
(Ph:Chl:IAA), etanol absolut, dan etanol 70%. Sedangkan untuk sintesis first strand digunakan kit RT-PCR (Roche) yang terdiri dari bufer RT-PCR, inhibitor RNAse, dTTP,
enzim transcriptase balik dan MgCl2. Kit PCR
(Invitrogen) yang terdiri dari complete buffer, dNTP, dan Taq polimerase digunakan untuk amplifikasi DNA. Agarosa, TBE 0.5x, loading
buffer, EtBr, air molekuler, dan marker 1-kb
plus DNA ladder (Invitrogen) untuk
elektroforesis agarosa.
Metode Penelitian
Pemilihan Sampel Kulit Batang H. Brasiliensis
Sampel yang digunakan adalah tanaman karet klon PB 260 dengan sistem perlakuan eksploitasi stimulasi, yaitu sistem kombinasi antara penyadapan dan penggunaan stimulasi
atau perangsang. Sistem eksploitasi
(penyadapan) dan pemberian stimulan pada Tabel 1 (Balai Penelitian Perkebunan Sembawa 1982).
Isolasi RNA Kulit Batang H. brasiliensis
RNA kulit batang tanaman karet diisolasi dengan metode Chaidamsari et al (2005). Sebanyak 1.5 gram sampel digerus sampai
halus dengan mortar yang ditambah N2 cair
serta PVP 1,5 % kemudian dimasukkan ke dalam tabung sentrifus yang berisi 15 ml bufer ekstrak bersuhu 65°C yang telah ditambah 150
µl β-merkaptoetanol lalu dikocok dengan kuat.
Suspensi tersebut diinkubasi selama 1 jam pada suhu 65°C dan setiap 15 menit dikocok kuat.
Setelah itu suspensi didiamkan sampai mencapai suhu ruang, lalu diekstrak dengan
Chl:IAA sebanyak 15 ml, suspensi dikocok
perlahan. Campuran kemudian disentrifugasi dengan kecepatan 15300 g pada suhu 25°C selama 15 menit, selanjutnya lapisan atas supernatan dipindahkan ke dalam tabung sentrifus baru. Supernatan yang dihasilkan kemudian diekstrak kembali berturut-turut dengan 1 volume Ph:Chl:IAA, Chl:IAA, dan Chl:IAA dengan kecepatan 15300 g pada suhu 25°C selama 15 menit. Supernatan yang dihasilkan kemudian diambil lalu ditambah LiCl 10 M sampai konsentrasi 2 M dan disimpan dalam suhu 4°C selama satu malam.
Supernatan yang didiamkan satu malam
tersebut kemudian disentrifugasi dengan
kecepatan 19621 g, 4°C, selama 30 menit. Pelet hasil sentrifugasi dilarutkan dalam 750 µ l
DEPC.ddH2O kemudian diekstrak dengan 1
volume fenol pada tabung mikro 2 ml, selanjutnya disentrifugasi dengan kecepatan 15300 g selama 15 menit pada suhu 4°C. Lapisan teratas supernatan dengan hati-hati dipindahkan ke tabung mikro baru kemudian diekstrak lagi dengan Ph:Chl:IAA dan Chl:IAA secara berurutan lalu disentrifugasi dengan kecepatan 15300 g selama 15 menit pada suhu 4°C. Lapisan teratas supernatan yang dihasilkan dipindahkan, selanjutnya ditambahkan 1 volum Na-asetat 3 M pH 5,8 dan 3 volume etanol absolut, kemudian disimpan pada suhu -40°C selama 3 jam. Setelah 3 jam supernatan tersebut disentrifugasi dengan kecepatan 15300 g pada 4°C selama 30 menit. Pelet yang dihasilkan kemudian dicuci dengan etanol 70% dan disentrifugasi kembali dengan kecepatan 15300 g pada 4°C selama 5
menit, kemudian etanol dibuang. Lalu
disentrifugasi kembali 15300 g selama 2 menit kemudian dikeringanginkan. Stok RNA yang didapat
ditambah 30 µl ddH2O. Kemudian RNA
dianalisis kemurnian dan konsentrasinya.
Uji Kualitatif dan Kuantitatif RNA
Larutan RNA hasil isolasi dianalisis kualitatif dan kuantitatif untuk mengetahui konsentrasi dan kemurniannya. Uji kualitatif dilakukan dengan elektroforesis RNA dalam gel agarosa 1% menggunakan bufer TBE 0.5x untuk diidentifikasi kualitas RNA yang
dihasilkan. Selain itu, dilakukan juga
pengukuran spektrofotometri pada panjang gelombang 260/280 nm. Kemurnian RNA dilihat dari perbandingan A260/280 yang berkisar antara 1,8-2,0 (Sambrook et al. 1989).
Uji kuantitatif dilakukan dengan cara
mengukur absorbansi contoh RNA dengan menggunakan spektrofotometer UV pada panjang gelombang 260 nm. Konsentrasi RNA dihitung dengan perbandingan bahwa pada panjang gelombang 260 nm, 1 unit absorban sebanding dengan 40 µ g/ml RNA (Wilson & Walker 2000). Sehingga konsentrasi RNA bisa didapat melalui pengalian nilai absorban
dengan faktor pengenceran dan 40 µg/ml
(Sambrook et al. 1989).
Sintesis cDNA (RT-PCR)
Sintesis cDNA dilakukan untuk
mendapatkan cDNA dari RNA total hasil isolasi yang akan digunakan sebagai cetakan untuk uji ekspresi gen yang responsif terhadap ROS. Molekul RNA total dengan konsentrasi 2
µ g/ml ditambah dengan 1 µl primer oligo(dT)18
dan air molekuler hingga volumenya menjadi 13 µl. Campuran tersebut diinkubasi pada suhu 65°C selama 10 menit pada mesin PCR. Setelah 10 menit ditambahkan buffer mix yang berisi 4 µl transcriptor RT reaction buffer 5X,
0.5 µl protector RNAse inhibitor (40 U/µl), 2 µ l
dNTP, dan 0.5 µl transcriptor reverse
Kode sampel Sistem Eksploitasi dan
Pemberian Stimulan
Keterangan
A, F, G, H O s2/d2 Sadapan setengah spiral; disadap dua hari sekali
B, I, P s2/d4 Sadapan setengah spiral; disadap empat hari sekali
C, J, Q s2/d6 Sadapan setengah spiral; disadap enam hari sekali
N s2/d4 E2/tahun Sadapan setengah spiral; disadap empat hari sekali;
pemberian etefon dua kali dalam setahun*.
D, K, R s2/d4 E4/tahun Sadapan setengah spiral; disadap empat hari sekali;
pemberian etefon empat kali dalam setahun*.
E, L, M s2/d4 E12/tahun Sadapan setengah spiral; disadap empat hari sekali;
pemberian etefon dua belas kali dalam setahun*. * konsentrasi etefon 2.5%; pemberian stimulan pada kulit di bawah irisan sadap.
transcriptase (20 U/µl). Campuran diinkubasi kembali pada suhu 55 °C selama 30 menit, suhu 85 °C selama 5 menit, dan pemantapan akhir reaksi pada suhu 10 °C.
Optimasi Suhu Annealing (PCR Gradien)
Optimasi dilakukan seperti amplifikasi DNA, disiapkan primer gen resposif terhadap ROS, cDNA, dan kit PCR (Invitrogen).
Sebanyak 3 µl MW dimasukkan ke dalam
tabung gradien (7 x 5 lubang) masing-masing
ditambahkan 1 µl cDNA. Selanjutnya baris
kesatu sampai ketujuh secara berurutan
ditambahkan 1 µl primer MnSOD,
Zn-CuSOD,HbAPX1, HbAPX2, GCLkloroplastik, GCLsitosolik, dan katalase. Suhu annealing diatur pada 45 °C, 48 °C, 50 °C, 52 °C, 54 °C, dan 55 °C. Program pada mesin pengatur suhu diatur dengan suhu pre-denaturasi 94 °C selama 3 menit, denaturasi 94 °C selama 30 detik, suhu annealing selama 1 menit, pre-polimerasi 72 °C selama 1 menit, pre-polimerasi 72 °C selama 7 menit, dan pemantapan reaksi pada suhu 10 °C, program diatur sebanyak 35
siklus. Selanjutnya
hasil PCR divisualisasikan dengan
elektroforesis agarosa 1%. Pita yang memiliki kualitas terbaik pada suhu annealing tertentu akan digunakan sebagai suhu annealing pada amplifikasi gen responsif terhadap ROS.
Amplifikasi Gen Responsif Terhadap ROS
Cetakan cDNA sebanyak 1 µl dilarutkan dalam 3 µl air molekuler. Kemudian pada tabung terpisah disiapkan buffer mix yang terdiri dari 2.5 µl Buffer complete RT-PCR, 1 µl dNTP, 7 primer ROS masing-masing sebanyak 1 µl, Taq sebanyak 1 µ l, dan MW sebanyak 17.5 µ l. Buffer mix sebanyak 21 µ l ditambahkan pada larutan cDNA, kemudian diinkubasi dengan mesin PCR pada suhu pre-denaturasi 94 °C selama 3 menit, pre-denaturasi 94 °C selama 30 detik, penempelan primer 55 °C selama 1 menit, pre-polimerasi 72 °C selama 1 menit, polimerasi 72 °C selama 7 menit, dan pemantapan reaksi pada suhu 10 °C, program diatur sebanyak 35 siklus.
Pengamatan Pola Ekspresi Gen Responsif Terhadap ROS
Pola ekspresi gen responsif terhadap ROS diamati pada agarosa 0.1%. Sebanyak 0.3 gram agarosa ditimbang dan dilarutkan dalam 30 ml bufer TBE 0.5X dengan bantuan pemanas
selama satu menit pada suhu 110 0C. Setelah
larut, larutan dibiarkan pada suhu kamar sebentar hingga cukup hangat dan segera
ditambahkan EtBr sebanyak 1.5 µl kemudian
dipindahkan kedalam cetakan gel yang telah disusun bersama sisirnya. Gel ditunggu hingga memadat dan sisirnya diangkat.
Hasil amplifikasi DNA dengan primer ROS dilarutkan dengan loading buffer dengan perbandingan 1:5 dan dimasukkan ke dalam sumur yang terbentuk pada gel. Gel diletakkan dalam bak elektroforesis yang telah diisi
dengan bufer TBE 0.5X. Kemudian
dihubungkan dengan adaptor dengan potensial listrik sebesar 100 Volt. Setelah loading buffer berada + 1 cm dari dasar gel, adaptor dimatikan dan gel diangkat. Gel kemudian dimasukkan ke dalam gel doc, yaitu alat yang dilengkapi dengan UV transiluminator dan kamera digital untuk memotret gel.
Visualisasi pita hasil elektroforesis pada UV
transiluminator tampak berwarna jingga.
Ekspresi gen responsif terhadap ROS diamati dengan melihat pola pita yang dihasilkan pada
elektroforesis gel agarosa dengan
membandingkan pita yang terbentuk. Intensitas pita kemudian dikonversi ke dalam bentuk
konsentrasi (ng/ul) menggunakan program
ImageQuant.
HASIL DAN PEMBAHASAN RNA Total Kulit Batang Karet Hasil Isolasi
Isolasi RNA total dari kulit karet dilakukan dengan metode Chaidamsari (2005) yang telah dimodifikasi. Tahapan isolasi RNA total dengan metode Chaidamsari terdiri atas 3 tahap utama, yaitu pemecahan dinding sel, ekstraksi, dan pemurnian RNA. Pemecahan dinding sel berfungsi membebaskan sitoplasma dan RNA dalam sel. Nitrogen cair digunakan karena
merupakan cara yang efektif untuk
membekukan jaringan sehingga mudah
dihancurkan, selain itu kondisi suhu yang dingin dapat menjaga RNAse berada dalam keadaan tidak aktif. Pemecahan dinding sel juga dipermudah dengan penambahan EDTA
yang dapat mengikat Mg2+ dan secara tidak
langsung menginaktivasi ribonuklease karena EDTA berfungsi sebagai kofaktor yang
mengikat ion Mg2+. Sedangkan PVP dan β
-merkaptoetanol berguna menghambat kerja enzim polifenol oksidase yang menyebabkan terjadinya oksidasi senyawa fenol pada sampel. Tahap kedua, yaitu ekstraksi meliputi
penggunaan senyawa pengekstrak dan
pengendapan RNA. Pengekstrak Ph:Chl:IAA, (25:24:1) dan Chl:IAA (24:1) berfungsi memisahkan lemak, protein, glukosa, dan kontaminan DNA. Contoh sampel RNA yang terkontaminasi DNA dapat dilihat dari hasil
Pengendapan RNA dilakukan dengan penambahan sodium asetat dan etanol absolut. Tahap selanjutnya merupakan pemurnian RNA dengan penambahan LiCl 8 M dan pencucian dengan etanol 70%. Isolasi harus dikerjakan secara hati-hati karena RNA sangat sensitif terhadap panas dan keberadaan RNAse dapat mendegradasi RNA. Pada visualisasi, agarosa sampel RNA yang terdegradasi tampak
smear (Gambar 8). Kontaminasi RNAse dapat
dihindari dengan cara merendam alat-alat dan pereaksi yang akan digunakan dalam DEPC 0.1% yang merupakan inhibitor RNAse. Perendaman alat-alat dan pereaksi dilakukan semalaman kemudian disterilisasi dengan autoklaf untuk menonaktifkan kerja DEPC yang diduga bersifat karsinogen.
Gambar 7 Elektroforegam contoh sampel RNA yang memiliki kontaminan DNA.
Gambar 8 Elektroforegram contoh sampel RNA yang terdegradasi.
Konsentrasi dan Kemurnian RNA Total Kulit Batang Hasil Isolasi
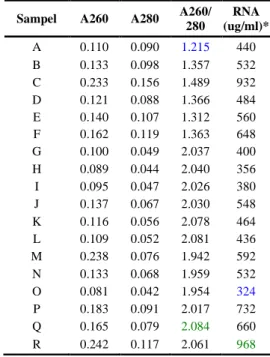
Uji kuantitatif dengan spektrofotometer UV pada panjang gelombang 260 nm dan 280 nm dapat diamati pada Tabel 2. Konsentrasi RNA
hasil isolasi berdasarkan pengukuran
spektrofotometer pada panjang gelombang 260 nm, nilai 1 unit absorban sebanding dengan 40
µg/ml RNA (Wilson & Walker 2000).
Berdasarkan Sambrook et. al (1989)
konsentrasi RNA didapat dari perkalian nilai absorban dengan faktor pengenceran dan 40
µg/ml.
Konsentrasi RNA tertinggi hasil isolasi
yang didapat adalah 968 µg/ml pada sampel R
dan terendah sebesar 324 µg/ml pada sampel
O. Hasil konsentrasi RNA dari isolasi dapat
dipengaruhi beberapa faktor, yaitu kehalusan sampel (hasil gerusan), pengocokan, dan kontaminasi. Sampel kulit batang sebaiknya digerus hingga sangat halus (seperti tepung)
karena kehalusan sampel tersebut akan
mempermudah RNA terekstrak lebih banyak. Pengocokan sampel dengan bufer ekstrak harus dilakukan dengan kuat agar ekstraksi RNA optimal.
Nilai rasio 260/280 yang didapat pada RNA kulit karet hasil isolasi berkisar antara 1.215 hingga 2.084. Nilai rasio 260/280 pada sampel A, B, C, D, E, dan F berkisar antara 1.215 hingga 1.489 merupakan nilai yang memiliki kemurnian RNA kurang tinggi. Berdasarkan Sambrook et. al (1989), nilai rasio 260/280 RNA kurang dari 1.8 menunjukkan kontaminasi dari protein. Konsentrasi dan kemurnian RNA jaringan kulit batang karet yang tinggi cukup sulit didapat dalam isolasi karena terdapat kandungan polisakarida yang tinggi pada tanaman berkayu (Couch & Fritz 1990).
Sampel yang lain pada Tabel 2 memiliki rasio 260/280 yang cukup tinggi antara 1.942 hingga 2.017. Menurut Sambrook et al. 1989, RNA hasil isolasi dikatakan murni apabila rasio 260/280 diantara 1.8 dan 2.0. Holme & Peck (1993) menyatakan, nilai rasio 260/280
Keterangan:
260 = Panjang gelombang untuk konsentrasi RNA 280 = Panjang gelombang untuk konsentrasi protein 260/280 = Kemurnian RNA dari kontaminan protein
* = Konsentrasi RNA hasil perhitungan
Sampel A260 A280 A260/
280 RNA (ug/ml)* A 0.110 0.090 1.215 440 B 0.133 0.098 1.357 532 C 0.233 0.156 1.489 932 D 0.121 0.088 1.366 484 E 0.140 0.107 1.312 560 F 0.162 0.119 1.363 648 G 0.100 0.049 2.037 400 H 0.089 0.044 2.040 356 I 0.095 0.047 2.026 380 J 0.137 0.067 2.030 548 K 0.116 0.056 2.078 464 L 0.109 0.052 2.081 436 M 0.238 0.076 1.942 592 N 0.133 0.068 1.959 532 O 0.081 0.042 1.954 324 P 0.183 0.091 2.017 732 Q 0.165 0.079 2.084 660 R 0.242 0.117 2.061 968 RNA DNA Smear
Tabel 2 Hasil pengukuran konsentrasi RNA dengan spektrofotometer
A B C D E F
G H I J K L lebih dari 2.0 menunjukkan masih terdapatnya
kontaminan DNA dalam larutan hasil isolasi. Namun kontaminasi DNA dapat dibersihkan dengan perlakuan DNAse.
Kontaminasi polisakarida dan DNA pada sampel RNA hasil isolasi juga mengakibatkan tidak akuratnya pengukuran jumlah konsentrasi (Sambrook et al. 1989). Ketidakakuratan
pengukuran konsentrasi karena
spektrofotometer UV pada panjang gelombang 260 nm mengukur RNA dan DNA (Sambrook
et al. 1989) secara total sehingga kontaminasi
DNA pun terbaca. Oleh karena itu diperlukan konfirmasi lebih lanjut untuk mengetahui
konsentrasi RNA yang sebenarnya
menggunakan visualisasi dengan gel agarosa.
Kualitas RNA Total Kulit Batang Hasil Isolasi
Analisis kualitatif RNA total hasil isolasi
diamati menggunakan elektroforesis gel
agarosa 1 %, Molekul RNA total yang diperoleh dalam proses isolasi ini mewakili 3 macam RNA yang terdapat di dalam jaringan tanaman, yaitu rRNA, mRNA, dan tRNA. Ribosomal RNA merupakan jenis RNA terbanyak di dalam suatu jaringan tanaman, yaitu mencapai 80-85% dari total RNA, sedangkan mRNA sekitar 1-5%, dan sisanya adalah tRNA (Sambrook et al. 1989). Ribosomal RNA paling banyak terkandung pada RNA total, yaitu molekul rRNA 23S dan 16S pada prokariot serta 18S dan 28S pada eukariot (Sambrook et al. 1989; Wilson & Walker 2000).
Elektroforesis gel agarosa 1% dilakukan untuk mengetahui kualitas RNA yang diisolasi, selain itu juga digunakan sebagai kontrol pada uji ekspresi. Penggunaan konsentrasi RNA dalam jumlah yang sama (250 ng) untuk setiap
sampel pada elektroforesis gel agarosa
bertujuan mengetahui kesamaan kualitas
intensitas masing-masing sampel. Intensitas
pita RNA yang dihasilkan dapat
mengkonfirmasi nilai konsentrasi hasil
perhitungan dengan spektrofotometer sehingga diketahui konsentrasi RNA hasil isolasi yang sebenarnya.
Hal ini tampak pada sampel B yang pada visualisasi dengan gel agarosa (Gambar 9) memiliki pita lebih tebal dibandingkan pita
sampel lainnya. Namun berdasarkan
pengukuran spektrofotometer (Tabel 2)
memiliki konsentrasi yang lebih rendah.
Konsentrasi RNA sampel B, yaitu 532 µg/ml
sedangkan sampel C sebesar 932 µg/ml.
Sampel RNA A, C, E dan F tampak memiliki intensitas yang sama dalam hal ketebalan dan ketegasan pita. Sampel B tampak memiliki
ketebalan pita 2 kali lebih tinggi dibandingkan sampel lain pada Gel 1, sehingga RNA yang diperlukan untuk sintesis cDNA setengah kali dari sampel lain. Perbedaan ketebalan pita ini menunjukkan konsentrasi RNA yang beragam pada masing-masing sampel, hal ini perlu diperhatikan karena akan mempengaruhi hasil uji ekspresi.
Pita sampel pada Gel 2 dan 3 relatif memiliki intensitas yang lebih seragam satu sama lain. Sehingga dapat disimpulkan
konsentrasi sampel RNA dengan
spektrofotometer UV pada panjang gelombang 260 nm sesuai. Hal ini karena intensitas pita yang dihasilkan merupakan visualisasi dari jumlah konsentrasi yang sama dari
masing-masing sampel (250 ng). Penggunaan
konsentrasi RNA pada uji ekspresi dengan metode RT-PCR memerlukan konsentrasi RNA
(cetakan) yang sama karena akan
mempengaruhi intensitas pita yang terbentuk.
Gel 1
Gel 2
Gel 3
Gambar 9 Elektroforegram RNA kulit batang hasil isolasi. A, F, G, H, O (d2); B, I, P (d4); C, J, Q (d6); N (d4/E2); D, K, R (d4/E4); E, L, M (d4/E12).
Sintesis cDNA dan Suhu Annealing Optimal
Metode RT-PCR digunakan dalam
penelusuran ekspresi gen atau mengidentifikasi sekuen suatu transkripsi RNA, termasuk permulaan transkripsi dan daerah terminasi. Reaksi RT-PCR memerlukan mRNA sebagai cetakan untuk disintesis menjadi cDNA. Molekul RNA tidak stabil sehingga diperlukan sintesis cDNA untuk keperluan analisis jangka
panjang karena cDNA dapat disimpan.
Molekul RNA total yang dijadikan cetakan mengandung 1-5% mRNA yang digunakan oleh ribosom untuk melangsungkan translasi informasi genetik menjadi urutan asam amino protein. Urutan mRNA bersifat komplementer dengan pesan genetik yang terkandung di
dalam potongan spesifik untai cDNA
(Lehninger 1994).
M N O P Q S
28S 18S
Penelitian ini menggunakan kit dengan merek dagang Roche untuk sintesis mRNA menjadi cDNA. Reaksi dimulai dengan penambahan primer oligo(dT). Primer ini akan berpasangan dengan adenin pada mRNA (ekor poli A). Komponen nukleotida (dNTPs) dengan bantuan reverse transciptase berpasangan dengan basa komplemennya pada mRNA sehingga terbentuk utas pertama cDNA. Proses selanjutnya mRNA dipisahkan dari hibrid (mRNA-cDNA) dengan cara mendegradasi
mRNA menggunakan enzim RNAseH.
Fragmen mRNA yang terbentuk berperan sebagai primer pada proses sintesis utas kedua
dibantu dengan enzim polimerase dan
nukleotida (dNTPs). Utas kedua cDNA masih berupa fragmen-fragmen cDNA, kemudian dihubungkan satu sama lain dengan T4 DNA ligase (Cowell 1998), yang akan membentuk ikatan fosfodiester antara gugus 3’fosfat dengan ujung 5’ hidroksi (Lehninger 1994).
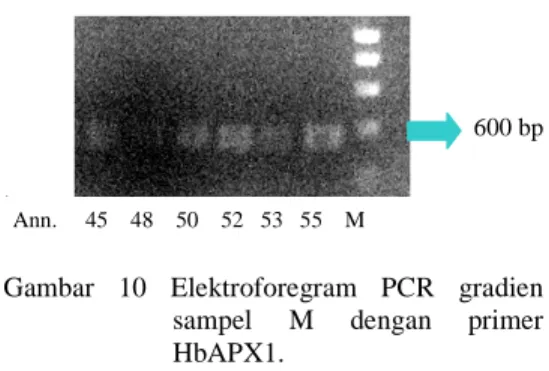
Molekul cDNA hasil sintesis digunakan sebagai cetakan untuk optimasi suhu annealing menggunakan PCR gradien, selanjutnya dilakukan amplifikasi DNA menggunakan primer gen responsif terhadap ROS. Optimasi
suhu annealing bertujuan mengurangi
kesalahan penempelan primer. Pita DNA yang paling tegas dan tebal pada Gambar 10, yaitu sampel dengan pengaturan annealing 55 °C. Hasil optimasi annealing dengan primer GCLkloroplastik, GCLsitosolik, Cu-ZnSOD, katalase, dan HbAPX2 tidak menunjukkan pita DNA. Hal ini dimungkinkan karena Tm primer yang terlalu rendah hingga pada kisaran suhu annealing yang diatur tidak terjadi
amplifikasi cDNA dengan primernya
(Lampiran 3). Sampel MnSOD pada annealing 55°C memiliki intensitas pita yang paling kuat. Selanjutnya, hasil optimasi suhu
annealing 55°C dipakai untuk RT-PCR ketujuh
primer gen responsif terhadap ROS.
600 bp
.
Gambar 10 Elektroforegram PCR gradien
sampel M dengan primer
HbAPX1.
Ekspresi Gen Responsif Terhadap ROS
Pada penelitian ini dilakukan uji ekspresi menggunakan teknik RT-PCR. Sampel yang diuji merupakan sampel kulit batang karet yang
diberi perlakuan penyadapan dan stimulasi etilena eksogen. Molekul cDNA hasil sintesis selanjutnya diamplifikasi dengan primer gen responsif terhadap ROS. Molekul DNA hasil RT-PCR selanjutnya dielektroforesis pada agarosa 1%.
Tingkat ekspresi gen ROS diamati melalui perbedaan intensitas pita yang dihasilkan oleh masing-masing sampel pada gel agarosa. Intensitas pita berbanding lurus dengan ekspresi gen. Intensitas pita hasil elaktroforesis
dikuantifikasi dalam satuan konsentrasi (µg/ml)
menggunakan program ImageQuant. Program tersebut membandingkan piksel pita sampel dengan piksel standar (marker yang telah diketahui konsentrasinya) sehingga didapat konsentrasi pita sampel.
Pita DNA yang dihasilkan pada Gambar 11
merupakan pita DNA hasil RT-PCR
menggunakan primer spesifik HbAPX1,
ukuran pasangan basa sesuai dengan ukuran yang diharapkan, yaitu sebesar 348 bp. Perbedaan intensitas dan konsentrasi pita gen HbAPX1 pada setiap sampel menunjukkan tingkat ekspresi yang berbeda. Sampel F tidak mengekspresikan gen HbAPX1 sedangkan sampel B dan R memiliki intensitas pita yang sangat kuat, hal ini menunjukkan tingginya ekspresi gen HbAPX1 .
Elektroforegram ekspresi gen responsif terhadap ROS lebih lengkap terdapat di lampiran 4. Ekspresi gen MnSOD tinggi pada perlakuan aplikasi etilena eksogen. Gen GCLsitosolik dan GCLkloroplastik cenderung berekspresi rendah apapun perlakuan yang diberikan.
Pengaruh Perlakuan Terhadap Ekspresi Gen Responsif ROS pada Kulit Batang
Karet
Pengaruh penggunaan stimulan terhadap ekspresi gen ROS pada penelitian ini diamati dari hubungan konsentrasi pita DNA hasil RT-PCR dengan perlakuan yang diberikan. Ekspresi gen HbAPX2 relatif tinggi apapun
perlakuannya. Ekspresi gen katalase
cenderung tinggi pada aplikasi etilena eksogen 12 kali per tahun dan penyadapan setiap 6 hari setelah 92 hari pembukaan, namun tidak berekspresi selama 2 minggu setelah pembukaan pertama (Lampiran 5). Gen Cu-ZnSOD tidak menunjukkan ekspresi apapun pada bulan ke-2 dan 3 setelah penyadapan pertama, tetapi berekspresi rendah pada dua minggu pertama dimulainya penyadapan.
Menurut Tristama & Siregar (2005), etilena eksogen meningkatkan aktivitas metabolisme dalam sel pembuluh lateks. Respon klon karet
400 bp m A B C D E F Perlakuan d/2 d/4 d/6 d/4, d/4, d/2 4/y 12/y Hari ke- Pembukaan/E 0 0 0 0/0 2/0 4/0
M N O P Q R m d/4, d/4, d/2 d/4 d/6 d/4, 12/y 2/y 4/y 68/2 68/2 92 92 92 92/23 m G H I J K L d/2 d/2 d/4 d/6 d/4, d/4, 4/y 12/y 10 14 14 14 14/11 14/11 0 20 40 60 80 100 120 0 10 20 30 40 50 60 70 80 90 100
Waktu Penyadapan (Hari ke-)
E k s p re s i G e n C a ta la s e d2 d4 d6
Gambar 12 Tingkat ekspresi gen katalase
pada perlakuan penyadapan.
terhadap pemberian etilena eksogen umumnya akan mencapai puncaknya pada pada 5-6 jam setelah aplikasi.
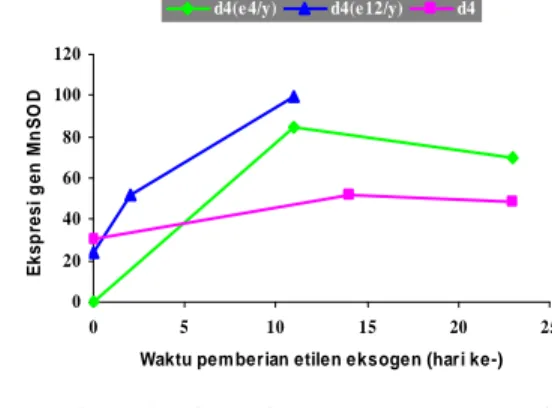
Ekspresi gen katalase tampak terjadi penurunan setelah kulit batang distimulasi etilena eksogen (Gambar 12). Sedangkan MnSOD meningkat setelah diberikan etilena eksogen (Gambar 13), hal ini terjadi pula pada gen GCLsitosolik, GCLkloroplastik, HbAPX1, dan Cu-ZnSOD (Lampiran 6). Ekspresi gen HbAPX2 tampak bervariasi pada aplikasi etilena eksogen E4/y dan E12/y.
Stimulasi etilena eksogen yang berlebihan akan dianggap sebagai cekaman bagi tanaman
hingga senyawa toksis ROS seperti,
superoksida dan radikal hidroksil hadir sebagai pemberi pesan keadaan yang dialami oleh tanaman tersebut. Enzim HbAPX1 hadir untuk menetralisir toksisitas yang ada dengan diaktivasi oleh senyawa tiol (Chrestin 1989; Chamnongpol et al. 1998). Menurut Niar et al. (2004), konsentrasi tiol semakin turun dengan adanya perlakuan etilena eksogen.
Fungsi enzim yang berbeda-beda dalam
menghadapi ROS mengakibatkan tingkat
ekspresi gen responsif terhadap ROS beragam
pada berbagai perlakuan. Seperti telah
disebutkan sebelumnya bahwa tingkat cekaman oksidatif dapat ditentukan dari jumlah ROS
seperti superoksida, peroksida, dan radikal hidroksil. Oleh karena itu,
Gambar 13 Ekspresi gen MnSOD pada perlakuan d4 setelah aplikasi etilena eksogen.
keseimbangan aktifitas enzim SOD, APX, dan katalase sangat penting untuk menekan level toksisitas ROS di dalam sel. Saat aktifitas katalase rendah di tanaman, aktifitas enzim lain, yaitu APX akan meningkat (Apel & Hirt 2004).
SIMPULAN DAN SARAN
Simpulan
Ekspresi gen MnSOD, GCLcsitosolik, GCLkloroplastik, HbAPX1, dan Cu-ZnSOD meningkat setelah diberikan etilena eksogen yang menunjukkan tanaman karet tersebut mengalami cekaman oksidatif karena kehadiran ROS. Sedangkan pada katalase tampak terjadi penurunan ekspresi gen setelah kulit batang distimulasi etilena eksogen, karena peningkatan aktifitas APX akan menurunkan aktifitas katalase. Ekspresi gen HbAPX2 tampak bervariasi setelah aplikasi etilena eksogen.
Saran
Uji Ekspresi gen responsif terhadap ROS pada lateks dan analisis parameter fisiologi lateks diperlukan agar diperoleh marka tanaman karet budidaya yang berdaya hasil lateks tinggi namun tahan terhadap cekaman. Gambar 11 Elektroforegram ekspresi gen HbAPX1 dengan visualisasi elektroforesis gel agarosa 1%.
0 20 40 60 80 100 120 0 5 10 15 20 25
Waktu pem berian etilen eksogen (hari ke-)
E k s p re s i g e n M n S O D
d4(e 4/y) d4(e 12/y) d4
E k sp re si G en K at al as e
DAFTAR PUSTAKA
Apel K, Hirt H. 2004. Reactive oxygen spesies: metabolism, oxidative stress, and signal transduction. Annual Review Plant Biology 55:373-399.
Asada K. 2006. Production and scavenging of reactive oxygen species in chloroplasts and their functions. Plant Physiology 141:391-396.
Bleecker AB, Kende H. 2000. Ethylene: a
gaseous signal molecule in plants
[abstract]. Di dalam: Annual Review Cell
Division Biology; Wisconsin. hlm 16. abstr
no PMID: 11031228.
Budiman AFS. 2005. Perkembangan global karet alam dan tantangan bagi Indonesia.
Warta Perkaretan 24:1-7.
Chaidamsari T. 2005. Biotechnology for cacao pod borer resistance in cacao plant research international [tesis]. Netherlands: Wagenigen University.
Farieh Y. 2007. Isolasi dan uji ekspresi gen proteinase inhibitor (PIN) dari buah Kakao (Theobroma cacao L.) [skripsi]. Bogor:
Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor.
Heldt HW. 2005. Plant Biochemistry Third
Edition. USA: Elsevier.
Jetro NN, Simon GM. 2007. Effects of 2-chloroethylphosponic acid formulations as yield stimulants on Hevea brasiliensis. Afr
J Biotechnol 6:523-528.
Jayashree R et al. 2003. Genetic transformation and regeneration of rubber tree (Hevea
brasiliensis Muell. Arg) transgenic plants
with a constitutive version of an anti-oxidative stress superoxide dismutase gene. Plant cell 22: 201-209.
Jones ML, Woodson WR. 1999. Differential expression of three members of the 1-aminocyclopropane-1-carboxylatesynthase gene family in carnation. Plant Physiol 19:755-764.
Innis MA, Gelfand DH. 1990. PCR Protocol a
Guide to Method and Application. London:
Academic.
Jithesh MN, Prashanth SR, Sivaprakash KR, Parida AK. 2006. Antioxidative response mechanisms in halophytes: their role in stress defence. Journal of Genetic 85:237-254.
Kebeish R et al. 2007. Chloroplastic
photorespiration bypass increases
photosynthesis and biomass production in
Arabidopsis thaliana. Nature
Biotechnology 10:1038-1049.
Krishnakumar R, Mathew R, Sreelatha S, Jacob J. 2005. Ethylene and oxidative stress in
Hevea Brasiliensis. India: Kottayam.
Lasminingsih et al. 1994. Deskripsi Klon Karet
Anjuran pada Tanaman Muda.
Palembang: Balai Penelitian Sembawa. Mathooko FM, Tsunashima Y, Kubo Y, Inaba
A. 2004. Expression of a
1-aminocyclopropane-1-carboxylate (ACC) oxidase gene in peach (Prunus persica L.) in response to treatment with carbodioxide and 1-methylcyclopropene: possible role of ethylene. Afr J Biotechnol 3:497-502. Mesquita AC, Oliveira LEM de, Mazzafera P,
Del, Delú-Filho N. 2006. Anatomical characteristic and enzymes of the sucrose metabolism and their relationship with latex yield in the rubber tree (Hevea
brasiliensis Muell. Arg.). Braz J Plant Physiol 18:263-268.
Rapley R. 1988. Polymerase chain reaction. Di dalam; Rapley R dan Walker JM, editor.
Molecular Biomethods Handbook. New
Jersey: Human press. hlm 305-316. Saiki et al. 1998. Primer directed enymatic
amplification of DNA with a termostable DNA polymerase. Sciences 239:487-491.
Salisbury FB, Ross CW. 1995. Fisiologi
Tumbuhan Jilid 3. R. Lukman dan
Sumaryono, penerjemah. Bandung:
Penerbit ITB. Terjemahan dari: Plant
Phsiology, 4th Edition.
Sambrook et al. 1989. Molecular Cloning A
Laboratory Manual. New York: Cold
Spring Harbour.
Schreurs J. 1972. Black thread disease, control measures, and yield stimulation in Hevea
brasiliensis in Liberia [tesis]. Netherlands:
Communications Agricultural,
Wageningen University.
Siswanto. 1994. Mekanisme fisiologis yang berkaitan dengan produksi lateks Hevea
brasiliensis. Buletin Bioteknologi
Perkebunan 1:23-29.
Slesak I, Haldas W, Slesak H. 2006. Influence of exogenous carbohydrates on superoxide dismutase activity in Trifolium repens L.
Explants cultured in vitro. Acta Biologica
Cracoviensia series Botanica 48:93-98.
Sobha S et al. 2003. Genetic transformation of
Hevea brasiliensis with the gene coding
for superoxide dismutase with FMV 34S promoter [research communications]. Cur
Science 85:1767-1773.
Sumarmadji. 1999. Kajian variasi musiman respon karakter fisiologis dan hasil lateks tanaman karet (Hevea brasiliensis Muell.
Arg.) terhadap stimulasi etilena [disertasi].
Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Sumarmadji, Tistama R, Siswanto. 2004. Protein-protein spesifik yang diinduksi oleh etefon pada beberapa klon tanaman karet. J Pnlit Krt 22:57-69.
Tistama R, Siregar THS. 2005. Perkembangan penelitian stimulan untuk pengaliran lateks
Hevea brasiliensis. Wrt Perkrt 24:45-57.
Vranova E, Inze D, Breusegem F. 2002. Signal
transduction during oxidative stress.
Journal of Experimental Botany
53:1227-1236.
Wang KLC, Li H, Ecker JR. 2002. Ethylene biosynthesis and signaling networks. Plant
Cell 14:131-151.
Wang NN, Shih MC, Li N. 2005. The GUS reporter-aided analysis of the promoter activities of Arabidopsis ACC synthase genes AtACS4, AtACS5, and AtACS7 induced by hormones and stresses. J Exp
Bot 56:909-920.
Wilson K, Walker J. 2000. Principles And
Techniques Of Practical Biochemistry.
United Kingdom: Cambrige University.
Lampiran 1 Tahapan penelitian
Isolasi RNA total kulit batang yang diberi perlakuan
Sintesis cDNA
(RT-PCR)
Amplifikasi gen responsif terhadap ROS dengan PCR
Pengamatan Ekspresi gen responsif terhadap ROS
Optimasi Suhu Annealing Primer (Gradient PCR)
Analisis kuantitatif (Spektrofotometer UV) dan
kualitatif (Elektroforesis agarosa) RNA total
Elektroforesis dengan gel agarosa 1%
Pengukuran konsentrasi pita DNA
hasil elektroforesis dengan
Program ImageQuant
Perbandingan konsentrasi pita
DNA dengan waktu pemberian
Lampiran 2 Pembuatan larutan sediaan
Natrium
Lanjutan lampiran 2
Bufer ekstraksi RNA. (50 mL):
CTAB 10%
10 mL
EDTA 0.5 M pH 8.0
2 mL,
tris-HCl 1M pH 8.0
5 mL,
NaCl 5 M
20 mL
ddH
2O DEPC
13 mL
Bufer TBE 5X (500 mL):
Tris-Base
27 gram
Asam borat
13.75 gram
EDTA 0.5 M pH 8.0
10 mL
Lampiran 3 Elektroforegram PCR gradien gen responsif terhadap ROS
Ann. 45 48 50 52 53 55 M 45 48 50 52 53 55
Sample M
35 siklus
MnSOD & Cu/Zn - SOD
Ann. 45 48 50 52 53 55 M 45 48 50 52 53 55 M 45 48 50 52 53 55
Sample M
35 siklus
GCLkloroplastik, GCLsitosolik, & HbAPX 2
Ann. 45 48 50 52 53 55 M