PENAPISAN MIKROB PENDEGRADASI
2-(3-BENZOILFENIL)-PROPIONITRIL DAN KARAKTERISASI NITRILASE
DARI ISOLAT TERPILIH
DEWI SUPARIASIH
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
2
ABSTRAK
DEWI SUPARIASIH. Penapisan Mikrob Pendegradasi
2-(3-Benzoilfenil)-Propionitril dan Karakterisasi Nitrilase dari Isolat Terpilih. Dibimbing oleh
I MADE ARTIKA dan BAMBANG SUNARKO.
Nitril merupakan kelompok senyawa yang toksik karena mengandung gugus
CN dalam strukturnya. Senyawa tersebut bersifat karsinogenik, teratogenik, dan
mutagenik, sehingga pengetahuan tentang biodegradasi nitril dinilai sangat
penting. Senyawa nitril dapat didegradasi dengan tiga macam enzim, yaitu
nitrilase (EC 3.5.5.1), NHase (nitril hidratase) (EC 4.3.2.84), dan amidase (EC
3.5.1.4). Nitrilase akan mendegradasi nitril menjadi asam karboksilat dan amonia.
Penelitian ini bertujuan mendapatkan isolat mikrob yang dapat menghasilkan
nitrilase dan juga bertujuan mengkarakteristik nitrilase dari isolat yang terpilih.
Isolat yang terpilih setelah proses penapisan, yaitu isolat yang mempunyai
aktivitas enzim tertinggi dan dapat tumbuh baik dalam asetonitril ialah TPIK
2000. TPIK 2000 yang ditumbuhkan memiliki waktu generasi (td) selama 15 jam
dan konstanta laju pertumbuhan (µ) sebesar 0,0476 jam
-1. Penentuan karakteristik
enzim yang meliputi pH, suhu, Km, dan Vmaks dilakukan dengan menentukan
aktivitas enzim dalam sel utuh. Enzim yang didapat dari sel TPIK 2000 memiliki
suhu dan pH optimum bagi aktivitasnya pada suhu 25 °C dan pH 7,2 dengan
aktivitas enzim masing-masing sebesar 1,1524 U/mL dan 1,2624 U/mL. Energi
aktivasi saat kecepatan reaksi maksimum sebesar 0,0357 kJ/mol. Nilai Km dan
Vmaks nitrilase berturut-turut sebesar 1,6970 mM dan 894,2976 µM/mL.min.
3
ABSTRACT
DEWI SUPARIASIH. Screening of 2-(3-Benzoylphenyl)-Propionitrile-Degrading
Microbes and Characterization of Nitrilase from a Selected Isolate. Under the
direction of I MADE ARTIKA and BAMBANG SUNARKO.
Nitrile is classified as a toxic compound due to the structure contains
CN-group. The compound is carcinogenic, teratogenic, and mutagenic, thus
information on nitrile biodegradation is very important. Nitrile can be degradated
by three enzymes, nitrilase (EC 3.5.5.1), NHase (nitrile hidratase) (EC 4.3.2.84),
and amidase (EC 3.5.1.4). Nitrilase catalyses the hydrolysis of nitriles into
carboxylic acids and ammonia. The aim of the research is to obtain
nitrilase-producing microbes and to determine the nitrilase characteristic from a selected
isolate.
The selected isolate after screening was TPIK 2000, the isolate with the
highest activity of enzyme and can grow on acetonitrile. The generation time (td)
and growth rate constant (µ) of TPIK 2000 was 15 hours and 0,0476 h
-1respectively. Enzymes activity assay was carried out using whole cells to
determine characteristic of enzymes (pH, temperature, Km, and Vmax). Enzymes
obtained from TPIK 2000 cell showed the optimum temperature and pH of 25 °C
and pH 7,2 with enzymes activity was 1,1524 U/mL and 1,2624 U/mL
respectively. Activation energy in maximum reaction rate was 0,0357 kJ/mol. Km
and Vmax of nitrilase was 1,6970 mM and 894,2976 µM/mL.min respectively.
4
PENAPISAN MIKROB PENDEGRADASI
2-(3-BENZOILFENIL)-PROPIONITRIL DAN KARAKTERISASI NITRILASE
DARI ISOLAT TERPILIH
DEWI SUPARIASIH
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
5
Judul Skripsi : Penapisan Mikrob Pendegradasi 2-(3-Benzoilfenil)-Propionitril
dan Karakterisasi Nitrilase dari Isolat Terpilih
Nama
: Dewi Supariasih
NIM
: G44104052
Disetujui
Dr. Ir. I Made Artika, M.App., Sc.
Dr. Ir. Bambang Sunarko
Ketua
Anggota
Diketahui
Dr. drh. Hasim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
6
PRAKATA
Alhamdulillah, segala puji bagi Allah SWT yang selalu memberikan rahmat
bagi makhluk-Nya dan atas ridho-Nya sehingga penelitian ini dapat diselesaikan.
Penelitian dengan judul Penapisan Mikrob Pendegradasi
2-(3-Benzoilfenil)-Propionitril dan Karakterisasi Nitrilase dari Isolat Terpilih dilaksanakan pada
bulan Februari sampai dengan bulan Agustus 2008 di Laboratorium Biokimia
Mikrob, Bidang Mikrobiologi, Puslit Biologi, LIPI Cibinong. Penulis
mengucapkan terima kasih kepada Lembaga Ilmu Pengetahuan Indonesia (LIPI)
yang telah mendanai kegiatan penelitian ini.
Penulis mengucapkan terima kasih kepada Dr. Ir. I Made Artika, M.App.,
Sc dan Dr. Ir. Bambang Sunarko yang telah membimbing penulis selama
melakukan penelitian dan menyelesaikan penulisan laporan ini. Terima kasih
untuk Pak Edi M dan teman-teman biokimia 41. Terima kasih untuk Intan, Ela,
Auline, Tyas, Hanifah, Fitri, Safety dan Ine atas doa dan persahabatan yang
terjalin. Ucapan terima kasih juga penulis haturkan kepada teknisi dan staf
Laboratorium Biokimia Mikrob, Bidang Mikrobiologi, Puslit Biologi, LIPI
Cibinong. Ucapan terima kasih terdalam penulis haturkan untuk kedua orang tua
dan kakak tercinta, Mas Anto, untuk segala perhatian dan kasih sayang serta doa
yang tulus. Semoga hasil dari penelitian ini dapat bermanfaat bagi semua pihak.
Bogor, September 2008
Dewi Supariasih
7
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 21 Januari 1987 dari pasangan
Bapak Toeparno dan Ibu Suwarni. Penulis merupakan anak kedua dari dua
bersaudara. Tahun 2004 penulis lulus dari SMUN 77 Jakarta dan pada tahun yang
sama penulis lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan
Mahasiswa Baru (SPMB) pada Program Studi Biokimia, Departemen Biokimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama di IPB, penulis aktif di organisasi himpunan keprofesian
Community of Research and Education in Biochemistry (CREBs) dan menjadi
panitia dalam berbagai kegiatan BEM, seperti panitia Masa Perkenalan Fakultas
dan Departemen, panitia Kompetisi Sains SMA-PESTA SAINS Nasional 2007,
dan berbagai kegiatan lainnya. Selama mengikuti perkuliahan penulis pernah
menjadi asisten praktikum untuk mata ajaran Biokimia Umum tahun ajaran
2007/2008 untuk mahasiswa Biologi dan Teknologi Hasil Perikanan, mata ajaran
Pengantar Penelitian Biokimia tahun ajaran 2007/2008 untuk mahasiswa
Biokimia, dan mata ajaran Biokimia untuk mahasiswa Akademi Kebidanan.
Penulis mengikuti praktik lapangan dengan judul Penapisan Mikrob Penghasil
Enzim untuk Biotransformasi Senyawa Nitril di Lembaga Ilmu Pengetahuan
Indonesia (LIPI) Cibinong di bidang Mikrobiologi.
8
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xi
PENDAHULUAN
TINJAUAN PUSTAKA
Nitril... 1
Enzim Pendegradasi Nitril dan Nitrilase (E.C.3.5.5.1)... 1
Karakteristik Enzim... 2
Kinetika Enzim... 3
Fermentasi... 3
Biotransformasi Nitril... 4
BAHAN DAN METODE
Bahan dan Alat... 4
Metode... 4
HASIL DAN PEMBAHASAN
Penapisan Mikrob Penghasil Nitrilase... 6
Fermentasi Isolat TPIK 2000... 6
Pengaruh Suhu Terhadap Aktivitas Nitrilase dalam Sel Uuh... 7
Pengaruh pH Terhadap Aktivitas Nitrilase dalam Sel Utuh... 8
Km dan Vmaks Nitrilase pada Sel TPIK 2000... 8
SIMPULAN DAN SARAN
Simpulan... 9
Saran... 9
DAFTAR PUSTAKA... 9
LAMPIRAN...11
9
DAFTAR GAMBAR
Halaman
1 Sintesis sianida dalam suasana asam... 1
2 Sintesis sianida dalam suasana basa... 1
3 Biokonversi senyawa nitril oleh nitrilase, amidase, dan NHase... 1
4 Kurva pertumbuhan mikrob... 3
5 Biokonversi nitril dengan bantuan mikrob... 4
6 Pola dan pH pertumbuhan TPIK 2000 dalam asetonitril dan logaritma
jumlah bakteri terhadap waktu... 6
7 Pengaruh suhu terhadap aktivitas nitrilase dalam sel utuh... 7
8 Hubungan antara kecepatan maksimum reaksi (V) dan suhu (T)... 7
9 Pengaruh pH terhadap aktivitas nitrilase dalam TPIK 2000... 8
10 Pengaruh konsetrasi substrat terhadap kecepatan reaksi nitrilase... 8
11 Kurva Lineweaver-Burk nitrilase... ... 9
DAFTAR LAMPIRAN
Halaman
1
Tahapan penelitian... ... 12
2 Penapisan mikrob penghasil nitrilase………. 13
3 Analisis NH
4+dengan metode Nessler (Svehla 1979) pada panjang
gelombang 403 nm dan kurva standar NH
4+…... 14
4 Penentuan kadar protein dengan metode Biuret (Layne 1957)... 15
5 Kurva standar protein dan sampel protein... 16
6 Pola pertumbuhan TPIK 2000 dalam asetonitril 100 mM... 17
7 Pengaruh suhu terhadap aktivitas nitrilase pada sel TPIK 2000... 18
8 Pengaruh pH terhadap aktivitas nitrilase pada sel TPIK 2000...19
9 Pengaruh substrat terhadap kecepatan enzimatik pada penentuan Km dan
Vmaks... 20
10 Waktu inkubasi optimum nitrilase pada TPIK 2000………… ... 21
11 Pembuatan pereaksi………. 21
PENDAHULUAN
Nitril merupakan kelompok senyawa yang toksik karena mengandung gugus CN dalam strukturnya. Senyawa tersebut bersifat karsinogenik, teratogenik, dan mutagenik, sehingga pengetahuan tentang biodegradasi nitril dinilai sangat penting. Sampai saat ini telah banyak penelitian tentang eksploitasi mikrob pendegradasi senyawa nitril dan lintasan reaksi tersebut untuk memproduksi senyawa organik bernilai ekonomis tinggi. Senyawa organik tersebut antara lain linamarin (Sorokin et al. 2007), alanin (Pace & Brenner 2001), dan asam salisilat (Zhu et
al. 2007).
Beberapa strain mikrob pendegradasi senyawa nitril yang telah ditemukan antara lain Agrobacterium (Wieser et al. 1997, Pace & Brenner 2001), Pseudomonas (Layh & Willette 1998, Pace & Brenner 2001),
Natronocella, Acetinitrilica (Sorokin et al.
2007), dan Gordona terrae (Favre-bulle et al. 1998). Senyawa nitril dapat didegradasi dengan tiga macam enzim, yaitu nitrilase (EC 3.5.5.1), NHase (nitril hidratase) (EC 4.3.2.84), dan amidase (EC 3.5.1.4).
Enzim dapat diukur secara kinetika berdasarkan katakteristiknya. Aktivitas katalitik enzimatik dipengaruhi oleh beberapa faktor, yaitu konsentrasi enzim, konsentrasi substrat, suhu, pH, dan inhibitor serta aktivator. Kecepatan reaksi ini dapat diketahui dengan menentukan kinetika kerja enzim, yaitu dengan mencari nilai Km dan kecepatan maksimum (Vmaks) enzim.
Isolat mikrob yang terpilih untuk karakteristik nitrilase didapatkan melalui proses penapisan. Penapisan mikrob ini didasarkan dari aktivitas enzim dan pertumbuhannya dalam senyawa nitril. Isolat yang berpotensi menghasilkan enzim (nitrilase) akan menghasilkan asam karboksilatnya dan amonia melalui proses biokonversi.
Berdasarkan hasil percobaan sebelumnya, telah banyak mikrob yang mampu mendegradasi senyawa-senyawa nitril, seperti asetonitril, benzonitril, asetamida, dan benzamida. Penelitian ini bertujuan mendapatkan isolat mikrob yang dapat menghasilkan enzim (nitrilase). Selain itu juga bertujuan mengkarakterisasi nitrilase dari isolat terpilih, yang mencakup pertumbuhan, pH dan suhu optimum, Km dan Vmaks. Penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai isolat mikrob penghasil nitrilase. Hipotesis yang
mendukung penelitian ini ialah diperolehnya paling tidak satu isolat yang mempunyai aktivitas enzim yang tinggi.
TINJAUAN PUSTAKA
NitrilNitril adalah senyawa kimia yang mengandung gugus siano (C=N), dengan atom karbon terikat-tiga pada atom nitrogen. Kelompok CN dapat ditemukan dalam banyak senyawa. Beberapa senyawa diantaranya berupa gas dan lainnya berupa zat padat atau cair. Gugus siano terdapat juga dalam bentuk garam dan polimer dan juga ada yang bersifat kovalen, molekuler, dan ionik (Hart, Craine, Hart 2003).
Ikatan rangkap tiga karbon-nitrogen dari sianida organik (nitril) dapat dihidrolisis menjadi gugus karboksil. Reaksi ini berlangsung dalam keadaan asam maupun basa. Bila dalam suasana asam atom nitrogen dari sianida dikonversi menjadi ion amonium (Gambar 1), sedangkan dalam suasana basa, nitrogen dikonversi menjadi amonia dan produk organik, yaitu garam karboksilat, yang perlu dinetralkan dalam langkah terpisah menjadi asam (Gambar 2) (Hart, Craine, Hart 2003).
R-C=N + 2H2O R-COOH + NH4+ + Cl-
Gambar 1 Sintesis sianida dalam suasana asam.
R-C=N + 2H2O R-COONa + NH3
Gambar 2 Sintesis sianida dalam suasana basa.
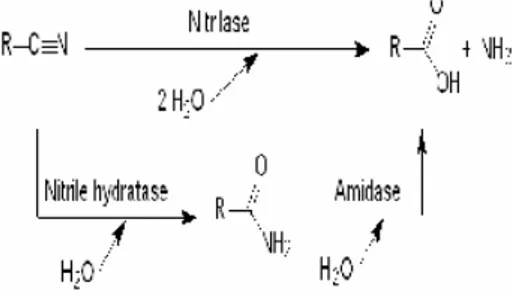
Enzim Pendegradasi Nitril dan Nitrilase (EC 3.5.5.1)
Secara umum terdapat dua reaksi hidrolisis senyawa nitril dengan menggunakan aktivitas mikrob yang dapat dilihat pada Gambar 3. Reaksi pertama, nitrilase (EC 3.5.5.1) mengubah senyawa nitril menjadi asam karboksilat dan amonia secara langsung. Reaksi kedua, NHase (nitril hidratase) (EC 4.3.2.84) mengubah senyawa nitril menjadi amida dan dilanjutkan oleh amidase (EC 3.5.1.4) yang mengubah menjadi asam karboksilat dan amonia (Ciskanik et al 1995). Umumnya, nitrilase aktif terhadap senyawa nitril aromatik, sedangkan NHase cenderung aktif terhadap senyawa nitril
HCl
2
alifatik (Tauber et al 2000). Mikroorganisme yang hanya mempunyai nitrilase tidak dapat memetabolisme senyawa amida (Bandyopadhyay et al 1986, Kobayashi et al 1997). Organisme yang mempunyai nitril hidratase dan amidase jarang merusak nitril-nitril aromatik atau amida-amidanya.
Nitrilase atau nitril aminohidrolase (EC 3.5.5.1) adalah enzim yang mengkatalis reaksi hidrolisis dari senyawa nitril menjadi asam karboksilat dan ammonia tanpa membentuk amida, sebagai produk antara. Nitrilase termasuk ke dalam kelas hidrolase, yaitu karbon-nitrogen hidrolase. Enzim ini dapat digunakan untuk memecah campuran rasemik (Pace & Brenner 2001).
Gambar 3 Biokonversi senyawa nitril oleh nitrilase, amidase, dan NHase.
Karakteristik Enzim
Enzim adalah biokatalisator, artinya zat yang mempunyai asal biologi, yang dapat mempercepat perubahan kimia. Hampir semua enzim adalah protein tetapi terdapat juga asam nukleat yang aktif secara katalitik, yang disebut sebagai ribozim (Koolman & Rohm 1994). Enzim bekerja dengan cara menempel pada permukaan molekul zat-zat yang bereaksi dan akan mempercepat proses reaksi. Percepatan terjadi karena enzim menurunkan energi pengaktifan, sehingga akan mempermudah terjadinya reaksi. Sebagian besar enzim bekerja secara khas. Artinya setiap jenis enzim hanya dapat bekerja pada satu macam senyawa atau reaksi kimia (Lehninger 1982).
Kerja enzim dipengaruhi oleh beberapa faktor, terutama adalah substrat, suhu, keasaman, kofaktor dan inhibitor. Setiap enzim memerlukan suhu dan pH (tingkat keasaman) optimum yang berbeda-beda karena enzim adalah protein, yang dapat mengalami perubahan bentuk jika suhu dan keasaman berubah. Hal ini akan menyebabkan enzim kehilangan fungsinya sama sekali. Kerja enzim juga dipengaruhi oleh kofaktor dan koenzim (Lehninger 1982).
Suhu
Suhu mempunyai dua pengaruh yang bertentangan bagi enzim. Suhu dapat meningkatkan aktivitas enzim dan juga dapat merusak struktur enzim. Suhu optimum merupakan batas dari keduanya (Dixon & Webb 1978). Peningkatan suhu akan meningkatkan kecepatan reaksi katalitik enzim dan juga enzim akan terdenaturasi. Hal ini disebabkan energi kinetik dari molekul-molekul yang bereaksi akan memecah ikatan sekunder pada konformasi enzim dan sisi aktifnya, sehingga enzim akan kehilangan sifat katalitiknya.
Substrat
Substrat akan melekat pada molekul enzim di daerah yang disebut sebagai sisi aktif. Reaksi dapat berlangsung pada konfigurasi permukaan sisi aktif enzim yang berikatan dengan permukaan substrat, ibarat lubang kunci dengan permukaan anak kunci. Jika tidak cocok maka pintu tidak dapat dibuka, artinya reaksi atau aktivitas tidak berlangsung, karena itu enzim bekerja khas untuk satu jenis substrat (Yatim 2000). Akan tetapi, sisi aktif dari enzim dapat berubah saat berikatan dengan substrat. Sisi aktif enzim akan menyesuaikan dengan bentuk substrat sesudah mengikat substrat. Mekanisme ini dinamai dengan kesesuaian terinduksi (induced fit) (Stryer 1995).
pH
Efek pH pada enzim berkaitan dengan keadaan ionisasi dari sistem yang dikatalisis, termasuk substrat dan enzim itu sendiri. Perubahan pH dapat mempengaruhi keadaan ionisasi dari asam amino pada sisi aktif enzim sehingga mempengaruhi interaksinya dengan molekul substrat. Nilai pH yang terlalu tinggi atau terlalu rendah akan menyebabkan ketidakstabilan pada konformasi enzim sehingga menyebabkan struktur enzim rusak. pH optimum adalah pH yang menunjukkan aktivitas enzim maksimal. Keadaan optimum dihubungkan dengan saat gugus penerima proton atau pemberi proton yang aktif pada sisi enzim berada pada kondisi ionisasi yang tepat (Lehninger 1982).
Inhibitor dan Aktivator (Koenzim dan Kofaktor)
Senyawa yang dapat menghambat kerja enzim disebut senyawa inhibitor, sedangkan senyawa yang berperan mengaktifkan enzim disebut aktivator (Sadikin 2002). Hampir semua enzim dapat dihambat oleh senyawa
3
kimia tertentu, misalnya ion logam, senyawa pengkelat, senyawa organik, bahkan substrat enzim itu sendiri. Lehninger (1982), menyatakan beberapa enzim membutuhkan komponen tambahan bagi aktivitasnya. Bila komponen tambahan tersebut berupa senyawa anorganik disebut kofaktor, sedangkan bila berupa senyawa organik disebut koenzim. Beberapa enzim, kofaktor dan koenzimnya terlibat langsung pada proses katalitik tetapi ada juga yang berfungsi sebagai pembawa gugus fungsional tertentu.
Kinetika Enzim
Kerja katalitik suatu enzim, yaitu aktivitas enzim, diukur dengan cara menentukan pertambahan kecepatan reaksi pada kondisi yang telah ditentukan. Biasanya kecepatan reaksi disebutkan sebagai perubahan konsentrasi per satuan waktu (mol/L/s). Satuan kedua yang biasa digunakan adalah satuan internasional (U, µmol hasil metabolisme/menit) (Koolman & Rohm 1994).
Kecepatan reaksi akan berbanding lurus dengan konsentrasi substrat. Namun, saat enzim telah jenuh oleh substrat maka kecepatan reaksi akan berjalan lambat. Kinetika reaksi yang dikatalisis oleh enzim ditentukan terutama oleh sifat-sifat katalisator. Oleh karena itu, reaksi enzimatik lebih kompleks daripada kinetika reaksi yang tidak terkatalisis (Koolman & Rohm 1994). Konsentrasi substrat tertentu pada saat enzim mencapai setengah kecepatan maksimum disebut Km atau konstanta Michaelis-Menten, sedangkan Vmak merupakan kecepatan maksimum dari reaksi enzimatik. Nilai Km bersifat khas pada setiap enzim. Hubungan antara Km dan Vmaks dinyatakan dalam persamaan Michaelis-Menten (Lehninger 1982).
Persamaan Michaelis-Menten merupakan dasar bagi aspek kinetika kerja enzim. Apabila nilai Km dan Vmaks diketahui, maka kecepatan reaksi suatu enzim pada setiap konsentrasi substrat dapat dihitung. Nilai Km dan Vmaks dapat diperoleh dengan memetakan data ke dalam persamaan Lineweaver-Burk sebagai berikut (Lehninger 1982):
Fermentasi
Fermentasi ialah proses menumbuhkan mikrob dalam media. Terdapat tiga macam proses fermentasi cair, yaitu fermentasi kontinyu, semi-kontinyu, dan diskontinyu. Fermentasi kontinyu dilakukan penambahan dan pengurangan kultur selama proses fermentasi, sehingga volume tetap dan kondisi fisiologi sel cenderung konstan, sedangkan proses fermentasi semi-kontinyu dilakukan penambahan substrat pada fase pertumbuhan yang bertujuan memperpanjang fase pertumbuhan yang diinginkan. Proses fermentasi diskontinyu tidak dilakukan penambahan substrat ke dalam media setelah inokulasi (Rahman 1992).
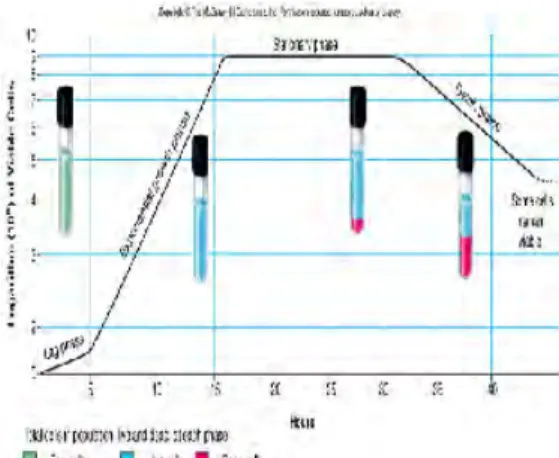
Terdapat empat fase pertumbuhan mikrob pada fermentasi diskontinyu, yaitu fase lag, log, stasioner, dan fase kematian. Fase lag merupakan awal pertumbuhan mikrob. Sel pada fase ini memerlukan penyesuaian terhadap kondisi lingkungan yang baru. Sel hanya akan mengalami perubahan komposisi kimiawi, pertambahan ukuran, dan substansi seluler. Fase log atau eksponensial, sel akan terjadi pembelahan dan pertumbuhan yang cepat, sangat dipengaruhi oleh temperatur dan komposisi medium pertumbuhan. Sel yang berada pada fase ini sering digunakan untuk mempelajari enzim dan komponen lainnya. Fase stasioner merupakan fase yang tidak terjadi peningkatan atau penurunan jumlah sel. Setelah fase stasioner, populasi mikrob akan mengalami fase kematian. Mikrob akan mati pada fase ini, karena substrat atau media untuk pertumbuhan sudah tidak tersedia dan akan menghasilkan metabolit sekunder (Rahman 1992, Pelczar & Chan 1986).
Selang waktu yang dibutuhkan bagi sel untuk membelah diri disebut waktu generasi (td). Tidak semua spesies bakteri mempunyai waktu generasi yang sama, seperti E. Coli dapat berlangsung singkat 15-20 menit tetapi untuk spesies yang lain mungkin dapat selama berjam-jam. Waktu generasi untuk suatu spesies bakteri tertentu juga tidak sama pada segala kondisi. Nilai µ digunakan untuk mengukur jumlah/banyaknya generasi per unit waktu dalam pertumbuhan eksponensial. Waktu generasi dan konstanta laju pertumbuhan suatu bakteri dapat dihitung dengan rumus sebagai berikut (Pelczar & Chan 1986):
B
b
log
3,3
t
td
dantd
2
In
ì
4
dengan td: waktu generasi, t: selang waktu antara pengukuran jumlah sel di dalam populasi pada saat log (B) dan pada titik waktu kemudian (b), B: populasi awal, b: populasi setelah waktu t, dan 3,3: faktor konversi log2 menjadi log10.
Gambar 4 Kurva pertumbuhan mikrob.
Biotransformasi Nitril
Biotransformasi, atau disebut juga sebagai biokonversi, adalah perubahan senyawa organik untuk menjadi suatu produk melalui proses biologi atau menggunakan agen biologis, seperti mikroorganisme atau enzim. Prinsip proses biotransformasi terdiri atas dua macam, yaitu enzimatik atau menggunakan sel mikrob. Suatu mikrob dapat melakukan reaksi biokonversi karena mikrob tersebut memiliki enzim yang dapat mengkonversi substratnya menjadi produk. Umumnya proses ini tidak menghasilkan produk samping yang dapat membahayakan. Menurut Crueger & Crueger (1984), reaksi biokonversi memiliki beberapa kelebihan dibandingkan dengan reaksi kimia biasa, yaitu spesifik terhadap substrat, spesifik terhadap situs tertentu (regioselektif), memiliki kespesifikan stereo dan enansio (stereoselektif dan enansioselektif), dan reaksi biokonversi tidak membutuhkan kondisi reaksi yang ekstrim.
Nitril dapat diubah menjadi asam karboksilat oleh mikrob yang memiliki aktivitas enzim pendegradasi nitril. Enzim tersebut mengubah gugus sianida menjadi gugus karboksilat yang relatif tidak toksik. Berikut adalah biokonversi nitril dengan bantuan mikrob (Gambar 5).
R-C=N R-COOH + NH4+
Gambar 5 Biokonversi nitril dengan bantuan mikrob.
BAHAN DAN METODE
Bahan dan AlatBahan yang digunakan pada pembuatan media agar adalah bacto agar, Nutrien Broth, dan akuades. Bahan untuk pembuatan media mineral untuk tumbuh mikrob antara lain Na2HPO4.2H2O, K2HPO4, KH2PO4,
CaCl2.2H2O, FeSO4.7H2O, yeast ekstrak,
ZnSO4.7H2O, MnCl2.4H2O, H3BO3,
NiCl2.6H2O, MgSO4.7H2O, CoCl2.6H2O,
Na2MoO4.2H2O, NaSeO3, CuSO4, asetonitril,
dan akuades. Bahan yang digunakan pada proses penapisan dan analisis karakterisasi enzim antara lain 2-(3-benzoilfenil)-propionitril, NaOH, HCl, reagen Nessler, INT (iodonitrotetrazoliumklorida), dan berbagai isolat mikrob, sedangkan untuk penentuan kadar protein ialah reagen Biuret, BSA (bovine serum albumin), TCA, dan NaOH. Bahan untuk pembuatan bufer, yaitu Na-asetat, asam Na-asetat, Tris-HCl, K2HPO4, dan
KH2PO4.
Alat yang digunakan pada pembuatan media agar dan media mineral adalah alat-alat gelas, otoklaf, neraca analitik, microwave, dan pH meter HM-256 TOADKK. Alat yang digunakan pada proses penapisan dan karakterisasi enzim antara lain mikrotiterplate, tip, pipet mikro, penangas air, laminar air
flow cabinet, shaker, neraca analitik, jarum
ose, inkubator, spektrofotometer UV-Vis 1700 Shimadzu, botol sentrifus, pH meter HM-256 TOADKK, dan High Speed Refrigerated
Centrifuge 6500 KUBOTA.
Metode
Media Nutrien Agar (NA) (Bergey 1948)
Sebanyak 18 g Bacto agar dan 6,4 g nutrient broth (NB) dilarutkan dalam 1 L akuades, pH 7. Larutan ini kemudian dipanaskan dalam microwave hingga homogen. Media dituang ke dalam tabung reaksi dan cawan petri lalu disterilisasi dengan otoklaf selama 15 menit, 121 ºC, 1 atm. Setelah itu, tabung dimiringkan dan cawan petri didiamkan hingga agar mengeras.
Media Tumbuh Mikrob (Meyer & Schlegel 1983)
Setiap liter media tumbuh isolat mengandung Na2HPO4.2H2O 0,4475 g,
KH2PO4 0,1 g, CaCl2.2H2O 0,01 g,
FeSO4.7H2O 0,001 g, yeast ekstrak 0,01 g,
MgSO4.7H2O 0,1 g dan unsur mikro sebanyak
1 mL. Komposisi unsur mikro sebagai berikut: mikrob
5
ZnSO4.7H2O 0,1 g, MnCl2.4H2O 0,03 g,
H3BO3 0,3 g, NiCl2.6H2O 0,02 g, CoCl2.6H2O
0,2 g, CuCl2.2H2O 0,01 g, NaSeO3 0,02 g, dan
Na2MoO4.2H2O 0,9 g. Asetonitril
ditambahkan sebagai sumber karbon dan nitrogen bagi isolat mikrob.
Penapisan Mikrob Penghasil Nitrilase
Penapisan mikrob penghasil nitrilase dilakukan dengan mengukur pertumbuhan dan aktivitas enzim secara kualitatif. Penapisan dilakukan dengan menumbuhkan isolat dalam 1000 µL media pertumbuhan yang mengandung 250 ppm 2-(3-benzoilfenil)-propionitril dalam mikrotiterplate. Setelah itu, kultur diinkubasi selama 3 hari di atas mesin pengocok pada suhu 30 ºC, 120 rpm.
Pertumbuhan isolat diukur dengan cara mereaksikan 100 µL kultur dengan 14 µL INT (iodonitrotetrazoliumklorida). Selanjutnya, kultur diinkubasi selama 30 menit pada suhu 37 ºC dan warna yang terbentuk diamati. Media pertumbuhan yang mengandung 250 ppm 2-(3-benzoilfenil)-propionitril tanpa isolat digunakan sebagai kontrol negatif.
Aktivitas enzim diukur dengan cara mereaksikan 2 µL kultur dengan 198 µL NaOH 0.1 N dan 4 µL reagen Nessler. Kultur kemudian diinkubasi selama 20 menit pada suhu kamar dan warna yang terbentuk diamati. Media pertumbuhan yang mengandung 250 ppm 2-(3-benzoilfenil)-propionitril tanpa isolat digunakan sebagai kontrol negatif.
Fermentasi Isolat Terpilih
Isolat terpilih dari hasil penapisan ialah isolat TPIK 2000. Fermentasi diawali dengan pembuatan inokulan dengan cara menumbuhkan isolat TPIK 2000 dalam Erlenmeyer (250 mL) berisi 100 mL media mineral yang mengandung 100 mM asetonitril. Kultur diinkubasi di atas mesin pengocok dengan kecepatan 120 rpm, 30 °C selama 3 hari. Pola pertumbuhan isolat TPIK 2000 ditentukan dengan menginokulasikan 25 mL inokulan ke dalam Erlenmeyer (1 L) berisi 475 mL media mineral yang mengandung 100 mM asetonitril. Kultur ini diinkubasi di atas mesin pengocok dengan kecepatan 120 rpm dan suhu 30 °C. Sampel diambil secara periodik untuk penentuan pertumbuhan (OD 436 nm) dan perubahan pH media.
Produksi Biomasa Sel
Produksi biomasa sel dilakukan dalam Erlenmeyer (1000 mL) berisi 600 mL media mineral yang mengandung 100 mM
asetonitril. Selanjutnya, 200 mL inokulan ditambahkan ke dalam media. Kultur diinkubasi dengan dikocok pada kecepatan 120 rpm, 30 ºC. Sel dipanen pada saat produksi sel optimum, yaitu nilai OD maksimum. Sel dipanen dengan mensentrifus kultur pada kecepatan 10.000 rpm selama 10 menit dan suhu 4 ºC. Pelet yang didapat dicuci dengan bufer fosfat pH 7 (50 mM KH2PO4
dan K2HPO4) sebanyak dua kali. Supernatan
dibuang dan pelet dikumpulkan. Bobot kering dan bobot basah pelet diukur. Sel basah kemudian dilarutkan dalam bufer fosfat pH 7,2 (50 mM KH2PO4 dan K2HPO4). Larutan
sel ini kemudian digunakan untuk penentuan karakteristik enzim dalam sel utuh.
Penentuan Kadar Protein (Layne 1957)
Suspensi sel (1 mL) ditambah dengan 0,2 mL NaOH 2 N dan 0,4 mL akuades. Selanjutnya, larutan diinkubasi pada 100 ºC selama 10 menit, didinginkan dengan es dan ditambah dengan 0,2 mL TCA 4 N. Larutan selanjutnya disentrifus 10.000 rpm selama 10 menit. Pelet yang didapat ditambah dengan 3 mL reagen Biuret dan diinkubasi pada suhu kamar selama 20 menit. Setelah diinkubasi, larutan disentrifus kembali, supernatan kemudian diukur pada panjang gelombang 560 nm. Kurva standar protein ditentukan dengan metode yang sama seperti di atas dengan larutan standar BSA (bovine serum
albumin).
Karakterisasi Nitrilase
Penentuan Aktivitas Enzim. Campuran
reaksi yang mengandung sel (1,5% b/v) dalam bufer fosfat pH 7,2 (50 mM KH2PO4 dan
K2HPO4) dengan 2 mM
2-(3-benzoilfenil)-propionitril, diinkubasi selama 30 menit pada 37 ºC. Setiap interval waktu 5 menit, sampel enzim diambil dan aktivitas enzim dihentikan dengan penambahan 0,20 mL HCl 4. Setelah itu, kadar NH4+ diuji dengan metode Nessler
(Svehla 1979).
Penentuan Suhu dan pH Optimum.
Pengaruh suhu ditentukan dengan menambahkan 1,5% (b/v) sel ke dalam 1 mL bufer fosfat pH 7,2 (50 mM KH2PO4 dan
K2HPO4). Setelah itu, larutan sel ditambah
dengan 2-(3-benzoilfenil)-propionitril 20 mM dan diinkubasi pada kisaran suhu 5-70 ºC dalam tabung reaksi tertutup selama 15 menit. Aktivitas enzim ditentukan dengan metode yang telah diuraikan sebelumnya. Penentuan pengaruh pH dilakukan sama seperti penentuan suhu namun diinkubasi pada kisaran pH 3,5-9,5 dan suhu 25 °C.
6
Penentuan Km dan Vmaks. Sebanyak
1,5% sel (b/v) ke dalam 1 mL bufer fosfat pH 7,2 (50 mM KH2PO4 dan K2HPO4). Setelah
itu, larutan tersebut ditambah 2-(3-benzoilfenil)-propionitril dengan konsentrasi 0-4,5 mM, kemudian diinkubasi selama 15 menit pada 25 °C. Aktivitas enzim ditentukan dengan metode yang telah diuraikan sebelumnya.
HASIL DAN PEMBAHASAN
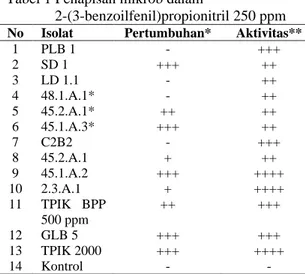
Penapisan Mikrob Penghasil NitrilaseHasil penapisan mikrob penghasil nitrilase dapat dilihat pada Tabel 1. Isolat 45.1.A.2, GLB 5, dan TPIK 2000 menunjukkan aktivitas enzim (nitrilase) dan pertumbuhan yang tinggi. Namun setelah dilakukan penapisan ulang, isolat TPIK 2000 menunjukkan aktivitas dan pertumbuhan tertinggi (Tabel 2). Isolat ini kemudian digunakan untuk penentuan karakteristik nitrilase.
Isolat mikrob yang dapat hidup dalam 2-(3-benzoilfenil)-propionitril diasumsikan memiliki enzim (nitrilase) dan akan mendegradasi 2-(3-benzoilfenil)-propionitril menjadi asam karboksilatnya dan amonia. Keberadaan aktivitas enzim ini secara tidak langsung dapat diketahui dari pengukuran amonia (sebagai salah satu produk degradasi senyawa nitril). Pertumbuhan mikrob dalam 2-(3-benzoilfenil)-propionitril menunjukkan bahwa mikrob dapat menggunakan 2-(3-benzoilfenil)-propionitril sebagai sumber karbon, nitrogen, dan energi.
Tabel 1 Penapisan mikrob dalam
2-(3-benzoilfenil)propionitril 250 ppm
No Isolat Pertumbuhan* Aktivitas**
1 PLB 1 - +++ 2 SD 1 +++ ++ 3 LD 1.1 - ++ 4 48.1.A.1* - ++ 5 45.2.A.1* ++ ++ 6 45.1.A.3* +++ ++ 7 C2B2 - +++ 8 45.2.A.1 + ++ 9 45.1.A.2 +++ ++++ 10 2.3.A.1 + ++++ 11 TPIK BPP 500 ppm ++ +++ 12 GLB 5 +++ +++ 13 TPIK 2000 +++ ++++ 14 Kontrol - -
(*) -: tidak tumbuh, +: tumbuh, ++: tumbuh baik, +++: tumbuh sangat baik, (**) -: tidak ada aktivitas, +: aktivitas kecil, ++: aktivitas sedang, +++: aktivitas tinggi, ++++: aktivitas sangat tinggi.
Tabel 2 Penapisan ulang mikrob dalam 2-(3-benzoilfenil)propionitril 250 ppm
No Isolat Pertumbuhan* Aktivitas**
1 PLB 1 - + 2 C2B2 - + 3 45.1.A.2 +++ +++ 4 TPIK BPP 500 ppm +++ ++ 5 GLB 5 +++ +++ 6 TPIK 2000 +++ ++++ 7 Kontrol - -
(*) -: tidak tumbuh, +: tumbuh, ++: tumbuh baik, +++: tumbuh sangat baik, (**) -: tidak ada aktivitas, +: aktivitas kecil, ++: aktivitas sedang, +++: aktivitas tinggi, ++++: aktivitas sangat tinggi.
Fermentasi Isolat TPIK 2000
Fermentasi isolat TPIK 2000 dilakukan dengan cara fermentasi diskontinyu. Fermentasi isolat TPIK 2000 tidak dilakukan penambahan substrat setelah inokulasi. Pola pertumbuhan isolat TPIK 2000 dalam asetonitril dan perubahan pH media dapat dilihat pada Gambar 6. Kemampuan tumbuh TPIK 2000 pada asetonitril ini mengindikasikan bahwa enzim yang dihasilkan isolat tersebut tidak bersifat spesifik yang hanya tumbuh pada 2-(3-benzoilfenil)-propionitril. Penurunan pH media pada awal fermentasi dari pH 8,18 menjadi 7,71 terjadi karena mikrob menggunakan sumber nitrogen terlebih dahulu dibandingkan dengan sumber karbon. Setelah itu, pH media mengalami kenaikan karena diduga mikrob telah menggunakan sumber karbon setelah menggunakan sumber nitrogen. Berdasarkan hasil tersebut, TPIK 2000 mempunyai pH media yang lebih tinggi dibandingkan pada pertumbuhan
Pseudomonas sp dalam suksinonitril, yaitu
media mengalami perubahan dari pH 7,46 menjadi pH 6,41 (Siregar 2006). Bila dibandingkan dengan Pseudomonas sp yang ditumbuhkan dalam adiponitril, pH media TPIK 2000 lebih rendah. pH media
Pseudomonas sp dalam adiponitril berkisar
pH 7,5-8,3 (Fitri 2005).
Waktu generasi (td) dan konstanta laju pertumbuhan (µ) untuk TPIK 2000 didapatkan masing-masing sebesar 15 jam dan 0,0476 jam-1 (Gambar 6). Bila dibandingkan dengan
Pseudomonas sp dalam suksinonitril, nilai td
dan µ masing-masing sebesar 3 jam dan 0,346 jam-1 (Siregar 2006), sehingga waktu generasi TPIK 2000 lebih tinggi, tetapi nilai µ lebih kecil. Pseudomonas sp dalam adiponitril memiliki waktu generasi dan µ yang lebih cepat, yaitu masing-masing sebesar 2 jam dan 0,346 jam-1 (Fitri 2005). Oleh karena itu, µ
7
merupakan nilai yang spesifik dan sangat ditentukan oleh jenis mikroorganisme serta kondisi fermentasi. y = 0,7946Ln(x) - 0,1491 R2 = 0,6012 -0,5 0 0,5 1 1,5 2 2,5 3 0 3 6 21 24 27 54 75 82 108 Waktu (Jam) O D 4 3 6 n m 7,3 7,4 7,5 7,6 7,7 7,8 7,9 8 8,1 8,2 8,3 p H
Gambar 6 Pola (¦), pH (?) pertumbuhan TPIK 2000 dalam asetonitril, dan ( ) logaritma jumlah bakteri terhadap waktu.
Pengaruh Suhu Terhadap Aktivitas Nitrilase dalam Sel Utuh
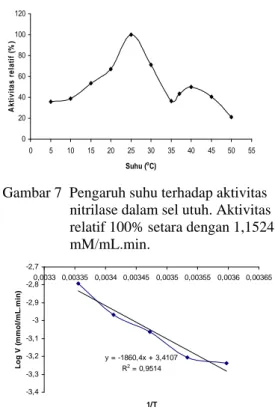
Pengaruh suhu terhadap aktivitas relatif enzim dapat dilihat pada Gambar 7. Nitrilase pada sel TPIK 2000 memiliki suhu optimum pada suhu 25 °C dengan aktivitas sebesar 1,1524 U/mL. Suhu lebih dari 40 °C membuat aktivitas relatif nitrilase menurun. Hal ini dapat disebabkan struktur protein enzim mengalami perubahan.
Suhu nitrilase pada TPIK 2000 lebih kecil bila dibandingkan pada sel Arabidopsis
thaliana. Nitrilase pada Arabidopsis thaliana
memiliki suhu optimum pada suhu 30 °C (Vorwerk et al. 2001). Suhu optimum nitrilase pada TPIK 2000 sama dengan suhu optimum pada ZmNIT2 (Zea mays) dengan substrat fenilbutironitril (Park et al. 2003). Suhu optimum nitrilase pada Alcaligenes faecalis lebih tinggi dibandingkan pada sel TPIK 2000, yaitu suhu 45 °C (Favre-bulle et al. 1998) dan 30 °C (Petersen & Kiener 1999). Begitu juga bila dibandingkan dengan nitrilase dari Bacillus pallidus mempunyai suhu optimum yang tinggi, yaitu 65 °C (Almatawah, Cramp, Cowan 1999). Hal ini dapat terjadi karena Bacillus pallidus
termasuk bakteri termofilik. Berdasarkan hasil penelitian Kiziak et al. (2005), suhu optimum nitrilase pada Pseudomonas fluorescens ialah 50-55 °C (dengan waktu reaksi 10 menit) dan 45-50 °C (waktu reaksi 30 menit).
Hubungan antara kenaikan suhu dengan laju reaksi menurut Arrhenius dapat ditentukan dari integrasi persamaan garis sebagai berikut (Sadikin 2002):
tetapan T 1 2,303R E V log
Energi aktivasi nitrilase pada TPIK 2000 didapatkan dari persamaan garis Y= -1860,4X + 3,4107. Energi aktivasi enzim pada saat laju reaksi maksimum sebesar 0,0356 kJ/mol (Gambar 8). Energi ini lebih rendah jika dibandingkan dengan energi aktivasi nitrilase pada Norcadia sp. sebesar 51,8 kJ/mol (Harper 1977). Secara umum semakin kecil 1/T (semakin tinggi T), maka semakin besar nilai log V. Berarti semakin tinggi suhu maka semakin besar juga laju reaksi maksimum. Namun, suhu yang dimaksud di sini adalah suhu enzim, sehingga pernyataan tersebut hanya berlaku selama enzim tersebut tidak mengalami denaturasi. Artinya, hubungan lurus antara logaritma laju reaksi dengan perubahan suhu hanya berlaku sampai suhu optimum (Sadikin 2002).
Suhu rendah akan membuat laju reaksi enzim berkurang karena kurangnya gerak termodinamik, sehingga kurangnya tumbukan antara molekul enzim dengan substrat. Suhu yang lebih tinggi akan membuat gerak termodinamik meningkat, sehingga benturan antar molekul akan lebih sering, tetapi molekul protein enzim akan mengalami denaturasi seiring tingginya suhu. Akibatnya kompleks ES akan sukar terbentuk sehingga produk juga semakin sedikit.
0 20 40 60 80 100 120 0 5 10 15 20 25 30 35 40 45 50 55 Suhu (oC) A k ti v it a s re la ti f (% )
Gambar 7 Pengaruh suhu terhadap aktivitas nitrilase dalam sel utuh. Aktivitas relatif 100% setara dengan 1,1524 mM/mL.min. y = -1860,4x + 3,4107 R2 = 0,9514 -3,4 -3,3 -3,2 -3,1 -3 -2,9 -2,8 -2,7 0,0033 0,00335 0,0034 0,00345 0,0035 0,00355 0,0036 0,00365 1/T L o g V ( m m o l/ m L .m in )
Gambar 8 Hubungan antara kecepatan maksimum reaksi (V) dan suhu (T)
8
Pengaruh pH terhadap Aktivitas Nitrilase dalam Sel Utuh
Pengaruh pH terhadap aktivitas relatif enzim dapat dilihat pada Gambar 9. pH optimum aktivitas nitrilase pada sel TPIK 2000 berada pada pH netral, yaitu 7,2. Aktivitas enzim saat pH 7,2, yaitu 1,2624 U/mL. Penentuan pengaruh pH pada penelitian ini dilakukan dengan 3 jenis bufer, yaitu bufer asetat (pH 3,5-5), bufer fosfat (pH 4,5-8), dan bufer Tris-HCl (pH 7,5-9,5). Penggunaan 3 jenis bufer disebabkan rentangan pH yang diselidiki biasanya berkisar dalam rentangan yang tidak lebar dan bukan dalam rentangan pH 1 sampai 14.
Hasil di atas menunjukkan bahwa pH optimum nitrilase pada sel TPIK 2000 lebih rendah dibandingkan dengan Arabidopsis
thaliana ialah pH 8 (Vorwerk et al. 2001) dan Bacillus pallidus yang didapatkan pada pH 7,6
(Almatawah, Cramp, Cowan 1999). Namun, mendekati pH optimum enzim nitrilase dari
Alcaliigenes faecalis pada kisaran pH 6,5-8,0
(Favre-bulle et al. 1998) dan pH 7 (Petersen & Kiener 1999), dan juga dari Pseudomonas
fluorosens pada pH 6,5 (Kiziak et al. 2005).
Nilai pH mempengaruhi aktivitas enzim karena enzim merupakan protein yang memiliki sifat asam atau basa tergantung dari asam amino penyusunnya. Perubahan nilai pH akan mempengaruhi struktur enzim. Enzim yang telah rusak (terdenaturasi) dapat diperbaiki (renaturasi) dengan cara nilai pH dikembalikan secara lambat ke nilai pH optimum, misalnya dengan cara mendialisis campuran tersebut. -5 5 15 25 35 45 55 65 75 85 95 105 115 125 135 3,5 4 4,5 5 5,5 6 6,5 7 7,5 8 8,5 pH A k ti v it a s r e la ti f (% )
Gambar 9 Pengaruh pH terhadap aktivitas nitrilase dalam TPIK 2000. Aktivitas relatif 100% setara dengan 1,2624 mM/mL.min.
Km dan Vmaks Nitrilase pada Sel TPIK 2000
Penentuan nilai Km dan Vmak berguna dalam mengetahui kinetika enzim sehingga dapat diketahui karakteristik dan kecepatan
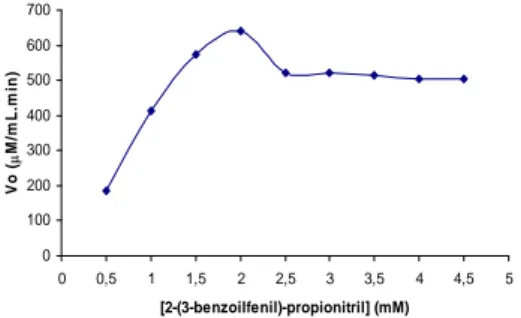
reaksi enzim dalam menguraikan substrat. Kecepatan reaksi nitrilase pada isolat TPIK 2000 mengikuti pola Michaelis-Menten. (Gambar 10). Semakin tinggi konsentrasi substrat maka kecepatan reaksi akan berjalan lambat. Semakin tinggi konsentrasi substrat maka reaksi enzimatik akan mengalami kejenuhan. Kecepatan reaksi enzimatik mulai berjalan lambat saat konsentrasi 2-(3-benzoilfenil)-propionitril sebesar 2,5 mM. Berarti nitrilase telah jenuh saat konsentrasi 2-(3-benzoilfenil)-propionitril lebih tinggi dari 2,5 mM.
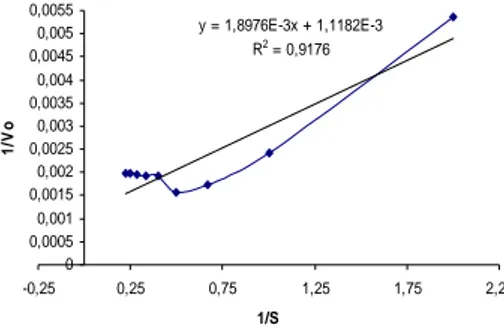
Nilai Km dan Vmak nitrilase dapat diperoleh dengan memplotkan kurva Michaelis-Menten (Gambar 11) ke dalam persamaan Lineweaver-Burk. Nilai Km dari nitrilase yang didapat adalah sebesar 1,6970 mM, sedangkan Vmaknya sebesar 894,2976 µM/mL.min yang didapat dari persamaan linear Y = 1,8976.10-3X + 1,1182.10-3. Hal ini berarti kecepatan reaksi enzim saat mencapai setengah maksimum, yaitu pada konsentrasi sebesar 1,6970 mM.
Nilai Km nitrilase dari TPIK 2000 lebih rendah dibandingkan dengan Rhodococcus
rhodococcus J11 dan Bradyrhizobium
japonicum, yaitu ditentukan masing-masing
2,1 mM (Kobayasi 1998) dan 4,36 mM (Zhu
et al. 2007). Namun, bila dibandingkan
dengan nilai Km dari Bacillus pallidus,
Rhodococcus, dan Bacillus subtilis, nilai Km
TPIK 2000 lebih tinggi. Nilai Km nitrilase dalam Bacillus paliidus sebesar 0,92 mM (Almatawah, Cramp, Cowan 1999), sedangkan Rhodococcus dan Bacillus subtilis ditentukan masing-masing sebesar 0,96 mM dan 1,54 mM (Zhu et al. 2007).
Nilai Km yang kecil menunjukkan afinitas enzim yang tinggi terhadap substrat (Koolman 2004). Berarti energi yang diperlukan untuk memulai terjadinya reaksi enzimatik lebih sedikit sehingga reaksi lebih mudah terjadi. Nilai Km yang tinggi menunjukkan afinitas yang rendah terhadap substrat.
0 100 200 300 400 500 600 700 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 [2-(3-benzoilfenil)-propionitril] (mM) V o ( M /m L .m in )
Gambar 10 Pengaruh konsentrasi
substrat terhadap kecepatan reaksi nitrilase.
9
y = 1,8976E-3x + 1,1182E-3 R2 = 0,9176 0 0,0005 0,001 0,0015 0,002 0,0025 0,003 0,0035 0,004 0,0045 0,005 0,0055 -0,25 0,25 0,75 1,25 1,75 2,25 1/S 1 /V o
Gambar 11 Kurva Lineweaver-Burk nitrilase.
SIMPULAN DAN SARAN
SimpulanPenapisan mikrob penghasil nitrilase yang memberikan aktivitas enzim nitrilase dan pertumbuhan tertinggi ialah isolat TPIK 2000. Isolat TPIK 2000 yang ditumbuhkan mengindikasikan memiliki enzim pendegradasi senyawa nitril yang bersifat tidak spesifik terhadap 2-(3-benzoilfenil)-propionitril. Waktu generasi (td) dan konstanta laju pertumbuhan (µ) dari TPIK 2000 ialah 15 jam dan 0,0476 jam-1. Enzim pada sel TPIK 2000 memiliki suhu dan pH optimum bagi aktivitasnya pada suhu 25 °C dan pH 7,2. Aktivitas nitrilase pada suhu 25 °C dan pH 7,2 ialah 1,1524 U/mL dan 1,2624 U/mL. Energi aktivasi nitrilase pada laju reaksi maksimum saat suhu 25 °C sebesar 0,0357 kJ/mol. Nilai Km dan Vmaks nitrilase berturut-turut sebesar 1,6970 mM dan 894,2976 µM/mL.min.
Saran
Saran yang diberikan untuk penelitian selanjutnya adalah perlu dilakukannya penelitian lebih lanjut mengenai optimasi konsentrasi substrat dan analisis produk yang didapat. Selanjutnya perlu dilakukan juga pemecahan sel, pemurnian enzim, produksi enzim dalam skala besar, dan identifikasi isolat lebih lanjut.
DAFTAR PUSTAKA
Almatawah QA, Cramp R,. Cowan DA. 1999. Characterization of an inducible nitrilase from a thermophilic Bacillus. Extremophiles 3:283-291.
Bandyopadhyay AK, et al. 1986. Purification and characterization of benzonitrilases
from Arthrobacter sp Strain J-1. Appl
Microbiol Biotechnol 60:33-34.
Ciskanik LM, Jolanta MW, Robert DW. 1995. Purification and characterization of an enantioselective amidase from
Pseudomonas chlororaphis B-23. Appl Environ Microbiol 61:998-1003.
Crueger W, Crueger A. 1984. Biotechnology:
A Text Boox of Industrial Microbiology.
Madison: Science Tech.
Dixon M, Webb EC. 1978. Enzymes. New York: Academic Pr.
Favre-bulle O, Bontoux MC, Largeau D, Ariagno A. 1999. Enzymatic hydrolysis of racemic a-substituted 4-methylthiobutyronitriles using a nitrilase from Alcaligenes faecalis, Gordona terrae
or Rhodococcus sp.
FreePatentsOnline.com.
Fitri EY. 2005. Kinetika fermentasi dan karakteristik enzim yang terlibat dalam proses produksi asam adipat oleh
Pseudomonas sp [skripsi]. Bogor: Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Harper DB. 1977. Microbial metabolism of aromatic nitriles enzymology of C-N cleavage by Norcadia sp. (Rhodococcus group) NCIB 11216. J Biochem 165:309-319.
Hart H, Craine LE, Hart DJ. 2003. Kimia
Organik, Suatu Kuliah Singkat. Ed ke-11.
Achmadi SS, penerjemah; Safitri A, editor. Jakarta: Erlangga. Terjemahan dari:
Organic Chemistry, A Short Course.
Kiziak C, Conradt D, Stolz A, Mattes R, Klein J. 2005. Nitrilase from Pseudomonas
fluorescens EBC 191 cloning and
heterologous expression of the gene and biochemical characterization of the recombinant enzyme. Microbiology
151:3639-3648.
Kobayashi M, et al. 1997. Identification of active sites in amidase: evolutionary relationship between amide bond and peptide bond-cleaving enzymes. Proc Natl
Acad Sei 94:11986-11991.
Kobayashi M, Goda M, Shimizu S. 1998. Nitrilase catalyzes amide hydrolysis as well as nitrile hydrolysis. Biochem
Biophys Res Commun 253:662-666.
Koolman J, Rohm KH. 1994. Altas Bergambar dan Teks Biokimia. Wanandi
10
SI, penerjemah. Jakarta: Hipokrates. Terjemahan: Color Atlas of Biochemistry. Layh N, Willetts A. 1998. Enzymatic nitrile
hydrolysis in low water systems.
Biotechnol Lett 20:329-331.
Layne E. 1957. Spectrophotometric and turbidimetric methods for measuring proteins. Methods in Enzymology 10:447-455.
Lehninger AL. 1982. Dasar-Dasar Biokimia. Jilid ke-1. Thenawidjaja M, penerjemah. Jakarta: Erlangga. Terjemahan dari:
Principles of Biochemistry.
Meyer O, Schlegel HG. 1983. Biology of aerobic carbon monoxide oxidizing bacteria. Ann Rev Microbiol 37:277-310. Pace HC, Brenner C. 2001. The nitrilase
superfamily: classification, structure and function. Genome Biology 2:1.1–1.9. Park et al. 2003. The nitrilase ZmNIT2
converts acetonitrile to indole-3-acetic acid. Plant Physiology 133:794-802. Pelczar MJ, Chan ECS. 1986. Dasar-Dasar
Mikrobiologi. Ed ke-1. Hadioetomo RS,
Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta: UI Pr. Terjemahan dari: Principles of Microbiology.
Petersen M, Kiener A. 1999. Biocatalysis-preparation and functionalization of N-heterocycles. Green Chem 2:99-106. Rahman A. 1992. Teknologi Fermentasi.
Jakarta: Arcan.
Robert D, Arie B-b, Robert FD. 2004. Method for stabilizing nitrilase activity and preserving microbial cell with carbamate salt. FreePatentsOnline.com.
Sadikin M. 2002. Biokimia Enzim. Jakarta: Widya Medika.
Siregar TU. 2006. Kinetika biotransformasi suksinonitril menjadi asam suksinat oleh
Pseudomonas sp. [skripsi]. Bogor:
Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sorokin DY, Pelt S, Tourova TP, Takaichi S, Muyzer G. 2007. Acetonitrile degradation under haloalkaline conditions by
Natronocella acetinitrilica gen. nov. sp. Microbiology 153:1157-1164.
Stryer L. 1995. Biokimia. Ed ke-4. Sadikin M,
et al, penerjemah; Soebianto S, Setiadi E,
editor. Jakarta: EGC. Terjemahan dari:
Biochemistry.
Svehla G. 1979. Vogel’s Textbook of Marco
and Semimicro Qualitative Inorganic Analysis. London: Longman.
Tauber MM, Cavaco-Paulo A, Robra KH, Gubitz GM. 2000. Nitrile hidratase and amidase from Rhodococcus rhodochrus hydrolyze acrilic fibers and granular polyacrylonitriles. Appl Environ Microbiol 66:1634-1638.
Vorwerk S et al. 2001. Enzymatic characterization of the recombinant
Arabidopsis thaliana nitrilase subfamily
encoded by the NIT2/NIT1/NIT3-gene cluster. Planta 212:508-516.
Wieser M, Heinzmann K, Kiener A. 1997. Bioconversion of 2-cyanopyrazine to 5-hydroxypyrazine-2-carboxylic acid with
Agrobacterium sp. DSM 6336. Appl Microbiol Biotechnol 48:174-180.
Yatim W. 2000. Enzim. Kompas. [terhubung berkala]. http://avicenia.8m.com./enzim. html [15 Apr 2008].
Zhu D et al. 2007. A new nitrilase from
Bradyrhizobium japonicum USDA 110,
gGene cloning, biochemical characterization and substrate specificity. 2007. J Biotechol 133:327-333.
Zhu Q et al. 2007. Novel sensitive high-throughput screening strategy for nitrilase-producing strains. Appl Environ Microbiol 73:6053–6057.
11
12
Lampiran 1 Tahapan penelitian
Penapisan Mikrob Penghasil Nitrilase
Isolat Terpilih
Ukur OD ? 436 nm
Sentrifus
10.000 rpm, 4 ºC, 10
menit
Produksi biomassa sel
Bobot kering
Pelet
Karakteristik enzim
pH
Suhu Km dan Vm
Kadar
protein
Biuret
Aktivitas
enzim
Nessler
13
Lampiran 2 Penapisan mikrob penghasil nitrilase
Inkubasi suhu 37 °C
30 menit
Inkubasi suhu ruang
20 menit
Kocok 120 rpm, 30 ºC, 3 hari
Isolat + 250 ppm 2-(3-benzoilfenil)-propionitril dalam 1 mL media pertumbuhan
Dimasukan ke dalam mikroplate
100 µL larutan kultur
+ 14 µL INT
Warna kuning (uji positif)
Uji aktivitas (kualitatif)
dengan metode Nessler
Uji pertumbuhan
2 µL Kultur + 198 µL NaOH 0,1 N
+ 4 µL pereaksi Nessler
14
Lampiran 3 Analisis NH
4+dengan metode Nessler (Svehla 1979) pada panjang
gelombang 403 nm dan kurva standar NH
4+Blanko
Standar
Sampel
Akuades (mL)
0,1
-
-
Standar (mL)
-
0,1
-
Sampel (mL)
-
-
0,1
NaOH 0,1 N (mL)
9,9
9,9
9,9
Pereaksi Nessler (mL)
0,2
0,2
0,2
Absorbansi standar NH
4+[Amonium] mM
Absorbansi
A rerata
Ulangan 1
Ulangan 2
1
0,1370
0,1370
0,1370
2
0,1870
0,1860
0,1865
4
0,3080
0,3080
0,3080
8
0,7480
0,7480
0,7480
10
0,8150
0,8150
0,8150
y = 0,0833x + 0,0189 R2 = 0,9845 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 0 1 2 3 4 5 6 7 8 9 10 11 [Standar] mM A b s o rb a n sKurva Standar
Inkubasi 20 menit
suhu ruang
Ukur pada ? 403 nm
15
Lampiran 4 Penentuan kadar protein dengan metode Biuret (Layne 1957)
Suspensi sel + 0,2 mL NaOH 2 N + 0,4 mL akuades
Rebus 10 menit (100 ºC)
Dinginkan dengan es
+ 0,2 mL 4 N TCA
Diamkan 20 menit
Pelet + Reagen Biuret 3 mL
Sentrifus 10.000 rpm, 10 menit
Supernatan
Sentrifus 10.000 rpm, 10 menit
16
Lampiran 5 Kurva standar protein dan sampel protein
Absorbansi Standar Protein (BSA)
[Standar] mg/mL
Absorbansi
0,00
0,080
2,00
0,234
4,00
0,388
6,00
0,539
8,00
0,686
10,00
0,812
y = 0,0738x + 0,0874 R2 = 0,9989 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 0 2 4 6 8 10 12 [BSA] mg/mL A b s o rb a n sKurva Standar
Kadar protein sel TPIK 2000
Ulangan
Absorbansi
[protein] mg/mL
1
0,232
1,9594
2
0,233
1,9729
3
0,256
2,2846
Rerata
0,240
2,0723
Perhitungan :
Ulangan 1
Y = 0,0738 X + 0,0874
0,232 = 0,0738 X + 0,0874
X = [protein] = 0,232 – 0,0874 = 1,9594 mg/mL
0,0738
17
Lampiran 6 Pola pertumbuhan TPIK 2000 dalam asetonitril 100 mM
Ulangan ke-1
Waktu (Jam)
A
Fp
A
terkoreksi
0
0,122
1
0,122
2
0,134
1
0,134
4
0,195
1
0,195
24
0,375
10
3,750
26
0,416
10
4,160
28
0,441
10
4,410
47
0,609
10
6,090
48
0,606
10
6,060
50
0,588
10
5,880
52
0,528
10
5,280
Fp: faktor koreksiUlangan ke-2
Waktu
(Jam)
OD 436 (nm)
OD
rerata
pH
pH
rerata
Ulangan
Ulangan
1
2
3
1
2
3
0
0,357
0,360
0,364
0,360
8,08
8,04
8,05
8,06
3
0,358
0,356
0,354
0,356
8,26
8,26
8,24
8,25
6
0,413
0,410
0,410
0,411
7,26
8,18
8,18
8,18
21
0,813
0,825
0,807
0,815
7,72
7,71
7,71
7,71
24
0,811
0,825
0,830
0,822
7,78
7,78
7,78
7,78
27
0,806
0,821
0,823
0,817
7,66
7,68
7,70
7,68
54
0,769
0,757
0,765
0,764
7,81
7,79
7,80
7,80
75
1,920
1,655
1,605
1,727
7,83
7,90
7,93
7,90
82
1,790
1,865
1,895
1,850
7,93
7,86
7,93
7,91
108
2,635
2,580
2,555
2,590
8,08
8,10
8,10
8,09
18
Lampiran 7 Pengaruh suhu terhadap aktivitas nitrilase pada sel TPIK 2000
Suhu
(ºC)
Absorbansi
A
rerata
[NH
4+]
mM
Aktivitas
(mM/mL.
menit)
Aktivitas
spesifik
(U/mg)
Aktivitas
relatif (%)
Ulangan
1
2
3
5
0,090
0,110
0,089
0,0963 0,9316
0,4140
0,3593
35,93
10
0,074
0,109
0,123
0,1020 0,1000
0,4444
0,3857
38,57
15
0,110
0,132
0,162
0,1347 1,3926
0,6189
0,5371
53,71
20
0,121
0,169
0,199
0,1630 1,7323
0,7699
0,6681
66,81
25
0,220
0,232
0,252
0,2347 2,5930
1,1524
1,0000
100,00
30
0,143
0,169
0,176
0,1727 1,8487
0,8216
0,7130
71,30
35
0,064
0,124
0,104
0,0973 0,9436
0,4194
0,3639
36,39
37
0,097
0,106
0,137
0,1133 1,1357
0,5048
0,4380
43,80
40
0,126
0,125
0,123
0,1267 1,2965
0,5762
0,5000
50,00
45
0,110
0,129
0,079
0,1067 1,0564
0,4695
0,4074
40,74
50
0,055
0,097
0,065
0,0650 0,5558
0,2470
0,2143
21,43
55
0,123
0,122
0,132
0,1257 1,2845
0,5709
0,4954
49,54
60
0,110
0,116
0,152
0,1260 1,2881
0,5725
0,4968
49,68
65
0,115
0,124
0,108
0,1163 1,1717
0,5208
0,4519
45,19
70
0,130
0,146
0,106
0,1273 1,3037
0,5794
0,5077
50,77
Ket: Satuan unit aktivitas (U) didefinisikan sebagai banyaknya enzim yang memproduksi NH4+
(mM) dari penguraian substrat per mL enzim per menit inkubasi percobaan.
Perhitungan: Suhu 25 °C
Y = 0,0833 X + 0,0189
0,2347 = 0,0833 X + 0,0189
X = [NH
4+] = 2,5930 mM
Aktivitas (mM/mL.min) =
enzim
volume
inkubasi
waktu
mM
NH4
=
mL
0,150
menit
15
mM
2,5930
= 1,1524 mM/mL.min
Aktivitas spesifik (U/mg) =
(mg)
protein
kadar
Aktivitas
=
1
,
0000
U/mg
mg
2,0723
mM/mL.min
1,1524
Aktivitas relatif (%) =
100
%
optimum
pada
spesifik
Aktivitas
spesifik
Aktivitas
=
100
%
100
%
U/mg
1,0000
U/mg
1,0000
19
Lampiran 8 Pengaruh pH terhadap aktivitas nitrilase pada sel TPIK 2000
Bufer pH Absorbansi A rerata [NH4+] mM Aktivitas (mM/mL. min) Aktivitas spesifik (U/mg) Aktivitas relatif (%)
Ulangan
1 2 3 Asetat 50 mM 3,5 0,118 0,120 0,120 0,1193 1,2077 0,5368 0,4252 42,52 4,0 0,122 0,106 0,143 0,1237 1,2605 0,5602 0,4438 44,38 4,5 0,132 0,167 0,142 0,1677 1,7887 0,795 0,6298 62,98 5,0 0,119 0,136 0,155 0,1367 1,4165 0,6296 0,4987 49,87 Fosfat 50 mM 4,5 0,141 0,113 0,125 0,1183 1,1957 0,5314 0,4210 42,10 5,0 0,088 0,063 0,061 0,0707 0,6242 0,2774 0,2198 21,98 5,5 0,108 0,141 0,127 0,1197 1,2125 0,5389 0,4269 42,69 6,0 0,137 0,144 0,165 0,1487 1,5606 0,6936 0,5494 54,94 6,5 0,090 0,135 0,114 0,1130 1,1321 0,5032 0,3986 39,86 7,0 0,118 0,060 0,060 0,0793 0,7275 0,3233 0,2561 25,61 7,2 0,221 0,272 0,273 0,2553 2,8403 1,2624 1,0000 100,00 7,5 0,167 0,222 0,187 0,1927 2,0888 0,9284 0,7354 73,54 8,0 0,179 0,138 0,190 0,1690 1,8043 0,8019 0,6352 63,53 Tris-HCl 50 mM 7,5 0,119 0,219 0,231 0,1897 2,0528 0,9124 0,7227 72,27 8,0 0,200 0,221 0,224 0,2150 2,3565 1,0473 0,8297 82,97 8,5 0,334 0,308 0,336 0,3260 3,6891 1,6396 1,2988 129,88 9,0 0,167 0,194 0,215 0,1920 2,0804 0,9246 0,7325 73,25 9,5 0,254 0,188 0,189 0,2100 2,2965 1,0207 0,8085 80,85
Ket: Satuan unit aktivitas (U) didefinisikan sebagai banyaknya enzim yang memproduksi NH4+ (mM) dari penguraian
substrat per mL enzim per menit inkubasi percobaan.