ANNA NABILLA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2017
KUALITAS SEMEN SAPI BALI DAN KRIOPRESERVASINYA DALAM
PENGENCER TRIS DAN SITRAT KUNING TELUR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Kualitas Semen Sapi Bali dan Kriopreservasinya dalam Pengencer Tris dan Sitrat Kuning Telur adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2017
Anna Nabilla
RINGKASAN
ANNA NABILLA. Kualitas Semen Sapi Bali dan Kriopreservasinya dalam Pengencer Tris dan Sitrat Kuning Telur. Dibimbing oleh R IIS ARIFIANTINI dan BAMBANG PURWANTARA.
Perkembangbiakan sapi bali sebagian besar dilakukan dengan teknik Inseminasi Buatan (IB) menggunakan semen beku. Proses pembekuan semen akan menurunkan kualitas semen, sehingga diperlukan modifikasi pengencer. Tujuan penelitian ini adalah untuk membandingkan kualitas semen segar sapi bali pada kelompok produktif dengan kelompok umur lewat produktif dan mengevaluasi kualitas semen beku sapi bali setelah kriopreservasi pada pengencer Tris kuning telur (TKT) dan Sitrat kuning telur (SKT) menggunakan
Dimethylformamide (DMF) dan gliserol dalam tiga konsentrasi (5%, 6%, dan 7%). Semen dikoleksi menggunakan vagina buatan dari dua kelompok umur sapi yaitu kelompok umur produktif dan kelompok umur lewat produktif masing-masing tiga ekor, yang dievaluasi semen segarnya. Semen dari tiga ekor sapi bali kelompok umur produktif dibekuan dalam pengencer TKT dan SKT dengan gliserol dan DMF sebagai krioprotektan.
Hasil percobaan menunjukkan bahwa tidak ada perbedaan pada semua parameter antar dua kelompok umur sapi (P>0.05). Motilitas setelah thawing
dalam pengencer TKT dengan berbagai konsentrasi gliserol adalah 5%, 6%, dan 7% masing-masing adalah 50.22±2.60%, 44.06±2.47%, dan 40.72±2.20%. Motilitas setelah thawing dalam pengencer TKT dengan berbagai konsentrasi DMF 5%, 6%, dan 7% berturut-turut adalah 50.44±1.94%, 47.83±2.34% dan 48.00±2.17%. Penggunaan gliserol pada pengencer SKT pada semen sapi tidak cocok. Motilitas setelah thawing sangat rendah antara 14.22±1.24% sampai 22.44±2.73%. Krioprotektan DMF dalam pengencer SKT menunjukkan hasil yang lebih baik. Konsentrasi DMF 5% (50.94±2.78%), dan 6% (54.33±1.59%) menunjukkan hasil yang sama dan keduanya lebih tinggi dibandingkan dengan 7% (43.94±2.95%).
Tidak ada perbedaan kualitas semen segar antara kelompok sapi umur produktif dan sapi lewat umur produktif, pada penelitian ini kemungkinan disebabkan karena seluruh sapi yang digunakan milik Balai Inseminasi Buatan Daerah (BIBD) Baturiti. Baturiti merupakan satu-satunya balai IB yang hanya memproduksi semen beku sapi bali. Sapi-sapi yang terdapat di BIBD Baturiti adalah sapi bibit unggul yang dipelihara dengan manajemen yang sangat baik sehingga sapi yang telah melewati umur produktif pun masih mampu menghasilkan semen yang berkualitas sama baiknya dengan semen dari kelompok umur produktif.
Motilitas setelah thawing dalam pengencer TKT tidak berbeda antara konsentrasi gliserol 5% dengan DMF 5%, 6%, dan 7%. Motilitas setelah thawing
dalam pengencer SKT menunjukkan hasil di bawah 40% dengan semua konsentrasi gliserol sehingga tidak memenuhi syarat untuk digunakan IB dan motilitas setelah thawing dalam pengencer SKT paling tinggi pada konsentrasi DMF 6% (54.33±1.59). Penggunaan gliserol menunjukkan nilai di bawah 40%, sedangkan konsentrasi DMF optimum pada konsentrasi 6% kemungkinan disebabkan oleh kemampuan pengencer SKT yang menyamai pengencer TKT
yang memiliki kandungan lengkap untuk perlindungan spermatozoa saat proses pembekuan.
SUMMARY
ANNA NABILLA. Semen Quality of Bali Bull Cattle and It‟s Cryopreservation Using Tris- and Citrate Egg Yolk Diluent. Supervised by R IIS ARIFIANTINI dan BAMBANG PURWANTARA.
Artificial insemination of frozen semen has been widely used in bali cattle breeding program. The objectives of this study were to evaluate the quality of bali bull cattle fresh semen during their productive and over productive age. The experiment were also conducted to evaluate the quality of frozen semen following cryopreservation using Tris egg yolk (TEY) and Citrate egg yolk (CEY) diluent with different concentration (5%, 6%, and 7%) of DMF and glycerol. Semen were collected using artificial vagina, three bulls for each group. Semen were evaluated macro- and microscopically. Semen from productive-age bulls were collected and undergone freezing in TEY and CEY extenders added with glycerol and dimethylformamide cryoprotectant.
Results of the experiment showed that there were no difference at all parameters between two different age groups of bali bull cattle fresh semen (P>0.05). Post-thawed motility of spermatozoa in TEY diluent were 50.22±2.60%, 44.06±2.47% and 40.72±2.20% for 5, 6 and 7% of glycerol concentration, respectively; and 50.44±1.94%, 47.83±2.34% and 48.00±2.17% of 5, 6 and 7% of DMF concentration, repectively. Moreover, post-thawed motility of spermatozoa in CEY diluent were 22.44±2.73%, 15.77±1.12%, and 14.22±1.24%, for 5, 6 and 7% of glycerol concentration, respectively; and 50.94±2.78%, 54.33±1.59% and 43.94±2.95%, of 5, 6 and 7% of DMF concentration, repectively.
There was no difference on spermatozoa motility between two age groups of bulls. It was speculated that most bulls at AI Center in Baturiti has been attributed as superior both genetically and physiologically and maintenance with high standar. The over productive age group still able to produce good quality semen comparable to the productive group. Post-thawed motility in the TEY diluent was not significantly different in 5% glycerol and 5%, 6%, or 7% DMF concentrations. Combination of TEY and DMF in all concentration and TEY with 5% glycerol demonstrated the best quality specullated that TEY itself known as diluent already has a complete composition therefore able to support spermatozoa during freezing.
Post-thawed motility in CEY diluents showed sperm motility below 40% in all glycerol concentrations, and were not eligible for AI. Post-thawed motility in CEY diluents was optimum in DMF 5% and 6%. The used of 5% and 6% DMF in CEY extender showed the best result that likely due to the similar capability of CEY and TEY to protect spermatozoa during freezing.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
KUALITAS SEMEN SAPI BALI DAN KRIOPRESERVASINYA
DALAM PENGENCER TRIS DAN SITRAT KUNING TELUR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2017
Judul Tesis : Kualitas Semen Sapi Bali dan Kriopreservasinya dalam Pengencer Tris dan Sitrat Kuning Telur
Nama : Anna Nabilla NIM : B352150091
Disetujui oleh Komisi Pembimbing
Prof Dr R. Iis Arifiantini, MSi Ketua
Prof Drh Bambang Purwantara, MSc, PhD Anggota
Diketahui oleh
Ketua Program Studi Biologi Reproduksi
Prof Dr Drh Mohamad Agus Setiadi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2017 ini ialah semen beku, dengan judul Kualitas Semen Segar Dan Kriopreservasi Semen Sapi Bali dalam Pengencer Tris dan Sitrat Kuning Telur.
Terima kasih penulis ucapkan kepada Prof Dr R. Iis Arifiantini, MSi dan Prof Drh Bambang Purwantara, MSc, PhD selaku pembimbing dan motivator yang telah meluangkan waktunya untuk membimbing serta memberikan saran dan kritik yang membangun dalam proses penulisan tesis ini. Terimakasih kepada kepala Program Studi Biologi Reproduksi Prof Dr Drh Mohamad Agus Setiadi yang juga telah memberikan motivasi selama masa studi. Terimakasih kepada Penguji Luar Komisi pada ujian tesis Drh Ni Wayan Kurniani Karja, MP, PhD yang telah memberikan saran sehingga tesis ini menjadi lebih baik.
Di samping itu, penghargaan penulis sampaikan kepada Drh Ni Putu Mahaning, I Made Sukariyana MP, I Made Sadwika SPt, Drh Ngakan Putu Oka Susanta, dan Ni Wayan Desi Kristianti SPt dari Balai Inseminasi Buatan Baturiti Bali, yang telah membantu selama penelitian dan pengumpulan data. Penulis berterimakasih kepada rekan penelitian yaitu Bq Hayyul Hidayati dan M Triyadi Herbowo yang telah membantu dan memberikan motivasi. Rasa hormat, cinta, dan kasih sayang serta terimakasih yang tak terhingga penulis ucapkan kepada orangtua, Ayah Banani dan Mama Hari Ruswanti, serta seluruh keluarga atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat bagi ilmu pengetahuan khususnya bidang reproduksi hewan.
Bogor, Mei 2017
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vii
1 PENDAHULUAN 1 Latar Belakang 1 Rumusan Masalah 2 Hipotesis Penelitian 3 Tujuan Penelitian 3 Manfaat Penelitian 3 2 TINJAUAN PUSTAKA 3
3 MATERI DAN METODE 7
Waktu dan Tempat 7
Materi Penelitian 7
Prosedur Penelitian 7
4 HASIL DAN PEMBAHASAN 12
Hasil 12
Pembahasan 16
5 SIMPULAN 20
DAFTAR PUSTAKA 20
DAFTAR TABEL
1 Bahan pengencer semen beku sapi bali Tahap 2 8
2 Bahan pengencer semen beku sapi bali Tahap 3 11
3 Karakteristik semensegar sapi bali (Rerata±SEM) 12 4 Karakteristik motilitas spermatozoa sapi bali menggunakan CASA 13 5 Motilitas, viabilitas, dan membran plasma utuh spermatozoa sapi bali
dalam pengencer TKT dengan berbagai konsentrasi gliserol dan DMF 14 6 Kualitas semen setelah pembekuan dalam pengencer SKT dengan gliserol
dan DMF 15
DAFTAR GAMBAR
1 Recovery rate spermatozoa dalam pengencer TKT dengan berbagai
konsentrasi gliserol dan DMF 14
2 Recovery rate spermatozoa dalam pengencer SKT dengan berbagai
1
PENDAHULUAN
Latar BelakangSapi bali merupakan salah satu bangsa sapi yang berkontribusi dalam perkembangan industri peternakan di Indonesia. Pada tahun 2016 populasi sapi potong Indonesia 16 093 000 ekor dan 30%-nya adalah sapi bali (Statistik Peternakan Dan Kesehatan Hewan 2016). Beberapa hasil penelitian menunjukkan sapi bali memiliki performa reproduksi dan produksi yang baik, mempunyai kualitas karkas yang tinggi (51.5-59.8%), presentase tulang <15% dari berat karkas, tahan pada kondisi lingkungan tropis dan pakan yang jelek, serta memiliki fertilitas tinggi (Supriyantono et al. 2008; Purwantara et al. 2012). Keunggulan-keunggulan tersebut membuat sapi bali diminati oleh peternak untuk dikembangbiakkan.
Tingginya minat terhadap sapi bali ini terjadi sebagai upaya untuk memenuhi pangan hewani nasional. Di sisi lain juga ditemukan masalah semakin mengecilnya proposi tubuh sapi bali yang diduga karena inbreeding. Inbreeding
terjadi karena terbatasnya pejantan yang ada di padang penggembalaan, sehingga teknologi reproduksi Inseminasi Buatan perlu dilakukan untuk mempertahankan populasi sapi bali. Semen beku sapi bali di produksi di beberapa Balai Inseminasi Buatan (BIB), salah satunya adalah Balai Inseminasi Buatan Daerah Baturiti.
Semen beku yang beredar di Indonesia harus mengikuti peraturan Undang-Undang Nomor 41 Tahun 2014 yang merupakan perubahan atas Undang-Undang-Undang-Undang nomor 18 Tahun 2009 tentang Peternakan dan Kesehatan Hewan diamanahkan dalam Pasal 13 ayat (6) Setiap benih atau bibit yang beredar wajib memiliki sertifikat benih atau bibit yg memuat keterangan mengenai silsilah dan ciri-ciri keunggulannya. Undang-undang tersebut mewajibkan semen beku yang didistribusikan harus sesuai dengan SNI semen beku sapi dengan salah satu persyaratannya adalah semen beku dihasilkan oleh pejantan yang mempunyai serifikat dan umur produktif maksimal 10 tahun.
Sapi bali merupakan sapi lokal yang kemungkinan mempunyai potensi reproduksi yang berbeda dibandingkan sapi-sapi eksotik seperti Simmental dan Limousin. Potensi reproduksi termasuk umur produktif sapi bali perlu diteliti sehingga untuk sapi-sapi lokal umur produktif dalam menghasilkan semen beku dapat dibedakan dengan sapi eksotik, sehingga umur afkirnya di BIB juga berbeda. Potensi genetik yang unggul harus disertai teknis produksi semen beku yang baik karena proses pembekuan akan menurunkan kualitas semen hingga 50% dari kondisi semen segar dan semen yang bertahan memiliki fertilitas rendah. Penggunaan pengencer yang tepat turut menentukan kualitas semen beku (Ariantie et al. 2013).
Penurunan kualitas semen terjadi pada saat produksi semen beku dan dapat diatasi dengan memodifikasi pengencer yang digunakan. Pengencer yang saat ini digunakan untuk semen beku sapi bali adalah pengencer komersial berbahan dasar soya lesitin yang seringkali terkendala penyediaannya sehingga diperlukan pengencer alternatif untuk menggantikannya. Pengencer Tris kuning telur (TKT) sudah banyak digunakan untuk kriopreservasi semen sapi karena memiliki
2
kandungan yang relatif lengkap seperti Tris (hydroxymethyl) aminomethane, asam sitrat, dan fruktosa. Komponen-komponen dalam pengencer TKT dapat menjaga stabilitas pH, mempertahankan tekanan osmotik, menjaga keseimbangan elektrolit, mengikat butir-butir lemak, sumber energi, serta melindungi sel spermatozoa dari
cold shock (Herdiawan 2004). Jenis pengencer lain yang juga dapat digunakan sebagai alternatif, yaitu Sitrat kuning telur (SKT). Pengencer Sitrat kuning telur, merupakan pengencer yang lebih ekonomis dibandingkan pengencer Tris kuning telur, namun hasilnya pada semen cair sapi FH dilaporkan Arifiantini dan Purwantara (2010) mampu menyamai penggunaan pengencer Tris kuning telur.
Spermatozoa juga membutuhkan bahan untuk mengurangi kerusakan sel pada saat pembekuan yang disebut krioprotektan. Krioprotektan yang umum digunakan adalah gliserol. Berbagai jenis amida telah digunakan sebagai krioprotektan sejak tahun 2000an, salah satunya dimethylformamide (DMF).
Dimethylformamide mempunyai berat molekul lebih kecil sehingga permeabilitasnya lebih tinggi daripada gliserol. Dimethylformamide telah dicobakan pada semen kuda (Osorio et al. 2008; Hoffman et al. 2011), semen kambing (Moustacas et al. 2011; Ariantie et al. 2013), semen domba (Jerez et al. 2016), dan semen sapi Korean Jeju Black (Oh et al. 2012).
Rendahnya toksisitas DMF membuat kualitas semen beku yang dihasilkan akan lebih baik jika dibandingkan dengan penggunaan gliserol.
Dimethylformamide juga dapat digunakan sebagai krioprotektan alternatif ketika gliserol tidak tersedia. Mengingat sapi bali merupakan plasma nutfah yang perlu dilestarikan, penggunaan DMF sebagai krioprotektan pada pengencer semen beku sapi diperlukan. Penelitian ini dilakukan untuk membandingkan kualitas semen segar sapi umur produktif dan lewat umur produktif dan membandingkan kualitas semen beku sapi bali dalam pengencer Tris kuning telur (TKT) dan Sitrat kuning telur (SKT) dengan berbagai konsentrasi gliserol dan DMF.
Rumusan Masalah
Pengencer komersial addalah pengencer utama yang digunakan untuk kriopreservasi semen sapi bali. Ketersediaannya terkadang terbatas, oleh karena itu diperlukan pengencer resep yang mudah didapat dan memiliki kemampuan sama seperti pengencer komersial untuk menghasilkan motilitas spermatozoa setelah pembekuan yang layak digunakan untuk Inseminasi Buatan (IB). Pengencer Tris kuning telur dan Sitrat kuning telur adalah bahan pengencer dasar yang umum digunakan dalam preservasi semen. Tris adalah buffer yang menjaga stabilitas pH dari asam laktat sisa aktivitas sel spermatozoa. Asam sitrat berfungsi sebagai pengikat granula kuning telur dan membantu mempertahankan tekanan osmotik dan keseimbangan elektrolit. Sedangkan kuning telur berfungsi anti cold shock pada saat ekuilibrasi.
Kriopreservasi semen memerlukan krioprotektan untuk melindungi spermatozoa dari suhu dingin. Dimethylformamide (DMF) adalah krioprotektan golongan amida yang mempunyai kemampuan meminimalisir pembentukkan kristal es intraseluler seperti gliserol dalam melindungi spermatozoa selama proses pembekuan. Gliserol selama ini paling sering digunakan dalam pengenceran semen beku yang diketahui dapat bersifat toksik untuk spermatozoa,
3 dapat mengacaukan tekanan osmotik, merusak struktur sel, juga membuat motilitas menurun yang mengakibatkan rendahnya daya fertilitas jika konsentrasinya terlalu tinggi. Penggunaan DMF dapat meminimalisir kerusakan spermatozoa karena memiliki berat molekul kecil sehingga lebih mudah penetrasi ke dalam sel spermatozoa.
Hipotesis Penelitian
Hipotesis yang diajukan dari penelitian ini adalah:
1. Kualitas semen segar sapi bali pada kelompok umur produktif dan kelompok umur lewat produktif tidak berbeda.
2. Kualitas semen beku sapi bali dalam pengencer Tris kuning telur (TKT) dengan DMF atau gliserol tidak berbeda.
3. Kualitas semen beku sapi bali dalam pengencer Sitrat kuning telur (SKT) dengan DMF atau gliserol tidak berbeda.
Tujuan Penelitian
Penelitian ini dilakukan untuk mengkaji kualitas semen segar sapi bali kelompok umur produktif dan umur lewat produktif, serta menentukan konsentrasi gliserol dan DMF terbaik dalam pengencer TKT dan SKT untuk pembekuan semen sapi bali.
Manfaat Penelitian
Mendapatkan bukti bahwa sapi umur lewat produktif masih dapat dijadikan sumber semen di Balai Inseminasi Buatan sehingga menjadi bahan pertimbangan pembuat kebijakan mengenai perbedaan umur afkir sapi lokal terutama sapi bali dan mendapatkan konsentrasi gliserol dan DMF terbaik dalam pengencer TKT dan SKT untuk pembekuan semen sapi bali.
2
TINJAUAN PUSTAKA
Sapi bali
Sapi bali bersama-sama dengan sapi Aceh dan sapi Madura telah ditetapkan sebagai salah satu plasma nutfah sapi potong lokal di Indonesia berdasarkan surat Keputusan Menteri Pertanian Republik Indonesia Nomor 2907/Kpts/OT. 140/6/2011 pada 17 Juni 2011. Sapi bali yang ada di pulau Bali merupakan bangsa murni dan memiliki penampilan, produksi maupun reproduksi yang sangat baik (UPT BIBD Provinsi Bali 2013).
Keunggulan sapi bali antara lain memiliki tingkat kesuburan mencapai 83%, mudah beradaptasi dengan iklim panas dan tangguh untuk membajak sawah
4
sehingga dapat dimanfaatkan daging dan tenaganya. Pedet sapi bali sejak lahir hingga berumur 1.5 tahun memiliki warna bulu sawo matang kemerahan, sedangkan warna bulu berubah menjadi hitam hingga dewasa.
Punggung sapi bali akan selalu ditemukan garis belut, yaitu bulu hitam yang membentuk garis memanjang dari gumba hingga pangkal ekor. Warna putih terdapat pada kaki di bawah persendian karpal dan tarsal, bibir bagian atas dan bawah, ujung ekor, tepi daun telinga, bagian pantat, paha bagian dalam berbentuk oval (white mirror), dan sapi bali memiliki bintik putih di antara bulu badan yang berwarna coklat namun hanya berkisar 1% dari populasi karena merupakan penyimpangan genetik (Inggriati dan Widianta 2015).
Bahan Pengencer Semen Beku
Bahan pengencer adalah suatu bahan yang ditambahkan untuk mengencerkan semen agar volume semen bertambah. Bahan pengencer yang baik adalah yang memiliki fungsi sebagai penyedia nutrisi untuk pembentukan energi spermatozoa, pelindung spermatozoa saat proses pembekuan, buffer untuk menjaga keseimbangan osmotik dan elektrolit, penghambat pertumbuhan kuman, dan meningkatkan volume semen agar jumlah straw yang dihasilkan lebih banyak. Bahan pengencer yang banyak digunakan untuk kriopreservasi semen sapi bali adalah pengencer komersial yang berbahan dasar soya lesitin. Bahan pengencer resep yang umum digunakan untuk pembekuan semen sapi adalah Tris kuning telur (TKT), namun diketahui pengencer Sitrat kuning telur (SKT) juga dapat menghasilkan motilitas yang baik menyamai pengencer TKT.
Krioprotektan digunakan dalam pembekuan semen sebagai pelindung terhadap perubahan suhu ekstrim dan mempertahankan membran sel spermatozoa agar tidak rusak. Kerusakan sel spermatozoa terjadi ketika peralihan massa padat menjadi gel pada proses kriopreservasi. Kerusakan dapat diminimalisir dengan penambahan krioprotektan yang dapat menembus spermatozoa dan melindungi sel dari dalam (Purdy 2004). Berdasarkan bahan aktif yang dikandungnya, krioprotektan digolongkan menjadi dua kelompok, yaitu kelompok alkohol (etilen glikol dan gliserol) dan amida (methylformamida dan dimethylformamide) (Arifiantini dan Supriatna 2007).
Bahan pengencer Tris Kuning Telur terdiri atas Tris (hydroxymethyl)
aminomethane, asam sitrat, fruktosa, kuning telur, penisilin, streptomisin dan akuades. Tris (hydroxymethyl) aminomethane dan asam sitrat berfungsi sebagai
buffer dengan mempertahankan tekanan osmotik dan keseimbangan elektrolit, serta mempertahankan pH dengan menekan pembentukan asam laktat hasil metabolisme spermatozoa.
Kuning telur berfungsi melindungi spermatozoa terhadap cold shock dan sebagai sumber energi. Tris adalah bahan pengencer dasar yang sudah dibuktikan paling baik mampu menghasilkan kualitas semen beku yang berkualitas. Wattimena (2009) menggunakan pengencer Tris kuning telur pada semen cair sapi bali pada hari ke 4 penyimpanan dengan hasil presentase motilitas 29%, viabilitas 41.80%, dan keutuhan membran plasma 42.40%.
Pengencer berbahan dasar sitrat jarang digunakan sebagai pengencer semen beku sapi namun dapat dijadikan alternatif karena natrium sitrat lebih
5 ekonomis dibandingkan Tris (hydroxymethyl) aminomethane. Fruktosa adalah golongan gula sederhana selain glukosa yang berperan sebagai sumber energi berupa adenosin trifosfat (ATP) untuk pergerakan spermatozoa. Fruktosa merupakan gugus gula sederhana dengan berat molekul kecil seperti glukosa dan umum digunakan sebagai sumber karbohidrat sebagai penyedia energi untuk menjalankan fungsi fisiologi sel dalam proses kriopreservasi (Naing et al. 2010). Fruktosa telah digunakan sebagai sumber karbohidrat pada pengencer semen sapi dan domba (Vishwanath dan Shannon 2000), semen anjing (Hermansson dan Forsberg 2006, semen sapi FH (Arifiantini dan Purwantara 2010), dan semen kambing (Naing et al. 2010). Spermatozoa yang disimpan pada suhu preservasi dalam pengencer Tris kuning telur dan Sitrat fruktosa kuning telur memiliki persentase yang tidak berbeda nyata setelah 144 hari penyimpanan. Penambahan fruktosa pada pengencer Sitrat kuning telur terbukti meningkatkan motilitas spermatozoa (Arifiantini dan Purwantara 2010).
Kuning telur mengandung lesitin dan fosfolipid. Lesitin adalah salah satu kandungan kuning telur yang memiliki kemampuan sebagai agen krioprotektan selain fosfolipid, ektrak lipid, fraksi lipoprotein dan lipoprotein spesifik yaitu low density lipoprotein (LDL) (Vishwanath dan Shannon 2000). Lesitin bersifat
membran coating untuk tetap menjaga keutuhan fosfolipid yang merupakan susunan utama membran sel spermatozoa. Penggunaan kuning telur dapat mempertahankan dan melindungi integritas selubung lipoprotein sel spermatozoa, bersifat osmotik sebagai penyanggah sel permatozoa terhadap larutan hipotonik dan hipertonik (Jones dan Martin 1973), dan sebagai krioprotektan terhadap dingin dan mencegah terjadi peningkatan kalsium ke dalam sel yang dapat merusak spermatozoa (White 1993). Kandungan 20% kuning telur dalam pengencer Sitrat kuning telur menghasilkan motilitas spermatozoa sapi Madura setelah pengenceran 51.2%, pH rata-rata 7.2, motilitas 92%, dan viabilitas post thawing 79.7% (Affandhy 1998).
Krioprotektan
Dua jenis krioprotetan yaitu krioprotektan ekstraseluler dan krioprotektan intraseluler. Krioprotektan ekstraseluoler contohnya adalah gliserol. Gliserol umum digunakan dalam pembekuan semen. Gliserol memiliki peranan penting untuk menjaga motilitas spermatozoa dalam proses ekuilibrasi. Konsentrasi gliserol yang digunakan berbeda tergantung jenis semen serta pengencer yang digunakan. Penggunaan gliserol 6% pada pengencer Tris lebih efektif mempertahankan motilitas, daya hidup dan keutuhan tudung akrosom sel sperma kambing Peranakan Etawah dibandingkan dengan konsentrasi 5% dan 7% (Tambing et al. 2000). Pada semen beku sapi dalam pengencer Tris konsentrasi gliserol yang digunakan adalah 6.4% (Arifiantini dan Yusuf 2006), sedangkan menurut Viswanath dan Shannon (2000) dosis optimum Gliserol dalam pengencer semen sapi sebesar 7%.
Gliserol mampu mengikat air dengan cukup kuat karena memiliki tiga gugus hidroksil dengan mekanisme kerja gliserol dapat berdifusi ke dalam sel spermatozoa dan dapat dimetabolisir dalam proses-proses yang menghasilkan energi dan membentuk fruktosa. Gliserol yang memasuki sel akan menggantikan
6
sebagian besar air yang bebas dan mendesak ke luar elektrolit-elektrolit, menurunkan konsentrasi intraseluler elektrolit-elektrolit tersebut dan mengurangi daya perusaknya terhadap spermatozoa (Toelihere 1993).
Dimethylformamide (DMF) adalah krioprotektan intraseluler golongan amida. Toksisitas golongan amida yang lebih rendah dari gliserol merupakan keuntungan DMF (Arientie et al. 2013), dan memiliki bobot molekul lebih rendah yang menyebabkan daya penetrasinya lebih baik dibandingkan dengan gliserol.
Dimethylformamide memiliki berat molekul 73.10 g mol-1 dengan berat jenis 0.95 dan mudah larut di dalam air serta sangat stabil (Kostaman dan Setioko 2011). Penggunaan DMF telah dilakukan pada berbagai ternak namun baru pertama kali digunakan pada sapi yaitu sapi Korean Jeju Black (Oh et al. 2012) dengan hasil penggunaan DMF 5% menunjukkan motilitas spermatozoa 59±5.48% dengan hasil yang tidak berbeda dengan penggunaan gliserol 7%, dan viabilitas spermatozoa 53.05±3.77%
Kriopreservasi dan Kerusakan Sel Spermatozoa
Kriopreservasi dilakukan dengan tujuan untuk menghentikan proses metabolisme spermatozoa, namun memiliki sisi negatif yaitu terjadi pembentukan kristal es intraselular yang bersifat merusak, membran plasma menjadi tidak stabil ketika menuju fase transisi dari cair ke gel seiring dengan menurunnya suhu, meningkatkan tekanan osmotik, dan cold shock. Dehidrasi sel spermatozoa harus terjadi sebelum air intraseluler membeku. Dehidrasi sel yang tidak maksimal akan memicu pembentukan kristal es di dalam sel sehingga menimbulkan kerusakan, namun jika sel terlalu dehidrasi maka akan terjadi kerusakan sitoskeleton sel yang bersifat letal. Pengeluaran air yang diharapkan adalah yang tidak terlalu cepat ataupun terlalu lambat agar daya hidup sel dapat dipertahankan sehingga fungsi sel secara biologis dan fisiologis tetap berlangsung.
Pembekuan yang terlalu cepat akan memicu terbentuknya kristal es diluar sel sehingga terjadi peningkatan tekanan osmotik yang membuat air keluar dari sel, sedangkan pembekuan yang terlalu cepat akan memicu kristal es di luar dan di dalam sel yang memicu peningkatan konsentrasi cairan sehingga makin banyak kristal es intraseluler yang terbentuk dan menyebabkan sel menjadi rusak. Pembentukan kristal es menandakan adanya perubahan tekanan osmotik dan dapat menyebabkan penurunan motilitas dan viabilitas spermatozoa, peningkatan pengeluaran enzim intraseluler ke ekstraseluler dan kerusakan pada mitokondria dan lisosom (Supriatna dan Pasaribu 1992). Rusaknya mitokondria menyebabkan rantai oksidasi putus dan akibatnya spermatozoa berhenti bergerak karena tidak ada pasokan energi dari mitokondria. Cekaman dingin (cold shock) pada spermatozoa akan menyebabkan penurunan aktivitas flagela, kerusakan organel intraseluler, dan kerusakan membran sel. Cold shock akan sangat mempengaruhi penurunan motilitas, viabilitas, permeabilitas membran, dan perubahan komponen lipid membran.
7
3
MATERI DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Februari-Maret 2017 di Unit Pelaksana Teknis (UPT) Balai Inseminasi Buatan Daerah (BIBD) Baturiti, Provinsi Bali, Laboratorium Processing semen sapi bali.
Materi Penelitian
Penelitian menggunakan sapi bali dari kelompok pejantan umur produktif 7-9 tahun (di bawah 10 tahun) dan kelompok pejantan umur lewat produktif 12-14 tahun (di atas 10 tahun) masing-masing 3 ekor. Sapi dipelihara dalam kandang individu yang dilengkapi dengan tempat pakan dan minum dengan pemberian air minum ad libitum. Pakan diberikan 5 kg/ekor/hari dan hijauan 50 kg/ekor/hari pada pagi dan sore hari ditambah kecambah 1 kg/ekor/minggu.
Prosedur Penelitian
Penelitian dibagi tiga tahap. Tahap I, membandingkan kualitas semen segar sapi bali umur produktif dengan sapi bali umur lewat produktif, Tahap II menguji konsentrasi gliserol dan DMF terbaik dalam pengencer Tris kuning telur (TKT) untuk pembekuan semen sapi bali, dan Tahap III menguji konsentrasi gliserol dan DMF terbaik dalam pengencer Sitrat kuning telur (SKT) untuk pembekuan semen sapi bali.
Tahap 1 Membandingkan kualitas semen segar sapi bali umur produktif dengan sapi bali umur lewat produktif
Koleksi semen
Semen dikoleksi menggunakan vagina buatan dari dua kelompok sapi umur produktif dan kelompok sapi umur lewat produktif dengan frekuensi penampungan 2 kali/ekor/minggu dan dilakukan oleh bull master. Penampungan dilakukan jam 8.00-10.00 WITA.
Evaluasi semen
Semen yang diperoleh dievaluasi secara makroskopis dan mikroskopis mengacu pada Baracaldo et al. (2007), Arifiantini dan Purwantara (2010) dan Arifiantini (2012). Evaluasi makroskopis yaitu volume semen diamati dengan melihat skala yang tertera pada tabung penampung. Warna dilihat secara visual. Konsistensi diamati dengan cara memiringkan tabung penampung semen, kemudian ditegakkan kembali ke posisi semula, kriteria penilaian adalah kental, sedang, dan encer. Derajat keasaman (pH) semen diukur menggunakan pH special indicator paper.
Evaluasi mikroskopis meliputi gerakan massa, dan skor gerakan individu, spermatozoa hidup dan mati (viabilitas) dan morfologi spermatozoa dengan
8
pewarna eosin nigrosin menggunakan mikroskop (Olympus CH21) yang dilengkapi dengan heating table. Konsentrasi spermatozoa dihitung menggunakan
photometer SDM 6. Evaluasi gerakan motilitas dilakukan menggunakan
Computerized Assisted Sperm Analysis (Sperm vision, Minitub, Germany). Tahap 2 Menguji beberapa konsentrasi gliserol dan DMF dalam pengencer
Tris kuning telur (TKT) untuk pembekuan semen sapi bali.
Persiapan bahan pengencer
Tahap 2, menggunakan pengencer TKT yang terbuat dari 3.03 g Tris (hydroxymethyl) aminomethane, 1.78 g asam sitrat dan 1.25 g fruktosa, dilarutkan dalam 100 mL aquades (Arifiantini dan Purwantara 2010). Bahan pengencer semen beku terdiri atas 6 macam yaitu TKT dengan 3 konsentrasi gliserol dan TKT dengan 3 konsentrasi DMF (Tabel 1).
Tabel 1 Bahan pengencer semen beku sapi bali Tahap 2
Bahan Pengencer TKTG5 TKTG6 TKTG7 TKTD5 TKTD6 TKTD7 Buffer Tris (%) 76 75 74 76 75 74 Kuning telur (%) 20 20 20 20 20 20 Gliserol (%) 5 6 7 - - - DMF (%) - - - 5 6 7 Penisilin (IU ml-1) 1000 1000 1000 1000 1000 1000 Streptomisin (mg ml-1) 1 1 1 1 1 1
Ket:TKTG5 = Tris Kuning Telur+gliserol 5%; TKTG6 = Tris Kuning Telur +gliserol 6%;
TKTG7 = Tris Kuning Telur +gliserol 7%; TKTD5 = Tris Kuning Telur +DMF 5%;
TKTD6 = Tris Kuning Telur +DMF 6%; TKTD7 = Tris Kuning Telur +DMF 7%. Pengolahan Semen
Semen dikoleksi dari tiga ekor sapi umur produktif dengan metode penampungan dan prosedur evaluasi semen yang sama seperti yang dilakukan pada Tahap I. Semen dibagi ke dalam 6 tabung masing-masing diencerkan dengan TKTG5, TKTG6, TKTG7, TKTD5, TKTD6, dan TKTD7. Semen yang telah
diencerkan dikemas dalam straw 0.25 ml kemudian diekuilibrasi selama 4 jam pada suhu 5 °C, setelah itu dibekukan di atas uap N2 cair kemudian dimasukkan ke
dalam N2 cair sesuai prosedur di Balai Inseminasi Buatan Baturiti.
Evaluasi Makroskopis
Volume semen diamati dengan melihat skala yang tertera pada tabung penampung. Pengamatan warna dilakukan secara visual. Normalnya akan berwarna krem atau putih susu. Semen tidak normal jika menunjukkan warna putih kemerahan yang berarti terdapat perlukaan dan warna putih kehijauan yang berarti mengandung bakteri tertentu. Konsistensi diamati dengan cara spuit dimemiringkan tabung penampung semen miringkan dan ditegakkan kembali ke posisi semula. Konsistensi encer ditandai dengan semen yang dengan cepat kembali ke dasar tabung. Konsistensi sedang ditandai dengan kembalinya semen ke dasar tabung dengan kecepatan yang lebih lambat dibandingkan konsistensi encer dan menyisakan sedikit semen yang turun agak cepat dari pinggir tabung. Konsistensi kental ditandai dengan kembalinya semen ke dasar tabung secara
9 perlahan dan menyisakan sebagian besar semen yang turun perlahan di pinggiran tabung. Derajat keasaman (pH) semen diamati menggunakan pH special indicator paper yang berskala sempit 6.4–8. Semen diteteskan di atas potongan pH special indicator paper dan diamati setelah 15-30 detik kemudian menyesuaikan warna yang didapat dengan standar pH special indicator paper.
Evaluasi Mikroskopis
Gerakan massa diamati untuk melihat gerakan spermatozoa yang bergerak secara keseluruhan. Preparat dibuat dengan cara meneteskan semen pada object glass preparat gantung kemudian dihangatkan pada heating table 10-15 detik.
Pengamatan menggunakan mikroskop dengan pembesaran 10x10 (100 kali). Penilaian dilakukan dengan melihat tebal tipisnya gelombang massa spermatozoa dan kecepatan gelombang spermatozoa berpindah tempat. Kriteria penilaian terbagi 4 yaitu (+++) gelombang massa tebal dan cepat berpindah tempat; (++) gelombang massa tebal namun lambat berpindah tempat atau gelombang massa sedang namun cepat berpindah tempat; (+) gelombang massa tipis dan lambat berpindah tempat; (-) tidak ada gelombang massa.
Motilitas dan Gerakan Individu dinilai dengan melihat melalui mikroskop dan Computerized Assisted Sperm Analysis (CASA). Pengamatan motilitas gerakan individu melalui mikroskop dengan menilai gerakan spermatozoa secara individu yang bergerak aktif progresif bergerak maju dibandingkan dengan gerakan spermatozoa yang lainnya dan dinilai dengan persentase. Semen diencerkan menggunakan NaCl fisiologis untuk memudahkan pengamatan. Preparat dibuat dengan meneteskan semen dan NaCl di atas object glass dengan perbandingan 1:4 atau 1:5 kemudian dihomogenkan dan dihangatkan dengan
heating table. Selanjutnya 1 tetes kecil campuran larutan diambil dan ditutup dengan cover glass dan diamati di bawah mikroskop dengan pembesaran 10x40 atau 10x45.
Penilaian dilakukan pada 10 lapang pandang dengan maksimal 20 sel spermatozoa dalam setiap lapang pandang. Hasil penghitungan motilitas berupa persentase dari perbandingan spermatozoa yang aktif progresif dengan yang bergerak selain progresif sedangkan penilaian gerakan individu (velositas) spermatozoa dalam skor antara 0-5 (Toelihere 1993), dengan kriteria penilaian 0 adalah spermatozoa tidak bergerak (immotil); 1 adalah gerakan berputar ditempat; 2 adalah gerakan berayun atau melingkar, kurang dari 50 bergerak progresif atau tidak ada gelombang; 3 adalah 50%-80% spermatozoa bergerak progresif dan menghasilkan gerakan massa; 4 adalah pergerakan progresif gesit dan segera membentuk gelombang dengan 90% sel spermatozoa motil; dan 5 adalah gerakan sangat progresif, gelombang sangat cepat bergerak dengan 100% motil aktif.
Konsentrasi Spermatozoa diamati menggunakan SDM 6. Penghitungan konsentrasi menggunakan SDM 6 dengan melihat skor yang tertera pada layar hasil penghitungan, sedangkan penghitungan menggunakan counting chamber
dilakukan dengan mengencerkan semen dalam larutan formol saline. Pembuatan larutan formol saline adalah mencampurkan disodium hydrogen phosphate dehydrate 6.19 g, potassium di-hydrogen phosphate 3.54 g, sodium chloride 5.41 g, formaldehyde solution 37% 125 ml kedalam akuades 875 ml.
Semen dimasukkan dalam formol saline dengan perbandingan 1:200 (5 µl semen:995 µl formol saline) kemudian dihomogenkan dengan membuat putaran
10
seperti angka 8 selama 2-3 menit. Semen yang telah diencerkan diambil dengan mikropipet kemudian dimasukkan ke dalam counting chamber sebanyak 8 µl–10 µl dan diamati di bawah mikroskop dengan pembesaran 40x10.
Rasio spermatozoa hidup dan mati (viabilitas) dinilai dengan membuat preparat ulas dibuat dengan meneteskan semen dan eosin nigrosin pada object glass dengan perbandingan 1:4. Campuran tersebut dihomogenkan kemudian dibuat preparat ulas pada object glass berbeda setelah itu dikeringkan dengan
heating table selama 10-15 detik. Pengamatan dilakukan pada 10 lapang pandang atau hingga jumlah sel minimal >200 sel. Spermatozoa hidup tidak menyerap warna, sedangkan spermatozoa mati akan menyerap warna. Pewarna eosin nigrosin dibuat dengan cara mencampurkan 20 g nigrosin dan sodium sitrat 1.5 g dalam 300 ml akuades kemudian dihomogenkan.
Morfologi spermatozoa adalah penilaian yang dilakukan untuk menentukan normalitas dan abnormalitas spermatozoa yang dilakukan seperti membuat preparat penilaian viabilitas namun tanpa perlu dikeringkan dengan heating table. Cara penghitungan abnormalitas yaitu melakukan pengamatan pada 10 lapang pandang dengan jumlah sel minimal > 200 sel dan abnormalitas sel dilihat bentuk keseluruhan dari kepala sampai ekor.
Evaluasi semen setelah pembekuan
Semen di-thawing dalam waterbath (suhu 37°C) kemudian dilakukan pengamatan terhadap motilitas dan viabilitas spermatozoa serta keutuhan membran plasma (MPU). Pengujian motilitas dilakukan dengan cara meneteskan satu tetes semen beku yang telah di thawing di atas object glass dan ditutup dengan cover glass. Pengamatan viabilitas spermatozoa dilakukan dengan cara mencampur semen dengan pewarna eosin nigrosin 1:1, dibuat preparat ulas kemudian dikeringan. Penghitungan dilakukan sama seperti pada semen segar. Penghitungan MPU dilakukan dengan metode hypoosmotic swelling tes (HOST) yaitu memaparkan spermatozoa dalam larutan hipoosmotik yang dibuat dari 0.9 g fruktosa dan 0.49 g Natrium sitrat yang dilarutkan dengan akuades hingga 100 ml. Sebanyak 10-20 μl semen beku yang telah di-thawing dimasukkan ke dalam 1000 μl larutan HOST, dihomogenkan kemudian diinkubasi pada suhu 37 °C selama 30–45 menit. Penghitungan dilakukan di bawah mikroskop dengan meneteskan campuran semen dan larutan HOST dan di atas object glass kemudian ditutup dengan cover glass. Spermatozoa dihitung pada 10 lapang pandang atau hingga 200 sel. Spermatozoa dengan membran plasma utuh ditandai oleh ekor yang menggembung atau melingkar, sedangkan yang rusak ditandai oleh ekor yang lurus. Pemeriksaan recovery rate dilakukan dengan rumus :
11 Tahap 3 Menguji beberapa konsentrasi gliserol dan DMF dalam pengencer Sitrat
kuning telur (SKT) untuk pembekuan semen sapi bali. Persiapan bahan pengencer
Tahap 3 menggunakan pengencer Sitrat kuning telur yang terbuat dari 1.25 g fruktosa dan 2.32 g natrium sitrat (Arifiantini dan Purwantara 2010). Bahan pengencer semen beku terdiri atas 6 macam yaitu SKT dengan 3 konsentrasi gliserol dan SKT dengan 3 konsentrasi DMF (Tabel 2).
Tabel 2 Bahan pengencer semen beku sapi bali Tahap 3
Bahan Pengencer SKTG5 SKTG6 SKTG7 SKTD5 SKTD6 SKTD7 Buffer Sitrat (%) 76 75 74 76 75 74 Kuning telur (%) 20 20 20 20 20 20 Gliserol (%) 5 6 7 - - DMF (%) - - - 5 6 7 Penisilin (IU ml-1) 1000 1000 1000 1000 1000 1000 Streptomisin (mg ml-1) 1 1 1 1 1 1
Ket : SKTG5 = Sitrat Kuning Telur+gliserol 5%; SKTG6 = Sitrat Kuning Telur +gliserol
6%; SKTG7 = Sitrat Kuning Telur +gliserol 7%; SKTD5 = Sitrat Kuning Telur +DMF
5%; SKTD6 = Sitrat Kuning Telur +DMF 6%; SKTD7 = Sitrat Kuning Telur +DMF
7%.
Pengolahan Semen
Semen dikoleksi dan dievaluasi seperti tahap 2, selanjutnya semen dibagi ke dalam 6 tabung masing-masing diencerkan dengan TKTG5, TKTG6, TKTG7,
TKTD5, TKTD6, dan TKTD7. Semen yang telah diencerkan dikemas, diekuilibrasi
dan dibekukan sama seperti pengolahan semen pada Tahap 2. Evaluasi semen setelah ekuilibrasi dan setelah thawing
Semen di-thawing pada water bath dengan suhu 37 °C kemudian dilakukan pengamatan motilitas setelah thawing, viabilitas, membran plasma utuh, dan menghitung recovery rate sama seperti pada Tahap 2.
Rancangan Penelitian dan Analisis Data
Rancangan penelitian dan analisis data pada Tahap I menggunakan uji T sampel bebas dan Tahap 2 dan tahap 3 menggunakan Rancangan Acak Lengkap (RAL) Faktorial dan dilanjutkan dengan uji Duncan (Steel dan Torrie 1993).
12
4
HASIL DAN PEMBAHASAN
Hasil
Tahap 1 Membandingkan kualitas semen segar sapi bali umur produktif dengan sapi bali umur lewat produktif
Hasil penelitian kualitas semen segar sapi bali disajikan pada Tabel 3 menunjukkan seluruh parameter kualitas semen segar tidak menunjukkan perbedaan (P>0.05).
Tabel 3 Karakteristik semen segar sapi bali (Rerata±SEM)
Parameter
Kelompok umur
Umur produktif Umur lewat
produktif Makroskopis (n=123)
Volume (mL) 6.33±1.11 4.53±0.88
Warna Krem Krem-putih susu
Konsistensi Sedang Kental
pH 6.40±0.00 6.41±0.01
Mikroskopis
Gerakan massa 2.67±0.10 2.51±0.15
Gerakan individu 2.89±0.16 3.82±0.25
Motilitas (%) 69.56±0.56 68.56±2.08
Konsentrasi spermatozoa (106 sel mL-1) 1 012.11±79.15 1 007.22± 135.91 Konsentrasi per ejakulat (106 sel) 6061.64±990.81 5244.56±709.52
Viabilitas spermatozoa (%) 78.17±3.48 72.67±4.28
Abnormalitas spermatozoa (%) 6.99±1.25 5.21±0.79
Volume semen kelompok umur produktif dibandingkan dengan volume semen kelompok umur lewat produktif tidak menunjukkan perbedaan. Kedua kelompok umur menunjukkan warna semen dalam kisaran normal dari putih susu hingga krem. Warna semen merupakan penilaian yang subjektif. Warna berkaitan erat dengan konsistensi dan konsentrasi. Semen dengan warna krem umumnya memiliki konsistensi kental dan konsentrasi yang tinggi, sedangkan semen dengan warna putih susu umumnya memiliki konsistensi dan konsentrasi sedang. Skor gerakan massa spermatozoa yang didapat dari penelitian ini adalah 2.67±0.10 dan 2.51±0.15, mengacu pada kriteria penilaian gerakan massa yaitu (+++) gelombang massa tebal dan cepat berpindah tempat; (++) gelombang massa tebal namun lambat berpindah tempat atau gelombang massa sedang namun cepat berpindah tempat; (+) gelombang massa tipis dan lambat berpindah tempat; (-) tidak ada gelombang massa (Arifiantini 2012). Motilitas secara visual yang didapat dari penelitian ini adalah 69.56±0.56% dan 68.56±2.08%.
Skor gerakan individu spermatozoa yang didapat dari penelitian ini adalah 2.89±0.16 dan 3.82±0.25, mengacu pada Toelihere (1993) bahwa skor 0 adalah spermatozoa tidak bergerak (Immotil); skor 1 adalah gerakan berputar ditempat; skor 2 adalah gerakan berayun atau melingkar, kurang dari 50 bergerak progresif atau tidak ada gelombang; skor 3 adalah 50%-80% spermatozoa bergerak
13 progresif dan menghasilkan gerakan massa; skor 4 adalah pergerakan progresif gesit dan segera membentuk gelombang dengan 90% sel spermatozoa motil; dan skor 5 adalah gerakan sangat progresif, gelombang sangat cepat bergerak dengan 100% motil aktif. Secara mikroskopis, gerakan massa, skor individu, viabilitas, konsentrasi spermatozoa per ml dan konsentrasi spermatozoa per ejakulat serta morfologi spermatozoa menunjukkan nilai yang tidak berbeda antara dua kelompok umur (P>0.05).
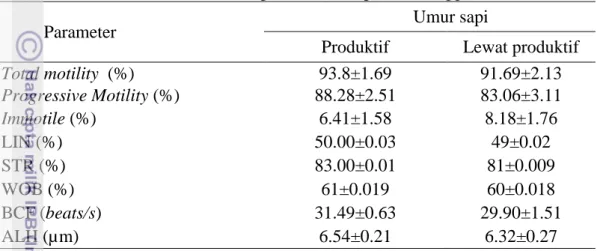
Tabel 4 Karakteristik motilitas spermatozoa sapi bali menggunakan CASA
Parameter Umur sapi
Produktif Lewat produktif
Total motility (%) 93.8±1.69 91.69±2.13 Progressive Motility (%) 88.28±2.51 83.06±3.11 Immotile (%) 6.41±1.58 8.18±1.76 LIN (%) 50.00±0.03 49±0.02 STR (%) 83.00±0.01 81±0.009 WOB (%) 61±0.019 60±0.018 BCF (beats/s) 31.49±0.63 29.90±1.51 ALH (µm) 6.54±0.21 6.32±0.27
Ket : Immotile= Spermatozoa tidak bergerak; LIN = Linearity; STR= Straightness; WOB= Wobble; BCF= Beat cross frequency; ALH= Amplitude of lateral displacement of the sperm head.
Karakteristik motilitas pada kedua kelompok umur yang dievaluasi menggunakan CASA tidak menunjukkan perbedaan (P>0.05). Motilitas total, motilitas progresif, immotile, linearity, straightness, wobble; beat cross frequency; amplitude of lateral displacement disajikan pada Tabel 4. Frekuensi gerakan spermatozoa per menit disebut beat cross frequency (BCF), frekuensi gerakan spermatozoa kelompok umur produktif tidak berbeda dibandingkan kelompok umur lewat produktif. Salah satu indikator gerakan hiperaktif dari spermatozoa adalah amplitude of lateral displacement of the sperm head (ALH). Nilai ALH >7 μm menandakan spermatozoa tersebut hiperaktif (Marquez dan Suarez 2007). Hasil penelitian ini menunjukkan nilai ALH dari kedua kelompok sapi bernilai di bawah 7 sehingga spermatozoa sapi dari kedua kelompok umur tidak hiperaktif. Keseluruhan nilai CASA yang didapat pada penelitian ini menunjukkan karakteristik yang normal.
Tahap 2 Penentuan konsentrasi gliserol dan DMF dalam pengencer Tris kuning telur (TKT) untuk pembekuan semen sapi bali.
Motilitas semen segar pada penelitian Tahap 2 adalah 72.44±1.68% dan secara keseluruhan terjadi penurunan motilitas dari semen segar, setelah ekuilibrasi, dan setelah thawing. Setelah ekuilibrasi motilitas spermatozoa dalam pengencer TKT dengan gliserol dan DMF menunjukkan nilai lebih dari 60%. Motilitas spermatozoa setelah thawing dalam pengencer TKT dengan konsentrasi gliserol 5% dan DMF 5%, 6% dan 7% menunjukkan nilai yang sama. Tabel 5 menunjukkan nilai motilitas spermatozoa lebih dari 40% (Batas minimal SNI
14
semen beku sapi), sehingga semen beku dalam pengencer dan krioprotektan ini layak untuk digunakan IB. Viabilitas spermatozoa dalam pengencer TKT menunjukkan nilai paling tinggi pada konsentrasi gliserol 7% dan DMF 5%. Keutuhan membran plasma spermatozoatidak berbeda pada seluruh konsentrasi gliserol dan DMF dengan nilai antara 77.72% sampai dengan 82.16%.
Tabel 5 Motilitas, viabilitas, dan membran plasma utuh spermatozoa sapi bali dalam pengencer TKT dengan berbagai konsentrasi gliserol dan DMF (Rerata±SEM). Parameter spermatozoa (%) Pengencer TKTG5 TKTG6 TKTG7 TKTD5 TKTD6 TKTD7 Motilitas SS ---72.44±1.68--- SE 65.33±1.97ab 67.00±1.01bc 63.83±1.00a 70.16±0.90d 69.00±0.30cd 68.83±0.27cd ST 50.22±2.60b 44.06±2.47ab 40.72±2.20a 50.44±1.94b 47.83±2.34b 48.00±2.17b Viabilitas 57.11±2.74ab 57.06±2.16ab 58.89±2.81b 59.5±1.99b 58.83±2.40ab 51.17±2.16a MPU 82.16±3.76 79.11±4.54 77.72±5.37 81.17±4.13 77.78±5.01 80.33±4.48
Ket: Huruf berbeda yang mengikuti angka pada baris menunjukkan perbedaan yang nyata (P<0.05). SS = Semen segar, SE = Setelah ekuilibrasi, ST = Setelah thawing, MPU=membran plasma utuh. TKTG5 = Tris Kuning Telur+gliserol 5%; TKTG6 = Tris Kuning Telur +gliserol
6%; TKTG7 = Tris Kuning Telur +gliserol 7%; TKTD5 = Tris Kuning Telur +DMF 5%;
TKTD6 = Tris Kuning Telur +DMF 6%; TKTD7 = Tris Kuning Telur +DMF 7%.
Gambar 1 Recovery rate spermatozoa dalam pengencer TKT dengan berbagai konsentrasi krioprotektan gliserol dan DMF
Salah satu parameter keberhasilan kriopreservasi pada semen adalah nilai
Recovery rate (RR). Recovery rate merupakan kemampuan spermatozoa pulih dari pembekuan. Nilai RR dari spermatozoa dalam pengencer TKT dengan berbagai konsentrasi gliserol dan DMF ditunjukkan pada Gambar 2. Nilai RR pada pegencer TKT dengan gliserol 5%, 6%, dan 7% berturut-turut adalah
15 69.25±3.26, 60.89±3.38, dan 56.28±3.05. Nilai RR dengan DMF adalah 5%, 6%, dan 7% berturut-turut yaitu 69.96±2.92, 66.13±3.22, dan 66.46±3.00. Nilai RR tertinggi ditunjukkan oleh spermatozoa dalam pengencer TKT dengan gliserol dan DMF konsentrasi 6% (63.33±2.40 dan 68.67±2.33).
Tahap 3 Penentuan konsentrasi gliserol dan DMF dalam pengencer Sitrat kuning telur (SKT) untuk pembekuan semen sapi bali.
Motilitas semen segar pada penelitian Tahap 3 adalah 73.56±1.47% dan secara terjadi penurunan motilitas dari semen segar, setelah ekuilibrasi, dan setelah thawing. Setelah ekuilibrasi motilitas spermatozoa dalam pengencer SKT dengan gliserol dan DMF masih menunjukkan nilai lebih dari 50%. Konsentrasi gliserol dan DMF 5% dalam pengencer SKT masih dapat mempertahankan motilitas hingga ekuilibrasi dengan motilitas antara 55.83±3.50% sampai dengan 66.58±1.09%. Seluruh konsentrasi gliserol yang digunakan dalam pengencer SKT menunjukkan motilitas setelah thawing di bawah 40%, namun hasil paling tinggi adalah dengan penggunaan gliserol 5% yaitu sebesar 22.44±2.73% dan paling rendah dengan gliserol 7% yaitu 14.22±1.24%. Hasil yang didapat membuktikan bahwa kombinasi pengencer SKT dan gliserol pada spermatozoa sapi bali pada penelitian ini tidak dapat digunakan untuk Inseminasi Buatan (IB). Konsentrasi optimum DMF dalam pengencer SKT adalah 6% dengan motilitas sebesar 54.33±1.59% dan paling rendah dengan DMF 7% yaitu 43.94±2.95%.
Tabel 6 Motilitas, viabilitas, dan membran plasma utuh spermatozoa sapi bali dalam pengencer SKT dengan berbagai konsentrasi gliserol dan DMF (Rerata±SEM). Parameter spermatozoa (%) Pengencer SKTG5 SKTG6 SKTG7 SKTD5 SKTD6 SKTD7 Motilitas SS ---73.56±1.47--- SE 64.89±1.96bc 61.70±1.98b 62.01±1.99bc 66.58±1.09c 65.05±2.22bc 55.83±3.50a ST 22.44±2.73b 15.77±1.12ab 14.22±1.24a 50.94±2.78d 54.33±1.59d 43.94±2.95c Viabilitas 51.44±3.06ab 47.83±3.37a 59.00±3.87b 50.00±2.45ab 43.33±3.94a 47.94±2.77a MPU 77.83±1.14bc 78.55±1.67bc 80.55±1.56c 65.16±4.72a 73.22±2.12b 73.72±1.91bc
Ket: Huruf berbeda yang mengikuti angka pada baris menunjukkan perbedaan yang nyata (P<0.05). SS = Semen segar, SE = Setelah ekuilibrasi, ST = Setelah thawing, MPU=membran plasma utuh. SKTG5 = Sitrat Kuning Telur+gliserol 5%; SKTG6 = Sitrat Kuning Telur +gliserol 6%; SKTG7 = Sitrat Kuning Telur +gliserol 7%; SKTD5 = Sitrat Kuning Telur +DMF 5%; SKTD6 = Sitrat Kuning Telur +DMF 6%; SKTD7 = Sitrat Kuning Telur +DMF 7%.
Viabilitas spermatozoa setelah thawing paling tinggi ditunjukkan gliserol 7% (59.00±3.87) dan DMF 5% (50.00±2.45). Viabilitas paling rendah ditunjukkan oleh penggunaan gliserol 6% (47.83±3.37%) dan DMF 6% (43.33±3. 94%). Hasil yang didapat dari penelitian ini, viabilitas spermatozoa tidak berbeda jauh dengan viabilitas setelah thawing pada semen sapi PO 51.7±0.90% (Shoae
16
dan Zamiri 2008). Konsentrasi gliserol dan DMF 7% dalam pengencer SKT sama-sama menunjukkan nilai MPU paling tinggi yaitu 80.55±1.56% dan 73.72±1.91%.
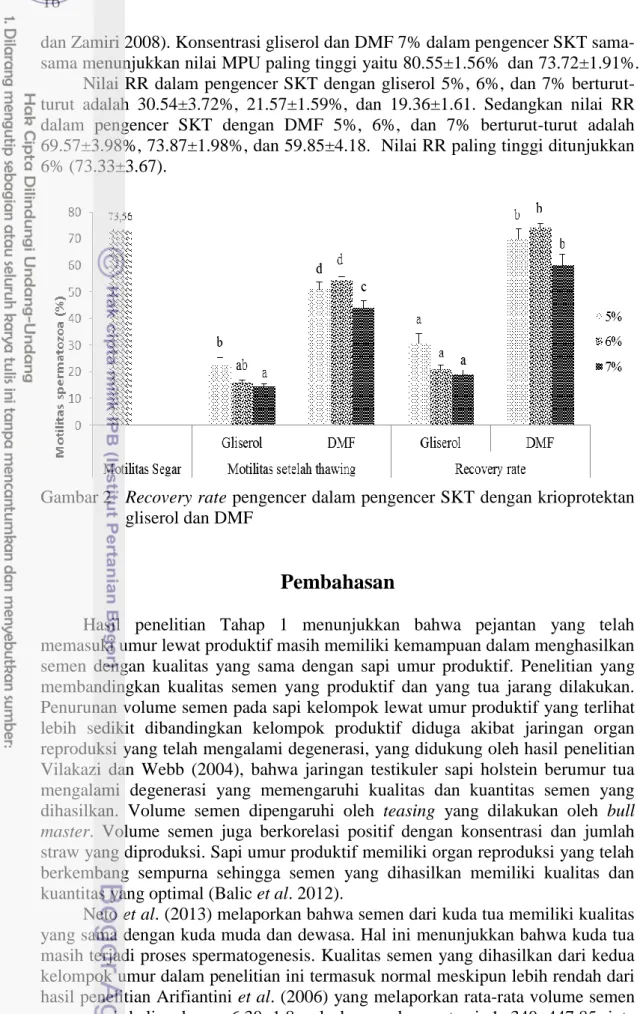
Nilai RR dalam pengencer SKT dengan gliserol 5%, 6%, dan 7% berturut-turut adalah 30.54±3.72%, 21.57±1.59%, dan 19.36±1.61. Sedangkan nilai RR dalam pengencer SKT dengan DMF 5%, 6%, dan 7% berturut-turut adalah 69.57±3.98%, 73.87±1.98%, dan 59.85±4.18. Nilai RR paling tinggi ditunjukkan 6% (73.33±3.67).
Gambar 2 Recovery rate pengencer dalam pengencer SKT dengan krioprotektan gliserol dan DMF
Pembahasan
Hasil penelitian Tahap 1 menunjukkan bahwa pejantan yang telah memasuki umur lewat produktif masih memiliki kemampuan dalam menghasilkan semen dengan kualitas yang sama dengan sapi umur produktif. Penelitian yang membandingkan kualitas semen yang produktif dan yang tua jarang dilakukan. Penurunan volume semen pada sapi kelompok lewat umur produktif yang terlihat lebih sedikit dibandingkan kelompok produktif diduga akibat jaringan organ reproduksi yang telah mengalami degenerasi, yang didukung oleh hasil penelitian Vilakazi dan Webb (2004), bahwa jaringan testikuler sapi holstein berumur tua mengalami degenerasi yang memengaruhi kualitas dan kuantitas semen yang dihasilkan. Volume semen dipengaruhi oleh teasing yang dilakukan oleh bull master. Volume semen juga berkorelasi positif dengan konsentrasi dan jumlah straw yang diproduksi. Sapi umur produktif memiliki organ reproduksi yang telah berkembang sempurna sehingga semen yang dihasilkan memiliki kualitas dan kuantitas yang optimal (Balic et al. 2012).
Neto et al. (2013) melaporkan bahwa semen dari kuda tua memiliki kualitas yang sama dengan kuda muda dan dewasa. Hal ini menunjukkan bahwa kuda tua masih terjadi proses spermatogenesis. Kualitas semen yang dihasilkan dari kedua kelompok umur dalam penelitian ini termasuk normal meskipun lebih rendah dari hasil penelitian Arifiantini et al. (2006) yang melaporkan rata-rata volume semen segar sapi bali sebesar 6.30±1.8 ml dengan konsentrasi 1 340±447.85 juta
17 spermatozoa per ml, selain itu kualitas semen yang didapat juga menunjukkan bahwa program pemuliaan pejantan sapi bali berjalan dengan baik karena sumber semen dipilih melalui seleksi dan manajemen pemeliharaan yang baik di Balai Inseminasi Buatan.
Tidak ada perbedaan antara kelompok sapi umur produktif dan sapi lewat umur produktif kemungkinan disebabkan karena seluruh sapi yang berada di Balai Inseminasi Buatan Daerah Baturiti adalah bibit unggul sehingga sapi yang telah melewati umur produktif pun masih mampu menghasilkan semen yang berkualitas sama baiknya dengan semen dari kelompok umur produktif.
Abnormalitas yang paling banyak ditemukan pada penelitian tahap 1 yaitu
bent tail sebesar 5.67%. Bent tail merupakan jenis abnormalitas sekunder yang dicirikan dengan melingkarnya ekor dengan rapat dari ujung ekor dengan tingkatan yang beragam. Bagian yang melingkar terbungkus oleh sitoplasma atau membran yang menyebabkan motilitas terganggu. Abnormalitas primer yang ditemukan pada penelitian Tahap 1 adalah macrochepalic dengan presentase 1.05%. Macrochepalic merupakan abnormalitas yang terjadi pada kepala spermatozoa dan digolongkan abnormalitas primer dan erat kaitannya dengan genetik. Kelainan macrochepalic terjadi akibat kekurangan atau kelebihan kromatin inti yang mengarah pada berlebihnya atau berkurangnya pembentukan kromosom inti (Arifiantini et al. 2006).
Abnormalitas yang ditemukan pada penelitian ini lebih rendah dibandingkan yang ditemukan pada spermatozoa sapi bali (Arifiantini et al. 2006) dan pada sapi PO (Ratnawati dan Affandhy, 2013) yaitu 9.38% dan 7.10±8.10%. Abnormalitas hasil penelitian tahap ini lebih tinggi dibandingkan penelitian Salim et al. (2012) serta Yuliani dan Lukman (2013), melaporkan bawa abnormalitas sapi bali berturut turut adalah 1.85±0.02% yaitu 3,78%. Hasil penelitian pada tahap ini masih di bawah batas minimal abnormalitas yang diperbolehkan. Abnormalitas dianggap serius jika mencapai 18-20% karena dapat menyebabkan penurunan fertilitas (Barth dan Oko 1989).
Motilitas total dan motilitas progresif linier berkaitan erat dengan daya tahannya terhadap pembekuan (Kathiravan et al. 2010). Spermatozoa dinilai bergerak secara linear lurus ke depan jika menunjukkan nilai STR>50 dan LIN>35 (Minitube 2004), maka didapat bahwa spermatozoa sapi bali dari kedua kelompok umur bergerak secara linear. Menurut Katebi et al. (2005), LIN adalah indikator motilitas progresif yang berperan dalam karakteristik fungsi spermatozoa dan STR adalah swimming pattern. WOB adalah goyangan spermatozoa terkuat per detik, sehingga berdasarkan hasil penelitian diketahui bahwa kelompok umur lewat produktif akan memiliki kemampuan fertilisasi yang sama baiknya dengan kelompok umur produktif.
Hasil penelitian Tahap 2 menunjukkan secara keseluruhan terjadi penurunan motilitas pada setiap tahap pembekuan. Motilitas semen segar pada penelitian Tahap 2 adalah 72.44±1.68%, kemudian terjadi penurunan motilitas pada ekuilibrasi berkisar antara 63.83±1.00% sampai dengan 69.00±0.30%. Penurunan motilitas ini disebabkan oleh hilangnya kemampuan spermatozoa untuk bergerak akibat rusaknya membran sel spermatozoa. Motilitas spermatozoa sapi bali setelah
thawing dalam pengencer TKT secara keseluruhan menunjukkan nilai di atas 40% dengan konsentrasi optimum gliserol 5% (50.22±2.60%) dan DMF 5% (50.44±1.94%), 6% (47.83±2.34%), dan 7% (48.00±2.17%). Motilitas setelah
18
thawing dalam pengencer TKT tidak berbeda pada konsentrasi gliserol 5% dan DMF 5%, 6%, dan 7%, namun optimal pada konsentrasi gliserol 5% (50.22±2.60%) dan DMF 5% (50.44±1.94%). Penggunaan kombinasi gliserol dan DMF 5% dalam pengencer TKT menunjukkan hasil yang optimal kemungkinan disebabkan pengencer TKT sudah memiliki komposisi yang lengkap untuk hidup spermatozoa pada saat pembekuan, sehingga tidak memerlukan krioprotektan dengan konsentrasi yang banyak. Konsentrasi gliserol dan DMF yang lebih tinggi dari 5% menunjukkan penurunan motilitas setelah thawing, hal ini kemungkinan karena konsentrasi lebih dari 5% berlebihan untuk spermatozoa sehingga tidak lagi bersifat melindungi namun bersifat toksik.
Pengencer TKT memiliki komposisi yang lebih lengkap karena mengandung Tris, fruktosa, lipoprotein, dan lesitin yang berperan sebagai penyedia zat makanan dan sumber energi untuk spermatozoa mempertahankan hidupnya saat pembekuan. Trisadalah buffer yang memiliki kemampuan menjaga stabilitas pH. Fruktosa merupakan gula sederhana yang berperan sebagai sumber energi bagi spermatozoa untuk mendukung motilitasnya. Motilitas spermatozoa setelah thawing dalam pengencer TKT pada penelitian ini berkisar antara 40.72±2.20% sampai dengan 50.44±1.94%, hasil yang diperoleh masih dalam kisaran yang sama seperti penelitian El Sisy et al. (2016) pada semen kerbau yaitu 41.50±1.98%, dan lebih tinggi dibandingkan pada sapi PO yaitu 33.30±0.90% (Shoae dan Zamiri 2008).
Hasil penelitian Tahap 3 menunjukkan hasil keseluruhan motilitas yang sama seperti pada Tahap 2 yaitu adanya penurunan motilitas dari semen segar, setelah ekuilibrasi, dan setelah thawing. Terdapat perbedaan yang signifikan antara penggunaan gliserol dengan DMF dalam pengencer SKT. Motilitas setelah
thawing dalam pengencer SKT menunjukkan hasil di bawah 40% dengan semua konsentrasi gliserol sehingga tidak memenuhi syarat untuk digunakan IB dan motilitas setelah thawing dalam pengencer SKT tidak berbeda nyata pada konsentrasi DMF 5% dan 6%, namun optimal pada konsentrasi 6% (54.33±1.59%). Penggunaan gliserol menunjukkan nilai di bawah 40%, sedangkan konsentrasi DMF optimum pada konsentrasi 6% kemungkinan disebabkan oleh kemampuan pengencer SKT yang menyamai pengencer TKT yang memiliki kandungan lengkap untuk perlindungan spermatozoa saat proses pembekuan. Spermatozoa sapi bali diduga tidak cocok dengan pengencer SKT dengan penambahan gliserol. Hal ini kemungkinan karena peroksidasi lipid yang diakibatkan oleh gliserol lebih tinggi sehingga dapat mengakibatkan penurunan motilitas spermatozoa (Sopiyana et al. 2006).
Pengencer SKT berbahan dasar natrium sitrat yang lebih ekonomis dibandingkan Tris (hydroxymethyl) aminomethane. Ion sitrat pada pengencer SKT akan berikatan dengan kalsium pada plasma semen sehingga kalsium tidak dapat menjalankan fungsinya sebagai pemacu motilitas. Metabolisme spermatozoa untuk menghasilkan energi akan terhambat jika kalsium terikat. Metabolisme yang terhambat memicu timbulnya asam laktat sehingga spermatozoa tidak memiliki energi untuk bergerak (Solihati et al. 2008). Motilitas ekuilibrasi dalam pengencer SKT lebih tinggi dibandingkan penelitian Hartono (2008) pada semen kambing boer 59.37±8.00%, lebih rendah dibandingkan pada sapi PO 80.33% (Solihati et al. 2008), namun hampir sama pada sapi PO yaitu 62.10±2.50% (Shoae dan Zamiri 2008). Rendahnya motilitas spermatozoa setelah thawing pada
19 penelitian ini sejalan dengan penelitian Siswanto (2006) yang mendapatkan motilitas sermatozoa semen rusa dalam pengencer SKT dengan gliserol 10% dan 15% adalah 36.46±15.17% dan 18.45±4.73%.
Hasil penelitian ini menunjukkan bahwa daya krioprotektif DMF lebih baik dalam melindungi spermatozoa sapi bali dibandingkan gliserol. Hal ini diduga karena berat molekul DMF lebih kecil daripada gliserol (Ball dan Vo 2001), sehingga DMF memiliki permeabilitas yang lebih tinggi. Hal ini menyebabkan pembentukan kristal es dalam sel dapat ditekan. Selain itu, tingginya permeabilitas DMF juga dapat meminimalisir terjadinya stres osmotik. Penggunaan DMF pada pembekuan berbagai semen telah digunakan pada semen babi dalam pengencer Beltsville thawing solution (BTS) dengan konsentrasi DMF terbaik adalah 5% (Bianchi et al. 2008), pada semen kuda konsentrasi terbaik adalah 2.5% (Pukazhenthi et al. 2014), pada semen domba dalam pengencer skim soya konsentrasi terbaik adalah 6% (Jerez et al. 2016). Penelitian pembekuan semen sapi menggunakan DMF baru ditemukan pada pembekuan semen sapi
Korean Jeju Black dalam pengencer TKT oleh Oh et al. (2012) dengan hasil penggunaan DMF 5% sama baiknya dengan gliserol 7%.
Batas minimal nilai MPU spermatozoa yang layak untuk IB pada sapi adalah 40% (Jeyendran et al. 1984) sehingga penggunaan kombinasi pengencer TKT dan SKT dengan kedua macam krioprotektan mampu menjaga keutuhan membran plasma spermatozoa. Tahapan kriopreservasi yaitu pengenceran, pendinginan dan pembekuan memicu terjadi perubahan tekanan osmotik dan perubahan suhu yang ekstrim. Perubahan-perubahan tersebut berpotensi merusak membran plasma dan akrosom spermatozoa yang pada akhirnya akan berpengaruh pada penurunan viabilitas spermatozoa (Bag et al. 2002).
Membran plasma yang masih utuh berkorelasi positif dengan motilitas dan viabilitas karena transpor ion tetap berlangsung dan proses metabolisme sel dapat berjalan dengan baik. Kerusakan membran plasma dapat terjadi pada bagian kepala dan bagian ekor. Kerusakan bagian kepala menyebabkan penurunan viabilitas, kerusakan bagian ekor terutama pada bagian midpiece akan berakibat hilangnya kemampuan mitokondria menghasilkan ATP sehingga terjadi defisiensi energi untuk menunjang motilitas spermatozoa. Kerusakan membran plasma utuh akan berakibat pada rendahnya daya fertilitas karena rusaknya membran plasma akan menghilangkan cairan intraseluler yang mengandung molekul penting untuk bersatunya sel telur dan spermatozoa dalam proses fertilisasi.
Recovery rate (RR) dapat digunakan sebagai indikator kemampuan pengencer dan krioprotektan yang mampu menjaga sel spermatozoa selama proses kriopreservasi. Angka RR menunjukkan kemampuan pulihnya spermatozoa setelah mengalami proses pembekuan. Hal ini berkaitan dengan integritas membran dalam menjaga kelangsungan biosintesis intraseluler dan penggunaan ATP sebagai energi untuk mendukung motilitas setelah thawing. Nilai RR dalam pengencer TKT dengan kombinasi pengencer gliserol 5%, 6%, dan 7% berturut-turut adalah 69.25±3.26%, 60.89±3.38%, dan 56.28±3.05%, sedangkan dengan DMF 5%. 6%, dan 7% berturut-turut adalah 69.96±2.92%, 66.13±3.22%, dan 66.46±3.00%. Nilai RR dalam pengencer SKT dengan kombinasi pengencer gliserol 5%, 6%, dan 7% berturut-turut adalah 30.54±3.72%, 21.57±1.59%, dan 19.36±1.61%.
20
Recovery rate hasil penelitian Tahap 3 sedikit lebih tinggi dibandingkan RR sapi pasundan dalam pengencer Tris adalah 59.62±5.57% (Baharun et al. 2017). Spermatozoa sapi Limousin, Simmental dan FH dalam pengencer Skim kuning telur mempunyai nilai RR berturut-turut adalah 58.87±6.37%; 56.27±7.08%; 58.87±5.31% (Komariah et al. 2013). Nilai RR dalam pengencer SKT menggunakan DMF menunjukkan hasil recovery rate yang lebih baik dibandingkan dengan penggunaan gliserol, sehingga dari hasil penelitian ini didapat bahwa kombinasi penggunaan pengencer SKT dengan krioprotektan gliserol tidak direkomendasikan untuk pembekuan semen sapi bali.
5
SIMPULAN
1. Kualitas semen segar sapi bali pada kelompok umur produktif dan umur lewat produktif tidak berbeda.
2. Penggunaan gliserol dan DMF dalam pengencer TKT optimum menghasilkan motilitas setelah thawing pada konsentrasi gliserol 5% (50.22±2.60) dan DMF 5% (50.44±1.94).
3. Penggunaan gliserol dalam pengencer SKT menunjukkan hasil di bawah 40% dengan semua konsentrasi gliserol sehingga tidak memenuhi syarat untuk digunakan IB dan DMF dalam pengencer SKT optimum menghasilkan motilitas setelah thawing pada konsentrasi DMF 6% (54.33±1.59).
DAFTAR PUSTAKA
[UU] Undang-Undang Republik Indonesia. 2014. Undang-Undang No. 41 tahun Perubahan Atas Undang-Undang Nomor 18 Tahun 2009 tentang Peternakan dan Kesehatan Hewan. Jakarta (ID): Kementan.
Affandhy L, Umiyasih U, Ma‟sum K. 1998. Evaluasi kualitas semen beku sapi Madura dengan berbagai diluter dan kandungan kuning telur yang berbeda. Seminar Nasional Peternakan dan Veteriner.
Ariantie OS, Yusuf TL, Sajuti D, Arifiantini RI. 2013. Pengaruh krioprotektan gliserol dan dimetilformamida dalam pembekuan semen kambing peranakan etawah menggunakan pengencer tris modifikasi. JITV. 18:239-250.
Arifiantini RI, Yusuf TL. 2006. Keberhasilan penggunaan tiga pengencer dalam dua jenis kemasan pada proses pembekuan semen sapi Frisien Holstein. Majalah Ilmiah Peternakan. 9(3):89-93.
Arifiantini RI. 2012. Teknik Koleksi dan Evaluasi Semen pada Hewan. Bogor (ID): IPB Pr.
Arifiantini RI, Purwantara B. 2010. Motility and viability of frisian holstein spermatozoa in three different extender stored at 5 °C. Indones Trop Anim Agric. 35(4):222-226.
Arifiantini RI, I Supriatna. 2007. Kriopreservasi semen kuda menggunakan berbagai krioprotektan pada pengencer susu skim. JITV. 12(2) : 2-5.