TUGAS AKHIR
PRARANCANGAN PABRIK ETILBENZENA DARI ETILEN DAN
BENZENA DENGAN PROSES MOBIL-BADGER
KAPASITAS 120.000 TON/TAHUN
Oleh :
Diah Kusumastuti I 0508005
Fhariest Chrissanto Putra I 0508043
JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS SEBELAS MARET
SURAKARTA
commit to user KATA PENGANTAR
Segala puji syukur kepada Allah SWT, hanya karena rahmat dan ridho-Nya, penulis akhirnya dapat menyelesaikan penyusunan laporan tugas akhir dengan judul ”Prarancangan Pabrik Etilbenzena dari Etilen dan Benzena dengan Proses Mobil-Badger Kapasitas 120.000 Ton/Tahun”.
Dalam penyusunan tugas akhir ini penulis memperoleh banyak bantuan baik berupa dukungan moral maupun spiritual dari berbagai pihak. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Dr. Sunu Herwi Pranolo selaku Ketua Jurusan Teknik Kimia Fakultas Teknik Universitas Sebelas Maret
2. Endang Kwartiningsih, S.T., M.T. selaku Dosen Pembimbing I dan Bregas S. T. Sembodo, S.T., M.T. selaku Dosen Pembimbing II, atas bimbingan dan bantuannya dalam penulisan tugas akhir
3. Inayati S.T., M.T., Ph.D. selaku Pembimbing Akademik
4. Kedua Orang tua dan keluarga atas dukungan doa, materi dan semangat yang senantiasa diberikan tanpa kenal lelah
5. Teman - teman mahasiswa Teknik Kimia FT UNS khususnya angkatan 2008
Penulis menyadari bahwa laporan tugas akhir ini belum sempurna. Oleh karena itu, penulis mengharapkan saran dan kritik yang membangun. Semoga laporan tugas akhir ini dapat bermanfaat bagi penulis dan pembaca sekalian.
Surakarta, Juli 2012
commit to user DAFTAR ISI
Halaman Judul ... i
Lembar Pengesahan ... ii
Kata Pengantar ... iii
Daftar Isi ... iv
Daftar Tabel ... x
Daftar Gambar ... xii
Intisari ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang Pendirian Pabrik ... 1
1.2 Kapasitas Perancangan ... 2
1.3 Pemilihan Lokasi Pabrik ... 6
1.4 Tinjauan Pustaka ... 8
1.4.1 Macam-macam Proses Pembuatan Etilbenzena ... 8
1.4.1.1 Proses AlCl3 ... 9
1.4.1.2 Proses Alkar ... 9
1.4.1.3 Proses Mobil/Badger ... 10
1.4.2 Kegunaan Produk ... . 12
1.4.3 Sifat Fisis dan Kimia Bahan Baku dan Produk ... . 12
1.4.3.1 Bahan Baku Benzena (C6H6) ... 12
1.4.3.2 Bahan Baku Etilen (C2H2) ... 14
1.4.3.3 Produk Etilbenzena (C8H10) ... 15
commit to user
BAB II DESKRIPSI PROSES ... 18
2.1 Spesifikasi Bahan Baku dan Produk ... 18
2.1.1 Spesifikasi Bahan Baku ... 18
2.1.2 Spesifikasi Katalis ... 19
2.1.3 Spesifikasi Produk ... 19
2.2 Konsep Dasar Proses ... 20
2.2.1 Dasar Reaksi ... 20 2.2.2 Pemakaian Katalis ... 20 2.2.3 Mekanisme Reaksi ... 21 2.2.4 Fase Reaksi ... 22 2.2.5 Kondisi Operasi ... 22 2.2.6 Tinjauan Termodinamika ... 23 2.2.7 Tinjauan Kinetika ... 27
2.2.8 Perbandingan Mol Reaktan ... 29
2.2.9 Reaksi Samping ... 29
2.3 Diagram Alir Proses ... 30
2.3.1 Diagram Alir Kualitatif ... 30
2.3.2 Diagram Alir Kuantitatif ... 30
2.3.3 Diagram Alir Proses ... 30
2.3.4 Langkah Proses ... 34
2.3.4.1. Tahap Persiapan Bahan Baku ... 34
2.3.4.2. Tahap Pembentukan Etilbenzena ... 35
commit to user
2.4 Neraca Massa dan Neraca Panas ... 38
2.4.1 Neraca Massa ... 39
2.4.2 Neraca Panas ... 44
2.5 Lay Out Pabrik dan Peralatan Proses ... 47
BAB III SPESIFIKASI PERALATAN PROSES ... 51
3.1 Tangki Penyimpanan Benzena ... 51
3.2 Tangki Penyimpanan Etilbenzena ... 52
3.3 Reaktor Alkilasi ... 53 3.4 Reaktor Transalkilasi ... 54 3.5 Menara Distilasi-01 ... 55 3.6 Menara Distilasi-02 ... 56 3.7 Heater-01 ... 57 3.8 Vaporizer-01 ... 58 3.9 Heater-02 ... 59 3.10 Heater-03 ... 60 3.11 Kondenser Parsial ... 61 3.12 Kondenser-01 ... 62 3.13 Reboiler-01 ... 63 3.14 Kondenser-02 ... 64 3.15 Reboiler-02 ... 65 3.16 Vaporizer-02 ... 66 3.17 Heater-04 ... 67 3.18 Kondenser-03 ... 68
commit to user 3.19 Cooler ... 69 3.20 Accumulator-01 ... 70 3.21 Accumulator-02 ... 71 3.22 Pompa-01 ... 71 3.23 Pompa-02 ... 72 3.24 Pompa-03 ... 73 3.25 Pompa-04 ... 74 3.26 Pompa-05 ... 74 3.27 Pompa-06 ... 75 3.28 Pompa-07 ... 76 3.29 Kompresor ... 77
BAB IV UNIT PENDUKUNG PROSES DAN LABORATORIUM ... . 78
4.1 Unit Pendukung Proses ... 78
4.1.1 Unit Pengadaan Air ... 79
4.1.1.1 Air Pendingin ... 81
4.1.1.2 Air Umpan Boiler ... 82
4.1.1.3 Air Konsumsi Umum dan Sanitasi ... 86
4.1.2 Unit Pengadaan Steam ... 87
4.1.3 Unit Pengadaan Udara Tekan ... 88
4.1.4 Unit Pengadaan Listrik ... 89
4.1.4.1 Listrik untuk Keperluan Proses dan Utilitas .. 89
4.1.4.2 Listrik untuk Penerangan ... 91
commit to user
4.1.4.4 Listrik untuk Laboratorium dan Instrumentasi 93
4.1.5 Unit Pengadaan Bahan Bakar ... 94
4.1.6 Unit Pengadaan Nitrogen... 95
4.2 Laboratorium ... 95
4.2.1 Laboratorium Fisik dan Analitik ... 97
4.2.2 Laboratorium Penelitian dan Pengembangan ... 97
4.2.3 Analisa Air ... 98
4.3 Unit Pengolahan Limbah ... 99
4.4 Keselamatan dan Kesehatan Kerja ... 100
BAB V MANAJEMEN PERUSAHAAN ... 102
5.1 Bentuk Perusahaan ... 102
5.2 Struktur Organisasi ... 102
5.3 Tugas dan Wewenang ... 105
5.3.1. Pemegang Saham ... 105
5.3.2. Dewan Komiaris ... 105
5.3.3. Dewan Direksi ... 106
5.3.4. Staf Ahli ... 107
5.3.5. Penelitian dan Pengembangan (LITBANG) ... 108
5.3.6. Kepala Bagian ... 108
5.3.7. Kepala Seksi ... 112
5.4 Pembagian Jam Kerja Karyawan ... 112
5.4.1. Karyawan Non Shift/Harian ... 112
commit to user
5.5 Status Karyawan dan Sistem Upah ... 114
5.6 Penggolongan Jabatan, Jumlah Karyawan, dan Gaji ... 115
5.6.1. Penggolongan Jabatan ... 115
5.6.2. Jumlah Karyawan dan Gaji ... 116
5.7 Kesejahteraan Sosial Karyawan ... 118
5.8 Manajemen Perusahaan ... 119
5.8.1. Perencanaan Produksi ... 120
5.8.2. Pengendalian Produksi ... 122
BAB IV ANALISA EKONOMI ... 123
6.1 Dasar Perhitungan ... 123
6.2 Penafsiran Harga Alat ... 124
6.3 Penentuan Total Capital Investment (TCI) ... 126
6.4 Penentuan Manufacturing Cost (TCI) ... 128
6.4.1. Direct Manufacturing Cost (DMC) ... 128
6.4.2. Indirect Manufacturing Cost (IMC) ... 129
6.4.3. Fixed Manufacturing Cost (FMC) ... 129
6.5 Penentuan Total Poduction Cost (TPC) ... 130
6.5.1. General Expense (GE) ... 130
6.5.2. Total Production Cost (TPC) ... 131
6.6 Keuntungan ... 131
6.7 Analisa Kelayakan ... 132
Daftar Pustaka ... 137 Lampiran
commit to user DAFTAR TABEL
Tabel 1.1 Perkembangan Import Etilbenzena Tahun 2006-2010 ... 2
Tabel 1.2 Pabrik Penghasil Etilbenzena ... 4
Tabel 1.3 Data Impor Etilbenzena di Negara Polandia dan China... 6
Tabel 1.4 Kelebihan dan kekurangan berbagai proses pembuatan etilbenzena 11 Tabel 2.1 Neraca Massa Tee-01 ... 39
Tabel 2.2 Neraca Massa Vaporizer-01 ... 39
Tabel 2.3 Neraca Massa Tee-02 ... 40
Tabel 2.4 Neraca Massa ReaktorAlkilasi ... 40
Tabel 2.5 Neraca Massa Kondenser Parsial ... 41
Tabel 2.6 Neraca Massa Tee-03 ... 41
Tabel 2.7 Neraca Massa Menara Distilasi-01 ... 42
Tabel 2.8 Neraca Massa Menara Distilasi-02 ... 42
Tabel 2.9 Neraca Massa Tee-04 ... 42
Tabel 2.10 Neraca Massa Vaporizer-02 ... 43
Tabel 2.11 Neraca Massa Reaktor Transalkilasi ... 43
Tabel 2.12 Neraca Massa Total ... 43
Tabel 2.13 Neraca Panas Reaktor Alkilasi ... 44
Tabel 2.14 Neraca Panas Reaktor Transalkilasi ... 44
Tabel 2.15 Neraca Panas Menara Distilasi-01 ... 45
Tabel 2.16 Neraca Panas Menara Distilasi-02 ... 45
Tabel 2.17 Neraca Panas Kondenser Parsial ... 46
commit to user
Tabel 4.1 Kebutuhan Air Pendingin ... 82
Tabel 4.2 Kebutuhan Air untuk Steam ... 83
Tabel 4.3 Jumlah Kebutuhan Air ... 87
Tabel 4.4 Kebutuhan Listrik untuk Keperluan Proses dan Utilitas ... 90
Tabel 4.5 Jumlah Lumen Berdasarkan Luas Bangunan ... 92
Tabel 4.6 Total Kebutuhan Listrik Pabrik ... 93
Tabel 5.1 Jadwal Pembagian Kelompok Shift ... 114
Tabel 5.2 Jumlah Karyawan Menurut Jabatan ... 116
Tabel 5.3 Perincian Golongan dan Gaji Karyawan ... 118
Tabel 6.1 Indeks Harga Alat ... 124
Tabel 6.2 Fixed Capital Investment ... 127
Tabel 6.3 Working Capital Investment ... 128
Tabel 6.4 Total Capital Investment ... 128
Tabel 6.5 Direct Manufacturing Cost ... 129
Tabel 6.6 Indirect Manufacturing Cost ... 129
Tabel 6.7 Fixed Manufacturing Cost ... 130
Tabel 6.8 Manufacturing Cost ... 130
Tabel 6.9 General Expense ... 131
Tabel 6.10 Total Production Cost ... 131
Tabel 6.11 Variable Cost ... 133
Tabel 6.12 Regulated Cost ... 134
commit to user DAFTAR GAMBAR
Gambar 1.1 Grafik Impor Etilbenzena di Indonesia ... 2
Gambar 1.2 Pemilihan Lokasi Pabrik ... 8
Gambar 2.1 Diagram Alir Kualitatif ... 31
Gambar 2.2 Diagram Alir Kuantitatif ... 32
Gambar 2.3 Diagram Alir Proses ... 33
Gambar 2.4 Layout Pabrik ... 49
Gambar 2.5 Layout Peralatan Proses ... 50
Gambar 4.1 Diagram Alir Pengolahan Air... 80
Gambar 5.1 Struktur Organisasi Pabrik Etilbenzena ... 105
Gambar 6.1 Chemical Engineering Cost Index ... 125
commit to user INTISARI
Diah Kusumastuti dan Fhariest Chrissanto Putra, 2012, Prarancangan Pabrik Etilbenzena dari Etilen dan Benzena dengan Proses Mobil-Badger, Kapasitas 120.000 Ton/Tahun, Program studi S1 Reguler, Jurusan Teknik Kimia, Fakultas Teknik, Universitas Sebelas Maret, Surakarta
Etilbenzena merupakan bahan intermediate yang digunakan untuk proses pembuatan Styrene Monomer. Proses pembuatan etilbenzena dengan proses Mobil-Badger adalah proses pembuatan etilbenzena menggunakan bahan baku benzena dan etilen dengan katalis zeolit tipe AB-97. Prarancangan pabrik etilbenzena kapasitas 120.000 ton/tahun dengan bahan baku benzena 88.926 ton/tahun dan etilen 31.793 ton/tahun. Pabrik direncanakan berdiri di Cilegon, Jawa Barat pada tahun 2016 dan beroperasi pada tahun 2017.
Reaksi pembentukan etilbenzena dari benzena dan etilen melalui proses alkilasi dan transalkilasi fase gas-gas dengan katalis padat. Reaksi alkilasi berlangsung di reaktor fixed bed pada suhu 350°C ~ 449°C dan tekanan 16,4 atm. Reaksi transalkilasi berlangsung di reaktor fixed bed pada suhu 420°C ~ 452°C dan tekanan 6 atm. Produk yang dihasilkan adalah etilbenzena dengan kadar etilbenzena sebesar 99,5%. Tahapan proses meliputi persiapan bahan baku, pembentukan etilbenzena di dalam reaktor, dan pemurnian produk. Pemurnian produk dilakukan di dalam menara distilasi.
Unit pendukung proses pabrik meliputi unit kebutuhan air, steam, udara tekan, tenaga listrik dan bahan bakar. Pabrik juga didukung laboratorium yang mengontrol mutu bahan baku dan produk sesuai dengan spesifikasi yang diharapkan. Selain itu terdapat unit pengolahan limbah yang menangani limbah baik padat, cair, maupun gas yang dihasilkan dari proses produksi.
Bentuk perusahaan adalah Perseroan Terbatas (PT) dengan struktur organisasi line and staff. Sistem kerja karyawan berdasarkan pembagian jam kerja yang terdiri dari karyawan shift dan non-shift .
Dari hasil analisis ekonomi diperoleh, ROI (Return on Investment) sebelum dan sesudah pajak sebesar 40,84% dan 32,67%, POT (Pay Out Time) sebelum dan sesudah pajak selama 1,97 dan 2,34 tahun, BEP (Break Event Point) 58,54% dan SDP 44,33%. Sedangkan DCF (Discounted Cash Flow) sebesar 18,36%. Jadi dari segi ekonomi pabrik tersebut layak untuk didirikan.
commit to user BAB I
PENDAHULUAN
1.1. Latar Belakang
Industri petrokimia di Indonesia dewasa ini terus berkembang secara meluas dan terintegrasi. Perkembangan industri dan juga bahan setengah jadi yang pesat selama ini merupakan faktor pendorong dibangunnya unit-unit industri. Dengan demikian, baik penyediaan maupun kebutuhan akan bahan baku di dalam industri petrokimia akan selalu saling berkaitan.
Etilbenzena dengan rumus kimia (C6H5) – C2H5 merupakan cairan yang jernih dan tidak berwarna serta memiliki bau yang khas. Etilbenzena merupakan senyawa intermediate pada proses pembuatan styrene monomer. Sekitar 85% konsumsi etilbenzena dunia adalah untuk pembuatan styrene monomer. Styrene
Monomer sendiri merupakan bahan baku Polystyrene, Styrene Butadiene
Rubber,Unsaturated Poliester Resin (UPR) dan Styrene Acrylonitril Polimer
(SAP) yang banyak digunakan untuk industri plastik dan industri otomotif.
Kebutuhan Etilbenzena dalam negeri dan luar negeri terus meningkat setiap tahunnya. Kebutuhan etilbenzena dunia meningkat 2,9% per tahun. Pemenuhan kebutuhan dalam negeri saat ini dipenuhi dari PT Styrindo Mono Indonesia dan sebagian kecil dengan cara impor. Oleh karena itu pabrik etilbenzena ini perlu didirikan di Indonesia untuk memenuhi kebutuhan dalam negeri maupun diekspor untuk meningkatkan devisa negara, membuka lapangan kerja baru untuk penduduk di sekitar wilayah yang didirikan, serta mendorong berdirinya industri-industri yang menggunakan bahan baku etilbenzena.
commit to user
1.2 Kapasitas Perancangan
Pemilihan kapasitas pabrik etilbenzena ini didasarkan dari beberapa pertimbangan, yaitu:
1. Proyeksi Kebutuhan Etilbenzena di Indonesia
Berdasarkan data yang diperoleh dari UNdata record view, kebutuhan etilbenzena di Indonesia dari tahun 2006 sampai dengan tahun 2010 adalah sebagai berikut :
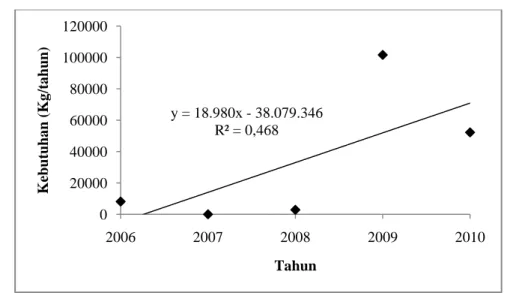
Tabel 1.1 Perkembangan ImporEtilbenzenaTahun 2006-2010
No. Tahun Impor (Kg/Tahun)
1. 2006 8.433
2. 2007 7
3. 2008 2.865
4. 2009 101.626
5. 2010 52.235
(United Nations Statistics Division, 2011)
Gambar 1.1 Grafik ImporEtilbenzena di Indonesia
y = 18.980x - 38.079.346 R² = 0,468 0 20000 40000 60000 80000 100000 120000 2006 2007 2008 2009 2010 K ebutuha n ( K g /t a hu n) Tahun
commit to user
Dari Tabel 1.1 di atas dapat dilihat bahwa secara umum permintaan etilbenzena di Indonesia masih cenderung fluktuatif. Kebutuhan utama etilbenzena dalam negeri saat ini disuplai oleh PT. Styrindo Mono Indonesia dengan kapasitas produksi 340.000 ton/tahun.
Untuk mengetahui kebutuhan pada tahun 2017, dilakukan regresi dari data yang ada pada Tabel 1.1, didapatkan persamaan seperti pada Gambar 1.1 :
y = 18.980x –38.079.346 dengan y = jumlah impor etilbenzena
x = tahun ke-n
Pada perancangan pabrik etilbenzena yang direncanakan akan didirikan dan berproduksi di Indonesia pada tahun 2017, maka dari persamaan empiris hubungan antara kapasitas dan tahun diperoleh kebutuhan etilbenzena pada tahun 2017 adalah sebesar 203.314 kg (≈ 203,314 ton).
2. Kebutuhan Etilbenzena Dunia
Berdasarkan data yang diperoleh dari Chemical Economics Handbook – SRI Consulting, kebutuhan global etilbenzena terus berkembang mencapai 2,9% per tahun. Kebutuhan etilbenzena pada 2013diperkirakan sejumlah 31.700.000 ton. Dengan kenaikan yang dianggap konstan, kebutuhan etilbenzena dunia pada tahun 2017 akan mencapai 35.540.000 ton.
Di Eropa, kebutuhan akan terus berkembang mencapai 3%~4% per tahun. Untuk kebutuhan Asia, diperkirakan akan meningkat hingga 3,5% per tahun mencapai 15.880.000 ton (Davis, 2009).
commit to user
3. Ketersediaan Bahan Baku
Bahan baku untuk memproduksi etilbenzena adalah benzena dan etilen. Benzena didapatkan dari Pertamina UP IV Cilacap yang memproduksi benzena sebesar 110.000 ton/tahun dan PT Trans-Pasific Petrochemical Indotama Tubansebesar 300.000 ton/tahun. Bahan baku etilen didapatkan dari PT. Chandra Asri yang memproduksi etilen sebesar 600.000 ton/tahun. Dari kapasitas produksi tersebut, kebutuhan bahan baku pabrik etilbenzena berupa benzena dan etilen dapat terpenuhi.
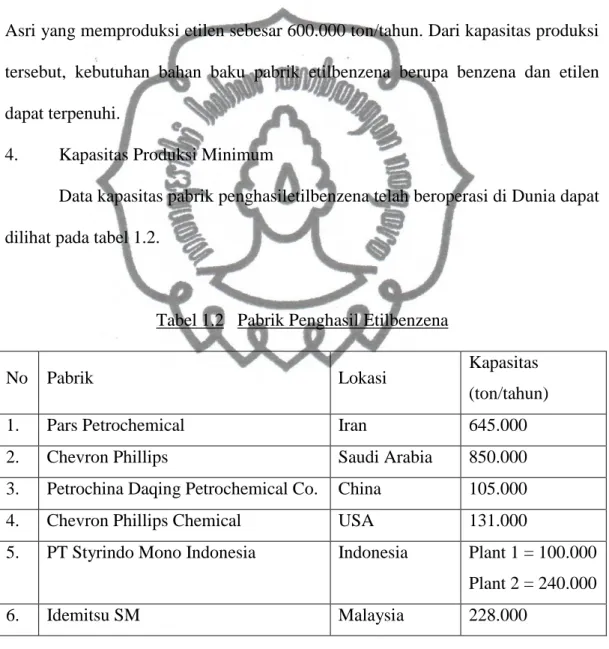
4. Kapasitas Produksi Minimum
Data kapasitas pabrik penghasiletilbenzena telah beroperasi di Dunia dapat dilihat pada tabel 1.2.
Tabel 1.2 Pabrik Penghasil Etilbenzena
No Pabrik Lokasi Kapasitas
(ton/tahun)
1. Pars Petrochemical Iran 645.000
2. Chevron Phillips Saudi Arabia 850.000
3. Petrochina Daqing Petrochemical Co. China 105.000
4. Chevron Phillips Chemical USA 131.000
5. PT Styrindo Mono Indonesia Indonesia Plant 1 = 100.000 Plant 2 = 240.000
6. Idemitsu SM Malaysia 228.000
commit to user
Pabrik direncanakan akan beroperasi pada tahun 2017 dengan kapasitas 120.000 ton/tahun. Kapasitas ini ditentukan sesuai dengan kapasitas minimal pabrik yang sudah berdiri menggunakan proses Mobil-Badger dan dapat memberikan keuntungan yaitu 105.000 ton/tahun.
Selain itu pada tahun 2007, PKN Orlen dan SYNTHOS mengadakan kerja sama untuk mendirikan pabrik etilbenzena di Polandia dengan kapasitas 120.000 ton/tahun. Penentuan kapasitas ini didasarkan pada kebutuhan etilbenzena di Polandia. Namun pada Maret 2009 terjadi pembatalan perjanjian pembangunan antara kedua belah pihak dikarenakan masalah ekonomi. Hal ini membuat Polandia masih terus bergantung pada impor untuk memenuhi kebutuhan etilbenzenanya.
Oleh karena itu diharapkan dengan kapasitas 120.000 ton/tahun, pabrik akan dapat memenuhi kekurangan dari total kebutuhan etilbenzena di Indonesia dan memenuhi kebutuhan etilbenzena di Polandia.
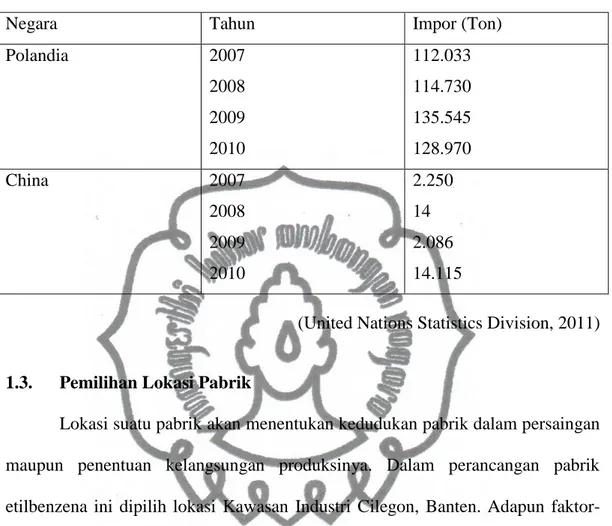
Hasil produksi direncanakan akan di ekspor ke Negara Polandia dan China sehingga dapat menambah devisa negara. Kebutuhan etilbenzena di Negara Polandia dan China dapat dilihat pada tabel 1.3.
commit to user
Tabel 1.3 Data Impor Etilbenzena di Negara Polandia dan China
Negara Tahun Impor (Ton)
Polandia 2007 2008 2009 2010 112.033 114.730 135.545 128.970 China 2007 2008 2009 2010 2.250 14 2.086 14.115
(United Nations Statistics Division, 2011)
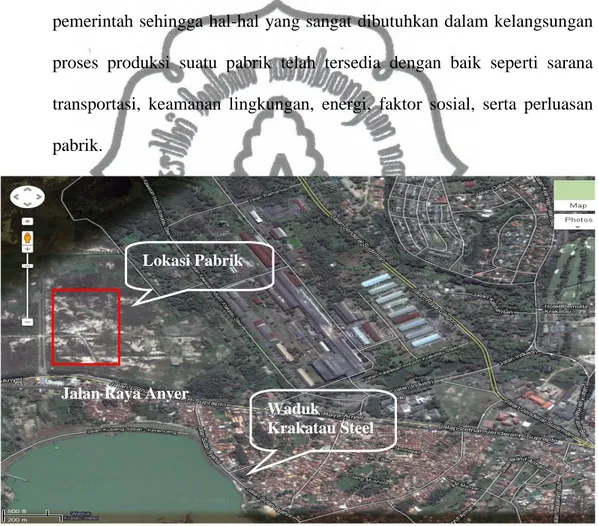
1.3. Pemilihan Lokasi Pabrik
Lokasi suatu pabrik akan menentukan kedudukan pabrik dalam persaingan maupun penentuan kelangsungan produksinya. Dalam perancangan pabrik etilbenzena ini dipilih lokasi Kawasan Industri Cilegon, Banten. Adapun faktor-faktor yang harus diperhatikan, adalah :
1. Faktor Primer
a. Keberadaan Bahan Baku
Bahan baku etilbenzena adalah etilen yang diperoleh dari PT. Chandra Asri yang berlokasi di Cilegon. Benzena yang diperoleh dari Pertamina UP IV Cilacapdan PT Trans-Pasific Petrochemical Indotama Tuban.Letak antara pabrik dan sumber bahan baku yang dekat diharapkan dapat memperlancar proses penyediaan bahan baku.
commit to user
b. Pemasaran Produk dan Sarana Transportasi
Produk ditargetkan untuk dipasarkan baik di dalam negeri maupun diekspor ke luar negeri. Untuk kebutuhan dalam negeri produk akan dipasarkan ke beberapa industri cat, antara lain PT. Internasional Paint Indonesia dan PT. Jotun Indonesia. Untuk ekspor ditujukan ke negara China dan Polandia.
Sarana transportasi untuk penyediaan bahan baku dan pemasaran produk dapat dilakukan lewat jalur darat maupun jalur laut. Untuk jalur laut, digunakan Pelabuhan Krakatau Steel Bandar Samudera Cigading, Banten yang jaraknya sekitar ± 10 km dari lokasi pabrik yang direncanakan.
c. Utilitas
Dalam hal penyediaan air sudah tersedia di dalam kawasan Industri Cilegon, Banten yang diproduksi oleh PT Krakatau Tirta Industri. Sedangkan untuk kebutuhan energi listrik akan dipenuhi oleh generator listrik milik pabrik dengan daya sebesar 1000 kW.
d. Tenaga Kerja
Tersedianya tenaga kerja yang diperlukan baik untuk proses produksi, pemasaran, dan administrasi. Tenaga kerja didapatkan dengan cara memanfaatkan sumber daya manusia yang berada di daerah Jawa Barat dan sekitarnya.
2. Faktor Sekunder
a. Karakteristik Lokasi
commit to user
kemungkinan terjadinya banjir, serta kondisi sosial masyarakat. Kondisi iklim di Cilegon seperti iklim di Indonesia pada umumnya dan tidak membawa pengaruh besar pada proses produksi.
b. Sarana Penunjang Lain
Cilegon sebagai kawasan industri yang telah ditetapkan oleh pemerintah sehingga hal-hal yang sangat dibutuhkan dalam kelangsungan proses produksi suatu pabrik telah tersedia dengan baik seperti sarana transportasi, keamanan lingkungan, energi, faktor sosial, serta perluasan pabrik.
Gambar 1.2Pemilihan Lokasi Pabrik
1.4. TINJAUAN PUSTAKA
1.4.1. Macam – macam Proses Pembuatan Etilbenzena
Ada beberapa macam proses utama yang digunakan dalam proses pembuatan etilbenzena, yaitu:
Lokasi Pabrik
Waduk
Krakatau Steel Jalan Raya Anyer
commit to user 1.4.1.1. Proses AlCl3
Proses ini merupakan proses alkilasi pertama yang dikembangkan untuk memproduksi etilbenzena berdasarkan proses Fiedel-Crafts. Proses ini terjadi pada fase cair-cair dengan katalis AlCl3. Pada proses alkilasi terbentuk hasil samping berupa dietilbenzena yang nantinya akan direaksikan kembali menjadi etilbenzena melalui reaksi transalkilasi. Reaksi alkilasi lebih cepat dibandingkan dengan transalkilasi sehingga untuk mencapai kondisi optimum keduanya dilakukan dalam dua buah reaktor yang terpisah. Reaksi alkilasi dan transalkilasi dijalankan pada 150oC ~ 180oC dan 6 ~ 11 atm. Komposisi aliran utama berupa aromatik cair, gas etilen dan fase cair dari katalis komplek yang mengandung faktor korosif tinggi, sehingga diperlukan pemilihan konstruksi alat yang benar-benar tepat. Kekorosifan disebabkan oleh promotor dari katalis AlCl3 yaitu HCl.Yieldyang diperoleh cukup besar yaitu sekitar 99,7%.
Reaksi: C6H6 + (H2C=CH2) AlCl3
C6H5C2H5 (1.1) Benzena Etilen Etilbenzena
(McKetta, 1984)
1.4.1.2. Proses Alkar
Proses ini dikembangkan oleh UOP dengan katalis BF3yang disupport menggunakan Al2O3. Reaksi berlangsung pada fase cair serta tekanan tinggi mengggunakan reaktor fixed bed. Pada proses Alkar, reaksi alkilasi dijalankan pada suhu operasi 95oC ~ 150oC dan tekanan mencapai 35 atm. Sedangkan untuk reaksi transalkilasi dijalankan pada suhu operasi 180oC ~ 230oC dan tekanan mencapai 28 atm. Yield yang diperoleh bisa lebih dari 99 %.
commit to user
Reaksi : C6H6 + (H2C=CH2) BF3
C6H5C2H5 (1.2) Benzena Etilen Etilbenzena
(McKetta, 1984) Katalis BF3 yang digunakan merupakan katalis yang bersifat asam, sangat beracun, korosif, dan sulit dalam penanganan serta transportasinya (Gerzeliev et al., 2011).
1.4.1.3. Proses Mobil-Badger
Proses ini dikembangkan oleh Mobil Oil Corporation dengan katalis zeolit (ZSM-5) dan berlangsung pada fase gas. Katalis yang dipakai bersifat non korosif, inert terhadap lingkungan, dan memiliki masa aktif yang cukup lama antara 2 ~ 3 tahun. Reaksi pada proses Mobil-Badger adalah sebagai berikut :
C6H6+ (H2C=CH2) 5 ZSM
C6H5C2H5 (1.3) Benzena Etilen Etilbenzena
Kondisi operasi suhu 350oC ~ 450oC dan tekanan berkisar antara 8 ~ 28 atm. Benzena dan etilen direaksikan pada reaktor fixed bed. Yield yang dihasilkan mencapai lebih dari 99,5 %. Panas yang dihasilkan dari reaksi cukup besar karena berlangsung pada suhu tinggi sehingga dapat dimanfaatkan kembali untuk pemanas maupun pembuatan steam. Pada proses ini, perbandingan antara etilen dan benzena mencapai 1:7. Hal ini memberikan keuntungan tersendiri karena dapat mengurangi presentase pembentukan dietilbenzena (Kirk and Othmer, 1998).
Kelebihan dan kekurangan dari masing-masing proses pembuatan etilbenzena dapat dilihat pada tabel 1.4.
commit to user
Tabel.1.4 Kelebihan dan kekurangan berbagai proses pembuatan etilbenzena
No. Proses Kelebihan Kekurangan
1. Proses AlCl3 1.Suhu operasi rendah
antara 150oC ~ 180oC
1.Katalis AlCl3 - HCl
bersifat korosif
2.Memerlukan proses
pemurnian katalis yang kompleks
2. Proses Alkar 1. Suhu operasi rendah
antara 95oC ~ 150oC
1. Katalis BF3 bersifat
asam, beracun, korosif.
2. Memerlukan proses
pemurnian katalis yang kompleks
3. Tidak dapat digunakan
untuk bahan baku
dengan impuritas tinggi karena dapat meracuni katalis
3. Proses Mobil-Badger 1. Katalis yang digunakan
adalah zeolit yang
merupakan zat yang
tidak beracun dan tidak korosif
2. Energi panas yang
dihasilkan dapat
digunakan kembali
3. Proses sederhana dan
tidak memerlukan
recovery katalis
4. Tidak menghasilkan
limbah yang berbahaya bagi lingkungan.
5. Dietilbenzena yang
terbentuk sedikit
1. Suhu operasi tinggi
commit to user
Pada pendirian pabrik etilbenzena ini dipilih proses Mobil-Badger dengan pertimbangan sebagai berikut :
1. Katalis yang digunakan tidak beracun dan tidak korosif.
2. Panas yang dihasilkan dari reaksi dapat dimanfaatkan kembali untuk pemanasan umpan awal maupun pembuatan steam.
3. Proses sederhana dan tidak memerlukan seleksi recovery katalis. 4. Tidak menghasilkan limbah yang berbahaya bagi lingkungan. 5. Dietilbenzena yang terbentuk sedikit
1.4.2. Kegunaan produk
Etilbenzena merupakan bahan intermediate yang sebagian besarnya digunakan untuk proses produksi Styrene Monomer. Styrene Monomer sendiri merupakan bahan baku dari Polystyrene, Styrene Butadiene Rubber, Styrene
Acrylonitril Polymer (SAP), Unsaturated Polyester Resin (UPR) yang banyak
digunakan untuk industri polimer dan industri otomotif.
Selain itu sebagian kecil produk etilbenzena digunakan sebagai solvent pada industri cat dan industri karet.
1.4.3. SifatFisik dan Kimia Bahan Baku dan Produk
1.4.3.1. Bahan baku Benzena (C6H6)
a. Sifat Fisis :
Rumus Molekul = C6H6
Berat molekul, (g/mol) = 78,115
commit to user
Titik didih (pada 1 atm), [oC] = 80,094 Densitas (pada 25oC), [g/cm3] = 0,8736
Tekanan kritis, (atm) = 48,351
Temperatur kritis, (oC) = 289,01
b.Sifat Kimia :
Ada tiga (3) tipe reaksi benzena yang terpenting yaitu : a. Reaksi subtitusi
Reaksi substitusi benzena biasanya terjadi pada cincin aromatik benzena. Contoh reaksi substitusi yaitu pada konversi klorobenzena menjadi fenol dengan bantuan NaOH pada 400oC.
Reaksi : C6H5Cl C6H5OH b. Oksidasi
Reaksi yang paling penting adalah oksidasi katalitik Benzena menjadi maleic anhidrid. Sedangkan oksidasi pada fase gas menjadi fenol pada suhu 450-800 oC tanpa adanya katalis.
c. Alkilasi
Beberapa reaksi alkilasi benzena yang dijumpai dalam industri kimia diantaranya:
1) Reaksi alkilasi benzena dengan propilena membentuk cumene baik pada fase gas maupun cair dengan menggunakan katalis BF3 ataupun AlCl3.
2) Reaksi alkilasi benzena dengan etilena membentuk etilbenzena yang berlangsung pada suhu diatas 370oC dengan adanya katalis zeolit.
commit to user
C6H6 + (H2C=CH2) C6H5 C2H5
Benzena(g) Etilen (g) Etilbenzena(g) (Kirk and Othmer, 1998)
1.4.3.2. Bahan Baku Etilen(C2H2)
a. Sifat Fisis :
Rumus Molekul = CH2= CH2
Berat molekul, (g/mol) = 28,0536
Titik didih (pada 1 atm), (oC) = -103.71 Titik leleh (pada 1 atm), (oC) = -169,15
Densitas, (g/cm3) = 0,214
Tekanan kritis, (atm) = 49,74
Temperatur kritis, (oC) = 9,194
b. Sifat Kimia :
a. Polimerisasi
Etilen dapat bergabung dengan etilen yang lain membentuk molekul yang lebih besar (polimer) dengan cara memutuskan ikatan rangkapnya.
Reaksi : n (H2C=CH2) ( H2C – CH2 )n
b. Oksidasi
Etilen merupakan bagian dari gugus Alkena, dimana gugus ini dapat dioksidsi menjadi beraneka ragam produk tergantung pada
Zeolit
commit to user
reagensia yang digunakan. Salah satu contohnya adalah reaksi oksidasi etilen menjadi suatu gugus epoksi menggunakan oksigen.
CH2 = CH2 + O2 CH2 CH2
O
Etilen Oksigen Etilen oksida c. Alkilasi
Reaksi alkilasi oleh Friedel Craft sangat efektif untuk mereaksikanetilen dengan benzena menggunakan katalis AlCl3.
Reaksi : ( H2C = CH2 ) + C6H6 C6H5C2H5
(Kirk and Othmer, 1998)
1.4.3.3. ProdukEtilbenzena (C8H10)
a. Sifat Fisik :
Rumus Molekul =(C6H5) - C2H5
Berat molekul, (g/mol) = 106,167
Titik didih (pada 1 atm), [oC] = 136,19 Titik leleh (pada 1 atm), [oC] = - 94,975 Densitas ( pada 25 oC), [g/cm3] = 0,8671
Temperatur kritis (oC) = 343,05
Tekanan kritis (atm) = 36,54
Sifat Kimia :
Reaksi yang paling utama dari etilbenzena adalah reaksi dehidrogenasi menghasilkan styrene. Pada reaksi ini digunakan bahan
commit to user
baku etilbenzena dengan kemurnian tinggi. Reaksi etilbenzena menjadi
styrene terjadi pada suhu 550oC~ 680oC dengan katalis Fe2O3.
C6H5CH2CH3 C6H5CH = CH2 + H2 Etilbenzena Styrene Hidrogen
(Kirk and Othmer, 1998)
1.4.4 Tinjauan Proses
Proses pembuatan etilbenzena dari etilen dan benzena termasuk dalam reaksi alkilasi. Reaksi alkilasi adalah penggabungan satu atau lebih gugus alkil ke dalam senyawa hidrokarbon. Proses alkilasi benzena menjadi etilbenzena terdiri dari tiga tahapan, yaitu :
1. Tahap alkilasi, yaitu reaksi alkilasi antara benzena dan etilen
2. Tahap transalkilasi, yaitu konversi dietilbenzena menjadi etilbenzena yang direaksikan kembali dengan benzena melalui reaksi transalkilasi. 3. Tahap pemisahan, yaitu proses pemisahan benzena yang tidak
bereaksi, dietilbenzena dan komponen lain dari produk etilbenzena sehingga menghasilkan kemurnian yang diinginkan (Ganji et al., 2004).
Reaksi alkilasi berlangsung pada suhu 350 oC ~ 450oCdan tekanan 8-28 atm . Reaksi yang terjadi adalah sebagai berikut :
C6H6 (g)+ (H2C=CH2)(g)ZSM 5 C6H5C2H5 (g) (1.4) Benzena Etilen Etilbenzena
commit to user
Pada reaksi ini terdapat juga reaksi samping berupa pembentukan dietilbenzena. Dietilbenzena kemudian akan direaksikan kembali menjadi etilbenzena melalui reaksi transalkilasi (Kirk and Othmer, 1998).
Reaksi transalkilasi berlangsung pada suhu 420oC ~ 460oC dengan reaksi sebagai berikut :
C6H6(g) + C6H4(C2H5)2 (g) 5 ZSM
2 C6H5C2H5 (g) (1.5) Benzena Dietilbenzena Etilbenzena
(Lim,1999) Gas keluaran reaktor alkilasi dan transalkilasi kemudian dikondensasikan dan diumpankan ke menara distilasi pertama untuk memisahkan benzena yang tidak bereaksi. Sebelumnya, fraksi hidrokarbon ringan berupa etana dan metana yang merupakan impuritas bahan baku etilen dipisahkan terlebih dahulu dan dapat digunakan sebagai bahan bakar. Hasil atas menara distilasi pertama berupa benzena dialirkan kembali menuju reaktor alkilasi dan transalkilasi untuk direaksikan kembali. Hasil bawah kemudian diumpankan ke menara distilasi kedua untuk pemurnian produk etilbenzena dari dietilbenzena hingga mencapai kadar 99,5% berat. Hasil bawah menara distilasi kedua berupa dietilbenzena kemudian diumpankan ke reaktor transalkilasi untuk direaksikan kembali menjadi etilbenzena (Kirk and Othmer, 1998).
commit to user BAB II
DESKRIPSI PROSES
2.1. Spesifikasi Bahan Baku dan Produk
2.1.1. Spesifikasi Bahan Baku
1. Benzena
Wujud : Cairan
Warna : tidak berwarna
Bau : khas benzena
Titik didih, [oC] : 80,1
Densitas : 873,7 kg/m3
Komposisi :
a. Benzena : minimal 99,9 % berat b. Toluena : maksimal 0,1 % berat
(PT. Pertamina, 2011)
2. Etilen
Wujud : Gas (6,8 atm, 30oC)
Warna : tidak berwarna
Bau : khas
Komposisi :
a. Etilen : minimal 99,5 % mol
commit to user
c. Etana : maksimal 0,2 % mol
(PT. Chandra Asri Petro Chemical, 2009)
2.1.2. Spesifikasi Katalis
Jenis : Zeolit AB-97
Bentuk : Bola Warna : Abu-abu Wujud : Padat Ukuran (diameter) : 1,5 mm Bulk density : 0,6 g/mL (Sinopec Petrochemical, 2008) 2.1.3. Spesifikasi Produk Etilbenzena Wujud : cairan Bau : khas Titik didih,[oC] : 136,9 Densitas : 862,6 kg/m3 Komposisi :
a. Etilbenzena : minimal 99,5 % berat
b. Benzena : 0,1%-0,4 % berat
c. Toluena : 0,1%-0,3 % berat
d. Dietilbenzena : 200 mg/kg
commit to user
2.2. Konsep Proses
2.2.1. Dasar Reaksi
Proses pembuatan etilbenzena dari benzena dan etilen merupakan proses alkilasi benzena pada fase gas yang dilakukan di dalam reaktor fixed bed sehingga menghasilkan produk etilbenzena dengan katalis Zeolit AB-97. Reaksi yang terjadi adalah sebagai berikut :
Reaksi Alkilasi : C6H6 (g) + C2H4 (g) C6H5C2H5 (g) Reaksi Samping : C6H5C2H5 (g) + 2C2H4(g) C6H4 (C2H5)2 (g) Reaksi Transalkilasi : C6H4 (C2H5)2 (g) + C6H6 (g) 2 C6H5C2H5 (g) 2.2.2. Pemakaian Katalis
Katalis yang digunakan adalah zeolit AB-97 yang dapat membantu dalam reaksi alkilasi dan transalkilasi. Alasan penggunaan katalis zeolit AB-97 adalah karena katalis ini lebih ramah lingkungan dibandingkan katalis AlCl3 dan BF3. Selain itu, katalis ini tidak terlarut di dalam produk sehingga tidak memerlukan proses pemisahan katalis.
Zeolit AB-97 350-449oC, 16,4 atm Zeolit AB-97 420-452oC, 6 atm 350-449oC, 16,4 atm Zeolit AB-97
commit to user
2.2.3. Mekanisme Reaksi
Reaksi pembentukan etilbenzena dengan proses Mobil-Badger adalah termasuk reaksi heterogen yang melibatkan dua fase yaitu reaktan dalam fase gas dan katalis dalam fase padat.
Mekanisme reaksi yang terjadi adalah sebagai berikut:
1. Transfer massa reaktan dari badan utama fluida ke permukaan luar katalis (external diffusion)
2. Transfer massa reaktan dari permukaan luar ke permukaan dalam pori – pori katalis (internal diffusion).
3. Adsorbsi reaktan pada permukaan katalis (chemisorbsion). 4. Reaksi pada permukaan katalis.
5. Desorbsi produk reaksi dari permukaan dalam katalis.
6. Transfer massa produk dari permukaan dalam ke permukaan luar katalis. 7. Transfer massa produk dari permukaan luar ke badan utama fluida.
Langkah proses nomor 1, 2, 6, 7 sangat cepat dibandingkan langkah nomor 3, 4, 5 sehingga kecepatan reaksi tidak dipengaruhi oleh transfer massa. Jadi langkah yang menentukan adalah reaksi pada permukaan katalis (Fogler, 1999).
Kondisi reaksi pada proses alkilasi benzena dengan suhu tinggi dan katalis AB-97 adalah bahwa etilen yang teradsorbsi akan bereaksi dengan benzena yang teradsorbsi dan etilbenzena yang terbentuk. Reaksi pada permukaan katalis merupakan pengendali reaksi pada proses ini (You and Pan, 2006).
commit to user
2.2.4. Fase Reaksi
Kondisi umpan sebelum masuk reaktor alkilasi maupun reaktor transalkilasi dalam fase gas – gas dengan katalis padat.
Reaksi Alkilasi : C2H4 (g) + C6H6 (g) C6H5C2H5 (g) C6H5C2H5(g) + C2H4 (g) C6H4(C2H5)2 (g) Reaksi transalkilasi : C6H4(C2H5)2(g) + C6H6 (g) 2C6H5C2H5 (g) 2.2.5. Kondisi Operasi
Proses pembuatan etilbenzena terdiri dari reaksi alkilasi dan transalkilasi yang dilakukan dalam dua reaktor fixed bed yang terpisah. Kondisi operasi dalam pembuatan etilbenzena ini dipengaruhi oleh perbandingan mol benzena dan etilen, temperatur, tekanan, dan jenis katalis yang digunakan.
Proses alkilasi benzena menjadi etilbenzena dilakukan pada fase gas dengan tekanan 16,4 atm dan suhu reaksi 350oC~449oC menggunakan katalis zeolit AB-97. Proses transalkilasi dietilbenzena menjadi etilbenzena dilakukan pada fase gas dengan tekanan 6 atm dan suhu reaksi 420oC~452oC menggunakan katalis zeolit AB-97. Hal ini dilakukan dengan melihat pertimbangan pengaruh kondisi suhu dan tekanan yang tinggi di dalam tahapan reaksi heterogen katalitik gas-padat agar reaksi berjalan sempurna. Semakin tinggi tekanan dan temperatur akan menyebabkan kecepatan reaksi bertambah cepat. Selain itu, katalis zeolit AB-97 digunakan agar lebih cepat mengarahkan reaksi bergeser ke kanan dengan
commit to user
konstanta kecepatan reaksi yang tinggi dimana katalis ini aktif pada kondisi suhu dan tekanan tinggi.
2.2.6. Tinjauan Termodinamika
Pada reaksi dipermukaan katalis, terjadi reaksi alkilasi antara etilen dengan benzena menghasilkan etilbenzena. Dengan tinjauan termodinamika, untuk mengetahui reaksi tersebut eksotermis atau endotermis dapat diketahui dari perhitungan ∆H298. Reaksi alkilasi : Pembentukan etilbenzena: C2H4 (g) + C6H6 (g) C6H5C2H5 (g) Pada 298 0C, ∆Hof C2H4 = 52,23 kJ/mol ∆Hof C6H6 = 82,93kJ/mol ∆Hof C6H5C2H5 = 17,24 kJ/mol (Yaws, 1999) ∆Hor = ∆Hof C6H5C2H5 - ( ∆Hof C2H4 + ∆Hof C6H6 ) = 17,24 - ( 82,93+ 52,23 ) = -117,92 kJ/mol Pembentukan dietilbenzena: C6H5C2H5 (g) + C2H4 (g) C6H4(C2H5)2 (g) Pada 298 0C, ∆Hof C2H4 = 52,23 kJ/mol ∆Hof C6H5C2H5 = 17,24 kJ/mol ∆Hof C6H5(C2H5)2 = -22,26 kJ/mol (Yaws, 1999)
commit to user ∆Hor = ∆Hof C6H5(C2H5)2- ( ∆Hof C2H4 + ∆Hof C6H5C2H5) = -22,26 – (17,24 + 52,23) = -91,73 kJ/mol Reaksi transalkilasi : C6H4(C2H5)2(g) + C6H6 (g) 2C6H5C2H5 (g) Pada 298 0C, ∆Hof C6H6 = 82,93 kJ/gmol ∆Hof C6H5(C2H5)2 = -22,26 kJ/gmol ∆Hof C6H5C2H5 = 17,24 kJ/gmol (Yaws, 1999) ∆Hor = 2 x ∆Hof C6H5C2H5- (∆Hof C6H5(C2H5)2 + ∆Hof C6H6) = 2x (17,24) – (-22,26 + 82,93) = -26,19 kJ/gmol
Karena ∆H yang dihasilkan negatif maka reaksi di atas merupakan reaksi eksotermis.
Dalam tinjauan termodinamika, hubungan antar panas reaksi, suhu dan konstanta kesetimbangan adalah sebagai berikut :
2 0 ln RT H dT K d
Bila persamaan tersebut diturunkan menjadi :
0 1 1' ' ln T T R H K K
(Smith and Van Ness,2001) Sifat reaksi yang reversibel atau irreversibel dapat diketahui dari harga konstanta kestimbangan.
commit to user Reaksi alkilasi : Pembentukan etilbenzena: C2H4(g) + C6H6 (g) C6H5C2H5 (g) Pada 298 0C, ∆Gof C2H4 = 68,12 kJ / gmol ∆Gof C6H6 = 129,66 kJ / gmol ∆Gof C6H5C2H5 = 120,58 kJ / gmol (Yaws, 1999) ∆Go = ∆Gof C6H5C2H5 - ( ∆Gof C2H4 + ∆Gof C6H6 ) = 120,58 - ( 68,12 + 129,66 ) = - 77,2 kJ / gmol
Harga konstanta kesetimbangan pada keadaan standar (T=298 K) ∆G = - RT ln K
K = e - ∆G / RT
= e – ( -77200 / 8,314 x 298 ) = 3,41x 1013
Harga konstanta kesetimbangan pada keadaan temperatur 723 K ln K723 K298 =-∆HR0 R 1 T2 -1 T1 ln K723-K298 =-(-117920) 8,314 1 723 -1 298 lnK723= -(-117920) 8,314 1 723 -1 298 +lnK298 𝐾723= 2,08 x 1012 Pembentukan dietilbenzena: C2H4(g) + C6H5C2H5(g) C6H4 (C2H5)2 (g)
commit to user Pada 298 0C, ∆Gof C2H4 = 68,12 kJ / gmol ∆Gof C6H5C2H5 = 120,58 kJ / gmol ∆Gof C6H4 (C2H5)2 = 137,86 kJ / gmol (Yaws, 1999) ∆Go = ∆Gof C6H4 (C2H5) - ( ∆Gof C2H4 + ∆Gof C6H5C2H5 ) = 137,86 - ( 68,12 + 120,58) = - 50,84 kJ / gmol
Harga konstanta kesetimbangan pada keadaan standar (T=298 K) ∆G = - RT ln K
K = e - ∆G / RT
= e – ( -50840 / 8,314 x 298 ) = 8,16 x 109
Harga konstanta kesetimbangan pada keadaan temperatur 723 K ln K723 K298 = ∆HR0 R 1 T2 -1 T1 ln K723-K298 =-(-91730) 8,314 1 723 -1 298 lnK723=-(-91730) 8,314 1 723 -1 298 +lnK298 𝐾723= 9,26 x 108 Reaksi transalkilasi : Pembentukan etilbenzena : C6H4(C2H5)2(g) + C6H6 (g) 2C6H5C2H5 (g)
commit to user Pada 298 0C, ∆Gof C6H6 = 129,66 kJ / gmol ∆Gof C6H5C2H5 = 120,58 kJ / gmol ∆Gof C6H4 (C2H5)2 = 137,86 kJ / gmol (Yaws, 1999) ∆Go = 2 x ∆Go f C6H5C2H5- (∆Gof C6H5(C2H5)2 + ∆Gof C6H6) = 2x (120,58) –(137,86+129,66) = -26,36 kJ/gmol ∆G = - RT ln K298 K298 = 4,18 x 104
Harga konstanta kesetimbangan pada keadaan temperatur 743 K ln K743 K298 =-∆HR0 R 1 T2 -1 T1 ln K743-K298 =-(-26190) 8,314 1 743 -1 298 lnK743=-(-26190) 8,314 1 743 -1 298 +lnK298 𝐾743= 2,22 x 104
Dari perhitungan diatas dapat disimpulkan bahwa reaksi alkilasi dan transalkilasi yang terjadi adalah reaksi searah ke kanan.
2.2.7. Tinjauan Kinetika
Reaksi alkilasi pembuatan etilbenzena merupakan reaksi eksotermis sehingga selama reaksi berlangsung akan terjadi pelepasan panas dan ini akan
commit to user
mempengaruhi kecepatan reaksi. Adapun harga k (konstanta kecepatan reaksi) pada pembuatan etilbenzena dari etilen dan benzena adalah sebagai berikut: Reaktor Alkilasi: C6H6(g) + C2H4 (g) C6H5C2H5 (g) B + E EB 𝑟1= k1PBPE-k-1PEB 1+KBPB+KEPE+KEBPEB+KDEBPDEB 2 C6H5C2H5 (g) + C2H4 (g) C6H4(C2H5)2(g) EB + E DEB 𝑟2= k2PEBPE-k-2PDEB 1+KBPB+KEPE+KEBPEB+KDEBPDEB 2 Dengan : k1 =245,3exp(- 48.396 RT) KE=0,457exp( 7.769 RT) k-1=5,13exp(- 69.641 RT) KB=6,77 ×10-3exp( 12.436 RT) k2=52,41exp(- 45.237 RT) KEB=3,19 ×10-3 exp( 10.173 RT) k-2=2,667exp(- 73.491 RT) KDEB=8,58×10-4exp( 14.059 RT) Keterangan :
ki = konstanta kecepatan reaksi ke arah produk k-i = konstanta kecepatan reaksi ke arah reaktan Kx = konstanta kesetimbangan adsorpsi
i = nomor reaksi
x = Etilen, Benzena, Etilbenzena, Dietilbenzena
commit to user Reaktor Transalkilasi: C6H4(C2H5)2(g) + C6H6 (g) 2C6H5C2H5 (g) DEB + B 2 EB r=k.pDEB.pB k=5,45 x 104e -24.000 x 4,12 RT (Lim, 1999)
2.2.8. Perbandingan Mol Reaktan
Pada reaksi alkilasi pembentukan etilbenzena digunakan perbandingan reaktan antara benzena dan etilen adalah sebesar 7 : 1. Umpan benzena dibuat berlebih karena dengan perbandingan tersebut dapat meminimalisir terjadinya reaksi samping yaitu, reaksi pembentukan dietilbenzena.
2.2.9. Reaksi Samping
Reaksi samping yang terjadi pada proses pembentukan etilbenzena adalah reaksi antara umpan etilen dengan etilbenzena yang terbentuk membentuk dietilbenzena :
Reaksi Alkilasi :
C2H4 (g) + C6H6 (g) C6H5C2H5 (g)
C6H5C2H5(g) + C2H4 (g) C6H4(C2H5)2 (g)
Konversi total etilen pada reaksi ini adalah sebesar 99,7%. Sebanyak 97% etilen bereaksi membentuk etilbenzena dan sisanya, 2,7% bereaksi membentuk dietilbenzena. Untuk meminimalisir pembentukan dietilbenzena, maka digunakan
commit to user
perbandingan umpan benzena yang berlebih sehingga umpan etilen akan lebih cenderung bereaksi dengan umpan benzena daripada etilbenzena yang terbentuk (U.S. Patent 6,252,126 B1).
2.3. Diagram Alir Proses
2.3.1. Diagram Alir Kualitatif
Diagram alir kualitatif dapat dilihat pada gambar 2.1.
2.3.2. Diagram alir Kuantitatif
Diagram alir kuantitatif dapat dilihat pada gambar 2.2.
2.3.3. Diagram alir Proses
commit to user C6 H6 C7 H8 C6 H6 C7 H8 C8 H1 0 C6 H6 C7 H8 C8 H1 0 R E A K T O R A L K IL A S I M E N A R A D IS T IL A S I 1 R E A K T O R T R A N S A L K IL A S I K O N D E N S E R P A R S IA L M E N A R A D IS T IL A S I 2 C6 H6 C7 H8 C8 H1 0 C1 0 H 1 4 C8 H1 0 C1 0 H1 4 C H 4 C2 H4 C2 H6 C6 H6 C7 H8 C8 H1 0 C1 0 H1 4 C H4 C2 H4 C2 H6 C6 H6 C7 H8 C8 H1 0 C6 H6 C7 H8 C8 H1 0 C1 0 H 1 4 C H4 C2 H4 C2 H 6 C6 H 6 C7 H 8 C8 H 1 0 C1 0 H1 4 C 6 H 6 C7 H 8 C8 H 1 0 C1 0 H1 4 T A N G K I B E N Z E N A E T IL E N A T A N G K I E T IL B E N Z E N A P = 1 a tm T = 3 0 o C P = 6 ,8 a tm T = 3 0 o C C H4 C2 H4 C2 H6 C6 H6 C7 H8 P = 1 6 ,4 a tm T = 3 5 0 oC P = 1 5 ,9 a tm T = 4 4 9 o C P = 1 a tm T = 5 7 o C P = 1 a tm T = 5 7 oC P = 5 ,9 a tm T = 4 5 2 oC C6 H 6 C7 H8 C8 H1 0 C1 0 H1 4 P = 1 ,2 a tm T = 5 8 o C P = 1 ,3 a tm T = 1 4 8 o C P = 1 ,4 a tm T = 1 9 2 o C P = 1 a tm T = 4 0 o C P = 1 a tm T = 8 2 o C P = 1 a tm T = 8 2 o C G a m b a r 2 .1 D ia g ra m a li r K u a li ta ti f C6 H6 C7 H8 C8 H1 0 C1 0 H1 4 P = 6 a tm T = 4 2 0 o C
commit to user R E A K T O R A L K IL A S I M E N A R A D IS T IL A S I 1 R E A K T O R T R A N S A L K IL A S I K O N D E N S E R P A R S IA L M E N A R A D IS T IL A S I 2 T A N G K I B E N Z E N A E T IL E N A T A N G K I E T IL B E N Z E N A G a m b a r 2 .2 D ia g ra m a li r K u a n it a ti f C6 H6 = 1 1 2 1 6 ,8 7 k g /j a m C7 H8 = 1 1 ,2 3 k g /j a m C H4 = 8 ,6 1 k g /j a m C2 H4 = 3 9 9 8 ,7 5 k g /j a m C2 H6 = 6 ,8 9 k g /j a m C H4 = 8 ,6 1 k g /j a m C2 H4 = 1 2 ,0 0 k g /j a m C2 H6 = 6 ,8 9 k g /j a m C6 H6 = 6 7 1 7 0 ,5 0 k g /j a m C7 H8 = 1 7 ,9 1 k g /j a m C8 H1 0 = 1 4 3 0 1 ,9 8 k g /j a m C1 0 H1 4 = 5 1 6 ,7 0 k g /j a m C H4 = 8 ,6 1 k g /j a m C2 H4 = 1 2 ,0 0 k g /j a m C2 H6 = 6 ,8 9 k g /j a m C6 H6 = 6 1 ,5 0 k g /j a m C7 H8 = 0 ,0 1 k g /j a m C8 H1 0 = 1 ,8 2 k g /j a m C1 0 H1 4 = 0 ,0 1 k g /j a m C6 H6 = 6 7 1 0 9 ,0 0 k g /j a m C7 H8 = 1 7 ,9 0 k g /j a m C8 H1 0 = 4 3 0 0 ,1 6 k g /j a m C1 0 H1 4 = 1 5 1 6 ,6 9 k g /j a m C6 H6 = 4 4 2 ,7 9 k g /j a m C7 H8 = 0 ,0 7 k g /j a m C8 H1 0 = 8 5 0 ,6 3 k g /j a m C6 H6 = 4 4 2 ,7 9 k g /j a m C7 H8 = 0 ,0 7 k g /j a m C8 H1 0 = 8 5 0 ,6 3 k g /j a m C8 H1 0 = 4 8 ,0 2 k g /j a m C1 0 H1 4 = 5 0 7 ,1 2 k g /j a m C6 H6 = 5 4 ,9 7 k g /j a m C7 H8 = 1 1 ,2 2 k g /j a m C8 H1 0 = 1 5 0 7 5 ,7 6 k g /j a m C1 0 H1 4 = 9 ,5 6 k g /j a m C6 H6 = 7 3 7 ,9 8 k g /j a m C7 H8 = 0 ,0 7 k g /j a m C8 H1 0 = 0 ,3 0 k g /j a m C6 H6 = 6 6 7 5 8 ,8 4 k g /j a m C7 H8 = 6 ,6 8 k g /j a m C8 H1 0 = 2 6 ,7 2 k g /j a m
commit to user
2.3.4. Langkah Proses
Langkah proses pembuatan etilbenzena dapat dikelompokan dalam tiga tahapan proses :
1. Tahap persiapan bahan baku 2. Tahap pembentukan etilbenzena 3. Tahap pemisahan dan pemurnian hasil
2.3.4.1. Tahap Persiapan Bahan Baku
Tahap persiapan bahan baku ini bertujuan untuk mengkondisikan keadaan bahan baku benzena dan gas etilen sehingga siap untuk diumpankan ke dalam reaktor alkilasi.
Bahan baku etilen diperoleh dari PT. Chandra Asri Petro Chemical yang dialirkan langsung pada kondisi 30oC, tekanan 6,8 atm. Etilen dinaikkan tekanannya terlebih dahulu menjadi 16,4 atm menggunakan kompresor (C-01). Setelah dinaikkan tekanannya, suhu etilen akan naik menjadi 85oC, setelah itu suhunya dinaikkan lagi menjadi 171oC menggunakan heat exchanger (E-04). Etilen siap diumpankan ke dalam reaktor alkilasi.
Benzena disimpan dalam tangki silinder (TT-01) pada suhu 30oC dan tekanan 1 atm dengan kapasitas penyimpanan 30 hari. Umpan segar benzena dicampur dengan recycle benzena dari hasil atas menara distilasi 1 (T-01) yang bersuhu 82oC. Campuran benzena ini mempunyai suhu akhir sebesar 74oC. Kemudian menggunakan pompa (J-01) benzena akan dinaikan tekanannya menjadi 16,4 atm. Benzena kemudian dinaikkan suhunnya hingga suhu bubble
commit to user
diuapkan menggunakan vaporizer 1 (E-02). Uap benzena yang dihasilkan dinaikkan suhunya lagi menggunakan heat exchanger (E-03) hingga suhu 360oC. Benzena siap diumpankan ke dalam reaktor alkilasi.
2.3.4.2. Tahap Pembentukan Etilbenzena
Tahap pembentukan produk ini bertujuan untuk :
a. Mereaksikan benzena dengan etilen membentuk produk utama etilbenzena dan produk samping dietilbenzena.
b. Mereaksikan dietilbenzena dengan benzena membentuk etilbenzena
c. Memanfaatkan panas keluaran dari tahap pembentukan produk sebagai pemanas benzena di dalam heat exchanger.
Benzena dan etilen diumpankan dari tahap persiapan bahan baku menuju bagian puncak reaktor secara kontinyu. Di dalam reaktor alkilasi (R-01) jenis
fixed bed yang dioperasikan pada suhu 350oC dan tekanan 16,4 atm, reaksi terjadi
antara benzenadengan etilen membentuk etilbenzenadan reaksi antara etilen sisa dengan etilbenzena membentuk dietilbenzena.
Reaksi alkilasi pada reaktor alkilasi (R-01) bersifat eksotermis sehingga suhu keluaran reaktor akan naik menjadi 449oC dan tekanannya akan turun menjadi 15,9 atm. Sebelum diproses lebih lanjut, produk keluaran reaktor alkilasi (R-01) akan diturunkan tekanannya terlebih dahulu menggunakan throttling valve hingga tekanan keluaran menjadi 1 atm dan suhunya turun menjadi 444oC. Panas keluaran reaktor yang tinggi dimanfaatkan sebagai media pemanas bahan baku benzena pada heat exchanger (E-01), (E-03). Setelah melewati throttling valve, produk keluaran reaktor alkilasi (R-01) kemudian dilewatkan melalui heat
commit to user
exchanger (E-03), suhu keluarannya turun menjadi sebesar 318oC.Dari heat
exchanger (E-03), keluaran reaktor kemudian dilewatkan heat exchanger (E-01).
Suhu awal masuk media pemanas adalah sebesar 318oC dan suhu keluarannya sebesar 173oC.
Sedangkan padareaktor transalkilasi terjadi reaksi antara recyclebenzena dari hasil atas menara distilasi 1 (T-01) dan dietilbenzenadari hasil bawah menara distilasi 2 (T-02) membentuk etilbenzena. Pada reaktor transalkilasi, jenis reaktor yang digunakan adalah fixed bed yang dioperasikan pada suhu 420oC - 452oC dan tekanan 6 atm. Sebelum masuk ke reaktor transalkilasi, umpan dietilbenzena dari hasil bawah menara distilasi 2 (T-02) yang bersuhu 192oC dicampur dengan
recycle benzena dari hasil atas menara distilasi 1 (T-01) yang bersuhu 82oC. Suhu
dari hasil campuran kedua umpan ini adalah sebesar 132oC. Kemudian campuran umpan inidinaikkan tekanannya dari 1 atm menjadi 6 atm menggunakan pompa sentrifugal (J-07). Kemudian campuran umpan ini akan diuapkan menggunakan
vaporizer 2 (E-10), dengan suhu masuk sebesar 148oC dan suhu keluaran
vaporizer 2 (E-10) sebesar 227oC. Sebelum masuk ke reaktor transalkilasi (R-02),
terlebih dahulu campuran ini dinaikkan suhunya menjadi 420oC menggunakan
heat exchanger (E-11). Campuran uap siap diumpankan masuk reaktor
transalkilasi (R-02). Reaksi transalkilasi bersifat eksotermis sehingga pada keluaran reaktor transalkilasi (R-02) suhu produk keluaran reaktor akan naik menjadi 452oC dan tekanannya akan turun menjadi 5,9 atm. Seperti halnya pada reaktor alkilasi (R-01), sebelum diproses lebih lanjut produk keluaran reaktor akan diturunkan tekanannya terlebih dahulu dari 5,9 atm menjadi 1 atm dan
commit to user
suhunya akan turun menjadi 450oC. Setelah diturunkan tekanannya, panas produk keluaran reaktor transalkilasi dimanfaatkan sebagai media pemanasumpan masuk reaktor transalkilasi (R-02). Pemanasan awalumpan masuk reaktor transalkilasi menggunakan heat exchanger (E-11) dengan suhu masuk 450oC dan suhu keluarnya sebesar 264oC. Dari heat exchanger (E-11), produk kemudian dilewatkan melalui heat exchanger (E-12) untuk dikondensasi menjadi suhu 103oC sehingga dapat dicampur dengan keluaran kondenser parsial (E-05).
2.3.4.3. Tahap Pemisahan dan Pemurnian Hasil
Tahap pemurnian produk ini bertujuan untuk :
a. Memisahkan inertberupa metana, etana dan sisa etilen pada kondenser parsial. b. Memisahkan sisa benzena dan etilbenzena serta dietilbenzena pada menara
distilasi I (T-01). Benzena ini digunakan sebagai recycle pada umpan reaktor alkilasi (R-01) dan umpan pada reaktor transalkilasi (R-02).
c. Memisahkan etilbenzena sebagai hasil atas, dari dietilbenzena pada menara distilasi 2. Dietilbenzena ini digunakan sebagai umpan pada reaktor transalkilasi (R-02).
Produk keluaran reaktor alkilasi (R-01) yang telah dimanfaatkan panasnya sebagai media pemanas umpan, kemudian akan dikondensasikan menggunakan kondenser parsial (E-05)untuk memisahkan inert yang berupametana, etana dan sisa etilen yang tidak bereaksi. Suhu masuk kondenser parsial (E-05) adalah sebesar 173oC dan dikondensasikan hingga suhu keluarnya mencapai 57oC. Gas metana, etana dan etilen yang tidak terkondensasi dikeluarkan melalui vent yang terdapat pada kondensar parsial (E-05). Sedangkan
commit to user
cairan hasil keluaran dari kondenser parsial (E-05) dicampur dengan cairan hasil keluaran dari keluaran kondenser (E-12) untuk diumpankan menuju menara distilasi 1 (T-01).
Umpan masuk pada menara distilasi 1 (T-01) dalam kondisi subcooled yaitu pada suhu 58oC dan tekanan 1,2 atm. Hasil atas menara distilasi 1 (T-01) adalah berupa benzena yang akan digunakan kembalisebagai umpan reaktor alkilasi (R-01) dan sebagai umpan reaktor transalkilasi (R-02). Sedangkan hasil bawah berupa produk etilbenzena dan produk samping dietilbenzena.
Umpan masuk menara distilasi 2 (T-02) dalam kondisi cair jenuh yaitu pada suhu 148oC. Hasil atas menara distilasi berupa produk etilbenzena. Sedangkan hasil bawah berupa produk samping berupa dietilbenzena yang nantinya digunakan sebagai umpan pada reaktor transalkilasi (R-02). Produk etilbenzena dari hasil atas menara distilasi 2 (T-02) sebelum disimpan pada tangki penyimpanan (TT-02) pada suhu 40oC dan tekanan 1 atm, diturunkan dahulu suhunya dengan cara dilewatkan padaheat exchanger (E-13).
2.4. Neraca Massa dan Neraca Panas
Produk : Etilbenzena 99,5% berat
Kapasitas perancangan : 120.000 ton/tahun Waktu operasi selama 1 tahun : 330 hari
commit to user
2.4.1. Neraca massa
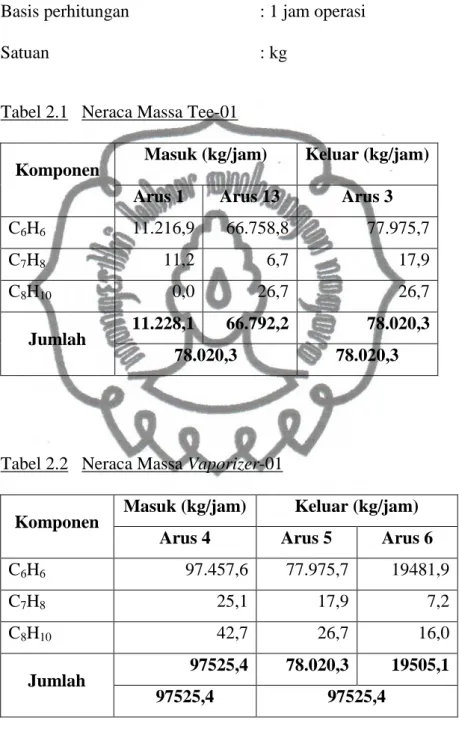
Diagram alir neraca massa sistem tabel merujuk pada gambar 2.3.3 Basis perhitungan : 1 jam operasi
Satuan : kg
Tabel 2.1 Neraca Massa Tee-01
Komponen Masuk (kg/jam) Keluar (kg/jam)
Arus 1 Arus 13 Arus 3
C6H6 11.216,9 66.758,8 77.975,7
C7H8 11,2 6,7 17,9
C8H10 0,0 26,7 26,7
Jumlah 11.228,1 66.792,2 78.020,3
78.020,3 78.020,3
Tabel 2.2 Neraca Massa Vaporizer-01
Komponen Masuk (kg/jam) Keluar (kg/jam)
Arus 4 Arus 5 Arus 6
C6H6 97.457,6 77.975,7 19481,9
C7H8 25,1 17,9 7,2
C8H10 42,7 26,7 16,0
Jumlah 97525,4 78.020,3 19505,1
commit to user
Tabel 2.3 Neraca Massa Tee-02
Komponen Masuk (kg/jam) Keluar (kg/jam)
Arus 2 Arus 5 Arus 7
C2H4 3.998,8 0,0 3.998,8 C2H6 8,6 0,0 8,6 CH4 6,9 0,0 6,9 C6H6 0,0 77.975,7 77.975,7 C7H8 0,0 17,9 17,9 C8H10 0,0 26,7 26,7 Jumlah 4.014,3 78.020,3 82.034,6 82.034,6 82.034,6
Tabel 2.4 Neraca Massa Reaktor Alkilasi
Komponen Masuk (kg/jam) Keluar (kg/jam)
Arus 7 Arus 8 C2H4 3.998,8 12,0 C2H6 8,6 8,6 CH4 6,9 6,9 C6H6 77.975,7 67.170,5 C7H8 17,9 17,9 C8H10 26,7 14.302,0 C10H14 0,0 516,7 Jumlah 82.034,6 82.034,6
commit to user
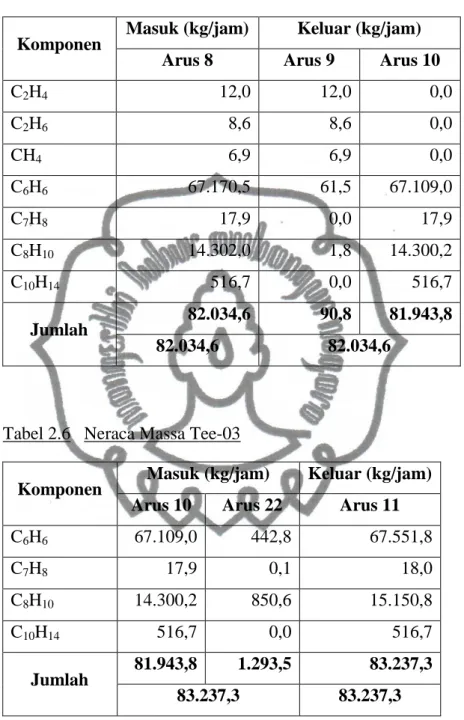
Tabel 2.5 Neraca Massa Kondenser Parsial
Komponen Masuk (kg/jam) Keluar (kg/jam)
Arus 8 Arus 9 Arus 10
C2H4 12,0 12,0 0,0 C2H6 8,6 8,6 0,0 CH4 6,9 6,9 0,0 C6H6 67.170,5 61,5 67.109,0 C7H8 17,9 0,0 17,9 C8H10 14.302,0 1,8 14.300,2 C10H14 516,7 0,0 516,7 Jumlah 82.034,6 90,8 81.943,8 82.034,6 82.034,6
Tabel 2.6 Neraca Massa Tee-03
Komponen Masuk (kg/jam) Keluar (kg/jam)
Arus 10 Arus 22 Arus 11
C6H6 67.109,0 442,8 67.551,8 C7H8 17,9 0,1 18,0 C8H10 14.300,2 850,6 15.150,8 C10H14 516,7 0,0 516,7 Jumlah 81.943,8 1.293,5 83.237,3 83.237,3 83.237,3
commit to user
Tabel 2.7 Neraca Massa Menara Distilasi-01
Komponen Masuk (kg/jam) Keluar (kg/jam)
Arus 11 Arus 12 Arus 15
C6H6 67.551,8 67.496,8 55,0 C7H8 18,0 6,8 11,2 C8H10 15.150,8 27,0 15.123,8 C10H14 516,7 0,0 516,7 Jumlah 83.237,3 67.530,6 15.706,7 83.237,3 83.237,3
Tabel 2.8 Neraca Massa Menara Distilasi-02
Komponen Masuk (kg/jam) Keluar (kg/jam)
Arus 15 Arus 16 Arus 17
C6H6 55,0 55,0 0,0 C7H8 11,2 11,2 0,0 C8H10 15.123,8 15075,8 48,0 C10H14 516,7 9,6 507,1 Jumlah 15.706,7 15151,6 555,1 15.706,7 15.706,7
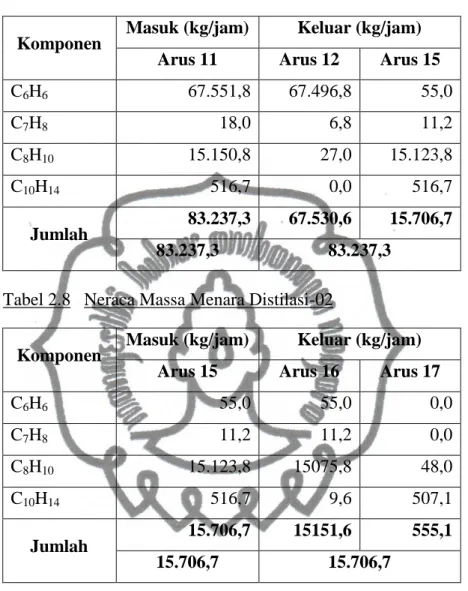
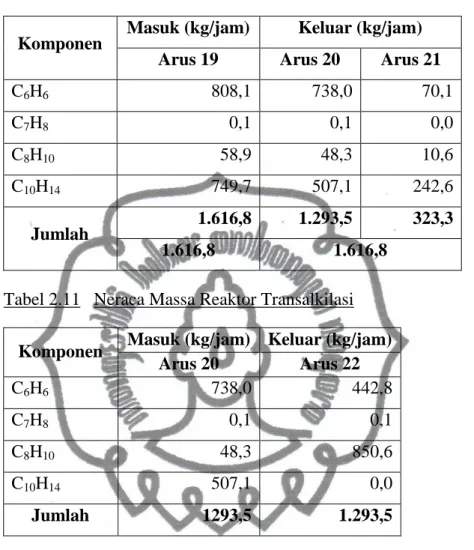
Tabel 2.9 Neraca Massa Tee-04
Komponen Masuk (kg/jam) Keluar (kg/jam)
Arus 14 Arus 17 Arus 18
C6H6 738,0 0,0 738,0 C7H8 0,1 0,0 0,1 C8H10 0,3 48,0 48,3 C10H14 0,0 507,1 507,1 Jumlah 738,4 555,1 1.293,5 1.293,5 1.293,5
commit to user
Tabel 2.10 Neraca Massa Vaporizer-02
Komponen Masuk (kg/jam) Keluar (kg/jam)
Arus 19 Arus 20 Arus 21
C6H6 808,1 738,0 70,1 C7H8 0,1 0,1 0,0 C8H10 58,9 48,3 10,6 C10H14 749,7 507,1 242,6 Jumlah 1.616,8 1.293,5 323,3 1.616,8 1.616,8
Tabel 2.11 Neraca Massa Reaktor Transalkilasi
Komponen Masuk (kg/jam) Keluar (kg/jam)
Arus 20 Arus 22 C6H6 738,0 442,8 C7H8 0,1 0,1 C8H10 48,3 850,6 C10H14 507,1 0,0 Jumlah 1293,5 1.293,5
Tabel 2.12 Neraca Massa Total
Komponen Masuk (kg/jam) Keluar (kg/jam)
Arus 1 Arus 2 Arus 9 Arus 16
C2H4 0,00 3.998,8 12,0 0,00 C2H6 0,00 8,6 8,6 0,00 CH4 0,00 6,9 6,9 0,00 C6H6 11.216,9 0,00 61,5 55,0 C7H8 11,2 0,00 0,0 11,2 C8H10 0,00 0,00 1,8 15075,8 C10H14 0,00 0,00 0,0 9,6 Jumlah 11.228,1 4.014,3 90,8 15151,6 15242,4 15242,4
commit to user
2.4.2. Neraca Panas
Diagram alir neraca panas sistem tabel Basis perhitungan : 1 jam operasi
Satuan : kJ
Tabel 2.13 Neraca Panas Reaktor Alkilasi
Komponen Masuk (kJ/jam) Keluar (kJ/jam)
Arus 7 QR Arus 8 C2H4 2.678.214,0 11.263,5 C2H6 6.722,9 9.461,2 CH4 6.202,4 8.614,8 C6H6 41.421.703,3 50.393.335,7 C7H8 9.940,7 14.020,1 C8H10 15.588,9 11.751.505,9 C10H14 0,0 447.096,3 Jumlah 44.138.372,2 18.496.925,3 62.635.297,5 62.635.297,5 62.635.297,5
Tabel 2.14 Neraca Panas Reaktor Transalkilasi
Komponen Masuk (kJ/jam) Keluar (kJ/jam)
Arus 7 Qreaksi Arus 8
C6H6 504.200,9 334.953,7 C7H8 52,7 58,3 C8H10 36.178,1 704.707,2 C10H14 400.171,2 0,00 Jumlah 940.602,9 99116,3 1.039.719,2 1.039.719,2 1.039.719,2
commit to user
Tabel 2.15 Neraca Panas Menara Distilasi-01
Komponen Masuk (kJ/jam) Keluar (kJ/jam)
Arus 11 QR Arus 12 Arus 15 QC
C6H6 4.016.611,5 6.990.281,9 12.938,0 C7H8 1.031,5 673,9 2.537,7 C8H10 873.881,9 2.706,6 3.419.945,7 C10H14 33.259,6 0,0 129.811,5 Jumlah 4.924.784,5 46.902.943,9 6.993.662,4 3.565.232,9 41.268.832,9 51.827.728,4 51.827.728,4
Tabel 2.16 Neraca Panas Menara Distilasi-02
Komponen Masuk (kJ/jam) Keluar (kJ/jam)
Arus 15 QR Arus 16 Arus 17 QC
C6H6 12.938,0 12.102,8 0,0 C7H8 2.537,7 2.374,7 0,0 C8H10 3.419.945,7 3.191.758,4 15.224,7 C10H14 129.811,5 2.250,4 177.885,0 Jumlah 3.565.232,9 7.697.371,7 3.208.486,3 193.109,7 7.861.008,6 11.262.604,6 11.262.604,6
commit to user
Tabel 2.17 Neraca Panas Kondenser Parsial
Komponen Masuk (kJ/jam) Keluar (kJ/jam)
QC Arus 8 Qkondensasi C2H4 1704,98 C2H6 1.420,8 CH4 1.334,1 C6H6 7.498.559,4 C7H8 2.093,4 C8H10 1.760.765,1 C10H14 67.447,0 Jumlah 44.901.233,4 9.333.324,8 35.567.908,6 44.901.233,4 44.901.233,4
Tabel 2.18 Neraca Panas Overall
Masuk Keluar
Komponen kJ/jam Komponen kJ/jam
Arus Masuk 1 195.643,9 Arus keluar 9 4.003,5
Arus Masuk 2 31.645,9 Arus keluar 16 394.239,3
E-04 652.244,8 Kondenser 1 41.268.833,0
Reboiler 1 46.902.943,9 Kondenser 2 7.697.371,6
Reboiler 2 7.697.371,6 Kondenser parsial 44.901.233,4
Vaporizer 1 25.015.774,0 E-12 921.476,5
Vaporizer 2 699.501,3 E-13 2.814.246,9
Qreaksi 18.596.041,6 Qloss 1.789.762,7
commit to user
2.5. Lay Out Pabrik dan Peralatan Proses
Lay Out merupakan tempat kedudukan keseluruhan bagian dari perusahaan yang meliputi tempat kerja alat, tempat kerja orang, tempat penimbunan bahan dan hasil, tempat utilitas, perluasan, dan lain-lain.
Lay Outpabrik merupakan suatu pengaturan yang optimal dari seperangkat fasilitas-fasilitas dalam pabrik. Tata letak yang tepat sangat penting untuk mendapatkan efisiensi, keselamatan, dan kelancaran kerja para pekerja serta keselamatan proses.
Untuk mencapai kondisi yang optimal, maka hal-hal yang harus diperhatikan dalam menentukan tata letak pabrik adalah :
1. Kemungkinan perluasan pabrik sebagai pengembangan pabrik di masa depan. 2. Sistem kontruksi yang direncanakan adalah outdoor untuk menekan biaya
bangunan dan gedung.
3. Letak masing-masing alat produksi sedemikian rupa sehingga memberikan kelancaran dan keamanan bagi tenaga kerja.
4. Alat-alat yang berisiko tinggi harus diberi jarak yang cukup sehingga aman dan mudah mengadakan penyelamatan jika terjadi kecelakaan, kebakaran dan sebagainya.
5. Jalan-jalan dalam pabrik harus cukup lebar dan memperhatikan faktor keselamatan manusia, sehingga lalu lintas dalam pabrik dapat berjalan dengan baik.
6. Letak kantor dan gudang mudah dijangkau dari jalan utama (Vilbrandt and Dryden, 1959).
commit to user
Secara garis besar lay out dibagi menjadi beberapa bagian utama, yaitu: a. Daerah perkantoran, laboratorium dan ruang kontrol
Daerah ini merupakan pusat kegiatan administrasi pabrik yang mengatur kelancaran operasi. Laboratorium dan ruang kontrol sebagai pusat pengendalian proses, kualitas dan kuantitas bahan yang akan diproses serta produk yang dijual.
b. Daerah proses
Daerah proses merupakan daerah dimana alat proses diletakkan dan proses berlangsung.
c. Daerah penyimpanan bahan baku dan produk.
Daerah ini merupakan daerah untuk tangki bahan baku dan produk. d. Daerah gudang, bengkel dan garasi.
Daerah ini merupakan daerah untuk penampung bahan-bahan yang diperlukan oleh pabrik dan untuk keperluan perawatan peralatan proses. e. Daerah utilitas
Daerah ini merupakan daerah untuk kegiatan penyediaan bahan pendukung proses berlangsung dipusatkan (Vilbrandt and Dryden, 1959).
commit to user 1 2 13 1 7 1 6 1 5 1 8 1 1 9 4 4 6 8 5 7 1 3 1 4 2 1 0 K et er an g an : 1 . P o s K ea m an an 2 . P o s K ea m an an 3 . K an to r K ea m an an 4 . P ar k ir 5 . M as ji d 6 . K an ti n 7 . K an to r 8 . P er p u st ak aa n 9 . P o li k li n ik 1 0 . R u an g K o n tr o l 1 1 . L ab o ra to ri u m 1 2 . P ro se s 1 3 . U ti li ta s 1 4 . R u an g G en er at o r 1 5 . B en g k el 1 6 . G ar as i 1 7 . G u d an g 1 8 . P em ad am A re a P er lu as an T am an Ja lu r M as u k K an to r Ja lu r M as u k P ab ri k S k al a :1 :2 0 0 U G am b ar 2 .4 T at a le ta k p ab ri k E ti lb en ze n a
commit to user 2 3 2 2 2 1 1 1 1 5 6 7 4
Gambaar 2.5 Tata letak peralatan Keterangan :
1. Tangki Benzena 5. Menara Distilasi 1 2. Tangki Etilbenzena 6. Menara Distilasi 2 3. Reaktor Alkilasi 7. Reaktor Transalkilasi 4. Kondenser Parsial
commit to user BAB III
SPESIFIKASI PERALATAN PROSES
3.1. Tangki Penyimpanan Benzena
Kode : TT-01
Fungsi : Menyimpan bahan baku benzena selama 30 hari Jenis : Tangki silinder tegak dengan alas datar (flat bottom)
dengan bagian atas berbentuk conical roof Jumlah : 4 buah
Volume : 2.669,316 m3
Bahan : Carbon steel SA 283 grade C Kondisi penyimpanan Tekanan : 1 atm Suhu : 30 oC Dimensi Diameter tangki : 15,24 m Tinggi tangki : 14,63 m
Tebal tangki : Course 1 = 0,022 m
Course 2 = 0,019 m
Course 3 = 0,019 m
Course 4 = 0,019 m
Course 5 = 0,019 m