Goniastrea aspera PADA TERAPAN BERBAGAI TARAF TEMPERATUR dan KETAHANANNYA PASCA PEMUTIHAN
Abstrak
Proses pemulihan karang akibat pemutihan tidak saja bergantung kepada seberapa jauh intensitas dan kontinyuitas faktor pengaruh akan tetapi juga kondisi seluler dari polip karang itu sendiri. Keduanya merupakan indikasi yang sangat penting untuk menjawab permasalahan penurunan yang berlanjut atau sebaliknya potensi pulih (recovery) dari karang yang bersangkutan. Oleh sebab itu, dalam kaitannya dengan proses pemutihan perlu dipahami secara internal pada polip karang khususnya mengenai pola peluluhan zooxanthellae berserta perangkat perubahan jaringannya. Mengingat bahwa temperatur merupakan salah satu potensi penyebab degradasi secara global, maka peubah ini dipergunakan sebagai variabel acuan dalam menentukan pola degradasi polip karang.
Kajian uji degradasi jaringan polip Goniastrea aspera pada terapan berbagai taraf temperatur dan ketahannya pasca pemutihan dilakukan pada media binaan di lingkungan Laboratorium Pengembangan Wilayah Pantai (LPWP) FPIK-UNDIP Jepara dan lingkungan perairan terumbu karang selatan Pulau Panjang Jepara pada April sampai dengan September 2006. Perlakuan yang diterapkan adalah dengan memberikan kejut temperatur kepada biota uji
Goniastrea aspera dalam 4 taraf yaitu 40oC, 36oC, 32oC dan 28oC. Kajian ini bertujuan untuk : (a) Mengkaji efek temperatur terhadap perubahan kadar zooxanthellae pada jaringan polip karang; (b) Mengkaji efek temperatur terhadap proses perubahan jaringan polip karang dan (c) Mengevaluasi kemampuan pulih karang pasca pemutihan
Hasil yang menonjol dari kajian tahan ini adalah : (a) Temperatur optimum bagi zooxanthellae yang masih dapat bertahan pada jaringan polip karang
Goniastrea aspera adalah 36oC selama 6 jam, (b) Di atas temperatur optimum terjadi proses degradasi jaringan polip, pelepasan zooxanthellae dan kematian karang, (c) Pemulihan biota uji hanya dapat terjadi pada kondisi pemutihan parsial (d) Pemulihan karang ditandai dengan terjadinya proses regulasi zooxanthellae di dalam jaringan polip karang dan mencapai penataan sempurna setelah minggu ke 12.
Abstract
Coral recovery from bleaching not only depend on intensity and continyuity of efect factors but also depend on celluler conditon on coral itself. Both efect are the most indicator to anwer decrease problem of coral quality and recovery potensial of coral. Reletionship between coral recovery and bleaching can be studied from losses procces of zooxanthellae from polyp and changes of histology profile. Main stressor applied in this study is temperature.
Research on degradation test of polyp histology by temperatur stressor and potensial recovery post bleaching do in artificial media at Coastal
Ecodevelopment Laboratory of FPIK-UNDIP Jepara and natural waters of coral reef ecosystem in South Pulau Panjang Jepara at April to September 2006. Research applied 4 levels temperatur are 40oC, 36oC, 32oC dan 28oC and are propose : (a) investigate effect temperature concerning change content zooxanthellae density in the polyp histologies, (b) investigate effect temperature on process change of polyp histologies and (c) the evaluation ability of coral after bleaching.
Result of this research are : (a) Optimum temperatur for resistent of zooxanthellae in the polyp histologist of Goniastrea aspera is 36oC until 6 hours, (b) More than optimal temperature and incubation time efected on the histologist degradation of the polyp of Goniastrea aspera, zooxanthellae release and coral death, (c) Recovery organism (Goniastrea aspera) examine on the condition partial bleaching and (d) Coral recovery marked with zooxanthellae regulation process in the polyp hystologies.and to achieve perfect systematic after week 12th.
Pendahuluan
Wilayah perairan di kepulauan Indonesia dan Filipina merupakan pusat keragaman terumbu karang dunia. Pada kawasan ini dijumpai sekitar 600 spesies karang yang sudah teridentifikasi. Selain itu, wilayah Indonesia-Filipina diperkirakan sebagai pusat sebaran spesies karang di dunia (Veron, 1995). Pada saat ini, kondisi terumbu karang di wilayah Indonesia sudah sangat memprihatinkan. Menurut penelitian P3O-LIPI yang dilakukan pada tahun 1996
dinyatakan bahwa 39,5% terumbu karang di Indonesia dalam keadaan rusak, 33,5% dalam keadaan sedang, 21,7% dalam keadaan baik dan hanya 5,3% dalam kondisi sangat baik (COREMAP, 2001). Menurut Westmacott et al. (2000), buruknya kondisi terumbu karang di Wilayah Indonesia-Filipina, selain akibat perbuatan manusia juga karena bencana alam seperti pemutihan karang.
Menurut Burke et al., (2002) ekosistem terumbu karang di wilayah Asia Tenggara merupakan ekosistem terumbu karang yang terancam di dunia. Besarnya ketergantungan manusia terhadap sumberdaya laut di seluruh Asia Tenggara telah menyebabkan eksploitasi yang berlebih sehingga banyak terumbu karang yang terdegradasi, khususnya di dekat pusat kepadatan penduduk. Sekitar 70% penduduk di kawasan ini hidup di radius 50 km dari kawasan pesisir. Sebaran penduduk ini mengakibatkan adanya ancaman-ancaman terhadap terumbu karang; termasuk penangkapan berlebihan (over fishing), penangkapan ikan dengan metode yang merusak, sedimentasi, pencemaran dan pembangunan
pesisir. Selain itu meningkat-nya temperatur global (global warming) juga telah menyebabkan sumberdaya yang sangat penting ini dalam keadaan bahaya.
Pengaruh temperatur air laut global yang meningkat merupakan penyebab utama dari menurunnya kualitas terumbu karang melalui proses pemutihan. Dalam jangka pendek, pengaruh tekanan peningkatan temperatur air laut terhadap karang menyangkut multifungsi dari fotosistem algae (Iglesias-Pricto et al., 1992; Salih et al., 1998; Warner et al., 1996; Jones et al., 2000; Fitt et al., 2001) dalam bentuk menurunkan produksi primer (Porter et al., 1999; Nystrom et al., 2001); mengubah respirasi (Porter et al., 1999; Nystrom et al., 2001; Fitt et al., 2001) yang mengakibatkan pemutihan karang (Warner et al., 1996; Jones et al., 2000; Fitt et al., 2001), menurunkan fekunditas (Szmant dan Gassman, 1990) dan kalsifikasi (Atkinson et al., 1994). Dalam jangka waktu lama pengaruh pemutihan karang akibat peningkatan temperatur dapat menyebabkan berkurangnya laju pertumbuhan dan kalsifikasi karang, perusakan reproduksi serta necrosis jaringan polip karang (Glynn, 1993).
Selama pemutihan karang secara global dari terumbu karang pada tahun 1997 dan 1998, maka peningkatan temperatur menjadi faktor yang terdiskriminasi tanpa melihat pengaruh aktivitas manusia lainnya (Wilkinson, 1999; Wilkinson, 2000). Meskipun dimungkinkan pengaruh tumpang tindih dengan faktor lain namun berbagai studi memperlihatkan bahwa peningkatan temperatur memberikan konstribusi terbesar terhadap hal tersebut (Salih et al., 1998; Berkelmans et al., 2002; Fitt et al., 2000). Hasil kajian Suharsono (1999) di kawasan terumbu karang beberapa lokasi di Indonesia menginformasikan bahwa dampak pemutihan karang mengakibatkan penurunan kualitas terumbu yakni dalam bentuk menurunnya tutupan karang. Namun demikian, kajian sekuansial oleh Abrar (1999) menginformasikan bahwa pada Pulau Sekuwai, Bungus, Teluk Kabung, Padang; kerusakan karang yang sama akibat pemutihan karang dalam perkembangannya mempunyai kecenderungan mempunyai pemulihan dengan kualitas yang sama. Pada bagian lain, di kawasan yang lebih dekat dengan
mainland (daratan utama yaitu Teluk Jakarta) penurunan kualitas karang sifatnya permanen. Informasi ini mengarahkan kepada pemikiran terhadap kemungkinan kemampuan pulih (recovery) dan sebaliknya berdampak secara berlanjut. Hal
terakhir inilah yang kemudian menjadi simpulan beberapa penelitian yang menyatakan bahwa pengaruh tumpang tindih dari berbagai faktor perlu diperhatikan sebagai faktor penentu dari kelangsungan ekosistem terumbu karang (Wilkinson, 1999; Wilkinson, 2000; Berkelmans et al, 2002; Salih et al., 1998; Fitt et al., 2000).
Terjadinya degradasi ekosistem terumbu karang dikhawatirkan akan menurunkan keragaman spesies organisme lain yang hidupnya tergantung pada ekosistem tersebut. Allen et al., (1990) meneliti beberapa parameter ekologi ikan yang dihubungkan dengan degradasi terumbu karang melaporkan bahwa respon ikan terhadap gangguan habitat bervariasi secara regional dan lokal tergantung spesies ikan dan tempat kerusakan. Secara umum, kebanyakan spesies ikan mempunyai respon negatif terhadap penurunan penutupan karang hidup yang menyebabkan penurunan diversitas, kekayaan spesies, dan penurunan spesies ikan karang yang berasosiasi. Pada sisi lain, degradasi yang bersifat parsial pada lingkungan terumbu karang dapat menyebabkan terjadinya kemunduran secara berlanjut, terlebih apabila pengaruh penyebab degradasi berlangsung secara terus menerus serta tumpang tindih dengan aspek penurun kualitas karang lainnya.
Proses pemulihan kembali terumbu karang tidak saja bergantung kepada seberapa jauh intensitas dan kontinyuitas faktor pengaruh degradasi berlangsung akan tetapi juga pada sediaan stock terumbu karang di sekelilingnya melalui proses recruitment. Di samping hal tersebut perubahan kondisi seluler dari polip karang itu sendiri juga merupakan indikasi yang sangat penting untuk menjawab permasalahan penurunan yang berlanjut atau sebaliknya potensi pulih (recovery). Oleh sebab itu, dalam kaitannya dengan proses pemutihan karang perlu dipahami secara internal pada polip karang khususnya mengenai pola peluluhan zooxanthellae berserta perangkat perubahan jaringannya. Mengingat bahwa temperatur merupakan salah satu potensi penyebab degradasi secara global, maka peubah ini dipergunakan sebagai variabel acuan dalam menentukan pola degradasi polip karang.
Uji degradasi dan pulih diri jaringan polip karang ini merupakan salah satu tahap penunjang untuk mendapatkan hasil yang dipergunakan bagi tujuan penelitian utama translokasi zooxanthellae. Adapun kriteria yang dipergunakan
adalah kondisi minimum bagi biota uji terdegradasi yang mampunyai ketahanan untuk bertahan hidup. Tujuan dari uji degradasi jaringan polip Goniastrea aspera
terhadap terapan berbagai taraf temperatur dan ketahanannya pasca pemutihan karang adalah :
1. Mengkaji efek temperatur terhadap perubahan kadar zooxanthellae pada jaringan polip karang
2. Mengkaji efek temperatur terhadap proses perubahan jaringan polip karang; 3. Mengevaluasi kemampuan pulih karang pasca pemutihan karang.
Metodologi
Kajian uji degradasi jaringan polip Goniastrea aspera terhadap terapan berbagai taraf temperatur dan ketahanannya pasca pemutihan karang yang dilakukan ini bertujuan menentukan tingkat ketahanan Goniastrea aspera selama waktu inkubasi pemutihan sampai keluarnya zooxanthellae secara optimum dari jaringan polipnya dan masih memperlihatkan dapat pulih kembali.
Peralatan Percobaan
Peralatan yang dipergunakan dalam penelitian tahap ini : pertama adalah peralatan selam dan transek meliputi scuba diving, tali rol 50 meter, palu, tatah, tempat sample karang, stiloform, perahu. Peralatan tersebut dipergunakan untuk penelitian pendahuluan penentuan materi uji dan penanaman kembali pasca pemutihan karang. Kedua adalah peralatan tekanan temperatur : thermoregulator kapasitas 25–40oC; set peralatan bak penangkaran, aerator yang dilengkapi dengan batu aerasi dan selangnya; pencahayaan neon hijau. Ketiga adalah peralatan uji : haemocytometer, fotograp mikroskop, blender, mikrotom; serta keempat adalah peralatan analisis kualitas air media : seperangkat penangas (water heater, stirer) dan filter air, deionyzed water instrument; thermometer skala 50oC, refraktometer, spectrophotometer.
Bahan Percobaan
Obyek penelitian adalah jenis karang yang terpilih dari hasil seleksi dari kawasan terumbu karang Pulau Bokor Jepara, yaitu Goniastrea aspera. Jenis karang yang dijadikan biota uji adalah jenis yang mempunyai tingkat ketahanan
tinggi terhadap sifat pathogenitas lingkungan. Dasar pemikiran penggunaan hewan uji karang ini adalah pada umumnya Goniastrea aspera mempunyai sebaran yang luas di ekosistemnya, sehingga mampu merepresentasikan adaptasi yang luas baik pada lapisan penghambat (inhibiting layer) sampai dengan lapisan pembatas (limiting layer) kehidupan karang. Kedua, dengan sebaran yang luas maka interaksi dengan zooxanthellae juga diperkirakan mempunyai peluang keacakan transduksi zooxanthellae besar.
Kriteria ketiga dari penggunaan hewan uji ini adalah Goniastrea aspera
mempunyaibentuk corralite yang besar. Dengan luas penampang yang lebar maka peluang retransduksi akan menjadi lebih besar dibandingkan dengan corralite kecil. Selanjutnya kriteria keempat adalah Goniastrea aspera merupakan karang yang bersimbiosis dengan zooxanthellae dan tidak bersifat fakultatif. Jenis karang yang bersifat fakultatif adalah Astrangia danae dan Madracis Sp (Jasques, 1983), umumnya jenis ini ditemukan di perairan lintang tinggi.
Untuk memperoleh biota uji sesuai dengan kriteria di atas dilakukan transek di berbagai sebaran vertikal di ekosistemnya (mulai dari reef flat sampai dengan tubir). Jenis tersebut umumnya dominan pada reef flat sebagai implementasi jenis karang yang mempunyai ketahanan terhadap fluktuasi lingkungan tinggi dan bersimbiosis dengan zooxanthellae (tidak bersifat fakultatif).
Pengumpulan dan pemeliharaan jumlah specimen karang yang dikoleksi dari Pulau Bokor Jepara kurang lebih jumlah koloni karang sesuai dengan perancangan percobaan yang akan dilakukan. Karang tersebut adalah jenis karang yang nampak sehat dipilih secara acak di lingkungannya pada kedalaman 2-5 meter. Specimen ini kemudian dibawa ke laboratorium dan ditempatkan pada bak sirkulasi dalam kondisi cahaya yang terkendali untuk menghindari meningkatnya temperatur.
Tahapan Penelitian
Untuk mengarahkan kepada tujuan yang hendak dicapai, maka dilakukan beberapa langkah kegiatan yang dirinci sebagaimana diuraikan berikut.
Aklimatisasi
Specimen karang Goneastra aspera yang diambil dari perairan terumbu karang Pulau Bokor Jepara ditandai secara acak dan dimasukkan dalam bak konikel yang pengisian airnya telah difilter dengan ukuran 0,2 m dan air lautnya telah ditreatment dengan sinar ultraviolet untuk mencegah masuknya pengaruh nutriphilik phytoplankton dan bakteri. Selanjutnya karang diaklimatisasi selama lebih kurang 5 hari sebelum eksperimen dilakukan. Penempatan karang pada media terlebih dahulu dipersiapkan penutupan atap bak dengan menggunakan plastik untuk menahan tingkat pencahayaan yang besar. Fluktuasi temperatur di media specimen tersebut dipertahankan dalam kisaran temperatur 20oC hingga 25oC. Goniastrea aspera yang nantinya akan dicobakan adalah jenis karang yang tidak ada perubahan warna, produksi mukus, penjuluran polip atau ciri lain yang menunjukkan adanya tekanan faali pada specimen. Ciri-ciri tersebut dideteksi selama masa aklimatisasi.
Untuk aklimatisasi diperlukan media inkubasi berupa bak konikel. Karang yang dijadikan biota uji adalah Goniastrea aspera yaitu karang masif berukuran diameter sekitar 10–15 cm. Hasil penelitian Fang et al., (1998) yang menerapkan kejut temperatur sebesar 35oC selama masa inkubasi 19 jam menunjukkan karang telah mengalami pemutihan. Penelitian Fang et a.,l (1998) tidak dilengkapi dengan analisis histologis dan uji ketahanan pulih kembali dari obyek penelitiannya. Oleh sebab itu tidak dapat dipakai rujukan secara keseluruhan dalam penelitian ini.
Penerapan Perlakuan
Untuk memperoleh keterangan tentang kondisi karang yang masih bertahan dalam kondisi mengalami pemutihan maka dalam penelitian ini dilakukan percobaan kejutan temperatur sebagai perlakuan tunggal terhadap jenis karang Goniastrea aspera. Temperatur yang diperlakukan adalah sebagai berikut : 1. S-1 menerapkan temperatur 40oC ( 2oC)
2. S-2 menerapkan temperatur 36oC ( 2oC) 3. S-3 menerapkan temperatur 32oC ( 2oC) 4. S-4 menerapkan temperatur 28oC ( 2oC)
Percobaan ini mengacu kepada perancangan acak lengkap yang diaplikasikan di lingkungan laboratorium.
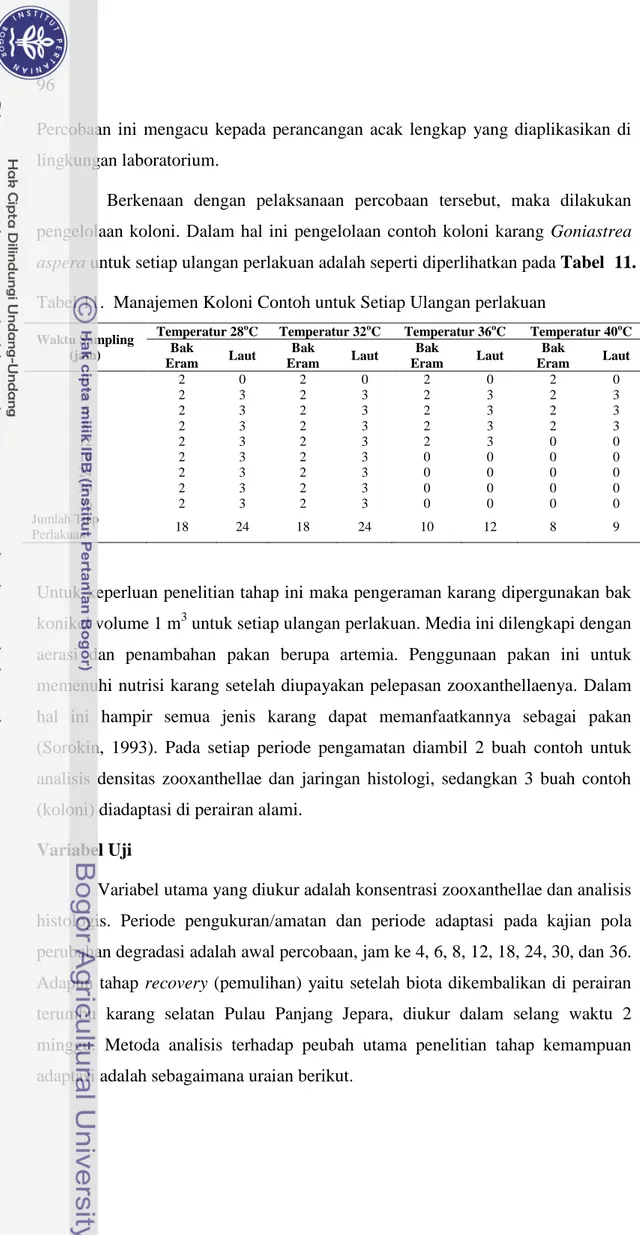
Berkenaan dengan pelaksanaan percobaan tersebut, maka dilakukan pengelolaan koloni. Dalam hal ini pengelolaan contoh koloni karang Goniastrea aspera untuk setiap ulangan perlakuan adalah seperti diperlihatkan pada Tabel 11. Tabel 11. Manajemen Koloni Contoh untuk Setiap Ulangan perlakuan
Waktu Sampling (jam)
Temperatur 28oC Temperatur 32oC Temperatur 36oC Temperatur 40oC Bak Eram Laut Bak Eram Laut Bak Eram Laut Bak Eram Laut 0 2 0 2 0 2 0 2 0 4 2 3 2 3 2 3 2 3 6 2 3 2 3 2 3 2 3 8 2 3 2 3 2 3 2 3 12 2 3 2 3 2 3 0 0 18 2 3 2 3 0 0 0 0 24 2 3 2 3 0 0 0 0 30 2 3 2 3 0 0 0 0 36 2 3 2 3 0 0 0 0 Jumlah Tiap Perlakuan 18 24 18 24 10 12 8 9
Untuk keperluan penelitian tahap ini maka pengeraman karang dipergunakan bak konikel volume 1 m3 untuk setiap ulangan perlakuan. Media ini dilengkapi dengan aerasi dan penambahan pakan berupa artemia. Penggunaan pakan ini untuk memenuhi nutrisi karang setelah diupayakan pelepasan zooxanthellaenya. Dalam hal ini hampir semua jenis karang dapat memanfaatkannya sebagai pakan (Sorokin, 1993). Pada setiap periode pengamatan diambil 2 buah contoh untuk analisis densitas zooxanthellae dan jaringan histologi, sedangkan 3 buah contoh (koloni) diadaptasi di perairan alami.
Variabel Uji
Variabel utama yang diukur adalah konsentrasi zooxanthellae dan analisis histologis. Periode pengukuran/amatan dan periode adaptasi pada kajian pola perubahan degradasi adalah awal percobaan, jam ke 4, 6, 8, 12, 18, 24, 30, dan 36. Adapun tahap recovery (pemulihan) yaitu setelah biota dikembalikan di perairan terumbu karang selatan Pulau Panjang Jepara, diukur dalam selang waktu 2 minggu. Metoda analisis terhadap peubah utama penelitian tahap kemampuan adaptasi adalah sebagaimana uraian berikut.
Konsentrasi Zooxanthellae
Konsentrasi zooxanthellae dalam polip karang dipergunakan sebagai variabel utama kajian ini. Berkenaan dengan pengukuran peubah ini, maka dilakukan urutan pekerjaan sebagai berikut :
Dekalsifikasi, mengambil sebagian specimen karang Goniastrea aspera
(dengan luas 10-15 cm2); kemudian specimen ini didekalsifikasi ke dalam larutan 5% HCl pekat yang dilarutkan ke dalam air laut terfilter selama 48 jam (Nordemar et al., 2003);
Analisis Densitas zooxanthellae. Dari hasil dekalsifikasi, jaringan dibilas dengan menggunakan air yang telah didestilasi; selanjutnya dikeringkan dengan mempergunakan kertas tissue atau mengeringkan dengan penyerapan; selanjutnya dipotong-potong dan dicampur serta dihomogenasi dalam 10 ml air terdestilasi. Homogenasi dengan sentrifugal selama sekitar 10 menit dengan kecepatan 2.500-3.000 rpm, selanjutnya supernatannya dianalisis dengan mempergunakan haemocytometer. Penghitungan dilakukan dengan pembesaran 400 kali dan didasarkan kepada luas area.
Evaluasi Histologis
Di samping kajian terhadap perubahan densitas zooxanthellae juga akan dilakukan pengukuran histologis dari jaringan polip karang. Ini dimaksudkan selain untuk mengevaluasi apakah masih ada zooxanthellae yang tertinggal beserta posisi sebarannya juga untuk melihat seberapa besar pengaruh kejut temperatur terhadap konstruksi seluler polip. Pengukuran histologis melalui tahapan sebagaimana dilakukan oleh Nordemar et al., (2003). Apabila sebagian rangka masih ada maka dilanjutkan dengan mensentrifugasi, sementara polip telah mengagulasi sehingga akan kompak dan struktur sayatan mikro dapat mencerminkan struktur sebenarnya. Polip diambil dari supernatan dan kemudian dilakukan sayatan mikrotom setebal 2 m dan selanjutnya dapat dilihat dari mikroskop. Ini dapat dilakukan dengan atau tanpa pewarnaan. Adapun tahapan untuk mendapatkan sayatan histologis yang siap untuk pemotretan adalah :
a. Pembuatan Contoh
Pengambilan contoh polip karang dilakukan dengan teknik dekalsifikasi dengan mengambil sebagian specimen karang. Dekalsifikasi dilakukan dengan
cara memasukkan sebagian specimen karang ke dalam larutan 5% HCl pekat yang dilarutkan ke dalam air laut terfilter selama 48 jam.
b. Pengawetan (Fiksasi)
Proses pengawetan dilakukan untuk menjaga agar tidak terjadi perubahan post-mortem (pasca mati) pada jaringan. Hal ini dicirikan dengan tetap terpisahnya bagian cair protoplasma, merubah bagian-bagian sel menjadi bahan-bahan yang tidak larut dalam setiap proses berikutnya, melindungi sel dari kerusakan dan pengerutan saat dimasukkan dalam alkohol atau parafin panas, meningkatkan kemampuan dari tiap-tiap bagian jaringan agar dapat diwarnai.
Larutan fiksasi yang baik dapat melakukan penetrasi secara cepat untuk mencegah terjadinya perubahan pasca mati, mengkoagulasikan substansi-substansi sel menjadi substansi-substansi yang tidak larut, melindungi jaringan pada saat pemotongan dan memudahkan pewarnaan bagian-bagian sel atau jaringan. Larutan pengawet yang digunakan adalah larutan Bouin. Organ yang telah difiksasi selama 24 jam dalam larutan Bouin selanjutnya dicuci dalam larutan alkohol 70%. Pencucian ini dilakukan untuk menghilangkan sisa-sisa pengawet yang terdapat di dalam jaringan yang dapat mengganggu proses mikroteknik selanjutnya. Organ yang telah dicuci dapat disimpan dalam alkohol 70% sebelum proses lebih lanjut.
c. Penarikan Air (Dehidrasi)
Proses ini merupakan proses penarikan air dari dalam jaringan yang dilakukan dengan cara merendam jaringan tersebut di dalam alkohol secara bertingkat, mulai dari 80%, 90%, 95% sampai ke alkohol absolut. Penggunaan alkohol bertingkat ditujukan untuk menarik air dan mencegah terjadinya pengerutan.
d. Penjernihan (Clearing) dan Proses Infiltrasi
Tujuan utamanya adalah menghilangkan pengaruh alkohol yang terdapat di dalam jaringan dengan cara merendam dalam xylol. Setelah mengalami proses penjernihan, jaringan menjadi transparan dan berwarna lebih tua. Jaringan yang telah melalui proses penjernihan selanjutnya direndam dalam parafin secara
bertingkat pada temperatur 60oC (parafin keras). Pemanfaatan parafin yang keras adalah agar pemotongan sayatan dapat diperoleh bahan sayatan yang tipis.
e. Penanaman (Embedding)
Sebagai kelanjutan dari proses infiltrasi dilakukan penanaman organ ke dalam parafin. Proses ini harus dilakukan di dekat bunsen dimana seluruh alat-alat yang digunakan harus berada dalam keadaan hangat untuk mencegah agar parafin tidak mengeras sebelum pekerjaan selesai. Jaringan diletakkan di dalam wadah sedemikian rupa sehingga memudahkan pemotongan dan pengenalan kembali jaringan. Wadah yang telah berisi jaringan bercampur parafin didinginkan agar parafin mengeras. Blok yang sudah mengeras diletakkan pada blok kayu, kemudian disimpan dalam kulkas minimal 6 jam sebelum pemotongan.
f. Pemotongan Blok Jaringan
Blok jaringan dapat dipotong dengan menggunakan mikrotom. Ketebalan jaringan yang diamati adalah lebih kurang 2 mikron. Hasil sayatan diapungkan terlebih dahulu pada air hangat (40oC), lalu diletakkan di atas gelas obyek. Selanjutnya gelas obyek ini diletakkan di atas hotplate selama 10-15 menit sampai seluruh air yang berada di antara jaringan dan gelas obyek menguap. Gelas obyek ini disimpan di dalam inkubator (37-40oC) selama satu malam sebelum digunakan pada proses selanjutnya.
g. Proses Pewarnaan
Sebelum dilakukan pewarnaan, permukaan gelas obyek dimana terdapat sayatan jaringan terlebih dahulu diberi tanda. Hal ini dilakukan agar pada saat gelas obyek tersebut dibersihkan dari sisa-sisa larutan, maka bagian yang dibersihkan adalah permukaan yang tidak bertanda. Untuk mendapatkan contoh sayatan histologis maka akan ditempuh dengan menggunakan teknik pewarnaan
hematoxylin-eosin (HE) sebagai berikut :
1. Jaringan dideparafinisasi dengan melakukan perendaman jaringan pada gelas obyek ke dalam larutan xylol III, II dan I; masing-masing selama 3 menit; 2. Rehidrasi dengan memasukkan jaringan ke dalam seri larutan alkohol absolut
III, II dan I; alkohol absolut, 95%, 90%, 80% dan 70% masing-masing selama 3 menit; kemudian direndam dengan air kran selama 30 menit,
4. Jaringan direndam dalam larutan hematoxylin selama 5 menit. Selama perendaman berlangsung jaringan dikontrol di bawah mikroskop untuk melihat intensitas warna yang dihasilkan, dengan mencelupkan terlebih dahulu jaringan tersebut ke air kran.
5. Jika warna yang dihasilkan terlalu keras, maka dilakukan pemucatan warna hematoxylin (diferensiasi) dengan asam alkohol (1% NaCl dalam alkohol 70%) selama beberapa saat dikontrol di bawah mikroskop.
6. Jaringan direndam dalam air kran selama 10 menit (untuk menghilangkan sisa larutan pewarna pada permukaan jaringan dan mematangkan warna hematoxylin) selanjutnya dimasukkan ke dalam air destilasi selama 5 menit (untuk menguatkan pengikatan antara jaringan dan zat pewarna).
7. Jaringan direndam dalam larutan eosin selama kurang lebih 30 menit. 8. Jaringan direndam dalam air destilasi selama kurang lebih 15 menit.
9. Dehidrasi dengan mencelupkan beberapa saat dalam larutan seri alkohol 70%, 80%, 90%, 95% dan absolut. Jika warna masih terlihat keras maka dilakukan perendaman lagi dalam larutan alkohol 95% beberapa saat dan dikontrol kembali di bawah mikroskop.
10.Penjernihan (clearing) dilakukan dengan mencelupkan jaringan ke dalam larutan Xylol I, II dan III selama beberapa saat. Pada larutan xylol III jaringan bisa berada dalam waktu beberapa menit.
11.Mounting dengan menggunakan alat perekat entelan. h. Mounting
Mounting adalah proses penutupan preparat dengan cover glass. Adapun prosedurnya adalah :
1. Preparat yang masih basah oleh xylol ditetesi satu atau dua tetas entelan. 2. Kemudian cover glass diletakkan di atas permukaan jaringan secara perlahan
dan hati-hati serta diusahakan agar tidak terbentuk gelembung udara. i. Mikrofotografi
Pemotretan dilakukan dengan menggunakan fotomikroskop. Adapun prosedur pemotretan sediaan adalah sebagai berikut :
1. Mengatur fokus lensa dengan intensitas cahaya dan lensa diafragma diperkecil, kemudian kondensor diatur sampai didapatkan cahaya yang fokus.
2. Mengatur lensa obyektif yang diinginkan, lampu skala dan kecepatan pembukaan lensa kamera.
3. Mengatur fokus makro sampai sediaan terlihat dengan jelas pada lensa okuler mikroskop.
4. Mengatur fokus mikro agar preparat terlihat lebih jelas dan fokus.
5. Menentukan daerah specimen yang akan difoto serta menekan tombol kamera. Analisis Kualitas Air
Adapun data penunjang adalah beberapa peubah kualitas air. Untuk memberikan deskripsi tentang perubahan kondisi lingkungan maka dilakukan pengukuran secara periodik terhadap beberapa peubah lingkungan. Rincian tentang jenis peubah, metoda pengukuran dan periode pengukuran faktor lingkungan pendukung ini adalah sebagaimana disajiikan pada Tabel 12.
Tabel 12. Peubah yang diukur, metoda dan periode pengukuran
No. Peubah Satuan Metoda Periode Ukur
1 Temperatur oC Thermometer 1 minggu (Maks – Min)
2 Salinitas o/oo Refraktometer 1 minggu
3 Ammonium mg/l Spectrophotometer 1 minggu
4 Nitrit mg/l Spectrophotometer 1 minggu
5 pH - pH meter 1 minggu
6 Oksigen terlarut mg/l Tetrimetrik 1 minggu
Waktu dan Tempat
Percobaan dilaksanakan di Laboratorium Pengembangan Wilayah Pantai (LPWP) FPIK-UNDIP Jepara dan di lingkungan terumbu karang Selatan Pulau Panjang Jepara. Waktu pelaksanaan kajian ini adalah April sampai dengan September 2006.
5. Analisis Data
Penelitian mengacu kepada aplikasi perancangan sederhana yaitu rancangan acak lengkap. Analisis statistik mempergunakan uji regresi linier terhadap perubahan densitas zooxanthellae. Analisis terhadap pola degradasi dan ketahanan karang didekati dengan pendekatan deskripsi melalui pola perubahan struktur jaringan dari profil histologis polip Goniastrea aspera.
Hasil Percobaan
Uji degradasi yang dimaksudkan dalam penelitian ini adalah proses penurunan ketahanan hidup dari jenis karang Goniastrea aspera akibat perlakuan temperatur. Ciri degradasi dapat ditera melalui pemucatan tampilan koloni sebagai akibat luluhnya pigmen dan diikuti lepasnya zooxanthellae dalam jaringan polip. Istilah yang dipergunakan terhadap hal tersebut adalah pemutihan karang (coral bleaching)(Brown, 1997). Menurut Zamani (1995) peluluhan pigmen dan pelepasan zooxanthellae dari polip karang akibat adanya tekanan temperatur tidak hanya terjadi dalam bentuk keluarnya zooxanthellae di dalam sel polip, akan tetapi proses pelepasan tersebut diikuti oleh kerusakan seluler. Berkenaan dengan hal tersebut, maka proses degradasi yang terjadi akibat diberlakukannya kejut
temperatur pada jenis karang Goniastrea aspera ditelusur melalui kajian perilaku perubahan kandungan endosimbiont zooxanthellae dalam jaringan polipnya serta perubahan struktur sel.
1. Zooxanthellae dalam Jaringan Polip Goniastrea aspera pada berbagai Temperatur
Pelepasan zooxanthellae dalam jaringan polip karang merupakan suatu kerugian besar bagi biota tersebut. Hal ini disebabkan karena selain mempengaruhi pasokan reguler hasil fotosintesisnya, dan juga akan berpengaruh terhadap pertumbuhan karang. Sebens (1997) menginformasikan bahwa 90% hasil fotosintesis zooxanthellae dipasok bagi pemenuhan nutrisi karang. Adapun pengaruhnya terhadap pertumbuhan karang karena hasil respirasinya akan mempengaruhi keberadaan karbondioksida bagi penyediaan karbonat yang berikatan dengan kalsium bebas membentuk karbonit kristal sebagai ciri tumbuhnya karang (Chapman, 1974).
Berkenaan dengan telaah kadar zooxanthellae dan profil histologis jaringan polip karang maka diperlukan pengaturan jumlah obyek penelitian (koloni Goniastrea aspera). Untuk keperluan ini maka media inkubasi dieramkan sebanyak 42 koloni tiap ulangan pada media bertemperatur 28oC dan 32oC, 22 koloni tiap ulangan pada media bertemperatur 36oC serta 17 koloni tiap ulangan pada media 40oC. Dari sejumlah koloni tersebut pada tiap tahap analisis selama
masa inkubasi di lingkungan binaan diambil 2 buah koloni untuk analisis dan 3 buah diinkubasikan kembali ke alam.
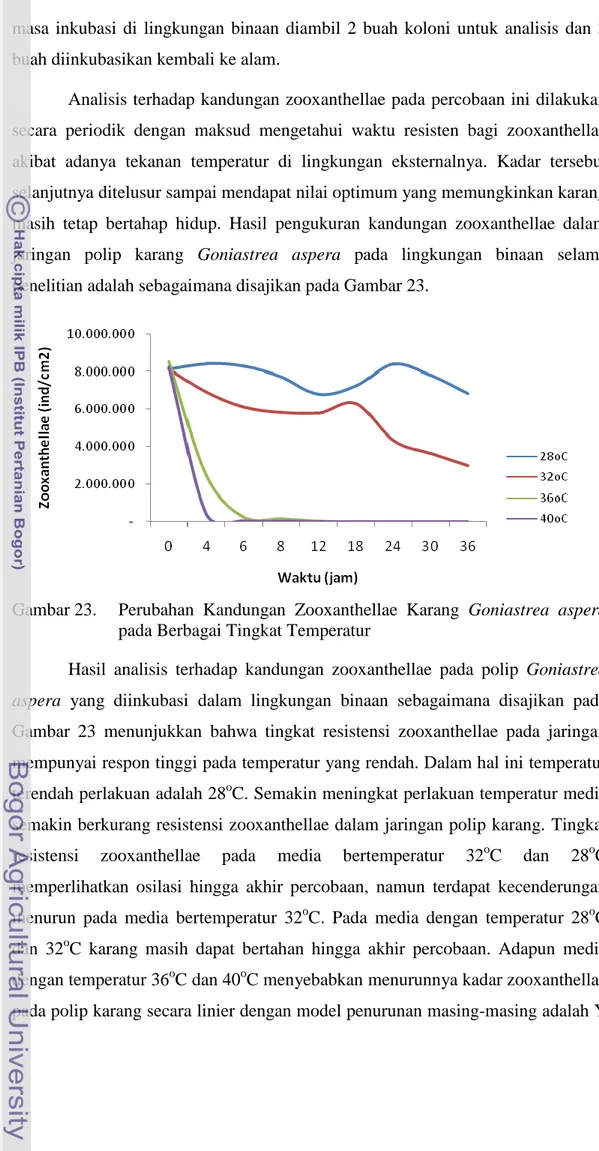
Analisis terhadap kandungan zooxanthellae pada percobaan ini dilakukan secara periodik dengan maksud mengetahui waktu resisten bagi zooxanthellae akibat adanya tekanan temperatur di lingkungan eksternalnya. Kadar tersebut selanjutnya ditelusur sampai mendapat nilai optimum yang memungkinkan karang masih tetap bertahap hidup. Hasil pengukuran kandungan zooxanthellae dalam jaringan polip karang Goniastrea aspera pada lingkungan binaan selama penelitian adalah sebagaimana disajikan pada Gambar 23.
Gambar 23. Perubahan Kandungan Zooxanthellae Karang Goniastrea aspera
padaBerbagai Tingkat Temperatur
Hasil analisis terhadap kandungan zooxanthellae pada polip Goniastrea aspera yang diinkubasi dalam lingkungan binaan sebagaimana disajikan pada Gambar 23 menunjukkan bahwa tingkat resistensi zooxanthellae pada jaringan mempunyai respon tinggi pada temperatur yang rendah. Dalam hal ini temperatur terendah perlakuan adalah 28oC. Semakin meningkat perlakuan temperatur media semakin berkurang resistensi zooxanthellae dalam jaringan polip karang. Tingkat resistensi zooxanthellae pada media bertemperatur 32oC dan 28oC memperlihatkan osilasi hingga akhir percobaan, namun terdapat kecenderungan menurun pada media bertemperatur 32oC. Pada media dengan temperatur 28oC dan 32oC karang masih dapat bertahan hingga akhir percobaan. Adapun media dengan temperatur 36oC dan 40oC menyebabkan menurunnya kadar zooxanthellae pada polip karang secara linier dengan model penurunan masing-masing adalah Y
= 5.879.590,72 – 631.102,28 (R = -0,68) dan Y = 6.467.176,15 – 986.679,73 (R = -0,74)(Lampiran 5). Dengan model tersebut, maka secara teoritis kematian karang pada dua media tersebut akan terjadi pada masing-masing 9 jam dan 6,5 jam.
Secara morfologis adanya perubahan kandungan zooxanthellae dalam jaringan polip karang akibat perbedaan temperatur lingkungannya yang menyebabkan terjadinya perubahan tampilan karang. Pemucatan karang yang lebih menyolok diperlihatkan pada media dengan temperatur tinggi 40oC yang hampir memutih baik secara menyeluruh maupun sebagian kemudian berangsur-angsur tampilan morfologinya menuju normal sejalan dengan menurunnya temperatur media. Perbedaan tersebut diperkirakan berkaitan dengan lepasnya zooxanthellae dari jaringan polip karang.
2. Perubahan Struktur Sel Polip Goniastrea aspera pada berbagai Temperatur
Dilihat dari bentuk morfologi-anatomi hewan karang, terlihat bahwa biota ini mempunyai bentuk seperti tabung dengan mulut di bagian atas yang juga berfungsi sebagai anus. Mulut dikelilingi oleh tentakel, berfungsi menangkap makanan. Selanjutnya terdapat tenggorokan yang pendek sebagai penghubung langsung ke rongga perut. Di dalam rongga perut terdapat semacam usus yang disebut dengan mesenteri filamen, organ ini berfungsi sebagai alat pencerna.
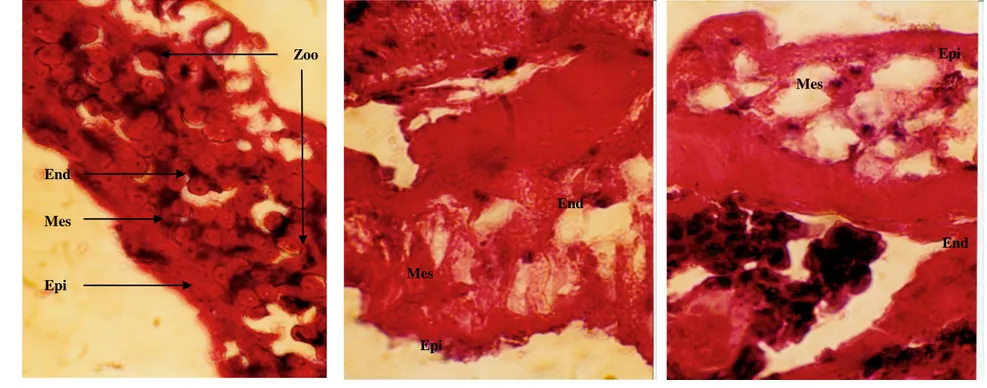
Rangka tersebut mulai dari tentakel hingga pada coeno sarc (tempat pelekatan polip) secara struktural terjadi dari pelapisan jaringan yang sederhana. Sayatan melintangnya memperlihatkan 3 lapisan utama, yaitu ectoderm
merupakan bagian terluar yang dtumbuhi oleh cilia. Di bawah lapisan ini ditemui
mesoglea merupakan lapisan tipis tengah dan terbawah aatau terdalam adalah
endoderm. Pada lapisan ini dalam kondisi normal umum sel-selnya dihuni oleh zooxanthellae. Distribusi zooxanthellae dalam jaringan polip karang tersebut bergantung kepada kondisi eksternalnya. Pada kondisi lingkungan yang sesuai dengan kebutuhan hidup polip karang maka distribusinya akan tertata dengan rapi di dalam jaringan endoderm. Sebaliknya pada kondisi lingkungan tidak stabil distribusinya hampir merata pada semua lapisan jaringan.
Untuk tegaknya seluruh jaringan, polip didukung oleh kerangka kapur sebagai penyangga. Kerangka kapur ini berupa lempengan-lempengan yang tersusun radial dan berdiri tegak pada lempengan dasar. Lempengan yang berdiri disebut dengan septa yang tersusun dari bahan organik dan kapur (CaCO3) sebagai
hasil sekresi dari polip karang. Berkaitan dengan diterapkannya temperatur media yang berbeda, secara nyata telah menunjukkan adanya pengaruh terhadap pelepasan zooxanthellae. Perubahan penampilan jaringan berkaitan dengan pelepasan zooxanthellae mempunyai pola yang beragam khususnya terhadap tipe struktur sel dalam tiap lapisan jaringan polip karang. Adapun dari sisi histologis perubahan pengaruh lingkungan eksternal khususnya temperatur yang diterapkan dalam penelitian ini memperlihatkan beberapa pola perubahan seluler.
Perubahan penampilan jaringan polip karang antara satu kondisi kejutan tinggi (40oC) dengan yang lain (36oC, 32oC dan 28oC) berbeda. Perbedaan tersebut terutama terkait dengan kemampuan adaptasi biota karangnya. Perubahan penampilan jaringan polip karang pada penerapan beberapa tingkat temperatur tersebut adalah sebagaimana diperlihatkan pada Gambar 24.
Gambar 24. Profil Jaringan Polip Karang Selama Proses Penerapan Berbagai Tingkat Temperatur a. Perubahan Seluler Pelepasan Zooxanthellae pada Penerapan Suhu 40oC.
A. Profil jaringan pada awal (jam ke-0) B. Profil jaringan pada jam ke-4 C. Profil jaringan pada jam ke-8 Keterangan : Epi = Epidermis Mes = Mesoglea End = Endodermis Zoo = Zooxanthellae Epi Mes End Epi Mes End End Zoo Epi Mes 10 6
b. Perubahan Seluler Pelepasan Zooxanthellae pada Penerapan Suhu 36oC.
A. Profil jaringan pada awal (jam ke-0) B. Profil jaringan pada jam ke-4 C. Profil jaringan pada jam ke-6 Keterangan : Epi = Epidermis Mes = Mesoglea End = Endodermis Zoo = Zooxanthellae Epi Mes End Epi Mes End End Epi Mes Zoo 1 07
106
Lanjutan Gambar 24.
D. Profil jaringan pada jam ke-8 E. Profil jaringan pada jam ke-12 Keterangan : Epi = Epidermis Mes = Mesoglea End = Endodermis Zoo = Zooxanthellae Zoo Epi Mes Mes 1 0 8
c. Perubahan Seluler Pelepasan Zooxanthellae pada Penerapan Suhu 32oC
A. Profil jaringan pada awal (jam ke-0) B. Profil jaringan pada jam ke-4 C. Profil jaringan pada jam ke-6 Keterangan : Epi = Epidermis Mes = Mesoglea End = Endodermis Zoo = Zooxanthellae Epi Mes Zoo End Mes Epi Epi End End Zoo 107 1 0 9
Lanjutan Gambar 24.
D. Profil jaringan pada jam ke-8 E. Profil jaringan pada jam ke-12 F. Profil jaringan pada jam ke-30 Keterangan : Epi = Epidermis Mes = Mesoglea End = Endodermis Zoo = Zooxanthellae Epi Mes Zoo End Epi End Zoo End 108 1 10
109
d. Perubahan Seluler Pelepasan Zooxanthellae pada Penerapan Suhu 28oC
A. Profil jaringan pada awal (jam ke-0) B. Profil jaringan pada jam ke-4 C. Profil jaringan pada jam ke-6 Keterangan : Epi = Epidermis Mes = Mesoglea End = Endodermis Zoo = Zooxanthellae Zoo Epi Mes End Epi Mes End Epi Mes End Zoo 109 1 11
Lanjutan Gambar 24
A. Profil jaringan pada jam ke-8 B. Profil jaringan pada jam ke-12 C. Profil jaringan pada jam ke-30 Keterangan : Epi = Epidermis Mes = Mesoglea End = Endodermis Zoo = Zooxanthellae Epi Mes End Zoo Epi Mes End Zoo End Zoo Epi Zoo Mes Epi End End End Mes Mes 110 1 1 2
Hasil kajian terhadap perubahan profil sel pada jaringan polip karang yang mendapat tekanan dari perlakuan media eksternalnya dengan berbagai temperatur menunjukkan tipe yang berbeda. Pada perlakuan temperatur tinggi yaitu 36oC dan 40oC memberikan ciri tersebarnya zooxanthellae secara acak dan bergerombol pada jaringan dengan sel yang rusak (Gambar 23a dan 23b). Kejadian ini tidak berlangsung dalam kurun waktu yang lama, yaitu hanya berkisar 4 jam. Selebihnya pada waktu yang relatif pendek yaitu kurang dari 6 jam telah terjadi kerusakan jaringan. Sebaliknya pada media dengan temperatur rendah yaitu 28 oC dan 32oC pelepasan zooxanthellae relatif sangat rendah.
3. Sintasan Goniastrea aspera Pasca Pemutihan pada kondisi Alamiah
Uji sintasan dimaksudkan untuk mengetahui tingkat ketahanan biota uji yaitu Goniastrea aspera setelah dikenakan tekanan temperatur di lingkungan binaan. Uji ini dilakukan dengan cara menginkubasi contoh setelah beberapa waktu dieramkan pada berbagai tingkat temperatur, mulai dari 28–40oC. Contoh yang mampu bertahan hidup diperhitungkan untuk mengetahui kemampuannya terhadap dikenakannya tekanan temperatur.
Uji sintasan terhadap contoh dilakukan dengan cara memindahkan sebagian obyek penelitian dari media inkubasi ke lingkungan alamiah. Pemindahan ke lingkungan alamiah ini disesuaikan dengan waktu kajian selama masa inkubasi di lingkungan binaan, yaitu setiap periode amatan pasca pemutihan karang. Pengaturan koloni obyek penelitian untuk uji ini adalah pemisahan masing-masing 3 contoh koloni Goniastrea aspera untuk tiap pengamatan di media binaan ke lingkungan alami. Pada media dengan terapan temperatur media 28oC dan 32oC dilakukan pada semua tingkat amatan hingga 36 jam dengan periode waktu 4, 6, 12, 18, 24, 30 dan 36 jam. Dengan demikian pada perlakuan tersebut masing-masing terdapat 24 koloni untuk keperluan uji sintasan. Periode pemisahan pasca kejut temperatur 36oC adalah 12 jam dengan periode waktu 4, 6, 8 dan 12 jam, sehingga tersedia stock koloni uji sebanyak 12 contoh. Adapun untuk koloni karang pasca kejut temperatur 40oC adalah 8 jam dengan periode waktu 4, 6 dan 8, sehingga terdapat 9 contoh.
Uji sintasan ini didasarkan kepada jumlah koloni yang mampu bertahan hidup setelah mengalami tekanan kejut temperatur. Analisis terhadap sintasan
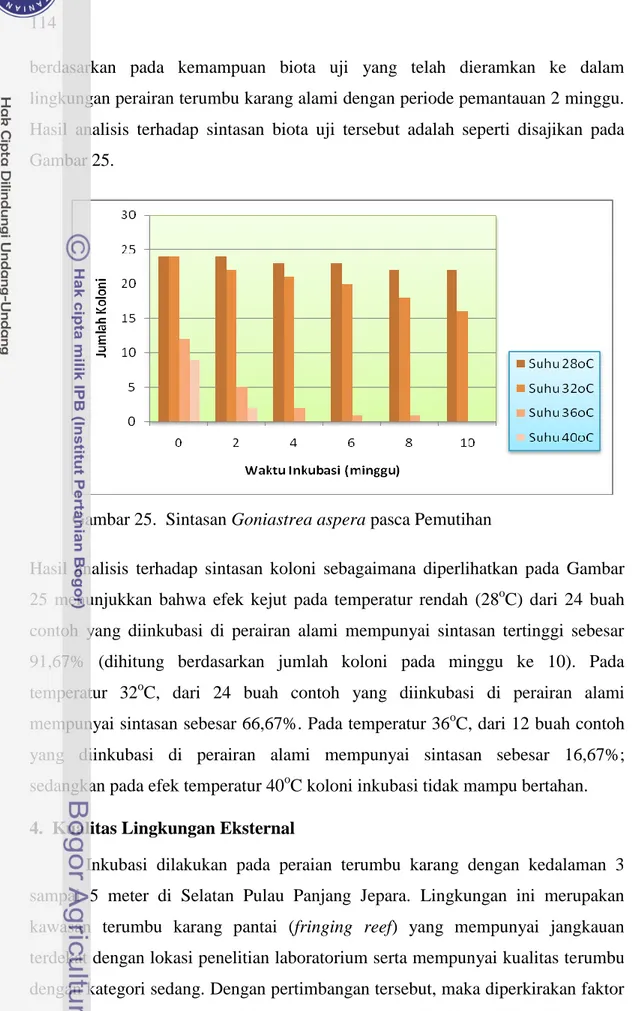
berdasarkan pada kemampuan biota uji yang telah dieramkan ke dalam lingkungan perairan terumbu karang alami dengan periode pemantauan 2 minggu. Hasil analisis terhadap sintasan biota uji tersebut adalah seperti disajikan pada Gambar 25.
Gambar 25. Sintasan Goniastrea aspera pasca Pemutihan
Hasil analisis terhadap sintasan koloni sebagaimana diperlihatkan pada Gambar 25 menunjukkan bahwa efek kejut pada temperatur rendah (28oC) dari 24 buah contoh yang diinkubasi di perairan alami mempunyai sintasan tertinggi sebesar 91,67% (dihitung berdasarkan jumlah koloni pada minggu ke 10). Pada temperatur 32oC, dari 24 buah contoh yang diinkubasi di perairan alami mempunyai sintasan sebesar 66,67%. Pada temperatur 36oC, dari 12 buah contoh yang diinkubasi di perairan alami mempunyai sintasan sebesar 16,67%; sedangkan pada efek temperatur 40oC koloni inkubasi tidak mampu bertahan. 4. Kualitas Lingkungan Eksternal
Inkubasi dilakukan pada peraian terumbu karang dengan kedalaman 3 sampai 5 meter di Selatan Pulau Panjang Jepara. Lingkungan ini merupakan kawasan terumbu karang pantai (fringing reef) yang mempunyai jangkauan terdekat dengan lokasi penelitian laboratorium serta mempunyai kualitas terumbu dengan kategori sedang. Dengan pertimbangan tersebut, maka diperkirakan faktor lingkungannya mampu mendukung sintasan karang. Hasil penelitian Wicaksono (2005) menunjukkan bahwa kualitas air di sekitar Pulau Panjang Jepara
memperlihatkan sebagai lingkungan perairan laut alami dengan kualitas yang mampu mendukung biota air laut termasuk karang.
Pengukuran kualitas air penelitian tahap ini lebih difokuskan pada lingkungan penempatan contoh karang pasca pemutihan di sekitar Pulau Panjang Jepara. Hasilnya adalah seperti disajikan pada Tabel 13 berikut.
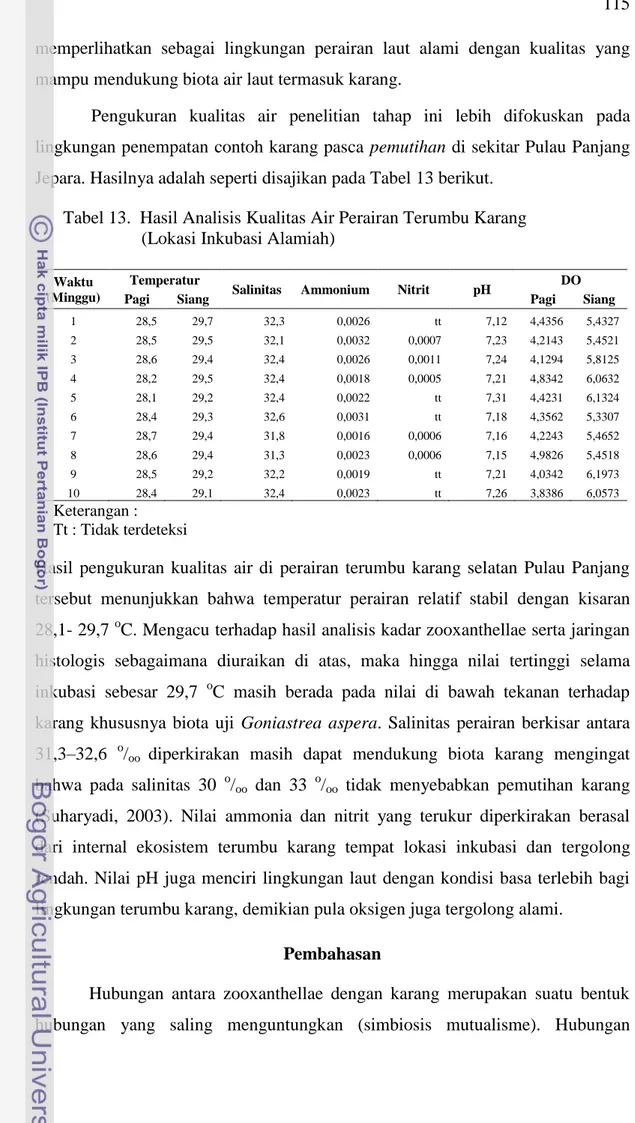
Tabel 13. Hasil Analisis Kualitas Air Perairan Terumbu Karang (Lokasi Inkubasi Alamiah)
Waktu (Minggu)
Temperatur
Salinitas Ammonium Nitrit pH DO
Pagi Siang Pagi Siang
1 28,5 29,7 32,3 0,0026 tt 7,12 4,4356 5,4327 2 28,5 29,5 32,1 0,0032 0,0007 7,23 4,2143 5,4521 3 28,6 29,4 32,4 0,0026 0,0011 7,24 4,1294 5,8125 4 28,2 29,5 32,4 0,0018 0,0005 7,21 4,8342 6,0632 5 28,1 29,2 32,4 0,0022 tt 7,31 4,4231 6,1324 6 28,4 29,3 32,6 0,0031 tt 7,18 4,3562 5,3307 7 28,7 29,4 31,8 0,0016 0,0006 7,16 4,2243 5,4652 8 28,6 29,4 31,3 0,0023 0,0006 7,15 4,9826 5,4518 9 28,5 29,2 32,2 0,0019 tt 7,21 4,0342 6,1973 10 28,4 29,1 32,4 0,0023 tt 7,26 3,8386 6,0573 Keterangan : Tt : Tidak terdeteksi
Hasil pengukuran kualitas air di perairan terumbu karang selatan Pulau Panjang tersebut menunjukkan bahwa temperatur perairan relatif stabil dengan kisaran 28,1- 29,7 oC. Mengacu terhadap hasil analisis kadar zooxanthellae serta jaringan histologis sebagaimana diuraikan di atas, maka hingga nilai tertinggi selama inkubasi sebesar 29,7 oC masih berada pada nilai di bawah tekanan terhadap karang khususnya biota uji Goniastrea aspera. Salinitas perairan berkisar antara 31,3–32,6 o/oo diperkirakan masih dapat mendukung biota karang mengingat
bahwa pada salinitas 30 o/oo dan 33 o/oo tidak menyebabkan pemutihan karang
(Suharyadi, 2003). Nilai ammonia dan nitrit yang terukur diperkirakan berasal dari internal ekosistem terumbu karang tempat lokasi inkubasi dan tergolong rendah. Nilai pH juga menciri lingkungan laut dengan kondisi basa terlebih bagi lingkungan terumbu karang, demikian pula oksigen juga tergolong alami.
Pembahasan
Hubungan antara zooxanthellae dengan karang merupakan suatu bentuk hubungan yang saling menguntungkan (simbiosis mutualisme). Hubungan
keduanya tidak saja berada pada tingkat ketergantungan fisik semata akan tetapi sampai ke tahap fisiologis. Pada umumnya zooxanthellae ditemukan dalam jumlah yang besar dalam setiap polip dengan hidup secara bersimbiosis serta saling melakukan transfer energi. Konstribusi zooxanthellae melalui fotosintesis adalah 90% dari kebutuhan karbon polip (Sebens, 1997), sementara kebutuhan zooxanthellae dipasok hampir 100% dari polip (Muscatine, 1990). Oleh karena itu polip karang tidak dapat hidup tanpa zooxanthellae, kecuali Astrangia danae
(Jasques, 1983) dan mungkin Madracis Sp yang dapat hidup secara fakultatif. Gleason (1993) mengemukakan bahwa karang dalam kondisi pemutihan total dapat mengalami kematian, sementara pemutihan parsial masih mempunyai potensi hidup sebagaimana diperlihatkan pada penelitian ini. Assosasi yang erat ini sangat efisien, sehingga karang dapat bertahan hidup bahkan di perairan yang sangat miskin hara. Keberhasilan hubungan ini dapat dilihat dari besarnya keragaman dan usia karang yang sangat tua, berevolusi pertama kali lebih dari 200 juta tahun yang lalu (Burke et al., 2002).
Studi yang ditunjukkan oleh Fitt et al., (1993) memperlihatkan bahwa biomassa jaringan dari karang Montastrea anularis pulih kembali dengan laju yang lebih lambat dibandingkan dengan perkembangan algae simbion zooxanthellae setelah kejadian pemutihan di Karibia pada 1987. Sebagian besar karang di Carysfort Reef mengandung kadar normal densitas zooxanthellae sebesar 1-3x1010 individu/cm2 dalam kurun waktu 10 bulan pasca pemutihan (Szmant dan Gassman, 1990; Gleason ,1993). Hasil kajian kadar zooxanthellae dalam inang pada kondisi lingkungan normal telah dirangkum Sorokin (1993) yaitu Stylophora pistillata sebesar 0,97x108–2,3x108 individu/cm2; Pocillopora damicornis adalah 0,9 x108–1,1x108 individu/cm2; P. Eydoxy sebesar 6,1x107 individu/cm2; Porites porites sebesar 3,13x108 individu/cm2; Seriatopora hystrix
sebesar 4,8x108–7,8x108 individu/cm2; Acropora diversa sebesar 0,6x108–0,7x 108 individu/cm2; serta 10 famili karang lainnya yang dikoleksi pada kedalaman 0–42 m mempunyai asuhan zooxanthellae sebesar 0,9x108–2,3x108 individu/cm2.
Percobaan yang dilakukan ini menelaah proses pemutihan karang
Goniastrea aspera dan pemulihannya dengan memperlakukan terapan tekanan temperatur dari 28oC hingga 40oC. Percobaan dilakukan secara parsial antar
temperatur maupun percobaan lintas temperatur. Hasil percobaan memperlihatkan bahwa penerapan temperatur secara parsial dicirikan oleh penurunan perkembangan zooxanthellae pada percobaan dengan media bertemperatur 36oC dan 40oC. Pada penerapan kejutan temperatur keduanya ditemukan karang
Goniastrea aspera mengalami pemutihan total pada pengeraman selama 12 jam pada media bertemperatur 36oC dan 8 jam pada media bertemperatur 40oC. Penerapan media bertemperatur 28oC memperlihatkan perkembangan zooxanthellae berfluktuatif, sedangkan pada media bertemperatur 32oC perkembangannya cenderung lambat dan relatif mengalami penurunan. Berkaitan dengan hal tersebut, maka Fitt et al., (2000) menginformasikan bahwa pada media bertemperatur 26oC, zooxanthellae akan tumbuh cepat. Pada temperatur 30oC pertumbuhan zooxanthellae akan lambat dan pada temperatur 32oC zooxanthellae tidak dapat tumbuh.
Sementara itu hasil percobaan lintas temperatur yaitu dengan memindahkan karang Goniastrea aspera dari kejutan temperatur tinggi namun masih mampu bertahan yaitu pada temperatur 36oC selama 6 jam kemudian obyek penelitian yang sama dipindahkan ke dalam media bertemperatur 32oC selama 20 jam. Dari media terakhir kemudian dipindahkan lagi ke media bertemperatur 28oC hingga akhir percobaan. Perubahan kadar zooxanthellae pada media lintas temperatur adalah sebagaimana disajikan pada Gambar 26.
Gambar 26. Perkembangan Zooxanthellae dari Adaptasi Karang Goniastrea aspera pada Berbagai Tingkat Media Temperatur
Hasil pengukuran zooxanthellae sebagaimana Gambar 26 adalah bahwa peletakan karang Goniastrea aspera pada media temperatur 36oC dalam kurun waktu 6 jam mengalami penurunan secara eksponensial. Selama masa adaptasi 6 jam zooxanthellae telah memperlihatkan adaptasi dilanjutkan dengan pertumbuhannya di jaringan selular polip karang Goniastrea aspera. Kadar terukur ini selanjutnya akan meningkat hingga mencapai 2,1x106 individu/cm2 dari hasil adaptasinya selama masa pengeramannya di media binaan.
Fenomena tersebut mempunyai bentuk yang sama dalam studi pemulihan dalam skala luas sebagaimana diamati oleh Gleason (1993). Dalam hal ini dikemukakan bahwa pemutihan karang yang terjadi secara bergantian dalam kurun waktu satu tahun menyebabkan berfluktuasinyanya pula hidup karang. Kejadian dimana karang-karang yang demikian dapat bertahan hidup meskipun temperatur lingkungan luarnya masih cukup tinggi dicirikan oleh : (a) pemutihan yang tidak komplit (pemutihan parsial), dimana zooxanthellae masih normal dalam jaringan polip hidup baik dalam posisi maupun jumlahnya (Hoegh-Guldberg dan Smith, 1989; Porter et al., 1989); (b) repopulasi zooxanthellae terjadi secara cepat (Hoegh-Guldberg dan Smith, 1989; Jaap, 1985; Szmant dan Gassmann, 1990). Sebaliknya pemutihan yang terjadi secara total secara signifikan menyebabkan kematian karang.
Pemutihan yang tidak komplit telah diperlihatkan berdasarkan kajian histologis. Dalam hal ini karang Goniastrea aspera sebagai hewan uji dieramkan pada media dengan berbagai tekanan temperatur. Temperatur optimum hingga biota ini masih bertahan adalah 36oC yang dieramkan selama 6 jam. Pada kondisi ini masih ditemukan sebagian sel polip masih utuh dan ditempati oleh zooxanthellae, yang selanjutnya diadaptasikan pada lingkungan perairan alami. Hasil analisis terhadap sintasannya mencapai 85% dari total karang yang diadaptasikan. Selanjutnya baik secara laboratoris maupun secara alamiah terjadi repopulasi zooxanthellae secara cepat.
Dengan segera setelah pemutihan karang dan penempatan simbion secara normal dalam jaringan polipnya maka segera melakukan kegiatan fotosintesis dan aktivitas nutrisional (Cole dan Jokiel, 1978; Glynn et al., 1985; Hoegh-Guldberg dan Smith, 1989; Porter et al., 1989). Sebaliknya, pertumbuhan akan berhenti
apabila pemutihan karang atau faktor yang mempengaruhinya terus berlangsung (Jokiel dan Coles, 1990; Goreau dan Macfarlane, 1990). Dengan keterangan lain dapat dinyatakan bahwa kejadian pemutihan karang dapat menyebabkan mortalitas selektif dan tekanan terhadap species yang terkena pengaruh. Gleason (1993) melaporkan hasil penelitiannya bahwa koloni-koloni karang yang mengalami pemutihan komplit pada bulan April 1991 di Pulau Moorea tidak mengalami perkembangan dan mati semua hingga Agustus 1991. Koloni-koloni yang hanya mengalami pemutihan parsial mempunyai kemampuan pulih secara komplit.
Jika kejadian pemutihan karang terjadi secara hebat dengan frekuensi tinggi, maka faktor ini akan dengan kuat menentukan komposisi species dan merupakan sumber bagi penyediaan ruang untuk recruitment baru. Hal ini akan menyebabkan terjadinya pengisian ruang baru dengan sifat persaingan yang rendah antar species, khususnya species yang tahan terhadap pemutihan Gleason (1993). Dalam tingkat yang lebih spesifik, ketika tingkat pemutihan bervariasi sangat besar diantara sesama species yang berdekatan, ada peluang besar mempengaruhi variasi genotip atau variasi kerentanan (Fisk dan Done, 1985; Harriot, 1985; Lang et al., 1988). Pemutihan juga dapat mempengaruhi struktur komunitas karang yang dikenainya jika pengaruh sekunder terjadi seperti meningkatnya kelimpahan algae dan sea urchin, sehingga menghasilkan pemulihan karang yang lemah (Glynn, 1990). Hoegh-Guldberg and Smith (1989) menemukan bahwa recovery pasca pemutihan pada karang setelah terkena pengaruh temperatur 32oC selama 7 jam adalah 23 hari.
Pengaruh pemutihan terhadap perubahan struktur komunitas karang dapat berlangsung cepat maupun lambat. Keadaan ini bergantung kepada skala gangguan dan variasinya yang terjadi dan mengenai kawasan terumbu karang (Glynn, 1993). Tidak semua jenis karang yang ada sebelumnya dapat tumbuh kembali, tetapi sebaliknya jenis karang sebelumnya dapat tumbuh kembali tanpa merubah keragamannya. Fisk dan Done (1985) dalam kajiannya terhadap fenomena pemulihan di Great Barrier Reef melaporkan bahwa setelah gangguan hebat temperatur mengakibatkan kerusakan yang besar. Dalam kurun waktu 2 tahun baru ditemukan gejala peningkatan cepat khususnya dari kelompok
Acroporid dan Pocilloporid. Hal ini merupakan gejala pemulihan yang dapat mengubah struktur komunitas setempat. Kejadian ini memungkinkan terbukanya kawasan baru yang merangsang terjadinya recruitmen, sebagaimana ditemukan oleh Dunstan dan Johnson (1998) dan Fitzhardinge (1989). Akibat fenomena ini dimungkinkan terjadi perubahan struktur komunitas.
Di laut Jawa, Brown dan Suharsono (1990) melaporkan bahwa lambatnya pemulihan terumbu karang akibat kematian besar-besaran hampir 90% selama 1982 – 1983. Lima tahun kemudian terjadi perubahan penutupan karang dengan kecenderungan meningkat. Peningkatan penutupan karang hidup mencapai 50% dengan dua gejala yaitu terjadi peningkatan pemulihan yang cepat disertai keragamannya pada suatu kawasan dan pada kawasan lain dengan pemulihan yang agak lambat dan tidak terjadi perubahan struktur keragamannya. Selanjutnya dikemukakan bahwa stabilitas pada kawasan dengan gejala pertama relatif rendah. Perubahan struktur komunitas pasca pemutihan yang kecil juga ditemukan oleh Glynn (1990) di kawasan Kosta Rica.
Gleason (1993) mengemukakan bahwa zooxanthellae yang tersisa setelah kejadian pemutihan dalam habitat intraselluler yang masih kaya akan nutrien akan relatif tumbuh secara cepat dibandingkan dengan karang dengan densitas yang besar. Namun demikian, hal ini masih bergantung kepada status kondisional dari zooxanthellae itu sendiri. Hal ini sebagaimana dinyatakan oleh Glynn (1984) bahwa kematian karang yang mengalami pemutihan parsial mungkin masih akan dapat bertahan dengan asumsi bahwa kondisi zooxanthellae tidak terpengaruh secara esktrim oleh pengaruh temperatur serta kondisi seluler dari polip. Namun sebaliknya apabila pengaruh temperatur atau faktor eksternal lain secara kuat terus-menerus yang mengakibatkan tidak terkontrolnya kondisi lingkungan oleh polip karang, meskipun secara fisiologis zooxanthellae masih toleran maka hal ini akan menyebabkan lepasnya zooxanthellae dari polip dan karang akan mati (Savina, 1991; Porter dan Meier, 1992).
Sebaliknya pada kondisi normal, maka faktor pertama dari proses pemulihan karang yang ditandai dengan perkembangan zooxanthellae di dalam jaringan polip akan dapat berlangsung secara normal. Mempertimbangan kebutuhan fungsional fitobiotik yaitu temperatur, cahaya dan nutrien sebagaimana
dikemukakan oleh Harris (1976), maka faktor ketersediaan nutrien yang akan menjadi pembatasnya. Namun demikian, bagi zooxanthellae hal ini bukan merupakan pembatas yang berarti. Dalam hal ini ketersediaan nutrien internal lebih dominan dalam menentukan baik perangsangan relokasi maupun keperluan fungsional faalinya. Sebagai dukungan terhadap hal ini adalah bahwa rangka karang yang menyangga tubuh polip dengan tingkat porositasnya yang tinggi ternyata merupakan gudang nutrien internal dari karang. Alasan dari hal ini didukung oleh model struktur kristalin dari rangka karang yang longgar memungkinkan ruang ini menjadi jebakan nutrien hasil metabolit polip maupun dari lingkungan eksternalnya. Hasil temuan Ferrer dan Szmant (1988) juga menguatkan fenomena tersebut. Dalam hal ini dikemukakan bahwa kadar ammonium dapat ditemukan dalam kadar 0,0412 mg/l di rangka. Nilai ini mempunyai kesetaraan dengan status lingkungan perairan subur (eutropik). Menurut Parson et al., (1984) bahwa kadar NH4-N di atas 0,03 mg/l dikategorikan
sebagai lingkungan perairan yang subur, yaitu lingkungan yang memungkinkan biota fitoplankton (termasuk dalam hal ini adalah zooxanthellae) berkembang dengan sangat baik. Nilai ini melebihi kadar status perairan terumbu karang di beberapa lokasi sebagaimana disitir oleh D’elia dan Wiebe (1990).
Berdasarkan kinetika siklus sel, Haynes et al., (1967) mengemukakan bahwa sel-sel pada jaringan ectoderm dan endoderm yang terpisah dapat menyusun kembali seluruh ikatan sel dalam polip. Hal ini didasarkan temuan Burnett (1961) bahwa jaringan maupun sel-sel setelah mengalami deferensiasi selalu mengalami perubahan posisi secara terus menerus. Hal serupa juga dinyatakan oleh David (1973), bahwa dalam hal ini terpisahnya beberapa sel
Hydra attenuata akibat tekanan lingkungan dapat terjadi (menjalin) kembali membentuk suatu jaringan yang sempurna. Pada polip karang (David, 1973) dikemukakan bahwa selama proses nutrisional sel masih dapat berlangsung dan sistem jaringan syaraf masih mempunyai ketersinambungan dalam lapisan jaringannya maka terseraknya sel akan dapat mengalami pemulihan melalui jalur sebagaimana pada Hydraattenuata.
Hal ini searah dengan pernyataan Hoegh-Guldberg and Smith, 1989; Porter et al., 1989, Fitt et al., (1993) dan Gleason (1993) bahwa pemutihan secara
parsial masih memungkinkan polip untuk pulih kembali. Dalam hal ini masih terdapat sel-sel bebas dengan kandungan zooxanthellae yang sempurna. Hasil penelitian ini juga memperlihatkan bahwa meskipun Goniastrea aspera mendapat tekanan temperatur 36oC masih dapat pulih setelah kurun waktu 6 jam setelah dikembalikan pada perairan alaminya meskipun mempunyai peluang lebih kecil dibandingkan dengan tekanan media dengan temperatur di bawahnya.
Pembentukan struktur jaringan sel pada tahap awal akan berlangsung dalam kolom strata yang sama, yaitu baik di bagian ectodermis, mesoglea maupun endodermis. Dalam kondisi perkembangan tiga strata polip telah berlangsung secara sempurna maka dimungkinkan terjadi transfer antar strata yaitu pemindahan sel dari ectoderm ke mesoglea dan selanjutnya ke jaringan endoderm dan sebaliknya. Model pemindahan ini dimungkinkan oleh sebab kesamaan struktur sel yang membangun seluruh jaringan polip. Dalam hal ini Campbell (1968) menerangkan adanya 4 mekanisme organisasi sel pada cniraria, yaitu : (a) Adisi sel-sel, dalam hal ini sejumlah sel melakukan kontak karena adanya aktivitas gastro cavity akibat tekanan hidrostatik pada suatu polip, sehingga membentuk organisasi secara longitudinal pada dasar suatu strata jaringan atau yang disebut teaniolae. (b) Adisi sel mesoglea, yaitu suatu proses pemampatan sel pada teaniolae sehingga akan mempererat sistem pada dasar tiap jaringan, yaitu baik di ektoderm, mesoglea dan endoderm. (c) Pengaturan sel antar tempat strata dalam jaringan polip, yaitu suatu proses pengaturan sel dimana pada kondisi ini akan terjadi pola serupa antar jaringan. Pada ketiga proses ini akan sinergis dengan proses penempatan zooxanthellae serta proses pertumbuhan zooxanthellae. (d) Proses digestif sel, yaitu suatu kondisi kenormalan pembentukan proses kematangan polip untuk pulih kembali yang diikuti oleh mekanisme hubungan timbal balik antara inang dan simbionnya.
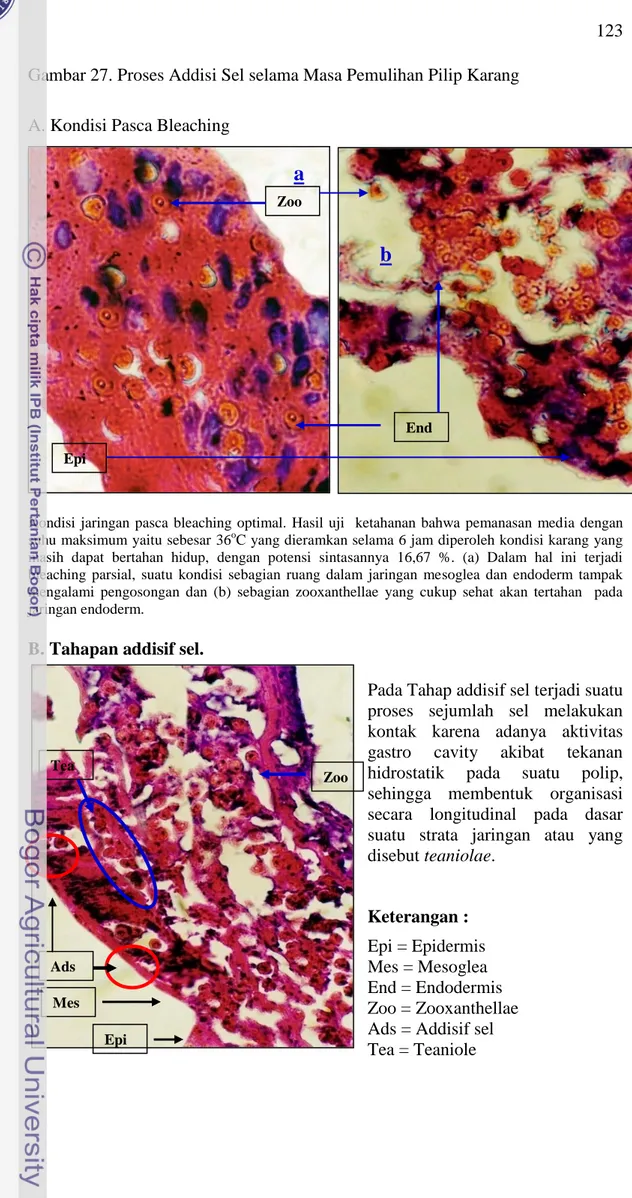
Proses adisi sel pada penelitian ini terlihat dengan cukup baik khususnya pada saat terjadi proses pemulihan akibat tekanan temperatur 36oC dan 32oC. Hal yang sama juga terlihat pada proses pemulihan baik pada media alami maupun media buatan pada temperatur media 28oC. Proses pemulihan pada temperatur 28oC menyerupai mekanisme proses alamiah sebagaimana diperlihatkan pada Gambar 27.
Gambar 27. Proses Addisi Sel selama Masa Pemulihan Pilip Karang
A. Kondisi Pasca Bleaching
Kondisi jaringan pasca bleaching optimal. Hasil uji ketahanan bahwa pemanasan media dengan suhu maksimum yaitu sebesar 36oC yang dieramkan selama 6 jam diperoleh kondisi karang yang masih dapat bertahan hidup, dengan potensi sintasannya 16,67 %. (a) Dalam hal ini terjadi bleaching parsial, suatu kondisi sebagian ruang dalam jaringan mesoglea dan endoderm tampak mengalami pengosongan dan (b) sebagian zooxanthellae yang cukup sehat akan tertahan pada jaringan endoderm.
B. Tahapan addisif sel.
Pada Tahap addisif sel terjadi suatu proses sejumlah sel melakukan kontak karena adanya aktivitas gastro cavity akibat tekanan hidrostatik pada suatu polip, sehingga membentuk organisasi secara longitudinal pada dasar suatu strata jaringan atau yang disebut teaniolae. Keterangan : Epi = Epidermis Mes = Mesoglea End = Endodermis Zoo = Zooxanthellae Ads = Addisif sel Tea = Teaniole Epi Zoo End
a
b
Tea Ads Epi Mes ZooC. Addisif sel mesoglea,
Addisif sel pada jaringan mesoglea yaitu suatu proses pemampatan sel pada teaniolae sehingga akan mempererat sistem pada dasar tiap jaringan, yaitu baik di ektoderm, mesoglea dan endoderm.
Regulasi sel antar region strata dalam jaringan polip. Yaitu suatu proses pengaturan sel dimana pada kondisi ini akan terjadi pola serupa antar jaringan. Pada ketiga proses ini akan sinergis dengan proses resttlement zooxanthellae serta proses pertumbuhan zooxanthellae
D. Proses Digestif Sel,
Proses digestif sel yaitu suatu kondisi kenormalan pembentukan proses kematangan polip untuk pulih kembali yang diikuti oleh mekanisme hubungan timbal balik antara inang dan simbionnya Keterangan : Epi = Epidermis Mes = Mesoglea End = Endodermis Zoo = Zooxanthellae Ads = Addisif sel Mes End Tea Epi Mes End Zoo
Mekanisme pemulihan sebagaimana diperlihatkan pada gambar di atas tidak saja merupakan ekspresi adesif kimiawi dari sel akan tetapi melibatkan mekanisme syaraf pada kelompok cnidaria. Asosiasi antara protein dengan jaringan yang terkoneksi dengan karbohidrat pada proses adesif sel secara umum berlangsung secara kompleks. Hal ini tidak saja berupa hubungan adesif semata, akan tetapi diikuti dengan terbentuknya ikatan muscular syaraf atau yang disebut sebagai organisasi syaraf ephitelium sel cnidaria (Stokes, 1972). Dalam proses pemampatan sel untuk membentuk teaniolae maka jaringan syaraf juga akan mengalami perkembangan sesuai dengan proses pembentukan teaniolae tersebut. Oleh sebab itu, maka jaringan syaraf tidak saja hanya berasosiasi dalam satu strata melainkan antar strata jaringan polip yaitu melintang mulai dari ectoderm hingga endoderm. Passano dan Passano et al., (1971) mengemukakan bahwa lintas pergerakan sel antar strata juga dimungkinkan terjadi melalui efektivitas organisasi syaraf ephitel sel cnidaria.
Ikatan sel dan jaringan syaraf pada kelompok cnidaria merupakan suatu hubungan fungsional yang terjadi secara spontan. Oleh Lenhoff (1974) sistem ini dinamakan sistem syaraf terpusat. Secara fungsional, sistem ini diterjemahkan dalam proses spontan baik yang terjadi pada pergerakan fisik tentakel atau (distal tentacle opener) sampai dengan sistem proksimalnya. Proses gerak serentak atau spontan dari mekanisme tersebut terjadi akibat adanya organisasi syaraf sel ephitel baik yang terdapat pada strata jaringan ectodermal, mesoglea maupun di jaringan endodermal. Mekanismenya oleh Josephson dan Uhrich (1969) disebut sebagai
conducting system.
Peranan zooxanthellae dalam proses pemulihan kembali jaringan polip karang yang telah mengalami pemutihan marupakan hal yang esensial. Statement dari Glasson (1993) yang mengemukakan bahwa perkembangan cepat zooxanthellae pasca pemutihan parsial diperkirakan merupakan serangkaian bagian yang memegang peranan penting bagi pemulihan karang, sebagaimana teori pemulihan sel yang dinyatakan oleh Campbell (1968). Dua fenomena uji ketahanan baik di lingkungan binaan maupun di lingkungan alami memperlihatkan pola yang demikian.
Dalam hal ini selama karang mengalami pemutihan parsial yaitu suatu kondisi dimana terjadi proses pemisahan sel-sel yang didalamnya masih terdapat zooxanthellae dan masa perubahan media eksternal mengalami pemulihan maka tingkat ketahanan karang masih terpelihara. Terdapat beberapa alasan terhadap fenomena ini, yaitu : (1) Adanya perlindungan dari radiasi sinar ultraviolet (UV). Karang mengandung materi penyerap ultra violet atau gelombang cahaya pendek suatu famili dari mycospore yang berikatan dengan asam amino (MAAs) yang mempunyai kemampuan untuk melindunginya dari pengaruh radiasi UV (Shick et al., 2002). (2) Perlindungan dari intensitas cahaya. Beberapa zooxanthellae mampu dan dapat memproduksi xanthophyll untuk melindungi mereka dari intensitas cahaya tinggi. Tidak semua mampu memproduksi, dan ada jalan alternatif perlindungan seperti pelimpahan atau penghilangan panas non radiasi pada saat absorbsi energi cahaya setelah reaksi photosistem II (Riddle, 2004). (3) Komposisi membran thylakoid. Riset yang dilakukan pada periode akhir-akhir in sering menemukan strategi untuk bertahan terhadap pemutihan. Tchernov (2004) mengemukakan bahwa lipid jenuh dari membran thylakoid hydrophilic dalam chloroplast berperan dalam menentukan resistensi terhadap pemutihan. Komponen tersebut akan melindungi zooxanthellae dari fotodestruksi dan pemutihan. Dengan alasan dan fenomena di atas dapat dinyatakan bahwa kemampuan pulih karang bergantung kepada kemampuan dapat dipertahankannya keberadaan zooxanthellae dalam jaringan polip.
Simpulan
Hasil percobaan tentang uji degradasi jaringan polip Goniastrea aspera
pada terapan berbagai taraf temperatur dan ketahanannya pasca pemutihan sebagaimana diuraikan di atas adalah :
1. Temperatur optimum bagi zooxanthellae yang masih dapat bertahan pada jaringan polip karang Goniastrea aspera adalah 36oC selama 6 jam.
2. Di atas temperatur optimum terjadi proses degradasi jaringan polip serta pelepasan zooxanthellae;
3. Pemulihan biota uji hanya dapat terjadi pada kondisi pemutihan parsial. 4. Pemulihan karang ditandai dengan terjadinya proses regulasi zooxanthellae di
dalam jaringan polip karang dan mencapai penataan sempurna setelah minggu ke 12.