POTENSI PENGGUNAAN SENYAWA ANASTETIKUM
XILAZIN SEBAGAI ALTERNATIF ANASTESI PADA
TRANSPORTASI IKAN PATIN
(Pangasisus pangasius)
KURNIA SUANDA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2010
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan Potensi Penggunaan Senyawa Anastetikum Xilazin sebagai Alternatif Anastesi pada Transportasi Ikan Patin (Pangasius pangasius) adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, 30 Agustus 2010
Kurnia Suanda
ABSTRACT
KURNIA SUANDA. The Potency of Xylzine Utilization as an Alternative Anaesthesia in Transportation of Catfish. Supervised by WASMEN MANALU and ANDRIYANTO.
This research was conducted to determine xylazine potency as an alternative anaesthesia in transportation of catfish. This research used xylazine as anaestethicum in catfish by dipping method. The research used 650 catfish with body weight about 6 grams and body length about 5 cm. This research used six treatments and five replications. The catfish were divided into 6 dosage groups of xylazine i.e., 0 (as a control), 10, 20, 30, 40, and 50 ppm. The anaesthesia effects were observed as imbalance and less muscle tone, lost of some reflex functions, and also reduced in pain perseption. Dipping with 40 ppm dosage had the onset of 96,2 minutes, the duration of 229,2 minutes, and 0% mortality. Onset and duration of anaesthesia could reflect the effectiveness of xylazine utilization as an alternative anaesthesia in transportation of catfish. The result showed that 40 ppm xylazine was the effective dosage for anaesthesia in transportation of catfish. Keywords: xylazine, onset, anaesthesia, duration, catfish.
©Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB
POTENSI PENGGUNAAN SENYAWA ANASTETIKUM
XILAZIN SEBAGAI ALTERNATIF ANASTESI PADA
TRANSPORTASI IKAN PATIN
(Pangasisus pangasius)
KURNIA SUANDA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan
Institut Pertanian Bogor
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2010
Judul penelitian : Potensi Penggunaan Senyawa Xilazin sebagai Alternatif Anastesi pada Transportasi Ikan Patin (Pangasius
pangasius)
Nama : Kurnia Suanda
NIM : B04061325
Disetujui
Prof. Dr. Ir. Wasmen Manalu Drh. Andriyanto, M.Si Pembimbing 1 Pembimbing 2
Diketahui
Dr. Dra. Nastiti Kusumorini Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT, karena dengan segala kehendak dan kekuatan dari-Nya penulis dapat menyelesaikan penelitian dan skripsi yang berjudul “ Potensi Penggunaan Senyawa Anastetikum Xilazin sebagai Alternatif Anastesi pada Transportasi Ikan Patin (Pangasius pangasius). “ Shalawat serta salam semoga selalu tercurah kepada Rasulullah Nabi Muhammad SAW yang membawa umat manusia dari zaman kebodohan menuju zaman yang penuh dengan ilmu. Oleh karena itu, dengan segala tuntunan dan tauladan dari Beliau menjadikan pedoman bagi penulis dalam menyelesaikan penelitian dan skripsi ini.
Melalui skripsi ini penulis ingin mengucapkan terima kasih kepada : 1. Prof. Dr. Ir. Wasmen Manalu sebagai Dosen Pembimbing 1 yang telah
memberikan bimbingan, pengarahan, dan banyak pengetahuan kepada penulis dengan penuh kesabaran selama melaksanakan penyusunan skripsi ini.
2. Drh. Andriyanto sebagai Dosen Pembimbing II yang telah memberikan bimbingan, saran, dan berbagai pengetahuan dengan penuh kesabaran kepada penulis dalam menyelesaikan penelitian dan skripsi ini.
3. Bapak dan Ibu yang selalu memberikan dukungan, semangat dan doa sepanjang perjalanan penulis dalam menuntut ilmu dan menggapai cita-cita sampai terselesaikannya penelitian dan skripsi ini.
4. Teteh Yani, Ade Baba, Zean, dan Mamah Dea sekeluarga yang selalu memberikan dukungan, semangat, dan doa kepada penulis.
5. Teman-teman satu penelitian (Laras, Rizki, Sisca, dan Mba Rina) yang telah membantu penulis dalam menyelesaikan penelitian dan penyusunan skripsi ini. Serta, Pak’de Sri dan Mas Paimin yang selalu siap membantu selama penelitian berlangsung.
6. Teman-teman Pondok Irafan.
7. Teman-teman Aesculapius 43 yang telah bersama-sama berjuang selama S-1 di FKH IPB yang telah memberikan berbagai warna dalam kehidupan penulis.
8. Adik-adik Gianuzi dan Avenzoar
9. Seluruh staf Departemen Anatomi Fisiologi dan Farmakologi serta pihak-pihak yang tidak dapat disebutkan satu per satu.
Besar harapan penulis agar skripsi ini bermanfaat bagi semua pihak khususnya bagi penulis dan umumnya bagi pembaca semua. Amin.
Bogor, 30 Agustus 2010
Kurnia Suanda
RIWAYAT HIDUP
Penulis dilahirkan di Desa Cikondang, Kecamatan Cingambul, Kabupaten Majalengka, Provinsi Jawa Barat pada tanggal 25 Agustus 1988. Penulis merupakan anak kedua dari tiga bersaudara dari pasangan Bapak Sumarja dan Ibu Rasinoh.
Penulis menyelesaikan pendidikan dasar pada tahun 2000 di SDN 1 Cikondang, Majalengka. Penulis melanjutkan pendidikan pada tahun 2000 sampai dengan 2003 di SLTPN 1 Cikijing, Majalengka. Selanjutnya, penulis lulus dari SMAN 1 Majalengka pada tahun 2006.
Tanggal 3 Juli 2006 penulis melanjutkan pendidikan di perguruan tinggi negeri Institut Pertanian Bogor (IPB) melalui jalur Undangan Saringan Masuk IPB (USMI). Tahun 2007 melalui program mayor minor, penulis diterima sebagai mahasiswa Fakultas Kedokteran Hewan IPB.
Himpunan Minat dan Profesi Ornithologi dan Unggas merupakan HIMPRO yang dipilih oleh penulis sebagai wadah pengembangan minat penulis. Selain itu, penulis mendapatkan bantuan beasiswa POM pada Tahun 2006 hingga 2007 dan pada tahun 2009 hingga 2010 penulis mendapat Beasiswa Bantuan Belajar Mahasiswa (BBM).
i
DAFTAR ISI
Halaman
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... iii
DAFTAR LAMPIRAN ... iv PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan Penelitian ... 3 Manfaat Penelitian ... 3 Hipotesis Penelitian ... 3 TINJAUAN PUSTAKA ... 4 Ikan patin ... 4
Morfologi Ikan Patin ... 4
Sifat Biologis Ikan Patin ... 5
Klasifikasi Ikan Patin ... 6
Habitat Ikan Patin ... 6
Faktor-Faktor yang Memengaruhi Kondisi Ikan Patin ... 7
Pakan Ikan Patin ... 8
Respons Stres pada Ikan... 10
Anastesi ... 12
Xilazin (C12H12N2S) ... 14
METODE PENELITIAN ... 18
Waktu dan Tempat Penelitian ... 18
Alat dan Bahan ... 18
Persiapan ... 18
Rancangan Percobaan ... 18
Tahap Persiapan ... 19
Tahap Perlakuan ... 19
Parameter yang Diamati ... 20
Analisis Data ... 20
HASIL DAN PEMBAHASAN ... 21
Onset pemberian xilazin ... 21
Durasi pemberian xilazin ... 23
Kematian pada ikan patin ... 26
Pembahasan umum... 28
SIMPULAN DAN SARAN ... 33
Simpulan ... 33
Saran ... 33
DAFTAR PUSTAKA ... 34
ii
DAFTAR TABEL
Halaman
1. Hasil Rataan Onset Pemberian Xilazin ... 22 2. Hasil Rattan Durasi Pemberian Xilazin ... 24 3. Hasil Rattan Persentase Kematian Ikan Patin ... 24
iii
DAFTAR GAMBAR
Halaman
1. Ikan Patin ... 5
2. Struktur Senyawa Xilazin ... 15
3. Ikan Patin Teranastesi ... 21
4. Ikan Patin Recovery... 24
iv
DAFTAR LAMPIRAN
Halaman
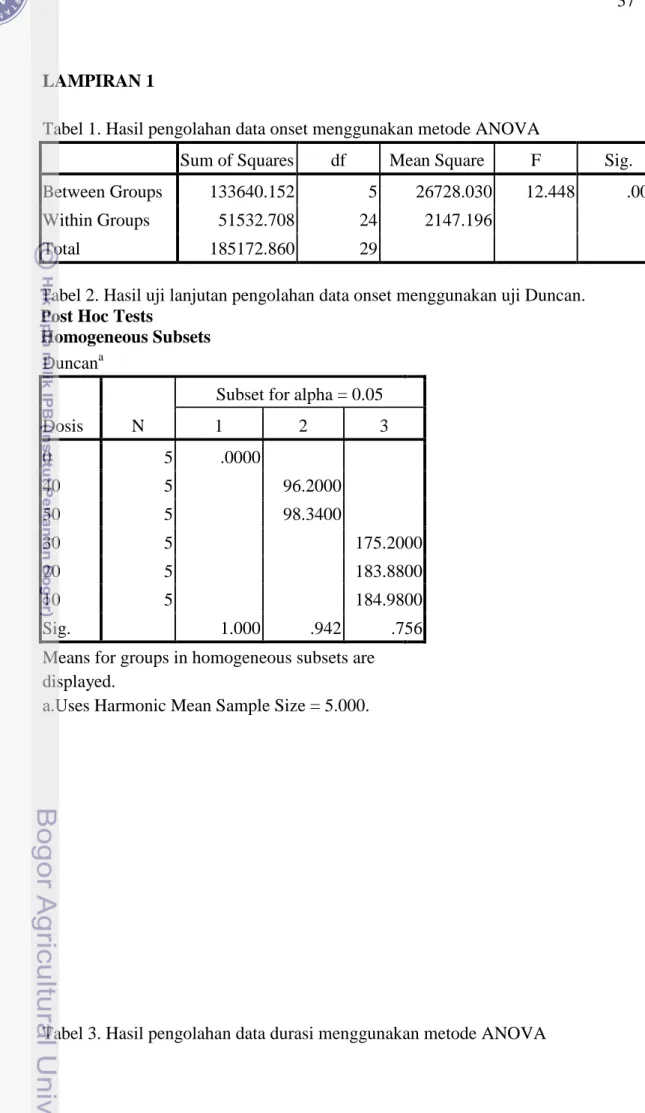
1. Tabel Hasil Pengolahan Rataan Onset Menggunakan ANOVA ... 36
2. Tabel Hasil Pengolahan Rataan Onset Menggunakan uji Duncan ... 36
3. Tabel Hasil Pengolahan Rataan Durasi Menggunakan ANOVA ... 37
4. Tabel Hasil Pengolahan Rataan Durasi Menggunakan uji Duncan ... 37
5. Tabel Hasil Pengolahan Rataan Kematian Menggunakan ANOVA... 38
PENDAHULUAN
Latar Belakang
Kekayaan alam yang sangat berlimpah baik berasal dari daratan maupun perairan membuat Indonesia dikenal sebagai negara megabiodiversitas. Perikanan merupakan salah satu kekayaan alam Indonesia asal perairan yang memberikan prospek cerah bagi masyarakat Indonesia. Peningkatan budi daya perikanan di Indonesia sangat potensial. Hal tersebut salah satunya dipengaruhi oleh letak geografis Indonesia yang hampir sebagian kondisi perairannya cocok untuk media pengembangan dan pemeliharaan ikan (Susanto 1998). Faktor peningkatan budi daya ikan juga didukung oleh pertambahan jumlah penduduk Indonesia yang setiap tahun mendorong munculnya peningkatan kebutuhan akan berbagai bahan pangan. Salah satu kebutuhan pangan tersebut ialah kebutuhan akan protein hewani asal ikan (Hernowo 2001). Protein hewani asal ikan sangat digemari oleh masyarakat Indonesia karena umumnya ikan mempunyai rasa daging yang enak, gurih, lezat, dan mempunyai kandungan protein yang tinggi (Khairuman & Dodi 2009).
Bidang perikanan yang dapat memberikan prospek cerah salah satunya adalah komoditas ikan patin. Hal ini disebabkan karena ikan patin cukup potensial untuk dibudidayakan pada berbagai media pemeliharaan (Susanto 1998). Pesatnya perkembangan dan pembudidayaan ikan patin di antaranya karena ikan patin mempunyai kemampuan reproduksi yang sangat cepat. Ikan patin juga mempunyai kemampuan beradaptasi yang tinggi terhadap kondisi berbagai perairan, misalnya pada kondisi perairan ekstrim dengan kandungan oksigen terlarut dan pH yang rendah (Abdul 2007). Menurut Hernowo (2001), ikan patin di Indonesia saat ini banyak dikembangkankan di pulau Jawa, Sumatera, dan Kalimantan.
Ikan patin banyak dimanfaatkan oleh sebagian besar masyarakat sebagai lauk pauk, hasil olahan, dan ikan hias. Namun, komoditas ikan patin bagi sebagian masyarakat belum menjadi salah satu prioritas sebagai komponen menu makanan sehari-hari. Hal ini disebabkan karena adanya keterbatasan hasil olahan ikan, cara pemeliharaan ikan segar, dan promosi penjualan ikan patin yang masih belum
2
luas. Ikan patin sekarang tidak hanya dimanfaatkan sebagai bahan pangan saja, tetapi merupakan komoditas ekspor yang cukup besar. Contohnya, negara Thailand merupakan negara terbesar pengekspor ikan patin di dunia. Namun, saat ini tidak hanya negara Thailand yang dikenal sebagai negara pengekspor ikan patin, akan tetapi negara Indonesia sudah mulai mengembangkan ikan patin sebagai salah satu komoditas ekspor unggulan (Departemen Kelautan dan Perikanan 2003). Pengembangan budi daya ikan patin di Indonesia sangat cocok karena dipengaruhi oleh beberapa faktor, di antaranya curah hujan dengan rata-rata 125 hingga 150 per tahun, suhu lingkungan mencapai 20°C hingga 25°C, dan tingkat keasamannya (pH) sekitar 7 hingga 8,5. Berbagai kondisi tersebut sangat cocok untuk perkembangan budi daya ikan patin (Coyle et al. 2004). Saat ini ikan patin banyak dikembangkan dan dibudidayakan di daerah Lampung, Sumatera Selatan, Jawa Barat, dan Kalimantan (Susanto 1999).
Perbedaan lokasi antara tempat pengembangan ikan patin dengan tempat pemasaran, membuat transportasi menjadi salah satu faktor penting dalam pengembangan ikan patin. Namun, dengan adanya alternatif transportasi ikan beberapa masalah dan kendala pun muncul. Kendala tersebut di antaranya tingginya tingkat stres ikan ketika transportasi berlangsung. Peningkatan stres pada ikan selama proses transportasi dapat berdampak pada tingginya tingkat kematian populasi ikan patin. Peningkatan stres tersebut dapat ditimbulkan salah satunya oleh peningkatan kadar amonia dan CO2 di dalam wadah ikan ketika ditransportasikan. Selain itu, meningkatnya hasil metabolisme ikan patin juga dapat memicu tingginya tingkat stres ikan (Abdul 2007). Namun, tingkat stres pada ikan patin selama transportasi dapat dikurangi salah satunya dengan menggunakan metode anastesi. Pemberian senyawa anastesi maupun obat-obatan herbal pada ikan patin bertujuan untuk mencegah stres dan mengantisipasi terganggunya ikan patin pada saat mendapat perlakuan (Hernowo 2001). Oleh karena itu, melalui metode anastesi tingkat kematian pada ikan patin akibat stres pada transportasi juga dapat dikurangi.
3
Tujuan Penelitian
Tujuan penelitian ini terdiri atas tujuan umum dan tujuan khusus. Tujuan umum dari penelitian ialah :
1. Memberikan informasi tentang pengaruh pemberian xilazin sebagai senyawa anastesi dalam upaya mengurangi tingkat stres pada ikan patin.
2. Mengetahui efektivitas pemberian senyawa xilazin pada ikan patin melalui pengamatan pada berbagai kondisi ikan selama lima kali ulangan.
Sementara itu, tujuan khusus dari penelitian yaitu :
1. Meningkatkan pengetahuan peneliti tentang efek dan pengaruh pemberian xilazin sebagai senyawa anastesi.
2. Mengetahui rangkaian fase anastesi secara teliti pasca pemberian senyawa xilazin.
Manfaat Penelitian
Manfaat penelitian ini ialah :
1. Mendapatkan dosis sediaan senyawa xilazin yang efektif sehingga dapat digunakan untuk memperkecil efek stres pada ikan patin.
2. Menghasilkan ikan patin yang segar dengan mengetahui dosis xilazin yang tepat.
3. Memperkecil kerugian yang disebabkan oleh stres pada ikan patin melalui penggunaan dosis xilazin yang tepat.
Hipotesis Penelitian
H0 : Adanya pengaruh dosis xilazin terhadap lamanya onset. H1 : Tidak adanya pengaruh dosis xilazin terhadap lamanya onset. H0 : Adanya pengaruh dosis xilazin terhadap lamanya durasi. H1 : Tidak adanya pengaruh dosis xilazin terhadap lamanya durasi. H0 : Dosis pemberian xilazin tidak menyebabkan kematian.
TINJAUAN PUSTAKA
Ikan patin
Ikan patin merupakan jenis ikan air tawar yang banyak ditemukan di perairan Asia Selatan, terutama di perairan negara Pakistan (Hernowo 2001). Menurut Leagler (1972), ikan patin juga banyak ditemukan di perairan Amerika Utara terutama di daerah perairan negara Kanada dan Guatemala. Perkembangan hidup ikan patin dipengaruhi oleh beberapa faktor, di antaranya curah hujan dengan rata-rata 125 hingga 150 per tahun, suhu sekitar 20°C hingga 25°C (Coyle
et al. 2004). Namun, suhu terbaik untuk pengembangan ikan patin di dalam
akuarium berkisar antara 26°C hingga 28°C, sementara itu tingkat keasaman (pH) yang baik sekitar 6,5 hingga 7 (Frid & Dobson 2004). Secara umum, kondisi yang ideal untuk ikan ialah suhu 24°C dan pH air berkisar 7. Suhu dan pH yang tidak sesuai dapat menyebabkan gangguan pada ikan, di antaranya menyebabkan hipoksia (kekurangan O2) dan hiperkapnia (kelebihan CO2) (Moris & Brown 1989). Literatur lain menjelaskan suhu terbaik untuk pengembangan ikan patin adalah 28°C hingga 30°C (Khairuman dan Dodi 2009).
Morfologi Ikan Patin
Ikan patin mempunyai struktur tubuh yang memanjang berwarna putih seperti perak dengan warna punggung kebiru-biruan. Panjang tubuh ikan patin dapat mencapai 120 cm (1,2 m) dengan kepala relatif kecil dan mulut yang terletak di sebelah bawah dilengkapi dua pasang kumis pendek yang berfungsi sebagai indera peraba. Ciri-ciri tersebut menunjukkan bahwa ikan patin tergolong
catfish (Susanto 1998). Ukuran ikan patin yang masih kecil panjangnya sekitar 5
hingga 12 cm. Umumnya ikan patin dipasarkan untuk konsumsi pada saat mencapai bobot 300 hingga 1000 g. Ikan patin mempunyai beberapa keistimewaan, yaitu rasanya khas dan enak, rendah kalori (120 kalori per 350 g), dan struktur tubuh yang kenyal tapi mempunyai daging yang empuk. Daging ikan patin mengandung kadar natrium yang rendah, kalsium, zat besi, dan mineral yang cukup tinggi sehingga sangat baik untuk kesehatan (Hernowo 2001). Kandungan gizi lain yang terdapat pada ikan patin di antaranya protein 68,6% , lemak 5,8%,
5
abu 3,5%, dan air 59,3% (Khairuman dan Dodi 2009). Selanjutnya gambar ikan patin disajikan pada Gambar 1.
Gambar 1 Ikan patin (Scott et al. 2009)
Ikan patin mempunyai sirip dengan sebuah jari-jari keras yang berubah menjadi patil bergerigi di bagian belakang dan sirip ekornya membentuk cagak yang simetris. Sirip dubur ikan patin terdiri atas 30 hingga 33 jari-jari lunak, sirip perutnya mempunyai enam jari-jari lunak, dan sirip dada ikan patin terdiri atas 12 hingga 13 jari-jari lunak serta sebuah jari-jari keras yang berubah menjadi patil (Susanto 1998).
Menurut Badan Kelautan dan Perikanan (2003) ciri morfologi kepala ikan patin ialah rasio panjang standar kepala sekitar 4,12 cm, kepala relatif panjang dan melebar ke arah punggung, mata berukuran sedang pada sisi kepala, lubang hidung relatif besar, mulut relatif kecil dan melebar ke samping, gigi tajam, dan mempunyai jarak yang panjang antara ujung moncong dengan tepi mata. Punggung ikan patin berwarna abu-abu kehitaman, perut lebih besar dibandingkan dengan kepala, dan jarak sirip punggung ke ujung moncong relatif panjang.
Sifat Biologis Ikan Patin
Ikan patin bersifat nokturnal atau beraktivitas pada malam hari yang menandakan bahwa ikan patin tergolong pada catfish. Ikan patin hidup di perairan bebas pada lubang-lubang tepi sungai sebagai habitat hidupnya. Ikan patin berbeda dari golongan catfish lainnya karena mempunyai keistimewaan sebagai ikan omnivor atau ikan pemakan segala. Makanan alami ikan patin di antaranya
6
ikan-ikan yang berukuran kecil, cacing, detritus, serangga, udang-udangan,
molusca, dan biji-bijian kecil. Oleh karena itu, ikan patin tergolong omnivor
(Khairuman & Dodi 2009).
Menurut Hernowo (2001) ikan patin mulai mengalami kematangan kelamin pada umur 2 hingga 3 tahun. Jumlah telur yang dihasilkan bergantung pada kondisi dan ukuran tubuh induk. Induk dengan bobot badan 5 kg hingga 6 kg dapat menghasilkan telur sekitar 1,5 juta butir. Larva ikan patin dalam perkembangannya dapat hidup pada kondisi air yang mempunyai salinitas sebesar 1,5 ppt. Menurut Badan Kelautan dan Perikanan (2003), kemampuan bertelur ikan patin rata-rata dapat mencapai 4000 hingga 8.500 butir telur per kg bobot badan, diameter telurnya berkisar antara 1,66 hingga 1,92 mm, dan panjang larva ikan patin sekitar 4,7 mm.
Klasifikasi Ikan Patin
Menurut Susanto (1998) & Hernowo (2001) ikan patin tergolong famili
Pangasidae dan genus Pangasius. Spesies ikan patin mempunyai banyak ragam di
antaranya Pangasius bleeker (patin djambal), patin kunyit (riau), patin boccourti,
Pangasius hipophtalamus (bangkok), Pangasius olyuranodo atau lebih dikenal
dengan ikan juaro, Pangasius macronema (ikan rios rui), Pangasius micronemus (ikan wakal), dan Pangasius nastutus (ikan pedado). Sementara itu, di Indonesia dikenal dua macam spesies ikan patin, yaitu ikan patin lokal (Pangasius sp.) dan ikan patin siam atau bangkok (Pangasius hypophtalmus)
Habitat Ikan Patin
Famili Pangasidae mempunyai habitat hidup yang berbeda. Populasi ikan patin terletak pada perairan yang berlumpur sedang, perairan dalam dan luas dengan kondisi sungai yang bersih, sungai yang mengandung pasir di bagian dasar perairan, mengandung batu kerikil atau batu-batu yang berukuran besar, dan sungai mengandung lumpur hanya di bagian dasar saja (Tucker & John 2004). Ikan patin juga menyukai kondisi perairan dasar (demersal), hal ini ditandai dengan adaptasi bentuk mulut ikan patin yang demersal (Khairuman & Dodi 2009).
7
Beberapa syarat dan kodisi yang harus dipenuhi dalam pengembangan ikan patin, yaitu jenis tanah untuk kolam pemeliharaan adalah jenis tanah liat atau tanah lempung, tidak berporos, dapat menahan massa air yang besar, dan struktur tanah tidak menyebabkan kebocoran sehingga dapat dibuat pematang atau dinding kolam. Kemiringan tanah yang baik untuk pembuatan kolam ikan patin berkisar antara 3% hingga 5% dengan tujuan untuk memudahkan pengairan kolam secara gravitasi. Kualitas air untuk pemeliharaan ikan patin harus bersih, tidak terlalu keruh, tidak tercemar bahan kimia beracun, minyak, dan limbah pabrik. Kualitas air yang baik ini harus diperhatikan untuk menghindari timbulnya jamur. Selain itu, terdapat metode praktis untuk mencegah munculnya jamur pada ikan patin, yaitu dengan menambahkan larutan penghambat pertumbuhan jamur seperti emolin dengan dosis 0,05 ml per liter. Suhu air kolam harus selalu diperhatikan terutama pada saat penetasan telur menjadi larva. Untuk pengembangan ikan patin di akuarium, suhu yang digunakan antara 26°C hingga 28°C. Untuk pengembangan ikan patin di daerah yang mempunyai suhu air yang relatif rendah, kadang diperlukan alat pemanas untuk mencapai suhu optimal yang relatif stabil (Susanto 1999).
Faktor-Faktor yang Memengaruhi Kondisi Ikan Patin
Faktor yang memengaruhi keberadaan ikan patin dalam habitatnya terdiri atas faktor kimia dan fisika. Faktor-faktor tersebut di antaranya dapat berpengaruh pada metabolisme, respirasi, pertukaran ion, aspek psikologi, dan proses reproduksi ikan patin. Besarnya pengaruh faktor-faktor tersebut ditentukan oleh biomassa dan dinamika populasi dari ikan.
Faktor-faktor fisika yang memengaruhi kondisi ikan patin di antaranya suhu lingkungan, curah hujan, pH air, kedalaman air, dan salinitas air. Nilai pH yang normal bagi kehidupan ikan patin adalah 7 hingga 8,5 (Zulkifli 1995). Menurut Sneddon (2003) pH yang rendah dalam lingkungan dapat menghambat reaksi katalisasi enzim dan secara tidak langsung dapat memengaruhi efektivitas metabolisme ikan. Salinitas yang dibutuhkan ikan patin tidak boleh melebihi 1,7 ppt. Sementara itu, menurut Leagler (2004) kadar garam yang baik untuk ikan patin tidak boleh lebih dari 1,5 ppm. Literatur lain juga menjelaskan faktor-faktor
8
yang berpengaruh pada kehidupan ikan patin di antaranya pH 5 hingga 9, kandungan O2 sekitar 3 ppm hingga 6 ppm, kadar CO2 sekitar 9 ppm hingga 20 ppm, alkalinitas sekitar 90 hingga 250, dan suhu airnya sekitar 28°C hingga 30°C (Khairuman & Dodi 2009).
Faktor-faktor kimia yang memengaruhi kondisi ikan patin ialah kadar oksigen terlarut, konsentrasi ion hidrogen, dan komposisi dari bahan kimia yang bersirkulasi di dalam air (Leagler 1972). Oksigen terlarut dapat memengaruhi hubungan dinamika kelompok ikan. Konsentrasi oksigen terlarut yang dibutuhkan ialah 0,75 ppm pada suhu 25°C, 1,00 ppm pada suhu 30°C, dan 1,23 ppm pada suhu 35°C. Apabila konsentrasi oksigen terlarut dihubungkan dengan kedalaman air, maka dapat diketahui pada kedalaman 4 meter (sekitar 13 kaki) kadar oksigen yang diperlukan sekitar 6 ppm dan pada kedalaman 3 meter kadar oksigen yang diperlukan sekitar 4 ppm (Sneddon 2003). Selain itu, menurut Leagler (2004) kadar oksigen terlarut yang baik untuk ikan patin adalah 5 ppm.
Pengaruh faktor fisika dan kimia dengan tingkat yang tinggi, dapat menyebabkan meningkatnya stres pada ikan akibat adanya gangguan dan kerusakan pada populasi ikan. Kerusakan populasi ikan dapat menyebabkan terjadinya perubahan pada kuantitas dan kualitas air dalam area yang luas (Leagler 2004).
Pakan Ikan Patin
Sebagian besar ikan kelompok catfish bersifat omnivor. Komposisi dan pemberian pakan ditentukan oleh beberapa faktor di antaranya letak geografi, musim, derajat air, dan ukuran ikan (Sneddon 2003). Pakan ikan patin juga ditentukan oleh tingkat populasi ikan, tingkat pertumbuhan ikan, dan kondisi kesehatan ikan (Leagler 1972). Menurut Susanto (1999), pakan yang dapat diberikan untuk ikan patin dapat berupa pelet dengan jumlah 3% hingga 5% per hari dari jumlah bobot badan ikan. Pemberian pakan pada ikan patin juga harus disesuaikan dengan kenaikan bobot badan ikan. Pemberian pakan idealnya dilakukan setiap 4 kali sehari, yaitu pagi, siang, sore, dan malam hari. Jumlah pemberian pakan pada malam hari harus diberikan lebih banyak, karena ikan patin bersifat aktif pada malam hari (nokturnal).
9
Menurut Hernowo (2001), beberapa kriteria pakan ikan patin yang baik ialah pakan mempunyai daya tarik bagi ikan, pakan harus mudah ditangkap oleh ikan, pakan harus memiliki ukuran yang sesuai dengan bukaan mulut ikan, pakan yang diberikan harus mudah dicerna, pakan mengandung gizi yang lengkap dan seimbang bagi kebutuhan ikan yang dipelihara, serta kriteria yang terakhir yaitu pakan tersebut harus mudah dalam pengolahannya.
Kriteria pakan ikan patin harus mempunyai daya tarik bagi ikan dimaksudkan supaya pada saat pakan diberikan, ikan diharapkan tertarik kemudian mendatangi atau mengahampiri pakan tersebut. Pakan yang diberikan harus mudah ditangkap oleh ikan, khususnya pakan alami yang berupa organisme hidup (zooplankton). Apabila pakan yang diberikan susah untuk ditangkap, risikonya dapat merugikan ikan. Kerugian pada ikan dapat disebabkan karena ikan hanya mengejar pakan terus tanpa bisa memakannya. Pakan yang diberikan harus memiliki ukuran yang sesuai dengan bukaan mulut ikan patin. Hal ini sangat diperlukan untuk memudahkan ikan memakan pakan yang diberikan. Pakan yang diberikan harus mudah dicerna, walaupun jumlah pakan yang diberikan pada ikan patin telah mencukupi tetapi akan menjadi sia-sia apabila pakan tersebut tidak dapat dicerna oleh ikan. Pakan harus mengandung nutrisi yang lengkap dan seimbang bagi kebutuhan ikan yang dipelihara. Nutrisi yang terkandung dalam pakan harus lengkap meliputi protein, karbohidrat, lemak, mineral, dan vitamin. Kelengkapan nutrisi berfungsi untuk menjamin kesehatan, serta keperluan bagi perkembangan tubuh ikan patin. Terakhir, kriteria pakan yang baik harus mudah pengolahannya. Tujuannya ialah agar pakan ikan mudah diperoleh, harga terjangkau, praktis dalam penyimpanan, dan pemberiaannya.
Pakan ikan patin idealnya ialah pakan yang mengandung 30% protein, namun untuk larva ikan patin paling baik adalah menggunakan pakan alami. Contoh pakan alami yang sekarang banyak digunakan ialah artemia. Adapun untuk benih ikan patin dianjurkan pakan yang diberikan ialah cacing rambut atau
10
Respons Stres pada Ikan
Stres merupakan respons fisiologi ikan yang dapat terbagi menjadi tiga macam respons, yaitu efek primer, efek sekunder, dan efek tersier. Respons stres berupa efek primer ditandai dengan meningkatnya level kortikosteroid dan katekolamin dalam plasma sistem neuroendokrin. Kortikosteroid dapat menghambat migrasi leukosit, mekanisme efek limfosit, peradangan, dan produksi interleukin pada ikan. Respons endokrin selanjutnya dapat menimbulkan stimulasi terjadinya efek sekunder yang menyebabkan gangguan pada metabolisme dan tekanan osmotik. Efek sekunder ini diindikasikan dengan adanya perubahan dalam plasma glukosa, asam laktat, dan asam lemak bebas. Sementara itu, efek tersier ditandai dengan adanya perubahan tingkah laku, penurunan tingkat pertumbuhan, dan peningkatan kepekaan terhadap paparan penyakit. Faktor stres pada ikan dapat distimulasi oleh beberapa faktor di antaranya perubahan ion dan tekanan osmotik, polutan, anastesi, kepadatan ikan, pengangkutan, serta perlakuan terhadap ikan. Durasi efek stres primer terjadi dengan cepat dan relatif singkat (Tucker et al. 2004).
Menurut Evans & James (2002) respons stres pada ikan juga terbagi menjadi tiga tahapan, yaitu respons primer, respons sekunder, dan respons tersier. Respons stres primer pada ikan dapat disebabkan oleh beberapa hal, yaitu pengelompokan ikan, transportasi, dan vaksinasi. Respons stres primer pada ikan ditandai dengan meningkatnya kadar katekolamin dan kortisol dalam sirkulasi. Katekolamin diproduksi oleh jaringan kromafin yang terletak di bagian anterior ginjal. Sementara itu, kortisol diproduksi oleh jaringan inter-renal yang terdapat di bagian anterior ginjal yang direspons oleh hormon pituitari. Peningkatan kadar kortisol dapat menyebabkan penurunan kadar epinefrin. Penurunan kadar epinefrin ini merupakan indikator lain respons stres primer.
Respons stres sekunder pada ikan terdiri atas efek respons biokimiawi dan fisiologis. Hormon stres akan teraktivasi pada jalur metabolik akibatnya hormon ini akan meningkat pada kimia darah dan hematologi. Adanya perubahan berupa peningkatan konsentrasi glukosa plasma umumnya merupakan indikator pada respons stres sekunder pada ikan. Proses stres pada tahap ini umumnya memerlukan energi yang cukup banyak. Peningkatan konsentrasi plasma glukosa
11
pada sirkulasi dapat menyebabkan terjadinya peningkatan produksi glukosa. Peningkatan glukosa juga dapat terjadi akibat stimulasi pada organ seperti otak, insang, dan otot untuk meningkatkan glikogenolisis dan glukoneogenesis. Glikogenolisis merupakan suatu proses pemecahan glikogen menjadi glukosa yang terjadi secara kimiawi. Sementara itu, glukoneogenesis merupakan suatu proses pembentukan glukosa yang terjadi secara kimiawi. Hati merupakan sumber produksi glukosa dan tempat terjadinya proses glikogenolisis dan glukoneogenesis. Proses glikogenolisis dan glukoneogenesis terjadi pada saat terjadinya respons stres. Kedua proses kimia tersebut bertujuan untuk pembentukan suplai energi yang akan digunakan pada saat respons stres terjadi. Adanya adrenalin dan kortisol juga dapat menyebabkan peningkatan produksi glukosa dan memiliki peranan penting dalam proses peningkatan kadar plasma glukosa. Konsentrasi adrenalin dapat menurun setelah stres (post stres) kira-kira kurang dari 30 menit, sementara itu sisa plasma glukosa akan tetap tinggi dalam periode yang cukup lama (Evans & James 2002).
Respons stres tersier ikan dapat distimulasi akibat kekurangan kemampuan ikan untuk beradaptasi terhadap iklim. Stres pada tahap tersier ini ditandai dengan adanya penurunan kapasitas produksi dan penurunan kemampuan pertumbuhan. Stres tahap tersier juga ditandai dengan adanya penurunan kebutuhan tubuh ikan (Evans & James 2002).
Menurut Evans & James (2002), secara spesifik stres dapat terjadi pada tingkat seluler. Umumnya stres tingkat seluler ini melibatkan adanya kandungan
Heat Stock Protein (HSPs). Protein ini terdiri atas 3 jenis, yaitu HSP90 dengan
berat molekul 85 hingga 90 kDa, HSP70 dengan berat molekul 68 hingga 73 kDa, dan HSPs dengan berat molekul yang rendah antara 16 hingga 24 kDa. HSP70 merupakan protein yang berfungsi untuk membungkus rantai polipeptida, dan mendenaturasi atau mendegradasi protein. HSP90 merupakan protein yang aktif dan berfungsi sebagai signal cell, peningkatan sitoskeleton, enzim, dan reseptor hormon steroid. HSPs dengan berat molekul yang rendah kurang begitu diketahui fungsinya tetapi protein ini muncul pada saat adanya aktivasi terhadap stres.
Menurut Tuckher et al. (2004) stres pada ikan dapat distimulasi oleh dua faktor, yaitu faktor kimiawi dan fisika. Respons primer terhadap stres berasal dari
12
plasma kortikosteroid yang terdiri atas kortisol, kortison, dan kortikosteron yang dilepaskan ke dalam aliran darah dari jaringan inter-renal. Kortikosteroid akan dikeluarkan bersama dengan pelepasan katekolamin (adrenalin dan noradrenalin) dari sel kromafin di bagian ujung ginjal. Kortikosteroid juga dapat menimbulkan efek sekunder di antaranya meningkatkan kadar glukosa dalam darah dan meningkatkan kecepatan denyut jantung. Respons stres primer merupakan proses adaptasi yang alamiah dengan tujuan agar ikan dapat bertahan dari gangguan dan kerusakan akibat pengaruh dari luar. Beberapa respons sekunder dapat menyebabkan kerusakan jangka panjang pada kondisi ikan. Kortisol plasma dapat meningkat pada suhu 20°C hingga 30°C (Tucker et al. 2004).
Masa pemulihan stres pada ikan bergantung pada jenis, durasi, dan intensitas stres. Waktu pemulihan stres yang dibutuhkan ikan rata-rata sekitar 1 hingga 4 hari. Menurut Tucker et al. (2004), beberapa contoh stressor dan waktu yang dibutuhkan untuk pemulihan stres yaitu pertama, konsentrasi oksigen yang rendah pada suhu 22°C respons akan muncul 30 menit setelah perlakuan dan periode
recovery ikan sekitar 30 menit. Kedua, kadar amonia 200 ppm pada suhu 21°C
hingga 24°C respons akan muncul kira-kira 8 jam setelah perlakuan dan periode
recovery ikan sekitar 16 jam. Ketiga kadar nitrit 5 ppm pada suhu 21°C hingga
24°C, respons muncul kira-kira 24 jam setelah perlakuan. Namun untuk periode
recovery ikan belum diketahui. Keempat KMnO4 pada suhu 21,5°C respons akan muncul kira-kira 24 jam setelah perlakuan dan periode recovery ikan sekitar 48 jam. Terakhir, CuSO4 pada suhu 23°C, respons muncul kira-kira 24 jam setelah perlakuan dan periode recovery ikan sekitar 54 jam.
Anastesi
Anastesi berasal dari bahasa Yunani yaitu an- yang berarti tidak atau tanpa dan aesthetos yang berarti persepsi atau kemampuan untuk merasa sesuatu. Secara umum, anastesi dapat diartikan sebagai suatu tindakan menghilangkan rasa sakit ketika melakukan pembedahan dan berbagai prosedur lainnya yang menimbulkan rasa sakit pada tubuh. Istilah anastesi digunakan pertama kali oleh Oliver Wendel Holmes Sr. pada tahun 1846. Obat untuk menghilangkan nyeri terbagi dalam 2 kelompok, yaitu analgesia dan anastesi. Analgesia adalah
13
obat pereda nyeri tanpa disertai hilangnya perasaan secara total. Seseorang yang mengonsumsi obat yang bersifat analgesia akan tetap berada dalam keadaan sadar. Sediaan analgesia tidak selalu menghilangkan seluruh rasa nyeri, tetapi dapat bersifat meringankan rasa nyeri. Beberapa jenis anastesi menyebabkan hilangnya kesadaran, sementara itu jenis yang lainnya hanya menghilangkan nyeri dari bagian tubuh tertentu dan pemakainya tetap sadar (Suryanto 1998).
Penggunaan obat bius sebagai anastesi pada ikan harus dilakukan secara hati-hati agar tidak menimbulkan dampak negatif bagi ikan, lingkungan, dan manusia. Perhatian khusus ditekankan pada beberapa aspek di antaranya jenis obat bius, dosis obat yang digunakan, cara penyimpanan obat bius, ukuran ikan patin, bobot badan ikan patin, limbah, dan efek residunya pada ikan patin. Pemilihan jenis dan dosis obat bius untuk anastesi berfungsi agar tujuan penggunaan obat bius dapat tercapai secara efesien, ekonomis, dan aman. Akhir-akhir ini penggunaan obat bius dalam media angkut dan transportasi banyak dipraktikkan di masyarakat. Beberapa keuntungan penggunaan obat bius antara lain mengurangi stres pada ikan, mengurangi konsumsi oksigen, mengurangi produksi CO2, mengurangi gerakan ikan sehingga dapat menekan kerusakan fisik ikan, dan menghemat waktu penanganan ikan. Penggunaan obat bius dalam pengangkutan benih ikan patin bersifat terbatas. Tetapi, penggunaan obat bius sangat penting pada proses pengangkutan ikan patin yang berukuran dewasa untuk pembenihan (Hernowo 2001).
Menurut Treeves & Brown (1999), tahapan anastesi suatu sediaan anastetikum pada ikan diawali dengan terabsorbsinya senyawa anastetikum ke dalam tubuh melalui insang dan dapat juga melalui kulit. Selanjutnya, sediaan anastetikum akan terakumulasi pada lapisan lemak yang terdapat dalam tubuh ikan. Banyaknya sediaan yang terakumulasi dipengaruhi oleh banyaknya kandungan lemak dalam tubuh ikan. Semakin banyak kandungan lemak, maka jumlah sediaan yang terabsorbsi pun akan semakin banyak. Molekul sediaan anastetikum selanjutnya akan dibawa ke susunan sistem saraf pusat, yaitu otak dan medulla spinalis. Ketika sediaan anastetikum mencapai SSP, maka senyawa anastetikum tersebut akan menghambat kerja inter-renal dan menekan SSP. Efek tersebut dapat mengakibatkan timbulnya efek sedasi, relaksasi otot, dan mereduksi
14
kegiatan yang bersifat spontan, misalnya refleks terhadap rangsangan dari lingkungan sekitar. Molekul xilazin juga akan menghambat kerja kortikostreoid. Oleh karena itu, efek sedasi muncul sebagai hasil kerja dari senyawa xilazin.
Sementara itu, stadium anastesi dan gejala anastesi pada ikan menurut Scott et al. (2009) terdiri atas stadium eksitasi yang ditandai dengan peningkatan gerakan operkular atau aktivitas. Setelah beberapa menit gerakan ikan melambat, menjadi ataksia, berenang tidak seimbang, dan mulai memutar ke samping. Kadang-kadang posisi ikan menjadi dorsal recumbency, depresi, ikan menjadi berada di dasar kolam, dan respirasi meningkat. Menurut Bowser (2001) tahapan anastesi terdiri atas tahap normal, tahap sedasi awal, tahap sedasi total, tahap kehilangan sebagian keseimbangan, tahap kehilangan keseimbangan total, tahap kehilangan refleks, dan tahap aspiksia. Sementara itu menurut Coyle et al.(2004), tahapan anastesi terdiri atas tahap sedasi, tahap anastesi ringan, tahap anastesi dalam, dan tahap kematian. Tahap sedasi ditandai dengan adanya penurunan gerakan ikan dan tingkat pernapasan ikan, tahap anastesi ringan ditandai dengan hilangnya sebagian keseimbangan dan bersifat aktif terhadap rangsangan dari luar, tahap anastesi dalam ditandai dengan kehilangan keseimbangan total dan berkurangnya refleks terhadap rangsangan dari luar, dan tahap kematian ditandai dengan berhentinya denyut jantung dan sistem pernapasan. Tahap kematian dapat terjadi apabila dosis anastesi yang diberikan melebihi batas aman obat.
Literatur lain mengatakan tahapan anastesi terdiri atas periode tranquilitas yaitu periode ikan berenang dengan lambat, periode eksitasi, yaitu periode keseimbangan ikan berkurang pada saat berenang. Level anastesi ringan, yaitu periode keseimbangan ikan hilang total dan sensitif terhadap stimulasi eksternal, dan level anastesi berat, yaitu periode pada saat gerakan ikan berenang dengan sangat lambat, keseimbangan hilang total, dan pengeluaran ekskreta pada saat memperoleh stimulasi eksternal yang tinggi (Altun et al. 2009).
Xilazin (C12H12N2S)
Xilazin disintesis pertama kali pada tahun 1962 dengan kode Bay Va 1470. Secara kimiawi struktur senyawa anastetikum xilazin dikenal sebagai 2(2,6-dimethyilpenylamino)-4H-5,6-dihydro-1,3-thiazinehydrochloride. Senyawa
15
anastetikum xilazin ini digunakan untuk mengontrol kondisi hipertensi. Sementara itu, secara farmakologi fungsi xilazin dapat diklasifikasikan sebagai fungsi analgesia, sedasi, dan relaxan pada otot skeletal (Adam 2001).
Xilazin merupakan senyawa preanastetikum yang biasa digunakan sebelum hewan diberikan anastesi general. Xilazin dapat diberikan sebagai senyawa preanastesikum tunggal atau dikombinasikan bersama senyawa anastesi atau preanastesi lainnya seperti atropin, acepromazin, medetomidin, diazepam, dan opoids (lebih dikenal dengan narkotik).
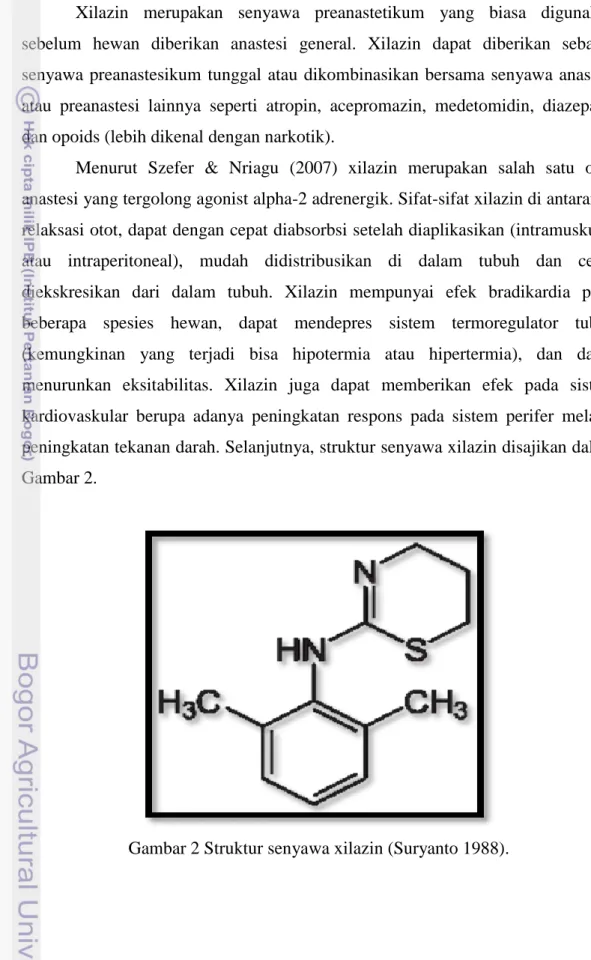
Menurut Szefer & Nriagu (2007) xilazin merupakan salah satu obat anastesi yang tergolong agonist alpha-2 adrenergik. Sifat-sifat xilazin di antaranya relaksasi otot, dapat dengan cepat diabsorbsi setelah diaplikasikan (intramuskular atau intraperitoneal), mudah didistribusikan di dalam tubuh dan cepat diekskresikan dari dalam tubuh. Xilazin mempunyai efek bradikardia pada beberapa spesies hewan, dapat mendepres sistem termoregulator tubuh (kemungkinan yang terjadi bisa hipotermia atau hipertermia), dan dapat menurunkan eksitabilitas. Xilazin juga dapat memberikan efek pada sistem kardiovaskular berupa adanya peningkatan respons pada sistem perifer melalui peningkatan tekanan darah. Selanjutnya, struktur senyawa xilazin disajikan dalam Gambar 2.
16
Menurut Bowser (2001) alasan penggunaan xilazin sebagai premedikasi, yaitu untuk menenangkan hewan yang sedang marah, ketakutan, dan hewan yang galak. Potensi penggunaan xilazin sebagai premedikasi ialah dapat menurunkan jumlah penggunaan anastesi general, menyebabkan relaksasi otot, meminimalkan terjadinya bradikardia, dapat menginduksi muntah, dapat mengurangi pergerakan usus dan organ visera, dan mengurangi salivasi. Alasan lain penggunaan xilazin ialah untuk mengurangi efek samping dari penggunaan anastesi general, dan yang terakhir dapat mengurangi kesakitan dan rasa tidak nyaman pada saat pembedahan, pascaoperasi, dan masa penyembuhan hewan pascaoperasi. Penggunaan xilazin harus hati-hati pada situasi terjadinya penyakit kardiovaskular, penyakit pernapasan, hewan sedang lemas, hewan yang sudah tua, neonatus, dan hewan yang sedang bunting (Bowser 2001).
Xilazin umumnya diaplikasikan sebagai obat bius pada hewan anjing, kucing, kuda, dan rusa. Indikasi pada hewan anjing dan kucing dapat menghilangkan rasa sakit dengan periode yang pendek. Xilazin dapat digunakan sebagai preanastesi sebelum anastesi general (Anonim 2009). Menurut Adams (2001), xilazin sangat efektif digunakan sebagai obat anastesi pada ikan tetapi pengunaannya terbatas karena efek utamanya dapat menyebabkan konvulsi pada saat pemberian dan periode recovery (pemulihan). Efek samping lainnya yang dapat ditimbulkan oleh xilazin ialah cardiac aberasi, hipotensi, kegagalan fungsi ginjal, kegagalan fungsi hati, dan bisa menyebabkan timbulnya epilepsi.
Xilazin merupakan senyawa yang bersifat cepat diabsorbsi oleh tubuh melalui aplikasi intramuskular , namun bioavabilitas xilazin ini bersifat inkomplit dan bervariasi. Bioavabilitas xilazin pada beberapa hewan di antaranya kuda 40% sampai dengan 48%, domba 17% sampai dengan 73%, dan anjing 52% sampai dengan 90%. Onset xilazin pada beberapa hewan menurut literatur berkisar antara 1 hingga 2 menit dengan efek maksimum 3 hingga 10 menit secara per injeksi. Durasi xilazin mencapai 90 hingga 120 menit. Periode recovery setelah pemberian xilazin mencapai 120 hingga 240 menit pada hewan kecil (Daelami 2002).
Kontraindikasi pemberian xilazin di antaranya cardiac arytmia, gagal jantung, hipotensi, kegagalan respirasi, insufisiensia ginjal, kegagalan fungsi hati,
17
(Szefer & Nriagu 2007). Efek samping pemberian xilazin dapat terlihat sekitar 3 sampai dengan 5 menit setelah pemberian. Gejala yang terlihat yaitu tremor otot, bradikardia akibat blokade pada AV node, menurunkan tingkat respirasi, dan meningkatkan urinasi pada hewan kecil (Anonim 2009).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilakukan di farm ikan patin Dramaga Pratama, Ciampea, Bogor selama 3 bulan yang dimulai pada bulan Mei sampai dengan Agustus 2009.
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini ialah air mineral kemasan 250 ml, 30 buah gelas kemasan air mineral, spuit 1 ml, gelas ukur, sendok, dan baskom. Sementara itu, bahan yang digunakan dalam penelitian ini ialah 650 ekor ikan patin dengan panjang sekitar 5 cm dan bobot badan 6 gram. Senyawa yang digunakan dalam perlakuan ialah xilazin.
Persiapan
Air mineral yang terstandar sebanyak 100 ml disiapkan di dalam gelas kemasan air mineral sebanyak 30 gelas menggunakan gelas ukur. Ikan patin sebanyak 5 ekor dimasukkan ke dalam masing-masing gelas. Senyawa xilazin disiapkan dalam spuit masing-masing 10, 20, 30, 40, dan 50 ppm. Ikan patin yang sudah berada pada masing-masing gelas dibiarkan terlebih dahulu selama 10 menit sebelum disuntikkan senyawa xilazin ke dalam media air.
Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan percobaan acak lengkap (RAL) dan terdiri atas enam kelompok perlakuan. Pengulangan dilakukan sebanyak lima kali dan setiap pengulangan terdiri atas 5 ekor ikan patin. Untuk memperkecil pengaruh lingkungan terhadap penelitian, maka dilakukan replikasi sebanyak lima kali dengan anggapan standar deviasinya besar. Replikasi dilakukan pada hari yang berbeda dengan keadaan yang dibuat sedemikian rupa, sehingga diperoleh kondisi yang sama dengan kondisi pada saat penelitian. Perlakuan yang diberikan dalam penelitian ini terdiri atas 6 kelompok dosis xilazin di antaranya kelompok ikan patin dengan dosis
19
xilazin 0 ppm sebagai kontrol yang tidak mendapat perlakuan apa-apa, kelompok 1 merupakan ikan patin yang direndam dalam media dengan dosis xilazin sebesar 10 ppm, kelompok 2 merupakan ikan patin yang direndam dalam media dengan dosis xilazin sebesar 20 ppm, kelompok 3 merupakan ikan patin yang direndam dalam media dengan dosis xilazin sebesar 30 ppm, kelompok 4 merupakan ikan patin yang direndam dalam media dengan dosis xilazin sebesar 40 ppm, dan kelompok 5 merupakan ikan patin yang direndam dalam media dengan dosis xilazin sebesar 50 ppm.
Tahap Persiapan
Tahap awal persiapan ialah aklimatisasi ikan patin selama 1 bulan di dalam akuarium dengan suhu 26°C hingga 28°C. Tujuan aklimatisasi ini ialah agar ikan patin percobaan dapat beradaptasi dengan lingkungan tempat penelitian. Proses aklimatisasi juga dilakukan untuk mengurangi kesalahan yang disebabkan oleh faktor lingkungan, sehingga dapat diperoleh hasil penelitian yang cukup akurat.
Tahap Perlakuan
Tahap awal perlakuan ialah pemilihan dan pemindahan ikan patin dari akuarium ke dalam wadah. Selanjutnya, ikan patin ditempatkan pada masing-masing gelas plastik yang telah diisi air mineral banyak 100 ml. Ikan patin dibiarkan terlebih dahulu selama 5 menit di dalam gelas plastik. Hal ini dilakukan agar ikan dapat beradaptasi. Xilazin dimasukkan ke dalam gelas plastik yang berisi ikan patin sesuai masing-masing dosis dengan menggunakan spuid. Secara bersamaan gejala yang terlihat pada ikan patin diamati satu per satu dengan teliti. Pengamatan gejala awal ini digunakan untuk menentukan onset anastesi yang terjadi pada ikan patin. Setelah terlihat adanya gejala anastesi, ikan langsung dipindahkan ke dalam gelas plastik yang berisi air mineral tanpa xilazin. Ikan yang telah dipindahkan tetap diamati kondisinya, khususnya gejala ikan dari kondisi teranastesi sampai dengan pulih kembali. Pengamatan ini dilakukan untuk menentukan durasi anastesi dari sediaan xilazin terhadap ikan patin.
Masing-20
masing perubahan gejala dicatat waktunya dalam tabel yang telah disiapkan. Selain itu, kejadian kematian ikan patin akibat perlakuan juga diamati dan dicatat.
Parameter yang Diamati
Parameter yang diamati dalam penelitian ini ialah onset dan durasi pada ikan patin dengan metode perendaman (dipping). Selain itu, diamati fase anastesi dan tingkat kematian ikan patin untuk mengetahui keamanan sediaan xilazin. Onset dapat diketahui dengan mengamati tingkat kesadaran, refleks, keseimbangan, tonus otot, dan rasa sakit. Durasi dapat diketahui dengan mengamati lamanya waktu mulai dari ikan patin teranastesi sampai dengan ikan pulih kembali. Sementara itu, tingkat kematian dapat diketahui dengan banyaknya ikan patin yang mati setelah ikan dipindahkan ke dalam media yang berisi air mineral tanpa xilazin.
Analisis Data
Data yang diperoleh dari hasil penelitian dianalisis dengan menggunakan metode Analysis of Variance (ANOVA) dan dilanjutkan dengan uji Duncan untuk mengetahui perbedaan pada masing-masing perlakuan.
HASIL DAN PEMBAHASAN
Efektivitas pemberian senyawa xilazin pada ikan patin dapat terlihat dari onset, durasi, kematian, dan tahapan anastesi xilazin. Pemberian xilazin pada ikan patin menggunakan metode perendaman (dipping). Hasil penelitian dapat disajikan pada uraian berikut.
Onset pemberian xilazin
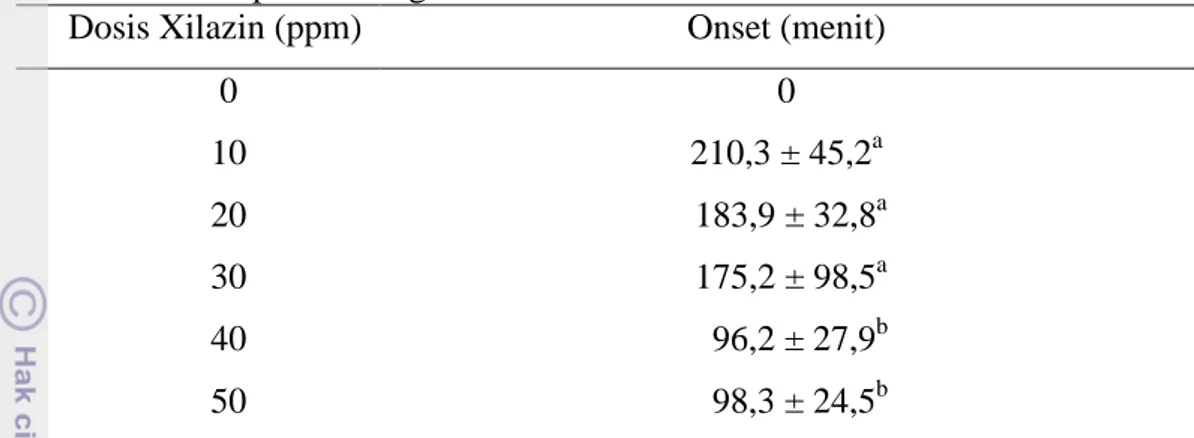
Onset kerja anastetikum merupakan waktu kerja obat dari mulai awal pemberian obat sampai terlihat adanya efek anastesi (Hitner 1999). Onset kerja xilazin ditandai dengan hilangnya kesadaran ikan patin setelah dilakukan pemberian senyawa xilazin. Onset xilazin pada beberapa hewan menurut literatur berkisar antara 1 sampai dengan 2 menit dengan efek maksimum 3 sampai dengan 10 menit secara per injeksi (Daelami 2002). Selanjutnya gambar ikan patin yang teranastesi dan hasil rataan onset pemberian xilazin disajikan pada Gambar 3.
Gambar 3 Ikan patin yang teranastesi.
Rataan hasil pengamatan onset anastesi pada ikan patin akibat pemberian senyawa xilazin pada media perendaman dengan dosis 0, 10, 20, 30, 40, dan 50 ppm disajikan pada Tabel 1.
22
Tabel 1 Rataan onset anastesi pada ikan patin yang direndam pada media dengan xilazin pada berbagai dosis
Dosis Xilazin (ppm) Onset (menit)
0 0 10 210,3 ± 45,2a 20 183,9 ± 32,8a 30 175,2 ± 98,5a 40 96,2 ± 27,9b 50 98,3 ± 24,5b
Keterangan : Huruf superskrip yang sama pada masing-masing kolom menunjukkan tidak berbeda nyata (p>0,05).
Onset anastesi paling panjang ditunjukkan oleh ikan patin yang direndam dalam media dengan dosis xilazin 10 ppm, sementara itu onset terpendek ditunjukkan oleh ikan patin yang direndam dalam media dengan dosis xilazin 40 ppm. Onset terpendek dapat memberikan gambaran waktu pemberian anastesi yang efektif. Oleh karena itu, anastesi dapat dilakukan minimal 96 menit sebelum transportasi dilaksanakan. Hal tersebut terjadi karena ikan patin pada media kontrol tidak mendapat perlakuan perendaman menggunakan xilazin, sehingga ikan patin tidak menunjukkan efek anastesi. Semakin besar dosis xilazin yang diberikan dalam media perendaman, maka semakin cepat onset yang ditunjukkan oleh ikan patin. Hal ini sesuai dengan literatur yang menyatakan bahwa semakin tinggi dosis obat yang diberikan, maka onset kerja obat tersebut akan semakin cepat (Crowell & Murray 2005). Sementara itu, menurut Plumb (2005) semakin tinggi pemberian dosis suatu anastetikum, maka onset kerja obat tersebut akan semakin cepat. Hal tersebut disebabkan karena konsentrasi molekul obat yang terkandung juga akan semakin banyak, sehingga memudahkan kerja obat tersebut pada target organ di dalam tubuh. Suatu anastetikum dikatakan efektif untuk digunakan apabila onset kerja anastetikum tersebut singkat dengan menggunakan dosis tertentu (Katzung 1988).
Berdasarkan hasil analisa statistik dapat diketahui bahwa H0 dapat diterima dan H1 ditolak, hal ini membuktikan bahwa dosis xilazin memengaruhi lamanya onset. Pengambilan hasil hipotesa tersebut berdasarkan nilai sigifikasi (p<0,05) yang menunjukkan hasil yang berbeda nyata. Kelompok dengan hasil uji
23
berbeda nyata menunjukkan bahwa perbedaan jumlah dosis xilazin yang dilarutkan dalam media akan menghasilkan onset anastesi yang relatif berbeda pada ikan patin. Sementara itu, data hasil uji yang tidak berbeda nyata menunjukkan bahwa perbedaan jumlah dosis xilazin yang dilarutkan pada media akan menghasilkan onset anastesi yang relatif sama bergantung pada dosis masing-masing.
Menurut Crowell & Murray (2005) faktor-faktor yang dapat memengaruhi onset kerja suatu obat, yaitu kecepatan penyerapan obat anastesi dan bobot badan ikan patin. Pemberian senyawa anastetikum xilazin dengan dosis yang tinggi akan mempunyai onset obat yang pendek. Hal ini disebabkan karena adanya penyerapan yang tinggi pada tubuh ikan patin. Xilazin akan terabsorbsi melalui insang dan akan memberikan efek berupa pendepresan pada medulla spinalis. Sementara itu, onset kerja xilazin juga dipengaruhi oleh bobot badan ikan patin. Semakin besar bobot badan ikan, maka onset kerja xilazin akan lebih pendek dibandingkan dengan ikan yang mempunyai bobot badan rendah.
Ikan patin mulai mengalami anastesi ditandai dengan mulai berkurangnya kesadaran ikan patin, tidak seimbangnya gerakan renang ikan, tonus otot mulai hilang, refleks mulai hilang ketika diberikan rangsangan berupa sentuhan, dan hilangnya respons rasa sakit pada ikan patin. Menurut Plumb (2005), sifat suatu obat anastesi bergantung pada kelarutannya di dalam lemak, ikatan dengan protein, difusi pada jaringan, dan efek vasodilatasi.
Durasi pemberian xilazin
Durasi anastetikum merupakan waktu kerja obat saat hewan teranastesi sampai dengan hewan menunjukkan tanda-tanda kesadaran (recovery). Hal ini berarti ditandai dari mulai ikan patin teranastesi sampai ikan patin mulai pulih kembali (Hitner 1999). Durasi pemberian xilazin mencapai 90 menit sampai 120 menit. Periode recovery setelah pemberian xilazin mencapai 120 menit sampai 240 menit pada hewan kecil (Daelami 2002). Selanjutnya gambar ikan patin yang
24
Gambar 4 Ikan patin yang mulai pulih (recovery).
Rataan hasil pengamatan durasi anastesi pada ikan patin akibat pemberian senyawa xilazin pada media perendaman dosis 0, 10, 20, 30, 40, dan 50 ppm disajikan pada Tabel 2.
Tabel 2 Rataan durasi anastesi pada ikan patin yang direndam pada media dengan xilazin pada berbagai dosis
Dosis xilazin (ppm) Durasi (menit)
0 0 10 147,0 ± 24,8a 20 137,9 ± 29,5ab 30 183,7 ± 39,8b 40 229,2 ± 19,7c 50 256,2 ± 30,5c
Keterangan : Huruf superskrip yang sama pada masing-masing kolom menunjukkan tidak berbeda nyata (p<0,05).
Durasi anastesi paling panjang ditunjukkan oleh ikan patin yang direndam dalam media dengan dosis xilazin 50 ppm. Sementara itu, durasi terpendek ditunjukkan oleh ikan patin yang direndam dalam media dengan dosis xilazin 20 ppm. Durasi anastesi ikan patin yang direndam pada media dengan dosis xilazin 10 ppm menurun menuju durasi ikan patin pada media perendaman dengan dosis xilazin 20 ppm. Durasi anastesi terpanjang dapat memberikan gambaran lamanya anastesi berlangsung. Oleh karena itu, dengan durasi terpanjang sebesar 256 menit maka anastesi dapat diberikan minimal setiap 4 jam pada saat transportasi
25
berlangsung. Metode ini dilakukan dengan cara memberikan sediaan anastesi pada media recovery setelah ikan berada pada fase recovery total. Selanjutnya setelah ikan patin teranastesi kembali, ikan patin dipindahkan ke dalam media
recovery yang baru. Berdasarkan data yang disajikan pada Tabel 1 bahwa semakin
besar dosis anastetikum yang diberikan maka semakin lama durasi obatnya. Menurut Plumb (2005), semakin tinggi dosis pemberian suatu obat maka durasi anastesinya juga akan semakin tinggi. Hal ini bertentangan dengan hasil pengamatan rataan durasi pada dosis 20 ppm yang mengalami penurunan dari hasil rataan durasi perlakuan sebelumnya. Perbedaan tersebut dapat terjadi akibat beberapa hal ialah kekurangtelitian peneliti dalam mengamati tahapan pemulihan (recovery) ikan patin, adanya pengaruh perubahan suhu lingkungan yang terjadi selama penelitian, dan lain-lain. Sementara itu, kontrol menunjukkan hasil rataan durasi sebesar 0. Hal ini terjadi karena ikan patin tidak mengalami perlakuan dan hanya direndam dengan menggunakan air mineral biasa tanpa adanya penambahan xilazin.
Berdasarkan hasil analisa statistik dapat diketahui bahwa H0 dapat diterima dan H1 ditolak, hal ini membuktikan bahwa dosis xilazin memengaruhi lamanya onset. Pengambilan hasil hipotesa tersebut berdasarkan nilai sigifikasi (p<0,05) yang menunjukkan hasil yang berbeda nyata. Kelompok dengan hasil uji berbeda nyata menunjukkan bahwa perbedaan jumlah dosis xilazin yang dilarutkan dalam media akan menghasilkan durasi anastesi yang relative berbeda pada ikan patin. Sementara itu, data hasil uji yang tidak berbeda nyata menunjukkan bahwa perbedaan jumlah dosis xilazin yang dilarutkan pada media akan menghasilkan durasi anastesi yang relatif sama pula bergantung pada dosis masing-masing.
Menurut Hitner (1999) tanda-tanda pemulihan (recovery) dari efek suatu senyawa anastesi, yaitu pulihnya kemampuan suatu individu untuk merespons rangsangan dari luar. Hal ini dapat terlihat dari perilaku ikan patin setelah beberapa menit dipindahkan ke dalam air mineral tanpa xilazin. Kesadaran ikan patin mulai muncul, ikan patin mulai berenang dengan posisi tubuh bertahap dari mulai tidak beraturan sampai seimbang kembali, tonus otot mulai berfungsi
26
kembali, adanya refleks setelah diberikan rangsangan sentuhan, dan respons rasa sakit mulai muncul ketika diberikan rangsangan.
Kematian pada ikan patin
Faktor-faktor yang memengaruhi kematian pada ikan patin ialah kekurangan oksigen, kelebihan CO2, kelebihan sisa metabolisme, dan akibat kerusakan fisik pada tubuh ikan. Kematian pada ikan dapat diakibatkan pula karena meningkatnya kadar CO2 dalam air, sehingga menyebabkan menurunnya pH air. Penurunan pH mempunyai risiko meningkatnya proses ionisasi molekul amonia yang bersifat toksik bagi ikan pada kadar yang tinggi. Kadar amonia 15 hingga 60 mg/L dapat menyebabkan kematian pada ikan (Hernowo 2001). Selanjutnya gambar kematian pada ikan patin dan hasil rataan kematian ikan setelah pemberian xilazin disajikan pada Gambar 5.
Gambar 5 Ikan patin dalam kondisi mati.
Rataan hasil pengamatan kematian ikan patin akibat pemberian senyawa xilazin pada media perendaman dengan dosis 0, 10, 20, 30, 40, dan 50 ppm disajikan pada Tabel 3.
27
Tabel 3 Rataan tingkat kematian ikan patin yang direndam pada media dengan xilazin pada berbagai dosis
Dosis xilazin (ppm) Rataan kematian (%) 0 0 10 8,8 ± 0,1a 20 5,6 ± 0,04a 30 4,0 ± 0,04a 40 0 ± 0a 50 0,8 ± 0.01a
Keterangan : Huruf superskrip yang sama pada masing-masing kolom menunjukkan tidak berbeda nyata (p>0,05).
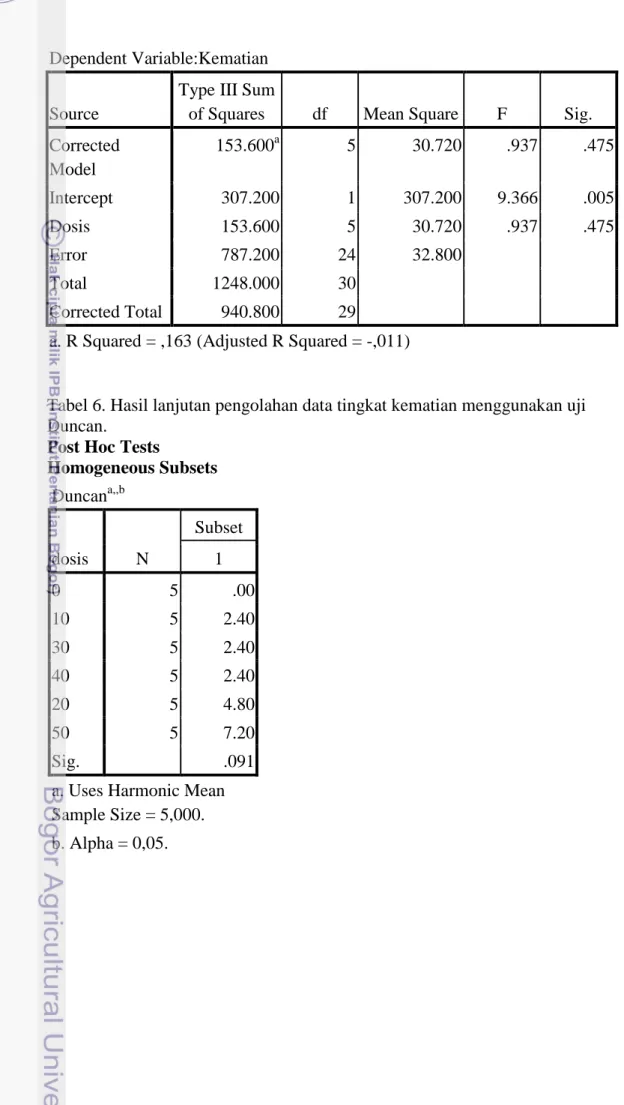
Secara umum, angka kematian ikan patin yang direndam dalam berbagai dosis xilazin (0 hingga 50 ppm) menunjukkan hasil yang tidak berbeda. Tingkat kematian paling tinggi ditunjukkan oleh ikan patin yang direndam pada media dengan dosis xilazin 10 ppm sebesar 8,8%. Sementara itu, tingkat kematian yang paling rendah ditunjukkan oleh ikan patin yang direndam pada media dengan dosis xilazin 40 ppm sebesar 0%. Kematian ikan patin sebesar 0% itu menunjukkan bahwa dosis senyawa xilazin yang digunakan pada air mineral aman untuk digunakan terhadap ikan patin. Hasil pengamatan tingkat kematian ikan patin menunjukkan hasil yang berada di dalam kisaran normal (tidak menunjukkan angka kematian yang tinggi). Menurut literatur, suatu sediaan obat dinyatakan efektif dan aman untuk digunakan apabila tingkat kematiannya maksimal 20% (Velisek et al. 2007). Sementara itu, tingkat kematian pada kontrol adalah 0%. Tidak adanya kematian pada kontrol, karena ikan patin hanya mengalami perendaman dengan air mineral biasa tanpa mengalami pencampuran dengan xilazin. Berdasarkan hasil analisa statistik dapat diketahui juga bahwa H0 dapat diterima dan H1 ditolak, hal ini membuktikan bahwa dosis xilazin memengaruhi lamanya onset. Pengambilan hasil hipotesa tersebut berdasarkan nilai sigifikasi (p>05) yang menunjukkan hasil yang tidak berbeda nyata.
Kematian pada saat pengangkutan dapat disebabkan karena beberapa hal yaitu kekurangan oksigen, kelebihan CO2, kelebihan kotoran (sisa metabolisme), dan akibat kerusakan fisik. Kandungan CO2 pada proses pengangkutan ikan
28
merupakan salah satu faktor penghambat. Kandungan CO2 yang meningkat dalam wadah dapat menyebabkan menurunnya pH, sehingga terjadi peningkatan proses ionisasi molekul amonia. Molekul amonia ini bersifat racun bagi ikan. Kandungan CO2 sebesar 15 sampai dengan 60 mg/L dalam air sudah cukup efektif untuk mengurangi racun amonia (Hernowo 2001).
Pembahasan umum
Obat merupakan senyawa kimia yang digunakan untuk mencegah, mengobati, mendiagnosa penyakit (gangguan) tertentu, dan menimbulkan suatu kondisi tertentu, misalnya membuat seseorang infertil atau melumpuhkan otot rangka selama pembedahan (Suryanto 1998). Menurut Bowser (2001), obat adalah suatu sediaan kimia berbentuk padat, cair atau gas yang dapat menyebabkan terjadinya perubahan fisik dan atau fungsi faal pada tubuh. Hampir semua obat berpengaruh pada sistem saraf pusat. Obat tersebut bereaksi terhadap otak dan dapat memengaruhi pikiran seseorang yaitu perasaan atau tingkah laku, hal ini disebut obat psikoaktif
Salah satu jenis obat yang paling banyak digunakan di antaranya adalah obat bius (anastetikum). Penggunaan obat bius kini tidak hanya digunakan pada hewan besar, tetapi dapat juga digunakan sebagai salah satu alternatif dalam anastetikum pada ikan. Penggunaan obat bius pada ikan harus dilakukan secara hati-hati agar tidak menimbulkan dampak negatif bagi ikan, lingkungan, dan manusia. Perhatian khusus ditekankan pada jenis obat bius, dosis, cara penyimpanan obat yang digunakan, ukuran ikan, limbah yang dihasilkan dan efek residunya pada ikan. Beberapa jenis obat bius yang biasa digunakan pada ikan, yaitu novacaine (50 mg/kg ikan), amobarbital sodium (85 mg/kg ikan), barbital sodium (50 mg/kg ikan), sodium amital (52 hingga 172 mg/kg ikan), tertiary amil alkohol (2 mg/4,5 L air), methyl paraphynol (1 hingga 2 ml/4,5 L air), chloral hidrat (3-3,5 g/4,5 L air), hidroksi quinaldine (1 ppm), tricaine methane sulphonate atau MS- 222 (2,5 ppm), urethane (100 ppm), thiouracil (10 ppm), quinaldine (5 hingga 10 ppm), phenoxyethanol, benzocaine, dan minyak cengkih (Hernowo 2001).
29
Pemilihan jenis dan dosis obat bius berfungsi agar tujuan penggunaan obat bius dapat tercapai secara efisien, ekonomis, dan aman. Akhir-akhir ini penggunaan obat bius dalam media angkut banyak dipraktikkan di masyarakat. Beberapa keuntungan penggunaan obat bius antara lain mengurangi stres pada ikan, mengurangi konsumsi oksigen, mengurangi produksi CO2, mengurangi gerakan ikan sehingga dapat menekan kerusakan fisik ikan, dan menghemat waktu penanganan ikan. Penggunaan obat bius lebih disarankan pada transportasi benih, tetapi untuk ikan dengan tujuan konsumsi penggunaan obat bius hanya diperbolehkan pada saat dirasa sudah mendesak (Hernowo 2001). Selain itu, menurut Hernowo (2001) hal-hal yang harus diperhatikan dalam memberikan anastesi pada ikan patin yaitu jenis obat yang diberikan, dosis pemberian obat bius, cara penyimpanan obat bius yang digunakan, ukuran ikan, serta limbah dan efek residunya pada ikan
Secara umum anastesi dibagi menjadi dua kelompok besar, yaitu anastesi lokal dan general. Anastesi lokal adalah obat yang menghambat hantaran saraf bila dikenakan secara lokal pada jaringan saraf dengan kadar yang cukup. Obat anastesi yang digunakan sebaiknya tidak bersifat mengiritasi dan tidak merusak jaringan saraf secara permanen. Batas keamanan obat anastesi juga harus lebar, awal kerja obat harus sesingkat mungkin. Sementara itu, masa kerja obat anastesi tersebut harus cukup lama. Senyawa anastesi juga harus larut dalam air, stabil dalam larutan, dan dapat disterilkan tanpa mengalami perubahan. Anastesi general merupakan suatu anastesi yang dikontrol dan secara tidak sadar dapat bersifat
reversible. Pemberian anastesi dapat dilakukan secara injeksi atau per inhalasi.
Karakteristik dari anastesi general yaitu hilangnya efek rasa sakit, memori, reseptor motor untuk stimuli, atau pun respons terhadap refleks. Idealnya, pemberian anastesi general harus diberikan tanpa adanya pengaruh pada sistem vital, sistem respirasi dan sistem sirkulasi. Hal-hal yang harus diperhatikan dalam pemberian anastesi general ialah pemilihan obat yang tepat, pemberian yang tepat dan hati-hati, dan monitor yang konstan (Bowser 2001). Menurut Scott (2009), tanda-tanda anastesi pasca pemberian senyawa anastesi ialah menurunnya aktivitas (gerakan dan motilitas) ikan, menyebabkan relaksasi otot, pelebaran pada pupil mata (efek okular), dan keseimbangan gerak renang ikan terganggu
30
Bentuk sediaan dan cara pemberian merupakan penentu dalam memaksimalkan proses absorbsi obat oleh tubuh karena keduanya sangat menentukan efek biologis suatu obat seperti absorpsi, kecepatan absorpsi dan bioavailabilitas (total obat yang dapat diserap), cepat atau lambatnya obat mulai bekerja (onset of action), lamanya obat bekerja (duration of action), intensitas kerja obat, respons farmakologik yang dicapai serta dosis yang tepat untuk memberikan respons tertentu (Ahyari 2007). Selain itu, Ahyari (2007) mengungkapkan bahwa obat sebaiknya dapat mencapai reseptor kerja yang diinginkan setelah diberikan melalui rute tertentu yang nyaman dan aman seperti suatu obat yang memungkinan diberikan secara intravena dan diedarkan di dalam darah langsung dengan harapan dapat menimbulkan efek yang relatif lebih cepat dan bermanfaat.
Media yang digunakan untuk melarutkan senyawa anastesi xilazin dalam penelitian yaitu air mineral yang terstandar. Penggunaan air mineral yang terstandar ini bertujuan untuk meminimalkan risiko kesalahan pada saat penelitian dilakukan. Tetapi, kondisi di lapangan untuk transportasi biasanya dapat menggunakan air sumur, air ledeng, dan air PAM tergantung dari tempat asal ikan yang akan ditransportasikan. Hal ini menjadi salah satu alasan penggunaan air mineral terstandar dalam penelitian.
Menurut Daelami (2002) faktor-faktor fisika dan kimia yang memengaruhi pemberian obat dan anastesi, yaitu spesies, kondisi ikan, dan kualitas air. Spesies ikan di antaranya bobot badan ikan, umur ikan, dan kandungan lemak dalam tubuh ikan yang berpengaruh pada absorbsi senyawa anastesi yang diberikan. Sementara itu, menurut literatur lain spesies ikan yang mempunyai pengaruh terdiri atas umur, bobot badan, jenis kelamin, persentase lemak, variasi genetik, tingkat emosi, dan kehadiran penyakit (Hitner 1999). Kondisi ikan dapat menjadi lemah antara lain dapat disebabkan oleh cara perawatan yang buruk sehingga ikan menjadi stres, pemberian pakan yang tidak mencukupi, dan komposisi pakan yang tidak mencukupi. Lemahnya kondisi ikan dapat menyebabkan peningkatan risiko kematian ikan pada saat dilakukan anastesi.
Kualitas air terdiri atas suhu air, keadaan pH, kandungan oksigen terlarut, gas amonia (NH3), kandungan belerang, zat beracun, dan pestisida. Ikan