BAB I PENDAHULUAN
I.1 Latar Belakang
Destilasi adalah proses pemisahan secara fisik yang berdasarkan atas perbedaan titik didih dan sedikitnya dibutuhkan dua komponen proses pemisahan tidak dapat dilakukan apabila kedua komponen memiliki komponen titik didih yang sama. Kondisi ini disebut dengan azeotrop. Height Equivalent of Theoritical Plate ( HETP ) terdapat di dalam proses pemisahan, salah satunya adalah proses destilasi. HETP adalah daerah ( stage ) yang mana daerah stage tersebut terdapat 2 fase cair dan uap yang berada di dalam setimbang.
Prosedur percobaan dari praktikum kolom berpacking ini adalah pertama mengkalibrasi alcohol 96%. Kemudian membuat alcohol 25% dengan mengencerkan alcohol 96% dengan aquades. Setelah itu alcohol 25% dimasukkan ke dalam labu leher tiga. Kemudian serangkaian alat destilasi dipasang. Alcohol 25% dipanaskan hingga terjadi boil up rate dan timbul destilat. Kemudian tunggu hingga beberapa saat hingga keadaan steady. Lalu amati suhu, volume destilat yang diperoleh ditimbang dengan piknometer. Catat pressure drop dan sample diambil dari atas dan bawah dengan volume 10 cc dan menentukan kadarnya. Hasil percobaan ditabelkan dan menentukan nilai HETP.
Tujuan dari percobaan ini adalah untuk menentukan nilai Height Equivalent of Theoritical Plate ( HETP ) oleh suatu plate teoritis atau ekivalen dengan satu plate teoritis pada suatu komposisi yang sama. Selain itu, untuk mengetahui pressure drop dan konsentrasi dari destilat yang diperoleh.
I.2 Tujuan
1. Menentukan nilai Height Equivalent of Theoritical Plate ( HETP ) 2. Untuk menentukan jumlah plate teoritis
I.3 Manfaat
1. Agar dapat mengetahui konsentrasi dari destilat yang diperoleh
2. Agar dapat mengetahui hubungan antara variasi konsentrasi dari alcohol yang digunakan dengan banyak destilat yang diperoleh
3. Agar dapat mengetahui metode penentuan jumlah plate teoritis
BAB II
TINJAUAN PUSTAKA II.1 Secara Umum
Height Equivalent of Theoritical Plate atau sering disebut HETP, banyak terdapat proses pemisahan seperti dalam menara destilasi, proses absorpsi dan proses adsorpsi HETP adalah daerah ( stage ) yang mana daerah stage tersebut terdapat dua fase cair dan uap yang berada dalam keadaan setimbang pada masing – masing fase. Juga dapat dikatakan HETP adalah tempat kontak antara fase cair dan fase uap, sekaligus titik dimana terjadi tingkat akurasi pemisahan yang Page | 2 Teknik Kimia UPN “Veteran” Jawa Timur
merupakan fungsi (stage), atau dapat dikatakan semakin banyak stage maka pemisahan akan semakin berkurang. Konsep dari HETP banyak digunakan dalam proses pemisahan. Contoh alatnya adalah menara destilasi. HETP biasanya digunakan dalam alat – alat yang mana dalam prosesnya terdapat kontak antara fase dan cair. Salah satunya adalah menara distilasi. Dalam menara distilasi terjadi proses pemisahan komponen – komponen tingkat volatilitas setiap komponen dalam larutan tersebut feed berupa fase cair masuk ke dalam menara distilasi dari bagian atas menara sedangkan uap, masuk ke dalam menara distilasi melalui bagian bawah menara. Feed akan melewati tiap plate yang terdapat dalam menara dan uap melalui lubang – lubang yang terdapat dalam plate terus ke atas membawa komponen dalam bentuk gelembung – gelembung dimana terjadi perpindahan masa yang mempunyai titik didih yang sama atau lebih rendah dengan suhu vapour. Begitu seterusnya hingga plate terakhir.
Bubble cap dan sive trays adalah contoh dari plate dan masih banyak plate dengan bentuk lain. Pada perancangan unit alat destilasi number of theoretical plate ditentukan berdasarkan beberapa factor antara lain komposisi umpan (feed) masuk, hasil akhir (output fraction) dan kondisi operasi selama proses. Selain itu oleh aliran refluks. Semakin banyak refluks maka number of theoretical plate akan semakin kecil begitu pula sebaliknya. Disamping itu biaya operasional juga akan menjadi factor penting yang menjadi pertimbangan.
(Ayudwi, 2009)
Distilasi merupakan suatu teknik pemisahan campuran dalam fase cair yang homogeny dengan cara penguapan dan pengembunan sehingga diperoleh destilat / produk destilasi yang relative lebih volatile (mudah menguap) dibandingkan larutan semula yang dimana sukar untuk menguap. Campuran dari masing – masing komponen dapat terpisahkan karena adanya perbedaan titik didih diantara zat – zatnya. Pada proses ini cairan berubah menjadi uap dan merupakan zat yang mempunyai titik didih lebih rendah dari titik didih zat lainnya. Kemudian uap ini didinginkan dalam kondensor yang luarnya ada aliran air yang mengalir dari bawah ke atas sehingga dapat mendinginkan uap Distilasi merupakan suatu
teknik pemisahan campuran dalam fase cair yang homogen dengan cara penguapan dan pengembunan, sehingga diperoleh destilat (produk Distilasi) yang relatif lebih banyak mengandung komponen yang lebih volatil (mudah menguap) dibanding larutan semula yang lebih sukar menguap. Campuran dari masing-masing komponen dapat terpisahkan karena adanya perbedaan titik didih diantara zat-zatnya (Wiratma,dkk, 2003). Pada proses ini cairan berubah menjadi uap yang merupakan zat yang mempunyai titik didih lebih rendah dari titik didih zat lainnya. Kemudian uap ini didinginkan dalam kondensor yang di luarnya ada aliran air yang mengalir dari bawah ke atas sehingga dapat mendinginkan uap. Pada pendinginan ini, uap mengembun menjadi cairan murni yang disebut destilat.
Model ideal Distilasi didasarkan pada Hukum Raoult dan Hukum Dalton. Pemisahan senyawa dengan Distilasi bergantung pada perbedaan tekanan uap senyawa dalam campuran. Tekanan uap campuran diukur sebagai kecenderungan molekul dalam permukaan cairan untuk berubah menjadi uap. Jika suhu dinaikkan, tekanan uap cairan akan naik sampai tekanan uap cairan sama dengan tekanan uap atmosfer. Pada keadaan itu cairan akan mendidih. Suhu pada saat tekanan uap cairan sama dengan tekanan uap atmosfer disebut titik didih. Cairan yang mempunyai tekanan uap yang lebih tinggi pada suhu kamar akan mempunyai titik didih lebih rendah daripada cairan yang tekanan uapnya rendah pada suhu kamar.
Secara umum, Distilasi dapat dibedakan menjadi beberapa macam, yaitu Distilasi sederhana, Distilasi bertingkat (fraksional), Distilasi vakum, Distilasi uap, dan lain sebagainya.
1. Distilasi sederhana
Adalah teknik pemisahan untuk memisahkan dua atau lebih komponen zat cair yang memiliki perbedaan titik didih yang jauh. Selain perbedaan titik didih, juga perbedaan kevolatilan, yaitu kecenderungan sebuah zat untuk menjadi gas.
2. Distilasi Bertingkat/Fraksionasi
Page | 4 Teknik Kimia UPN “Veteran” Jawa Timur
Adalah memisahkan komponen-komponen cair, dua atau lebih, dari suatu larutan berdasarkan perbedaan titik didihnya yang berdekatan
3. Distilasi azeotrop
Memisahkan campuran azeotrop (campuran dua atau lebih komponen yang sulit dipisahkan) biasanya dalam prosesnya digunakan senyawa lain yang dapat memecah ikatan azeotrop tersebut, atau dengan menggunakan tekanan tinggi.
4. Distilasi uap
Adalah teknik pemisahan zat cair yang tidak larut dalam air dan titik didihnya cukup tinggi. Distilasi uap dapat menguapkan senyawa-senyawa ini dengan suhu mendekati 100 °C dalam tekanan atmosfer dengan menggunakan uap atau air mendidih.
5. Distilasi Vakum (Anonim, 2015)
Salah satu metode yang sering digunakan dalam menghitung jumlah stage ideal untuk destilasi dua komponen (binary distillation) adalah dengan menggunakan metode McCabe-Thiele, disamping itu terdapat metode lain yaitu metode ponchon Savarit. Bila dibandingkan dengan metode ponchon savarit, maka metode McCabe – Thiele lebih mudah digunakan karena dengan metode McCabe-Thiele ini kita tidak memerlukan perhitungan Heat Balance ( necara panas ) untuk menentukan jumlah stage yang dibutuhkan. Metode McCabe-Thiele ini mengasumsikan bahwa laju alir molar baik liquid maupun vapour atau L/V konstant, atau dikenal juga dengan istilah Constant Molar Overflow ( CMO ), namun pada keadaan sebenarnya keadaan CMO tidaklah konstant.
Dalam perhitungan theoritical stage ada beberapa tahap yang harus dilakukan , yaitu :
1. Pembuatan kurva kesetimbangan uap cair ( biasanya untuk senyawa atau komponen yang lebih ringan )
2. Membuat garis operasi baik seksi rectifying ( enriching ) maupun stripping
3. Membuat garis umpan / feed ( q-line ), q- line ini akan menunjukkan kualitas dari umpan itu sendiri, apakah dalam keadaan uap jenuh, liquid jenuh dan lain – lain
4. Membuat atau menarik garis stage yang memotong kurva kesetimbangan yang memotong kurva kesetimbangan xy, garis operasi rectifying dan stripping yang diawali dari XD dan berakhir pada XB
a. Membuat kurva Kesetimbangan
Dalam membuat kurva kesetimbangan xy, umumnya kurva dibuat untuk komponen yang lebih ringan, misalkan pemisahan komponen benzene-toluene, maka kurva yang dibuat kesetimbangan xy adalah untuk komponen benzene. jika dalam soal telah tersedia data kesetimbangan xy , maka data tersebut dapat langsung digunakan , namun jika tidak data tersebut harus dibuat terlebih dahulu , terdapat beberapa cara dalam membuat kurva kesetimbangan ini :
a) Dengan menggunakan relatif volatilitas :
Page | 6 Teknik Kimia UPN “Veteran” Jawa Timur
b) Jika diketahui tekanan operasi kolom ( dan biasanya diasumsikan tidak terjadi penurunan tekanan dalam kolom ) maka kurva kesetimbangan dapat dibuat dengan rumusan
b. Membuat Garis Opersi Rectifying
Garis operasi rectifying dapat dijabarkan dengan :
c. Garis operasi stripping
Garis operasi stripping dapat di jabarkan dengan
Dimana :
Lm = laju alir molar liquid stage ke m Vm+1 = laju alir molar uap stage ke m+1 Xm = fraksi liquid ke n+1 komponen ringan XB = fraksi bottom produk komponen ringan B = laju alir molar bottom produk
d. Garis umpan ( q line )
Feed yang masuk ke kolom destilasi dapat dalam berbagai kondisi antara lain : Feed pada kondisi dingin , q > 1
Feed pada kondisi titik gelembung, saturated liquid, q = 1 Feed pada kondisi campuran uap – cair 0 < q < 1
Feed pada kondisi titik embun, saturated vapour q = 0 Feed pada kondisi uap panas lanjut, saturated vapour q < 0 (Anonim, 2012)
Kalibrasi alcohol 96%
Alkohol 25%
Aquadest
Masukkan dalam labu leher 3
Panaskan hingga terjadi boil up rate dan terbentuk destilat
Catat suhu dan pressure drop
Ambil sampel destilat dan hasil bottom
Ukur densitasnya
Menentukan kadarnya
Konstruksi McCabe – Thiele untuk plate teratas tidak bergantung pada kegiatan kondensor. Terlihat diagram neraca bahan untuk plate teratas adalah Xc sesuai dengan sifat – sifat umum garis operasi. Ujung garis ini adalah pada titik (Xc,Yi). Susunan yang paling sederhana untuk mendapat refluks dan hasil berwujud zat cair dan yang paling umum digunakan adalah sebuah kondensor total seperti terlihat pada yang mengkondensasikan semua uap dari kolom untuk dijadikan refluks maupun hasil.
(McCabe, 1987) II.2 Sifat Bahan
1. Air
Rumus molekul : H2O
Massa molar : 18.0153 g/mol
Densitas dan fase : 0.998 g/cm³ (cariran pada 20 °C) 0.92 g/cm³ (padatan) Titik lebur : 0 °C (273.15 K) (32 °F) Titik didih : 100 °C (373.15 K) (212 °F) (Anonim, 2015, “Air”) 2. Alkohol Rumus molekul : C2H5OH
Massa molar : 46,07 g/mol
Penampilan : Cairan tak berwarna
Densitas : 0,789 g/cm3
Titik lebur : −114,3
Titik didih : 78,4
Kelarutan dalam air : tercampur penuh Keasaman (pKa) : 15,9
Viskositas : 1,200 cP (20oC)
(Anonim, 2015, “Etanol”) II.2 Hipotesa
Pada praktikum Height Equivalent of Theoritical Plate (HETP) ini diharapkan diperoleh jumlah plate dalam kolom destilasi dari perhitungan dari data – data suhu, pressure drop dan konsentrasi destilat. Serta mendapatkan nilai HETP yang ekuivalen dengan satu plate.
II.3 Diagram Alir
Page | 8 Teknik Kimia UPN “Veteran” Jawa Timur
BAB III
PELAKSANAAN PRAKTIKUM III.1 Bahan
1. Air 2. Alcohol 25%
III.2 Alat
1. Labu Leher Tiga 2. Thermometer 3. Gelas Ukur 4. Pipet 5. Kondensor 6. Erlenmeyer 7. Statif + klem 8. Piknometer 9. Kompor Listrik 10. Diffider
III.4 Prosedur A. Kalibrasi
1. Ukur volume air sebesar 10ml, kemudian masukkan dalam piknometer 2. Timbang piknometer yang sudah diisi dan catat beratnya
3. Ukur air sebesar 9 ml dan etanol 1 ml, lalu masukkan keduanya dalam piknometer
4. Timbang piknometer yang sudah diisi dan catat beratnya
5. Lakukan prosedur no. 3 dan 4 dengan mengubah volume air menjadi 8 ml dan etanol 2 ml dan seterusnya.hingga volume etanol 10 ml.
B. Destilasi
1. Lakukan pengenceran terhadap etanol 96 % menjadi etanol 25 % 500 ml 2. Masukkan etanol 25 % 500 ml ke dalam labu tiga leher
3. Rangkai alat destilasi yang sudah disiapkan kemudian panaskan hingga terbentuk destilat
4. Ambil 10 cc distilat yang terbentuk dan 10 cc bottom. Masukkan ke dalam piknometer kemudian ditimbang dan dicatat beratnya .Catat pula suhu yang tertera pada kolom dan bottom.
5. Ulangi langkah ke 4 setiap 10 menit hingga 10 kali.
BAB IV
HASIL DAN PEMBAHASAN IV.1 Tabel Hasil Pengamatan
Massa pikno kosong = 12.635 gr Massa pikno air = 20,714 gr
Page | 10 Teknik Kimia UPN “Veteran” Jawa Timur
ρair = 998, 0450 kg/ m3
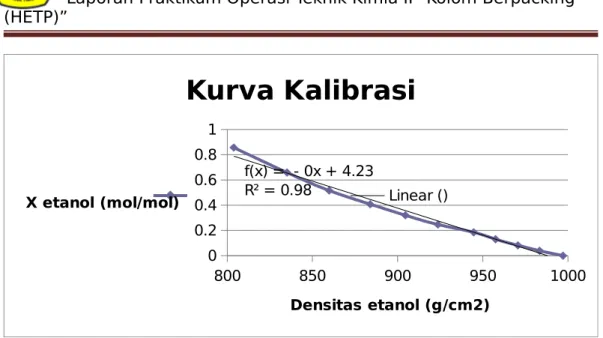
= 0,998 g/ cm3 ρetanol = 990,64 kg/ m3 = 0,99064 g/ cm3 IV.1.1 Pembuatan Kurva Kalibrasi
Vair ( ml ) Vetanol ( ml ) M ( gr ) Xcr ( v/v ) Densitas Etanol (kg/m3) Xcr ( mol / mol ) 10 0 23.083 0 997.04 0 9 1 22.94 0.1 983.39 0.0389 8 2 22.806 0.2 970.61084 0.08198 7 3 22.669 0.3 957.53691 0.13021 6 4 22.534 0.4 944.653 0.18506 5 5 22.314 0.5 923.659 0.24686 4 6 22.114 0.6 904.573 0.31987 3 7 21.898 0.7 883.96 0.40766 2 8 21.645 0.8 859.816 0.51642 1 9 21.386 0.9 835.099 0.65886 0 10 21.056 1 803.799 0.85694
IV.1.2 Data Kesetimbangan Uap – Cair Sistem t T kolom T labu m1 piknometer + m1
piknometer + ρ bottom ρ destilat
X bottom (xw) X destilat (xd) (menit) (°c) (°c) campuran destilat campuran bottom (m1/ml) (m2/ml) 10 32 84 20.56 21.01 799.2201259 756.2769549 0.621386605 0.934894353 20 32 84 20.4 21.13 821.9211329 751.291065 0.469069007 0.973444695 30 33 83 20.42 21.23 842.5525292 763.1496731 0.338684008 0.882488775 40 34 84 20.18 21.09 840.1450543 749.7213997 0.353503754 0.985673781 50 34 84 20.13 21.1 852.609953 754.9098166 0.277901589 0.945420387 60 33 85 20.02 21.08 869.9292308 760.7374031 0.177499183 0.900785882 70 34 86 19.77 21.05 885.1285658 750.4922539 0.093834751 0.9796626 80 34 87 19.78 20.9 889.6229002 769.0690408 0.069892367 0.838034137 90 35 85 19.41 20.64 885.8318785 749.7202969 0.090064041 0.985682388 100 35 84 19.36 20.43 888.1231602 766.2127328 0.077841417 0.859406358 Page | 12 Teknik Kimia UPN “Veteran” Jawa Timur
IV.1.3 Tabel Volume Destilat dan Bottom pada Akhir Setiap Run No Run Kondisi Refluks Xfed Vdestilat (ml) Vbottom (ml) 1 Total 0.25 10 10 2 Total 0.25 10 10 3 Total 0.25 10 10 4 Parsial 0.25 10 10 5 Parsial 0.25 10 10 6 Parsial 0.25 10 10 7 Parsial 0.25 10 10 8 Parsial 0.25 10 10 9 Parsial 0.25 10 10
IV.2 Tabel Perhitungan HETP (Height Equivalent of Theoritical Plate)
IV.3 Grafik
Page | 14 Tinggi Kolom
(cm) Jumlah Plate HETP
800 850 900 950 1000 0 0.2 0.4 0.6 0.8 1 f(x) = - 0x + 4.23 R² = 0.98
Kurva Kalibrasi
Linear () Densitas etanol (g/cm2) X etanol (mol/mol)Grafik 1. Grafik Hubungan Antara X Etanol dengan Densitas Etanol
0 20 40 60 80 100 120 0 0.2 0.4 0.6 0.8 1 1.2
Grafik Xb dan Xd terhadap waktu
xb xd
Waktu Xb, Xd (mol/mol)
Grafik 2. Grafik Hubungan Antara Xd, Xb Terhadap Waktu
Page | 15 Teknik Kimia UPN “Veteran” Jawa Timur
IV.4 Pembahasan
Dari grafik diatas tentang kurva kalibrasi densitas etanol dapat dilihat semakin besar nilai densitas etanol maka fraksi mol etanolnya semakin kecil. Didapatkan nilai y = 9E-06x2 - 0.0213x + 11.896 dan R² =0.9849 Sedangkan
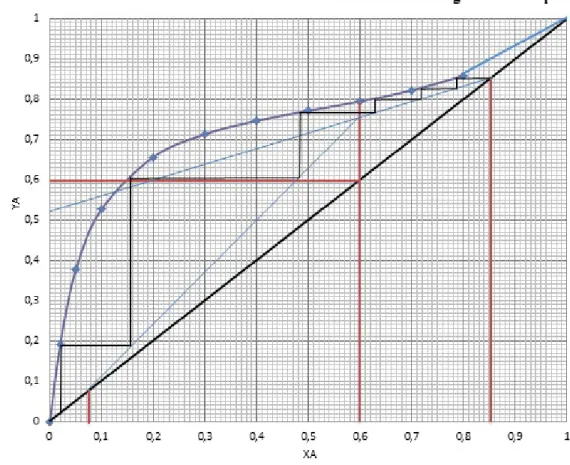
untuk grafik kesetimbangan Uap – Cair Etanol dmulai dimula dari titik Xd yang berpotongan dengan garis x=y dibuat anak tangga dengan batas persamaan garis operasi dengan kurva kesetimbangan. Anak tangga tersebut berakhir pada titik Xw. Jumlah tahap pada refluks parsial adalah jumlah anak tangga yang terbentuk sepanjang Xd dan Xw. Xw dan Xd bernilai masing - masing Xw = 0.077841417 dan untuk Xd sebesar 0.859406358, untuk nilai Xf didapatkan dari perhitungan fraksi mol yang masuk dengan nilai 0,6. Sehingga bila semua di plotkan akan didapatkan plate teoritis sebanyak 6 buah. Dan tinggi HETP 5.3 cm.
BAB V
SIMPULAN DAN SARAN V.1 Simpulan
1. Faktor – faktor yang mempengaruhi dalam praktikum ini yaitu perubahan suhu,perubahan fase,perubahan massa,perubahan panas dan perubahan momentum.
2. Dari grafik kurva kesetimbangan Uap – Cair etanol dan air didapatkan jumlah plate teoritis sebanyak 6 buah.
V.2 Saran
1. Sebaiknya dalam pembacaan manometer harus teliti karena hasil yang didapat akan mempengaruhi hasil perhitungan dan hasil akhir percobaan.
2. Sebaiknya sebelum melakukan percobaan, alat percobaan di cek terlebih dahulu supaya kerusakan/kebocoran dalam alat percobaan dapat diminimalisir.
3. Berhati-hati dalam mengoperasikan kompresor pada saat trial laju alir udara ,karena alat yang digunakan tidak tahan terhadap tekanan tinggi.
DAFTAR PUSTAKA
Anonim, 2012. “Perhitungan Plate Teoritis” (http://cheeng09. blog.com/2012 /01/ 24/perhitungan- theoritical-stage-mccabe-thiele/) Diakses pada tanggal 17 Maret 2016 pukul 13.45 wib
Anonim. 2015. “Air”. (https://id.wikipedia.org/wiki/Air) diakses pada tanggal 17 Maret 2016 pukul 07.00 WIB.
Anonim, 2015. “Distilasi” (
http://mtdp.blogspot.co.id/2015/01/distilasi-jenis-jenisnya.html) Diakses pada tanggal 17 Maret 2016 pukul 07.00 WIB.
Anonym. 2015. “Etanol”. (https”//id.wikipedia.org/wiki/Etanol) diakses pada tanggal 17 Maret 2016 pukul 07.00 WIB.
Ayudwi, 2009.”HETP”.( http://ayudwi32952.blogspot.co.id/) diakses pada tanggal 17 Maret 2016 pukul 07.00 WIB.
McCabe,Warren. L & Smith, Julian. C. 1998. Operasi Teknik Kimia Jilid 2 Edisi Keempat. Penerbit Erlangga : Jakarta
APPENDIX a. Data Literatur
Data Kesetimbangan Uap-Cair yang Diuji Pada Tekanan Praktikum
T (˚C) Xa Ya
79,1 0,8 0,858
80,1 0,7 0,822
81 0,6 0,794 82 0,5 0,771 83,2 0,4 0,746 84,7 0,3 0,713 87,3 0,2 0,656 91,8 0,1 0,527 95,2 0,05 0,377 98,1 0,02 0,192 100 0 0
Sumber : Geankoplis, C.J, 1978, “Transport Process and Unit Operation”, Second Edition, Allyn and Bacon Inc, Boston.
Densitas Air pada Berbagai Temperatur T (˚C) Densitas air
(g/ml)
28 0,97727
Sumber : Perry, JM, Chemical Engineering HandBook, edisi 8, Mc.Graw Hill Book Company Inc, New York, 1950.
Sifat Fisik Etanol dan Air
Mr (g/mol) Tdidih (˚C) Puap (mmHg)
Air 18 100 28,4521
Etanol 46 78,4 76,2812
Sumber : Perry, JM, Chemical Engineering HandBook, edisi 8, Mc.Graw Hill Book Company Inc, New York, 1950.
1. Pengenceran
Etanol 25 % 500 ml %.V1 = %. V2
0.96 . V1 = 0.25 . 500 ml V1 = 130,2 ml
Jadi untuk membuat etanol 25 % 500 ml, diperlukan 130,2 ml etanol 96% yang diencerkan hingga 500 ml dengan aquadest.
2. Densitas etanol
Massa pikno kosong = 12,635 gr Massa pikno air = 23,083 gr
ρair = 997, 0450 kg/ m3 = 0,997 g/ cm3 Untuk densitas bottom pada menit ke 10
ρetanol = massa etanol−massa pikno kosongmassa air−massa piknokosong . ρair ¿ 21.01−12.635 23.083−12.635. 997.045 = 799.2 gr / cm3 ρetanol = 799.2 kg/ m3 = 0,7992 g/ cm3 X ethanol X ethanol =
Kemurnian Etanol x Vol Etanol x ρ Etanol BM Etanol
Kemurnian Etanol x Vol Etanol x ρ Etanol
BM Etanol +
(1−Kemurnian Etanol) x Vol Ai
BM Air x
Vol Air x ρ Air BM Air ¿ 0.96 x 1 x 789,3 46.06884 0.96 x 1 x 789,3 46.06884 + (1−0.96) x 9 18 x 9 x 997 18 = 0.0389 kg/ m3 3. Densitas Bottom
Untuk densitas bottom pada menit ke 10
ρbottom = massabottom−massa pikno kosongmassa air−massa piknokosong . ρair \ ¿ 21.01−12.635
23.083−12.635. 997.045 = 799.2 kg / cm3
4. Densitas Distilat
Untuk densitas bottom pada menit ke 10
ρdistilat = massa distilat−massa pikno kosongmassa air−massa pikno kosong . ρair ¿ 20.56−12.635
23.083−12.635x 997.045 = 756.277 kg / m3
5. Menghitung Fraksi Mol pada Destilat Untuk ρ destilat pada menit ke 10
Xet , D=9.106(0.756 )2−0.0213 .(0.756 )+11.896 = 0,934894353
6. Menghitung Fraksi Mol pada Bottom Untuk ρ bottom pada menit ke 10
Xet , B=9. 106(0.799)2−0.0213 . (0.799)+11.896=0.621386605 7. Menentukan Refluks Minimum
Intersep= Xd Rm+1
0.6= 0.86 Rm+1 Rm=0.43 8. Menghitung y operasi Yop= Xd (Rm x 1,5)+1 Yop= 0.86 (0.43 ×1.5)+1 ¿0.52
9. Menghitung HETP (Height Equivalent of Theoritical Plate)
HETP= Tinggi Kolom
JumlahTahap Kesetimbangan ¿32
6 =5.33 cm