APLIKASI PROBIOTIK RICA PADA PEMELIHARAAN LARVA UDANG WINDU,
Penaeus monodon DI HATCHERI
Bunga Rante Tampangallo dan Muharijadi Atmomarsono Balai Penelitian dan Pengembangan Budidaya Air Payau Jl. Makmur Dg. Sitakka No. 129, Maros 90512, Sulawesi Selatan
E-mail: [email protected]; [email protected]
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh aplikasi probiotik RICA yang telah diperbanyak dalam media miskin nutrisi untuk diaplikasikan pada pemeliharaan larva udang windu di hatcheri. Penelitian ini terdiri atas 3 tahap penelitian, tahap pertama adalah pengamatan kepadatan isolat probiotik RICA 1, 4, dan 5 pada beberapa jenis media miskin nutrisi. Tahap selanjutnya adalah mengaplikasikan hasil dari tahap pertama pada pemeliharaan larva udang windu di hatcheri dengan perlakuan A = probiotik RICA 4, B = probiotik RICA 5, C = probiotik RICA 1, D = pergiliran probiotik RICA 4, 5, dan 1, dan E = kontrol tanpa probiotik. Hewan uji yang digunakan pada tahap ini adalah naupli udang windu sebanyak 50.000 ekor per perlakuan yang ditebar dalam bak fiber volume 1 ton.Tahap terakhir adalah uji resistensi benur tahap II terhadap Vibrio harveyi.Kepadatan benur PL12 adalah 30 ekor per 2 liter air laut yang ditempatkan dalam stopless kaca. Variabel yang diamati adalah populasi probiotik, sintasan benur PL-12, sintasan benur setelah uji tantang, total sel hemosit, aktivitas prophenoloksidase dan kualitas air media pemeliharaan larva. Hasil penelitian menunjukkan populasi probiotik pada media miskin nutirisi masih cukup tinggi, berkisar 107–108
cfu/mL setelah diinkubasi selama 24 jam di atas inkubator bergoyang. Media perbanyakan bakteri yang dipilih untuk diaplikasikan adalah nutrien broth 10%. Sintasan larva hingga hingga menjadi benur PL12 belum memberikan hasil yang konsisten, rata-rata 15,6±19,35 (E), 14,14±14,998 (B), 12,84±15,320 (A), 12,05±12,625 (C) dan terendah 7,744±7,548 (D). Setelah benur diuji tantang diperoleh sintasan tertinggi pada perlakuan A (66,67±8,823) diikuti oleh kontrol (58,89±28,348), C (58,89±12,619), B (56,89±5,976) dan D (50±24,039). Total sel hemosit tertinggi ditemukan pada perlakuan B (8,32±3,633 sel/mL), C (7,8±1,693), A (7±1,089), D (4,56±0,668) dan E (3,84±1,1 sel/mL). Aktivitas prophenoloksidase tertinggi di benur perlakuan B (0,007±0,005Abs), C (0,007±0,001Abs), E (0,007±0,003), A (0,005±0,002Abs) dan D (0,004±0,003Abs). Selama penelitian beberapa parameter kualitas air yang diamati masih berada pada kisaran yang layak untuk produksi benur PL-12.
KATA KUNCI: larva udang windu, probiotik RICA, sintasan PENDAHULUAN
Penggunaan mikroba yang menguntungkan dalam berbagai produk makanan hingga aplikasinya di bidang pertanian dan perikanan telah menjadi suatu alternatif yang dianggap cukup efisien dan efektif. Pada bidang perikanan penggunaan mikroba diharapkan dapat memperbaiki kualitas air seperti
menurunkan kandungan bahan organik, ammonia, nitrit, H2S, mempercepat pembentukan warna air
dan menjaga kestabilan plankton, menghasilkan natural antibiotik dan eksoenzym yang dapat menekan kandungan vibrio/bakteri merugikan dalam air sehingga dapat menekan timbulnya kasus penyakit, menghasilkan enzym dan nutrisi esensial yang sangat dibutuhkan oleh udang, sebagai antivirus dan meningkatkan respon imun cultivan (Balcazar et al., 2006).
Beberapa jenis bakteri Bacillus diketahui tidak patogen (Fox, 2001).Penggunaan bakteri Bacillus sp. di bidang akuakultur diketahui dapat mengurangi vibrio patogen, meningkatkan kualitas air, sintasan dan pertumbuhan serta kesehatan juvenil udang windu (Dalmin et al. dalam Balcazar et al., 2006). Penggunaan B. subtilis dalam pakan juvenil udang vanamei selama 28 hari dapat mengurangi
mortalitas juvenil setelah dipapar Vibrio harveyi 105 CFU/mL selama 24 jam (Anonim, 2013). Muliani
et al. (2006) telah berhasil mengisolasibakteri Brevibacillus BT951 yang dapat meghambat bakteri patogen, Bacillus subtilis BM12 dan Bacillus licheniformis BM58 dari makroalga yang bersifat bakteri Gram positif, dapat menghasilkan enzim amilase dan protease (Tampangallo et al., 2013). Isolat-isolat
ini merupakan bagian dari koleksi bakteri probiotik RICA yang telah diketahui dapat meningkatkan sintasan dan produksi juvenil udang windu (Atmomarsono, 2013).
Pengembangan penggunaan probiotik RICA telah diaplikasikan pada pemeliharaan larva udang windu mulai dari stadia 4 pasca larva (PL4) yang diketahui dapat meningkatkan resistensi benur setelah diberikan selama 21 hari lalu dipapar bakteri patogen Vibrio harveyi (Tampangallo et al., 2012). Penggunaan probiotik RICA pada pemeliharaan larva udang windu, khususnya aplikasi sejak fase zoea hingga pasca larva 12 (PL12), masih mengalami kendala oleh karena media kultur probiotik (nutrien broth) yang digunakan untuk memperbanyak bakteri probiotik ikut dimasukkan dalam wadah pemeliharaan (Tampangallo et al., 2015). Hal ini menyebabkan tingginya amoniak dalam bak pemeliharaan larva, oleh karena itu upaya untuk mencari alternatif media kultur untuk perbanyakan bakteri probiotik yang rendah kandungan nutriennya namun dapat meningkatkan populasi bakteri probiotik perlu dilakukan dan diaplikasikan pada pemeliharaan larva udang windu di hatcheri.
Penelitian ini bertujuan untuk mengetahui kepadatan populasi probiotik RICA dalam media miskin nutrisiyang berbeda setelah inkubasi seharianserta efektifitas penggunaannya pada pemeliharaan larva udang windu (P. monodon) di hatcheri.
METODE PENELITIAN
Penelitian ini dilakukan melalui beberapa tahap. Tahap pengamatan pertumbuhan bakteri probiotik dan uji resistensi benur terhadap bakteri patogen V. harveyi dilakukan di Laboratorium Kesehatan Ikan dan Lingkungan sedangkan aplikasi bakteri probiotik dilakukan di Instalasi Perbenihan Udang Balai Penelitian dan Pengembangan Budidaya Air Payau, Maros dan Barru.
Pengamatan Pertumbuhan Probiotik
Pengamatan pertumbuhan bakteri probiotik yang akan digunakan pada pemeliharaan larva udang windu di hatcheri dirancang menggunakan rancangan acak lengkap pola faktorial 5×7×3 ulangan. Variabel bebas terdiri atas 5 jenis media tumbuh dan waktu inkubasi ( 1, 3, 6, 9, 12, 24, dan 48 jam inkubasi) sedangkan variabel terikat adalah koloni bakteri yang tumbuh (CFU/mL). Tahapan penelitian meliputi:
Persiapan Media Uji
Media tumbuh yang digunakan adalah jenis media yang biasa digunakan di Laboratorium Kesehatan Ikan dan Lingkungan Balitbang Budidaya Air Payau Maros, yakni A = Nutrien Broth 100% (Nutrien Broth 8g/L+NaCl 1,5%, akuades), B = Nutrien Broth 10% (0,8g/L+NaCl 1,5%, akuades), C = artificial sea water (NaCl 52,7g, KCl 2,25g, Na2SO4 0,825g, MgCl2.6H2O 15,24g, CaCl2.2H2O 0,436g, akuades 1L), D= sea water complex 10% (akuades 250 mL, air laut 750 mL, bacto pepton 0,5 g, yeast extract 0,1 g, gliserol 0,3 mL), dan E = air laut 28 ppt. Semua media uji dibuat masing-masing dalam volume 100 mL dan dimasukkan dalam wadah erlenmeyer lalu disterilkan dengan menggunakan
autoclave pada suhu 121ïC, tekanan 1 atm selama 15 menit.
Pengaktifan Isolat Bakteri
Isolat bakteri B. subtilis BM12, B. licheniformis BM58, dan Brevibacillus BT951 yang akan digunakan terlebih dahulu diaktifkan oleh karena telah disimpan selama ± 1 tahun dalam media skim milk 2%
pada suhu -80ïC. Pengaktifan isolat ini dilakukan dengan cara mengambil 50 µL stok isolat yang ada
dalam skim milk kemudian diinokulasi pada media TSA plate lalu diinkubasi selama 24 jam pada suhu ruang. Koloni bakteri yang tumbuh lalu dipanen dan diinokulasi ke dalam 400 mL nutrien broth. Kultur ini kemudian diinkubasi di atas shaker inkubator selama 24 jam.
Pengamatan Viabilitas dan Populasi Bakteri
Kultur baru tadi diinkubasi selama ± 17 jam di atas shaker inkubator lalu dibagi-bagi sebanyak 10 mL per media uji, kemudian diinkubasi kembali. Pengamatan pertumbuhan bakteri dilakukan dengan mengambil 1 mL sampel dari masing-masing media uji lalu dimasukkan ke dalam botol yang telah
pada sampling 1, 3, dan 6 jam inkubasi sedangkan untuk sampling 9, 12, 24, dan 48 jam inkubasi
pengenceran dilakukan hingga 10-5. Sebanyak 0,1 mL sampel dari pengenceran tertinggi pertama
dan kedua dari masing-masing media dan jam pengamatan diinokulasikan ke dalam media TSA lalu diinkubasi selama 48 jam. Perhitungan populasi bakteri dilakukan secara manual, dengan menghitung koloni bakteri yang tumbuh. Tabulasi data dilakukan dengan menggunakan rumus :
di mana:
P = populasi bakteri probiotik (CFU/mL)
Q = jumlah total bakteri yang tumbuh dalam satu tingkat pengenceran (koloni) T = jumlah plate yang digunakan
S = tingkat pengenceran
V = volume sampel yang ditanam (mL)
Aplikasi Probiotik Pada Pemeliharaan Larva Udang windu di Hatcheri
Penelitian ini didesain dengan menggunakan Rancangan Acak Kelompok (RAK) dimana waktu menjadi kelompok, dengan 5 perlakuan dan 3 ulangan. Perlakuan yang diujikan adalah:
A : bakteri probiotik BM 12 B : bakteri probiotik BM 58 C : bakteri probiotik BT951
D :pergiliran BM12, BM58 dan BT951
E : kontrol (pemeliharaan larva udang windu tanpa bakteri probiotik).
Probiotik yang digunakan pada penelitian ini adalah media nutrien broth 10%. Pada unit ini larva udang windu dipelihara dalam bak fiber volume 1 ton yang dilengkapi dengan alat-alat aerasi sebagai sumber oksigen. Naupli ditebar sebanyak 50 ekor/liter. Pemberian pakan dan prosedur pemeliharaan larva lainnya dilakukan dengan mengacu pada protap yang telah ada. Pemberian bakteri probiotik
sebanyak 1 L per bak (asumsi kepadatan bakteri probiotik dalam bak 104 sel/mL), dilakukan pada
awal penelitian dan selanjutnya setiap 3 hari, sesuai perlakuan. Pemberian probiotik dilakukan setiap hari setelah larva memasuki fase post larva (Tampangallo et al., 2009).
Variabel yang diamati pada tahap ini adalah sintasan larva dihitung pada setiap stadia larva udang dengan cara disampling dan diakhir penelitian, populasi bakteri vibrio dan total bakteri, suhu, salinitas, oksigen terlarut, pH, redoks, Nitrit, Nitrat, dan Amonium dilakukan setiap 3 hari.
Uji Resistensi Benur PL12
Uji resistensi benur yang dihasilkan dilakukan untuk mengetahui kualitas larva. Uji resistensi dilakukan dengan melakukan uji tantang beberapa ekor benur PL-12 dari masing-masing perlakuan yang dihasilkan pada akhir penelitian. Uji resistensi juga menggunakan rancangan acak kelompok. Benur PL-12 dari setiap perlakuan per ulangan diambil sebanyak 30 ekor dan dimasukkan ke dalam stoples yang telah berisi air laut steril sebanyak 2 liter per stopless. Setiap stopless dilengkapi dengan
aerasi. Uji tantang menggunakan V. harveyi 106 CFU/mL (Kadriah, 2010). Variabel yang diamati adalah
sintasan, total hemosit, dan prophenoloksidase pada akhir pengamatan.
Pengamatan variabel
Sintasan dihitung dengan menggunakan rumus Effendi (1997):
V
1
x
S
1
x
T
Q
P
=
100%
x
N
N
SR
o t=
di mana:
SR = survival rate Nt = kepadatan akhir No = kepadatan awal
Pengamatan bakteri dilakukan dengan mengisolasi bakteri vibrio dan total bakteri dalam bak air larva. Sampel air diambil dengan menggunakan botol steril lalu diencerkan hingga pengenceran 10 -2 dengan menggunakan larutan fisiologis. Sampel asli dan pengenceran 10-1 diinokulasi ke media TCBSA sebanyak 0,1 mL sedang pengenceran 10-1 dan 10-2 diinokulasi sebanyak 0,1 ml ke media TSA. Sampel ini kemudian diinkubasi selama 24-48 jam pada suhu ruang lalu diidentifikasi morfologi dari setiap koloni yang tumbuh.
Pengaruh dari penggunaan probiotik terhadap larva dianalisa dengan melihat aktifitas dari sistem imun pada udang, yakni: total hemolim (THC) diambiI dari 5-10 ekor benur udang windu yang digerus dalam tabung eppendorf ditambahkan antikoagulan(Na-sitrat 3,8%.) sebanyak 1 mL. Campuran dihomogenkan lalu cairan disedot dengan menggunakan pipet tetes. Tetesan pertama dibuang, dan tetesan selanjutnya diteteskan ke haemositometer (Improved Neubauer type). Jumlah sel hemosit dilihat dan dihitung di bawah mikroskop cahaya binokuler dengan pembesaran 100 kali (Rantetondok et al., 2004).
Aktivitas phenoloksidase diukur dengan menggunakan spektrofotometer. Pengamatan dilakukan dengan melihat perekaman pembentukan dopachrome yang dihasilkan dari L-dihydroxyphenil alanine (L-DOPA) seperti yang dijelaskan oleh Liu & Chen (2004).
Analisis Data
Analisis statistik dengan menggunakan bantuan SPSS 19 dilakukan untuk mengetahui pengaruh dari penggunaan jenis media yang digunakan dan lama inkubasi. Analisis lebih lanjut untuk mengetahui perbedaan dari perlakuan digunakan uji BNT (Fisher, 1935). Data kualitas air yang diamati dianalisis secara deskriptif.
HASIL DAN BAHASAN Kepadatan Probiotik RICA
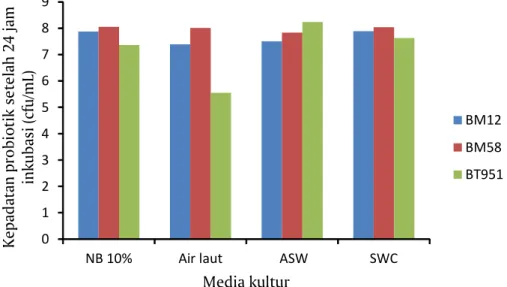
Populasi probiotik RICA 1, 4, dan 5 dalam media miskin nutrisi yang digunakan dapat dilihat pada Gambar 1. Pada umumnya semua isolat probiotik RICA dapat tumbuh/diperbanyak dalam media uji dimana pada media nutrien broth 10% RICA 1 dapat tumbuh hingga 2,3x107 cfu/mL, RICA4 7,8x107
0 1 2 3 4 5 6 7 8 9
NB 10% Air laut ASW SWC
K ep ad at an p ro b io ti k se te lah 2 4 j am in ku b as i (c fu /m L) Media kultur BM12 BM58 BT951
Gambar 1. Kepadatan isolat probiotik Bacillus subtilis BM12 (A), Bacillus licheniformis BM58 (B) dan Pseudoalteromonas BT951 (C) pada media kultur setelah 24 jam diinkubasi
cfu/mL, RICA5 1,13x107 cfu/mL. Demikian halnya dengan media air laut masing-masing 3,58x105 cfu/
mL, 2,438x107 cfu/mL dan 1,038x108 cfu/mL; pada media ASW 1,738x107 cfu/mL, 3,218x107 cfu/mL
dan pada media SWC10% 4,298x107 cfu/mL, 7,788x107 cfu/mL serta 1,098x108 cfu/mL.
Pola pertumbuhan bakteri B. subtilis BM12, B. licheniformis BM58, dan Brevibacillus BT951 pada media uji berbeda-beda berdasarkan jenis media, nutrisi yang terdapat dalam media, pH, suhu dan sebagainya. Pola pertumbuhan bakteri pada umumnya terdiri atas fase adaptasi, fase logaritmik, fase stasioner. Fase adaptasi isolat B. subtilis BM12 terjadi hingga pengamatan 3 jam inkubasi, B. licheniformis (BM58) hingga pengamatan 9 jam inkubasi di semua media, kecuali penggunaan media SWC10%, 3 jam sedang Pseudoalteromonas BT951 hingga pengamatan 9 jam, kecuali penggunaan media nutrien broth 10% hanya memerlukan waktu 3 jam adaptasi. Panjang pendeknya fase sangat ditentukan oleh jumlah sel yang diinokulasi, kondisi fisiologis dan morfologis yang sesuai serta media kultivasi yang dibutuhkan (Scragg, 1991 dalam Yuliana, 2006). Pada penelitian ini, jumlah inokulum yang diberikan semuanya dalam jumlah yang sama dan isolat yang digunakan walaupun
telah disimpan dalam media skim milk pada suhu -80ïC, telah disegarkan kembali dalam media nutrien
broth sebelum digunakan.
Fase logaritmik setiap isolat bakteri probiotik diperoleh setelah 6 jam inkubasi (isolat BM12), setelah 12 jam inkubasi (BM58), dan diatas 12 jam inkubasi pada isolat BT951. Pertumbuhan bakteri/ pembelahan sel bakteri sangat dipengaruhi oleh media tumbuh seperti pH, kandungan nutrien, kondisi lingkungan seperti suhu dan kelembaban udara (Middlebeek et al. dalam Yuliana, 2006).
Suhu optimum untuk pertumbuhan B. subtilis adalah 30-37ïC, minimum 18ïC dan tertinggi 43ïC
(Korsten & Cook, 1996) sedang B. subtilis strain KO adalah 45ïC dan pH 6,5-7,5 (Younis et al., 2010).
Selanjutnya dikatakan bahwa masa inkubasi optimum bakteri tersebut adalah 24 jam dan setelah 36 jam memasuki fase stasioner bila diinokulasi pada media molase broth ditambah gelatin (molase 100 mL, gelatin 10 g, akuades 1000 mL). Fase stasioner pada umumnya diperoleh setelah masa inkubasi di atas 24 jam. Pada umumnya media yang digunakan dapat meningkatkan populasi bakteri sehingga dapat digunakan untuk memperbanyak probiotik RICA.
Aplikasi pada Pemeliharaan Larva
Penggunaan probiotik RICA pada pemeliharaan larva udang windu sejak fase naupli belum memberikan hasil yang konsisten. Pada penelitian ini, pemeliharaan larva sepenuhnya hanya mengandalkan penggunaan probiotik untuk mencengah penyakit dan kontrol tanpa menggunakan probiotik maupun antibiotik. Berdasarkan hasil pada Tabel 1, sintasan larva rata-rata tertinggi masih lebih tinggi pada kontrol lalu disusul dengan perlakuan B, lalu disusul perlakuan A, C, dan D. Hasil pengamatan selama penelitian ini dilakukan menunjukkan ada kecenderungan sintasan benur yang dipelihara dengan menggunakan bakteri probiotik akan lebih tinggi pada saat kondisi kualitas air ataupun ketersediaan pakan alami berupa plankton kurang memadai. Hal ini dapat mengindikasikan kemungkinan probiotik yang diberikan dapat dijadikan sebagai substitusi pakan alami.Tingginya rata-rata sintasan benur pada kontrol kemungkinan disebabkan adanya kerentanan dari larva terhadap air media budidaya, dimana diketahui bahwa larva udang windu hingga stadia zoea masih sangat rentan terhadap perubahan lingkungannya. Fase zoea juga sangat rentan terhadap keberadaan V. harveyi. Mariyono et al. (2002) melaporkan bahwa zoea yang dipapar dengan V. harveyi mulai mati
Tabel 1. Sintasan, resistensi, total sel hemosit dan aktivitas prophenoloksidase benur yang diamati selama penelitian
A B C D E
Sintasan (%) 12,84±15,320 14,14±14,998 12,05±12,625 7,744±7,548 15,6±19,35 Resistensi (%) 66,67±8,823 56,89±5,976 58,89±12,619 50±24,039 58,89±28,348 THC (×106 sel/mL) 7±1,089 8,32±3,633 7,8±1,693 4,56±0,668 3,84±1,1 Prophenoloksidase (A) 0,005±0,002 0,007±0,005 0,007±0,001 0,004±0,003 0,007±0,003
Keterangan; A: RICA 4, B: RICA 5, C: RICA1, D: Pergiliran RICA4, 5, 1, E: kontrol tanpa probiotik.
pada kepadatan bakteri dalam air sebesar 104 CFU/mL dan pada kepadatan 107 CFU/mL, mortalitas
zoea mencapai 40%, mysis 29% dan PL 16%.
Pemberian probiotik BM12 dapat meningkatkan resistensi benur yang diperoleh terhadap bakteri patogen, V. harveyi, (66,67%) dibanding BT951 dan kontrol (58,89%), probiotik BM58 (56,89%) dan pergiliran probiotik (50%). Namun hasil pengamatan terhadap total sel hemosit tertinggi ditemukan
pada perlakuan B (8,32×106 sel/mL) disusul C (7,8×106 sel/mL), A (7,0×106 sel/mL), D (4,56×106 sel/
mL) dan kontrol (3,84×106 sel/mL) sedangkan aktifitas prophenoloksidase tertinggi pada perlakuan
B, C, dan kontrol (0,007A) disusul A (0,005A) dan D (0,004A). Terlihat bahwa belum ada konsistensi dari pengamatan kualitas benur yang didapatkan. Kemungkinan hal ini disebabkan oleh karena pemberian probiotik belum optimal, hanya 12 hari setelah larva memasuki fase pasca larva, mungkin setelah pemberian 60-90 hari telah memberikan hasil yang signifikan (Rengpipat et al., 2000).
Kualitas Air
Kualitas air media pemeliharaan larva udang windu selama penelitian dapat dilihat pada Lampiran
1. Suhu air media pemeliharaan selama penelitian berkisar antara 30,68-31,56ïC. Suhu ini masih
berada pada kisaran yang normal untuk pemeliharaan larva, dimana pada suhu tersebut proses
pergantian stadia dapat berjalan dengan baik, namun bila suhu lebih dari 32ïC dapat menyebabkan
pergantian stadia yang terlalu cepat dan rawan mati. Pada Gambar 2 juga terlihat bahwa pada pengamatan ke-4 (stadia pasca larva 2-3) suhu air cenderung menurun, hal ini kemungkinan disebabkan karena pada stadia ini mulai dilakukan pergantian air yang lebih banyak (±30%). Fluktuasi suhu
1-2oC dapat menyebabkan perubahan kondisi media pemeliharaan dan mengakibatkan rendahnya
respon larva udang memangsa pakan, blooming atau pengendapan plankton. Dampak selanjutnya adalah larva udang menjadi lemah sehingga infeksi sekunder dari bakteri berpendar dapat menyebabkan kematian larva (Wardana et al., 2008). Demikian halnya dengan salinitas, pada pengamatan ke-4 salinitas di setiap perlakuan mengalami penurunan. Hal ini juga disebabkan adanya pergantian air dan pada fase ini digunakan air dari membran filter yang salinitasnya sedikit lebih rendah, akan tetapi salinitas yang terpantau (31,26-31,698o/oo) masih berada dalam kisaran yang sesuai untuk kehidupan larva udang windu. Oksigen terlarut mengalami penurunan sejalan dengan peningkatan stadia larva yang dipelihara. Hal ini disebabkan kebutuhan larva akan oksigen semakin tinggi akan tetapi aerasi yang digunakan untuk menyuplai oksigen tetap jumlahnya. Kadar oksigen terlarut terendah ditemukan pada perlakuan D pada akhir pengamatan yakni 3,93 ppm dan masih dalam kisaran yang layak. Derajat asam-basa air media pemeliharaan tertinggi rata-rata ditemukan pada perlakuan D, titik tertinggi pada pengamatan ke-3 (8,168).Kemungkinan disebabkan interaksi dari pergiliran probiotik yang digunakan, namun masih aman untuk kehidupan larva.
KESIMPULAN
Populasi probiotik setelah diperbanyak pada media miskin nutrisi masih berkisar 107-108 cfu/mL
sehingga pemilihan media perbanyakan isolat probiotik yang dipilih untuk tahap pemeliharaan larva udang windu pada penelitian ini adalah menggunakan nutrien broth 10%.
Aplikasi probiotik RICA pada pemeliharaan larva udang windu mulai dari fase naupli sampai PL-12 belum memberikan hasil yang konsisten, sehingga perlu dikaji waktu aplikasi dan dosis yang sesuai untuk meningkatkan sintasan dan respon imun larva udang windu yang lebih baik.
UCAPAN TERIMA KASIH
Penelitian ini dibiayai dari APBN tahun anggaran 2013 dan pada kesempatan ini penulis mengucapkan terima kasih kepada rekan-rekan peneliti dan teknisi serta tenaga lapang pada laboratorium kesehatan ikan dan lingkungan, Balai Penelitian dan Pengembangan Budidaya Air Payau Maros, Sulawesi Selatan, Indonesia.
DAFTAR ACUAN
Anonim. (2013). Inhibitory Activity of Probiotic Bacillus subtilis UTM 126 Against Vibrio Species Confers Protection Against Vibriosis in Juvenile Shrimp (Litopenaeus vannamei). actifity_bacillus subtilis_juvenile_Bachara.pdf.
Balcazar, J., Luiz, de Blas I., Ruiz-Zarzuela, I., Cunningham, D., Vendral, D., & Muzquiz, J.L. (2006). The role of probiotic in aquaculture. Veterinary Microbiology, 114, 173-186.
Braak, V.D. (2002). Haemocytic defence in black tiger shrimp (Penaeus monodon), Disertation. Van Wareningan University, Germany, 157 hlm.
Fox J. Ryder. (2001). Monograph of Bacillus subtilis strain QST 713. 30 hlml.
Kadriah, I.A.K. (2012). Analisis Keragaman Morfologi, Fisiologi dan Genetik serta Uji patogenitas Isolat-isolat Vibrio sp. Tesis. Sekolah Pascasarjana Institut Pertanian Bogor. Bogor. 127 hlm. Korsten, L., & Cook, N. (1996). Optimizing culturing conditions for Bacillus subtilis. Soth African
Avo-cado Growers’ Association Yearbook, 19, 54-58.
Liu, C.H., & Chen, J.C. (2004). Effect of ammonia on the immune respons of white shrimp Litopenaeus vannamei and susceptibility to Vibrio alginolyticus.Fish and Shelfish Imunology, 16, 321-334.
Mariyono, Wahyudi, A., & Sutomo. (2002). Teknik penanggulangan penyakit udang menyala melalui pengendalian populasi bakteri di laboratorium. Buletin Teknik Pertanian, 7(1), 25-27.
Muliani, Nurbaya, & Atmomarsono, M. (2006). Penapisan Bakteri yang diisolasi dari tambak udang sebagai kandidat probiotik pada budidaya udang windu, Penaeus monodon. J. Ris. Akuakultur, 1(1), 73-85.
Rantetondok, A., Anshary, H., & Galugu A. 2004. Pengaruh Probiotik Bacillus Plus-1 pada dosis berbeda terhadap kualitas air, bakteri Vibrio, sintasan dan total haemocyte post larva udang vannamei (Litopenaeus vannamei). Jur.Torani, 18(4).
Rengpipat, S., Rukpratanporn, S., Piyatiratitivorakul, S., & Menasaveta, P. (2000). Immunity Enhance-ment in Black Tiger Shrimp (Penaeus monodon) by a Probiont Bacterium (Bacillus S11). Aquaculture, 191, 271-288.
Tampangallo, B.R., Atmomarsono, M., & Lante, S. (2009). Frekuensi pemberian probiotik BT-951 pada pemeliharaan udang pama (Penaeus semisulcatus). Prosiding seminar perikanan nasional. Sekolah Tinggi Perikanan. Jakarta.
Tampangallo, B.R., Pakidi, C.S., & Rantetondok, A. (2012). Respon imun pasca larva udang windu (Penaeus monodon) yang dipapar bakteri Vibrio harveyi. Prosiding Ristek, Bandung. 265-269. Tampangallo, B.R., Atmomarsono, M., & Muliani. (2013). Isolasi dan identifikasi bakteri penghasil
enzym amylase, proteinase, kitinase dan selulase dari makroalga. Makalah telah dipresentasikan pada seminar forum inovasi teknologi perikanan di Mataram, 13 hlm.
Yuliana, N. (2008). Kinetika pertumbuhan bakteri asam laktat isolat T5 yang berasal dari tempoyak. Jurn. Teknologi industri dan hasil pertanian, 13(2), 108-116.
Wardana, I.K., Muzaki, A., Fahrudin, Permana, G.N., & Haryanti. (2008). Selektif breeding udang windu Penaeus monodon dengan karakter pertumbuhan dan SPF (Spesific Pathogen Free). Jurn. Riset Akuakultur, 3(3), 301-312.
Lampiran 1. Kualitas air media pemeliharaan larva udang windu P. monodon selama penelitian 30 30,5 31 31,5 32 I II III IV V Suh u ( OC) Sampling ke-A B C D E 7,9 8 8,1 8,2 8,3 I II III IV V pH Sampling ke-A B C D E 0 1 2 3 4 5 6 I II III IV V DO (p pm ) Sampling ke-A B C D E 30,5 31 31,5 32 32,5 I II III IV V Salinitas (ppt) Sampling ke-A B C D E 0 0,5 1 1,5 2 2,5 3 I II III IV V Kadar amoni um (ppm) Sampling ke-A B C D E 0 0,5 1 1,5 2 2,5 I II III IV V Kadar ni tr at (ppm) Sampling ke-A B C D E 0 0,2 0,4 0,6 I II III IV V Kadar nitrat (ppm) Sampling ke-A B C D E