METODOLOGI
Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Kimia SEAFAST, Laboratorium Kimia Pusat Studi BIOFARMAKA, Institut Pertanian Bogor dan Laboratorium Kimia Universitas Sahid Jakarta. Penelitian berlangsung mulai bulan Agustus sampai dengan Maret 2008.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini meliputi bahan untuk membuat ekstrak sayuran, bahan untuk membuat lamtan standar dan bahan-bahan untuk analisa. Bahan-bahan yang digunakan dalam pembuatan ekstrak sayuran indigenous adalah d a m kemangi (Ocimum americanum L), daun katuk (Sauropus androgynus (L.) Merr), daun mangkokan (Nothopanax scutellarius (Burm.f.) Merr), daun kenikir (Cosmos caudatus H.B.K.), daun beluntas (Pluchea indica (L)Less), daun pohpohan (Pilea melastonzides (Poir.) BI), daun antanan (Centella asiatica (L) Urb), daun ginseng (Talinum friangulare (Jacq.) Willd.), bunga kecombrang (Etlingera elatior (Jack) R.M.Sm), daun dan batang krokot (Portulaca oleracea L) dan daun kedondong cina (Polyscias pinnata) yang diperoleh dari pasar lokal yang berada di daerah Bogor, metanol. Bahan-bahan dalam pembuatan larutan standar adalah standar asam galat d a l trolox (6-hydroxy-2,5,7,8- tetramethylchrornan-2-carboxylic acid). Sedangkan bahan-bahan yang digunakan untuk analisa meliputi metanol, etanol, reagent Folii-ciocalteau, Na2C03, DPPH (1.1-diphenil -2-picyhidrazil), buffer asetat, reagent ABTS (2.2'-Azino-bis (3-ethyl-benzhiazoline-6-sulfonic acid), asam linoleat, buffer phosphate pH 7, FeC12, K3Fe(CN),j, ammonium tiosianat, trichloroacetic acid, thiobarbituric acid.
Alat-ala? yang digunakan dalam penelitian ini meliputi alat untuk ekstraksi, alat untuk membuat larutan standar dan alat untuk analisa. Alat untuk membuat ekstrak sayuran terdiri dari freeze dryer, freezer, neraca analitik, blender kering, labu takar, erlenmeyer, gelas ukur, kertas saring Whatman 41, shaker, water bath, vaccumfilter, rotavapor, pipet Mohr, pipet tetes dan pisau. AIat-alat untuk msmbuat larutan standar adalah labu takar, gelas ukur, erlenmeyer, tabung reaksi, pipet tetes, dan spatula. Sedangkan alat-alat yang digunakan untuk analisis terdiri dari spectrofotometer, dan tabung reaksi.
Metode Penelitian
Penelitian ini dibagi dalam dua tahap dengan rincian sebagai berikut: Tahap Persiapan Sampel
Tahapan ini dimulai dengan mengidentifikasi/determinasi sayuran indigenous. Pengidentifikasian sayuran ini dilakukan di Herbarium Bogoriense, bidang botani, Pusat Penelitian Biologi-LIPI, Bogor (Lampiran 20). Pembuatan bubuk sayuran indigenous, ekstraksi komponen antioksidan, dan karakterisasi sifat fisik dan kimia ekstrak sayuran indigenous. Karakterisasi sifat fisik ekstrak antioksidan sayuran indigenous yang diamati meliputi pengamatan terhadap warna ekstrak dan penghitungan rendemen.. Sedangkan karakterisasi sifat kimia yang diamati meliputi analisa kadar air sayuran segar, kadar air bubuk kering, kadar bahan kering ekstrak, dan total fen01 ekstrak antioksidan sayuran indigenous.
Pembuatan Bubuk Sayuran
Sayuran indigenous yang digunakan adalah daun kemangi (Ocimum americanum L), daun katuk (Sauropus androg~nus (L) Men), daun mangkokan (Nothopanax scutellarius (Burm.f.) Merr), daun kenikir (Cosmos caudatus H.B.K.), daun beluntas (Pluchea indica Less), daun pohpohan
(Pilea melastornoides (Poir.) Bl), d a m antanan (Centella asiatica), daun ginseng (Talinurn triangulare (Jacq.) Willd), bunga kecombrang (Etlingera elatior (Jack) R.M.Srn), daun dan batang krokot (Portulaca oleracea) dan d a m kedondong cina (Polyscias pinnata). Bagian tanaman yang digunakan dalam penelitian ini adalah bagian daun yang masih muda (lima pucuk pertama). Bagian tanaman krokot yang digunakan adalah batang dan daunnya, tanaman antanan yang digunakan adalah seluruh bagiannya, sedangkan bunga kecombrang yang digunakan adalah bunga kec0rnbrar.g yang telah mekar. Pernilihan bagian-bagian tersebut didasarkan pada bagian yang biasa diionsumsi oleh masyarakat.
Sayuran-sayuran indigenous tersebut yang diperoleh dari pasar lokal yang berada di daerah Bogor, pertama-tarna disiangi untuk diambil bagian yang akan diteliti, dicuci sarnpai bersih kemudian ditiriskan. Setelah itu sayuran dibekukan dalam freezer selama satu malam untuk memudahkan proses pengeringan vakum. Sayuran yang sudah beku tersebut selanjutnya dikering bekukan dengan alat freeze dryer selama 48 jam. Proses pengeringan dengan cara dibekukan ini mernpunyai kelebihan yaitu dapat mencegah kerusakan atau kehilangan komponen aktif dari sayuran tersebut. Pengeringan ini dirnaksudkan untuk menurunkan kandungan air dari sayuran indigenous sehingga dapat menurunkan efisiensi ekstraksi yang akan dilakukan.
Setelah dilakukan proses pengeringan beku, sayuran tersebut dihancurkan dengan cara diblender, kernudian diayak dengan ayakan berukuran 30 mesh, agar diperoleh bubuk sayuran dengan tingkat kehalusan yang tinggi. Selanjutnya sampel yang berupa bubuk sayuran disimpan cialam freezer. Bagan alir persiapan sampel dapat dilihat pada Garnbar 12.
Sayuran indigenous
I
Penyiangan dan pencucian Pengeringan Beku(Freeze dryer, 48 jam)
Penghancuran sayuran kering
Gambar 12. Bagan alir pembuatan bubuk sayuran indigenous
Ekstraksi Komponen Antioksidan
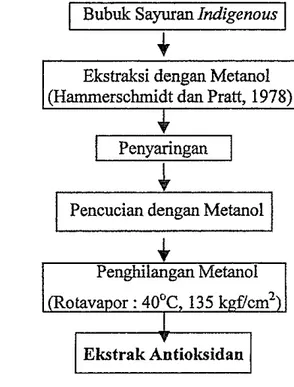
Tujuan dari tahap ini adalah mengekstrak komponen-komponen antioksidan yang tedapat dalam sayuran tersebut. Ekstraksi dilakukan dengan menggunakan metode Harnrnersshcmidt dan Pratt (1978). Ekstraksi dimulai dengan menimbang bubuk sayuran indigenous kering sebaxiyak 6 @am (bk) lalu diekstraksi dengan 100 ml metanol menggunakan penggoyang
(shaker) selama 3 jam. Sebanyak 70 ml metanol kemudian ditambahkan dengan campuran dipanaskan dalam penangas air pada suhu 60°C selama 1 jam. Hasil ekstraksi disaring dengan penyaring vakum menggunakan kertas saring Whatman 42. Residu dicuci dengan 100 ml metanol panas dan disaring kembali dengan penyaring vakum. Hasil ekstraksi dan residu dicampur lalu dipekatkan dengan menggunakan rotavapor pada suhu 40°C
dengan tekanan rendah (13.5 kgf/cm2). Ekstrak yang diperoleh selanjutnya ditempatkan pada veal-veal dan disimpan dalam freezer. Bagan alir proses ekstraksi dapat dilihat pada Gambar 13.
I
Bubuk Sayuran Ind.qenousI
Ekstraksi dengan Metanol (Hammerschmidt dan Pratt, 1978).
I
PenyaringanI
I
f
Pencucian dengan Metanol
4
Penghilangan Metanol
I
Ekstrak Antioksidan
Gambar 13. Bagan alir proses ekstraksi komponen antioksidan
Karakterisasi Sifat Fisik dan Kimia Ekstrak Antioksidan Sayuran
Indigettous
Pengujian karakterisasi ekstrak antioksidan sayuran indigenous meliputi sifat fisik dan k i i i a ekstrak. Pengamatan terhadap sifat fisik ekstrak terdiri dari pengamatan terhadap warna dan rendemen ekstrak. Sedangkan pengamatan terhadap sifat kimia ekstrak terdiri dari analisis kadar air, kadar bahan kering ekstrak dan penentuan nilai total fenol.
Tahap Pengujian Kapasitas Antioksidan
Pengujian kapasitas anfioksidan ekstrak sayuran indigenous t e r d i dari pengujian kapasitas antioksidan sebagai radikal scavenger dengan menggunakan metode DPPH dan ABTS, kapasitas mereduksi menggunakan metode ferisianida dan pengujian kapasitas antioksidan sebagai penghambat oksidasi lipid lanjut.
Pengamatan
Pengamatan yang dilakukan terhadap ekstrak antioksidan sayuran
indigenous adalah sebagai berikut:
Karakterisasi Sifat Fisik Ekstrak Antioksidan Sayuran indigenous
Warna Ekstrak
Pengamatan terhadap warna ekstrak dilakukan dengan mengamati warna yang terbentuk setelah proses ekstraksi.
Rendemen Ekstrak
Penghitungan terhadap rendemen ekstrak dilakukan untuk mengetahui berapa banyak bahan baku yang dibutuNcan untuk mendapatkan sejumlah tertentu ekstrak sayurannya. Rendemen ekstrak d i t u n g dengan cara menirnbang ekstrak yang diperoleh dibagi dengan bobot awal sayuran segar dikurang bobot kering sayuran segar.
W e b m k
Rendemen Ekstrak (% bb) = x 100%
W awal - W nwal kering
Keterangan:
W rl;sbal; = bobot ekstrak yang diperoleh (g)
w
a ~ a ~ = bobot awal sampel yang akan diekstrak (g)Karakterisasi Sifat Kimia Ekstrak Antiohidan Sayuran Indigenous
Karakterisasi sifat kimia yang diamati meliputi analisa kadar air (dilakukan terhadap sampel sayuran segar dan bubuk sayuran), analisa kadar bahan kering ekstrak dan nilai total fen01 ekstrak sayuran indigenous.
Kadar Air (AOAC, 1984)
Penetapan kadar air merupakan cara
untuk
mengukur banyaknya air yang terdapat di dalam suatu bahan pangan. Analisis kadar air dilakukan terhadap sampel sayuran segar (awal) dan pada sampel bubuk sayuran kering (setelah fieeze drying). Penentuan kadar air ini dilakukan dengan menggunakan metode pengeringan dengan oven biasa. Prinsip dari metode ini adalah air dikeluarkan dari sampel dengan cara menguapkanair
yang terdapat dalam bahan pangan.Cawan aluminium dikeringkan dalam oven pada suhu 103OC selama 15 menit kemudian didinginkan dalam desikator dan dilakukan penirnbangan untuk mengetahui bobot kosong daricawan aluminium tersebut. Sampel ditimbang sebanyak 5 g kemudian dikeringkan dalam oven pada suhu 103°C kemudian didinginkan dalam desikator lalu dilakukan penimbangan. Penimbangan dilakukan hingga diperoleh bobot tetap.
W-(W1-W2)
Kadar air (%) = x 100%
W
Keterangan : W = bobot contoh sebelum diieringkan (g)
WI = bobot (contoh + cawan) sesudah dikeringkan (g)
w2
= bobot cawan kosong (g) Kadar Bahan Kering EkstrakTujuan dari pengukuran ini adalah
untuk
mengetahui berat komponen kering dari ekstrak per 100 mg ekstrak. Prosedur yang dilakukan adalah menyiapkan cawan porselen bersih, bebas lemak dan kotoran. Cawan dikeringkan dalam oven sampai kering lalu didinginkan dalam desikator, laluditimbang. Sampel ekstrak diambil sebanyak 2.5 mg lalu dikeringkan dalam oven pada suhu 4OvC selama kurang lebii 6 jam. Pengeringan dilakukan pada suhu 40°C dimaksudkan agar komponen-komponen volatile yang terdapat dalam ekstrak tidak ikut teruapkan. Ekstrak kering kemudian diieluarkan dari oven dan didinginkan lalu ditimbang hingga diperoleh bobot tetap.
- (W1- W2)
Kadar bahan kering
(YO)
-x
100%W
I I
Keterangan : W = bobot contoh sebelum d i i e ~ g k a n (mg)
W, = bobot {mntoh
+
cawan) sesudah diieringkan {ntg) W2 = bobot cawan kosong (mg)Nilai Total Fen01 Ekstrak
Pengukuran nilai total fenol pada tahap ini bertujuan untuk mengetahui kandungan fenol yang terdapat dalam ekstrak sampel, dan selanjutnya nilai ini digunakan sebagai standar atau dasar penggunaan bahan baku tersebut dalam pengujian kapasitas antioksidan dari masing-masing sampel.
Total fenol ekstrak diukur dengan reagent Folin-Ciocalteau menggunakan metode Javanmardi et al. (2003) dengan sediit modifikasi. Prosedur pengukuran dilakukan dengan cara menimbang sampel sebanyak lebih kurang 5 mg untuk masing-masing sampel lalu ditambahkan 0.5 ml metanol, 2.5 ml aquadest, dan 2.5 ml reagent Folin-Ciocalteau 50%.
Campuran didiamkan selama 5 menit kemudian ditambahkan 2 ml NazCO3
7.5% dan divorteks lalu d i i i b a s i selama 15 menit pada suhu 45OC.
Absorbansi kesemua sampel diukur pada panjang gelombang 765 nm dengan menggunakan spektrofotometer. Hasil pengukuran diekspresikan sebagai mg ekuivalen asam galat per gram berat kering sampel (mg GAE/g bk).
Standar yang digunakan dalam penentuan nilai total fenol ekstrak adalah asam ga!at. Standar asam galat dibuat dengan variasi konsentrasi antara 50 - 250 m a .
Tahap Pengujian Kapasitas antioksidan Ekstrak Sayuran Indigenous
Tahapan ini meliputi pengujian kapasitas antioksidan sebagai radikal
scavenger yang diuji dengan menggunakan metode DPPH dan ABTS,
kapasitas mereduksi yang diuji dengan metode ferisianida. Hasii pengujian ketiga metode tersebut dinyatakan sebagai TEAC (Trolox Equivalent Antioxydant Capacity). Selain itu pengujian kapasitas antioksidan juga
dilakukan terhadap antioksidan sebagai penghambat oksidasi lipid lanjut yang diuji dengan metode TBA.
Pengujian Kapasitas Antioksidan Sebagai Radical Scavenger
Menggunakan Metode DPPH
Pengujian kapasitas antioksidan diukur dengan menggunakan metode Payet et 01. (2005). Ekstrak sampel dibuat dalam konsentrasi 100 ppm
berdasarkan nilai total fen01 untuk masing-masing sampel. Sebanyak 5 ml dari 0.1 mM larutan DPPH dalam metanol ditambahkan ke dalam masing-
masing sampel kemudian dikocok hingga homogen. Selanjutnya sampel disimpan pada suhu 27OC selama 20 menit. Kontrol disiapkan tanpa
penambahan ekstrak sampel dan metanol digunakan sebagai koreksi. Absorbansi sampel diukur pada panjang gelombang 517 nm. Kapasitas antioksidan diekspresikan sebagai persen inhibisi (penghambatan) dan dihitung dengan menggunakan rumus :
Abs kontro~ - Abs sampel
Penghambatan (YO) =
x
100Abs liontro~
Nilai perhitungan persen penghambatan dinyatakan pula dalam TEAC dengan cara :
TEAClDPPH = x [Trolox]
Pengujian Kapasitas Antioksidan sebagai Radikal Scavenger dengan metode TEACIABTS"
Nilai total kapasitas antioksidan (TAA) diestimasikan sebagai Trolox Equivalent Antioxidant Capacity (TEAC) assay menggunakan metode Lee et
al. (2006). Pengujian didasarkan pada kemampuan dari masing-masing
substansi untuk membentuk kation radikal ABTs* yang dibandingkan dengan standar (Trolox). Kation radikal disiapkan dengan mencampurkan 7 mM larutan stok ABTS dengan 2.45 mM potassium persulfat (111, v/v) dan dibiarkan bercampur selama 4
-
8 jam hingga reaksi bejalan sempurna yang ditandai dengan absorbansi yang stabil. Larutan BTS" dilarutkan dengan etanol hingga absorbansinya mencapai 0.700 F 0.05 pada panjang gelombang 734 nm. Pengukuran dilakukan dengan mengambil 0.9 ml dari larutan ABTS'+ dan 0.1 ml ekstrak sampel yang dilarutka dalam metanol. Campuran dikocok selama 45 detik dan segera dilakukan pengukuran untuk mengetahui absorbansinya pada panjang gelombang 734 nm setelah 1 menit.Standar yang digunakan dalam penentuan nilai total fen01 ekstrak adalah trolox. Standar trolox dibuat dengan variasi konsentrasi antara 0-0.5
PM
Pengujian Kapasitas antioksidan Sebagai Kapasitas Mereduksi Menggunakan Metode Ferisianida
Pengujian kemampuan mereduksi dilakukan dengan menggunakan metode Duh et al. (2004). Sebanyak 0-500 mg/mL ekstrak dalam buffer phosphate (2.5 mL., 0.2 M, pH 6.6) ditambahkan potassium ferisianat (2.5
mL., 10 mgIrnL) lalu campuran diinkubasi pada suhu 50°C selama 20 menit. TCA (2.5 mL., 100 mg/mL) ditambahkan ke dalam campuran lalu disentrifuge
selama 10 menit. Sebanyak 2.5 mL supematan dicampurkan dengan 2.5 mL air destilasi clan feri klorida (0.5 mL., 10 m a ) . Kemudian diukur absorbansinya diukur dengan alat spektrofotometer pada panjang gelombang 700 nm. Semakin tinggi absorbansi meagindiiasikan kemampuan mereduksi yang semakin baik.
Kemampuan mereduksi dinyatakan dalam TEAC dengan cara membagi absorbansi kontrol dengan absorbansi sampel. Hasil penghitungan perbandigan tersebut selanjutnya dikonversikan dengan hasil penghitungan kemampuan mereduksi dari standar trolox dengan cara membaginya dengan nilai reduksi trolox.
Pengujian Kapasitas antioksidan Sebagai Penghambat Oksidasi Lipid
Lanjut Menggunakan Metode TBA (Aqil et aL 2006)
Sebelum pengukuran potensi antioksidan dari ekstrak sayIran indigenous dilakukan pengukuran hidroperoksida sebagai produk primer asam linoleat yang teroksidasi dengan metode FTC.
Metode yang digunakan sebagaimana dijelaskan dalam Aqil et al,
(2006). Campuran yang terdiri dari 4 mg ekstrak sampel dalam 4 ml etanol absolut, 4.1 ml asam linoleat dalam etanol 2.52%, 8 ml buffer phosphate @H 7) 0.05 M dan 3.9 ml air diletakkan dalam vial yang ditutup rapat dan disimpan dalam oven dengan suhu 40°C. Sebanyak 0.1 ml dari campuran tersebut ditambahkan dengan etanol 75%, 0.1 ml ammonium tiocianat 30% dan 0.1 ml fero klorida 0.02 M dalam 3.5% HC1. Absorbansi warna merah diukur pada panjang gelombang 500 nm setiap 24 jam sampai 1 hari setelah absorbansi kontrol mencapai nilai tertinggi. Trolox digunakan sebagai standar positif dan kontrol tanpa sampel sebagai kontrol negatif.
Pengujian tahap selanjutnya adalah pengujian terhadap daya hambat oksidasi lipid lanjut menggunkan metode TBA. Metode yang digunakan sebagaimana dijelaskan dalam Aqil et al. (2006). Sebanyak 2 ml asam trikloroasetat dan 2 ml 0.67% asam thiobarbiturat ditambahakan ke dalam 1
ml sampel yang telah disiapkan pada metode FTC. Campuran diletakkan dalam air mendidih dan setelah dingin disentrifus pada 3000 rpm selama 20 menit. Absorbansi supematan diukur pada panjang gelombang 532
nm.
Kapasitas antioksidan didasarkan pada absorbansi hari terakhir dari metode FTC. Untuk pembuatan kurva standar dengan cara yang sarna digunakan larutan 1.1.3.3-tetra metoksi propane (TMP) dengan konsentrasi 0.5 - 3.0 PM.
Nilai kapasitas antioksidan ditentukan berdasarkan kemampuan ekstrak antioksidan untuk menahan laju pembentukan MDA (malonaldehid). Oleh karena itu aktivitas dihitung sebagai persen inhibisi dengan rumus :
Penghambatan
1%)
= x 100%Analisis Data
Analisis Data mengenai Hubungan Nilai Total Fenol dan Kapasitas Antioksidan sebagai Radikal Scavenger.
Analisis data hasil penelitian untuk mengetahui adanya hubungan antara nilai total fen01 dengan kapasitas antioksidan sebagai radikal
scavenger digunakan analisis regresi linier dan dinyatakan sebagai koefisien korelasi (r). Analisis data dilakukan terhadap kapasitas antioksidan yang dinyatakan dalam % penghambatan (Yoinhibisi) radikal bebas DPPH dan kapasitas antioksidan yang dinyatakan dalam TEAC (radikal bebas DPPH dan radikal bebas ABTS). Sedangkan untuk melihat sejauh mana perbedaan
kemampuan antioksidan dalam menghambat perkembangan radial bebas DPPH dan ABTS dilakukan uji analisis variansi pada a = 0.05.
Hasil analisis dinyatakan mempunyai korelasi yang positif apabila hasil perhitungan menghasilkan nilai koefisien korelasi ( r )
>
0.8 artinya lebih dari 80% nilai total fenol berpengaruh terhadap kapasitas antioksidan sebagai radikal scavenger.Analisis Data mengenai Hubungan Nilai Total Fenol dan Kemampuan Mereduksi
Analisis data hasil penelitian untuk mengetahui adanya hubungan antara nilai total fenol dan kemampuan mereduksi dari suatu antioksidan digunakan analisis regresi linier dan dinyatakan sebagai koefisien korelasi (r). Hasil analisis dinyatakan mempunyai korelasi yang positif apabila hasil perhitungan menghasilkan nilai koefisien korelasi ( r ) > 0.8 aainya lebih dari 80% nilai total fenol berpengaruh terhadap kemampuan mereduksi dari suatu antioksidan.
Analisis Data mengenai Hubungan Nilai Total Fenol dan Kapasitas Antioksidan sebagai Penghambat Oksidasi Lipid Lanjut
Nilai persentase penghambatan oksidasi lipid lanjut diukur berdasarkan jumlah malonaldehid (MDA) yang terbentuk yang didapat dari rata-rata MDA linoleat yang terbentuk (MDA kontrol) dikurangi dengan rata-rata MDA tiap perlakuan yang terbentuk dibagi dengan MDA kontrol dan dikali 100%.
Untuk mengetahui adanya hubungan antara nilai total fenol dari suatu antioksidan dengan kemampuan antioksidan dalam menghambat tejadiiya oksidasi lipid lanjut digunakan analisis regresi linier sederhana dan dinyatakan sebagai koefisien korelasi (r).
Hasil analisis dinyatakan mempunyai korelasi yang positif apabila hasil perhitungan menghasilkan nilai koefisien korelasi ( r ) > 0.8 artinya
lebih dari 80% nilai total fenol berpengaruh terhadap kemampuan antioksidan dalam menghambat terjadinya oksidasi lipid lanjut.
Analisis Data mengenai Hubungan Kemampuan Mereduksi dan Kapasitas Antioksidan sebagai Radikal Scavenger
Analisis data hasil penelitian untuk mengetahui adanya hubungan antara kemampuan mereduksi dengan kapasitas antioksidan sebagai radikal
scavenger digunakan analisis regresi l i ~ e r dan dinyatakan sebagai koefisien korelasi (r). Analisis data dilakukan terhadap kapasitas antioksidan yang dinyatakan dalam % penghambatan (%inhibisi) radikal bebas DPPH dan kapasitas antioksidan yang diiyatakan dalam TEAC (radial bebas DPPH dan radikal bebas ABTS). Sedangkan untuk melihat sejauh mana perbedaan
kemampuan antioksidan dalam mereduksi radikal bebas DPPH dan ABTS
dilakukan uji analisis variansi pada a = 0.05.
Hasil analisis diiyatakan mempunyai korelasi yang positif apabila hasil perhitungan menghasilkan nilai koefisien korelasi ( r ) > 0.8 artinya lebih dari 80% nilai total fenol berpengaruh terhadap kapasitas antioksidan sebagai radikal scavenger.
Analisis Data mengenai Hubungan Kemsmpuan Mereduksi dan Nilai Total Flavonol dan Flavon
Data untuk nilai total flavonol dan flavon adalah data sekunder yang diperoleh dari hasil penelitian Batari (2007). Analisis data mengenai hubungan antara kemampuan mereduksi dengan nilai total flavonol dan flavon dimaksudkan untuk mengetahui kemampuan flavonol dan flavon dalam mereduksi senyawa lain. Pengolahan data untuk menganalisis hubungan ini dilakukan dengan membuang 2 (dua) buah data pencilan yaitu Nlai total flavonol (kaempferol) dari daun katuk (138.14 mg/100 g) dan daun antanan (8.57 mg/100 g). Hal ini dikarenakan nilai kaempferol yang terlalu tinggi
dapat menghalangi pelepasan hidrogen dari antioksidan sehingga akan menuninkan aktivitas antioksidannya.
Untuk mengetahui adanya hubungan antara kemampuan mereduksi dari suatu antioksidan dengan kapasitas antioksidan digunakan analisis regresi l i e 1 sederhana dan diiyatakan sebagai koefisien korelasi (I).
Hasil analisis dinyatakan rnempunyai korelasi yang positif apabila hasil perhitungan menghasilkan nilai koefisien korelasi ( r ) > 0.8 artinya lebih dari 80% kemampuan mereduksi antioksidan dipengaruhi oleh nilai total flavonol dan flavon.