I. PENDAHULUAN A. Latar Belakang
Pertumbuhan merupakan proses bertambahnya ukuran atau substansi atau masa zat suatu organisme, misalnya kita sebagai makhluk makro ini dikatakan tumbuh ketika bertambah tinggi, bertambah besar atau bertambah berat. Pada organisme bersel satu pertumbuhan lebih diartikan sebagai pertumbuhan koloni, yaitu pertambahan jumlah koloni, ukuran koloni yang semakin besar atau subtansi atau massa mikroba dalam koloni tersebut semakin banyak, pertumbuhan pada mikroba diartikan sebagai pertambahan jumlah sel mikroba itu sendiri (Waluyo, 2005).
Dalam pertumbuhannya setiap makhluk hidup membutuhkan nutrisi yang mencukupi serta kondisi lingkungan yang mendukung demi proses pertumbuhan tersebut. Sehingga bisa dikatakan bahwa ada beberapa faktor yang mempengaruhi pertumbuhan mikroba khususnya mikroba pada makanan, antara lain faktor intrinsik (sifat fisik, kimia, dan struktur makanan), ekstrinsik (kondisi lingkungan penyimpanan), implisit (interaksi dengan mikroba lain), dan pengolahan (proses pengolahan makanan). Pengaruh faktor ini akan memberikan gambaran yang memperlihatkan peningkatan jumlah sel yang berbeda dan pada akhirnya memberikan gambaran pula terhadap kurva pertumbuhannya (Waluyo, 2005).
Kemampuan mikroorganisme untuk tumbuh dan tetap hidup merupakan suatu hal yang penting untuk diketahui. Pengetahuan tentang faktor-faktor yang mempengaruhi pertumbuhan mikroba sangat penting di untuk mengendalikan pertumbuhan mikroba, adapun faktor yang mempengaruhi pertumbuhan mikroba terdiri dari faktor intrinsik dan faktor ekstrinsik. Faktor intrinsik meliputi pH, Aw, potensial oksidasi-reduksi, kandungan nutrisi, kandungan senyawa anti mikrobia dan stuktur biologi. Sedangkan faktor ekstrinsik meliputi temperatur, kelembapan relatif lingkungan, dan susunan gas di lingkungan.
Faktor-faktor yang mempengaruhi pertumbuhan mikroba ini dapat dimanfaatkan untuk mengendalikan pertumbuhan mikroba seperti pH, Aktivitas mikroorganisme secara signifikan dipengaruhi oleh pH, pH adalah parameter untuk mengetahui intensitas tingkat kesamaan/kebasaan dari suatu larutan yang
dinyatakan dengan konsentrasi ion hidrogen terlarut. Mikroba yang ada disekitar kita mempunyai syarat tumbuh yang berbeda-beda, agar mereka dapat tumbuh dengan baik. Syarat tumbuh mikroba dapat berupa suhu maupun pH. untuk pertumbuhan mikroba biasanya terdapat 3 pH pertumbuhan yaitu pH optimum, pH maksimum dan pH minimum. Dari ketiga pH diatas biasanya pH yang paling cocok untuk pertumbuhan mikroba disebut pH optimum. pH minimum merupakan pH terendah dimana mikroba tidak dapat tumbuh, sedangkan pH maksimum merupakan pH tertinggi dimana mikroba tidak dapat tumbuh, ketiga jenis pH pertumbuhan itu sesuai dengan karakteristik kebutuhan mikroba untuk hidup pada pH tertentu . Mikroba umumnya hidup pada pH netral (6,6-6,7), pH pertumbuhan bakteri adalah 4,0-8,0 , kapang 1,5-12, sedangkan khamir mempunyai daerah pH 1,5-8,5. Berdasarkan daerah pH bagi kehidupannya, mikroba dibedakan menjadi 3 golongan, mikroba asidofil yaitu mikroba yang dapat tumbuh pada pH antara 2,0-5,0, mikroba mesofil yaitu mikrobayang dapat tumbuh pada pH antara 5,5-8, mikroba alkalifil yakni mikroba yang dapat tumbuh pada pH antara 8,5-9,5. Nilai pH merupakan faktor yang mempengaruhi aktivitas enzim, dimana aktivitas enzim ini akan maksimum pada kondisi pH optimum. Nilai pH sel mikroorganisme dipengaruhi oleh pH lingkungan dimana mikroorganisme tersebut hidup. Bila pH lingkungan tidak sesuai untuk aktivitas enzim secara optimal, maka mikrobia tidak dapat melakukan metabolisme dengan baik. Akibatnya mikrobia tidak dapat tumbuh dengan optimal. Untuk itulah dengan adanya praktikum ini kita dapat mengetahui pengaruh pH (HCl, NaOH, Akuades) terhadap pertumbuhan mikroba baik gram positif Bacillus cereus maupun bakteri gram negatif E.coli.
Praktikum kali ini difokuskan kepada salah satu faktor intrinsik yaitu pH. Pada medium diberikan kertas cakram yang mengandung larutan asam organik, asam anorganik, dan basa dengan pH 3, 5, 7, dan 9 untuk diketahui pengaruhnya terhadap pertumbuhan bakteri Gram positif dan Gram negatif. B. Tujuan
Mengetahui pengaruh pH terhadap pertumbuhan mikroba gram positif dan negatif.
II. TINJAUAN PUSTAKA
Dalam kehidupan sehari-hari kita selalu berhubungan dengan berbagai macam mikroorganisme yang dapat menginfeksi yang dapat membahayakan atau merusak inang. Akan tetapi, agar dapat memahami lebih banyak masalah dalam mendiagnosis dan pencegahan infeksi, maka perlu diketahui bahwa mikroorganisme tumbuh dipengaruhi oleh beberapa faktor yang menunjang pertumbuhannya (M. Natsir Djide, 2005).
Pertumbuhan adalah penambahan secara teratur semua komponen sel suatu jasad. Pembelahan sel adalah hasil dari pertumbuhan sel. Pada jasad bersel tunggal (uniseluler), pembelahan atau perbanyakan sel merupakan pertambahan jumlah individu. Misalnya pembelahan sel pada bakteri akan menghasilkan pertambahan jumlah sel bakteri itu sendiri. Pada jasad bersel banyak (multiseluler), pembelahan sel tidak menghasilkan pertambahan jumlah individunya, tetapi hanya merupakan pembentukan jaringan atau bertambah besar jasadnya (Suharjono, 2006).
Seperti makhluk hidup pada umumnya, pertumbuhan mikroba tentunya tidak lepas dari pengaruh lingkungan. Faktor-faktor yang mempengaruhi itu dapat berupa faktor fisika, faktor kimia, maupun faktor biologi. Namun, pertumbuhan mikroba ini tidak hanya dipengaruhi faktor lingkungan, tetapi juga mempengaruhi keadaan lingkungan. Akibat ukurannya yang sangat mikroskopis, pertumbuhan mikroba sangat tergantung pada keadaan sekelilingnya (Pelczar dan Chan, 2006).
Beberapa faktor abiotik yang dapat mempengaruhi pertumbuhan bakteri, antara lain: suhu, kelembaban, cahaya, pH, Aw dan nutrisi. Apabila faktor-faktor abiotik tersebut memenuhi syarat, sehingga optimum untuk pertumbuhan bakteri, maka bakteri dapat tumbuh dan berkembang biak (Haastuti, 2008).
Medium harus mempunyai pH yang tepat, yaitu tidak terlalu asam atau basa. Kebanyakan bakteri tidak tumbuh dalam kondisi terlalu basa, dengan pengecualian basil kolera (Vibrio cholerae). Pada dasarnya tak satupun yang dapat tumbuh baik pada pH lebih dari 8. Kebanyakan patogen, tumbuh paling baik pada pH netral (pH7) atau pH yang sedikit basa (pH 7,4). Beberapa bakteri tumbuh
pada pH 6, tidak jarang dijumpai organisme yang tumbuh baik pada pH 4 atau 5. Sangat jarang suatu organisme dapat bertahan dengan baik pada pH 4; bakteri autotrof tertentu merupakan pengecualian. Karena banyak bakteri menghasilkan produk metabolisme yang bersifat asam atau basa (Hafsah, 2009).
Mikroba pada umumnya hidup pada pH netral (6,6-7,5), namun setiap mikroba mempunyai nilai pH minimum, pH optimum, dan pH maksimum. pH pertumbuhan untuk bakteri adalah 4,0-8; kapang 1,5-12; sedangkan khamir mempunyai daerah pH 1,5-8,5. Berdasarkan daerah pH bagi kehidupannya, mikroba dibedakan menjadi 3 golongan yaitu:
- mikroba asidofil, yaitu mikroba yang dapat tumbuh pada pH antara 2,0-5,0;
- mikroba mesofil/neutrofil, yaitu mikroba yang dapat tumbuh pada pH antara 5,5-8;
- mikroba alkalifil, yaitu mikroba yang dapat tumbuh pada pH antara 8,5-9,5 (Waluyo, 2005).
Secara garis besar, bakteri dibagi menjadi dua kategori yaitu bakteri Gram positif dan Gram negatif. Bacillus cereus merupakan salah satu contoh bakteri Gram positif, dan Escherichia coli merupakan salah satu contoh bakteri Gram negatif. Ciri-ciri bakteri Gram negatif adalah:
- struktur dinding selnya tipis, sekitar 10-45mm, berlapis tiga atau multi layer,
- dinding selnya mengandung lemak lebih banyak (11-22%), peptidoglikan terdapat dalam lapisan kaku sebelah dalam dengan jumlah sedikit (10% dari berat kering), tidak mengandung asam laktat, - kurang rentan terhadap senyawa penisilin,
- tidak resisten terhadap gangguan fisik (Waluyo,2005). Sedangkan ciri-ciri bakteri Gram positif adalah:
- struktur dinding selnya tebal, sekitar 10-50mm,
- dinding selnya mengandung peptidoglikan yang tinggi (90% dari berat kering,
- sensitif terhadap penisilin,
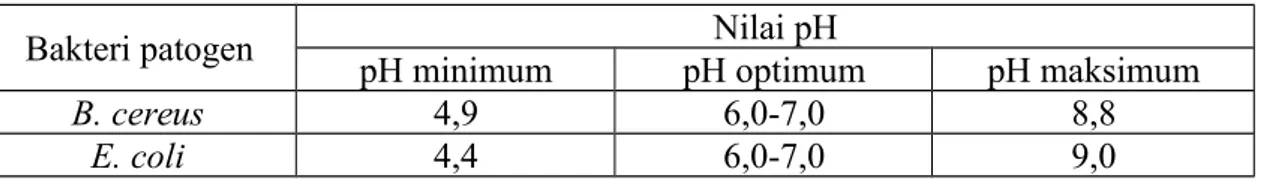
Berikut merupakan tabel perkiraan nilai pH pertumbuhan bakteri pathogen pada makanan menurut International Comission on Microbiological Specification
for Foods, 2004:
Tabel 1.1 Perkiraan Nilai pH Pertumbuhan Bakteri Patogen
Bakteri patogen Nilai pH
pH minimum pH optimum pH maksimum
B. cereus 4,9 6,0-7,0 8,8
E. coli 4,4 6,0-7,0 9,0
Asam kuat seperti HCl memiliki pKa yang sangat rendah sehingga pada pH diantara 3-6 (pH makanan yang normal) asam kuat akan terdisosiasi sempurna. Disosiasi asam kuat ini akan meningkatkan konsentrasi H+ lingkungan (pH makanan). pH makanan yang rendah ini penting bagi pengawetan makanan. Meskipun asam kuat meningkatkan pH eksternal mikroba, namun tidak mampu masuk kedalam sel mikroba. Sehingga kemampuan antimikroba dari asam kuat disebabkan oleh:
- denaturasi enzim ekstraselluler (terutama yang ada pada permukaan membran sel, biasanya kemampuan katalitik membran akan hilang sehingga metabolisme akan berhenti,
- turunnya pH internal (ada permeasi proton H+) yang disebabkan meningkatnya permeabilitas proton karena gradien pH yang terlalu besar,
- menurunnya aktivitas sistem transpor ion sehingga ion-ion esensial dan nutrien tidak akan diserap oleh mikroba (Kusumaningrum, 2011). Penghambatan oleh pH rendah dari ini dapat disebabkan oleh asam kuat maupun asam lemah, dan akibat dari penghambatan ini dapat berupa penurunan kecepatan pertumbuhan dan memperpanjang fase lag bakteri (fase adaptasi) (Kusumaningrum, 2011).
Berbeda dengan asam kuat, didalam larutan asam lemah berada pada keadaan kesetimbangan antara bentuk terdisosiasi dengan bentuk tidak terdisosiasi. Bentuk terdisosiasi asam lemah memberikan efek penghambatan mikroba sebagaimana asam kuat, sedangkan bentuk tidak terdisosiasi memiliki mekanisme penghambatan yang berbeda. Bentuk tidak terdisosiasi ini merupakan bentuk yang paling efektif menghambat mikroba, hal ini dikarenakan sifatnya yang mudah masuk ke dalam sel mikroba dan menurunkan pH internal dari sitoplasma mikroba. Bentuk tidak terdisosiasi asam lemah memiliki sifat yang lebih lipofilik, yang menjadikannya lebih bebas masuk melalui membran (lipid bilayer) sebagai fungsi adanya gradien konsentrasi. Setelah asam lemah tidak terdisosiasi ini berada dalam sitoplasma yang memiliki pH diatas pKa asam lemah, maka asam lemah akan segera terdisosiasi, melepaskan proton (H+), dan akan segera meningkatkan pH internal dari sitoplasma. Penghambatan mikroba oleh asam lemah ini disebabkan oleh:
- kerusakan membran,
- penghambatan reaksi metabolisme yang esensial, - stess dari homeostatis pH internal sel,
- akumulasi anion sisa asam pada sitoplasma yang bersifat toksik, - menggangu sistem sintesis protein atau genetik (sintesis DNA/RNA), - kematian mikroba karena kehabisan ATP disebabkan penggunaan ATP
untuk menjalankan pompa proton dengan tujuan mengeluarkan H+ dari dalam sel demi menjaga kesetimbangan homeostatis pH didalam sel (Ray, 2005).
Efektivitas dari asam lemah menghambat mikroba sangat tergantung dari nilai pKa asam lemah dan pH makanan. Pada pH makanan yang diatas pKa, sebagian besar asam lemah berada pada keadaan terdisosiasi, sehingga pada pH
ini asam lemah tidak efektif sebagai pengawet. Sedangkan pada pH dibawah pKa, sebagian besar asam lemah berada pada keadaan tidak terdisosiasi sehingga pada pH dibawah pKa inilah asam lemah efektif sebagai pengawet. Sehingga semakin tinggi pKa asam lemah serta semakin rendah pH makanan, maka efek pengawetan asam lemah semakin baik (Ray, 2005).
III. METODE A. Alat dan Bahan
Alat yang digunakan pada praktikum ini adalah : - Cawan petri steril
- Pipet mikro
- Kertas saring Whatman (cakram) - Jangka sorong
- Medium NA
Bahan yang digunakan pada praktikum ini adalah :
- E.coli
- Bacillus cereus
- HCL (pH 3 dan 5) - NaOH (pH 7 dan 9) B. Prosedur Kerja
2 cawan petri steril disiapkan, masing-masing dimasukan 1 ml starter mikroba
Medium dimasukan ke dalam cawan petri steril dalam keadaan hangat 45 0C.
Cawan diputar-putar untuk meratakan medium
Kertas cakram dicelupkan kedalam larutan per-pH tertentu selama 10 menit lalu dikering anginkan dan dimasukan ke dalam cawan petri yang telah diisi medium
Medium diinkubasi selama 48 jam pada suhu ruang dan posisi cawan terbalik
Zona bening diamati dan dilakukan pengukuran penghambat antimikroba terhadap bakteri, pengamatan dialukan 2 kali setelah 24 jam dan 48 jam
IV. HASIL DAN PEMBAHASAN A. Hasil.
Waktu
pengamatan Bakteri pH
Pengukuran Zona Bening
I II III Rata-rata 24 jam E.coli 3 0 0 0 0 5 0 0 0 0 7 0 0 0 0 9 0 0 0 0 Bacillu s cereus 3 1,4 1,2 1,4 1,33 5 0,3 0,3 0,2 0,26 7 0 0 0 0 9 0 0 0 0 48 jam E.coli 3 0 0 0 0 5 0 0 0 0 7 0 0 0 0 9 0 0 0 0 Bacillu s cereus 3 1,29 1,27 1,31 1,29 5 0,33 0,31 0,27 0,3 7 0 0 0 0 9 0 0 0 0 B. Pembahasan
Banyak faktor yang dapat mempengaruhi aktivitas kehidupan mikroba antara lain faktor abiotik yang meliputi temperatur, kelembaban, tekanan osmosis, pengaruh pH, pengaruh logam berat serta pengaruh zat-zat kimia. Sedangkan faktor biotik meliputi bebas hama serta asosiasi. Berdasarkan faktor-faktor tersebut, maka dilakukanlah pengamatan tentang pengaruh pH, terhadap pertumbuhan Mikroba. Perlu diketahui bahwa aktivitas kehidupan suatu jasad memerlukan keadaan sekitar yang sesuai, yang dapat mempengaruhi sifat morfologi dan fisiologi dari jasad akan menyesuaikan dengan keadaan sekitar yang ada pada waktu itu.
Pada praktikum ini bertujuan untuk mengamati pengaruh dari pH terhadap pertumbuhan dari mikroba, dengan menggunakan 3 jenis larutan untuk
menentukan pH, antara lain larutan HCl, NaOH dan Akuades. Larutan HCl ditepatkan sampai pH 3 dan 5 sebagai pH asam, larutan NaOH ditepatkan sampai pH 7 dan 9 sebagai pH basa , dan akuades sebagai pH netral.
Mikroba yang digunakan yaitu salah satu dari golongan Gram positif dan negatif. B. cereus sebagai indikator dari Gram positif, sedangkan E. coli sebagai indikator dari Gram negatif. Medium yang digunakan adalah medium NA. Pengamatan pengaruh pH dilakukan selama 2x24 jam, dengan cara mengamati zona bening yang ada pada sekitar kertas cakram. Adanya zona bening menunjukkan bahwa tidak ada mikroba yang hidup atau tumbuh di zona tersebut, sehingga ketika didapati zona bening pada kertas cakram dengan pH tertentu berarti bahwa pH tersebut berpengaruh terhadap pertumbuhan mikroba.
Hasil pengamatan dapat dilihat pada tabel di atas, bahwa pada 24 jam setelah inkubasi, diukur diameter zona bening tiga kali kemudian di rata-rata kan, pada E.coli dengan kertas cakram yang direndam selama 10 menit dalam larutan HCl pH 3 dan 5 setelah dikukur 3 kali didapatkan hasil secara berurutan dari pengukuran pertama sampai dengan ketiga, sebagai berikut 0 cm, 0 cm dan 0 cm dengan rata-rata hasil 0 cm , pada E.coli dengan kertas cakram yang direndam selama 10 menit dalam larutan NaOH pH 7 dan 9 setelah dikukur 3 kali didapatkan hasil secara berurutan dari pengukuran pertama sampai dengan ketiga, sebagai berikut 0 cm, 0 cm dan 0 cm dengan rata-rata hasil 0 cm, hal tersebut menunjukan bahwa pertumbuhan E.coli tidak dipengaruhi atau terhambat oleh kondisi pH asam karena zona bening itu tidak ada pada bagian cawan petri yang diletakan kertas cakram yang telah di rendam dalam larutan HCl pH 3 dan 5 (asam), hasil dari pengamatan tersebut tidak sesuai dengan literatur dari International Comission on Microbiological
Specification for Foods (2004), bahwa pH minimum pertumbuhan E. coli
adalah 4,4, pH maksimumnya adalah 9,0 dan pH optimum 6,0-7,0 . Dapat dilihat dari tabel hasil pengamatan bahwa pada larutan HCl tidak terdapat zona bening, yang berarti bahwa pertumbuhan E. coli tidak terhambat atau tetap tumbuh pada medium di sekitar kertas cakram yang pH nya 3 dan 5.
Sedangkan pada larutan NaOH juga tidak terdapat zona bening yang berarti bahwa pH 7 dan 9 tidak mempengaruhi pertumbuhan E. coli, karena pH optimum pertumbuhan E. coli adalah 6,0-7,0, pH optimum bisa dikatakan sebagai pH pertumbuhan mikroba, maka terjadi kesalahan sehingga tidak sesuai dengan literature.
Hasil pengamatan pada bakteri Gram positif atau B. cereus, dapat dilihat bahwa pada 24 jam setelah inkubasi, diukur diameter zona bening tiga kali kemudian di rata-rata kan, pada B. cereus dengan kertas cakram yang direndam selama 10 menit dalam larutan HCl pH 3 dan 5 setelah dikukur 3 kali didapatkan hasil secara berurutan dari pengukuran pertama sampai dengan ketiga, sebagai berikut 1,4 cm, 1,2 cm, 1,4 cm dengan rata-rata hasil 1,33 cm. pada B. cereus dengan kertas cakram yang direndam selama 10 menit dalam larutan NaOH pH 7 dan 9 setelah dikukur 3 kali didapatkan hasil secara berurutan dari pengukuran pertama sampai dengan ketiga, sebagai berikut 0 cm, 0 cm, 0 cm dengan rata-rata hasil 0 cm, hal tersebut menunjukan bahwa
B. cereus terhambat atau dipengaruhi pertumbuhannya pada pH asam karena
pada cawan yang telah diletakan kertas cakram yang direndam dalam larutan HCl selama 10 menit terdapat zona bening dan pada kertas cakram yang direndam dalam larutan NaOH tidak terapat zona bening. Hal ini sesuai dengan literatur dari International Comission on Microbiological
Specification for Foods (2004), bahwa pH minimum pertumbuhan B. cereus
adalah 4,9, pH maksimumnya adalah 8,8 dan pH optimum 6,0-7,0 . Dapat dilihat dari tabel hasil pengamatan bahwa pada larutan HCl terdapat zona bening paling luas, yang berarti bahwa pertumbuhan B. cereus terhambat atau tidak tumbuh pada medium di sekitar kertas cakram yang pH nya 3 dan 5. Sedangkan pada larutan NaOH tidak terdapat zona bening yang berarti bahwa pH 7 dan 9 tidak mempengaruhi pertumbuhan B. cereus,namun pH optimum bisa dikatakan sebagai pH pertumbuhan mikroba, dengan kata lain mikroba dapat tumbuh dengan baik pada pH optimumnya masing-masing mikroba.
Pada hasil pengamatan setelah di inkubasi selama 2x24 jam yang terjadi pada E.coli dengan larutan HCl masih tidak terdapat zona bening. Sedangkan pada B.cereus setelah di inkubasi selama 2x24 jam mengalami
penurunan jumlah zona bening pada cawan dengan perlakuan perendaman kertas cakram pada pH dimana yang tadinya memiliki rata-rata 1,33 cm menjadi 1,29 cm, pada pH 5 dimana zona bening bertambah dari rata-rata 0,26 cm menjadi 0,3 cm hal tersebut. Hal tersebut sesuai dengan literatur Suharni (2009), enzim sistem transport elektron dan sisem transport nutrien pada membran sel bakteri sangat peka terhadap konsentrasi ion hidrogen (pH). Selama pertumbuhan, mikrobia dapat menyebabkan perubahan pH medium sehingga tidak sesuai lagi untuk pertumbuhan.Oleh karena itu perlu diberi bufer di dalam medium untuk mencegah perubahan pH
Baik pada B. cereus maupun E. coli seharusnya pertumbuhan dipengaruhi oleh pH. E. coli dan B. cereus sama-sama memiliki pH minimum sekitar 4 dan pH maksimum sekitar 8-9. Berdasarkan pengamatan, pada B.
cereus dengan HCL menunjukan adanya zona bening daripada zona bening
pada E. coli yang tidak terlihat sama sekali. Hal ini berbanding terbalik dengan literature yang mengatakan bahwa bakteri Gram positif lebih tahan terhadap asam, karena dinding sel bakteri Gram positif lebih tebal sehingga bisa lebih tahan terhadap kondisi-kondisi ekstrim. Ketika pH basa, tidak terlalu terlihat perbedaan antara zona bening E. coli dan B. cereus karena pH maksimum kedua bakteri tersebut tidak berbeda jauh (8,8 dan 9,0) (International Comission on Microbiological Specification for Foods, 2004).
V. PENUTUP A. Kesimpulan
Berdasarkan hasil praktikum ini dampat disimpulkan bahwa:
- Pada bakteri E. coli tidak pernah terdapat zona bening pada pH asam yang menunjukkan bahwa pH asam (3 dan 5) tidak mempengaruhi atau menghambat pertumbuhan E. coli.
- Pada bakteri E. coli tidak pernah terdapat zona bening pada pH basa yang menunjukkan bahwa pH basa (7 dan 9) tidak mempengaruhi atau menghambat pertumbuhan E. coli.
- Pada bakteri B. cereus selalu terdapat zona bening pada pH asam yang menunjukkan bahwa pH asam (3 dan 5) dapat mempengaruhi atau menghambat pertumbuhan B. cereus.
- Pada bakteri B. cereus tidak pernah terdapat zona bening pada pH basa yang menunjukkan bahwa pH basa (7 dan 9) tidak mempengaruhi atau menghambat pertumbuhan B. cereus.
B. Saran
Saran untuk praktikum selanjutnya adalah:
- Sebaiknya praktikan lebih aseptis dan berhati-hati ketika menuangkan bakteri dan mediumnya.
- Sebaiknya kertas cakram yang digunakan tidak terlalu kering tetapi juga tidak terlalu basah agar lebih terlihat pengaruhnya.
- Sebaiknya praktikan mengetahui betul bagaimana pengukuran dengan jangka sorong agar bisa lebih teliti sehingga tidak terjadi kesalahan dalam pengukuran.
DAFTAR PUSTAKA
Haastuti, Utami Sri. 2008 .Petunjuk Praktikum Mikrobiologi. Malang: Universitas Negeri Malang.
Hafsah. 2009. Mikrobiologi Umum. Makassar: UIN Alauddin Makassar, Hafsan. 2011. Mikrobiologi Umum. Makassar: Alauddin University Press.
International Comission on Microbiological Specification for Foods. 2004.
Microbial ecology of foods. Volume 1, “Factors Affecting Life and death of microorganism”.
Kusumaningrum, H.D. 2011. Effect of pH, Acid, and Low Temperature on
Microbial Growth: Mecanism and Application on Food Product.
Natsir Djide, M. 2005. “Bakteriologi”. Makassar: Fakultas MIPA Universitas Hasanuddin
Pelczar, MJ dan ECS. Chan,. 1988. Dasar-Dasar Mikrobiologi jilid II. Jakarta: Penerbit Universitas Indonesia (UI - Press).
Ray, B. 2005. Control by Low pH and Organic Acid di dalam: Fundamental Food Microbiology, 3rd Eds. 35. 483-490. Boca Raton: CRC Press.
Suharjono. 2006. Mikrobiologi. Malang: Universitas Brawijaya.
Suharni, Theresia Tri dkk. 2008. Mikrobiologi Umum. Penerbit Universitas Atma Jaya. Yogyakarta.