commit to user
PENUMBUHAN LAPISAN TIPIS NiFe DENGAN MENGGUNAKAN METODE ELEKTRODEPOSISI
Disusun Oleh :
GUNAWAN APRIYANTO SUNDORO
NIM M0207036SKRIPSI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SEBELAS MARET
SURAKARTA
Mei, 2012commit to user
ii
PENUMBUHAN LAPISAN TIPIS NiFe DENGAN MENGGUNAKAN METODE ELEKTRODEPOSISI
Disusun Oleh :
GUNAWAN APRIYANTO SUNDORO
NIM M0207036SKRIPSI
Diajukan untuk memenuhi sebagian persyaratan mendapatkan gelar Sarjana Sains
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SEBELAS MARET
SURAKARTA
Mei, 2012commit to user
commit to user
iv
PERNYATAAN
Dengan ini saya menyatakan bahwa isi intelektual skripsi saya yang berjudul PENUMBUHAN LAPISAN TIPIS NiFe DENGAN MENGGUNAKAN METODE ELEKTRODEPOSISI adalah hasil kerja saya atas arahan pembimbing dan sepengetahuan saya hingga saat ini, isi skripsi tidak berisi materi yang telah dipublikasikan atau ditulis oleh orang lain atau materi yang telah diajukan untuk mendapatkan gelar kesarjanaan di Universitas Sebelas Maret atau di Perguruan Tinggi lainnya, jika ada maka telah dituliskan di daftar pustaka skripsi ini dan segala bentuk bantuan dari semua pihak telah ditulis di bagian ucapan terimakasih. Isi skripsi ini boleh dirujuk atau difotokopi secara bebas tanpa harus memberitahu penulis.
Surakarta, 22 Mei 2012
commit to user
v
MOTTO
Ya ALLAH, jadikan diriku lebih baik daripada sangkaan mereka, janganlah
Engkau hukum aku karena ucapan mereka dan ampunilah daku lantaran
(Asshiddiq Abu Bakar Ra)
Sesungguhnya Allah tidak akan merubah suatu kaum sehingga mereka
merubah keadaan yang ada pada diri mereka sendiri
(Ar-Seorang pesimis melihat kesulitan di setiap kesempatan , seorang optimistis
melihat kesempatan dalam setiap kesulitan.
Winston Churchil
commit to user
vi
PERSEMBAHAN
Penuh syukur kepada-Nya, Robb semesta alam,
kupersembahkan karya kecil ini teruntuk:
Allah SWT, atas rahmat yang Engkau berikan.
Rosulullah Muhammad SAW, penyampai kebenaran yang hakiki.:
& Bapak tercinta, Tiada pengorbananmu yang sia-sia, dengan penuh
.
Adikku Indra Yuni Wiryawan,
Bapak/ Ibu Dosen yang saYa hormati.
Almamaterku, Universitas Sebelas Maret
commit to user
vii
Penumbuhan Lapisan Tipis NiFe dengan Menggunakan Metode
Elektrodeposisi
GUNAWAN APRIYANTO SUNDORO
Jurusan Fisika Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret
ABSTRAK
Telah dilakukan penumbuhan lapisan tipis magnetik NiFe dengan metode elektrodeposisi di atas substrat Cu printed circuit board. Eksperimen dilakukan pada suhu ruang dengan variasi waktu deposisi dan rapat arus. Lapisan tipis NiFe yang diperoleh dikarakterisasi dengan STM untuk menentukan morfologi permukaan. Karakterisasi komposisi lapisan tipis NiFe dilakukan dengan XRF dan sifat magnetik bahan diuji dengan alternating gradient field magnetometer. Hasil eksperimen memperlihatkan ketebalan lapisan tipis NiFe meningkat secara linier seiring dengan kenaikan waktu dan rapat arus deposisi. Analisis morfologi permukaan memperlihatkan bahwa lapisan tipis NiFe dengan ketebalan 50 nm memperlihatkan lapisan diskrit kemudian menjadi lapisan kontinu dengan kenaikan ketebalan pada sekitar 350 nm. Analisis komposisi lapisan tipis NiFe menunjukkan bahwa prosentase mol lapisan tipis yang terbentuk adalah Ni:Fe= 89:11. Akhirnya, analisis karakteristik magnetik memperlihatkan kecenderungan bahwa material NiFe yang terbentuk bersifat soft magnetik dan hubungan nilai koersivitasnya berbanding terbalik dengan ketebalan.
Kata kunci: alternating gradient field magnetometer, STM , soft magnetik, lapisan tipis NiFe, XRF
commit to user
viii
Fabrication of NiFe Thin Film by Electrodeposited Method
GUNAWAN APRIYANTO SUNDORO
Physics Department of Mathematics and Sciences Faculty Sebelas Maret University
ABSTRACT
Magnetic thin films of NiFe alloy have been fabricated by eletrodeposition method on Cu printed circuit board substrates. Experiments were performed at room temperature with variation of time and current density. The surface morphology films were characterized by a STM. The compotition films were characterized by a XRF and magnetic property by an alternating gradient field magnetometer. Experiment results showed that the thickness of NiFe films increases linearly with time deposition and current density. Analysis of surface morphology demonstrated that a structural surface of NiFe thin films when still very thin is descrete, and then change to become continue film with the increase of thickness. Analysis of composition that the percentage of moles of NiFe thin films is formed 89 : 11. Finally a results of magnetic property confirmed that the NiFe films tends to be soft magnetic material which observed the decreased of coercive field with the raise of thickness.
Key words: alternating gradient field magnetometer, STM, soft magnetic, thin film of NiFe, XRF
commit to user
ix
KATA PENGANTAR
Puji syukur kepada Allah SWT atas segala limpahan nikmat dan karunia-Nya sehingga penulis dapat menyalesaikan penulisan skripsi. Sholawat dan salam senantiasa penulis haturkan kepada Rosulullah SAW sebagai pembimbing seluruh umat manusia.
Skripsi yang penulis susun sebagai bagian dari syarat untuk mendapatkan gelar
Penumbuhan Lapisan Tipis NiFe dengan
Menggunakan Metode Elektrodeposisi saikannya skripsi ini adalah suatu kebahagian bagi saya. Setelah sekitar satu semester penulis harus berjuang untuk bisa menyelesaikan skripsi ini tepat waktu. Dengan segala suka dan dukanya, pada akhirnya skripsi ini terselesaikan juga. Kepada berbagai pihak yang telah membantu penulis menyelesaikan skripsi ini penulis ucapkan terima kasih. Atas bantuannya yang sangat besar selama proses pengerjaan skripsi ini, ucapan terima kasih secara khusus penulis sampaikan kepada :
1. Dr. Eng. Budi Purnama, S.Si., M.Si. selaku pembimbing I atas perhatian dan kesabarannya dalam menuntun penulis sehingga penulis mampu menyelesaikan skripsi ini.
2. Drs. Suharyana, M.Sc. selaku pembimbing II atas perhatian dan telah meluangkan waktunya untuk membina dan memberikan bimbingan kepada penulis hingga terselesaikannya skripsi ini.
3. Drs. Cari, MA., Ph.D. selaku pembimbing akademis atas segala nasehat, dorongan dan motifasinya. Mohon maaf karena banyak mengecewakan. 4. Seluruh Bapak dan Ibu Dosen serta Staff di Jurusan Fisika, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret, atas ilmu dan bantuannya selama ini.
5. Bapak Dr. Eng. Edi Suharyadi, S.Si., M.Si., yang membantu pengukuran sifat magnet dengan AGFM
6. Semua pihak yang tidak mungkin dapat saya sebutkan satu persatu sehingga skripsi ini dapat terselesaikan.
commit to user
x
Semoga Allah SWT membalas jerih payah dan pengorbanan yang telah diberikan dengan balasan yang lebih baik. Amin.
Penulis menyadari akan banyaknya kekurangan dalam penulisan skripsi ini. Namun demikian, penulis berharap semoga karya kecil ini bermanfaat.
Surakarta, 22 Mei 2012 Penulis
commit to user
xi
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERNYATAAN ... iv
MOTTO ... v
PERSEMBAHAN ... vi
HALAMAN ABSTRAK ... vii
HALAMAN ABSTRACT ... viii
KATA PENGANTAR ... ix
DAFTAR ISI ... xi
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang Masalah ... 1
1.2.Batasan Masalah ... 2
1.3.Perumusan Masalah ... 2
1.4.Tujuan Penelitian ... 2
1.5.Manfaat Penelitian ... 2
BAB II LANDASAN TEORI ... 3
2.1.Elektrodeposisi ... 3
2.2.Larutan Elektrolit ... 4
2.3.Potensial Elektroda ... 5
2.4.Hukum Faraday ... 6
2.5.Faktor-Faktor yang Berpengaruh pada Proses Elektrodeposisi ... 7
2.6.Substrat ... 9
2.7.Lapisan Tipis NiFe ... 10
2.8.Material Magnetik ... 10
2.9.Material Paramagnetik ... 11
commit to user
xii
2.11. Material Diamagnetik ... 16
2.12. Klasifikasi Soft dan Hard Material Magnetik ... 16
2.13. Kurva Histerisis ... 17
2.14. X-ray Fluorescence Spectrometry ... 18
2.15. Scanning Tunneling Microscopy ... 20
BAB III METODELOGI PENELITIAN ... ` 22
3.1.Tempat dan Waktu Penelitian ... 22
3.2.Alat dan Bahan yang Digunakan ... 22
3.2.1. Alat yang Digunakan ... 22
3.2.2. Bahan yang Digunakan ... 23
3.3. Metodelogi Penelitian... 23
3.4. Teknik Analisia Data ... 24
BAB IV HASIL DAN PEMBAHASAN ... 30
1.1. Analisia Komposisi Lapisan Tipis NiFe ... 30
1.2. Ketebalan Lapisan Tipis NiFe ... 32
1.2.1. Ketebalan Lapisan Tipis NiFe Vs Waktu ... 32
1.2.2. Ketebalan Lapisan Tipis NiFe Vs Rapat Arus ... 34
1.3. Struktur Permukaan Lapisan Tipis NiFe ... 35
1.4. Hasil Karakterisasi Magnetik ... 38
BAB V PENUTUP ... 41
5.1. Kesimpulan ... 41
5.2. Saran ... 41
DAFTAR PUSTAKA ... 42
commit to user
xiii
DAFTAR TABEL
halaman Tabel 2.1. Paduan-paduan yang Terbentuk dari Elemen Ni dan Fe ... 10 Tabel 3.1. Formula Bak Sulfat Desain untuk Elektrolit Copper Strike ... 25 Tabel 4.1. Unsur-unsur yang terkomposisi didalam lapisan tipis
NiFe... 31 Tabel 4.2. Data Massa dan Ketebalan Lapisan tipis NiFe pada Beberapa
Variasi Waktu pada Suhu t = 10 menit... 32 Tabel 4.3. Waktu yang Diperlukan untuk Mendapatkan Ketebalan Lapisan
Tipis NiFe... . 33
Tabel 4.4. Data Massa dan Ketebalan Lapisan Tipis NiFe pada Beberapa
commit to user
xiv
DAFTAR GAMBAR
halaman
Gambar 2.1. Skema Rangkaian Proses Elektrodeposisi 3
Gambar2.2. Orientasi Momen Magnet Material Paramagnetik bila tidak dikenai Medan Luar... 12 Gambar2.3. Orientasi Momen Magnet Material Paramagnetik bila dikenai
Medan ... 12
Gambar 2.4. Arah Domain Material Feromagnetik tanpa Medan Luar... 13 Gambar 2.5. Pengaruh Suhu terhadap Sifat Bahan Feromagnetik ... 14 Gambar 2.6. Arah Momen Magnet Material Feromagnetik saat H = 0 dan saat
diberi Medan Magnet Luar H 14
Gambar 2.7. Konfigurasi Elektron pada Sub Kulit 3d6 untuk B 15 Gambar 2.8. Konfigurasi Elektron pada Sub Kulit 3d8 untuk N ... 15 Gambar 2.9. Induksi Magnetik (B) dan Momen Magnet Material Diamagnetik
saat a) Tanpa Medan Luar; b) diberi Medan Luar .. 16
Gambar 2.10. Kurva Histerisis Material Feromagnetik 18
Gambar 2.11. Skema Bagian- 19
Gambar 2.12. Skema Komponen . 21
Gambar 3.1. Diagram Alur Penelitian ... 23
Gambar 3.2. Foto Skema Proses Elektrodeposisi 26
Gambar 3.3. Foto Skema Alat STM 28
Gambar 4.1. Spektra Hasil Uji XRF untuk 30
Gambar 4.2. Grafik Hubungan Ketebalan Vs Waktu 33
Gambar 4.3. Grafik Hubungan Ketebalan Vs Rapat Arus 35
Gambar.4.4. Hasil Penggambaran Scanning Tunneling Microscopy Permukaan Lapisan NiFe Hasil Elektrodeposisi dengan Variasi Ketebalan Lapisan Tipis (a) 50 nm, (b) 100 nm, (c) 150 nm, (d) 200 nm, (e)
250 nm, (f) 300 nm 36
Gambar.4.5. Permukaan Morfologi Lapisan Ni-Fe Hasil Scan STM iuntuk Sampel dengan Variasi Rapat Arus, (a) J = 3 mA/cm2, (b) J = i4 mA/cm2,(c) J = 5 mA/cm2,(d) J = 6 mA/cm2, dan (e) J = 7
commit to user
xv
Gambar 4.6. Kurva Histeresis Lapisan Tipis Ni-Fe dengan Variasi K 38 Gambar 4.7.(a)Medan Koersivitas Hc (b) Magnetisasi Jenuh ms (c) Magnetisasi
commit to user
1
BAB I PENDAHULUAN
1.1. Latar Belakang
Lapisan tipis magnetik Ni-Fe merupakan kunci berbagai aplikasi ranah teknologi informasi seperti sebagai media penyimpanan (recording medium) maupun memori. Mulai dari teknologi berbasis induksi hingga saat ini yang dikenal dengan spin elektronik, paduan bahan lapisan tipis Ni-Fe masih tetap menjadi bahan utama seperti halnya bahan silikon pada teknologi semikonduktor. Oleh karena itu pengkajian sifat unggul bahan maupun potensi pemanfaatannya terus dikembangkan oleh ilmuwan.
Salah satu aspek fundamental pada lapisan tipis Ni-Fe adalah metode preparasi atau penumbuhan lapisan tipis. Banyak ragam metode yang telah terbukti menghasilkan lapisan tipis berkualitas seperti evaporasi, sputtering, elektrodeposisi. Selain akan menentukan karakter fisis fundamental lapisan tipis, pemilihan metode juga diselaraskan dengan potensi aplikasi lapisan tipis yang diperoleh. Dewasa ini metode elektrodeposisi menjadi salah satu metode alternatif rasional pilihan para peneliti mengingat kemudahan metode dan biaya yang relatif murah. Selain itu, modifikasi karakterisasi magnetiknya dapat dilakukan dengan mengubah parameter penumbuhannya seperti waktu dan rapat arus deposisi.
Pada penelitian ini dilakukan pembuatan lapisan tipis Ni-Fe dengan metode elektrodeposisi dengan substrat tembaga printed circuit board (PCB). Dari hasil pembuatan lapisan tipis dilakukan karakterisasi lapisan tipis yang diperoleh meliputi karakterisasi komposisi dengan menggunakan x-ray fluorosense (XRF) dan mikro stuktur morfologi permukaan dengan scanning tunneling microscopy (STM). Serta karakterisasi magnetik lapisan yang terbentuk menggunakan alternating gradient field magnetometer (AGFM).
commit to user
2
1.2. Batasan Masalah
Penelitian ini dibatasi oleh beberapa batasan masalah antara lain:
1. Penumbuhan lapisan tipis Ni-Fe menggunakan metode elektrodeposisi. 2. Variasi rapat arus adalah 2 mA/cm2, 3 mA/cm2, 4 mA/cm2, 5 mA/cm2,
6 mA/cm2, serta 7 mA/cm2.
3. Sifat magnetik Ni-Fe hasil elektrodeposisi pada suhu kamar.
1.3. Rumusan Masalah
Dari uraian latar belakang diatas maka pada penelitian ini dituliskan butir perumusan sebagai berikut: Akan diklarifikasi pengaruh rapat arus dan waktu deposisi terhadap struktur morfologi permukaan dan sifat magnet lapisan tipis Ni-Fe.
1.4. Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut:
1. Memperoleh lapisan tipis paduan Ni-Fe hasil elektrodeposisi pada substrat Cu.
2. Mengetahui pengaruh rapat arus dan waktu terhadap morfologi hasil elektrodeposisi dan ketebalan lapisan tipis Ni-Fe.
3. Menentukan karakterisasi magnetik lapisan Ni-Fe hasil elektrodeposisi.
4. Menentukan mikrostuktur permukaan lapisan tipis Ni-Fe yang terbentuk hasil elektrodeposisi.
1.5. Manfaat Penelitian
1. Penelitian ini diharapkan dapat memberikan informasi tentang struktur komposisi lapisan tipis Ni-Fe, struktur morfologi lapisan tipis Ni-Fe serta Karakterisasi magnetik lapisan Ni-Fe.
2. Dapat menambah referensi untuk penelitian lebih lanjut tentang pembuatan bahan induktor lapisan tipis Ni-Fe.
commit to user
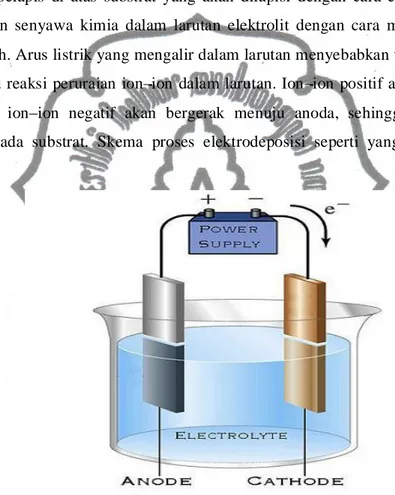
3 BAB II DASAR TEORI 2.1. ElektrodeposisiElektrodeposisi merupakan proses pengendapan logam di atas logam lainnya menggunakan dasar elektrolisis. Prinsip dasar elektrodeposisi adalah penempatan ion ion logam pelapis di atas substrat yang akan dilapisi dengan cara elektrolisis, yaitu menguraikan senyawa kimia dalam larutan elektrolit dengan cara mengalirkan arus listrik searah. Arus listrik yang mengalir dalam larutan menyebabkan terjadinya reaksi kimia, yaitu reaksi peruraian ion ion dalam larutan. Ion ion positif akan bergerak ke katoda dan ion ion negatif akan bergerak menuju anoda, sehingga dapat terjadi pelapisan pada substrat. Skema proses elektrodeposisi seperti yang terlihat dalam gambar
Gambar 2.1. Skema Rangkaian Proses Elektrodeposisi (http://www.rustyiron.com/engines/electrolysis/index.html)
Perpindahan elektron antar elektroda dan zat-zat dalam sel menghasilkan reaksi pada permukaan elektroda yaitu reaksi oksidasi dan reduksi. Elektroda tempat berlangsungnya reaksi oksida disebut anoda dan tempat berlangsungnya reaksi reduksi disebut katoda.
Anoda yang digunakan dalam proses elektrodeposisi ada 2 macam yaitu anoda yang dapat larut (soluble) dan anoda tidak larut (insoluble). Anoda soluble adalah
commit to user
4
anoda yang selama proses elektrodeposisi memberikan ion-ion logamnya pada katoda, sehingga anoda jenis ini makin lama makin habis terkikis, contohnya seng, nikel dan timah putih. Pada anoda soluble secara umum terjadi reaksi :
M(s) 2+(aq)+ 2e (2.1)
Anoda insoluble adalah anoda yang selama proses elektrodeposisi tidak terkikis, misalnya platina dan timah hitam. Pada anoda insoluble, reaksi anoda tergantung pada jenis anion pada larutan. Anion sisa asam oksi seperti SO42-, NO3-,
dan PO43- mempunyai oksida lebih negatif daripada air. Anion-anion seperti ini sukar
beroksidasi sehingga air yang teroksidasi seperti pada reaksi berikut (Anton Hartono dan Kaneko, 1992):
2H2 + + O2 +4e- E0= 1,229 V (2.2)
Katoda adalah elektroda yang menerima elektron, merupakan tempat pengendapan sewaktu terjadi proses elektrodeposisi, dalam hal ini katoda adalah substrat yang dipakai untuk membuat lapisan tipis.
Penelitian ini menggunakan substrat tembaga dalam bentuk lempengan. Substrat yang akan dilapisi ditempatkan pada katoda, sedangkan sebagai anodanya logam platina. Kedua elektroda dihubungkan dengan sumber daya DC. Substrat yang akan dilapisi dihubungkan dengan kutub negatif, sedangkan platina dihubungkan dengan kutub positif. Kedua elektroda tersebut dicelupkan ke dalam larutan elektrolit, sehingga jika sumber daya DC dihidupkan arus akan mengalir pada larutan tersebut. Arus searah yang mengalir melalui larutan elektrolit tersebut mengakibatkan terjadinya reaksi peruraian ion-ion larutan. Ion yang bermuatan positif akan bergerak ke katoda sedangkan ion-ion yang bermuatan negatif bergerak menuju anoda.
2.2. Larutan Elektrolit
Larutan adalah campuran homogen dari molekul-molekul atom atau ion dari dua zat atau lebih. Larutan elektrolit adalah larutan yang mengandung ion-ion sehingga bersifat menghantarkan arus listrik.
Larutan elektrolit akan mengalami elektrolisis bila dihubungkan dengan sumber arus searah. Terjadinya proses elektrolisis tersebut mengakibatkan terurainya ion-ion dalam larutan, sehingga ion-ion positif akan bergerak menuju kutub negatif
commit to user
5
dan ion-ion negatif bergerak menuju kutub positif. Larutan elektrolit biasanya mengandung logam pelapis. Konsentrasi larutan elektrolit sangat mempengaruhi proses elektrodeposisi, sehingga perbandingan bahan kimia dengan zat pelarut pada penumbuhan lapisan tipis harus sangat diperhintungkan.
Proses elektrodeposisi pada katoda akan dilapisi NiFe yang terdapat reaksi sebagai berikut: Reaksi di katoda Fe2+ + 2e Fe E0= -0,440 volt (2.3) Ni2+ + 2e Ni E0= -0,250 volt (2.4) 2H+ + 2e H2 E0= 0 volt (2.5) Reaksi di Anoda O2 + 4 H+ + 4e 2H2O E0 = 1,229 volt (2.6)
Agar dapat terjadi pengendapan Fe dan Ni pada substrat, maka tegangan minimum yang harus diberikan adalah:
Fe = -0,440 1,229 = -1,6 volt (2.7)
Ni = -0,250 1,229 = -1,4 volt (2.8)
Jika tegangan yang diberikan di bawah tegangan minimum tersebut maka Fe dan Ni tidak akan mengendap sehingga tidak akan terbentuk lapisan tipis. Untuk membentuk lapisan tipis tegangan minimum yang harus diberikan adalah 1,6 volt untuk Fe dan 1,4 volt untuk Ni. Tegangan minimum yang dibutuhkan oleh Ni lebih kecil dari pada tegangan minimum yang dibutuhkan oleh Fe, sehingga Ni lebih cepat menempel pada substrat dari pada Fe.
2.3. Potensial Elektroda
Adanya beda potensial pada ujung-ujung elektroda menyebabkan ion-ion bergerak. Hubungan antara konsentrasi ion dengan potensial elektroda dikemukakan oleh Waltern Nerst yaitu (Petrucci,1993) :
commit to user
6
dimana :
Eelk = potensial elektroda, E0 = potensial standar unsur, T = suhu mutlak (K), R=
tetapan gas (8,3143 Jmol-1 K-1), e = perubahan valensi, F = 96500 C/mol, A= konsentrasi logam, dan Ax+ =konsentrasi ion logam. Potensial standar sistem pada elektrodeposisi adalah (Petrucci,1993):
E = Ekatoda - E anoda (2.10)
Tegangan listrik yang diperlukan dalam elektrodeposisi harus lebih besar dari potensial standar system. Karena pada potensial standar hanya akan terbentuk gas yang akan menutupi elektroda. Oleh karena itu diperlukan potensial lebih agar terbentuk endapan. Jika potensial yang diberikan terlalu tinggi akan menyebabkan endapan berwarna kusam atau gelap. Warna kusam kemungkinan disebabkan logam teroksidasi berada dalam bentuk oksidanya.
2.4. Hukum Faraday
Hubungan antara banyaknya zat yang terdeposit pada elektroda dengan arus listrik yang dialirkan melalui sel elektrolisis dinyatakan dalam hukum Faraday yaitu (Leon dan Rennhard, 1970)
(2.11)
dengan
M = Massa zat yang terdeposit (gram) A = Luasan area (cm²)
J = Rapat arus area (mA/cm²) t = Waktu elektrodeposisi (detik) E = Medan listrik
= Konstanta tergantung pada E
Sebagai konsekuensi dari hukum Faraday adalah:
a. Banyaknya zat yang dibebaskan oleh elektroda berbanding lurus dengan jumlah arus yang dialirkan melalui rangkaian ke larutan elektrolit.
commit to user
7
b. Jumlah arus listrik yang sama akan membebaskan sejumlah zat pada elektroda sebanding dengan berat ekuivalen kimianya.
Dengan demikian dari hukum Faraday di atas, beberapa faktor yang mempengaruhi proses elektrolisis yaitu waktu deposisi dan rapat arus listrik. Waktu deposisi akan mempengaruhi ketebalan lapisan, dari hukum Faraday teramati bahwa semakin lama waktu deposisi maka jumlah ion yang terdeposit pada substrat semakin banyak. Jika luasan substrat konstan maka peningkatan jumlah ion yang akan menumpuk pada substrat dan akhirnya meningkatkan ketebalan.
Sedangkan rapat arus listrik akan mempengaruhi pertumbuhan kristal. Artinya besar kecilnya arus akan mempengaruhi pola pertumbuhan kristal, semakin besar arus maka transfer dan pergerakan ion-ion yang terjadi semakin besar dan cepat. Hal ini mempengaruhi proses reduksi pada katoda.
2.5. Faktor-Faktor yang Berpengaruh pada Proses Elektrodeposisi
Faktor-faktor yang dapat mempengaruhi proses Elektrodeposisi antara lain: 1) Rapat Arus (Current Density)
Pada praktek elektrodeposisi besaran yang diperhatikan adalah rapat arus yaitu arus per satuan luas permukaan benda kerja, biasanya dapat dinyatakan dalam satuan ampere/dm2 (A/dm2) atau ampere/cm2 (A/cm2). Rapat arus dinyatakan dengan rumus sebagai berikut :
(2.12)
Dimana; J adalah rapat arus (current density), I adalah arus listrik, A adalah luas permukaan.
Rapat arus mempengaruhi proporsi logam deposit. Rapat arus yang kecil menyebabkan ion bermuatan yang bergerak sedikit, sehingga endapan yang terbentuk sedikit. Maka pada kondisi tersebut, kemungkinan deposit berupa kristal yang kasar karena deposisi permulaan belum sempurna selesai tetapi sudah disusul deposisi berikutnya. Sedangkan ketika rapat arus mulai dinaikkan, maka laju pembentukan kristal deposit (nuclei) permulaaan mulai mengalami peningkatan, sehingga
commit to user
8
kemungkinan deposit menjadi lebih fine-grained berbentuk butiran yang bagus (Glastone, 1962).
Semakin besar rapat arus menyebabkan ion bermuatan semakin banyak yang bergerak membentuk endapan. Rapat arus yang terlalu tinggi juga dapat menyebabkan timbulnya panas, sebagai konsekuensi konversi energi listrik menjadi energi panas. Akibat selanjutnya, dapat menghasilkan deposit yang terbakar dengan ditandai warna yang menghitam (Purwanto dan Syamsul, 2005). Sesuai dengan hukum Joule berikut ini :
E listrik = E panas (2.13)
t adalah selang waktu deposisi, T adalah kenaikan suhu pada larutan. Makin tinggi i maka kenaikan suhu semakin tinggi.
2) Substrat
Substrat yang digunakan dalam elektrodeposisi berpengaruh pada sifat magnetik lapisan tipis yang terbentuk (Soohoo, 1965). Substrat selain sebagai tempat menampung deposit juga berfungsi sebagai lapisan penyangga atau cetakan dimana struktur morfologi dan volume lapisan yang akan ditumbuhkan bergantung pada morfologi substratnya ( Toifur dkk, 2002).
3) Tegangan
Tegangan yang diperlukan untuk proses elektrodeposisi tergantung dari jenis, komposisi, dan kondisi elektrolit. Rapat arus dapat dinaikkan dengan menaikkan tegangan, tetapi hal ini akan menyebabkan polarisasi dan tercapainya tegangan batas. Pada keadaan tegangan batas, tidak terjadi aliran arus melalui elektrolit, dan bila tegangan dinaikkan akan terjadi elektrolisis air yang menghasilkan gas hydrogen dan oksigen (Purwanto dan Syamsul, 2005).
4) Konsentrasi Elektrolit
Konsentrasi Elektrolit selama proses elektrodeposisi berlangsung akan mengalami perubahan, dapat disebabkan oleh pengendapan ion logam dari larutan menuju katoda maupun karena penguapan. Pada umumnya kelebihan kadar logam akan menyebabkan menurunnya kekilapan dan kerataan lapisan dan juga mengakibatkan terjadinya pemborosan bahan. Apabila kadar logam rendah akan
commit to user
9
terjadi penurunan konduktivitas sehingga proses plating menjadi lambat (Purwanto dan Syamsul, 2005).
5) Keasaman (Ph)
Keasaman (pH) lebih mempengaruhi sifat fisik deposit daripada komposisinya. Semakin asam larutan konsentrasi ion hidrogennya semakin tinggi dan hantaran arus dari anoda ke katoda semakin besar sehingga semakin banyak ion-ion pelapis yang didistribusikan ke katoda.
6) Waktu
Semakin lama proses elektrodeposisi, maka endapan yang terbentuk semakin banyak. Endapan hanya terbentuk jika ion-ion yang akan dideposisikan dalam larutan masih ada. Jika kandungan ion-ion dalam larutan telah habis maka tidak akan lagi terbentuk endapan atau lapisan.
7) Pengadukan
Pengadukan larutan elektrolit saat proses elektrodeposisi akan mengurangi gelembung-gelembung gas hidrogen. Gelembung-gelembung gas hidrogen ini akan menempel pada anoda dan katoda, sehingga menghalangi proses pelepasan ion dari anoda dan menghambat proses penangkapan ion-ion pelapis oleh katoda. Terhalangnya pelepasan ion-ion pelapis dari anoda mengakibatkan jumlah ion-ion pelapis yang didistribusikan ke katoda menjadi sedikit dan terhambatnya penangkapan ion-ion pelapis oleh katoda mengakibatkan lapisan yang terbentuk tidak rata dan berlubang-lubang.
2.6. Substrat
Substrat yang akan dipakai dalam elektrodeposisi berfungsi sebagai cetakan lapisan tipis dan berpengaruh pada struktur morfologi lapisan hasilnya. Pada penelitian ini substrat yang digunakan adalah tembaga. Tembaga tergolong logam yang kurang aktif, bersifat liat, lunak, permukaannya halus dan cerah. Dalam udara lembab akan terkorosi secara perlahan-lahan. Pertama warnanya berubah menjadi coklat karena terbentuk lapisan tipis oksida logam (CuO) atau tembaga sulfida (CuS) kemudian akan berubah menjadi hijau karena terbentuk lapisan tipis tembaga karbonat basa (Cu2(OH)2CO3. Tembaga merupakan konduktor yang sangat baik, sehingga bisa
commit to user
10
digunakan untuk kawat listrik dan baik digunakan sebagai substrat pada pelapisan logam atau pembuatan logam paduan. Tembaga bersifat elektropositif (mulia), sehingga tembaga mudah diendapkan oleh logam yang deret daya gerak listriknya lebih tinggi seperti besi atau seng. Tembaga relatif inert terhadap berbagai larutan plating, sehingga baik digunakan sebagai substrat (Anton Hartomo dan Kaneko, 1992).
2.7. Lapisan Tipis NiFe
Lapisan tipis Ni-Fe merupakan bahan paduan magnetik dari unsur-unsur logam transisi yaitu nikel dan besi yang merupakan unsur-unsur yang bersifat ferromagnetik. Berdasarkan JCPDS ada beberapa kemungkinan paduan lapisan tipis yang terbentuk dari elemen Ni, Fe. Paduan yang terbentuk hanya mungkin tersusun oleh dua elemen yaitu antara Ni dan Fe, seperti yang ditampilkan pada tabel 2.1.
Tabel 2.1. Kemungkian Paduan-paduan yang Terbentuk dari Elemen Ni dan Fe (Emsley, J. 1991).
Nama Paduan Simbol Paduan
Awaruite, nikel besi
Taenite, besi nikel (Fe,Ni)
besi nikel
Unnamed mineral [NR], besi nikel Awaruite, besi nikel
Kamacite, besi nikel (Fe,Ni)
besi nikel (Fe,Ni)
Taenite, syn, besi nikel (Fe,Ni)
Unnamed mineral [NR], besi nikel (Fe,Ni)
2.8. Material Magnetik
Gerak sebuah elektron dalam orbitnya serupa dengan sebuah sosok arus kecil (arusnya berlawanan dengan arah gerak elektron) dan dapat mengalami torka dalam medan magnetik eksternal. Torka ini cenderung untuk menjajarkan medan magnetik
commit to user
11
yang ditimbulkan oleh elektron, yang memberi kontribusi pada momen magnetik atom hanyalah spin elektron dalam kulit yang tidak lengkap. Kontribusi yang ketiga pada momen sebuah atom ditimbulkan oleh spin nuklir, tetapi pengaruh dari faktor ini biasanya dapat diabaikan.
Medan magnet digambarkan dengan dua vektor yang berlainan: induksi magnet B atau intensitas medan magnet H. Hubungan antara B dan H adalah (Omar, 1975) 0 = B H (2.14) dimana 7 0 4 10 H x
m merupakan permeabilitas ruang hampa.
Ketika bahan material ditempatkan dalam medan magnet akan mengalami magnetisasi. Magnetisasi disimbulkan dengan vektor M , yaitu momen dipol per satuan volume. Induksi magnet dalam bahan diberikan dalam persamaan.
(2.15) Karena magnetisasi disebabkan oleh medan, maka M sebanding dengan H, sehingga:
(2.16) merupakan suseptibilitas magnetik bahan. M sebanding dengan H, medan luar. Suseptibilitas magnet besarnya kontribusi yang diberikan suatu bahan yang berada dalam pengaruh medan magnet terhadap seluruh rapat fluks magnet yang ada.
Berdasarkan arah dan nilai suseptibilitas magnetnya material magnetik dapat dikelompokkan menjadi tiga, yaitu material paramagnetik, diamagnetik dan feromagnetik (Omar, 1975).
2.8.1. Material Paramagnetik
Material paramagnetik mempunyai kepekaan yang positif dan kecil terhadap medan magnet. Material paramagnetik merupakan material yang sedikit tertarik terhadap suatu medan magnet dan mempunyai nilai positif yaitu untuk M parallel
H. Material paramagnetik mempunyai momen dipol magnet permanen, sehingga momen magnetnya acak bila tidak dipengaruhi oleh medan magnet luar, tapi bila
commit to user
12
dikenai medan luar, sebagian momen magnet akan menjadi searah dengan medan magnet luar tersebut. Material paramagnetik memiliki nilai suseptibilitas antara 10-6 sampai 10-2. Contoh material paramagnetik adalah oksigen, sodium, aluminium, tungsten, gadolinium, platinum dan titanium (Omar, 1975).
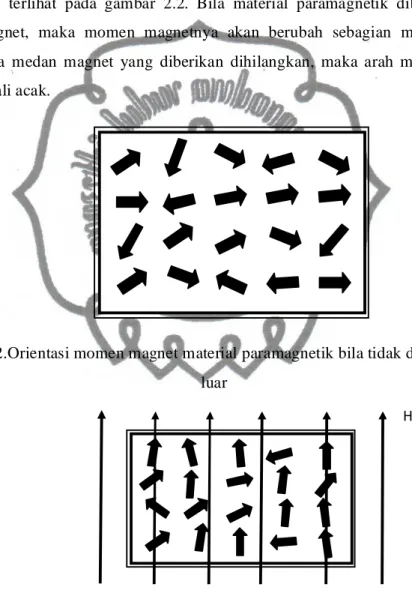
Skema momen magnet pada material paramagnetik bila tidak diberi medan luar seperti terlihat pada gambar 2.2. Bila material paramagnetik diberi pengaruh medan magnet, maka momen magnetnya akan berubah sebagian mengikuti arah medan. Bila medan magnet yang diberikan dihilangkan, maka arah momen magnet akan kembali acak.
Gambar 2.2.Orientasi momen magnet material paramagnetik bila tidak dikenai medan luar
Gambar 2.3. Orientasi momen magnet material paramagnetik bila dikenai medan luar
commit to user
13
2.8.2. Material Ferromagnetik
Material feromagnetik merupakan material yang mengalami gejala magnetisasi secara spontan tanpa adanya medan magnet dari luar. Bahan feromagnetik mempunyai kepekaan yang positif dan besar terhadap medan magnet eksternal. Material feromagnetik mempunyai momen dipol yang sangat kuat yang berasal dari spin elektron.
Dalam bahan feromagnetik, masing-masing atom memiliki momen dwikutub yang relatif besar, yang terutama ditimbulkan oleh momen spin elektron yang tak terkompensasi. Gaya antara atom menyebabkan momen ini mempunyai arah yang sejajar dalam suatu daerah yang terdiri dari banyak atom. Daerah ini disebut domain, bentuk serta ukurannya dapat bermacam-macam berkisar dari ukuran satu mikrometer sampai beberapa sentimeter.
Tanpa adanya medan luar orientasi domain acak, sehingga jumlah magnetisasi secara makroskopik adalah nol. Domain merupakan daerah yang mempunyai momen dipol sama. Di bawah temperatur Curie, bahan feromagnetik terbagi dalam beberapa domain. Domain-domain tersebut termagnetisasi dalam arah yang berbeda seperti yang di tunjukkan dalam gambar 2.3. Domain-domain tersebut dipisahkan oleh dinding domain yang mengalami peralihan arah magnetisasi.
Gambar 2.4. Arah domain material feromagnetik tanpa medan luar (Omar, 1975) Material yang termasuk dalam golongan feromagnetik adalah logam transisi seperti besi, cobalt, nikeldan paduan beberapa logam seperti NiFe (Omar, 1975). Gejala magnetisasi terjadi hanya dibawah temperatur tertentu, yaitu temperatur transisi feromagnetik, yang biasa disebut dengan temperatur Curie. Temperatur tersebut tergantung pada bahan, tetapi nilainya berode sekitar 1000 K. Temperatur Curie untuk Co, Fe, dan Ni masing-masing adalah 1388 K, 1043 K dan 627 K (Kittel, 1996).
commit to user
14
Gambar 2.5. Pengaruh suhu terhadap sifat bahan feromagnetik (Omar, 1975) Diatas temperatur Curie momen dipol berorientasi secara acak sehingga magnetisasinya nol. Pada daerah ini material berubah menjadi bersifat paramagnetik.
Pemberian medan magnet membuat domain tumbuh mendesak domain yang lain karena migrasi batas domain. Sehingga seluruh spesimen mengalami magnetisasi (Omar, 1975). Nilai magnetisasi bergantung pada besar medan magnet luar yang diberikan. Magnetisasi akan mencapai nilai maksimum jika momen magnetik atom sudah sejajar seluruhnya. Nilai maksimum ini disebut magnetisasi jenuh (Ms).
Gambar 2.6. menunjukkan arah momen magnet pada material feromagnetik saat berada dalam pangeruh medan magnet.
Gambar 2.6. Arah momen magnet material feromagnetik saat H = 0 dan saat diberi medan magnet luar H
a. Besi
Besi murni adalah logam yang berwarna putih mengkilat dan relatif lunak. Besi merupakan logam yang reaktif dan mudah terkorosi dalam udara lembab. Besi mudah dicampurkan dengan zat-zat lain sehingga menjadi bahan yang
Paramagne k Ms Feromagne k Tc T(K) H
commit to user
15
keras dan tidak mudah berkarat. Konfigurasi elektron dari atom 26Fe adalah 1s2
2s2 2p6 3s2 3p6 4s2 3d6.
Gambar 2.7.Konfigurasi elektron pada sub kulit 3d6 untuk Fe (Smith, 1993)
Besi mempunyai nomor atom 26 dan empat elektron yang tidak berpasangan pada sub kulit 3d, hal ini menyebabkan besi mempunyai momen magnet yang tidak nol. Momen magnet ini disebabkan karena adanya pergerakan elektron yang mengelilingi inti dan berputar pada sumbunya. Setiap elektron yang berputar mempunyai momen dipol magnet yang biasa disebut dengan magneton Bohr yang nilainya = 9,27 x 10-24 Am2 (Smith, 1993). b. Nikel
Nikel merupakan logam yang berwarna putih mengkilat, keras dan tahan korosi. Sifat-sifat seperti itu dapat dimanfaatkan untuk melapisi barang-barang yang terbuat dari besi, baja atau tembaga, sehingga barang-barang itu terlindungi dari korosi. Nikel juga biasa digunakan sebagai paduan logam seperti stainless steel, monel ( Ni, Cu, dan sedikit Fe), nikrom (Ni, Fe, dan Cr), alniko (Al, Ni, Fe, dan Co), dan paduan NiFe.
Konfigurasi elektron dari atom 28Ni adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d8.
Nikel mempunyai nomor atom 28 dan dua elektron yang tidak berpasangan pada sub kulit atom 3d.
Gambar 2.8. Konfigurasi elektron pada sub kulit 3d8 untuk Ni (Smith, 1993)
26Fe
commit to user
16
2.6.3. Material Diamagnetik
Bahan diamagnetik yaitu bahan yang terdiri dari atom yang memiliki momen magnetik permanen sama dengan nol. Medan magnetik eksternal tidak akan menimbulkan torka pada atom dan tidak menimbulkan penjajaran medan dwikutub, sehingga medan magnetik internalnya sama dengan medan magnetik yang kita pasang.
H = 0 H
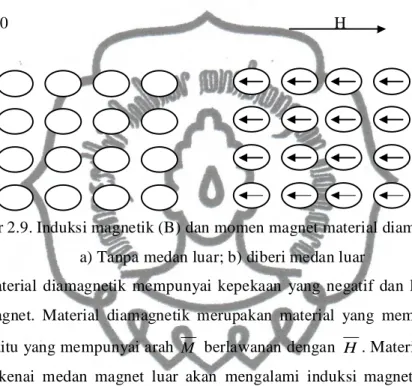
Gambar 2.9. Induksi magnetik (B) dan momen magnet material diamagnetik saat a) Tanpa medan luar; b) diberi medan luar
Material diamagnetik mempunyai kepekaan yang negatif dan lemah terhadap medan magnet. Material diamagnetik merupakan material yang mempunyai nilai negatif, yaitu yang mempunyai arah M berlawanan dengan H. Material diamagnetik apabila dikenai medan magnet luar akan mengalami induksi magnetik yang lemah yang arahnya berlawanan dengan arah medan luar. Bila medan luar dihilangkan induksi dan momen dipol lenyap. Besarnya suseptibilitas magnet sekitar = 10-6.
Material yang termasuk dalam kelompok diamagnetik diantaranya: bismuth, gold, silver, water, carbondioxide, hydrogen, copper (Griffiths, 1989).
2.7. Klasifikasi Soft dan Hard Material Magnetik
Klasifikasi secara sederhana dari material ferromagnetik berdasarkan koersivitasnya dapat dibedakan menjadi dua yaitu soft material magnetik dan hard material magnetik. Untuk material yang mempunyai nilai koersivitasnya yang tinggi disebut sebagai hard material magnetik sedangkan untuk material yang mempunyai nilai koersivitas yang rendah disebut sebagai soft material magnetik.
commit to user
17
Untuk hard material magnetik adalah material yang mempunyai nilai koersivitas diatas 10 kA/m, serta sukar dihilangkan sifat magnetik. Untuk soft material magnetik adalah material yang mempunyai nilai koersivitas dibawah 1kA/m, serta mudah dihilangkan sifat magnetik.
2.8. Kurva Histerisis
Karakteristik suatu material ferromagnetik dapat dilihat dari kurva histerisis yang menggambarkan hubungan antara medan magnet luar, induksi magnet dan magnetisasi dengan persamaan:
(2.17)
Dengan:
B = induksi magnet (tesla) H = medan magnet luar (A/m) M = magnetisasi (A/m)
= permeabilitas ruang hampa Karena :
(2.18) Dengan J merupakan polarisasi dalam satuan tesla maka persamaan (2.18) menjadi:
(2.19)
Kurva histerisis memiliki 2 tipe berbeda yaitu :
1. B terhadap H ( B vs H), loop histerisis disebut loop B-H 2. J terhadap H ( J vs H), loop histerisis disebut loop J-H
Menurut teori elektromagnetik tenaga yang terdesipasi sebagai panas persatuan volume akan sebesar H-dB. Ini sama dengan luasan yang dibatasi oleh kurva histerisis dan sumbu H pada grafik kurva histeris.
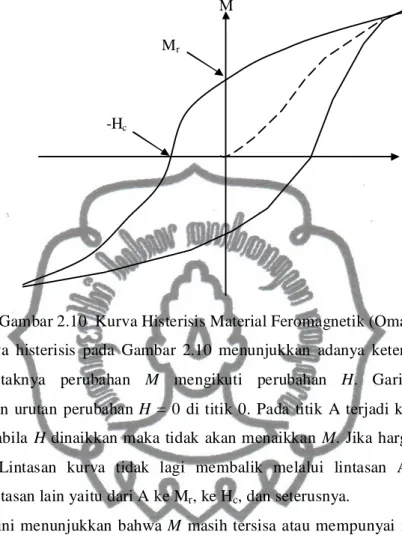
Berbeda dengan gejala pragmatik, maka dalam feromagnetik medan magnet yang dikenakan menjadi sangat kuat. Selain itu hubungan antara induksi magnet (B) dan kuat medan magnet (H) tidak tetap, melainkan tergantung pada proses perubahannya. Gambar 2.10 memperlihatkan kurva histeris dari material feromagnetik.
commit to user
18
Gambar 2.10 Kurva Histerisis Material Feromagnetik (Omar, 1975) Kurva histerisis pada Gambar 2.10 menunjukkan adanya keterlambatan atau tidak serentaknya perubahan M mengikuti perubahan H. Garis putus-putus menunjukkan urutan perubahan H = 0 di titik 0. Pada titik A terjadi kejenuhan akan M, yaitu apabila H dinaikkan maka tidak akan menaikkan M. Jika harga H di titik A diperkecil, Lintasan kurva tidak lagi membalik melalui lintasan A0, melainkan melewati lintasan lain yaitu dari A ke Mr, ke Hc, dan seterusnya.
Hal ini menunjukkan bahwa M masih tersisa atau mempunyai nilai meskipun M sudah bernilai 0 dan bahan feromagnetik masih bersifat sebagai magnet. Pada saat B = Mr, untuk H = 0 sisa harga Mr disebut remanensi magnetik. Untuk menghilangkan
sisa kemagnetan Mr, diperlukan medan magnet yang arahnya berlawanan dan kuat
medannya sebesar Hc. Kuat medan Hc disebut dengan gaya koersif.
2.9. X-ray Fluorescence Spectrometry
Spektroskopi XRF adalah teknik analisis unsur yang membentuk suatu material dengan dasar interaksi sinar-X dengan material analisis. Teknik ini banyak digunakan dalam analisa material karena membutuhkan jumlah sampel yang relatif kecil. Teknik ini dapat digunakan untuk mengukur unsur-unsur yang tertutama banyak terdapat dalam mineral. Sampel yang digunakan biasanya berupa serbuk hasil penggilingan atau pengepresan menjadi bentuk lapisan (Beckhoff, 2005).
H
M A
-Hc
commit to user
19
Pada tabung pembangkit sinar-X, elektron dari kulit bagian dalam suatu atom pada sampel analis menghasilkan sinar-X dengan panjang gelombang karakteristik dari setiap atom di dalam sampel. Untuk setiap atom di dalam sampel, intensitas dari sinar-X karakteristik tersebut sebanding dengan jumlah (konsentrasi) atom di dalam sampel. Dengan demikian, jika kita dapat mengukur intensitas sinar X karakteristik dari setiap unsur, kita dapat membandingkan intensitasnya dengan suatu standar yang diketahui konsentrasinya, sehingga konsentrasi unsur dalam sampel bisa ditentukan (Beckhoff, 2005).
Instrumen yang digunakan untuk melakukan pengukuran tersebut dinamakan X-Ray Fluorescence Spektrometer. Peralatan ini terdiri dari tabung pembangkit sinar-X yang mampu mengeluarkan elektron dari semua jenis unsur yang sedang diteliti. Sinar-X ini yang dihasilkan harus berenergi sangat tinggi, sehingga anoda target dalam tabung pembangkit harus berupa unsur Cr, Mo, W, atau Au.
Sinar-X yang dihasilkan ini, kemudian dilewatkan melalui suatu kolimator untuk menghasilkan berkas sinar yang koheren. Berkas sinar ini kemudian didifraksikan oleh kisi kristal yang sudah diketahui nilai tebal kisinya. Dengan menggunakan persamaan Bragg kita dapat menentukan sudut dari sinar-X yang telah diketahui panjang gelombangnya. Kemudian kristal dan detektor diatur untuk mendifraksikan hanya panjang gelombang tertentu.
commit to user
20
Intensitas sinar-X karakteristik untuk setiap unsur yang sedang diselidiki ditentukan dengan cara merotasikan kristal dan detektor pada sudut yang dibutuhkan untuk mendifraksi panjang gelombang karakteristik tersebut. Intensitas sinar-X kemudian diukur untuk setiap unsur dan setiap unsur pada standar yang telah diketahui konsentrasinya.
Kelebihan dari metode XRF adalah : 1. Akurasi yang tinggi.
2. Dapat menentukan unsur dalam material tanpa adanya standar.
3. Dapat menentukan kandungan mineral dalam bahan biologik maupun dalam tubuh secara langsung.
Kelemahan dari metode XRF adalah :
1. Tidak dapat mengetahui senyawa apa yang dibentuk oleh unsur-unsur yang terkandung dalam material yang akan kita teliti.
2. Tidak dapat menentukan struktur dari atom yang membentuk material itu.
2.10. Scanning Tunneling Microscopy
Proses Scanning Microscopy tunnelling dikembangkan oleh Gerd Bin- nig dan Heinrich Rohrer di IBM Zurich laboratorium pada tahun 1981, dan memperoleh Hadiah Nobel untuk Fisika pada tahun 1986. Proses ini memiliki kemampuan untuk gambar dan memanipulasi atom individu dalam lingkungan non vakum disuhu kamar.
STM adalah mikroskop non-optik yang membaca probe listrik pada permukaan yang kemudian dicitrakan untuk mendeteksi arus listrik antara tip dan permukaan atom yang dipelajari. STM memungkinkan para ilmuwan untuk memvisualisasikan densitas elektron dan mengetahui posisi masing-masing atom dan jari-jari permukaan kisi. STM menghasikan bentuk tiga dimensi dari permukaan yang berguna untuk mengkarakterisasi kekasaran permukaan dan mengetahui ukuran dan komposisi molekul yang menyusun permukaan atom. Sebuah Mikroskop STM menggunakan sebuah plat atom tajam iridium ujung dalam hubungannya dengan X piezoelektrik, scanner Y dan elektronik kontrol umpan balik. Seperti gambar 2.12
commit to user
21
Gambar 2.12. Skema Komponen Penyusun STM
(Website.http://wikimedia.org/ScanningTunnelingMicroscope_schematic.png) Prinsip kerja STM menggunakan prinsip mekanika kuantum dimana elektron pada permukaan material dan elektron pada tip menyebabkan terjadinya arus tunneling. Sebuah probe penghubung dengan tip (ujung scan) yang sangat runcing digerakkan diatas permukaan suatu material yang konduktif. Interaksi antara tip dan permukaan menyebabkan elektron dipermukaan akan ditarik sehingga menyebabkan elektron di permukaan menjadi energi total terendah dibandingkan elektron di tip. Berdasarkan mekanika kuantum, elektron akan dapat bergerak melewati penghalang dari permukaan ke tip karena adanya proses tunneling. Elektron yang terkumpul pada atom logam pada permukaan memberikan jarak yang sangat kecil dibawah permukaan. Ketika tip yang sangat tajam diletakkan cukup dekat dengan permukaan, ada interaksi yang kuat antara elektron pada permukaan dan tip kemudian arus tunneling mengalir ketika tegangan yang kecil dikenakan. Pada daerah dengan diameter atom kecil, arus tunneling meningkat perlahan dengan penurunan jarak antara tip dan permukaan. Perubahan arus dengan jarak menghasilkan resolusi jika tip membaca seluruh permukaan untuk menghasilkan citra.
commit to user
22
BAB III
METODE PENELITIAN
3.1. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Sub Lab Kimia Laboratorium Pusat Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta. Waktu pelaksana penelitian ditempuh selama 5 bulan mulai dari bulan Agustus 2011 sampai Januari 2012.
3.2. Alat dan Bahan yang Digunakan 3.2.1. Alat Penelitian
Alat yang digunakan dalam penelitian ini meliputi alat yang digunakan dan alat karakterisasi.
Alat-alat yang digunakan:
1. Electrolityc analyzer, Model: AES-2D,Yanaco 1 set 2. Magnetic Stirrer and Hot Plate, Model: 4658,Cole Parmer 1 buah
3. PH meter, Model: Combo, Hanna 1 buah
4. Neraca analitik, max = 310 gr; d = 0,001 gr, Model :Bp3103,Sartorius
5. Stopwatch 1 buah
6. Statif dan holder 1 set
7. Peralatan gelas 1 set
Alat untuk karakterisasi hasil lapisan tipis NiFe:
Peralatan yang digunakan adalah sebagai berikut :
1. X-Ray Fluoresence 1set
2. Scanning Tunneling MicroscopyModel: nano surf 1 set 3. Alternating Gradient Field Magnetometer 1 set
commit to user
23
3.2.2. Bahan Penelitian
Bahan Kimia yang digunakan pada penelitian ini adalah:
1. NiSO4.6H2O p.a., Merck 2,63 gr/L
2. FeSO4.7H20 p.a., Merck 0,34 gr/L
3. H3BO3 p.a., Merck 24,72 gr/L 4. SO4.5 H2O p.a., Merck 9,98 gr/L 5. H2SO4 10 ml 6. C8H8O3 p.a., Merck 1,00 gr/L 7. Aquades secukupnya 3.3. Metode Penelitian
Metode yang digunakan dalam penelitian ini adalah metode eksperimen. Alur penelitian yang dilakukan dapat dilihat pada gambar :
Gambar 3. 1. Diagram Alur Penelitian
Persiapan Substrat Pembuatan Formula Cooper strike Pembuatan Larutan Elektrolit Elektrodeposisi Elektrodeposisi variasi waktu dan Rapat arus
Karakterisasi struktur morfologi
Karakterisasi komposisi dan Karakterisasi magnetik
Analisa Data
commit to user
24
3.4. Teknik Analisa Data 3.4.1. Persiapan Substrat
Persiapan substrat memiliki beberapa tahapan proses sebagai berikut :
3.4.1.1. Pemotongan plat tembaga
Pemotongan plat tembaga dilakukan dengan menggunakan pisau cutter. Plat tembaga yang digunakan berbentuk strip, dipotong dengan dimensi (2,5 × 4) cm2.
3.4.1.2. Pemolesan Plat Tembaga Secara Mekanik (Mechanical Polishing)
Pemolesan secara mekanik merupakan salah satu pretreatment fisika sebelum benda kerja (substrat) siap untuk dielektrodeposisi. Perlakuan tersebut bertujuan untuk menghilangkan kotoran-kotoran atau lemak yang terdapat pada permukaan substrat pada plat tembaga. Tingkat keberhasilan pemolesan ditunjukan oleh permukaan tembaga terlihat semakin mengkilap. Papan PCB yang akan digunakan diolesi dengan autosol yang kemudian digosok dengan kertas tissue.
3.4.1.2. Perlakuan Awal Plat Tembaga Sebelum Elektrodeposisi NiFe
Selain Pretreatment fisika, plat tembaga (substrat) juga perlu diberi pretreatment kimia agar permukaannya lebih bersih dan siap (permukaannya telah aktif) untuk dielektrodeposisi, oleh karena kebersihan dan kesiapan permukaan substrat dapat mempengaruhi hasil akhir pelapisan dan kelekatan substrat-deposit, pretreatment untuk substrat (logam dasar) tembaga yaitu :
1. Pembilasan ,
Semua proses pembilasan menggunakan akuades. Setelah plat tembaga dibilas, lalu dikeringkan dengan menggunakan tissue kering.
2. Copper Strike,
Proses cooper strike menggunakan prinsip elektrolisis sistem dua elektroda yang terdiri dari satu buah anoda dan satu buah katoda, posisi anoda dan katoda saling berhadapan. Logam yang dilapisi (sebagai katoda) adalah Tembaga. Sedangkan anodanya adalah Pt (4 cm × 2,5 cm). Jarak antar elektroda adalah 3 cm. Elektrolisis
commit to user
25
setiap pengerjaan copper strike membutuhkan 100 ml campuran larutan pada Tabel 3.1.
Tabel 3.1. Formula Bak Sulfat Desain untuk Elektrolit Copper Strike
Bahan Konsentrasi
O 0,04 M
0,10 M ditetesi
Akuades (sebagai pelarut) Disesuaikan kebutuhan volume
3.4.2. Proses Elektrodeposisi
3.4.2.1 Pembuatan Larutan Elektrolit dan Proses Elektrodeposisi NiFe
1. Persiapan pembuatan larutan Elektrolit
Larutan elektrolit dibuat dengan mencampurkan serbuk NiSO4.6H2O (0,02 M),
FeSO4.7H2O (0,02 M), H3BO3 (0,4 M), dan Vanily 0.1 gr dalam 100 mL aquades.
Serbuk H3BO3 berfungsi untuk mempercepat menempelnya ion Fe2+ dan Ni2+ pada
substrat Tembaga. Penambahan vanily dalam larutan elektrolit ini bertujuan untuk mendapatkan lapisan yang padat dan halus dengan permukaan yang mengkilap dan mempunyai daya rekat yang baik dengan substrat. Larutan elektrolit tersebut diaduk menggunakan pengaduk magnetic stirrer sampai samua bahan bahan tersebut larut dalam aquades. pH larutan elektrolit diukur menggunakan pH-meter, sebagai pengontrolnya digunakan H2SO4 pekat. Fungsi larutan elektrolit adalah sebagai
pelapis karena mengandung bahan-bahan yang akan digunakan untuk membuat lapisan tipis NiFe dan sebagai penghantar arus, yaitu penghantar ion-ion logam dari anoda ke katoda.
2. Elektrodeposisi
Pada penelitian ini proses elektrodeposisi dilakukan menggunakan substrat Tembaga dalam bentuk PCB pada tegangan 5 volt selama 10 menit karena pada penelitian ini dalam suhu kamar dan tanpa pengadukan. Selanjutnya plat tembaga dalam bentuk PCB tersebut ditimbang beratnya sebelum dielektrodeposisi. Sebelum melakukan elektrodeposisi NiFe terlebih dahulu dilakukan proses copper strike plating.
commit to user
26
Proses elektrodeposisi NiFe menggunakan prinsip elektrolis sistem dua elektroda, yang terdiri dari satu buah anoda dan satu buah katoda. Posisi anoda dan katoda saling berhadapan. Logam yang dilapisi (sebagai Katoda) adalah tembaga sedangkan anodanya adalah Pt. Jarak antar elektroda adalah 3 cm. Elektrolisis dikerjakan selama 10 menit, tanpa pengadukan. Alat elektrodeposisi yang digunakan ditunjukan oleh Gambar 3.2
. Gambar 3.2. Foto Skema Proses Elektrodeposisi
3.4.3 Karakterisasi Sampel
Pada penelitian ini uji karakterisasi lapisan tipis yang dilakukan adalah Karakterisasi komposisi lapisan tipis NiFe yang terbentuk dengan menggunakan XRF, mikro stuktur dengan STM serta karakteristik magnetik lapisan yang terbentuk menggunakan AGFM.
3.4.4 Analisa Analisa meliputi :
1. Teknik pengumpulan data 2. Teknik analisa data
3.4.5 Teknik Pengumpulan dan Analisa Data 3.5.1. Teknik Pengumpulan Data
Penelitian ini memperoleh data-data sebagai berikut : a. Komposisi lapisan tipis NiFe hasil elektrodeposisi.
commit to user
27
Pengambilan data diperoleh dengan melakukan uji identifikasi sampel lapisan NiFe yang dikerjakan menggunakan XRF. Pengujian dilakukan terhadap sampel NiFe hasil elektrodeposisi optimum yang ditinjau dari karakter tekstur permukaan. Proses pengujian sampel dikerjakan di Lab. MIPA Terpadu Universitas Sebelas Maret.
Untuk menghitung komposisi NiFe yang terbentuk dari hasil elektrodeposisi dapat menggunakan persamaan sebagai berikut:
(3.1)
(3.2)
b. Ketebalan Lapisan Tipis NiFe.
Pengambilan data dilakukan dengan menggunakan neraca analitik dengan ketelitian sebesar 0,001 gr. Pengukuran ini dimaksudkan untuk mencari ketebalan lapisan yang terbentuk pada permukaan substrat tembaga. Sebelum dilakukan proses pelapisan terlebih dahulu substrat tembaga ditimbang untuk mengetahui massa dari substrat tembaga tersebut. Kemudian setelah terjadi proses pelapisan, substrat tembaga ditimbang kembali sehingga diketahui massa substrat tembaga sesudah proses pelapisan. Menghitung nilai ketebalan dengan menggunakan persamaan 3.6. pengukuran ketebalan dilakukan dengan menggangap bahwa tebal lapisan yang terbentuk adalah homogen dan massa jenis yang digunakan adalah 8,74 gr/cm2.
Perkalian antara massa jenis dengan Volume lapisan tipis adalah massa lapisan itu sendiri yang dapat ditulis dengan persamaan sebagai berikut:
(3.3) dengan (3.4) maka
(
3.5) Sehingga untuk menghitung ketebalan lapisan tipis NiFe yang terbentuk dapat ditulis dengan persamaan sebagai berikut (Lowenheim,1978) :(3.6)
commit to user
28
tebal lapisan yang terbentuk = panjang substrat tembaga
lebar substrat tembaga = massa jenis lapisan tipis
massa lapisan yang terbentuk
c. Mikrostruktur dari lapisan tipis NiFe hasil elektrodeposisi
Pengambilan data diperoleh dari pengujian sampel dengan menggunakan alat STM yang berada di Laboratorium Pusat MIPA Universitas Sebelas Maret Surakarta. Prosedur langkah kerja pengujian lapisan tipis NiFe hasil elektrodeposisi sebagai berikut :
1. Memotong sampel dengan ukuran 0,9 cm x 0,9 cm.
2. Menjepit sampel dengan menggunakan lempeng seng. Penjepitan ini bertujuan agar sampel terkoneksi dengan holder.
3. Membuka software easyscan di dekstop pada layar komputer. Tunggu mikroskop terhubung dengan komputer, yang ditandai dengan menyalanya lampu merah pada mikroskop.
4. Meletakkan sampel yang sudah dipotong di holder sampai warna lampu merah pada mikroskop berubah menjadi hijau.
commit to user
29
d. Karakteristik magnetik lapisan tipis NiFe
Data tersebut diperoleh dengan melakukan uji identifikasi sampel lapisan NiFe menggunakan AGFM Uji AGFM dilakukan dengan cara memberikan medan magnet luar pada lapisan tipis NiFe. Metode pemberian medan magnet luar (magnetisasi) yaitu dengan cara medan magnet diberikan tegak lurus dan sejajar bidang sampel. Hasil dari karakterisasi AGFM menghasilkan kurva yang menggambarkan sifat- sifat magnetik lapisan tipis NiFe hasil elektrodeposisi.
3.5.2. Teknik Analisa Data
Analisa pertama mengenai komposisi lapisan tipis NiFe hasil elektrodeposisi. Dari analisa ini akan diketahui berapa kandungan Ni dan Fe yang terbentuk pada penelitian ini. Dengan cara pengujian sampel menggunakan XRF di dapatkan hasil komposisi lapisan tipis NiFe yang terbentuk.Analisa kedua mengenai ketebalan lapisan tipis NiFe yang didapatkan hasil dari perhitungan menggunakan persamaan 3.6. dengan perhitungan maka ketebalan lapisan tipis NiFe yang terbentuk dapat di ketahui. Analisa ketiga mengenai tekstur permukaan morfologi lapisan tipis NiFe dengan menggunakan STM. Dari hasil analisa ini dapat diketahui bagaimana pengaruh perubahan rapat arus dan waktu elektrodeposisi terhadap karakter mikroskopik permukaan deposit lapisan tipis NiFe yang akan dihasilkan. Analisa keempat adalah tentang karakteristik magnetik lapisan tipis NiFe hasil dari proses elektrodeposisi.
commit to user
30
BAB IV
HASIL DAN PEMBAHASAN
Dalam penelitian ini, hasil lapisan tipis Ni-Fe ditumbuhkan pada substrat tembaga kemudian dilakukan karakterisasi. Hal pertama yang dilakukan adalah penentuan komposisi lapisan tipis dengan menggunakan XRF. Setelah itu klarifikasi ketergantungan ketebalan dengan waktu dan rapat arus. Metode graviti yaitu penimbangan berat massa yang terdeposit menjadi lapisan tipis digunakan untuk memperhitungkan ketebalan lapisan tipis secara kasar. Kemudian karakterisasi morfologi permukaan lapisan tipis dilakukan dengan STM. Akhirnya untuk mengetahui karakterisasi magnetik lapisan tipis Ni-Fe digunakan AGFM.
4.1. Analisis Komposisi lapisan tipis Ni-Fe
Untuk mengetahui komposisi unsur yang terdeposisi pada hasil penumbuhan lapisan tipis Ni-Fe dilakukan uji komposisi dengan menggunakan XRF. Sampel yang dikarakterisasi adalah lapisan tipis hasil elektrodeposisi dengan menggunakan rapat arus J = 4 selama 10 menit. Sampel ini
merupakan hasil optimasi dari beberapa sampel yang di buat. Hasil karakterisasi berupa kurva spektrograf XRF dan hasil analisis unsur-unsur yang terkandung pada lapisan tipis disajikan pada Gambar 4.1. dan tabel 4.1.
commit to user
31
Tabel 4.1 Unsur-unsur yang terkomposisi didalam lapisan tipis Ni-Fe
Formula Z Concentration Cu 29 94,79 % Ni 28 4,13 % Fe 26 0,49 % Al 13 0,17 % Ca 20 0,15 %
Teramati dengan jelas dari spektrograf XRF bahwa luasan dibawah kurva pada energy eksitasi tertentu menunjukkan nilai kandungan unsur yang terdeposit. Pen-cocok-an level energi dengan unsur diperoleh Tabel 4.1. Terdapat 5 unsur yang terdeposit pada lapsian tipis yang terbentuk. Cu memiliki prosentase tertinggi yaitu 94,79% mengingat substrat lapisan tipis ini adalah lempeng Cu PCB. Sedangkan prosentase Al dan Ca yang ditinjau sebagai pengotor berturut-turut adalah 0,17% dan 0,15%.
Jika hanya ditinjau elemen Ni dan Fe yaitu unsur utama penyusun lapisan tipis maka komposisi unsur dapat dinyatakan dalam prosentase mol. Dengan mengubah komposisi prosentase berat ke komposisi mol, maka prosentase mol lapisan tipis yang terbentuk adalah Ni:Fe = 89:11. Selanjutnya, berdasar komposisi ini akan digunakan untuk mengevaluasi ketergantungan proses elektrodeposisi terhadap waktu maupun rapat arus.
commit to user
4.2. Ketebalan Lapisan Tipis4.2.1. Ketebalan lapisan tipis Ni-Fe Vs Waktu
Untuk menyakinkan kebenaran nilai pengukuran massa terdeposit pada substrat, maka penimbangan dilakukan sebanyak 5 kali untuk setiap sampel. Massa lapisan NiFe dihitung dari selisih rata-rata pengukuran massa sebelum dan rata-rata pengukuran sesudah proses elektrodeposisi. Pengukuran massa lapisan NiFe menggunakan neraca analitik Sartorius model: BP 3103 dengan ketelitian 0,001 gram. Sampel yang digunakan mempunyai dimensi panjang 4 cm dan lebar 2,5 cm. Hasil pengukuran massa lapisan NiFe pada beberapa variasi rapat arus disajikan dalam Tabel 4.2.
Tabel 4.2. Data Massa dan ketebalan Lapisan tipis pada Variasi Waktu pada Suhu
t = 10 Menit t (s) Massa sebelum gram Massa sesudah gram Massa lapisan tipis (10-3) gram Ketebalan (10-4) cm 120 2,5972 0,0004 2,5988 0,0002 ( 1,6 0,4 ) 0,18 0,05 240 2,5274 0,0004 2,5292 0,0004 ( 1,8 0,5 ) 0,20 0,06 360 2,5260 0,0005 2,5286 0,0005 ( 2,6 0,7 ) 0,29 0,08 480 2,4222 0,0004 2,4254 0,0005 ( 3,2 0,6 ) 0,36 0,08 600 2,5772 0,0006 2,5808 0,0004 ( 3,6 0,7 ) 0,41 0,09
Dari hasil perolehan massa lapisan tipis Ni-Fe dapat dihitung dengan menggunakan persamaan 3.6. sehingga terbentuk ketebalan lapisan tipis NiFe pada 1 sisi permukaan sampel Cu.
Dari data ketebalan (d) pada beragam waktu deposisi (t) hasil diskusi sebelumnya dapat di sajikan dalam bentuk grafik d sebagai fungsi t yang ditunjukkan pada Gambar 4.2.
commit to user
33
Gambar 4.2. Grafik Hubungan Ketebalansebagai fungsi Waktu
Teramati dengan jelas bahwa ketebalan d meningkat secara linier dengan kenaikan waktu t. Hal ini sesuai dengan rumus banyaknya material terdeposit pada proses elektrolisa. Hasil ini juga menyakinkan ketebalan lapisan tipis dapat dikontrol dengan waktu deposisi. Dari grafik di atas, jika ditinjau sebagai persamaan y = mx + C, maka gradient persamaan tersebut menunjukkan laju deposisi elektrodeposisi yang berlangsung, yaitu sebesar m = 0,514 nm/s. Dengan menggunakan laju deposisi ini maka variasi ketebalan yang diharapkan yaitu sebesar 50 nm, 100 nm, 150 nm, 200 nm, 250 nm, serta 300 nm dapat diperkirakan lama waktu deposisi yang di rangkum pada Tabel 4.3.
Tabel 4.3. Waktu yang Diperlukan untuk Mendapatkan Ketebalan Lapisan Tipis Ketebalan (nm) Waktu (s) 50 97 100 195 150 292 200 389 250 486 300 584 y = 0.514x + 107.5 R² = 0.974 0 50 100 150 200 250 300 350 400 450 0 100 200 300 400 500 600 700 ke te ba la n nm Waktu s
Ketebalan Vs Waktu
commit to user
4.2.2. Ketebalan Lapisan Tipis Ni-Fe Vs Rapat Arus
Pada studi lapisan tipis hasil elektrodeposisi, variabel penumbuhan lainnya yang mudah dimodifikasi adalah rapat arus, arus yang mengalir tiap satuan luas J = I/A. Seperti prosedur sebelumnya massa lapisan NiFe dihitung dari selisih rata-rata pengukuran massa terdeposisi pada katoda sebelum dan sesudah proses elektrodeposisi. Pengukuran massa lapisan NiFe menggunakan neraca Sartorius model: BP 3103 dengan ketelitian 0,001 g. Hasil pengukuran massa lapisan NiFe pada beberapa variasi rapat arus disajikan dalam Tabel 4.4.
Data yang diperoleh kemudian dapat disajikan dalam bentuk kurva ketebalan d versus rapat arus J seperti yang ditunjukkan pada Gambar 4.3. Teramati dengan jelas bahwa d meningkat secara liniar dengan kenaikan rapat arus J. Hasil ini juga sesuai dengan rumus umum pelapisan dengan metode elektrodeposisi. Hasil ini dan sebelumnya semakin menyakinkan bahwa prosedur eksperimen pada penelitian ini yaitu penumbuhan lapisan tipis Ni-Fe pada substrat Cu PCB telah berlangsung dengan benar.
Tabel 4.4. Data Massa dan Ketebalan Lapisan Tipis pada Variasi Rapat Arus pada Suhu t = 10 Menit
J Massa Sebelum dilapisi gram Massa Sesudah dilapisi gram Massa lapisan tipis (10-3) gram Ketebalan (10-4) cm 2 2,5612 0,0005 2,5666 0,0006 5,4 0,8 0,61 0,09 3 2,5668 0,0008 2,5738 0,0006 7,0 0,9 0,80 0,13 4 2,6400 0,0004 2,6570 0,0006 15,2 0,7 1,73 0,19 5 2,5418 0,0006 2,5610 0,0004 19,2 0,7 2,19 0,23 6 2,6402 0,0005 2,6626 0,0005 22,4 0.5 2,56 0,26 7 2,6046 0,0005 2,6296 0,0005 25,0 0,7 2,86 0,29
commit to user
35
Gambar 4.3. Grafik Hubungan Ketebalan sebagai Fungsi Rapat Arus
4.3. Struktur Permukaan Lapisan Tipis
Hasil karakterisasi struktur morfologi lapisan tipis Ni-Fe pada substrat tembaga dengan menggunakan STM ditunjukkan pada Gambar 4.4 yaitu untuk ketebalan 50 nm, 100 nm, 200 nm dan 300 nm. Luasan scan range ditetapkan 250 nm × 250 nm untuk ke empat sampel uji. Evolusi morfologi permukaan lapisan tipis teramati dari gambar yang diperoleh. Saat ketebalan d = 50 nm, struktur permukaan teramati pola kontur yang memperlihatkan ketidak rataan permukaan. Namun demikian, pola tersebut secara gradual hilang dengan kenaikan ketebalan. Hasil ini memperlihatkan proses perbaikan tingkat kerataan (roughness). Mekanisme perbaikan ini dapat dijelaskan sebagai berikut.
Pada penumbuhan lapisan tipis dengan J konstan, maka ion-ion elektrolit terdeposit pada substrat dengan laju yang sama. Pada waktu yang singkat, sebaran ion terdeposit pada luasan substrat akan terdistribusi dalam kumpulan ion-ion berupa pulau-pulau membentuk lapisan diskrit. Namun seiring dengan meningkatnya waktu, ruang kosong antara sebaran lapisan diskrit dapat diisi oleh ion-ion elektrolit yang menghasilkan lapisan kontinu seperti ditunjukkan pada lapisan ketebalan 300 nm. y = 484.4x - 383.7 R² = 0.963 0 500 1000 1500 2000 2500 3000 3500 0 1 2 3 4 5 6 7 8 ke te ba la n nm
rapat arus mA/cm2
Ketebalan Vs Rapat Arus
commit to user
36
Gambar .4.4. Hasil Penggambaran Scanning Tunneling Microscopy Permukaan Lapisan Ni-Fe Hasil Elektrodeposisi dengan Variasi Ketebalan Lapisan Tipis
commit to user
37
Gambar.4.5. Permukaan Morfologi Lapisan Ni-Fe Hasil Scan STM iuntuk Sampel dengan Variasi Rapat Arus, (a) J = 3 mA/cm2, (b) J = i4 mA/cm2,(c)
J = 5 mA/cm2,(d) J = 6 mA/cm2
Gambar 4.5. memperlihatkan perubahan bentuk morfologi permukaan lapisan Ni-Fe yang dideposisikan dengan variasi rapat arus pada saat elektrodeposisi. Variasi yang dilakukan pada penelitian ini 3 mA/cm2, 4 mA/cm2, 5 mA/cm2 dan 6 mA/cm2. Terlihat dengan jelas bahwa bentuk struktur morfologi permukaan lapisan Ni-Fe yang dideposisikan terlihat berubah dengan perbedaan rapat arus (J) saat elektrodeposisi. Pertumbuhan lapisan Ni-Fe saat J yang diberikan 3 mA/cm2 terlihat tipikal pola pertumbuhan lapisan yang jelas yaitu lapisan tipis yang tersusun lapisan diskrit pulau-pulau. Dengan kenaikan rapat