PEMBUATAN KATALIS ASAM HETEROGEN DENGAN
METODE KARBONISASI HIDROTERMAL SATU TAHAP
Disusun Oleh:
Herry Santoso, S.T., M.T.M., Ph.D.,
Dra. H. Maria Inggrid, M.Sc.,
Evie Christiana, Sharon Arvina,
Maria Prisila Paru, Thomas Santosa,
Albert, Fitriah
Lembaga Penelitian dan Pengabdian kepada Masyarakat
Universitas Katolik Parahyangan
2016
ii
ABSTRAK
Katalis asam merupakan salah satu jenis katalis yang berperan penting dalam industri kimia. Lebih dari 15 juta ton asam sulfat (H2SO4) telah terkonsumsi sebagai katalis yang tidak dapat diperbaharui, yang membutuhkan biaya tinggi dan juga pemisahan katalis yang tidak efisien dari campuran reaksi homogennya (Xiao, et al., 2010). Saat ini, sintesis katalis asam heterogen berbahan dasar sakarida menjadi pusat perhatian untuk menemukan solusi dari masalah tersebut. Katalis berbahan dasar sakarida, yang dapat dibuat dari bahan baku yang memiliki gugus dasar glukosa seperti D-glukosa, sukrosa, pati, dan selulosa, merupakan katalis asam padat, yang terdiri dari material karbon tersulfonasi, sebagai hasil dari proses karbonisasi dan sulfonasi secara bertahap. Untuk meningkatkan efisiensi sekaligus mengurangi penggunaan bahan kimia yang berbahaya yang dapat mencemari lingkungan, proses karbonisasi hidrotermal satu tahap dikembangkan untuk mensintesis katalis karbon dari bahan sakarida. Dalam proses ini, karbonisasi dan sulfonasi dilakukan secara serempak dengan bantuan hydroxyethylsulfonic acid. Lebih lanjut, untuk meningkatkan luas permukaan katalis, material karbon tersulfonasi dapat dipadukan dengan support berbasis silika untuk menghasilkan katalis komposit karbon-silika tersulfonasi. Sebagai sumber silika dapat digunakan tetraethyl orthosilicate (TEOS).
Tujuan penelitian ini adalah untuk mengembangkan proses pembuatan katalis asam heterogen berbahan dasar pati jagung melalui metode karbonisasi hidrotermal satu tahap di mana proses karbonisasi dan sulfonasi dilakukan secara bersamaan. Secara khusus, hal ini meliputi (1) mensintesis katalis asam heterogen melalui proses karbonisasi hidrotermal satu tahap; (2) mengetahui pengaruh penggunaan hydroxyethylsulfonic acid dalam bentuk garam dan dalam bentuk asam dalam pembuatan katalis asam heterogen menggunakan metode karbonisasi hidrotermal satu tahap; (3) mengetahui pengaruh rasio hydroxyethylsulfonic acid
dan tetraethyl orthosilicate (TEOS) terhadap pati jagung dalam pembuatan katalis asam heterogen menggunakan metode karbonisasi hidrotermal satu tahap; (4) mengetahui kinerja katalis asam heterogen yang dihasilkan dalam reaksi esterifikasi asam oleat.
Dari hasil penelitian ditemukan bahwa material yang dihasilkan melalui proses karbonisasi hidrotermal dan sulfonasi secara serempak dengan bantuan sodium hydroxyethyl sulfonate maupun asam hydroxyethyl sulfonate merupakan material komposit karbon-silika dengan luas permukaan yang cukup besar. Material komposit karbon-silika dengan luas permukaan terbesar diperoleh pada variasi percobaan menggunakan asam hydroxyethyl sulfonate, dengan jumlah pati jagung, asam hydroxyethyl sulfonate, dan TEOS masing-masing sebesar 2 gram. Luas permukaan yang dihasilkan adalah 315,853 m2/gram. Akan tetapi, material komposit karbon-silika yang dihasilkan tidak mengandung gugus sulfonat sehingga tidak memiliki kemampuan katalisasi saat dicoba dalam reaksi esterifikasi asam oleat. Dengan demikian dapat disimpulkan bahwa proses hidrotermal dan sulfonasi serempak hanya mampu menghasilkan material komposit karbon-silika, namun gagal memasukkan gugus sulfonat ke dalam material tersebut.
iii
DAFTAR ISI
ABSTRAK ii
DAFTAR ISI iii
BAB I PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Tujuan Penelitian 3
1.3 Urgensi Penelitian 3
BAB II TINJAUAN PUSTAKA 5
2.1 Katalis 5
2.2 Katalis Karbon Tersulfonasi Berbahan Dasar Sakarida 6
2.3 Sintesis Katalis Karbon Tersulfonasi 8
2.3.1 Sintesis Katalis Karbon Tersulfonasi dengan Proses Pirolisis-Sulfonasi 8 2.3.2 Sintesis Katalis Karbon Tersulfonasi Dengan Proses Impregnasi 9 2.3.3 Sintesis Katalis Karbon Tersulfonasi Dengan Proses Hidrotermal 11
BAB III METODOLOGI PENELITIAN 16
3.1 Pembuatan Katalis Asam Heterogen dengan Proses Karbonisasi Hidrotermal 16
3.2 Analisa Sifat Fisik dan Kimia Katalis 18
3.3 Uji Kinerja Katalis 19
BAB IV JADWAL PELAKSANAAN 20
BAB V HASIL DAN PEMBAHASAN 21
5.1 Pembuatan Katalis Dengan Menggunakan Garam Na-hydroxyethyl sulfonate 21
5.1.1 Uji Kinerja Katalis 22
5.1.2 Karakterisasi Katalis 23
5.2 Pembuatan Katalis Dengan Menggunakan Asam Hydroxyethyl Sulfonate 26
5.2.1 Uji Kinerja Katalis 27
5.2.2 Karakterisasi Katalis 28
BAB VI KESIMPULAN DAN SARAN 31
6.1 Kesimpulan 31
6.2 Saran 32
1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Katalis memegang peranan penting dalam industri kimia karena hampir semua produk industri dihasilkan melalui proses yang memanfaatkan jasa katalis, baik dalam salah satu atau beberapa proses di dalamnya. Katalis sangat berperan dalam pengaktifan reaksi yang dapat mempercepat laju reaksi dengan cara menurunkan energi aktivasi. Secara umum katalis digolongkan mejadi katalis homogen dan katalis heterogen. Katalis homogen merupakan katalis yang memiliki fasa yang sama dengan reaktan dan produk reaksinya.
Katalis homogen memiliki kelebihan yakni dapat tercampur secara sempurna dalam campuran reaksi sehingga dapat dianggap memiliki luas permukaan kontak yang tidak terbatas. Adapun keunggulan katalis heterogen adalah ramah lingkungan, tidak bersifat korosif, mudah dipisahkan dari produk, serta dapat digunakan berulangkali dalam jangka waktu yang lama. Selain itu, katalis heterogen dapat meningkatkan kemurnian hasil karena pemisahan yang relatif mudah antara katalis dengan campuran reaksinya. Katalis heterogen secara umum berbentuk padat dan banyak digunakan pada reaktan berwujud cair atau gas.
Katalis asam merupakan salah satu jenis katalis yang berperan penting dalam proses kimia. Lebih dari 15 juta ton asam sulfat (H2SO4) telah terkonsumsi sebagai katalis yang tidak dapat diperbaharui, yang membutuhkan biaya tinggi serta pemisahan katalis yang tidak efisien dari campuran reaksi homogennya (Xiao, et al., 2010). Oleh karena itu berbagai penelitian mengenai katalis asam heterogen terus dikembangkan guna mengatasi kelemahan dari katalis asam homogen tersebut. Namun permasalahannya adalah langkanya katalis asam heterogen yang memiliki keaktifan dan kestabilan yang tinggi, serta harga yang relatif murah dibandingkan dengan asam sulfat.
Katalis asam padat konvensional seperti Amberlyst-15, Nafion-NR50, dan Zirconia Sulfat kebanyakan memiliki stabilitas yang rendah dan harganya mahal. Oleh karena itu diperlukan upaya lebih lanjut untuk mengembangkan katalis asam heterogen dengan performa yang tinggi namun dengan harga yang lebih ekonomis. Katalis asam padat berbasis karbon tersulfonasi banyak diminati karena memiliki stabilitas termal yang tinggi (Liang, et al., 2011). Penelitian menunjukan bahwa katalis asam padat berbasis karbon tersulfonasi dari sakarida terutama pati merupakan katalis yang sangat efektif dan merupakan katalis asam
2
padat yang menjanjikan dibandingkan dengan jenis katalis padat berbahan dasar karbon lainnya (Lou, et al., 2008). Pati jagung adalah pati yang baik untuk digunakan sebagai bahan baku pembuatan katalis asam karena memiliki kandungan amilopektin yang tinggi.
Sintesis katalis asam heterogen berbahan dasar pati dapat dilakukan melalui proses pirolisis disertai dengan impregnasi untuk menghasilkan material karbon polisiklik aromatic dengan luas permukaan yang besar yang kemudian dilanjutkan dengan proses sulfonasi untuk menambahkan gugus aktif –SO3H ke dalam material karbon polisiklik tersebut. Meskipun proses pirolisis-sulfonasi mampu menghasilkan katalis asam heterogen yang stabil dan memiliki nilai acid site density yang cukup tinggi serta proses impregnasi mampu menghasilkan luas permukaan spesifik yang lebih besar, namun proses pirolisis yang dilakukan pada temperatur tinggi (± 400 oC) dan dalam waktu yang lama (15 jam) menjadikan proses ini kurang ekonomis dan tidak ramah lingkungan. Lebih lanjut, pada proses sulfonasi dibutuhkan asam sulfat pekat (96%) yang cukup banyak dan dilakukan pada temperatur 150oC selama 15 jam juga menjadi pertimbangan tersendiri bagi para ilmuwan untuk mengembangkan sintesis katalis asam heterogen berbahan dasar sakarida dengan proses yang lebih ramah lingkungan. Salah satu proses yang dapat digunakan untuk menghasilkan katalis berbahan dasar sakarida adalah dengan proses karbonisasi hidrotermal satu tahap.
Proses karbonisasi hidrotermal satu tahap merupakan metode untuk membentuk material karbon polisiklik aromatik sekaligus memasukan gugus fungsi tertentu ke dalam kerangka karbon yang dihasilkan dengan menambahkan zat aditif tertentu. Kelebihan dari proses ini adalah kondisi temperatur yang relatif lebih rendah dari pirolisis, tidak dibutuhkannya aliran gas inert untuk menghilangkan oksigen dari proses, lebih ramah lingkungan, murah, dan lebih mudah dilakukan (Zhang, et al., 2011). Proses karbonisasi hidrotermal satu tahap dikembangkan untuk mensintesis katalis karbon dari bahan sakarida secara lebih efisien untuk mengurangi limbah kimia yang berbahaya karena meminimalisir penggunaan asam kuat seperti asam sulfat pada proses sulfonasi. Dalam proses karbonisasi hidrotermal satu tahap, tahap karbonisasi dan sulfonasi dilakukan secara serempak. Pada proses ini tidak digunakan asam sulfat pekat melainkan menggunakan hydroxyethylsulfonic acid dimana asam ini tidak memiliki kemampuan dehidrasi yang cepat seperti pada asam sulfat sehingga proses karbonisasi yang dikatalisis dengan asam ini berjalan lebih lambat dan gugus hidroksil yang terlibat dalam proses ini mampu mengikat gugus –SO3H ke permukaan katalis.
3
Dalam penelitian ini, akan dilakukan pembuatan katalis asam heterogen menggunakan metode karbonisasi hidrotermal dan sulfonasi secara serempak (karbonisasi hidrotermal satu tahap). Katalis asam heterogen akan dibuat dari bahan baku berbahan dasar sakarida yaitu pati jagung. Sebagai agen sulfonasi, akan digunakan hydroxyethylsulfonic acid.
Hydroxyethylsulfonic acid pada dasarnya merupakan senyawa yang tidak stabil sehingga umumnya dijual dalam bentuk garam. Oleh karena itu dalam penelitian ini akan dilakukan variasi pembuatan katalis asam heterogen menggunakan hydroxyethylsulfonic acid dalam bentuk garam dan hydroxyethylsulfonic acid dalam bentuk asam untuk melihat pengaruhnya terhadap katalis yang dihasilkan. Untuk meningkatkan luas permukaan katalis, akan digunakan support berbasis silika. Sebagai sumber silika akan digunakan tetraethyl orthosilicate (TEOS). Pengaruh rasio jumlah hydroxyethylsulfonic acid, TEOS, dan bahan baku pati jagung terhadap luas permukaan spesifik katalis, acid site density katalis, dan kemampuan katalisasi katalis pada reaksi esterifikasi asam oleat kemudian akan dipelajari.
1.2 Tujuan Penelitian
1. Melakukan sintesa katalis asam heterogen berbahan dasar pati jagung melalui proses karbonisasi hidrotermal dan sulfonasi secara serempak (karbonisasi hidrothermal satu tahap) dengan bantuan hydroxyethylsulfonic acid.
2. Mengetahui pengaruh penggunaan hydroxyethylsulfonic acid dalam bentuk garam dan dalam bentuk asam terhadap katalis asam heterogen yang dihasilkan.
3. Mengetahui pengaruh rasio jumlah hydroxyethylsulfonic acid dan tetraethyl orthosilicate (TEOS) terhadap pati jagung dalam pembuatan katalis asam heterogen menggunakan metode karbonisasi hidrotermal satu tahap.
4. Mengetahui kinerja katalis asam heterogen yang dihasilkan dari proses karbonisasi hidrotermal satu tahap dalam reaksi esterifikasi asam oleat.
1.3 Urgensi Penelitian
Penelitian ini dilakukan untuk memperoleh pemahaman yang mendalam mengenai proses pembuatan katalis asam heterogen berbahan dasar pati melalui proses karbonisasi hidrotermal-sulfonasi satu tahap. Informasi dari penelitian ini, yang berupa kondisi operasi karbonisasi hidrotermal-sulfonasi satu tahap, yaitu temperatur dan waktu operasi, serta rasio jumlah hydroxyethylsulfonic acid dan TEOS terhadap pati, sangat berguna untuk pengembangan katalis asam heterogen yang lebih ramah lingkungan. Sintesis katalis asam
4
heterogen dengan proses hidrotermal-sulfonasi satu tahap diharapkan mampu mengurangi dampak pencemaran terhadap lingkungan dari limbah kimia yang berbahaya akibat penggunaan asam kuat seperti asam sulfat yang umumnya terjadi dalam proses pembuatan katalis asam heterogen menggunakan proses pirolisis-sulfonasi konvensional.
5
BAB II
TINJAUAN PUSTAKA
2.1 Katalis
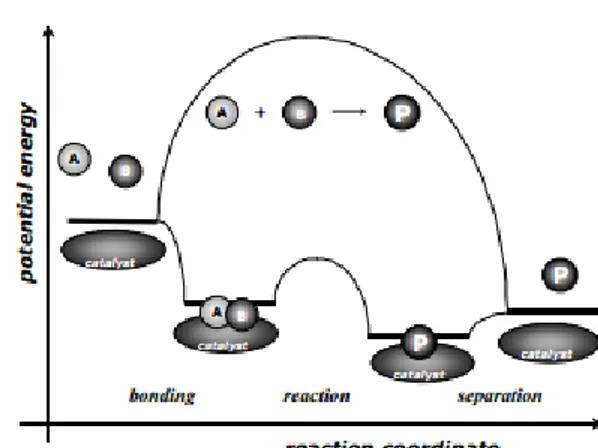
Katalis adalah senyawa, yang ketika ditambahkan ke dalam suatu reaksi kimia dapat mengurangi energi aktivasi dan meningkatkan laju reaksi. Jumlah katalis tidak berubah selama reaksi karena tidak dikonsumsi sebagai bagian dari proses reaksi. Katalis berfungsi untuk menurunkan energi yang dibutuhkan untuk mencapai keadaan transisi pada reaksi serta memungkinkan interaksi yang lebih pada molekul untuk mencapai keadaan tersebut Pada Gambar 2.1 disajikan diagram energi potensial dari reaksi menggunakan katalis heterogen, dengan fasa reaktan gas.
Gambar 2.1 Diagram Energi Potensial Reaksi Menggunakan Katalis Heterogen (I Chorkendorff dan J.W. Niemantsverdriet, 2003)
Beberapa hal yang dapat disimpulkan dari gambar diatas adalah
a) Energi aktivasi reaksi dengan katalis jauh lebih rendah dari energi aktivasi tanpa katalis sehingga laju reaksi menjadi lebih cepat.
b) Energi bebas secara keseluruhan antara reaksi dengan dan tanpa katalis adalah sama. Katalis tidak mempengaruhi nilai koefisien kesetimbangan. Katalis mempengaruhi kinetika namun tidak mempengaruhi secara termodinamika.
c) Katalis mempercepat kinetika reaksi reaktan menjadi produk maupun produk menjadi reaktan pada reaksi reversibel.
6
Berdasarkan fasanya, katalis dapat dibedakan menjadi katalis homogen dan katalis heterogen. Katalis homogen merupakan katalis yang memiliki fasa yang sama dengan reaktan dan produk reaksi, sedangkan katalis heterogen merupakan katalis yang memiliki fasa yang berbeda dengan fasa reaktan dan produk reaksi. Saat ini di dunia industri, penggunaan katalis homogen sudah mulai dikurangi karena sulitnya pemisahan katalis dari produk. Oleh karena itu untuk mengatasi kelemahan katalis homogen tersebut, banyak digunakan katalis heterogen.
Beberapa contoh katalis heterogen yang umum digunakan adalah katalis basa heterogen dan katalis asam heterogen. Katalis basa heterogen yang paling umum digunakan adalah senyawa-senyawa oksida logam seperti oksida logam alkali dan oksida logam alkali tanah seperti MgO, CaO, SrO dan BaO. Selain katalis basa heterogen, katalis asam heterogen juga banyak digunakan di industri. Katalis senyawa karbon berbasis sulfonat menjadi katalis asam heterogen yang sangat diminati saat ini karena memiliki gugus –SO3H dengan kerangka karbon yang stabil sehingga memiliki kinerja yang baik dan mudah dipisahkan dari sistem reaksi (Kang, Ye, & Chang, 2013).
Beberapa kriteria katalis asam heterogen yang ideal antara lain: memiliki stabilitas tinggi, memiliki pusat aktif yang kuat, memiliki pori-pori besar, memiliki permukaan yang bersifat hydrophobic, harganya relatif murah, mudah dilakukan pemisahan katalis dari media reaksi sehingga meminimallisasi kontaminasi produk, dan dapat dilakukan regenerasi (Lam, et al., 2010). Namun katalis asam heterogen yang tersedia saat ini memiliki beberapa kekurangan, seperti rendahnya luas permukaan katalis, densitas asam yang rendah, dan terjadinya leaching pusat aktif. Penelitian dalam pembuatan katalis asam heterogen saat ini terus dilakukan untuk menghasilkan katalis asam heterogen yang memiliki acid site density
yang tinggi, stabil, serta memiliki luas permukaan yang besar. Salah satu penelitian sintesis katalis asam heterogen yang sangat banyak dikembangkan saat ini adalah sintesis katalis senyawa karbon tersulfonasi berbahan dasar sakarida.
2.2 Katalis Karbon Tersulfonasi Berbahan Dasar Sakarida
Katalis asam memegang peranan penting dalam proses kimia. Lebih dari 15 juta ton asam sulfat telah terkonsumsi sebagai katalis yang tidak dapat diperbaharui, yang membutuhkan biaya tinggi dan juga pemisahan katalis yang tidak efisien dari campuran reaksi homogennya (Xiao, et al., 2010). Oleh karena itu berbagai penelitian mengenai katalis asam terus dikembangkan guna mengatasi kelemahan dari katalis asam tersebut. Namun
7
permasalahannya adalah langkanya katalis asam heterogen yang memiliki keaktifan dan kestabilan yang tinggi, dan harga yang relatif murah dibandingkan dengan asam sulfat. Saat ini sintesis katalis padat berbahan dasar sakarida menjadi pusat perhatian dalam penemuan solusi dari masalah tersebut. Katalis berbahan dasar sakarida dapat dibuat dari bahan baku yang memiliki gugus dasar glukosa seperti D-glukosa, sukrosa, pati, dan selulosa. Katalis asam padat tersebut pada dasarnya merupakan material karbon tersulfonasi sebagai hasil dari proses pirolisis dan sulfonasi. Sintesis katalis asam heterogen menggunakan glukosa, sukrosa, selulosa, atau pati memiliki kelebihan yaitu harga yang murah dan jumlah bahan baku yang melimpah, serta dapat menghasilkan material karbon yang kuat yang terdiri dari karbon polisiklik aromatik kecil dalam struktur tiga dimensi dengan ikatan sp3.
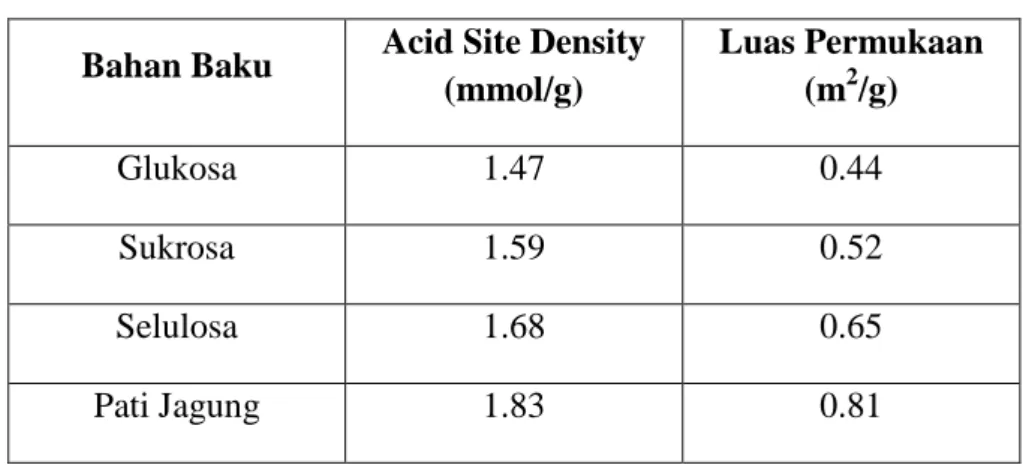
Lou, et al (2008) melakukan percobaan untuk memproduksi katalis asam heterogen menggunakan bahan baku berbahan dasar sakarida berupa glukosa, sukrosa, selulosa, dan pati. Hasil penelitiannya.menunjukkan bahwa katalis berbahan dasar pati memiliki aktivitas katalitik yang paling baik ketika diuji pada reaksi pembuatan biodiesel.
Tabel 2.1 Hasil penelitian Lou, et al (2008) Bahan Baku Acid Site Density
(mmol/g) Luas Permukaan (m2/g) Glukosa 1.47 0.44 Sukrosa 1.59 0.52 Selulosa 1.68 0.65 Pati Jagung 1.83 0.81
Katalis yang dihasilkan dari bahan baku berupa pati, selulosa, sukrosa, dan glukosa mampu menghasilkan yield masing-masing sebesar 95%, 88%, 80%, dan 76%. Dari hasil tersebut dapat disimpulkan bahwa pati merupakan pilihan biomassa terbaik dalam pembuatan katalis untuk sintesa biodiesel. Selain yield yang tinggi, pati juga juga dapat mencapai yield
maksimumnya yaitu 95% dalam waktu yang cukup singkat yaitu 3 jam dan memiliki ketahanan yang baik di mana catalytic activity dari katalis tersebut masih dapat mencapai mencapai 93% dari kondisi awalnya setelah 50 cycle penggunaan ulang.
Pati merupakan polisakarida dari tanaman. Polisakarida terdiri dari beberapa monosakarida yang terhubung dengan ikatan glikosida. Tanaman yang mengandung pati di
8
antaranya: beras, jagung, kentang, gandum, sagu, ubi, tapioka, dan umbi garut. Pati memiliki struktur granular semikristalin yang merupakan rezim antara kristal dan amorph. Rezim kristal yang dimiliki oleh pati berasal dari polimer amilopektin yang cabang terluarnya adalah hidrogen yang terikat satu sama lain membentuk crystallite, sedangkan rezim amorph berasal dari titik percabangan dari amilosa dan amilopektin. Pati dapat dipisahkan menjadi dua fraksi utama berdasarkan kelarutannya dalam air panas, yaitu 20% pati terdiri dari amilosa (larut) dan 80% sisanya adalah amilopektin (tidak larut). Kandungan amilopektin pada pati sangat penting dalam pembentukan struktur polisiklik aromatik karbon yang berfungsi untuk mengikat gugus sulfonat (-SO3H). Pati yang digunakan dalam penelitian Lou et al (2008) adalah pati jagung. Pati jagung memiliki kandungan amilosa sebesar 28% dan kandungan amilopektin sebesar 72%. Kandungan amilopektin yang tinggi ini merupakan alasan utama pati jagung menghasilkan aktivitas katalitik yang paling baik.
2.3 Sintesis Katalis Karbon Tersulfonasi
Katalis asam heterogen berbahan dasar karbon menggunakan bahan baku sakarida dapat disintesis melalui beberapa proses seperti pirolisis, impregnasi, dan karbonisasi hidrotermal.
2.3.1 Sintesis Katalis Karbon Tersulfonasi dengan Proses Pirolisis-Sulfonasi
Pirolisis merupakan proses dekomposisi dengan pemanasan pada temperatur tinggi yang mendorong terjadinya proses karbonisasi tidak sempurna untuk membentuk material karbon polisiklik aromatik, sedangkan sulfonasi merupakan proses untuk menambahkan gugus aktif –SO3H ke dalam material karbon polisiklik tersebut. Tahap sulfonasi dapat merusak struktur pori katalis sehingga luas permukaan katalis akan berkurang. Pori katalis yang besar akan menyebabkan reaktan lebih mudah berdifusi ke bagian dalam katalis. Hal ini dapat menyebabkan kontak yang lebih intensif antara reaktan dengan pusat asam katalis dan katalis akan menghasilkan aktivitas yang lebih baik. Proses sulfonasi dari material karbon hasil pirolisis akan menghasilkan padatan yang stabil dengan massa jenis sisi aktif yang besar. Dengan demikian, proses karbonisasi dan sulfonasi yang baik dari senyawa sakarida akan menghasilkan struktur karbon yang stabil dengan densitas gugus –SO3H yang besar (Liu, et al., 2009). Selain itu katalis karbon tersulfonasi memiliki gugus karbon yang stabil dan tidak larut dalam kondisi asam maupun basa. Katalis ini dapat dengan mudah dipisahkan dari reaksi dan sangat mudah untuk digunakan kembali (Kang, Ye, & Chang, 2013). Proses
9
sintesis material karbon tersulfonasi melalui proses pirolisis-sulfonasi ditampilkan dalam Gambar 2.2.
(A) Pirolisis ; (B) Karbonisasi tidak Sempurna ; (C) Sulfonasi Gambar 2.2 Proses pirolisis-sulfonasi (Okamura, et al., 2006)
Katalis yang dihasilkan melalui proses pirolisis-sulfonasi memilki jumlah gugus fungsional hidrofilik yang besar sehingga mampu menyediakan akses yang baik untuk reaktan hidrofilik untuk dapat bereaksi dengan kelompok –SO3H. Namun, gugus-gugus fungsional hidrofilik tersebut dapat menjadi penghalang dalam penggabungan molekul hidrofobik (asam lemak) ke pusat aktif katalis. Akibatnya, katalis ini masih kurang baik untuk digunakan dalam reaksi-reaksi hidrofobik karena reaksi hanya dapat terjadi jika reaktan dapat mengakses permukaan katalis. Katalis asam padat yang dihasilkan dari proses pirolisis-sulfonasi memiliki luas permukaan spesifik yang relatif rendah yakni < 8 m2/g (Lou, et al., 2008; Nakajima, et al., 2008) sehingga kemampuan katalis tersebut masih kurang baik untuk mengkatalisis reaksi pada molekul-molekul reaktan yang kecil seperti reaksi asam asetat dengan metanol.
2.3.2 Sintesis Katalis Karbon Tersulfonasi Dengan Proses Impregnasi
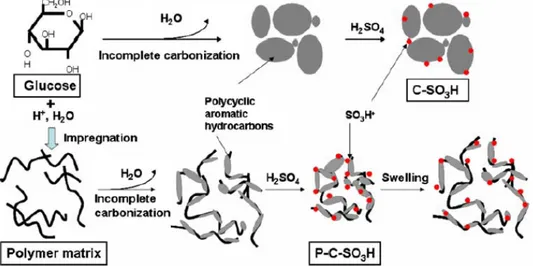
Untuk menyikapi keterbatasan katalis karbon tersulfonasi yang memiliki luas permukaan spesifik yang kecil tersebut, maka dikembangkan prosedur sintesis katalis dengan luas permukaan spesifik yang besar sehingga kontak antara reaktan dengan permukaan katalis menjadi lebih intensif. Strategi awalnya dikemukakan oleh Mo, et al. (2008) di dalam penelitiannya untuk mensintesis katalis karbon tersulfonasi (P-C-SO3H) dengan proses pirolisis yang disertai impregnasi dan diikuti dengan proses sulfonasi. Prinsip impregnasi adalah memasukkan katalis logam secara paksa ke dalam rongga-rongga pengemban. Hasilnya katalis (P-C-SO3H) memiliki luas permukaan spesifik dan tingkat kepadatan asam yang lebih besar dari katalis (C-SO3H) yang dihasilkan dengan proses pirolisis-sulfonasi
10
tanpa impregnasi. Proses impregnasi ini bertujuan untuk memberikan support pada katalis sehingga material karbon yang dihasilkan dari proses pirolisis tidak hancur melainkan membentuk luas permukaan aktif yang lebih besar. Proses pembuatan katalis melalui proses pirolisis-sulfonasi dengan dan tanpa impregnasi ditunjukkan dalam Gambar 2.3.
Gambar 2.3 Sintesis katalis karbon tersulfonasi C-SO3H dan P-C-SO3H (Mo, et al, 2008)
Beberapa penelitian telah dikembangkan terkait dengan proses impregnasi ini. Kitano, et al. (2009) melaporkan katalis karbon dengan luas permukaan spesifik yang tinggi dapat disintesis dengan proses impregnasi menggunakan ZnCl2 yang dilanjutkan dengan proses sulfonasi. Dalam hasil penelitiannya, katalis karbon tersulfonasi yang diperoleh melalui proses impregnasi menggunakan ZnCl2 ini memiliki acid site density sebesar 1,3 mmol/g dan hasil BET menunjukkan bahwa katalis memiliki luas permukaan spesifik sebesar 805 m2/g dengan temperatur pirolisis optimum pada 450oC. Sedangkan katalis karbon tersulfonasi yang dihasilkan tanpa proses impregnasi memiliki acid site density sebesar 0,5 mmol/g dan luas permukaan spesifik hanya sebesar 33 m2/g. Namun penggunaan ZnCl2 sebagai agen pengaktif telah menurun karena masalah ekonomi dan pencemaran lingkungan karena adanya senyawa seng (Zn) yang berbahaya.
Selanjutnya Fu, et al (2012) mengembangkan prosedur sintesis katalis asam padat berbasis karbon dengan proses impregnasi menggunakan H3PO4 untuk menghasilkan katalis dengan luas permukaan spesifik yang tinggi untuk menjamin aksesibilitas gugus SO3H yang baik ke dalam pusat aktif katalis. Fu, et al. (2012) melakukan variasi temperatur dan waktu
11
pirolisis untuk menemukan waktu dan temperatur yang paling tepat dalam sintesa katalis asam berbahan dasar karbon ini. Katalis karbon tersulfonasi yang dihasilkan dari proses impregnasi menggunakan H3PO4 memiliki acid site density sebesar 1.1 mmol/g dan luas permukaan spesifik sebesar 118 m2/g dengan temperatur pirolisis optimum pada 250oC selama 1.5 jam. Dalam penelitiannya juga dilakukan sintesis katalis karbon tersulfonasi tanpa proses impregnasi menggunakan H3PO4 dan dihasilkan acid site density sebesar 1 mmol/g dengan luas permukaan spesifik < 1 m2/g. Selain itu juga dilakukan sintesis katalis karbon menggunakan proses impregnasi namun tidak diikuti proses sulfonasi dan hasilnya menunjukkan acid site density sebesar 0.4 mmol/g dengan luas permukaan spesifik sebesar 830 m2/g.
Meskipun proses pirolisis-sulfonasi mampu menghasilkan katalis asam heterogen yang stabil dan memiliki nilai acid site density yang cukup tinggi serta proses impregnasi mampu menghasilkan katalis dengan luas permukaan spesifik yang lebih besar, namun proses pirolisis yang dilakukan pada temperatur tinggi ( ± 400 oC ) dan dalam waktu yang lama (15 jam) menjadikan proses ini tidak ramah lingkungan dan menimbulkan potensi dihasilkannya limbah yang dapat mencemari lingkungan. Di sisi lain pada proses sulfonasi dibutuhkan asam sulfat pekat (96%) yang cukup banyak dan dilakukan pada temperatur 150oC selama 15 jam juga menjadi pertimbangan tersendiri bagi para ilmuwan untuk mengembangkan sintesis katalis asam heterogen berbahan dasar sakarida dengan proses yang lebih ramah lingkungan. Salah satu proses yang dapat digunakan untuk menghasilkan katalis berbahan dasar sakarida adalah dengan proses karbonisasi hidrotermal.
2.3.3 Sintesis Katalis Karbon Tersulfonasi Dengan Proses Hidrotermal
Proses karbonisasi hidrotermal sering disebut sebagai proses karbonisasi basah. Proses hidrotermal dilakukan dengan cara memanaskan biomassa dalam kondisi basah dengan temperatur tertentu (170-220°C) dengan rentang tekanan 10-22 bar atau tekanan
saturated steam. Proses karbonisasi hidrotermal merupakan salah satu metode untuk membentuk material polisiklik aromatik sekaligus memasukkan gugus fungsi tertentu ke dalam kerangka karbon yang dihasilkan dengan menambahkan zat aditif tertentu. Kelebihan dari proses ini adalah kondisi temperatur yang relatif lebih rendah dari pirolisis, tidak dibutuhkannya aliran gas inert untuk menghilangkan oksigen dari proses, lebih ramah lingkungan, murah, dan lebih mudah dilakukan (Wei, Xu, & Li, 2009).
12
Secara umum katalis asam berbahan dasar karbon dapat disintesis melalui proses hidrotermal dilanjutkan dengan proses sulfonasi. Pada proses hidrotermal terjadi karbonisasi secara tidak sempurna terhadap material biomassa untuk pembentukan material karbon polisiklik aromatik sementara pada proses sulfonasi terjadi penambahan gugus aktif –SO3H ke dalam material karbon hasil karbonisasi hidrotermal.
Deshmane, et al (2013) mensintesis katalis karbon tersulfonasi dari glukosa menggunakan proses hidrotermal yang dilanjutkan dengan proses sulfonasi menggunakan asam sulfat. Proses karbonisasi hidrotermal dilakukan pada temperatur 200oC selama 24 jam. Luas permukaan yang dihasilkan dari proses karbonisasi hidrotermal relatif kecil yakni kurang dari 10 m2/g. Kemudian material hasil karbonisasi hidrotermal disulfonasi pada temperatur 150oC selama 15 jam dan menghasilkan material karbon tersulfonasi yang memiliki kandungan karbon sebesar 53% dan kandungan sulfur mencapai 1.45% dengan luas permukaan spesifik yang besar yakni 300-600 m2/g.
Sama halnya dengan proses pirolisis-sufonasi, katalis yang dihasilkan menggunakan proses hidrotermal-sulfonasi ini mampu menghasilkan katalis yang stabil dengan tingkat kepadatan –SO3H yang besar. Namun proses sulfonasi menggunakan asam kuat seperti asam sulfat membutuhkan temperatur yang tinggi dan waktu yang lama sehingga kondisi tersebut menjadi kurang ramah lingkungan. Penggunaan asam sulfat dalam jumlah yang besar dapat menghasilkan limbah kimia yang membahayakan lingkungan.
Oleh karena itu dikembangkan prosedur yang lebih efisien untuk mensintesis katalis karbon tersulfonasi yaitu melalui proses karbonisasi hidrotermal satu tahap. Liang, et al. (2011) mensintesis katalis karbon tersulfonasi menggunakan 2-hydroxyethylsulfonic acid dan pati pada temperatur 180oC selama 4 jam. Dalam proses satu tahap ini, 2-hydroxyethylsulfonic acid bertindak sebagai molekul bifunctional untuk mengakatalisis proses karbonisasi pati dan membentuk kelompok -SO3H.
Penggunaan 2-hydroxyethylsulfonic acid menggantikan asam sulfat dilakukan karena alasan berikut ini. Ketika asam sulfat dicampurkan dengan suatu bahan sakarida, akan terjadi karbonisasi secara sangat cepat dan mengakibatkan terbentuknya material karbon dengan permukaan yang hidrofilik sehingga akan menyebabkan sulitnya proses sulfonasi untuk membentuk permukaan katalis dengan sisi aktif yang besar dikarenakan gugus –SO3H sulit menempel pada katalis. Berbeda halnya jika digunakan 2-hydroxyethylsulfonic acid dimana asam ini tidak memiliki kemampuan dehidrasi yang cepat seperti pada asam sulfat sehingga proses karbonisasi yang dikatalisis dengan asam ini berjalan lebih lambat dan gugus hidroksil yang terlibat dalam proses ini mampu membantu mengikat gugus –SO3H ke permukaan
13
katalis. Perlu diketahui bahwa 2-hydroxyethylsulfonic acid (Gambar 2.4) merupakan asam yang tidak stabil sehingga asam ini umumnya diperoleh dalam bentuk garam natrium atau garam ammonium.
Gambar 2.4 Struktur 2-hydroxyethyl sulfonic acid
Katalis karbon tersulfonasi yang dihasilkan dari percobaan Liang, et al. (2011) ini memiliki acid site density sebesar 2.6 mmol/g dimana angka ini lebih besar dari katalis asam padat seperti Nafion dan Amberlyst-15 (0.8 mmol/g) dan katalis karbon tersulfonasi menggunakan proses pirolisis-sulfonasi (< 2 mmol/g).
Song, et al (2012) mensintesis katalis karbon tersulfonasi dengan proses hidrotermal satu tahap menggunakan gliserol dan concentrated sulfuric acid pada temperatur 180oC selama 0.5 jam. Disini concentrated sulfuric acid bertindak sebagai molekul bifuctional
dalam mengkatalisis proses karbonisasi gliserol dan membentuk kelompok –SO3H pada katalis secara simultan. Hasilnya katalis karbon tersulfonasi ini memiliki acid site density
sebesar 1.6 mmol/g dan luas permukaan spesifik sebesar 87 m2/g.
Xiao, et al (2010) mensintesis katalis karbon tersulfonasi menggunakan glukosa, asam sitrat, dan hydroxyethylsulfonic acid dengan proses hidrotermal satu tahap pada temperatur 180oC selama 4 jam. Dalam proses ini, hydroxyethylsulfonic acid berperan untuk menambahkan gugus aktif –SO3H ke dalam katalis, sedangkan asam sitrat berperan sebagai
supplier gugus karbonil untuk mencegah terurainya gugus aktif –SO3H menjadi gugus sulfonat atau sulfone. Hasilnya katalis ini memiliki nilai acid site density sebesar 1.7 mmol/g dengan perbandingan gugus karbonil dengan gugus asam sulfonat sebesar 1:3. Hasil BET menunjukkan katalis memiliki luas permukaan spesifik sebesar 138 m2/g.
Lu, et al (2012) mensintesis katalis karbon tersulfonasi menggunakan sukrosa,
hydroxyethylsulfonic acid, dan tetraethyl orthosilicate (TEOS) dengan proses karbonisasi hidrotermal satu tahap pada temperatur 180oC selama 4 jam (Gambar 2.5).
14
Gambar 2.5 Proses hidrotermal satu tahap menggunakan hydroxyethyl sulfonic acid dan TEOS (Lu, et al., 2012)
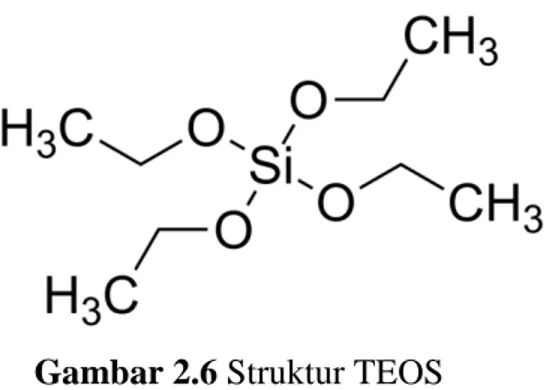
Katalis yang dihasilkan memiliki acid site density sebesar 2 mmol/g dimana angka ini lebih tinggi dari katalis asam padat komersial seperti Nafion dan Amberlyst-15 (0.8 mmol/g). Selain itu katalis ini juga menghasilkan nilai BET sebesar 532 m2/g. Dalam proses ini TEOS (Gambar 2.6) berperan untuk memperluas permukaan katalis dimana luas permukaan katalis yang dihasilkan tanpa TEOS sebesar 126 m2/g. Adanya rangka silika organik dalam struktur katalis mampu meningkatkan kestabilan katalis.
Gambar 2.6 Struktur TEOS
Perbandingan molar TEOS terhadap hydroxyethylsulfonic acid praktis mengubah tingkat keasaman dan luas permukaan BET katalis yang dihasilkan. Semakin banyak TEOS yang digunakan menghasilkan luas permukaan yang semakin besar, namun di sisi lain akan mereduksi tingkat keasaman katalis karena tingginya kadar silikon dioksida (SiO2). Sementara itu penggunaan hydroxyethylsulfonic acid yang semakin banyak mampu menghasilkan katalis dengan tingkat keasaman yang besar namun luas permukaan spesifiknya menjadi kecil karena terjadi reaksi hidrolisis TEOS secara cepat tanpa berinteraksi dengan sukrosa.
15
Zhang, et al. (2011) telah berhasil mensintesis katalis karbon tersulfonasi dengan rantai gabungan antara karbon-silika yang menunjukkan kestabilan yang tinggi dan kereaktifan secara kimia yang baik pada reaksi esterifikasi maupun transesterifikasi untuk menghasilkan biodiesel. Katalis dengan rantai karbon-silika dapat digunakan berulang kali karena adanya silika dalam katalis ini. Senyawa dengan basis silika dapat mengikat lebih banyak cincin benzena untuk disubstitusi oleh gugus sulfonat sehingga derajat sulfonasi menjadi lebih tinggi. Dengan meningkatnya jumlah gugus -SO3H maka daya pencampuran antara alkohol dengan minyak atau lemak akan semakin besar.
Dari beberapa penelitian yang telah diuraikan di atas, dapat disimpulkan bahwa katalis karbon tersulfonasi yang disintesis melalui proses hidrotermal satu tahap ini mampu menghasilkan luas permukaan katalis yang lebih besar dibandingkan dengan katalis karbon tersulfonasi yang dihasilkan melalui proses pirolisis-sulfonasi dan mampu mempertahankan nilai acid site density yang cukup tinggi. Di sisi lain, proses karbonisasi hidrotermal satu tahap ini mampu mengurangi limbah kimia yang berbahaya karena meminimalisir penggunaan asam kuat seperti asam sulfat pada proses sulfonasi. Temperatur yang digunakan pada proses hidrotermal satu tahap ini juga lebih rendah dari temperatur proses pirolisis-sulfonasi sehingga proses ini menjadi alternatif proses sintesis katalis yang lebih ramah lingkungan.
Dalam penelitian ini, katalis asam heterogen akan dibuat dari bahan baku berbahan dasar sakarida yaitu pati jagung. Katalis asam heterogen tersebut akan disintesis menggunakan proses karbonisasi hidrotermal satu tahap. hydroxyethylsulfonic acid sebagai asam yang memiliki gugus sulfonat akan digunakan sebagai molekul yang bertindak sebagai molekul bifunctional untuk mengakatalisis proses karbonisasi pati dan membentuk kelompok -SO3H dan TEOS digunakan untuk memperoleh katalis dengan luas permukaan spesifik yang besar sehingga dapat meningkatkan performa katalis asam heterogen yang dihasilkan. Dalam penelitian ini performa katalis asam heterogen yang dihasilkan akan diuji melalui reaksi esterifikasi asam oleat.
16
BAB III
METODE PENELITIAN
Dalam penelitian ini, akan dilakukan pembuatan katalis asam heterogen menggunakan metode karbonisasi hidrotermal dan sulfonasi secara serempak (karbonisasi hidrotermal satu tahap).
3.1 Pembuatan Katalis Asam Heterogen dengan Proses Karbonisasi Hidrotermal
Katalis asam heterogen akan dibuat dari bahan baku berbahan dasar sakarida yaitu pati jagung. Sebagai agen sulfonasi, akan digunakan hydroxyethylsulfonic acid.
Hydroxyethylsulfonic acid merupakan senyawa yang tidak stabil sehingga umumnya dijual dalam bentuk garam. Oleh karena itu dalam penelitian ini akan dilakukan variasi pembuatan katalis asam heterogen menggunakan hydroxyethylsulfonic acid dalam bentuk garam maupun dalam bentuk asam untuk melihat pengaruhnya terhadap katalis yang dihasilkan. Untuk meningkatkan luas permukaan katalis, akan digunakan support berbasis silika. Sebagai sumber silika akan digunakan tetraethyl orthosilicate (TEOS). Pengaruh rasio jumlah
hydroxyethylsulfonic acid, TEOS, dan bahan baku pati jagung terhadap luas permukaan spesifik katalis, acid site density katalis, dan kemampuan katalisasi katalis pada reaksi esterifikasi asam oleat kemudian akan dipelajari. Adapun temperatur dan waktu karbonisasi hidrotermal yang digunakan didasarkan pada penelitian Zhang, et al. (2010) dan Zhang, et al.
(2011) yaitu pada temperatur 180oC dan waktu 24 jam.
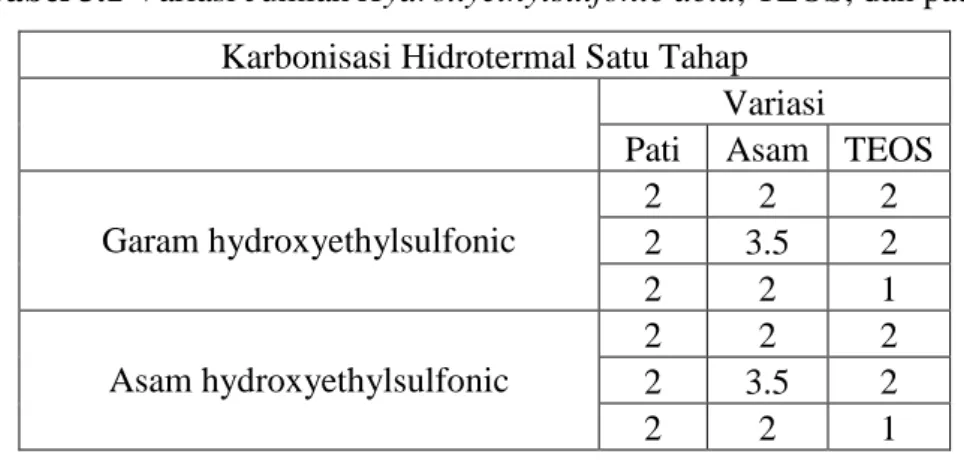
Tabel 3.1 Variasi Jumlah Hydroxyethylsulfonic acid, TEOS, dan pati Karbonisasi Hidrotermal Satu Tahap
Variasi
Pati Asam TEOS Garam hydroxyethylsulfonic 2 2 2 2 3.5 2 2 2 1 Asam hydroxyethylsulfonic 2 2 2 2 3.5 2 2 2 1
Dalam penelitian pembuatan katalis asam heterogen dengan metode hidrotermal satu tahap ini, bahan baku pati jagung, asam yang memiliki gugus sulfonat, dan TEOS dicampur
17
di dalam autoklaf kemudian dipanaskan dalam oven pada suhu 180ºC selama 24 jam. Padatan yang diperoleh disaring, dicuci, dan kemudian dikeringkan dalam oven pada temperatur 100oC selama 24 jam. Autoklaf yang digunakan untuk melangsungkan proses karbonisasi hidrotermal diperlihatkan pada Gambar 3.1. Diagram alir proses pembuatan katalis asam heterogen dengan proses karbonisasi hidrotermal satu tahap diperlihatkan pada Gambar 3.2.
Gambar 3.1 Teflon-Lined Stainless Steel Autoclave
Gambar 3.2 Prosedur Pembuatan Katalis Karbonisasi Hidrotermal Satu Tahap Bahan baku pati dan Hydroxyethylsulfonic acid dimasukkan ke dalam 60 ml air demin
lalu diaduk pada temperatur 65oC selama 25 menit. Kedalam campuran tersebut selanjutnya ditambahkan TEOS dengan komposisi sesuai variasi percobaan
Campuran dimasukkan ke dalam 100 ml lined stainless steel autoclave. Teflon-lined stainless steel autoclave ditutup dengan rapat dam dipanaskan dalam oven pada
temperatur 180 o C selama 24 jam.
Hasil dari proses karbonisasi hidrotermal kemudian dicuci menggunakan air dan etanol sampai warna filtrat bening
Selesai.
Padatan katalis karbon yang diperoleh dikeringkan di dalam oven pada temperatur 100oC selama 24 jam.
18
Pada pembuatan katalis asam heterogen menggunakan hydroxyethylsulfonic acid
perlu dilakukan pembebasan asam hydroxyethylsulfonic dari bentuk garamnya. Proses pembebasan hydroxyethylsulfonic acid dari bentuk garam diperlihatkan pada Gambar 3.3.
Gambar 3.3 Diagram Alir Proses Pembuatan hydroxyethylsulfonic acid
3.2 Analisa Sifat Fisik dan Kimia Katalis
Analisa yang digunakan dalam menguji karakteritik katalis, adalah BET (Brunauer Emmett Teller), SEM (Scanning Electron Microscopy) dan EDS (Energy Dispersive Spectrocopy) . Analisa BET digunakan untuk mengetahui luas permukaan dan rata-rata
Asam oksalat dan hydroxyethylsulfonic acid (dalam bentuk garam)ditimbang (perbandingan mol asam oksalat dan garam hydroxyethylsulfonic adalah 1:1)
Air dipanaskan hingga mencapai temperatur 100oC.
Air yang telah dipanaskan digunakan untuk melarutkan asam oksalat dan garam
hydroxyethylsulfonic, masing-masing dalam gelas kimia yang berbeda.
• Jumlah air untuk melarutkan asam oksalat adalah berdasarkan literatur: 370.3 gram oksalat dilarutkan dalam 250 mL aquades
• Jumlah air untuk melarutkan garam hydroxyethylsulfonic adalah berdasarkan literatur: 315.2 gram garam hydroxyethylsulfonic dilarutkan dalam 500 mL aquades
Larutan asam oksalat dan garam hydroxyethylsulfonic dicampur dalam gelas kimia lalu diletakan dalam ice bath untuk proses kristalisasi
Kristal yang terbentuk dipisahkan melalui proses filtrasi
Filtrat yang terbentuk dikeringkan dalam oven untuk menghilangkan air yang terkandung dalam filtrat
19
ukuran pori katalis hidrotermal yang didapat. Analisa SEM (Scanning Electron Microscopy) digunakan untuk melihat sturuktur dan morfologi katalis hidrotermal. Analisa EDS (Energy Dispersive Spectrocopy) digunakan untuk menentukan komposisi dalam katalis hidrotermal. 3.3 Uji Kinerja Katalis
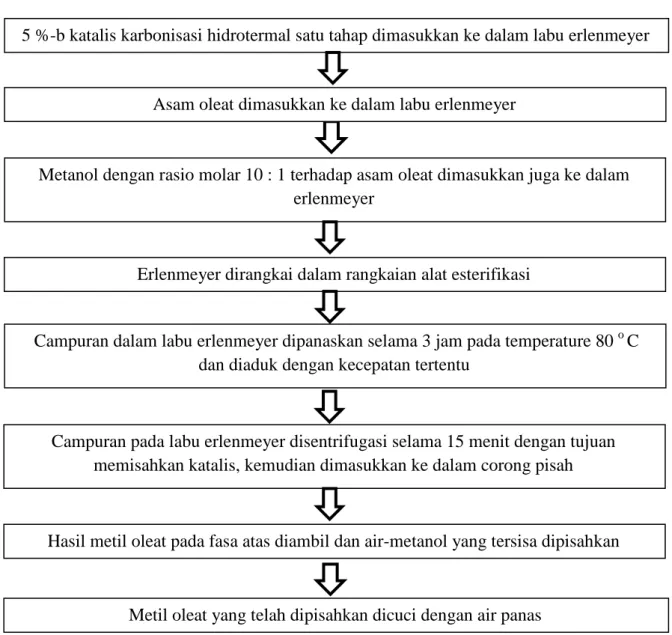
Pada penelitian ini, uji kinerja katalis dilakukan menggunakan reaksi esterifikasi asam oleat. Kinerja katalis akan dinilai berdasarkan parameter konversi asam oleat, densitas metil oleat dan viskositas metil oleat. Cara kerja pada proses ini ditampilkan pada Gambar 3.4
Gambar 3.4 Cara Kerja Reaksi Esterifikasi Asam Oleat Asam oleat dimasukkan ke dalam labu erlenmeyer
Metanol dengan rasio molar 10 : 1 terhadap asam oleat dimasukkan juga ke dalam erlenmeyer
Campuran dalam labu erlenmeyer dipanaskan selama 3 jam pada temperature 80 o C dan diaduk dengan kecepatan tertentu
Erlenmeyer dirangkai dalam rangkaian alat esterifikasi
Campuran pada labu erlenmeyer disentrifugasi selama 15 menit dengan tujuan memisahkan katalis, kemudian dimasukkan ke dalam corong pisah
Hasil metil oleat pada fasa atas diambil dan air-metanol yang tersisa dipisahkan
Metil oleat yang telah dipisahkan dicuci dengan air panas
20
BAB IV
JADWAL PELAKSANAAN
No. Kegiatan 1 2 3 4 5 6 7 8 9 10 11 12
1 Persiapan alat dan bahan
2 Pembuatan katalis asam heterogen menggunakan pati jagung
3 Karakterisasi sifat fisik dan kimia katalis asam heterogen
4 Uji reaksi esterifikasi dengan menggunakan asam oleat 5 Penyelesaian laporan
21
BAB V
HASIL DAN PEMBAHASAN
Pada penelitian ini, pembuatan katalis asam heterogen berbasis komposit karbon-silika menggunakan bahan dasar sakarida yaitu pati jagung sebagai sumber kerangka karbon dalam katalis. Pembuatan katalis asam heterogen ini dilakukan menggunakan proses hidrotermal dan sulfonasi secara serempak yang dilangsungkan dalam 100 ml Teflon-lined stainless steel autoclaves. Sebagai agen sulfonasi digunakan hydroxyethylsulfonic acid dalam bentuk garam maupun dalam bentuk asam. Selain itu dalam pembuatan katalis asam heterogen ini juga digunakan tetraethyl orthosilicate (TEOS) sebagai support katalis yang diharapkan mampu memperluas permukaan katalis.
Karakterisasi katalis dilakukan menggunakan Scaning Electron Microscope (SEM),
Energy Dispersive Spectroscopy (EDS), dan Brunauer-Emmett-Teller (BET). Pengujian performa katalis dilakukan dengan reaksi esterifikasi asam oleat.
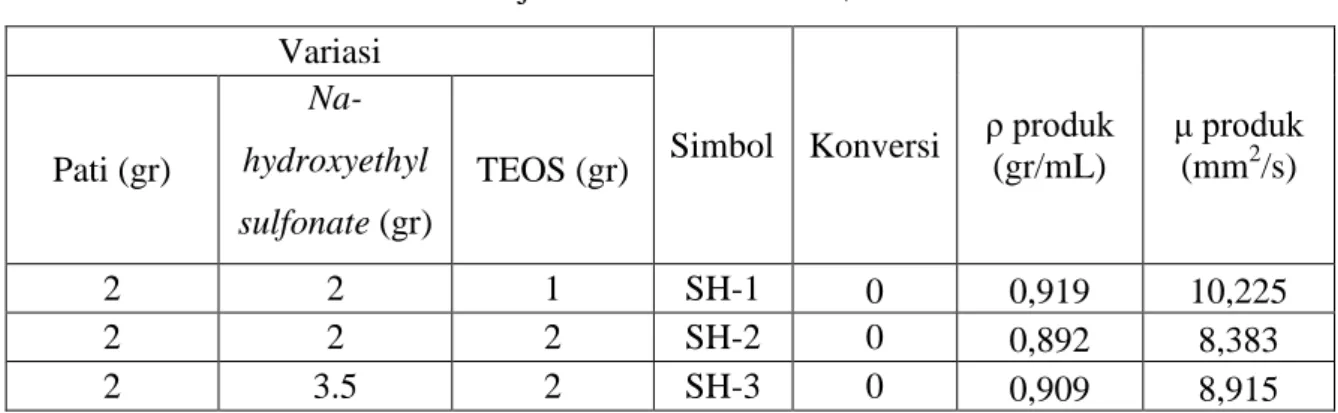
5.1 Pembuatan Katalis Dengan Menggunakan Garam Na-hydroxyethyl sulfonate
Variasi percobaan dilakukan untuk melihat pengaruh rasio jumlah pati jagung, asam hydroxyethyl sulfonate dalam bentuk garam natrium, dan TEOS terhadap acid site density
dan luas permukaan katalis yang dihasilkan.
Tabel 5.1 Variasi Jumlah Pati, Garam Na-hydroxyethyl sulfonate, dan TEOS Variasi Simbol Pati jagung (gr) Na-hydroxyethyl sulfonate (gr) TEOS (gr) 2 2 1 SH-1 2 2 2 SH-2 2 3,5 2 SH-3
Prosedur pembuatan katalis asam heterogen dilakukan berdasarkan prosedur yang diusulkan oleh Zhang, et al., (2011). Pati jagung dan garam Na-hydroxyethyl sulfonate
dengan jumlah tertentu dicampur terlebih dahulu sambil diaduk dalam air demin selama 30 menit pada temperatur 65ºC. Pada tahap ini terjadi gelatinisasi pati. Selanjutnya TEOS ditambahkan dalam jumlah tertentu. Campuran kemudian dimasukkan ke dalam autoklaf. Pemanasan campuran dalam autoklaf dilakukan menggunakan oven pada temperatur 180°C
22
selama 24 jam. Produk yang dihasilkan disaring dan dicuci menggunakan aquades dan etanol sampai pH filtrat dari pencucian katalis netral dan filtrat berwarna bening. Setelah dilakukan pencucian produk yang dihasilkan dikeringkan dalam oven selama 24 jam pada temperatur 100°C sehingga diperoleh padatan berwarna hitam.
5.1.1 Uji Kinerja Katalis
Katalis yang dihasilkan diuji kinerjanya dalam reaksi esterifikasi asam oleat. Sebanyak 5%-wt katalis dimasukkan ke dalam campuran methanol dan asam oleat dengan rasio molar 10:1 dan direaksikan pada temperatur 80°C selama tiga jam. Reaksi dilangsungkan dalam sebuah erlenmeyer yang dilengkapi kondensor refluks. Untuk mempertahankan temperatur reaksi digunakan waterbath yang dilengkapi thermostat.
Setelah reaksi esterifikasi selesai, campuran kemudian disentrifugasi untuk memisahkan katalis padat dari campuran reaksi. Kemudian campuran reaksi dimasukkan ke dalam corong pisah dan didiamkan semalaman. Campuran reaksi yang sudah didiamkan semalaman tidak menunjukkan adanya pemisahan dua fasa. Hal ini terjadi pada semua campuran hasil reaksi esterifikasi menggunakan katalis SH-1, SH-2, dan SH-3.
Pada dasarnya reaksi esterifikasi asam oleat dan metanol mengikuti persaman reaksi kimia seperti yang ditunjukkan berikut ini:
Berdasarkan persamaan reaksi diatas dapat dilihat bahwa reaksi esterifikasi asam oleat dan metanol akan menghasilkan metil oleat dan air. Metil oleat memiliki sifat tidak larut dalam air. Dengan demikian, salah satu indikasi awal keberhasilan reaksi esterifikasi dapat ditentukan melalui terbentuk atau tidaknya dua fasa cairan setelah reaksi dilangsungkan. Tidak terbentuknya dua fasa cairan dari campuran hasil reaksi menunjukkan bahwa reaksi esterifikasi asam oleat sesungguhnya tidak terjadi.
Untuk memastikan bahwa campuran reaksi masih berupa larutan asam oleat dan metanol dan bukan produk metil oleat maka dilakukan analisis densitas dan viskositas terhadap campuran hasil reaksi esterifikasi menggunakan katalis SH-1, SH-2 dan SH-3 tersebut di atas. Hasil selengkapnya disajikan pada Tabel 5.2.
23
Tabel 5.2 Hasil Uji Reaksi Katalis SH-1, SH-2 dan SH-3 Variasi
Simbol Konversi ρ produk (gr/mL) μ produk (mm2/s) Pati (gr) Na-hydroxyethyl sulfonate (gr) TEOS (gr) 2 2 1 SH-1 0 0,919 10,225 2 2 2 SH-2 0 0,892 8,383 2 3.5 2 SH-3 0 0,909 8,915
Densitas metil oleat pada 40oC adalah 0,874 gr/mL sedangkan viskositas kinematik metil oleat pada 40°C berada pada rentang 2,3-6 mm2/s. Dari Tabel 5.2 dapat dilihat bahwa densitas produk esterifikasi berada pada rentang 0,892-0,919 gr/mL. Nilai densitas ini melebihi densitas metil oleat seharusnya. Nilai densitas ini lebih mendekati nilai densitas asam oleat yaitu 0,895 gr/mL. Pada uji viskositas juga diperoleh hal yang serupa dengan uji densitas. Viskositas produk esterifikasi yang diperoleh berada pada rentang 8,38-10,255 mm2/s. Nilai viskositas ini cukup jauh dari viskositas metil oleat. Hasil analisis yang diperoleh mengindikasikan bahwa katalis asam heterogen SH-1, SH-2, dan SH-3 yang digunakan tidak berfungsi seperti yang diharapkan dalam reaksi esterifikasi asam oleat dan metanol.
5.1.2 Karakterisasi Katalis
Karakterisasi katalis hasil karbonisasi hidrotermal dan sulfonasi secara serempak menggunakan garam Na-hydroxyethyl sulfonate yang dilakukan meliputi Scaning Electron Microscope (SEM), Energy Dispersive Spectroscopy (EDS), dan Brunauer-Emmett-Teller (BET). Karakterisasi dilakukan pada dua sampel katalis yaitu katalis SH-2 dan SH-3.
Scaning Electron Microscope (SEM)
Tujuan dari analisis SEM adalah untuk mengetahui morfologi katalis. Hasil analisis SEM katalis SH-2 dan SH-3 dengan perbesaran 2000x diperlihatkan pada Gambar 5.1. Berdasarkan Gambar 5.1 dapat dilihat bahwa katalis yang dihasilkan memiliki permukaan yang tidak halus (cenderung kasar) dan teragregasi serta memiliki rongga pada permukaan katalis.
24
Gambar 5.1 Analisis SEM Katalis (a) SH-2 dan (b) SH-3 (Perbesaran 2000x)
Analisis Energy Dispersive Spectroscopy (EDS)
Kandungan unsur pada permukaan katalis dianalisis menggunakan Energy Dispersive Spectroscopy (EDS). Hasil analisis Energy Dispersive Spectroscopy (EDS) katalis SH-2 dan katalis SH-3 diperlihatkan pada Tabel 5.3 dan 5.4.
Tabel 5.3 Analisis EDS Spektrum Murni Katalis SH-2 dan SH-3
Variasi Simbol % massa C % massa O % massa Si % massa S Pati (gr) Na-hydroxyethyl sulfonate (gr) TEOS (gr) 2 2 2 SH-2 50,94 39,05 10,02 - 2 3.5 2 SH-3 69,75 27,13 3,11 -
Tabel 5.4 Analisis EDS Spektrum Oksida Katalis SH-2 dan SH-3
Variasi Simbol % massa S %
massa SO3H % massa SiO2 Pati (gr) Na-hydroxyethyl sulfonate (gr) TEOS (gr) 2 2 2 SH-2 - - 27,99 2 3.5 2 SH-3 - - 9,10
Berdasarkan hasil analisis EDS dapat disimpulkan bahwa unsur-unsur yang terdapat di permukaan katalis diantaranya karbon (C), oksigen (O), dan silika (SiO2). Keberadaan silika pada masing-masing katalis menunjukkan bahwa katalis yang terbentuk merupakan katalis komposit karbon-silika.
Dari hasil EDS tidak ditemukan adanya kandungan sulfur (S) pada katalis. Hal ini menunjukkan bahwa metode pembuatan katalis asam heterogen dengan proses karbonisasi
25
hidrotermal dan sulfonasi secara serempak belum berhasil memasukkan gugus sulfonat pada kerangka karbon katalis. Hal ini diduga terjadi karena garam Na-hydroxyethyl sulfonate yang digunakan sebagai agen sulfonasi tidak cukup kuat untuk dapat memasukkan gugus sulfonat ke dalam kerangka karbon katalis. Pada pengukuran pH larutan garam Na-hydroxyethyl sulfonate, diperoleh pH larutan garam tersebut berkisar pada pH 9 (sedikit basa).
Tidak adanya kandungan sulfur (S) di dalam katalis menunjukkan bahwa katalis tidak memiliki gugus SO3H yang berfungsi sebagai pusat aktif katalis. Hal ini sejalan dengan hasil yang ditunjukkan pada uji kinerja reaksi di atas. Pada reaksi esterifikasi asam oleat menggunakan katalis yang dihasilkan dari proses karbonisasi hidrotermal dan sulfonasi secara serempak menggunakan garam Na-hydroxyethyl sulfonate, katalis tidak memiliki kemampuan katalisasi sehingga produk metil oleat yang diharapkan tidak terbentuk.
Jika dilihat dari variasi penambahan jumlah Na-hydroxyethyl sulfonate dengan jumlah TEOS yang tetap, diperoleh kecenderungan jumlah silika dalam katalis cenderung berkurang. Hal ini diduga karena terjadinya reaksi hidrolisis TEOS yang merupakan sumber silika bagi katalis oleh Na-hydroxyethyl sulfonated sebelum sempat membentuk material komposit karbon-silika.
Analisis Brunauer-Emmett-Teller (BET)
Luas permukaan katalis SH-2 dan SH-3 dianalisis menggunakan Brunauer-Emmett-Teller (BET) disajikan pada Tabel 5.5.
Tabel 5.5 Analisis BET Katalis SH-2 dan SH-3 Variasi
Simbol
Luas permukaan
(m2/g)
Diameter rata rata pori katalis Pati (gr) Na-hydroxyethyl sulfonated (gr) TEOS (gr) ( Å) (nm) 2 2 2 SH-2 82,818 310,484 31,0484 2 3,5 2 SH-3 12,719 179,750 17,975
Hasil analisis BET menunjukkan bahwa katalis SH-2 memiliki luas permukaan yang lebih besar di bandingkan katalis SH-3. Berdasarkan kandungan silika dari analisis EDS, katalis SH-2 memiliki kandungan silika (Si) lebih besar, yaitu 27,99%. Sementara kandungan silika pada katalis SH-3 hanya 9,10%. Dengan kandungan silika yang lebih besar tentu katalis SH-2 memiliki luas permukaan yang lebih besar juga. Ukuran diameter rata-rata pori katalis berada pada kategori mesopori dengan rentang ukuran diameter pori di antara 2-50 nm.
26
5.2 Pembuatan Katalis Dengan Menggunakan Asam Hydroxyethyl Sulfonate
Pada percobaan ini dilakukan pembebasan asam hydroxyethyl sulfonate dari bentuk garam nya terlebih dahulu menggunakan asam oksalat. Asam hydroxyethyl sulfonate yang dihasilkan memiliki viskositas yang tinggi dengan pH yang sangat asam (mendekati 0). Bentuk asam hydroxyethyl sulfonate yang diperoleh diperlihatkan pada Gambar 5.2.
Gambar 5.2 Asam Hydroxyethyl Sulfonate
Variasi percobaan dilakukan untuk melihat pengaruh rasio jumlah pati jagung, asam hydroxyethyl sulfonate,dan TEOS terhadap acid site density dan luas permukaan katalis yang dihasilkan.
Tabel 5.6 Variasi Jumlah Pati, Asam hydroxyethyl sulfonate, dan TEOS Variasi Simbol Pati jagung (gr) Asam-hydroxyethyl sulfonate (gr) TEOS (gr) 2 2 1 AHS-1 2 2 2 AHS-2 2 3,5 2 AHS-3
Secara visual katalis yang dihasilkan dari metode karbonisasi hidrotermal dan sulfonasi serempak menggunakan garam Na-hydroxyethyl sulfonate dan asam hydroxyethyl sulfonate tidak memiliki perbedaan yang mencolok. Warna katalis yang dihasilkan adalah hitam dan berbentuk serbuk. Namun terdapat perbedaan tekstur katalis yang dihasilkan saat
27
katalis disentuh, yaitu katalis yang dihasilkan menggunakan asam hydroxyethyl sulfonate
memiliki tekstur yang lebih kasar dan keras. 5.2.1 Uji Kinerja Katalis
Kinerja katalis yang dihasilkan diuji menggunakan reaksi esterifikasi asam oleat. Parameter yang diamati meliputi konversi asam oleat serta densitas dan viskositas campuran hasil reaksi. Prosedur reaksi esterifikasi asam oleat yang dilakukan sama seperti prosedur reaksi esterfikasi asam oleat pada percobaan sebelumnya.
Setelah reaksi esterifikasi selesai, campuran disentrifugasi untuk memisahkan katalis padat dari campuran reaksi. Kemudian campuran reaksi dimasukkan ke dalam corong pisah dan didiamkan semalaman. Campuran reaksi yang sudah didiamkan semalaman tidak menunjukkan adanya pemisahan dua fasa. Hal ini terjadi pada semua campuran hasil reaksi menggunakan katalis AHS-1, AHS-2, dan AHS-3. Hal ini menunjukkan bahwa reaksi esterifikasi asam oleat menggunakan katalis AHS-1, AHS-2, dan AHS-3 tidak menghasilkan produk metil oleat yang diinginkan.
Untuk memastikan bahwa campuran reaksi masih berupa larutan asam oleat dan metanol dan bukan produk metil oleat maka dilakukan analisis densitas dan viskositas terhadap campuran hasil reaksi menggunakan katalis AHS-1, AHS-2 dan AHS-3 tersebut di atas. Hasil selengkapnya disajikan pada Tabel 5.7.
Tabel 5.7 Hasil Uji Reaksi Katalis AHS-1, AHS-2 dan AHS-3 Variasi
Simbol Konversi ρ produk (gr/mL) μ produk (mm2/s) Pati (gr) Asam hydroxyethyl sulfonate (gr) TEOS (gr) 2 2 1 AHS-1 0 0,887 9,586 2 2 2 AHS-2 0 0,908 10,012 2 3.5 2 AHS-3 0 0,877 7,477
Dari Tabel 5.7 dapat dilihat bahwa densitas produk esterifikasi berada pada rentang 0,877-0,908 gr/mL. Nilai densitas ini melebihi nilai densitas metil oleat yang seharusnya dan lebih mendekati nilai densitas asam oleat. Viskositas produk esterifikasi yang diperoleh juga melebihi viskositas metil oleat dan lebih mendekati viskositas asam oleat. Hasil analisa yang diperoleh mengindikasikan bahwa katalis AHS-1, AHS-2, dan AHS-3 yang digunakan tidak berperan aktif dalam reaksi esterifikasi asam oleat.
28 5.2.2 Karakterisasi Katalis
Katalis hasil karbonisasi hidrotermal dan sulfonasi serempak menggunakan asam
hydroxyethyl sulfonate selanjutnya diuji menggunakan Scaning Electron Microscope (SEM),
Energy Dispersive Spectroscopy (EDS), dan Brunauer-Emmett-Teller (BET).
Scaning Electron Microscope (SEM)
Karakterisasi SEM dilakukan dengan perbesaran 2000x. Gambar hasil karakterisasi SEM katalis dengan perbesaran 2000x diperlihatkan pada Gambar 5.3. Berdasarkan Gambar 5.3 dapat dilihat bahwa katalis yang dihasilkan memiliki permukaan yang cenderung kasar, teragregasi, serta memiliki rongga pada permukaan katalis.
Gambar 5.3 Analisis SEM Katalis (a) AHS-1, (b) AHS-2 dan (c) AHS-3 (Perbesaran 2000x)
Energy Dispersive Spectroscopy (EDS)
Kandungan unsur-unsur pada permukaan katalis dianalisis menggunakan Energy Dispersive Spectroscopy (EDS). Hasil analisis Energy Dispersive Spectroscopy (EDS) spektrum murni dan spektrum oksida katalis AHS-1, AHS-2, dan AHS-3 ditunjukkan pada Tabel 5.8 dan 5.9.
Tabel 5.8 Analisis EDS Spektrum Murni Katalis AHS-1, AHS-2 dan AHS-3
Variasi Simbol % massa C % massa O % massa Si % massa S Pati (gr) Asam hydroxyethyl sulfonate (gr) TEOS (gr) 2 2 1 AHS-1 38,93 41,8 19,26 - 2 2 2 AHS-2 59,57 28,99 11,4 - 2 3.5 2 AHS-2 76,1 23,44 0,39 -
29
Tabel 5.9 Analisis EDS Spektrum Oksida Katalis AHS-1, AHS-2 dan AHS-3
Variasi Simbol % massa S %
massa SO3H % massa SiO2 Pati (gr) Asam hydroxyethyl sulfonate (gr) TEOS (gr) 2 2 1 AHS-1 - - 48,75 2 2 2 AHS-2 - - 28,07 2 3.5 2 AHS-2 - - 1,25
Berdasarkan hasil analisis EDS dapat disimpulkan bahwa unsur-unsur yang terdapat pada permukaan katalis adalah karbon (C), oksigen (O), dan silika (SiO2). Keberadaan silika pada masing-masing katalis menunjukkan bahwa katalis yang terbentuk merupakan merupakan katalis komposit karbon-silika.
Dari hasil analisa EDS tidak ditemukan adanya kandungan sulfur (S) pada katalis. Hal ini menunjukkan bahwa metode pembuatan katalis asam heterogen dengan proses karbonisasi hidrotermal dan sulfonasi secara serempak menggunakan asam hydroxyethyl sulfonate hanya mampu membentuk material komposit karbon-silika, namun belum berhasil memasukkan gugus sulfonat pada kerangka karbon katalis tersebut.
Brunauer-Emmett-Teller (BET)
Luas permukaan katalis AHS-1, AHS-2, dan AH-S 3 dianalisis menggunakan
Brunauer-Emmett-Teller (BET). Hasil analisis BET disajikan pada Tabel 5.10. Tabel 5.10 Analisis BET Katalis AHS-1, AHS-2 dan AHS-3
Variasi
Simbol
Luas permukaan
(m2/g)
Diameter rata rata pori katalis Pati (gr) Asam hydroxyethyl sulfonated (gr) TEOS (gr) ( Å) (nm) 2 2 1 AHS-1 152,112 108,755 10,8755 2 2 2 AHS-2 315,853 84,5516 8,45516 2 3,5 2 AHS-3 288,097 98,1246 9,81246
Dari hasil tersebut diperoleh bahwa seiiring dengan meningkatnya jumlah TEOS, luas permukaan katalis juga akan meningkat. Hal ini dapat dilihat dengan membandingkan luas permukaan katalis AHS-1 dengan katalis AHS-2. Sementara itu, pada peningkatan jumlah asam hydroxyethyl sulfonate, luas permukaan katalis cenderung mengalami penurunan seperti yang terlihat pada perbandingan luas permukaan katalis AHS-2 dengan katalis AHS-3.
30
Hal ini sejalan dengan penelitian yang dilakukan oleh Wu, et al. (2013). Wu, et al. (2013) mengemukakan bahwa rasio asam hydroxyethyl sulfonate dan TEOS yang digunakan sebagai bahan katalis akan mempengaruhi luas permukaan katalis yang dihasilkan. Peningkatan jumlah TEOS akan memperbesar luas permukaan spesifik katalis. Sementara itu, penambahan asam hydroxyethyl sulfonated dapat menurunkan luas permukaan katalis. Penambahan asam hydroxyethyl sulfonate akan memberikan luas permukaan spesifik katalis yang lebih kecil karena terjadi reaksi hidrolisis TEOS secara cepat sebelum berinteraksi dengan lembaran polisiklik aromatik karbon(PAC) pada katalis.
Luas permukaan tebesar diperoleh pada katalis AHS-2 dengan jumlah pati, asam
hydroxyethyl sulfonate, dan TEOS masing-masing sebesar 2 gr. Dengan demikian pada pembuatan katalis dengan metode hidrotermal dan sulfonasi serempak, untuk mendapatkan luas permukaan katalis yang paling besar, dapat digunakan bahan baku pati, asam
hydroxyethyl sulfonate, dan TEOS dengan perbandingan rasio massa sebesar 1:1:1.
Lebih lanjut, luas permukaan katalis yang diperoleh dengan proses karbonisasi hidrotermal dalam suasana asam menggunakan asam hydroxyethyl sulfonate lebih besar jika dibandingkan dengan luas permukaan katalis yang diperoleh dengan proses karbonisasi hidrotermal dalam suasana basa menggunakan garam Na-hydroxyethyl sulfonate. Hal ini menunjukkan bahwa suasana asam atau basa pada proses karbonisasi hidrotermal sangat berpengaruh terhadap luas permukaan katalis yang dihasilkan.
31
BAB VI
KESIMPULAN DAN SARAN
6.1 Kesimpulan
Dari hasil penelitian dapat disimpulkan hal-hal berikut ini:
1. Pembuatan katalis dengan proses hidrotermal dan sulfonasi secara serempak, baik menggunakan garam Na-hydroxyethyl sulfonate maupun asam hydroxyethyl sulfonate, hanya berhasil membentuk material komposit karbon-silika, sementara proses pemasukan gugus sulfonat ke dalam material katalis belum berhasil dilakukan.
2. Katalis yang dihasilkan dari proses karbonisasi hidrotermal dan sulfonasi secara serempak menggunakan garam Na-hydroxyethyl sulfonate maupun asam hydroxyethyl sulfonate
tidak memiliki kemampuan untuk mengkatalisasi reaksi esterifikasi asam oleat karena tidak memiliki pusat aktif asam SO3H.
3. Penggunaan TEOS sebagai sumber silika pada pembentukan katalis komposit karbon-silika mampu menghasilkan luas permukaan katalis yang cukup besar.
4. Proses karbonisasi hidrotermal pada suasana asam menggunakan asam hydroxyethyl sulfonate mampu menghasilkan luas permukaan katalis yang relatif besar yaitu berkisar antara rentang 152,1 - 315,8 m2/g. Sebaliknya, proses karbonisasi hidrotermal pada suasana basa menggunakan garam Na-hydroxyethyl sulfonate, luas permukaan katalis yang dihasilkan relatif kecil, yakni berkisar antara rentang 12,7 - 82,8 m2/g.
5. Pada pembuatan katalis melalui proses karbonisasi hidrotermal menggunakan garam Na-hydroxyethyl sulfonate dan asam hydroxyethylsulfonate masing-masing menunjukkan kecenderungan penurunan luas permukaan seiring bertambahnya jumlah garam Na-hydroxyethyl sulfonate maupun asam hydroxyethylsulfonate yang digunakan.
6. Pada pembuatan katalis melalui proses karbonisasi hidrotermal menggunakan asam
hydroxyethyl sulfonate, perbandingan rasio jumlah pati, asam hydroxyethyl sulfonate dan TEOS untuk menghasilkan luas permukaan katalis terbesar adalah 1:1:1.
32 6.2 Saran
Adapun beberapa saran yang dapat diberikan untuk penelitian selanjutnya, yaitu:
1. Penggunaan suport silika dapat dipertahankan untuk memperbesar luas permukaan katalis sehingga dapat meningkatkan performa katalis.
2. Perlu dilakukan peninjauan lebih lanjut terhadap jenis asam yang cocok untuk digunakan sebagai agen sulfonasi dalam proses karbonisasi hidrotermal dan sulfonasi secara serempak.
3. Perlu dilakukan peninjauan lebih dalam terhadap metode karbonisasi hidrotermal dan sulfonasi secara serempak agar mampu memasukan gugus aktif sulfonat ke dalam katalis.
33
DAFTAR PUSTAKA
Chorkendorff, I. and J.W. Niemantsverdriet, Concepts of modern catalysis and kinetics. 2003: Weinhem: WILEY-VCH Verlag GmbH & Co. KGaA.
Deshmane, C. A., Wright, M. W., Lachgar, A., Rohlfing, M., Liu, Z., Le, J., & Hanson, B. E. (2013). A comparative study of solid carbon acid catalysts for the esterification of free fatty acids for biodiesel production. Evidence for the leaching of colloidal carbon.
Bioresource technology, 147, 597-604.
Fu, Z., Wan, H., Hu, X., Cui, Q., & Guan, G. (2012). Preparation and catalytic performance of a carbon-based solid acid catalyst with high specific surface area. Reaction Kinetics, Mechanisms and Catalysis, 107(1), 203-213.
Kang, S., Ye, J., & Chang, J. (2013). Recent advances in carbon-based sulfonated catalyst: preparation and application. Int Rev Chem Eng, 5(2), 133-144
Kitano, M., Arai, K., Kodama, A., Kousaka, T., Nakajima, K., Hayashi, S., & Hara, M. (2009). Preparation of a sulfonated porous carbon catalyst with high specific surface area. Catalysis letters, 131(1-2), 242-249.
Lam, M. K., Lee, K. T., & Mohamed, A. R. (2010). Homogeneous, heterogeneous and enzymatic catalysis for transesterification of high free fatty acid oil (waste cooking oil) to biodiesel: a review. Biotechnology advances, 28(4), 500-518.
Liang, X., Li, C., & Qi, C. (2011). Novel carbon-based strong acid catalyst from starch and its catalytic activities for acetalization. Journal of materials science, 46(16), 5345-5349.
Liu, Y., Chen, J., Yao, J., Lu, Y., Zhang, L., & Liu, X. (2009). Preparation and properties of sulfonated carbon–silica composites from sucrose dispersed on MCM-48. Chemical Engineering Journal, 148(1), 201-206.
Lou, W.-Y., Zong, M.-H., & Duan, Z.-Q. (2008). Efficient production of biodiesel from high free fatty acid-containing waste oils using various carbohydrate-derived solid acid catalysts. Bioresource Technology, 99(18), 8752-8758.
Lu, Y., Liang, X., & Qi, C. (2012). Synthesis of novel carbon/silica composites based strong acid catalyst and its catalytic activities for acetalization. Bulletin of Materials Science,
35(3), 419-424.
Mo, X., Lotero, E., Lu, C., Liu, Y., & Goodwin, J. G. (2008). A novel sulfonated carbon composite solid acid catalyst for biodiesel synthesis. Catalysis Letters, 123(1-2), 1-6. Nakajima, K., Okamura, M., Kondo, J. N., Domen, K., Tatsumi, T., Hayashi, S., & Hara, M.
(2008). Amorphous carbon bearing sulfonic acid groups in mesoporous silica as a selective catalyst. Chemistry of Materials, 21(1), 186-193
34
Okamura, M., Takagaki, A., Toda, M., Kondo, J. N., Domen, K., Tatsumi, T., Hara, M., & Hayashi, S. (2006). Acid-catalyzed reactions on flexible polycyclic aromatic carbon in amorphous carbon. Chemistry of Materials, 18(13). 3039–3045.
Song, X. L., Fu, X. B., Zhang, C. W., Huang, W. Y., Zhu, Y., Yang, J., & Zhang, Y. M. (2012). Preparation of a novel carbon based solid acid catalyst for biodiesel production via a sustainable route. Catalysis letters, 142(7), 869-874.
Wei, Z., Xu, C., & Li, B., (2009). Application of waste eggshell as low-cost solid catalyst for biodiesel production. Bioresource Technology, 100(11), 2883-2885.
Wu, L., Wu, Y., & Liang, X. (2013). One-pot synthesis of a novel catalyst with strong acid sites based on carbon/silica composite. Kinetics and Catalysis, 54(3), 378-381.
Xiao, H., Guo, Y., Liang, X., & Qi, C. (2010). One-step synthesis of a novel carbon-based strong acid catalyst through hydrothermal carbonization. Monatshefte für Chemie-Chemical Monthly, 141(8), 929-932.
Zhang, B., Ren, J., Liu, X., Guo, Y., Guo, Y., Lu, G., & Wang, Y. (2010). Novel sulfonated carbonaceous materials from p-toluenesulfonic acid/glucose as a high-performance solid-acid catalyst. Catalysis Communications, 11(7), 629-632.
Zhang, W., Tao, H., Zhang, B., Ren, J., Lu, G., & Wang, Y. (2011). One-pot synthesis of carbonaceous monolith with surface sulfonic groups and its carbonization/activation.